苹果(Malus domestica)隶属于蔷薇科(Rosaceae)苹果亚科(Maloideae)苹果属(Malus)[1-2],是我国栽培面积最广、经济效益较高的水果[3]。 苹果在西藏主要分布于林芝、昌都和山南地区。 其中,林芝产区是西藏重要的苹果生产基地,其依托高原生态条件,所产苹果色泽鲜艳、酸甜适口。林芝苹果种植面积约2 520 hm2,年产1.5万t,产值1.7亿元[4]。 随着农业技术的推广和政策的支持,西藏苹果的种植规模逐年扩大,产量稳步增长。 然而,西藏地理位置偏远,物流成本较高,因此开发丰富的苹果加工类产品已成为产业发展的必然需求。
苹果渣(apple pomace,AP)是鲜苹果压榨取汁后所留下的副产物,含有丰富的营养物质及多种活性成分[5],如多糖、多酚类、黄酮类物质、维生素、矿物质等[6]。具有抗氧化[7]、抗衰老[8]、抗肿瘤[9]等功效。目前苹果渣年产量高达1 200万t[10],而这些苹果渣除少量用作燃料、饲料和提取果胶外,大部分被当作垃圾处理,造成资源极大浪费。故对苹果渣的综合利用不仅可以减少资源浪费和环境污染,还能够为苹果加工业带来经济效益。 发酵技术是提升果蔬价值的关键,利用苹果渣生产酵素,为其高值化转化提供了可行方案。
果蔬酵素是以水果蔬菜为原料,经过酵母菌、乳酸菌等益生菌发酵产生的具有一定功效的产品。益生菌在果蔬基质中参与复杂的代谢反应和代谢物之间的转化[11]。其代谢过程不仅引起果蔬原料的原本风味改变,还能够引起酚类、黄酮类、有机酸以及活性酶等种类及成分的变化[12-13]。不同果渣发酵对酵素的抗氧化活性有着显著的影响。YI X X等[14]研究酿酒酵母(Saccharomyces cerevisiae)和枯草芽孢杆菌(Bacillus subtilis)共发酵刺梨渣抗氧化活性,结果发现,刺梨渣经枯草芽孢杆菌与酿酒酵母混合(1∶1)后,2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azinobis-3-ethylbenzothiazoline-6-sulfonic acid,ABTS)自由基清除能力、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力和总抗氧化能力(total antioxidant capacity,T-AOC)显著高于未发酵刺梨渣(P<0.05),发酵后黄酮类化合物、多酚类化合物和三萜类化合物含量均有所提高。杨柳等[15]研究酵母菌和干酪乳杆菌(Lactobacillus casei)对樱莓果渣酵素抗氧化活性的影响,结果表明,酵素添加量为60 μg/mL时,DPPH自由基、ABTS自由基清除率分别为94.05%、99.50%,其还原力为维生素C(vitamin C,VC)对照组的81.12%。 当前,随着消费者对保健营养型产品的需求持续攀升,开展基于果渣发酵的高活性酵素研究,对开发相关功能性产品具有重要的技术支撑价值。
本研究以林芝苹果果渣为原料,采用酵母菌和戊糖乳杆菌(Lactobacillus pentosus)顺序发酵制备苹果渣酵素(apple pomace Jiaosu,APJS)。以酵母菌、戊糖乳杆菌活菌数和超氧化物歧化酶(superoxide dismutase,SOD)活性为评价指标,通过响应面和正交试验优化酵母菌、戊糖乳杆菌发酵条件,并分析苹果酵素的理化指标和抗氧化能力。旨在为林芝地区苹果果渣的资源化利用提供新的技术路径,并为健康食品的开发应用拓展新的研究视角与实践方向。
1 材料与方法
1.1 材料与试剂
1.1.1 原料和菌株
苹果:采摘于西藏林芝市巴宜区;酵母菌BV 818:安琪酵母股份有限公司;戊糖乳杆菌(Lactobacillus pentosus)ATCC8041:北京生物菌种保藏中心。
1.1.2 试剂
SOD检测试剂盒、γ-氨基丁酸(gama-aminobutyric acid,GABA)检测试剂盒:苏州格锐思生物科技有限公司;白砂糖:上海怡神保健食品有限公司;果胶酶(300 00 U/g)、纤维素酶(100 000 U/g):山东隆科特酶制剂有限公司;磷酸氢二钠、柠檬酸(均为分析纯):国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS):合肥博美生物科技有限公司;芦丁、没食子酸(纯度均>98%):北京索莱宝科技有限公司;无水乙醇、亚硝酸钠、硝酸铝(均为分析纯):天津市致远化学试剂有限公司。
1.1.3 培养基
MRS肉汤培养基、MRS琼脂培养基:北京奥博星生物技术有限公司。
1.2 仪器与设备
PAL-1手持糖度计:日本爱拓科技有限公司;STARTER 300便携式酸度计:奥豪斯国际贸易有限公司;RSD-YF2400大容量双层摇床、GSP-9160MBE培养箱:上海博讯实业有限公司医疗设备厂;ReadMax1900光吸收型全波长酶标仪:上海闪谱生物科技有限公司;CiPOL偏光显微镜:日本Nikon公司;HWS-24恒温水浴锅:上海齐欣科学仪器有限公司;JYZ-V18A榨汁机:九阳股份有限公司;XS105DU电子天平:瑞士Mettler公司。
1.3 试验方法
1.3.1 苹果渣酵素的工艺流程及操作要点
苹果→清洗→去皮、去核→切片→钝酶→榨汁→冷冻干燥→苹果渣→复溶→酶解→调糖→灭菌→酵母菌接种→发酵→戊糖乳杆菌接种→发酵→苹果果渣酵素
操作要点:分选无腐烂无破损苹果,清洗去皮去核,切成厚度0.3 mm苹果片,置于沸水浴钝酶3 min后榨汁,苹果渣经真空冷冻干燥(-30 ℃保持6 h,-20 ℃保持6 h,-10 ℃保持6 h,-5 ℃保持10 h,5 ℃保持10 h,10 ℃保持10 h),即得苹果渣干品。苹果渣按照1∶10(g∶mL)的料液比加入pH值为4.8的磷酸-柠檬酸缓冲溶液,得到苹果渣(AP)水溶液,加入5.0%纤维素酶和果胶酶,酶解时间为2.5 h,酶解温度为55 ℃。酶解后加入5%白砂糖充分溶解后置于80 ℃水浴中巴氏杀菌20 min,冷却至室温后接入0.2%活化酵母菌(称取一定量的酵母菌加入10 mL的无菌水,37 ℃活化30 min),发酵60 h后接入1.5%活化戊糖乳杆菌(戊糖乳杆菌冻干菌粉用0.5 mL无菌水完全溶解,用无菌吸头将溶解液接种于2支MRS斜面培养基上,置于37 ℃培养4 d。采用平板划线法在MRS固体培养基上连续传代至第3代,以恢复菌株活力。将活化后的戊糖乳杆菌接入MRS液体培养基,于37 ℃条件下培养12 h),继续发酵36 h,待酵母菌、戊糖乳杆菌活菌数及SOD活性达最高时终止发酵,采用200目尼龙纱布过滤,即得苹果渣酵素(APJS)。
1.3.2 苹果渣酵素酵母菌发酵条件优化
(1)单因素试验
以酵母菌活菌数和SOD活性作为评价指标,以白砂糖添加量5%、发酵温度25 ℃、酵母菌添加量0.20%为基本条件,分别考察白砂糖添加量(3%、4%、5%、6%、7%)、发酵温度(21 ℃、23 ℃、25 ℃、27 ℃、29 ℃)、酵母菌接种量(0.10%、0.15%、0.20%、0.25%、0.30%)3个因素对酵母菌活菌数和SOD活性的影响。
(2)响应面试验
在单因素试验基础上,以酵母菌活菌数(Y1)和SOD活性(Y2)作为响应值,白砂糖添加量(A)、发酵温度(B)和酵母菌接种量(C)3个因素作为自变量,运用Design-Expert 13.0进行3因素3水平的Box-Behnken试验设计,Box-Behnken试验因素与水平见表1。
表1 酵母菌发酵条件优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken experiments for optimization of yeast fermentation conditions

水平 A 白砂糖添加量/% B 发酵温度/℃ C 酵母菌接种量/%-1 0 1 4 5 6 23 25 27 0.15 0.20 0.25
1.3.3 苹果渣酵素戊糖乳杆菌发酵条件优化
(1)单因素试验
以戊糖乳杆菌活菌数和SOD活性作为评价指标,以发酵时间36 h、温度37 ℃、戊糖乳杆菌添加量2.0%为基本条件,分别考察发酵时间(12 h、24 h、36 h、48 h、60 h)、发酵温度(33 ℃、35 ℃、37 ℃、39 ℃、41℃)、戊糖乳杆菌接种量(1.0%、1.5%、2.0%、2.5%、3.0%)3个因素对戊糖乳杆菌活菌数和SOD活性的影响。
(2)正交试验
在单因素试验基础上,以SOD活性和戊糖乳杆菌的活菌数为评价指标,以发酵时间(A)、发酵温度(B)、戊糖乳杆菌添加量(C)为影响因素,进行3因素3水平的正交试验,正交试验因素与水平见表2。
表2 戊糖乳杆菌发酵条件优化正交试验因素与水平
Table 2 Factors and levels of orthogonal experiments for optimization of Lactobacillus pentosus fermentation conditions

水平 A 发酵时间/h B 发酵温度/℃ C 戊糖乳杆菌接种量/%1 2 3 24 36 48 35 37 39 1.5 2.0 2.5
1.3.4 理化指标及微生物指标分析
可溶性固形物(total soluble solids,TSS):采用PAL-1手持糖度计测定;pH值:采用STARTER300便携式酸度计测定;总糖、还原糖、总酸分别采用蒽酮比色法、3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法、酸碱滴定法[16]测定;酵母菌活菌数:采用血球计数板法[17]测定;戊糖乳杆菌活菌数测定:采用GB 4789.35—2016《食品安全国家标准 食品微生物学检验乳酸菌检验》中平板计数法测定[18];总酚:采用福林-酚法测定;总黄酮:采用硝酸铝-亚硝酸钠分光光度法测定[19];SOD活性、GABA含量:采用SOD、GABA检测试剂盒测定。
1.3.5 抗氧化活性分析
(1)DPPH自由基清除率的测定
参考FANG S等[20]的方法略有修改。1 mL经无水乙醇稀释100倍的苹果渣酵素样品,与1 mL 60 mmol/L DPPH-乙醇溶液混合避光反应30 min,在波长517 nm处测定吸光度值,DPPH自由基清除率计算公式如下:
式中:A为DPPH自由基清除率,%;A0为无水乙醇+DPPH溶液的吸光度值;A1为样品溶液+DPPH溶液的吸光度值;A2为无水乙醇+样品溶液的吸光度值。
(2)ABTS自由基清除率的测定
参考FANG S等[20]法略有修改。7.4 mmol/L的ABTS自由基溶液和2.6 mmol/L的过硫酸钾以体积1∶1混合,避光静置12~16 h,用无水乙醇稀释至吸光度值0.70±0.02,得到ABTS自由基储备液。 取2 mL的苹果渣酵素样品和8 mL ABTS储备液进行混合均匀,静置放置6 min,在波长734 nm处测定其吸光度值,ABTS自由基清除率计算公式如下:
式中:B为ABTS自由基清除率,%;B0为ABTS储备液的吸光度值;B1为样品+ABTS储备液的吸光度值;B2为无水乙醇+样品溶液的吸光度值。
(3)铁离子还原/抗氧化能力(ferric reducing/antioxidant power,FRAP)测定
参考高莉等[21]方法略有修改,10 mmol/L的2,4,6-三吡啶基三嗪(2,4,6-tri pyridyl triazine,TPTZ)溶液、300 mmol/L pH值为3.6的醋酸缓冲溶液和20 mmol/L的FeCl3溶液按体积比1∶1∶1混合,得到FRAP工作液,取1 mL的苹果渣酵素样液加入12 mL的FRAP工作液,在37 ℃反应10 min后于波长593 nm条件下测定吸光度值。
1.3.6 数据处理与统计分析
采用Microsoft Excel 2021软件进行数据整理;采用SPSS 23.30软件进行单因素方差分析(analysisofvariance,ANOVA)和正交试验设计;使用Origin 2021对数据进行制图;利用Design-Expert 13.0软件进行响应面试验优化。
2 结果与分析
2.1 苹果渣酵素酵母菌发酵条件优化单因素试验结果分析
合适的白砂糖添加量有利于微生物的生长,糖过低可能会导致发酵不充分,糖添加量过高微生物将处在于高渗透环境中进而抑制微生物的生长[22]。由图1a可知,随着白砂糖添加量在3%~7%范围内的增加,酵母菌活菌数和SOD活性呈先增加后下降趋势。在白砂糖添加量为3%~5%时,酵母菌活菌数和SOD活性随之增加;在白砂糖添加量为5%时,酵母菌活菌数和SOD活性最高,分别为8.79lg(CFU/mL)、808.70 U/mL;在白砂糖添加量>5%之后,酵母菌活菌数和SOD活性均有所下降。因此,选择最适白砂糖糖添加量为5%。
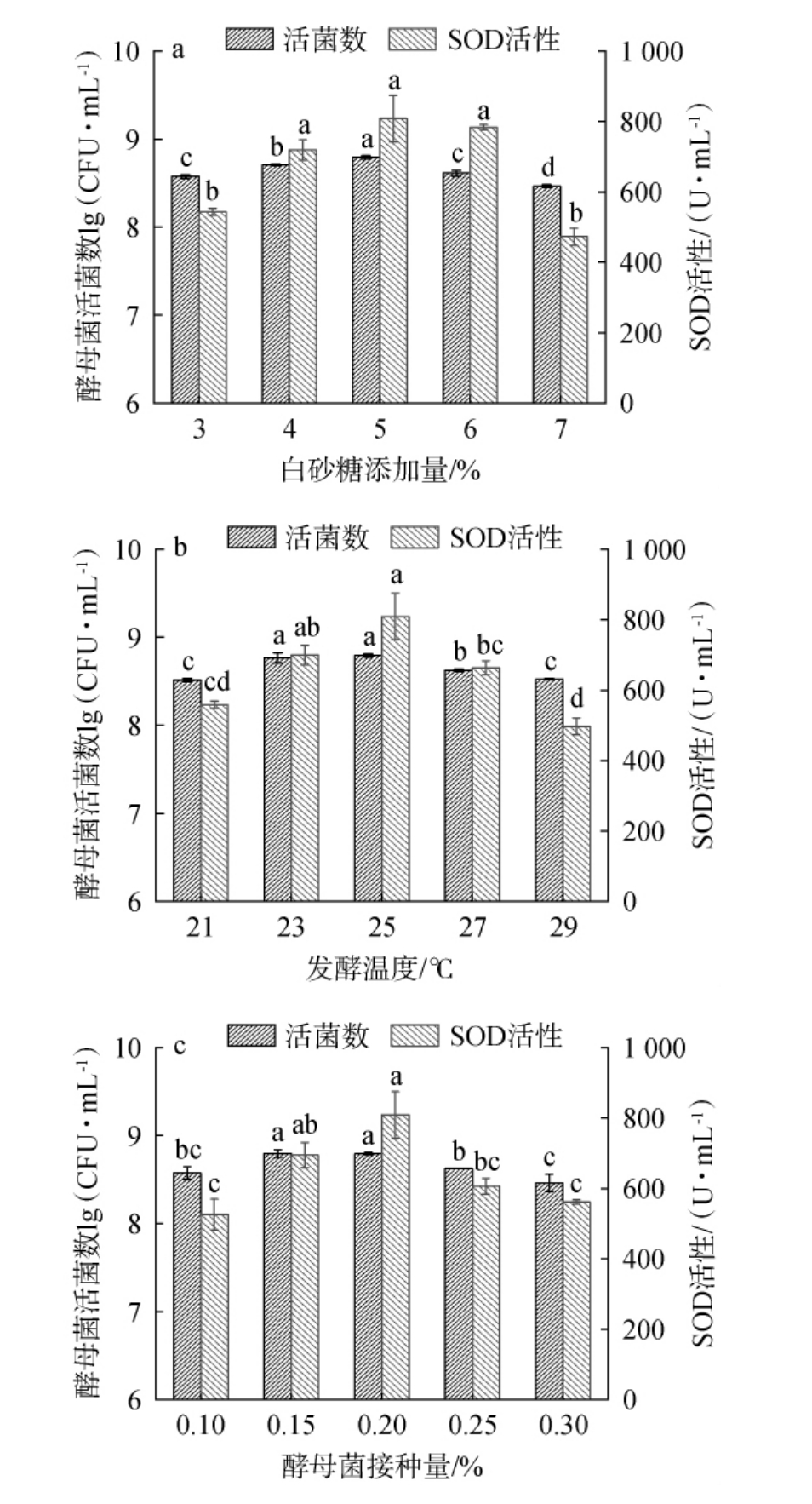
图1 白砂糖添加量(a)、发酵温度(b)、酵母菌接种量(c)对酵母菌活菌数和超氧化物歧化酶活性的影响
Fig.1 Effect of sugar addition (a), fermentation temperature (b) and yeast inoculum (c) on viable yeast counts and superoxide dismutase activity
不同小写字母表示相同指标差异显著(P<0.05)。下同。
温度对发酵过程有着重要的影响,温度过高过低会导致微生物的生长速度较慢甚至死亡[23]。由图1b可知,随着发酵温度在21~29 ℃范围内的增加,酵母菌活菌数和SOD活性呈先增加后下降趋势。当发酵温度为21~25 ℃时,酵母菌活菌数和SOD活性随之增加;当发酵温度为25 ℃时,酵母菌活菌数和SOD活性最高,分别为8.79 lg(CFU/mL)、808.70 U/mL;当发酵温度>25 ℃之后,酵母菌活菌数和SOD活性有所下降。因此,选择最适发酵温度为25 ℃。
菌种添加量过低时,酵素制备速度过慢,对营养基质的利用率较低,随着菌种接种量的增加,代谢的有机物有利于营养物质的溶出,菌种添加量过高时,酸性环境快速增高,不利于酵母的繁殖生长[24]。由图1c可知,随着酵母菌接种量在0.10%~0.30%范围内的增加,酵母菌活菌数和SOD活性呈先增加后下降趋势。当酵母菌接种量为0.10%~0.20%时,酵母菌活菌数和SOD活性随之增加;当酵母菌接种量为0.20%时,酵母菌活菌数和SOD活性最高,分别为8.79 lg(CFU/mL)、808.70U/mL;当酵母菌接种量>0.20%之后,酵母菌活菌数和SOD活性有所下降。因此,选择最适酵母菌接种量为0.20%。
2.2 苹果渣酵素酵母菌发酵条件优化响应面试验结果分析
2.2.1 响应面试验设计及回归模型建立
根据单因素试验结果,选择白砂糖添加量(A)、发酵温度(B)、酵母菌接种量(C)为自变量,以酵母菌活菌数(Y1)和SOD活性(Y2)为响应值,设计3因素3水平响应面试验,确定苹果渣酵素酵母发酵最佳发酵条件,Box-Behnken试验设计及结果见表3,方差分析结果见表4。
表3 酵母菌发酵条件优化Box-Behnken试验设计及结果
Table 3 Design and results of Box-Behnken experiments for optimization of yeast fermentation conditions
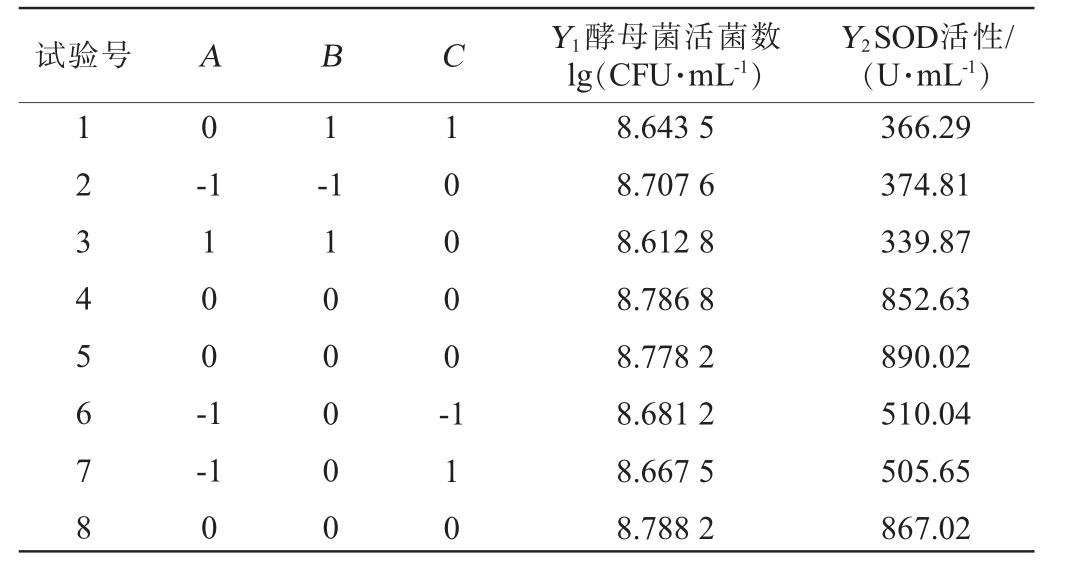
试验号 A B C Y1酵母菌活菌数lg(CFU·mL-1)Y2SOD活性/(U·mL-1)12345678 0 1-11 0 0 -1-1 1 0 0 0 0 --1 0 100000 110 8.643 5 8.707 6 8.612 8 8.786 8 8.778 2 8.681 2 8.667 5 8.788 2 366.29 374.81 339.87 852.63 890.02 510.04 505.65 867.02
续表
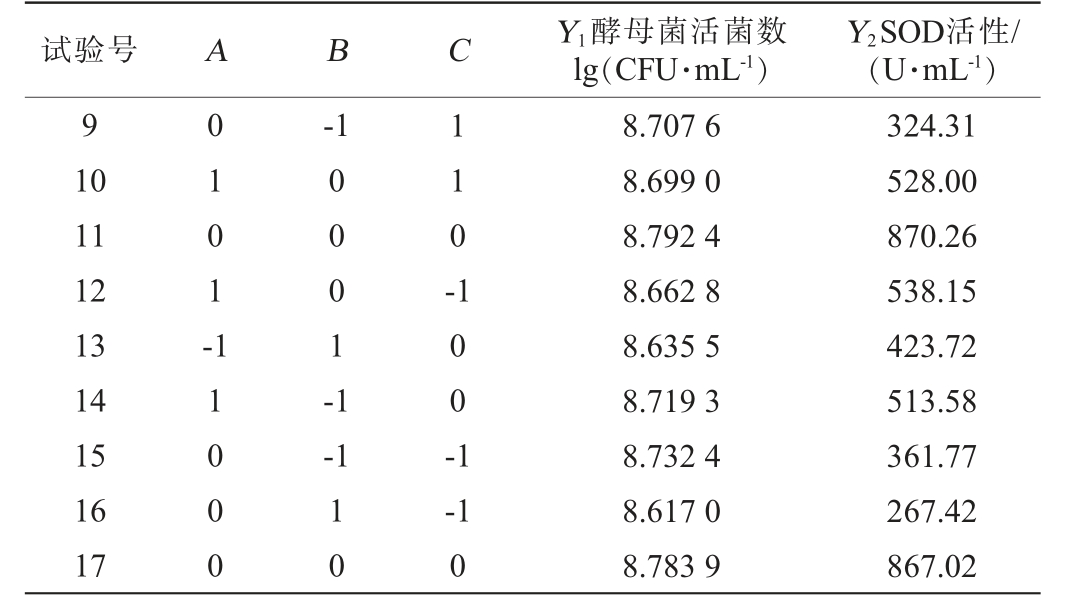
试验号 A B C Y1酵母菌活菌数lg(CFU·mL-1)Y2SOD活性/(U·mL-1)9 10 11 12 13 14 15 16 17 0101--1 110-11000 0001-1-1 100-1 10-1 0 8.707 6 8.699 0 8.792 4 8.662 8 8.635 5 8.719 3 8.732 4 8.617 0 8.783 9 324.31 528.00 870.26 538.15 423.72 513.58 361.77 267.42 867.02
表4 以酵母菌活菌数和超氧化物歧化酶活性为响应值的回归模型方差分析
Table 4 Variance analysis of regression model using viable yeast counts and superoxide dismutase activity as response values
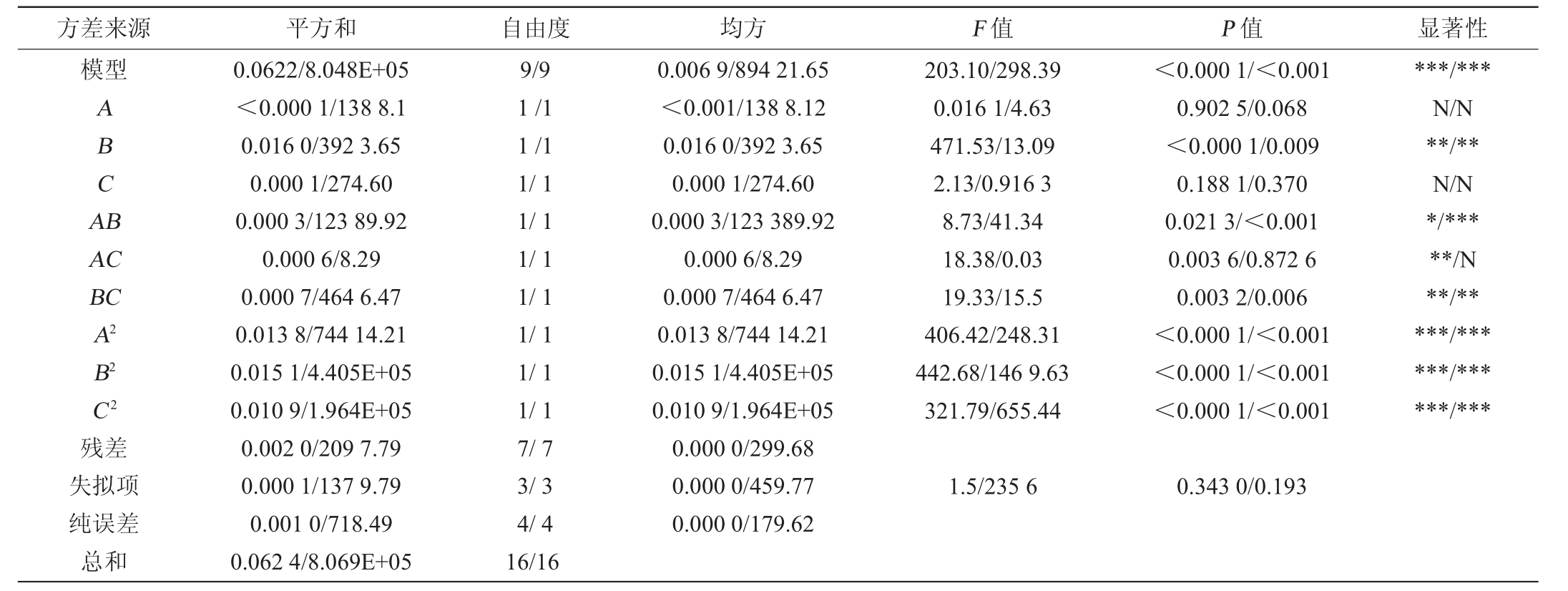
注:“***”表示对结果影响高度显著(P<0.001);“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05);“N”表示对结果影响不显著(P>0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B AC BC A2 B2 C2残差失拟项纯误差总和0.0622/8.048E+05<0.000 1/138 8.1 0.016 0/392 3.65 0.000 1/274.60 0.000 3/123 89.92 0.000 6/8.29 0.000 7/464 6.47 0.013 8/744 14.21 0.015 1/4.405E+05 0.010 9/1.964E+05 0.002 0/209 7.79 0.000 1/137 9.79 0.001 0/718.49 0.062 4/8.069E+05 9/9 1/1 1/1 1/1 1/1 1/1 1/1 1/1 1/1 1/1 7/7 3/3 4/4 16/16 0.006 9/894 21.65<0.001/138 8.12 0.016 0/392 3.65 0.000 1/274.60 0.000 3/123 389.92 0.000 6/8.29 0.000 7/464 6.47 0.013 8/744 14.21 0.015 1/4.405E+05 0.010 9/1.964E+05 0.000 0/299.68 0.000 0/459.77 0.000 0/179.62 203.10/298.39 0.016 1/4.63 471.53/13.09 2.13/0.916 3 8.73/41.34 18.38/0.03 19.33/15.5 406.42/248.31 442.68/146 9.63 321.79/655.44<0.000 1/<0.001 0.902 5/0.068<0.000 1/0.009 0.188 1/0.370 0.021 3/<0.001 0.003 6/0.872 6 0.003 2/0.006<0.000 1/<0.001<0.000 1/<0.001<0.000 1/<0.001***/***N/N**/**N/N*/*****/N**/*****/******/******/***1.5/235 6 0.343 0/0.193
利用Design-Expert 13.0软件分析表3结果,分别得到以酵母菌活菌数(Y1)和SOD活性(Y2)为响应值的多元二次回归方程如下:
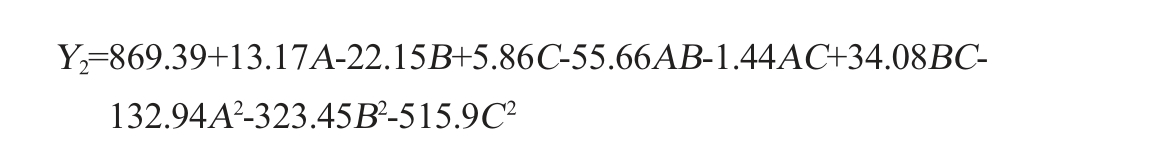
由表4可知,酵母菌活菌数和SOD活性回归模型P值均<0.01,具有极显著性,失拟项P值分别为0.343、0.193,均>0.05,不显著。表明该模型方程与实际值拟合度良好。模型决定系数R2分别为0.996 2、0.997 4,调整决定系数R2adj分别为0.991 3、0.994 1,酵母菌活菌数和SOD活性的R2和R2adj差值均<0.02,说明试验误差小,模型与数据拟合程度良好,具有较高的可靠性。由P值可知,二次项A2、B2、C2对酵母菌活菌数和SOD活性影响高度显著(P<0.001),一次项B、交互项AC、BC对酵母菌活菌数影响极显著(P<0.01),交互项AB对酵母菌活菌数影响显著(P<0.05),一次项B、交互项BC对SOD活性影响极显著(P<0.01)。由F值可知,各因素对酵母菌活菌数影响顺序为发酵温度(B)>酵母菌接种量(C)>白砂糖添加量(A);各因素对SOD活性影响顺序为发酵温度(B)>白砂糖添加量(A)>酵母菌接种量(C)。
2.2.2 各因素间交互作用对结果影响的响应面分析
响应面的曲线越陡、等高线越接近椭圆,表明两因素之间的交互作用对结果影响越大;反之,响应面的曲线越平缓、等高线越接近圆形,表明两因素之间交互作用对结果影响越小。各因素间交互作用对酵母菌活菌数和SOD活性的响应面及等高线见图2。
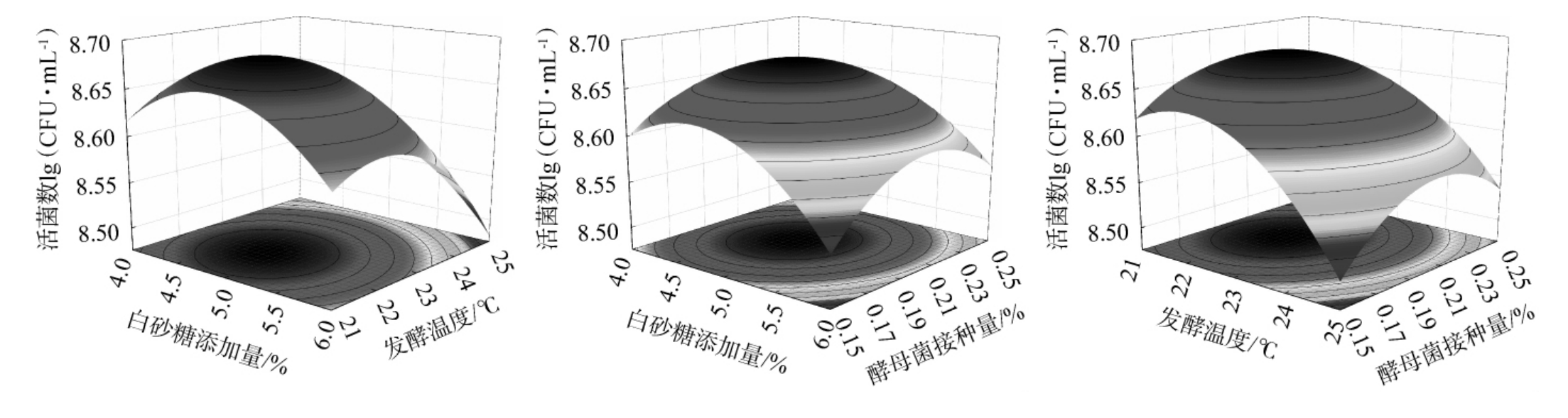
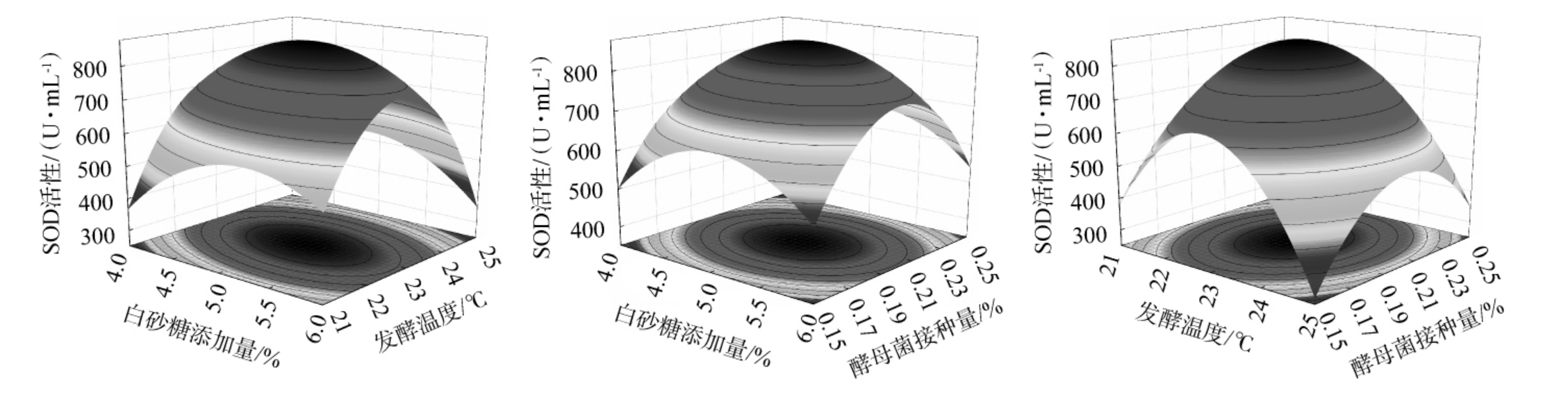
图2 白砂糖添加量、发酵温度、酵母菌接种量间交互作用对酵母菌活菌数及超氧化物歧化酶活性影响的响应面及等高线
Fig.2 Response surface plots and contour lines of effect of interaction between sugar addition, fermentation temperature, and yeast inoculum on viable yeast counts and superoxide dismutase activity
由图2可知,白砂糖添加量和发酵温度、白砂糖添加量和酵母菌接种量、发酵温度和酵母菌接种量交互作用对酵母菌活菌数影响较大;白砂糖添加量和发酵温度、发酵温度和酵母菌接种量交互作用对SOD活性影响较大。这与表4方差结果一致。
2.2.3 验证试验
利用Design-Expert 13.0软件进行数据分析,得到最优酵母发酵条件为白砂糖添加量5.04%、发酵温度24.68 ℃、酵母菌接种量0.20%。在此条件下,酵母菌活菌数和SOD活性预测值分别为8.79 lg(CFU/mL)、865.44 U/mL。考虑实际操作的可行性,调整酵母发酵条件为白砂糖添加量5%、发酵温度25 ℃、酵母菌接种量0.20%。 在此条件下进行3次平行验证试验,酵母菌活菌数实际值为8.79 lg(CFU/mL)、SOD活性实际值为932.95 U/mL。
2.3 苹果渣酵素戊糖乳杆菌发酵条件优化单因素试验结果分析
为了得到酵素最佳发酵条件,利用戊糖乳杆菌对酵母菌发酵苹果渣后再次发酵,考察发酵时间(A)、发酵温度(B)、戊糖乳杆菌接种量(C)对戊糖乳杆菌活菌数和SOD活性的影响,结果见图3。
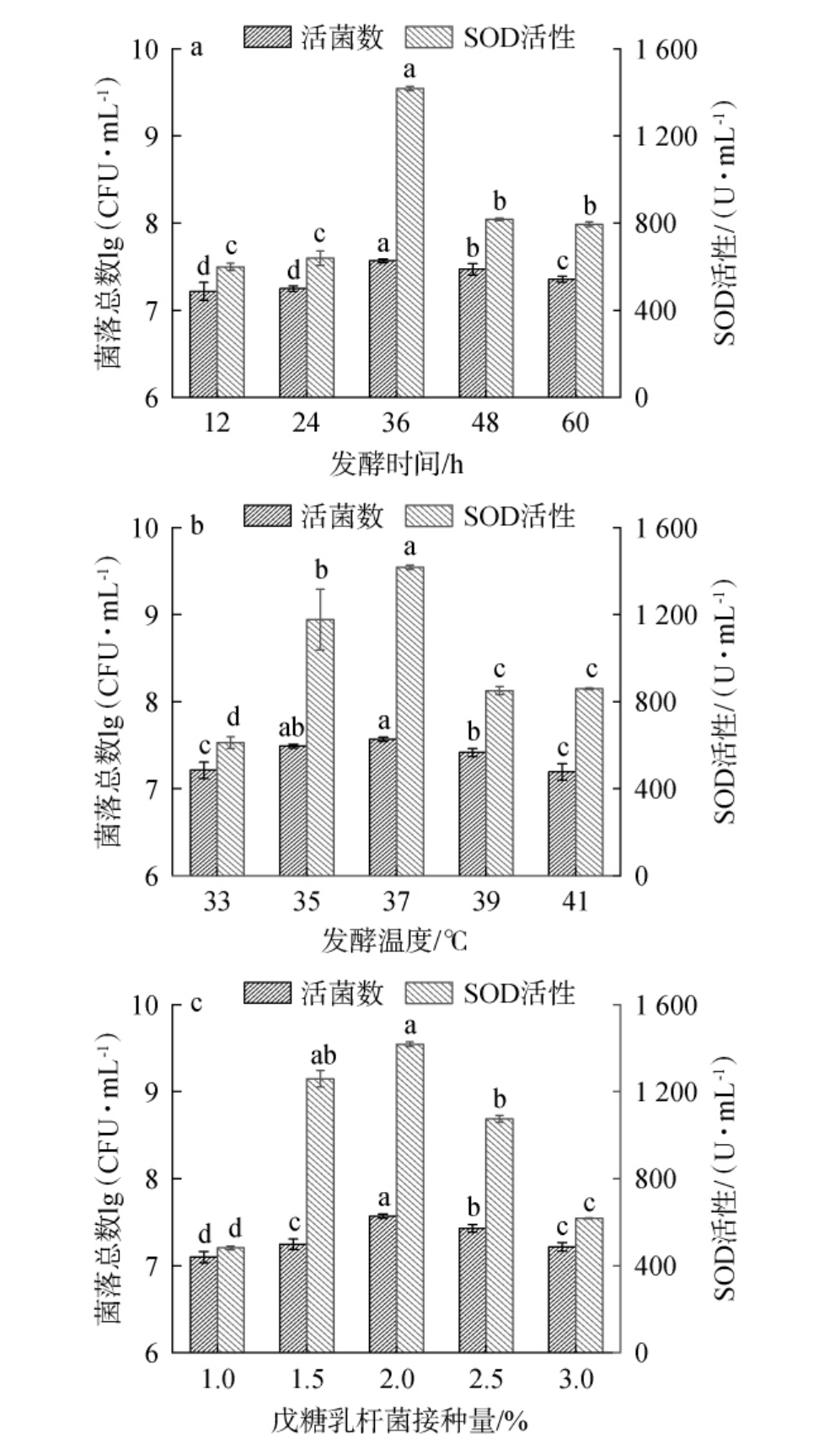
图3 发酵时间(a)、发酵温度(b)及戊糖乳杆菌接种量(c)对戊糖乳杆菌活菌数和超氧化物歧化酶活性的影响
Fig.3 Effect of fermentation time (a), temperature (b) and Lactobacillus pentosus inoculum (c) on the viable counts of Lactobacillus pentosus and superoxide dismutase activity
由图3a可知,随着发酵时间在12~60 h范围内的延长,戊糖乳杆菌活菌数和SOD活性呈先上升后下降趋势。当发酵时间为12~36 h时,戊糖乳杆菌活菌数和SOD活性随之升高;当发酵时间为36 h时,活菌数和SOD活性最高,分别为7.57 lg(CFU/mL)、1 417.16 U/mL;当发酵时间>36 h之后,戊糖乳杆菌活菌数和SOD活性有所下降。 因此,选择最适发酵时间为36 h。
由图3b可知,随着发酵温度在33~41 ℃范围内的增加,戊糖乳杆菌活菌数和SOD活性均呈先上升后下降趋势。当发酵温度为33~37 ℃时,戊糖乳杆菌活菌数和SOD活性随之升高;当发酵温度为37 ℃时,活菌数和SOD活性最高,分别为7.57 lg(CFU/mL)、1 417.16 U/mL;当发酵温度>37 ℃之后,戊糖乳杆菌活菌数和SOD活性有所下降。 发酵温度偏高可偏低都对戊糖乳杆菌活菌数和SOD活性均有一定影响,戊糖乳杆菌的活菌数和SOD的活性结果与陈诗宇等[25-26]的研究一致。因此,选择最适发酵温度37 ℃。
由图3c可知,随着戊糖乳杆菌接种量在1.0%~3.0%范围内的增加,戊糖乳杆菌活菌数和SOD活性均呈先上升后下降趋势。 当戊糖乳杆菌接种量为1.0%~2.0%时,戊糖乳杆菌活菌数和SOD活性随之升高;当戊糖乳杆菌接种量为2.0%时,戊糖乳杆菌活菌数和SOD活性最高,分别为7.57 lg(CFU/mL)、1417.16 U/mL;当戊糖乳杆菌接种量>2.0%之后,戊糖乳杆菌活菌数和SOD活性有所下降。因此,最适戊糖乳杆菌接种量为2.0%。
2.4 苹果渣酵素戊糖乳杆菌发酵条件优化正交试验结果分析
在单因素试验基础上,以发酵时间(A)、发酵温度(B)、戊糖乳杆菌接种量(C)为影响因素,以SOD活性和戊糖乳杆菌活菌数为评价指标,进行3因素3水平的正交试验,正交试验结果与分析见表5。
表5 戊糖乳杆菌发酵条件优化正交试验结果与分析
Table 5 Results and analysis of orthogonal experiments for optimization of Lactobacillus pentosus fermentation conditions
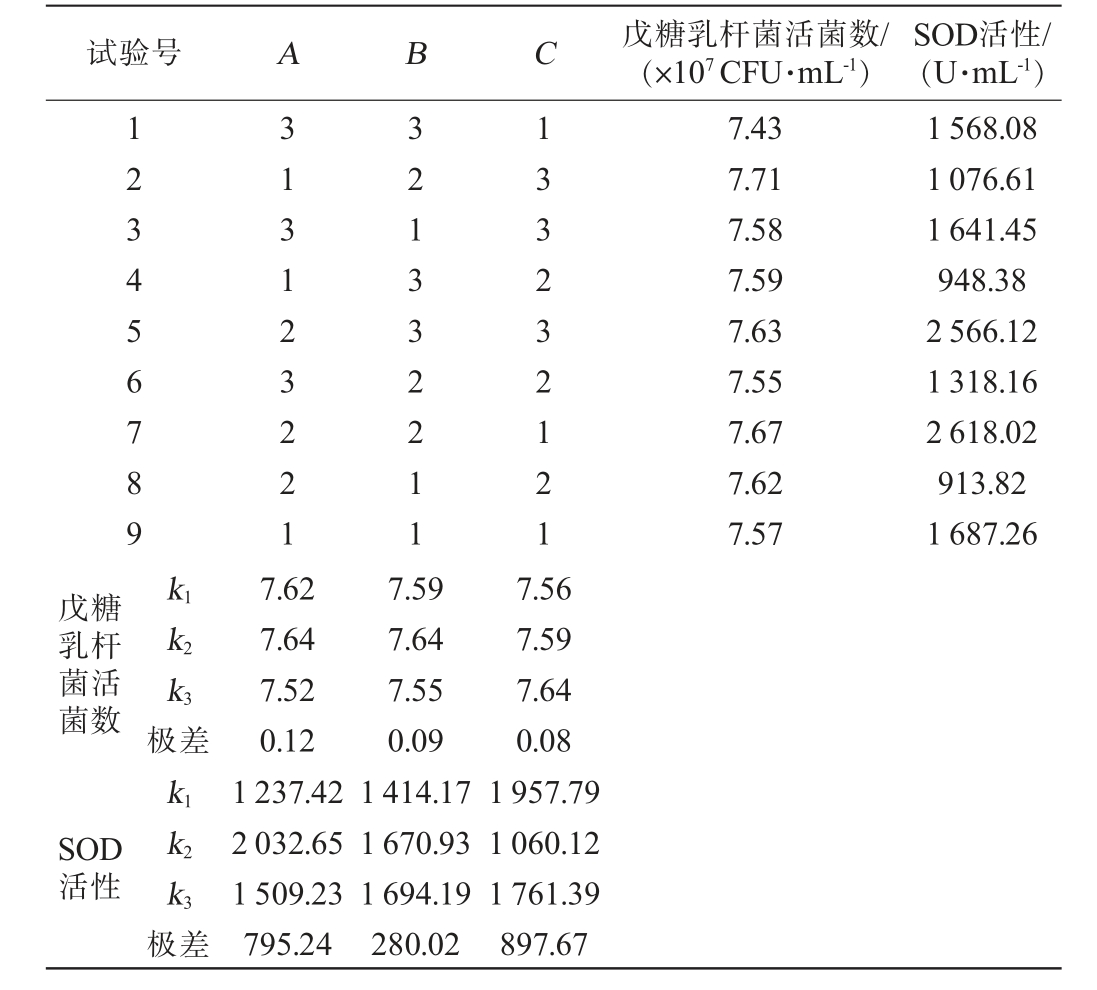
试验号 A B C 戊糖乳杆菌活菌数/(×107 CFU·mL-1)SOD活性/(U·mL-1)123456789 313123221 321332211 133232121 7.43 7.71 7.58 7.59 7.63 7.55 7.67 7.62 7.57 1 568.08 1 076.61 1 641.45 948.38 2 566.12 1 318.16 2 618.02 913.82 1 687.26戊糖乳杆菌活菌数k1 k2 k3 SOD活性极差k1 k2 k3极差7.62 7.64 7.52 0.12 1 237.42 2 032.65 1 509.23 795.24 7.59 7.64 7.55 0.09 1 414.17 1 670.93 1 694.19 280.02 7.56 7.59 7.64 0.08 1 957.79 1 060.12 1 761.39 897.67
由表5可知,以戊糖乳杆菌活菌数为评价指标,发酵时间>发酵温度>戊糖乳杆菌接种量,最佳发酵条件组合为A2B2C3。以SOD活性为评价指标时,戊糖乳杆菌接种量>发酵时间>发酵温度,最佳发酵条件组合为A2B3C1。利用综合平衡法[27]对B因素和C因素进行分析。根据戊糖乳杆菌活菌数考虑,B因素极差影响力排第2,对SOD活性而言,B因素极差影响力排第3,故B因素对戊糖乳杆菌活菌数的影响力大于SOD活性,即选择B2(发酵温度为37 ℃)为最优条件;根据活菌数考虑,C因素极差影响力排第3,对SOD活性而言,C因素极差影响力排第1,C因素对SOD活性的影响力大于戊糖乳杆菌活菌数,故以C1(戊糖乳杆菌接种量为1.5%)为最优条件。 因此,最佳戊糖乳酸杆菌发酵条件为发酵时间36 h、发酵温度37 ℃,戊糖乳杆菌接种量1.5%。在此优化条件下进行3次平行验证试验,苹果渣酵素的戊糖乳杆菌活菌数为7.67 lg(CFU/mL)、SOD活性为2 618.02 U/mL。
2.5 苹果渣酵素理化指标分析
以苹果渣为对照,苹果渣酵素理化指标分析结果见表6。
表6 苹果渣酵素理化指标测定结果
Table 6 Determination results of physicochemical indicators of apple pomace Jiaosu
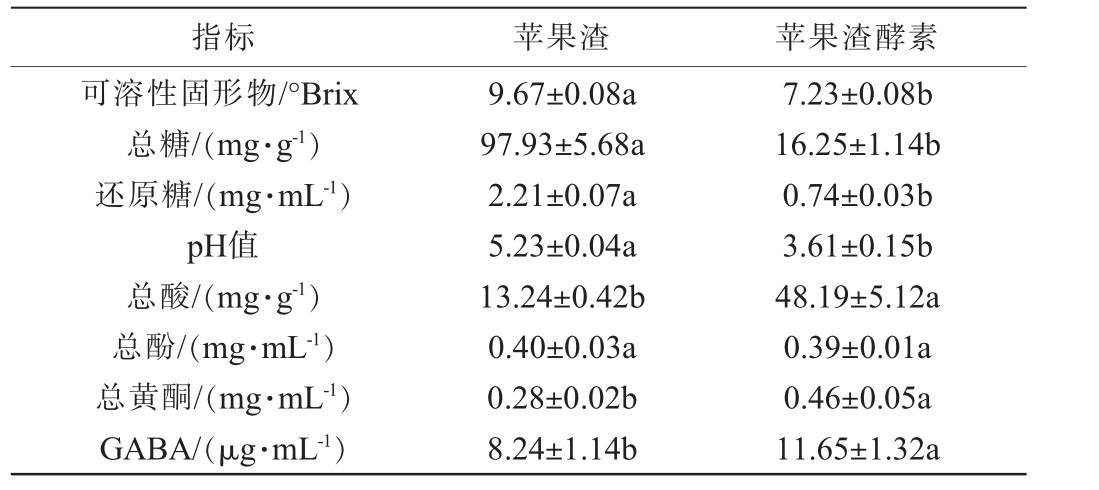
注:同行不同小写字母表示差异显著(P<0.05)。
指标 苹果渣 苹果渣酵素可溶性固形物/°Brix总糖/(mg·g-1)还原糖/(mg·mL-1)pH值总酸/(mg·g-1)总酚/(mg·mL-1)总黄酮/(mg·mL-1)GABA/(μg·mL-1)9.67±0.08a 97.93±5.68a 2.21±0.07a 5.23±0.04a 13.24±0.42b 0.40±0.03a 0.28±0.02b 8.24±1.14b 7.23±0.08b 16.25±1.14b 0.74±0.03b 3.61±0.15b 48.19±5.12a 0.39±0.01a 0.46±0.05a 11.65±1.32a
由表6可知,AP经发酵后的TSS含量、总糖、还原糖及pH值均显著降低(P<0.05),AP经发酵后总酸含量呈显著上升(P<0.05),APJS的可溶性固形物、总糖、还原糖、pH值、总酸含量分别为7.23°Brix、16.25 mg/mL、0.74 mg/mL、3.61、48.19 mg/mL。还原糖是酵母菌发酵的主要底物,在发酵过程中,微生物利用果汁中的糖类物质进行能源的代谢,将其转化成乙醇、有机酸和其他代谢产物[28]。总酚与黄酮是发酵饮料重要的功能活性物质。AP经过发酵后总酚含量无显著变化(P>0.05),相关研究表明,酵母菌分泌的胞外水解酶对聚合酚类物质进行水解作用产生游离酚,同时存在的脱羧酶将有利酚分解为其他小分子物质[29]。AP经酵母菌先发酵、戊糖乳杆菌后发酵总黄酮含量显著升高(P<0.05),可能是乳杆菌所产生的β-糖苷酶破坏糖苷结合态黄酮的糖苷键,也可能是游离的酚类物质代谢转化为黄酮类物质[30-31]。GABA具有抗抑郁、降血压、助睡眠等益处,相关研究表明乳酸菌是代谢GABA菌种之一[32]。 经过戊糖乳杆菌发酵后APJS的GABA含量显著高于AP(P<0.05),说明戊糖乳杆菌能够赋予苹果渣发酵酵素较高的GABA。综上苹果渣酵素功能活性成分有所提升。
2.6 苹果渣酵素抗氧化活性分析
以苹果渣为对照,评估苹果渣酵素的抗氧化能力,测定APJS的DPPH自由基清除率、ABTS自由基清除率及FRAP值,结果见表7。由表7可知,与AP相比,APJS的DPPH自由基清除能力、ABTS自由基清除能力、FRAP值显著高于AP(P<0.05),其APJS的DPPH自由基清除能力、ABTS自由基清除能力、FRAP值分别为60.57%、78.12%、1.36。在酵母菌-戊糖乳杆菌混合发酵中,酵母菌先发酵可为乳杆菌提供无氧环境,乳杆菌产生的乳酸可为酵母菌提供碳源,其次酵母菌和乳酸菌所产生的酶类可相互为对方提供特异性的酶,使酶解释放更多游离态多酚、生成高活性代谢产物[33],导致最终发酵体系的还原性物质总量增加,故抗氧化活性上升。综上,苹果渣酵素抗氧化能力显著提高。
表7 苹果渣酵素抗氧化活性指标测定结果
Table 7 Determination results of antioxidant activity indexes of apple pomace Jiaosu
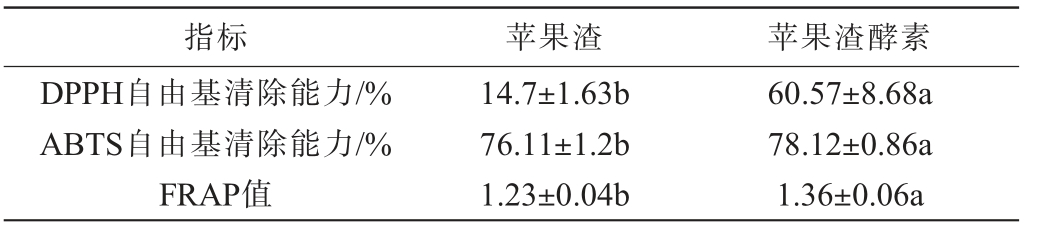
指标 苹果渣 苹果渣酵素DPPH自由基清除能力/%ABTS自由基清除能力/%FRAP值14.7±1.63b 76.11±1.2b 1.23±0.04b 60.57±8.68a 78.12±0.86a 1.36±0.06a
3 结论
本研究以苹果渣为原料,采用酵母菌BV818与戊糖乳杆菌顺序发酵制备苹果酵素,并对发酵前后的理化指标和抗氧化能力进行分析比较。 结果表明,最佳酵母菌发酵条件为白砂糖添加量为5%、发酵温度为25 ℃、酵母菌接种量为0.20%。此条件下酵母菌活菌数为8.79 lg(CFU/mL),SOD活性为932.95 U/mL;最佳戊糖乳杆菌发酵条件为发酵时间36 h、发酵温度37 ℃,戊糖乳杆菌接种量为1.5%。 此条件下,戊糖乳杆菌活菌数为7.67 lg(CFU/mL),SOD活性为2 618.02 U/mL。与AP相比,APJS的总固形物、总糖、还原糖含量及pH值显著降低(P<0.05);总酸、总黄酮含量、GABA、DPPH、ABTS自由基清除能力及FRAP值显著提高(P<0.05)。结果表明,苹果渣经发酵转化生成富含SOD、GABA等功效成分高活性酵素,该研究既解决了资源浪费,又为西藏高原特色农业产业的多元发展提供了新方向。
[1]路贵龙.西藏苹果研究进展[J].农学学报,2019,9(1):30-34.
[2]冯建文,吴亚维,宋莎,等.西南高海拔区域苹果光合作用与光和CO2响应模型的筛选[J].经济林研究,2020,38(1):106-116.
[3]郑海菊,马维峰,梁国平,等.不同嫁接组合对苹果根系生长和果实品质的影响[J].甘肃农业大学学报,2025,60(4):168-175,185.
[4]张汝锋.高原苹果获丰收[J].农产品市场,2020(23):7.
[5]王正荣,吴鹏,田小磊,等.苹果渣粗多糖对发酵乳品质及抗氧化活性的影响[J].食品工业科技,2023,44(6):66-73.
[6]陈笑言,梁新红.苹果渣营养成分分析[J].河南科技学院学报(自然科学版),2021,49(5):41-46.
[7]PASCOALINO L A,FINIMUNDY T C,PIRES T C S P,et al.Investigating bioactive compounds in apple pomace: Potential to develop high addedvalue products from an industrial surplus[J].Food Biosci,2025,63:105664.
[8]NANASHIMA N,MAEDA H,NAKAJIMA A,et al.Apple pomace extract induces cell proliferation and increases type I collagen and hyaluronan production in human skin fibroblasts in vitro[J].Plant Food Hum Nutr,2024,79(3):693-699.
[9]李倩.苹果寡糖的制备、结构鉴定与抗肿瘤活性研究[D].西安:第四军医大学,2013.
[10]曲映红,王建中.苹果渣的利用研究现状[J].中国果菜,2017,37(11):11-13.
[11]索婧怡,朱雨婕,陈磊,等.食用酵素的研究及发展前景分析[J].食品与发酵工业,2020,46(19):271-283.
[12]GAUR G,GÄNZLE M G.Conversion of(poly)phenolic compounds in food fermentations by lactic acid bacteria:Novel insights into metabolic pathways and functional metabolites[J].Curr Res Food Sci, 2023, 6:100448.
[13]SHI F F,WANG L,LI S R.Enhancement in the physicochemical properties, antioxidant activity, volatile compounds, and non-volatile compounds of watermelon juices through Lactobacillus plantarum JHT78 fermentation[J].Food Chem,2023,420:136146.
[14]YI X X, ZHANG S, MENG D, et al.Optimization of Rosa roxburghii Tratt pomace fermentation process and the effects of mono- and mixed culture fermentation on its chemical composition[J].Front Nutr,2024,11:1494678.
[15]杨柳,丁雪,姜志鹏,等.野樱莓果渣酵素发酵工艺优化及抗氧化活性研究[J].中国调味品,2024,49(9):29-37.
[16]曹建康.果蔬采摘后的生理 生化实验指导[M].北京:中国轻工业出版社,2010:32-36.
[17]洪厚胜,朱曼利,李伟,等.葡萄果渣酵素的发酵工艺优化及其理化特性[J].食品科学,2019,40(8):63-72.
[18]国家市场监督管理总局,国家卫生健康委员会.GB 4789.35—2023 食品安全国家标准食品微生物学检验乳酸菌检验[S].北京:中国标准出版社,2023.
[19]冯雨.黄连素和硫辛酸对柑橘青霉病的防治研究[D].重庆:西南大学,2021.
[20]FANG S,ZHAO Q,JIN Z N,et al.Changes in organic acids and in vitro antioxidant activity of Chinese bayberry Jiaosu during fermentation[J].J Biobased Mater Bio,2020,14(6):715-722.
[21]高莉,杨俊燕,赵英虎,等.植物蛋白基玉米黄色素微胶囊的制备及性能评价[J].食品科学,2025,46(5):65-74.
[22]姚芳,吴平,刘萍,等.黑果腺肋花楸果酒发酵条件优化及抗氧化活性分析[J].中国酿造,2023,42(12):206-211.
[23]刘维兵,王舸楠,王犁烨,等.葡萄海棠果酵素发酵工艺优化及体外抑菌与抗氧化活性的研究[J].食品工业科技,2019,40(16):118-125.
[24]唐少军,雷平,邵晨霞,等.粗毛纤孔菌液体发酵工艺优化及胞外多糖的抗菌和抗肿瘤活性[J].食品工业科技,2021,42(5):101-107.
[25]陈诗宇,茶光辉,李吉琴,等.固态发酵饲料工艺优化及抗营养因子降解效果研究[J].动物营养学报,2023,35(10):6787-6800.
[26]王瑞,陈洁如,刘亚平,等.番茄酵素发酵工艺优化及营养成分变化分析[J].中国调味品,2024,49(4):11-17,24.
[27]王子苑,吉玉玉,舒健虹,等.菌酶协同正交试验对3种青贮饲料发酵品质影响的研究[J].动物营养学报,2024,36(8):5399-5410.
[28]MARKOWSKI J, BARON A, LE QUÉRÉ J M, et al.Composition of clear and cloudy juices from French and Polish apples in relation to processing technology[J].LWT-Food Sci Technol,2015,62(1):813-820.
[29]YANG S A,HOU M X,TAN W T,et al.Lactic acid bacteria sequential fermentation improves viable counts and quality of fermented apple juice via generating two logarithmic phases[J].Food Chem, 2025, 464(1):141635.
[30]MARAZZA J A,LEBLANC J G,DE GIORI G S,et al.Soymilk fermented with Lactobacillus rhamnosus CRL981 ameliorates hyperglycemia,lipid profiles and increases antioxidant enzyme activities in diabetic mice[J].J Funct Foods,2013,5(4):1848-1853.
[31]WANG Y,QI X Y, FU Y, et al.Effects of Torulaspora delbrueckii cofermented with Saccharomyces cerevisiae on physicochemical and aromatic profiles of blueberry fermented beverage[J].Food Chem, 2023,409:135284.
[32]ZHOU H L,CHEN H Y,BAO D P,et al.Recent advances of γ-aminobutyric acid:Physiological and immunity function,enrichment,and metabolic pathway[J].Front Nutr,2022,9:1076223.
[33]HAN S S,ZHANG H Y,YIN H,et al.Characteristics of inoculated multistage apple fermentation over spontaneous fermentation for the production of traditional functional beverage Jiaosu: antioxidant, antibacterial activities and metabolic changes[J].Curr Res Nutr Food Sci,2021,9(2):606-617.