近年来,随着枸杞栽培面积和产量的增加,枸杞加工业快速发展。 枸杞皮渣作为枸杞加工过程中产生的废弃物,因不能被合理利用而对环境造成了污染,但有研究表明[1],在枸杞皮渣中仍保留了很多营养物质,如干物质、氨基酸、纤维素、糖类化合物等[1]。 李勇等[1]提出通过物理、化学及生物技术手段提升其附加值的可能性,现有处理枸杞皮渣的方法为提取色素[2]、类胡萝卜素[3]或作为畜禽饲料[4]等,然而枸杞皮渣的应用潜力没有被充分挖掘。刘宁等[5]则利用气流式超微粉碎机处理枸杞皮渣并应用于面包制作中;王兆燃等[6]将枸杞渣与小米粉结合制作出一款蛋糕,从而实现对枸杞皮渣中营养成分的再利用。
现有研究主要集中在物理或化学改性方面,但物理处理方法不能很好地改善枸杞皮渣适口性差以及大分子蛋白等物质不利于吸收的问题,化学的方法又涉及溶剂残留等问题,相比之下,微生物发酵技术可以解决上述难题。固态发酵技术被广泛认为是农业废弃物资源化的有效策略,尤其在提升酚类化合物和抗氧化活性方面具有显著优势[7]。由于乳酸菌的新陈代谢对发酵产品的结构、口感以及营养成分有重要影响[8],乳酸菌固态发酵成为一种有效的生物转化方法。 吴寒等[9]研究表明多菌种固态发酵可以有效提升燕麦全谷物蛋白质的营养价值;ANOKHINA E等[10]则探讨了乳酸菌对青贮饲料发酵品质的影响,证明了乳酸菌在改善饲料质量和增加营养价值方面的显著作用。NACCHIO B L等[11]通过乳酸菌固态发酵豆酱,研究其挥发性物质的变化,结果显示发酵能够产生所需的挥发性物质,减少令人不适的化合物,从而提高了消费者的接受度。SEVINDIK O A等[12]的研究表明,选择特定的乳酸菌株可以显著影响发酵果汁中的香气和生物活性成分,进一步证实了乳酸菌在改善食品品质方面的潜力。目前乳酸菌主要用于发酵枸杞汁饮料等方面[13-14],而使用乳酸菌固态发酵枸杞皮渣的研究较少。
本研究将乳酸菌应用于固态发酵枸杞皮渣,以发酵后枸杞皮渣的理化性质、生物活性成分及抗氧化性为指标,筛选适合发酵枸杞皮渣的乳酸菌株,并分析不同发酵条件下枸杞皮渣生物活性成分及抗氧化性,再通过单因素试验和响应面试验优化固态发酵条件,以期实现枸杞皮渣资源的有效再利用,同时为其在功能性食品开发中的应用提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
枸杞皮渣:由宁夏全通枸杞供应链管理股份有限公司提供。
植物乳植杆菌(Lactiplantibacillus plantarum)NXU-Q5、NXU-Q6、NXU-Q8、NXU-Q12,嗜酸乳杆菌(Lactobacillus acidophilus)G-2、G-3、G-4、G-14、G-15,发酵乳杆菌(Lactobacillus fermentum)NX-Q10、NX-Q11:实验室分离、鉴定、保藏。
1.1.2 化学试剂
乳清蛋白(食品级):潍坊市美凯威医药科技有限公司;芦丁(分析纯):上海源叶生物科技有限公司;没食子酸(分析纯):上海一基实业有限公司;浓硫酸、碳酸钠、硝酸钠(均为分析纯):国药集团化学试剂有限公司;酚酞(分析纯):天津市科密欧化学试剂有限公司;Folin-酚:上海麦克林生化科技有限公司;无水乙醇、亚硝酸钠(均为分析纯):天津市永大化学试剂有限公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)自由基清除能力检测试剂盒、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力检测试剂盒:北京索莱宝科技有限公司。
1.1.3 培养基
枸杞皮渣培养基:将枸杞皮渣粉碎并通过60目筛,得到枸杞皮渣粉,将枸杞皮渣粉与水以料液比1∶1.1(g∶mL)混匀后在121 ℃蒸汽灭菌锅中热处理30 min,室温静置冷却。
MRS培养基:称取MRS培养基干粉66.2 g,加热溶解于1 000 mL蒸馏水中,121 ℃高压灭菌15 min,备用。
1.2 仪器与设备
SW-CJ2D超净工作台:苏州净化设备有限公司;PL203电子天平:上海梅特勒-托利多公司;BKQ-B7511立式压力蒸汽灭菌器:山东博科消毒设备有限公司;JL-D漩涡振荡器:太仓市华利达实验设备有限公司;PHS-3E pH计:贵州众创仪云科技有限公司;BSP-150生化培养箱:上海博讯实业有限公司。
1.3 方法
1.3.1 乳酸菌发酵枸杞皮渣试验
乳酸菌的活化:用无菌吸管吸取0.4 mL MRS液体培养基,滴入菌种管内,轻轻振荡,使冻干菌体溶解成悬浮液体。取0.2 mL上述菌悬液注入装有4 mL MRS液体培养基的试管中,轻轻摇匀。置于37 ℃恒温培养箱中培养24 h,活化三代。
参考肖旸等[13]的方法,将已活化的乳酸菌菌液(106 CFU/mL)以体积比10%的接种量接入枸杞皮渣培养基中,对照组(WG)为加入相同体积的生理盐水,放置37 ℃培养箱中发酵培养48 h后,检测其理化性质、生物活性成分含量及抗氧化活性。
1.3.2 乳酸菌发酵枸杞皮渣工艺优化
(1)单因素试验
设置基础发酵条件为乳酸菌液接种量10%,料水比1∶1.1(g∶mL),乳清蛋白添加量20%,发酵温度37 ℃,发酵时间48 h,分别考察不同乳酸菌液接种量(4%、6%、8%、10%、12%)、发酵时间(25 h、30 h、35 h、40 h、45 h)、料水比(1∶0.5、1∶0.8、1∶1.1、1∶1.3、1∶1.5)(g∶mL)、乳清蛋白添加量(10%、12%、14%、16%、18%、20%)、发酵温度(20 ℃、25 ℃、28 ℃、31 ℃、34 ℃、37 ℃、40 ℃)对总酚和总黄酮含量及ABTS+自由基清除率的影响。
(2)响应面试验
在单因素试验结果的基础上,以接种量、发酵时间、料水比、发酵温度和乳清蛋白添加量为自变量,以总酚含量、总黄酮含量和ABTS+自由基清除率为响应值,编码值1、0、-1分别表示高、中、低水平,运用Design-Expert软件设计5因素3水平试验。
1.3.3 理化指标的测定
采用pH计测定检测发酵48 h后枸杞皮渣的pH值;参照GB/T 12456—2008《食品中总酸的测定》测定总酸含量;参考CHEN F等[15]的方法检测枸杞皮渣中总糖(以葡萄糖计)含量,并绘制葡萄糖标准曲线为y=0.280 9x+0.010 4(R2=0.990 1);参考焦贺等[16]的方法检测枸杞皮渣中可溶性蛋白含量;参考TARRÉS Q等[17]的方法检测枸杞皮渣中纤维素含量。
1.3.4 总酚、总黄酮和多糖含量的测定
参考陆健等[18]的方法检测总酚含量,以没食子酸为标准品绘制标准曲线计算总酚含量,标准曲线为y=0.689 2x-0.017 2(R2=0.997 3)。参考田建华[19]的方法检测总黄酮含量,以芦丁为标准品绘制标准曲线为y=0.080 4x-0.031 9(R2=0.992 7)。 参考王高锋[20]的苯酚-硫酸法测定枸杞皮渣中多糖含量。
1.3.5 抗氧化活性的测定
(1)ABTS+自由基清除率的测定
参考张山佳等[21]的方法测定ABTS+自由基清除率。称取100 mg样品加入900 μL提取液,旋涡振荡混匀,室温10 000 r/min离心10 min,取上清,置冰上待测。按照检测试剂盒内说明书步骤操作,使用96孔板测定在波长405 nm处的吸光度值。ABTS+自由基清除率计算公式如下:
式中:D为ABTS+自由基清除率,%;A测为待测溶液与ABTS溶液混合液的吸光度值;A对照为ABTS溶液与磷酸缓冲盐溶液(phosphate buffer saline,PBS)液混合液的吸光度值;A空白为ABTS溶液与70%酸化乙醇溶液混合液的吸光度值。
(2)DPPH自由基清除率的测定
参考刑慧珍等[22]的方法测定DPPH自由基清除率,并稍作修改。称取100 mg样品,使用10 mL无水乙醇将其溶解,旋涡振荡混匀,室温10 000 r/min离心10 min,取上清为待测溶液。将0.02 mg/mL的DPPH溶液加入2 mL待测溶液中,并将其混合均匀后置于25 ℃恒温水浴锅中加热30 min,测定其在波长517 nm处的吸光度值。DPPH自由基清除率计算公式如下:
式中:P为DPPH自由基清除率,%;Am为待测溶液与DPPH溶液混合液的吸光度值;An为待测溶液与无水乙醇混合液的吸光度值;A0为DPPH溶液与无水乙醇混合液的吸光度值。
1.3.6 综合评分计算
综合X(总酚)、Y(总黄酮)、M(ABTS+清除率)三个指标构建抗氧化活性综合评分(antioxidant activity composite score,AACS),将每个指标的实验值进行归一化,然后根据其重要性赋予权重(w1,w2,w3),计算AACS=w1X+w2Y+w3M(w1=w2=w3=1/3)。
1.3.7 数据处理与统计分析
试验测定指标进行3次重复,利用Microsoft Excel 2016软件对试验数据进行处理,并用“平均值±标准差”表示,采用SPSS27.0进行单因素方差分析和林肯检验(P<0.05),采用Origin 2021和Design-Expert 13作图。
2 结果与分析
2.1 不同菌株发酵对枸杞皮渣理化性质的影响
不同乳酸菌发酵枸杞皮渣后其理化指标测定结果见表1。
表1 不同菌株发酵枸杞皮渣的理化指标
Table 1 Physicochemical indexes of fermented goji pomace by different strains

注:同一列不同字母表示差异性显著(P<0.05);WG为对照组。
菌株编号 pH值 总酸含量/(mg·g-1) 总糖含量/(g·kg-1) 可溶性蛋白含量/(mg·mL-1) 纤维素含量/%NXU-Q5 NXU-Q6 NXU-Q8 NXU-Q12 G-2 G-3 G-4 G-14 G-15 NX-Q10 NX-Q11 WG 4.55±0.04f 4.25±0.03h 4.68±0.03cd 4.65±0.04de 4.81±0.03b 4.62±0.04e 4.54±0.03f 4.65±0.04bcd 4.32±0.03g 4.73±0.05c 4.72±0.04c 6.31±0.07a 9.85±0.01cd 14.93±0.02a 6.84±0.10f 5.94±0.01g 7.42±0.02ef 10.67±0.01c 7.40±0.01e 13.82±0.02b 9.40±0.04d 12.84±0.06b 9.93±0.04cd 4.35±0.10h 11.43±0.18c 7.45±0.10i 6.72±0.10j 8.32±0.18g 8.59±0.06f 7.62±0.10f 8.61±0.08f 10.20±0.12d 14.65±0.30b 9.47±0.08e 6.42±0.18k 17.79±0.24a 0.82±0.03a 0.53±0.01f 0.22±0.02i 0.52±0.02f 0.45±0.01g 0.66±0.04c 0.63±0.01d 0.54±0.04ef 0.69±0.01b 0.56±0.03e 0.45±0.01g 0.32±0.05h 5.60±0.02i 6.00±0.11d 6.10±0.05c 6.30±0.18a 4.80±0.11h 4.60±0.11j 5.70±0.06f 5.70±0.05f 4.70±0.04gh 5.60±0.15g 5.80±0.12e 6.20±0.08b
由表1可知,与对照组相比,发酵后枸杞皮渣的总酸含量、pH值和总糖含量均具有显著性差异(P<0.05)。 总酸含量与pH值呈相反趋势,产酸量最高的为菌株NXU-Q6。发酵后枸杞皮渣中的总糖含量降低了17.65%~62.06%,其中经乳酸菌NXU-Q6发酵后的皮渣中总糖消耗量最高,表明该菌发酵枸杞皮渣的能力最强。各菌株发酵后枸杞皮渣中的可溶性蛋白含量具有显著性差异(P<0.05),且除菌株NXU-Q8外,其余菌株发酵后的皮渣中可溶性蛋白含量均增加,增加幅度为28.89%~60.98%,与吴寒等[9]通过多菌种固态发酵提升燕麦蛋白质溶解性的机制一致。黄宁馨等[23]采用多种乳酸菌对枸杞汁进行发酵,发现不同乳酸菌对枸杞汁中可溶性蛋白质的影响具有差异,除干酪乳杆菌外其他乳酸菌发酵枸杞果汁可溶性蛋白增加,这与本研究得出的结果相似。所有乳酸菌发酵均显著改变了纤维素含量(P<0.05),但影响方向不同:降解效果显著的菌株有10株,如菌株G-3、G-15、G-2显著降低了纤维素含量(P<0.05),降解率范围在1.61%~25.81%。 其中菌株NXU-Q6发酵后纤维素质量分数降低至6.00%,这可能是由于乳酸菌产生的纤维素酶或相关酶促进了纤维素的分解。综上,不同乳酸菌发酵枸杞皮渣后其理化指标(pH、总酸、总糖、可溶性蛋白及纤维素)均发生显著变化(P<0.05),其中菌株NXU-Q6表现出最优异的产酸能力,糖消耗与纤维素降解能力居中。
2.2 不同菌株发酵对枸杞皮渣活性成分的影响
不同菌株发酵对枸杞皮渣总酚、总黄酮、多糖含量的影响见图1。 由图1A和B可知,与菌株WG相比,除菌株G-2外其余菌株发酵枸杞皮渣均显著增加了总黄酮和总酚含量,尤其经L.plantarum NXU-Q6发酵后枸杞皮渣中总酚和总黄酮含量最高,总酚含量达39.33 mg/g,较未发酵组(17.79 mg/g)提升了65.92%,总黄酮含量增加了70.89%。这可能是因为乳酸菌代谢产生的酶(如纤维素酶)通过降解枸杞皮渣的纤维结构释放出结合型酚类物质,从而显著提升总酚和总黄酮含量。 也有研究表明发酵使总酚含量增加,是因为乳酸菌在发酵过程中能将大分子酚类物质分解成小分子酚类物质[24],并使其通过细胞壁释放出共轭酚类或结合型酚类物质,从而导致酚类物质含量增加。 乳酸菌是一种能够将糖类物质分解成乳酸的微生物,它可以降解植物中的多糖,从而导致多糖含量下降[25]。由图1C可知,与对照组相比,经11株乳酸菌发酵后枸杞皮渣中多糖含量均显著降低(P<0.05),经L.plantarum NXU-Q6发酵后的枸杞皮渣中多糖含量降至最低,为3.66 g/100 g,较菌株WG(11.49 g/100 g)显著降低了68.15%(P<0.05)。 马晓娟等[26]使用植物乳植杆菌发酵枸杞原浆,发现发酵后的枸杞原浆中多糖含量同样显著降低。综上,除菌株G-2外其余菌株均能显著增加总酚和总黄酮含量,其中菌株NXU-Q6提升最显著;同时所有菌株均能显著降低多糖含量,菌株NXU-Q6降解率最高。
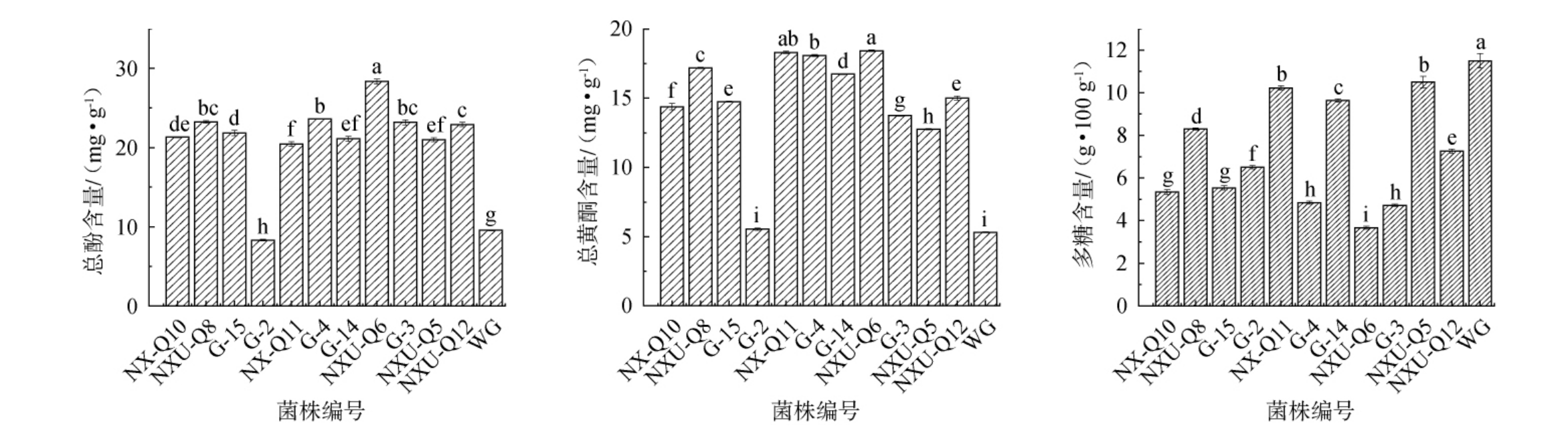
图1 不同菌株发酵后枸杞皮渣中总酚含量、总黄酮含量和多糖含量的变化
Fig.1 Changes of total phenol content, total flavonoid content and polysaccharide content in goji pomace after fermentation by different strains
不同小写字母表示差异显著(P<0.05)。下同。
2.3 不同菌株发酵对枸杞皮渣抗氧化活性的影响
经11株乳酸菌发酵后枸杞皮渣中的ABTS+自由基清除率和DPPH自由基清除率测定结果见图2。由图2A可知,与对照组相比,除菌株NXU-Q8外,经其他菌株发酵后枸杞皮渣的DPPH自由基清除率显著升高(P<0.05)。 其中NXU-Q12在DPPH自由基清除能力上表现最优,清除率增长138.56%,其次是菌株NXU-Q6,清除率增长了136.54%。由图2B可知,与对照组相比,经乳酸菌发酵后枸杞皮渣的ABTS+自由基清除率均显著升高(P<0.05),菌株NXU-Q6在ABTS+自由基清除率上表现最优,清除率增长了80.67%,其次是菌株NXU-Q12,增长了78.95%。这可能是因为植物乳杆菌发酵提高了具有质子供体特性的抗氧化活性成分的利用[12],在早期的研究中发现乳酸菌可以增加具有质子供体特性的化合物的可用性,从而导致DPPH自由基清除率的增加[27]。枸杞皮渣经乳酸菌发酵后抗氧化活性较发酵前均显著提高,这表明乳酸菌发酵是提高废弃物营养价值的有效方法之一[28]。HUANG Z等[29]研究表明,大豆中总酚、黄酮是发挥抗氧化活性的主要成分,总酚含量和总黄酮含量的增加,有利于皮渣抗氧化能力的增强。 本研究观察到NXU-Q6组ABTS+自由基清除率达94.67%,其总酚含量高达39.33 mg/g,二者呈正相关,与近期研究发现乳酸菌发酵枸杞浆通过提升酚类物质含量缓解氧化损伤的机制相符[30]。 综上,经乳酸菌发酵后,枸杞皮渣的抗氧化活性显著高于未发酵组,尤其菌株NXU-Q6、NXU-Q12使得枸杞皮渣抗氧化活性提升最显著。
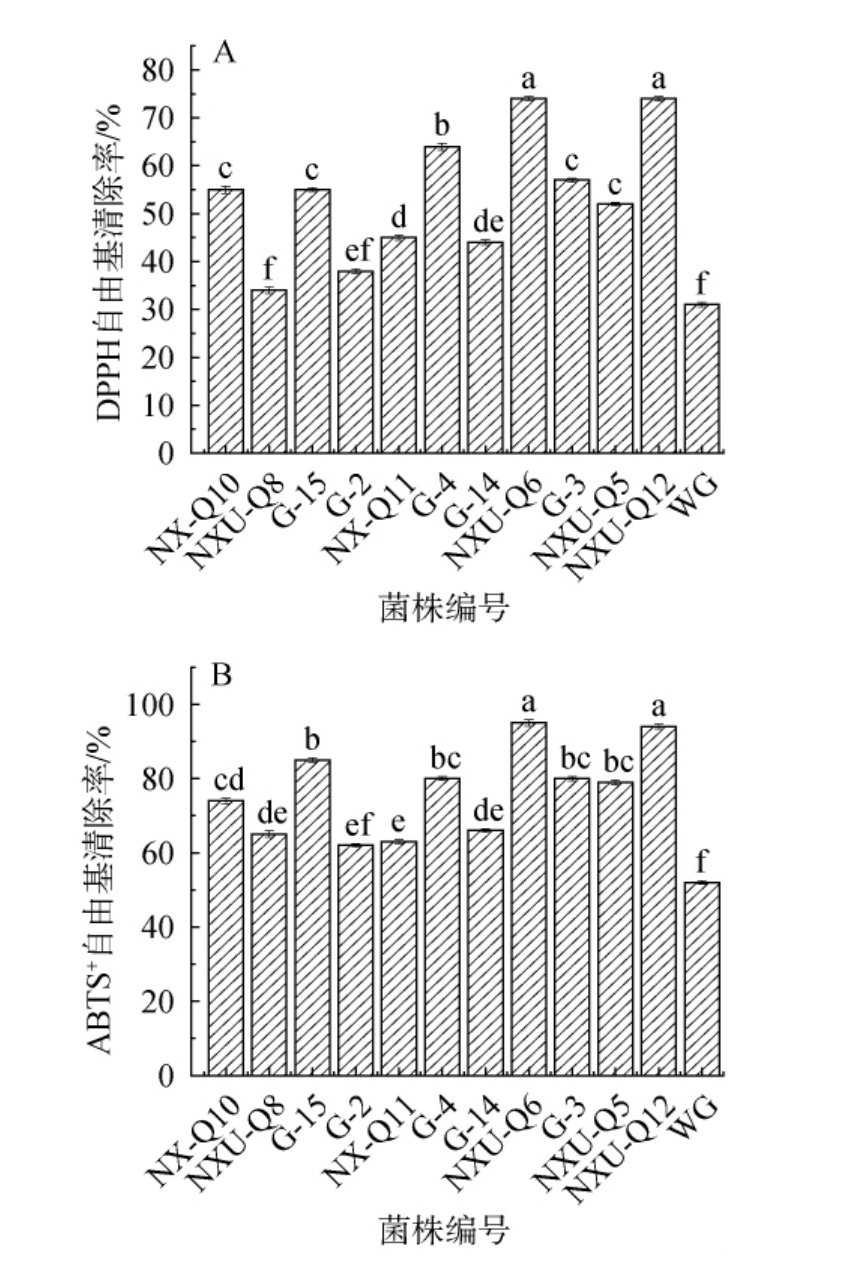
图2 不同菌株发酵枸杞皮渣中DPPH自由基清除率(A)和ABTS+自由基清除率(B)的变化
Fig.2 Changes of DPPH radical scavenging activity (A) and ABTS+radical scavenging activity (B) after fermentation of goji pomace by different strains
2.4 植物乳植杆菌NXU-Q6发酵条件优化单因素试验
不同菌株发酵枸杞皮渣的实验结果表明,L.plantarum NXU-Q6对皮渣的分解能力最强,因此选取NXU-Q6进行后续发酵实验。
2.4.1 NXU-Q6接种量对枸杞皮渣发酵的影响
接种量对枸杞皮渣总酚含量、总黄酮含量和ABTS+自由基清除率的影响见图3。
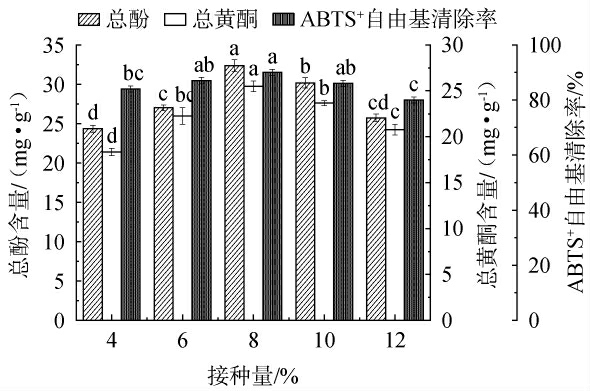
图3 接种量对总酚含量、总黄酮含量和ABTS+自由基清除率的影响
Fig.3 Effect of inoculum on total phenol content, total flavonoid content, and ABTS+radical scavenging activity
由图3可知,随着L.plantarumNXU-Q6接种量的增加,发酵后皮渣中总酚、总黄酮含量和ABTS+自由基清除率先增大后减小,当接种量为8%时这三个值均最大,显著高于其他接种量(P<0.05)。可能随着菌株接种量的增加,微生物繁殖量增大,对营养物质的消耗量也增加,枸杞皮渣中的多酚类物质可能被乳酸菌作为营养物质消耗掉,导致含量降低[31]。因此,选择最佳接种量为8%。
2.4.2 不同发酵时间对枸杞皮渣发酵的影响
发酵时间对总酚含量、总黄酮含量和ABTS+自由基清除率的影响见图4。 由图4可知,在发酵前35 h,总酚含量随着发酵时间的增加而显著增加(P<0.05),可能是在发酵初期,枸杞皮渣中的营养成分充足,导致微生物迅速增长并产生有机酸和酶等代谢物,这些物质有助于将皮渣中的酚类化合物释放出来。 当发酵时间超过35 h后,大量的酚类物质就会影响到细菌的生长,微生物代谢能力下降,而且一些酚类物质被微生物生长利用,使总酚含量显著下降(P<0.05)。总黄酮含量先升高后降低的原因可能是,前期的高渗环境及微生物的活动使植物细胞破裂,引起原料中物质渗出与合成[32]。随着发酵进一步进行(35~45 h),加速了总黄酮的氧化分解,致使总黄酮含量降低。因此,选择最佳发酵时间为35 h。
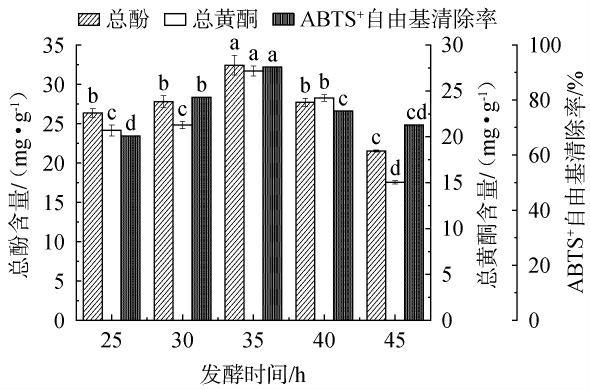
图4 发酵时间对总酚含量、总黄酮含量和ABTS+自由基清除率的影响
Fig.4 Effect of fermentation time on total phenol content, total flavonoid content, and ABTS+radical scavenging activity
2.4.3 不同料水比对枸杞皮渣发酵的影响
枸杞皮渣粉与水的比值,即料水比对总酚含量、总黄酮含量和ABTS+自由基清除率的影响见图5。由图5可知,随着料水比的增加,总酚、总黄酮和ABTS+自由基清除率都是先增加后减少。 当料水比为1∶1.1(g∶mL)时,总酚和总黄酮含量及ABTS+自由基清除率达到最大值,分别为34.84 mg/g、27.57 mg/g、92%。当料水比超过1∶1.1(g∶mL)时,总酚和总黄酮含量及ABTS+自由基清除率随之显著降低(P<0.05),可能是因为料水比高时,基质为粘稠状液体,粘稠液体(如高浓度糖浆、胶体溶液)因流动性和低透气性,无法提供固态发酵所需的气-固界面环境而不适宜固态发酵[33]。 因此,最适料水比为1∶1.1(g∶mL)。
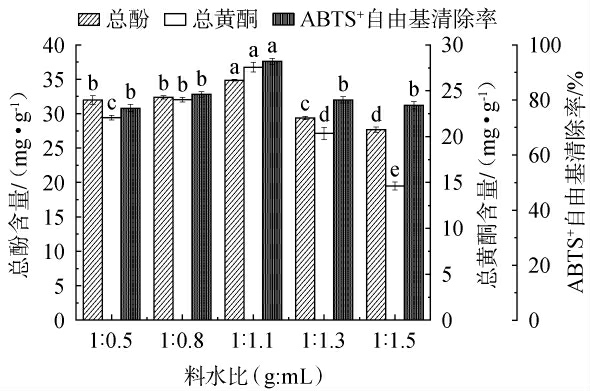
图5 料水比对总酚含量、总黄酮含量和ABTS+自由基清除率的影响
Fig.5 Effect of solid-liquid ratio on total phenol content, total flavonoid content, and ABTS+radical scavenging activity
2.4.4 不同乳清蛋白添加量对枸杞皮渣发酵的影响
乳清蛋白添加量对总酚含量、总黄酮含量和ABTS+自由基清除率的影响见图6。由图6可知,乳清蛋白添加量为16%时,各响应值达到最大,分别为37.62 mg/g、28.94 mg/g和95%,这可能是因为适宜氮源提供菌体生长所需氮元素,增强乳酸菌分泌胞外酶(如纤维素酶),促进纤维结构降解,释放更多结合态酚类与黄酮。当添加量>16%时,总酚、总黄酮及ABTS+自由基清除率显著下降,提示高氮环境可能改变碳氮代谢平衡,优先合成菌体蛋白而非次级代谢产物;或是引起渗透压胁迫,抑制菌株活性[34]。总酚和总黄酮含量与ABTS+自由基清除率变化高度一致,在乳清蛋白添加量16%时三者均达峰值,因此最佳乳清蛋白添加量为16%。
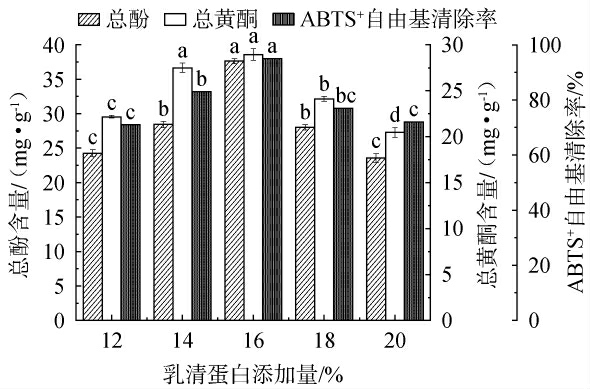
图6 乳清蛋白添加量对总酚含量、总黄酮含量和ABTS+自由基清除率的影响
Fig.6 Effect of whey protein addition on total phenol content, total flavonoid content, and ABTS+radical scavenging activity
2.4.5 不同发酵温度对枸杞皮渣发酵的影响
发酵温度对总酚含量、总黄酮含量和ABTS+自由基清除率的影响见图7。由图7可知,随着发酵温度的升高,各响应值随之显著升高(P<0.05),当发酵温度为34 ℃时,各响应值达到最大,分别为38.71 mg/g、30.72 mg/g和98%。这可能是因为发酵温度升高使得枸杞皮渣内分子的渗透、扩散、溶解速率加快,同时高温条件破坏了细胞壁的完整性,使得酚类物质及总黄酮物质更易被产生[35]。 但发酵温度超过34 ℃时,温度太高则会使菌种的酶失活,且不利于进行生物化学反应。因此,最适发酵温度为34 ℃。
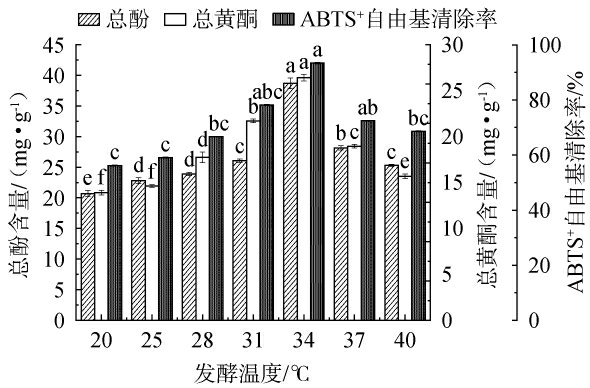
图7 发酵温度对总酚含量、总黄酮含量和ABTS+自由基清除率的影响
Fig.7 Effect of fermentation temperature on total phenol content,total flavonoid content, and ABTS+radical scavenging activity
2.5 响应面试验
2.5.1 响应面试验结果及方差分析
以单因素试验结果为基础,设置接种量(A)、发酵时间(B)、料水比(C)、氮源添加量(D)和发酵温度(E)为评价因素,以总酚含量、总黄酮含量和ABTS+自由基清除率为响应值,利用响应面试验优化菌株发酵枸杞皮渣的发酵工艺条件,响应面试验设计及结果见表2。以AACS为响应值,进行回归模型方差分析,结果见表3。
表2 发酵条件优化响应面试验设计与结果
Table 2 Design and results of response surface experiments for fermentation conditions optimization

序号 A B C D E 总酚/(mg·g-1)总黄酮/(mg·g-1)ABTS+自由基清除率/% AACS 1 2 3 4 5 6 7 8 9 1 0 8 6 1 0 8 8 1 0 8 6 8 1 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 0 8 8 1 0 10 8 8 1 0 8 8 6 8 6 8 8 8 8 6 6 1 0 8 6 8 8 8 8 8 8 8 6 8 1 0 8 8 35 35 35 35 40 35 30 35 35 35 35 35 40 35 35 35 35 40 30 35 30 30 40 35 35 40 35 35 35 35 40 35 40 30 35 30 30 35 35 35 30 35 35 1∶0.8 1∶0.8 1∶1.05 1∶1.3 1∶1.05 1∶1.3 1∶1.05 1∶1.05 1∶1.05 1∶1.05 1∶0.8 1∶1.3 1∶1.05 1∶1.05 1∶1.05 1∶0.8 1∶1.05 1∶1.05 1∶1.05 1∶1.05 1∶1.3 1∶1.05 1∶0.8 1∶1.3 1∶1.05 1∶1.3 1∶1.3 1∶1.05 1∶0.8 1∶1.3 1∶1.05 1∶1.05 1∶1.05 1∶0.8 1∶0.8 1∶1.05 1∶1.05 1∶1.05 1∶1.05 1∶1.05 1∶1.05 1∶1.05 1∶1.05 16 16 18 16 16 16 16 16 18 16 16 14 16 16 14 18 14 18 16 16 16 16 16 16 18 16 16 18 16 18 16 16 16 16 14 14 18 14 14 16 16 16 16 31 34 34 37 37 34 31 37 31 37 37 34 34 31 37 34 34 34 37 31 34 34 34 31 37 34 34 34 34 34 34 34 31 34 34 34 34 31 34 34 34 34 34 26.54 27.64 25.73 25.34 26.56 26.56 26.21 27.19 27.56 28.12 28.45 28.78 27.57 28.89 28.15 28.45 30.36 30.56 29.56 29.87 30.50 30.65 28.77 29.98 30.34 32.34 31.31 31.17 32.78 31.76 32.31 33.69 33.98 34.87 36.17 35.17 35.56 35.72 32.56 38.78 37.72 39.32 38.72 15.33 17.78 17.32 17.32 18.98 18.33 18.29 19.33 19.37 20.23 20.33 20.64 20.18 20.13 20.12 20.78 21.09 21.34 21.34 21.55 22.15 22.56 22.78 22.45 22.12 23.88 23.89 23.23 23.65 23.33 24.26 25.33 25.45 26.77 26.25 27.12 27.45 27.44 27.28 29.34 29.45 31.22 30.45 65.32 67.34 67.67 67.77 69.32 69.58 69.89 71.16 71.34 73.12 73.23 73.34 73.36 73.67 73.74 73.87 75.36 75.37 75.59 75.78 78.28 78.52 78.56 78.56 78.83 78.94 81.33 81.35 81.89 83.34 83.54 85.36 85.39 86.39 86.56 89.34 89.37 89.37 89.54 91.73 91.89 93.13 93.35 0.028 6 0.128 3 0.076 8 0.068 7 0.149 5 0.138 9 0.133 1 0.192 3 0.203 9 0.255 0 0.266 1 0.281 7 0.243 5 0.277 4 0.260 3 0.282 6 0.351 2 0.361 3 0.339 9 0.353 7 0.409 0 0.423 8 0.384 0 0.406 0 0.410 7 0.496 3 0.498 5 0.481 6 0.534 7 0.519 9 0.554 6 0.630 0 0.639 7 0.699 5 0.721 6 0.746 7 0.763 2 0.766 9 0.690 1 0.905 6 0.884 4 0.973 2 0.945 3
续表
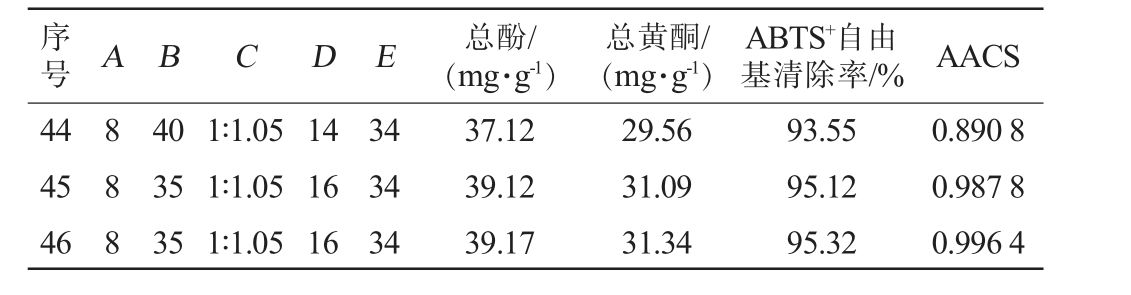
序号 A B C D E 总酚/(mg·g-1)总黄酮/(mg·g-1)ABTS+自由基清除率/% AACS 44 45 46 888 40 35 35 1∶1.05 1∶1.05 1∶1.05 14 16 16 34 34 34 37.12 39.12 39.17 29.56 31.09 31.34 93.55 95.12 95.32 0.890 8 0.987 8 0.996 4
表3 回归模型方差分析
Table 3 Variance analysis of regression models
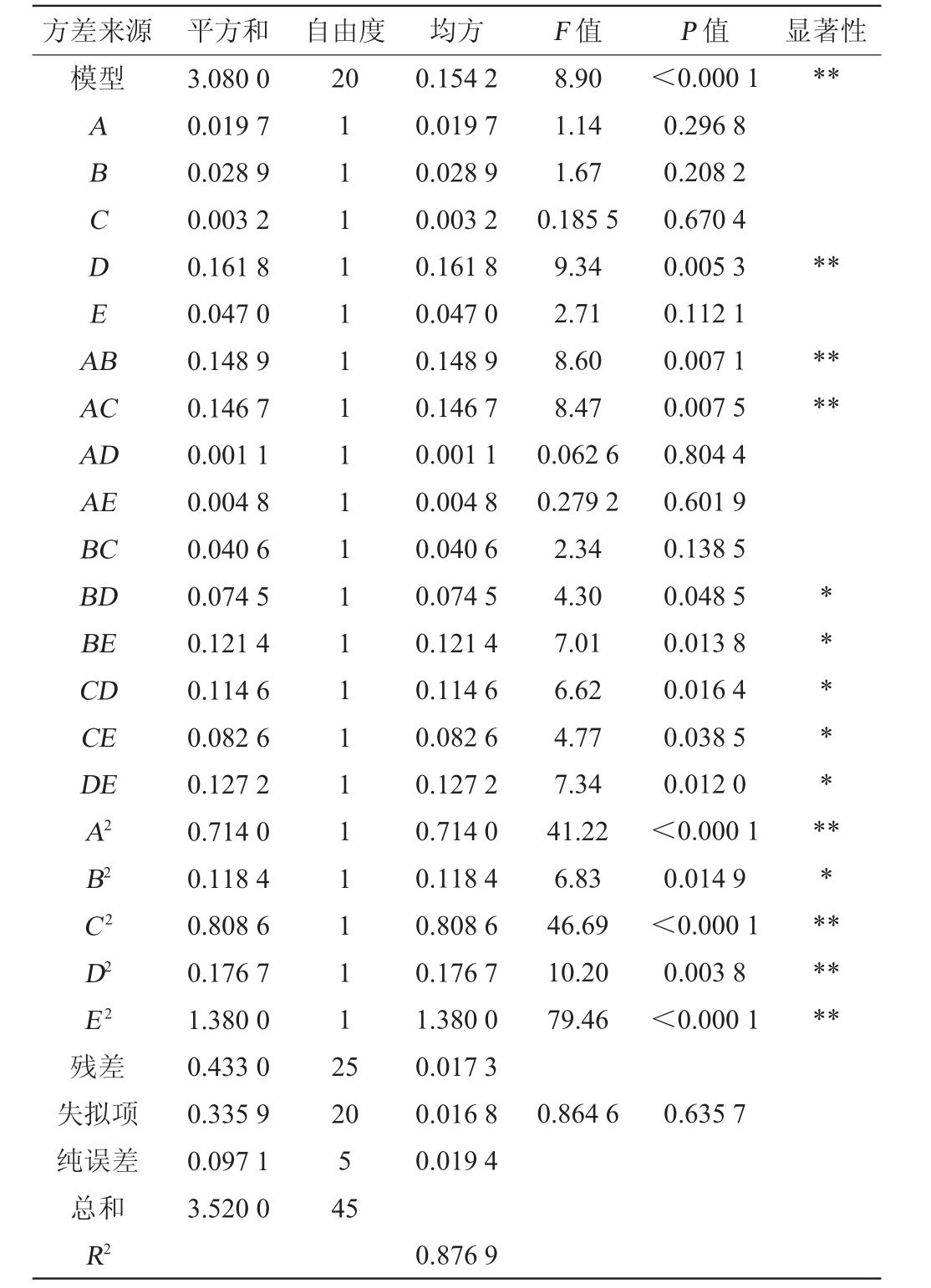
注:“**”表示影响极显著(P<0.01);“*”表示影响显著(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型**20 ABCDEA B**AC AD AE BC BD BE CD CE DE A2 B2 C2 D2 E2 8.90 1.14 1.67 0.185 5 9.34 2.71 8.60 8.47 0.062 6 0.279 2 2.34 4.30 7.01 6.62 4.77 7.34 41.22 6.83 46.69 10.20 79.46<0.000 1 0.296 8 0.208 2 0.670 4 0.005 3 0.112 1 0.007 1 0.007 5 0.804 4 0.601 9 0.138 5 0.048 5 0.013 8 0.016 4 0.038 5 0.012 0<0.000 1 0.014 9<0.000 1 0.003 8<0.000 1******************残差失拟项纯误差总和R2 3.080 0 0.019 7 0.028 9 0.003 2 0.161 8 0.047 0 0.148 9 0.146 7 0.001 1 0.004 8 0.040 6 0.074 5 0.121 4 0.114 6 0.082 6 0.127 2 0.714 0 0.118 4 0.808 6 0.176 7 1.380 0 0.433 0 0.335 9 0.097 1 3.520 0 111111111111111111112 5 20 5 45 0.154 2 0.019 7 0.028 9 0.003 2 0.161 8 0.047 0 0.148 9 0.146 7 0.001 1 0.004 8 0.040 6 0.074 5 0.121 4 0.114 6 0.082 6 0.127 2 0.714 0 0.118 4 0.808 6 0.176 7 1.380 0 0.017 3 0.016 8 0.019 4 0.864 6 0.635 7 0.876 9
由表3回归模型方差分析可以看出,所建立的二次回归模型具有高度统计学意义(F=8.90,P<0.000 1),模型整体解释力达87.69%(R2=0.876 9),且失拟项不显著(P=0.635 7),证实模型能充分捕捉因素与响应值间的复杂关系。二次项A2、C2、D2和E2对结果影响达到极显著水平(P<0.01),B2对结果影响显著(P<0.05),这明确揭示了响应曲面存在强烈的弯曲特征,表示各因素均存在最优水平区间。 在交互作用方面,七组两因子交互效应显著凸显:AB和AC交互作用极显著(P<0.01);BD、BE、CD、CE及DE交互作用显著(P<0.05),表明多因素间存在复杂的耦合机制。一次项中,乳清蛋白添加量(D)对结果影响极显著(P<0.01)。 各因素对AACS的影响强弱排序为E>C>A>D>B。 经多元回归分析并拟合回归方程如下:
AACS=0.906 4-0.035 1A-0.042 5B-0.014 2C-0.100 6D-0.054 2E-0.192 9AB-0.191 5AC-0.016 5AD+0.034 8AE+0.100 7BC-0.136 5BD-0.174 2BE+0.169 3CD-0.143 7CE+0.1783DE-0.2860A2-0.1165B2-0.3044C2-0.1423D2-0.3971E2。
2.5.2 响应面各因素交互作用结果与分析
等高线的形态可以揭示交互效应的程度,为更加直观的了解各个因素在交互情况下对指标的作用影响,基于回归方差分析数据得到各因素交互作用对响应值影响的响应面和等高线图,结果见图8。 由图8可知,接种量(A)和发酵时间(B)的交互作用、发酵时间(B)和乳清蛋白添加量(D)的交互作用响应曲面坡度较陡,等高线接近椭圆,对AACS影响显著。 发酵时间(B)和发酵温度(E)的交互作用、料水比(C)和乳清蛋白添加量(D)的交互作用、料水比(C)和发酵温度(E)的交互作用、乳清蛋白添加量(D)和发酵温度(E)的交互作用响应曲面坡度较陡,等高线接近椭圆,对AACS影响显著。这与方差分析结果一致。

图8 各因素交互作用对综合评分影响的响应面和等高线
Fig.8 Response surface plots and contour line of effects of interaction between various factors on comprehensive score
2.5.3 验证试验
采用Design-Expert 13对回归方程进行最优求解得出最优发酵方案:接种量7.022%,发酵时间39.997 h,乳清蛋白添加量14.019%,料水比1∶1.086(g∶mL),发酵温度32.313 ℃,在此条件下预测的AACS为0.997。结合试验操作的实际情况,最终确定最佳发酵条件为料水比1∶1.1(g∶mL),乳清蛋白添加量14%,菌液接种量7%,发酵时间40 h,发酵温度32 ℃,在此条件下进行3次试验,此时所测的总酚含量为(39.17±0.12)mg/g,总黄酮含量为(31.34±0.27)mg/g,ABTS+自由基清除率为(95.32±0.89)%,由均值计算的AACS为0.996。与ZHAO Y等[36]优化真菌发酵葡萄籽粕相比,本研究获得的枸杞皮渣发酵产物总酚含量具有明显优势,这也凸显了植物乳植杆菌NXU-Q6固态发酵在释放枸杞皮渣结合态酚类物质方面的有效性。ŠELO G等[37]研究真菌发酵葡萄渣ABTS+清除率最高约为81.68%,本研究枸杞皮渣发酵后的ABTS+清除率高达95.32%,充分证明了优化工艺下发酵枸杞皮渣具有很强的抗氧化潜力。
3 结论
本研究通过筛选11株乳酸菌对枸杞皮渣进行固态发酵,其中植物乳植杆菌NXU-Q6能有效促进皮渣中纤维素降解、增加总酸和可溶性蛋白含量,并大幅提升总酚、总黄酮含量及ABTS+自由基清除能力,显著增强了枸杞皮渣的抗氧化活性,显著改善皮渣理化特性并提升其生物活性价值。 对该菌株的发酵条件进行优化,采用响应面法确定的最佳发酵条件为菌液接种量7%,发酵时间40 h,料水比为1∶1.08(g∶mL),乳清蛋白添加量14%,发酵温度为32 ℃。本研究结果为枸杞加工副产物,即枸杞皮渣的资源化、高值化利用提供了有效的生物转化策略和科学依据,对促进枸杞深加工产业的绿色可持续发展具有积极意义。
[1]李勇,潘泰安,徐桂花.枸杞皮渣的综合利用[J].中国酿造,2013,32(11):129-131.
[2]余昆,李勇,陈玲,等.响应面分析法优化枸杞皮渣中色素的超声波辅助提取工艺[J].食品工业科技,2013,34(2):299-302.
[3]王晓璇,牛黎莉,张盛贵.响应面法优化枸杞皮渣中类胡萝卜素提取工艺[J].食品工业科技,2013,34(4):232-235,238.
[4]李冠杰,苗侨伟,王晓丽,等.枸杞渣的营养成分及在畜禽饲料中的应用[J].广东饲料,2023,32(7):38-40.
[5]刘宁,任歌,陈雪峰,等.枸杞皮渣的超微粉碎及其在面包中的应用[J].农产品加工,2021(6):11-13,19.
[6]王兆燃,李文钊,冯艺飞,等.粒度对小米粉特性和小米枸杞渣蛋糕品质的影响[J].食品工业科技,2019,40(13):40-45,51.
[7]ABU YAZID N,BARRENA R,KOMILIS D,et al.Solid-state fermentation as a novel paradigm for organic waste valorization: A review[J].Sustainability,2017,9(2):224.
[8]FILANNINO P,DI CAGNO R,GOBBETTI M.Metabolic and functional paths of lactic acid bacteria in plant foods: Get out of the labyrinth[J].Curr Opin Biotechnol,2018,49:64-72.
[9]吴寒,芮昕,李春阳,等.多菌种固态发酵法提高燕麦全谷物的蛋白质营养品质[J].食品科学,2018,39(16):168-175.
[10]ANOKHINA E,OBRAZTSOVA S,TOLKACHEVA A,et al.Development of a lactic bacteria starter for amaranth silage and investigation of its influence on silage quality[J].Agriculture,2023,13(8):1534.
[11]NACCHIO B L, AVILA HAEL N, MEDINA R B, et al.Aroma compounds and consumer acceptability of soybean paste fermented by lactobacilli[J].J Food Sci Technol,2022,59(5):1948-1957.
[12]SEVINDIK O A, GUCLU G, AGIRMAN B, et al.Impacts of selected lactic acid bacteria strains on the aroma and bioactive compositions of fermented gilaburu (Viburnum opulus) juices[J].Food Chem, 2022,378:132079.
[13]肖旸,薄斯洋,任安琪,等.发酵枸杞汁复配乳酸菌的筛选及工艺优化[J].中国食品学报,2025,25(5):242-250.
[14]田欢,房丹丹,张剑林,等.枸杞红枣复合发酵饮料工艺优化及抗氧化活性研究[J].中国酿造,2025,44(7):180-188.
[15]CHEN F,HUANG G.Antioxidant activity of polysaccharides from different sources of ginseng[J].Int J Biol Macromol,2019,125:906-908.
[16]焦贺,孟敌,韩颖,等.微酸性电解水对采后香葱抑菌特性及贮藏品质的影响[J].食品科学,2024,45(9):197-203.
[17]TARRÉS Q, EHMAN N V, VALLEJOS M E, et al.Lignocellulosic nanofibers from triticale straw: The influence of hemicelluloses and lignin in their production and properties[J].Carbohydr Polym, 2017,163:20-27.
[18]陆健,樊伟,孔维宝,等.大麦总多酚不同溶剂提取物对DPPH自由基清除能力的影响[J].食品与生物技术学报,2008,27(1):57-61.
[19]田建华.产地及采集时间对沙棘叶多酚和总黄酮含量的影响[J].山西林业科技,2023,52(2):18-21.
[20]王高峰.葛根多糖提取工艺及抗腹泻小鼠活性研究[J].中国食品工业,2023(12):95-99.
[21]张山佳,商银行.蓝莓不同部位活性成分及抗氧化能力比较分析[J].中国调味品,2024,49(1):141-145.
[22]邢慧珍,张玉梅,刘会平,等.淡竹叶多糖的制备、热稳定性及其抗氧化活性[J].食品研究与开发,2023,44(19):86-96.
[23]黄宁馨,丁士勇,刘睿,等.主成分分析法优选枸杞乳酸菌发酵饮品发酵剂[J].农业工程学报,2021,37(7):286-292.
[24]刘梦培,铁珊珊,王璐,等.发酵条件对杜仲茶组分及抗氧化性的影响[J].食品科技,2018,43(2):105-108.
[25]WANG X,HU K,CHEN Y,et al.Effect of Lactiplantibacillus plantarum fermentation on the physicochemical, antioxidant activity and immunomodulatory ability of polysaccharides from Lvjian Okra[J].Int J Biol Macromol,2024,257:128649.
[26]马晓娟,谢有发,余银芳,等.发酵枸杞原浆中多糖、活菌数的变化规律[J].食品安全导刊,2019(28):62-65.
[27]KWAW E,MA Y K,TCHABO W,et al.Effect of lactobacillus strains on phenolic profile,color attributes and antioxidant activities of lactic-acidfermented mulberry juice[J].Food Chem,2018,250:148-154.
[28]MONTIJO-PRIETO S D,RAZOLA-DÍAZ M D C,BARBIERI F,et al.Impact of lactic acid bacteria fermentation on phenolic compounds and antioxidant activity of avocado leaf extracts[J].Antioxidants,2023,12(2):298.
[29]HUANG Z,ZHAO M,CUI C,et al.A new sight on soy isoflavones during the whole soy sauce fermentation process by UPLC-MS/MS[J].LWT-Food Sci Technol,2021,152:112249.
[30]DUAN W, ZHOU L, REN Y, et al.Lactic acid fermentation of goji berries(Lycium barbarum)prevents acute alcohol liver injury and modulates gut microbiota and metabolites in mice[J].Food Funct,2024,15(3):1612-1626.
[31]ZHANG J,XIA N,TENG J.Effect of lactic acid bacteria fermentation on extractable and non-extractable polyphenols of soybean milk:Influence of β-glucosidase and Okara[J].Food Biosci,2023,56:103326.
[32]MASHITOA F M, MANHIVI V E, AKINOLA S A, et al.Changes in phenolics and antioxidant capacity during fermentation and simulated in vitro digestion of mango puree fermented with different lactic acid bacteria[J].J Food Process Pres,2021,45(11):e15937.
[33]LIZARDI-JIMÉNEZ M A, HERNÁNDEZ-MARTÍNEZ R.Solid state fermentation(SSF):Diversity of applications to valorize waste and biomass[J].3 Biotech,2017,7(1):44.
[34]杨雄州,姚国强,于洁,等.工业微生物在渗透胁迫下的应激反应及保护措施[J].微生物学报,2022,62(11):4176-4187.
[35]LARNO L, REICHWAGE M, PONANGI R, et al.Effects of cap and overall fermentation temperature on phenolic extraction in Cabernet Sauvignon fermentations[J].Am J Enol Viticult,2015,66(4):444-453.
[36]ZHAO Y,LIU D,ZHANG J,et al.Improving soluble phenolic profile and antioxidant activity of grape pomace seeds through fungal solid-state fermentation[J].Foods,2024,13(8):1158.
[37]ŠELO G, PLANINIC′ M, TIŠMA M, et al.Effects of fungal solid-state fermentation on the profile of phenolic compounds and on the nutritional properties of grape pomace[J].Microorganisms,2024,12(7):1310.