枳椇子(Hovenia dulcis Thunb)是鼠李科传统药食同源材料,具有抗菌[1]、抗氧化[2]和治疗糖尿病的功能[3],尤其对治疗酒精中毒效果明显[4-5];古代名方中“葛花-枳椇子”是常见解酒药,长期服用可缓解酒精性肝损伤症状[6]。现代医学研究表明,黄酮作为枳椇子主要生物活性成分[7],包含的二氢杨梅素、槲皮素、山奈酚和芹菜素等组分均对酒精性肝病有良好效果[8-9];不同剂量的枳椇子黄酮均能显著降低酒精引起的炎症反应,可对抗肝纤维化的形成[10]。因此,枳椇子黄酮已被认为是治疗酒精相关性肝病的潜在药物[11-12]。
枳椇子黄酮现有主要生产方法是乙醇萃取,但是溶剂用量大,生产效率低,面临绿色清洁生产要求的挑战。 因此,新型高效绿色生产方法受到关注。QU Y等[13]利用蒸汽预处理,结合微波辅助乙醇提取,枳椇子黄酮的得率提升了11.63%。ZHANG X等[14]利用超声波辅助提取枳椇子中杨梅素和二氢杨梅素,得率分别达到了0.53 mg/g和4.06 mg/g,较对照分别提升了39.47%和53.21%。但是,微波和超声波辅助提取的工业化生产均面临装备投入大、运行成本高的问题。近年来,黄酮的生物辅助提取方法得到快速发展;BOATENG I D等[15]利用枯草芽孢杆菌(Bacillus subtilis)发酵银杏黑茶,总黄酮含量提升14.64%;JU X等[16]研究表明,根霉发酵可以将金花葵总黄酮提取率从2.65%提升至3.69%;PINTO J T等[17]用酿酒酵母(Saccharomyces cerevisiae)发酵制备枳椇子饮料,酚类化合物含量及其抗氧化活性均有显著提高。生物辅助法黄酮提取易于放大,操作简便,过程相对温和,对环境影响较小,有利于实现清洁生产;另一方面,利用生物方法处理后提取的黄酮具有更高的生物学活性[18-19]。因此,生物辅助方法在黄酮提取方面展现了良好的应用前景。
本研究利用米根霉(Rhizopus oryzae)1006发酵对枳椇子(Hovenia dulcis),通过单因素及响应面试验优化其发酵工艺,探究枳椇子黄酮对酿酒酵母的抗逆性能及黄酒抗氧化性,并采用超高效液相色谱-四级杆-飞行时间-质谱(ultra performance liquid chromatography-quadrupole-time of flightmass spectrometry,UPLC-QTOF-MS)对发酵前后枳椇子黄酮进行非靶向组学分析。旨在探究米根霉辅助提取对枳椇子黄酮生物活性的增效作用及其机理,对其生物活性的提升提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
枳椇子:河北省凯捷中药有限公司;将枳椇子清洗干净,干燥后研磨成粉,过40目筛备用。
米根霉(Rhizopus oryzae)1006:嘉兴大学发酵食品开发与分析检测实验室筛选保藏。
1.1.2 化学试剂
无水乙醇、葡萄糖(均为分析纯):浙江一诺生物科技有限公司;芦丁(纯度>98%)、维生素C、硝酸铝九水合物、六水合三氯化铁、三氯乙酸、磷酸氢二钠和磷酸二氢钠(均为色谱纯):麦克林生化科技股份(上海)有限公司;亚硝酸钠(色谱纯):新纯化学试剂(上海)有限公司;乙腈、生物胺标品、丹磺酰氯、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazylradical,DPPH)、1,7-二氨基庚烷、碳酸氢钠、盐酸、乙酸乙酯、丙酮、甲醇(均为色谱纯):上海阿拉丁生化科技股份有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:去皮马铃薯200 g,蔗糖20 g,蒸馏水1 000 mL,pH自然,琼脂20 g,121 ℃高压蒸汽灭菌20 min。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:葡萄糖20 g,蛋白胨20 g,酵母浸粉10 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min,冷却备用。
1.2 仪器与设备
LDZH-150KBS高压蒸汽灭菌锅:上海申安医疗器械厂;UV-1100紫外分光光度计:上海美谱达仪器有限公司;CT14RD11台式离心机:上海天美生化仪器设备有限公司;LRH-150恒温培养箱:上海沙鹰科学仪器有限公司;DGG-9150G鼓风干燥箱:上海森信实验仪器有限公司;QE-300高速粉碎机:浙江屹立工贸有限公司;ACQUITY HPLCTM I-Class、XevoG3XSQTOF超高液相色谱-四级杆-飞行时间-质谱(UPLC-QTOF-MS)联用仪:沃特世科技(上海)有限公司。
1.3 方法
1.3.1 米根霉孢子悬液制备
将米根霉1006接入装有PDA培养基的培养皿中,28 ℃恒温培养3 d。将培养基表面的米根霉孢子洗入无菌水中,稀释至108个/mL,制成孢子悬液,现制现用。
1.3.2 枳椇子发酵工艺流程及操作要点
枳椇子→洗净、烘干→研磨,过40目筛→加入适量米根霉孢子悬液、水、硫酸铵、葡萄糖→混合均匀,恒温发酵→将发酵基质全部取出,烘干→研磨成粉备用
将枳椇子洗净,60 ℃烘干24 h,研磨后过40目筛网,称取适量枳椇子粉末于发酵桶,加入0.9 mL/g无菌水、0.04 mL/g米根霉孢子悬液、0.04 g/g葡萄糖和0.002 g/g硫酸铵,混合均匀,于培养箱中30 ℃恒温发酵24 h后60 ℃烘干24 h、粉碎过40目筛网,制得发酵枳椇子粉末,备用。
1.3.3 发酵条件优化
(1)单因素试验
分别考察米根霉孢子悬液(0.02 mL/g、0.03 mL/g、0.04mL/g、0.05mL/g、0.06mL/g)、葡萄糖(0、0.02 g/g、0.04 g/g、0.06 g/g、0.08 g/g)、硫酸铵(0、0.001 g/g、0.002 g/g、0.003 g/g、0.004 g/g)添加量、液固比(0.7∶1、0.8∶1、0.9∶1、1.0∶1、1.1∶1)(mL∶g)、发酵温度(26 ℃、28 ℃、30 ℃、32 ℃、34 ℃)和发酵时间(8 h、16 h、24 h、32 h、40 h)对枳椇子发酵的影响。每个因素进行3次平行试验,取平均值。
(2)Plackett-Burman试验
在单因素试验的基础上,以黄酮得率为响应值,进行6因素2水平Plackett-Burman试验设计,试验因素与水平见表1。
表1 发酵条件优化Plackett-Burman试验因素与水平
Table 1 Factors and levels of Plackett-Burman experiments for flavonoids extraction conditions optimization
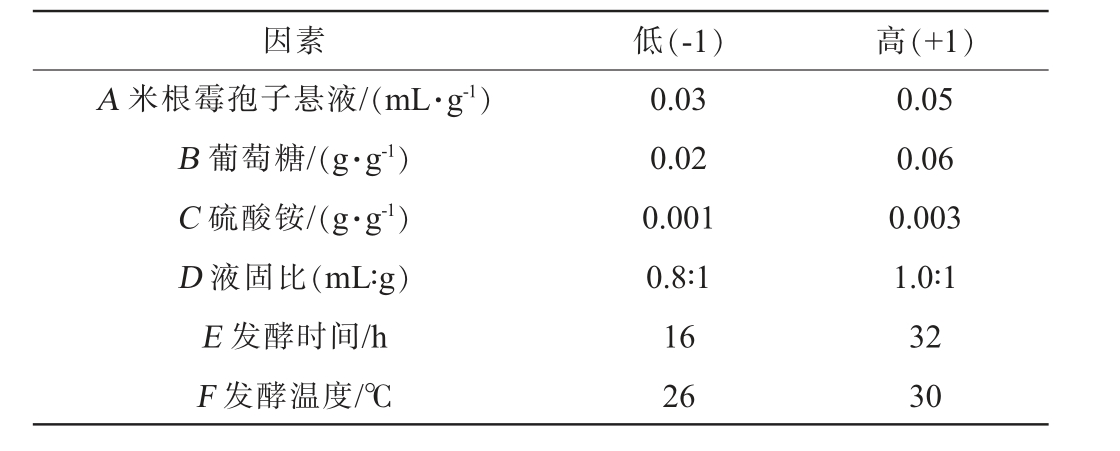
因素 低(-1) 高(+1)A 米根霉孢子悬液/(mL·g-1)B 葡萄糖/(g·g-1)C 硫酸铵/(g·g-1)D 液固比(mL∶g)E 发酵时间/h F 发酵温度/℃0.03 0.02 0.001 0.8∶1 16 26 0.05 0.06 0.003 1.0∶1 32 30
(3)Box-Behnken响应面试验
根据Plackett-Burman试验结果开展中心组合试验设计,以黄酮得率(Y)为响应值进行响应面分析。Box-Behnken响应面试验因素与水平见表2。
表2 黄酮提取条件优化Box-Behnken响应面试验因素与水平
Table 2 Factors and levels of Box-Behnken response surface experiments for flavonoids extraction conditions optimization

因素-1水平0 1发酵时间/h液固比(mL∶g)葡萄糖/(g·g-1)16 0.8∶1 0.2 24 0.9∶1 0.4 32 1.0∶1 0.6
1.3.4 枳椇子黄酮的提取和测定
根据文为等[20]的方法进行改进,称取干燥的枳椇子(或发酵枳椇子)6 g,加入体积分数70%的乙醇48 mL,80 ℃恒温回流提取1 h,收集提取液,5 000 r/min离心2 min,稀释2.5倍后得待测液。 取待测液1 mL于10 mL容量瓶中,然后加入亚硝酸钠溶液(5 g/100 mL)0.4 mL,摇匀;静置6 min后加入硝酸铝溶液(10 g/100 mL)0.4 mL,摇匀;静置6 min后加入氢氧化钠溶液(4 g/100 mL)4 mL,再用体积分数70%的乙醇溶液定容,摇匀后静置15 min,用紫外可见分光光度计在波长510 nm处检测吸光度值。根椐芦丁标准曲线回归方程(A=0.001 9C+0.029,R2=0.996 1)计算样品中黄酮含量(未发酵枳椇子提取的黄酮标记为HDT,发酵枳椇子提取的黄酮标记为FHDT)。
枳椇子黄酮的得率计算公式如下:
式中:C为提取液中黄酮的质量浓度,μg/mL;V为样品溶液的体积,mL;N为稀释倍数;M为样品质量,g;1 000为单位换算系数。
1.3.5 枳椇子黄酮对酿酒酵母抗逆性能的影响
乙醇对酿酒酵母存活率的影响:YPD培养基中分别添加0.001%HDT或FHDT,以不添加黄酮作为对照,接种酿酒酵母后于28 ℃、150 r/min恒温振荡培养24 h,分别置于含体积分数10%、15%、20%、25%、30%乙醇的体系中处理1 h,美蓝染色后显微镜下检测其活菌数,并计算存活率。
40 ℃培养对酿酒酵母存活率的影响:YPD培养基中分别添加0.001%HDT和FHDT,以不添加黄酮作为对照,接种酿酒酵母后在40 ℃条件下培养48 h,每6 h测定酿酒酵母的存活率。
1.3.6 枳椇子黄酮在黄酒酿造中的应用
黄酒的酿造主要包括浸米、蒸饭、淋水、加麦曲、补水、喂饭、后发酵、压榨过滤、煎酒和贮存等多个阶段。 具体工艺如下:淘洗粳米60 kg,浸泡1 d后蒸饭、淋水搭窝,1 d后翻缸,翻缸次日加入160 kg水、喂饭65 kg和14 kg麦曲进行发酵;12 h后开一次耙,品温控制在(33±4)℃;1 d后分坛,每坛分装20 kg进行后发酵;30 d后发酵结束,压榨过滤,7 d后煎酒和贮存。以上生产在浙江嘉善黄酒股份有限公司完成,并在黄酒酿造过程中的加麦曲阶段分别加入0.001%HDT或FHDT,陈酿270 d后测定黄酒的抗氧化性。
1.3.7 黄酒抗氧化性能的检测
DPPH自由基清除率的测定:参照AYELE D T等[21]的方法并加以改进。 取2.5 mL样品与1 mL DPPH(0.2 mmol/L)溶液混合,避光反应30 min,实验重复3次。DPPH自由基清除率按下式计算:
式中:Y为DPPH自由基清除率,%;A0为乙醇+DPPH溶液组吸光度值;Ai为样品+DPPH溶液组吸光度值;Aj为样品+乙醇组吸光度值。
ABTS自由基清除率的测定:参照ARNAO M B等[22]的方法进行改进。 加入不同浓度的黄酒溶液500 μL,再加入3 mL ABTS工作液,避光静置6 min。 黄酒对ABTS自由基清除率的计算公式如下:
式中:E为ABTS自由基清除率,%;A0为乙醇+ABTS溶液组吸光度值;A1为样品+ABTS溶液组吸光度值;A2为样品+乙醇组吸光度值。
总还原能力测定:参照RAZA A等[23]的方法进行改进。取2.5 mL用磷酸盐缓冲液(0.2 mol/L,pH 6.6)稀释成不同浓度的酒样,加入2.5 mL铁氰化钾(0.1 g/L),50 ℃水浴20 min,之后加入三氯乙酸(trichloroacetic acid,TCA)终止反应,并3 000 r/min离心10 min。 取上清液2.5 mL,再加入超纯水和三氯化铁,混匀后静置10 min,于波长700 nm处测量吸光度值(OD700nm值)。 同时,使用同等浓度的维生素C(vitamin C,VC)作为对照,空白组不加样品,实验重复3次。
1.3.8 枳椇子黄酮的UPLC-QTOF-MS分析
色谱条件:ACQUITY UPLCTM I-Class和XevoG3XS QTOF组合,Waters BEH T3 1.8 m毛细管色谱柱(2.1 mm×150 mm)。 流动相A:0.1%甲酸水,流动相B:乙腈;进样量:8 μL,柱温:30 ℃。
质谱条件:电离方式:电喷雾电离(electro-spray ionization,ESI)正、负离子模式采集。 采集模式:MSE模式,离子源温度120 ℃,毛细管电压3.0 kV,锥孔电压50 V,脱溶剂气流量800 L/h,脱溶剂气温度400 ℃。
1.3.9 数据处理
每个处理进行3次平行测定,利用Design-Expert 13.0和SPSS_29.0.2.0对数据进行统计分析。 P<0.05为差异显著,P>0.05为差异不显著,0.05≤P<0.10表示具有差异显著趋势。采用Origin 2021和MetaboAnalyst绘制图表。UPLC-QTOFMS分析数据处理软件为UNIFI 1.9.2。
2 结果与分析
2.1 枳椇子发酵条件优化
2.1.1 单因素试验
孢子悬液、葡萄糖、硫酸铵添加量、液固比、发酵温度、发酵时间对枳椇子黄酮得率的影响见图1。由图1A可知,当发酵时间为8~24 h时,黄酮得率随之增高;当发酵时间为24 h时,黄酮得率最高,为5.77 mg/g;当发酵时间为24~40 h时,黄酮得率下降。因此最适发酵时间为24 h。由图1B可知,当发酵温度为26~28 ℃时,黄酮得率随之增高;当发酵温度为28 ℃时,黄酮得率最高,为5.87 mg/g;当发酵时间为28~34 ℃时,黄酮得率下降。因此最适发酵温度为28 ℃。由图1C可知,当孢子悬液添加量为0.02~0.04 mL/g时,黄酮得率随之增高;当孢子悬液添加量为0.04 mL/g时,黄酮得率最高,为5.95 mg/g;当孢子悬液添加量为0.04~0.06 mL/g时,黄酮得率下降。因此最适孢子悬液为0.04 mL/g。由图1D可知,当葡萄糖添加量为0~0.02 g/g时,黄酮得率随之增高;当葡萄糖添加量为0.02 g/g时,黄酮得率最高,为5.37 mg/g;当葡萄糖添加量为0.02~0.08 g/g时,黄酮得率呈下降趋势。因此最适葡萄糖添加量为0.02 g/g。由图1E可知,当液固比为0.7∶1~0.9∶1(mL∶g)时,黄酮得率随之增高;当液固比为0.9∶1(mL∶g)时,黄酮得率最高,为5.92 mg/g;当液固比为0.9∶1~1.1∶1(mL∶g)时,黄酮得率随之降低。因此最适液固比为0.9 ∶1(mL∶g)。由图1F可知,当硫酸铵添加量为0~0.002 g/g时,黄酮得率随之增高;当硫酸铵添加量为0.002 g时,黄酮得率最高,为5.19 mg/g;当硫酸铵添加量为0.002~0.004 g/g时,黄酮得率下降,因此最适硫酸铵添加量为0.002 g/g。
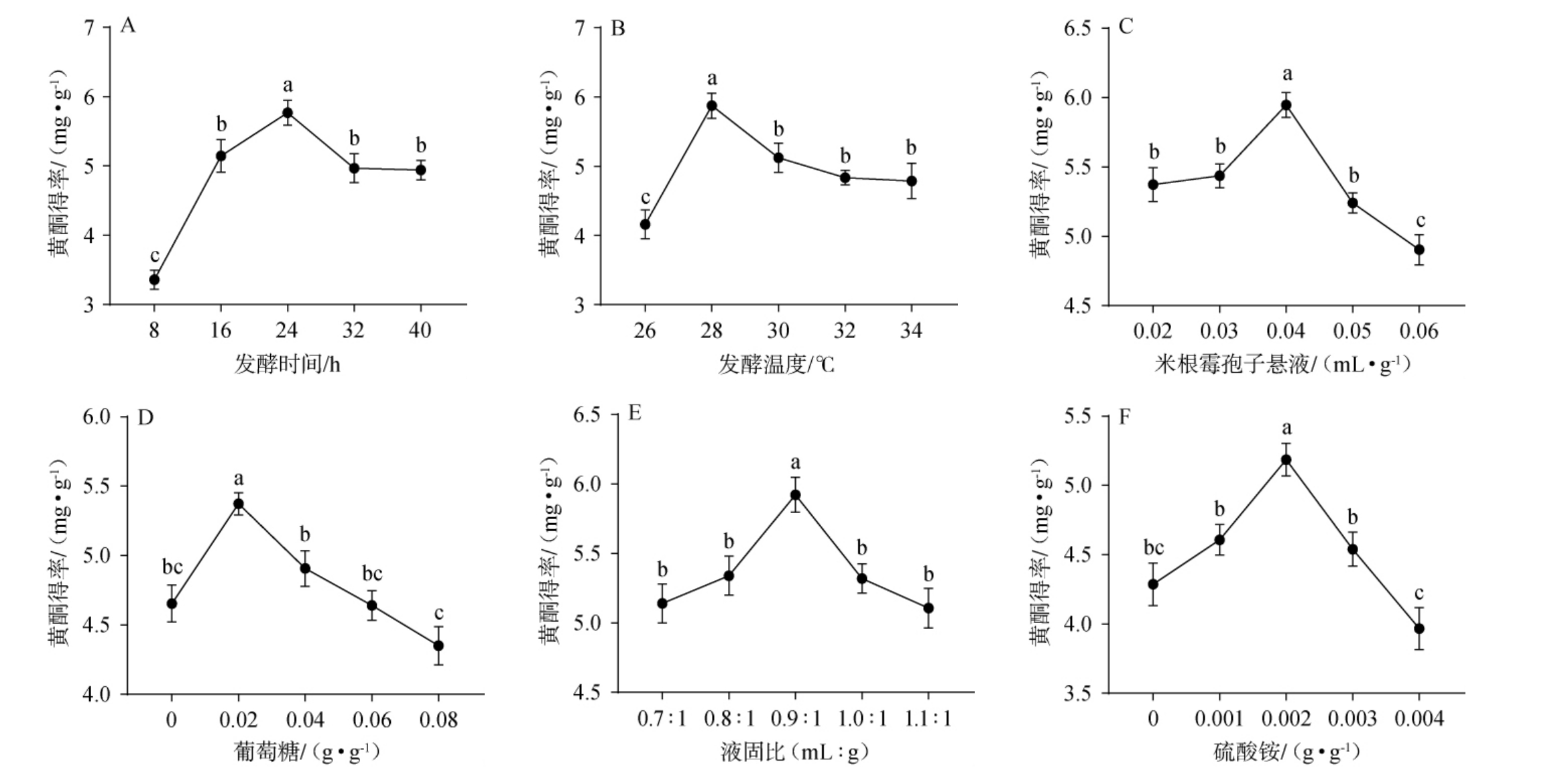
图1 不同因素对枳椇子黄酮得率的影响
Fig.1 Effect of different factors on the yield of flavonoids from Hovenia dulcis
不同小写字母表示差异显著(P<0.05)。
2.1.2 Plackett-Burman试验
为确定影响米根霉发酵枳椇子的主要影响因素及水平,利用Plackett-Burman试验对各单因素结果进一步研究,结果见表3。
表3 Plackett-Burman试验回归模型方差分析
Table 3 Variance analysis of regression model of Plackett-Burman experiments
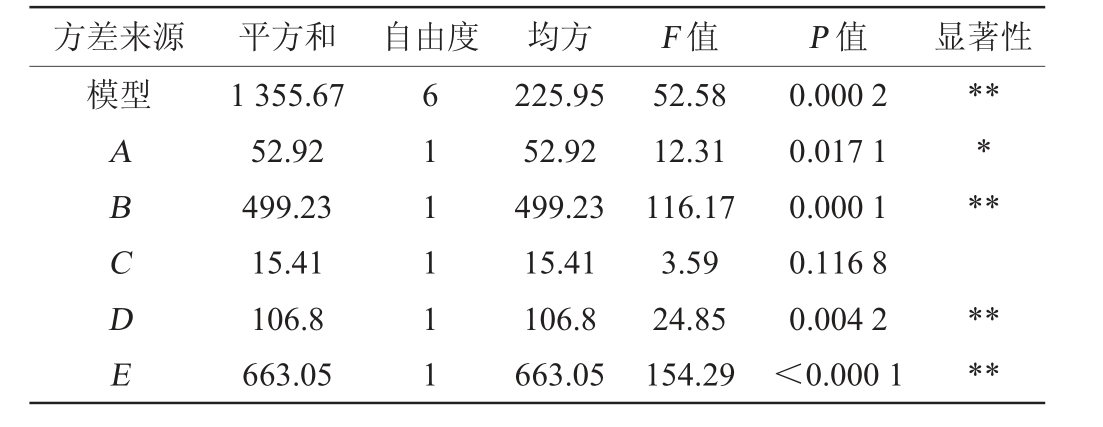
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCDE 1 355.67 52.92 499.23 15.41 106.8 663.05 611111 225.95 52.92 499.23 15.41 106.8 663.05 52.58 12.31 116.17 3.59 24.85 154.29 0.000 2 0.017 1 0.000 1 0.116 8 0.004 2<0.000 1*********
续表
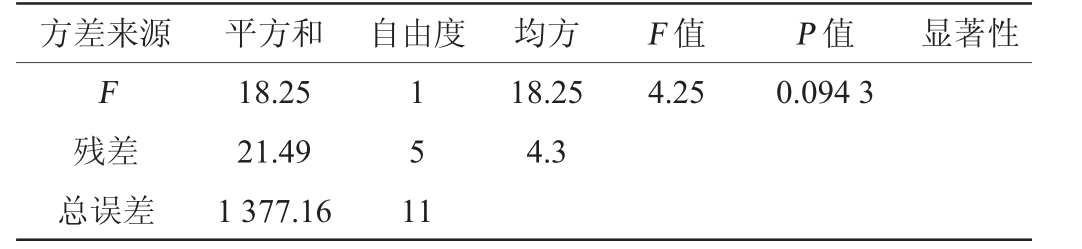
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。下同。
方差来源 平方和 自由度 均方 F 值 P 值 显著性F残差总误差18.25 21.49 1 377.16 1 5 1 1 18.25 4.3 4.25 0.094 3
由表3可知,发酵时间、葡萄糖添加量、液固比对黄酮得率有极显著影响(P<0.01),米根霉孢子悬液添加量对黄酮得率有显著影响(P<0.05),各因素影响的显著性为:发酵时间>葡萄糖添加量>液固比>孢子悬液添加量,因此选取发酵时间、葡萄糖添加量和液固比进行响应面试验。
2.1.3 Box-Behnken响应面试验
在Plackett-Burman试验的基础上,以发酵时间(A)、葡萄糖添加量(B)和液固比(C)为自变量,以黄酮得率(Y)为响应值,采用响应面法优化枳椇子黄酮发酵工艺,响应面试验设计及结果见表4。
表4 Box-Behnken响应面试验设计及结果
Table 4 Design and results of Box-Behnken response surface experiments
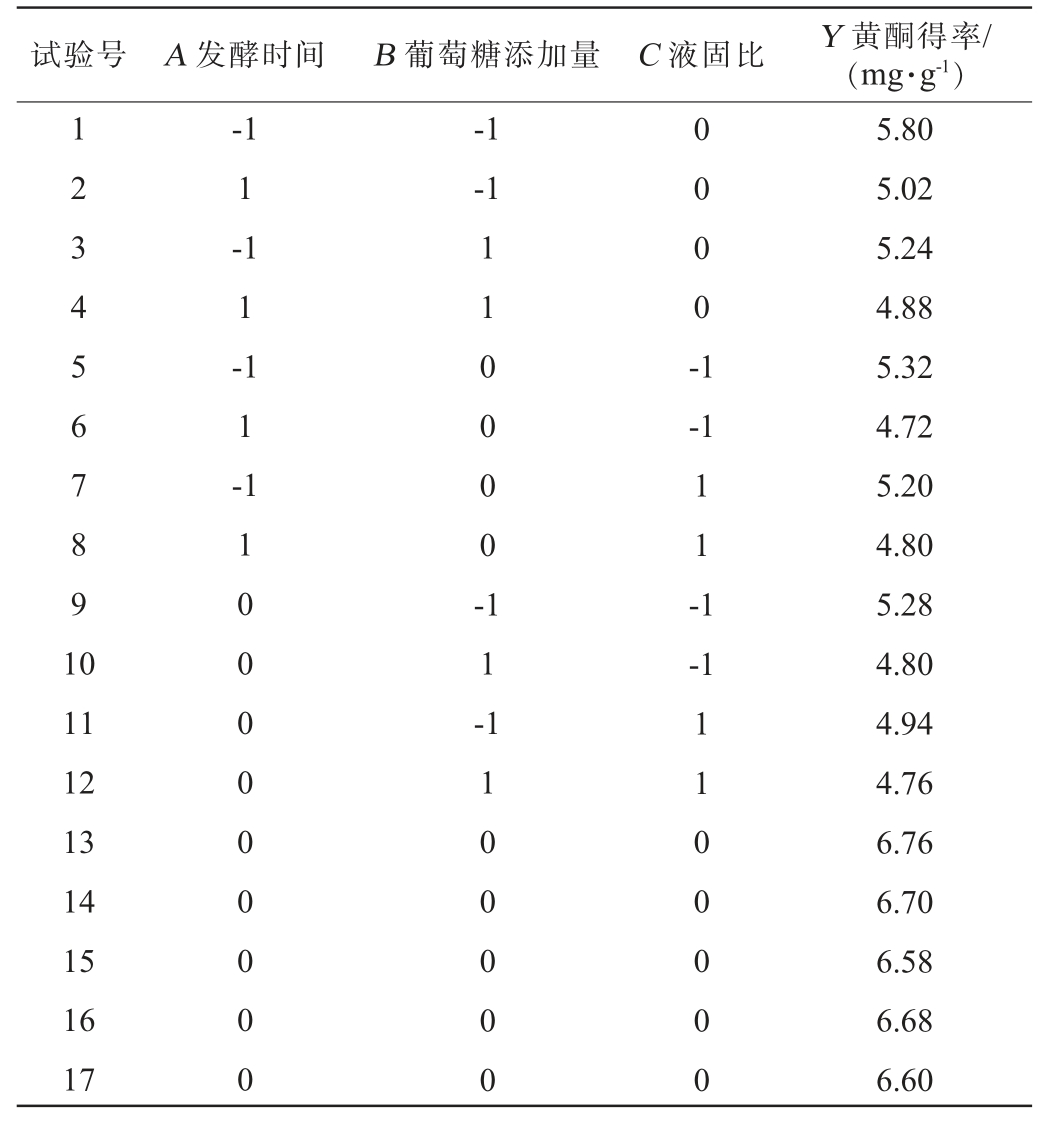
试验号 A 发酵时间 B 葡萄糖添加量 C 液固比 Y 黄酮得率/(mg·g-1)1 2 3 4 5 6 7 8 9 1 0-1 1-1 1-1 1-1-1-1 1 1 0 0 0 0 -0 0 0 0 -1-1 1 1 -1-1 11 12 13 14 15 16 17 1 0 0 0 0 0 0 0 0 0 1 1 -1 1 0 0 0 0 0 1 1 0 0 0 0 0 5.80 5.02 5.24 4.88 5.32 4.72 5.20 4.80 5.28 4.80 4.94 4.76 6.76 6.70 6.58 6.68 6.60
使用Design Expert 13.0软件对表4中黄酮得率数据进行回归分析,得出多元二次回归方程:Y=6.66-0.28A-0.16B-0.08C+0.11AB+0.08AC+0.05BC-0.67A2-0.74B2-0.95C2。
由表5可知,模型的P值<0.01,表示模型极显著,失拟项不显著(P>0.05),说明所得多项回归方程可以准确反映各因素对响应值的影响。模型中一次项A、B,二次项A2、B2、C2对结果影响极显著(P<0.01);一次项C,交互项AB对结果影响显著(P<0.05)。决定系数R2=0.991 6,表明99.16%的响应值均可由该模型解释。 因此,可用该回归方程代替试验真实点对试验结果进行分析。
表5 Box-Behnken试验回归模型方差分析
Table 5 Variance analysis of regression model of Box-Behnken experiments
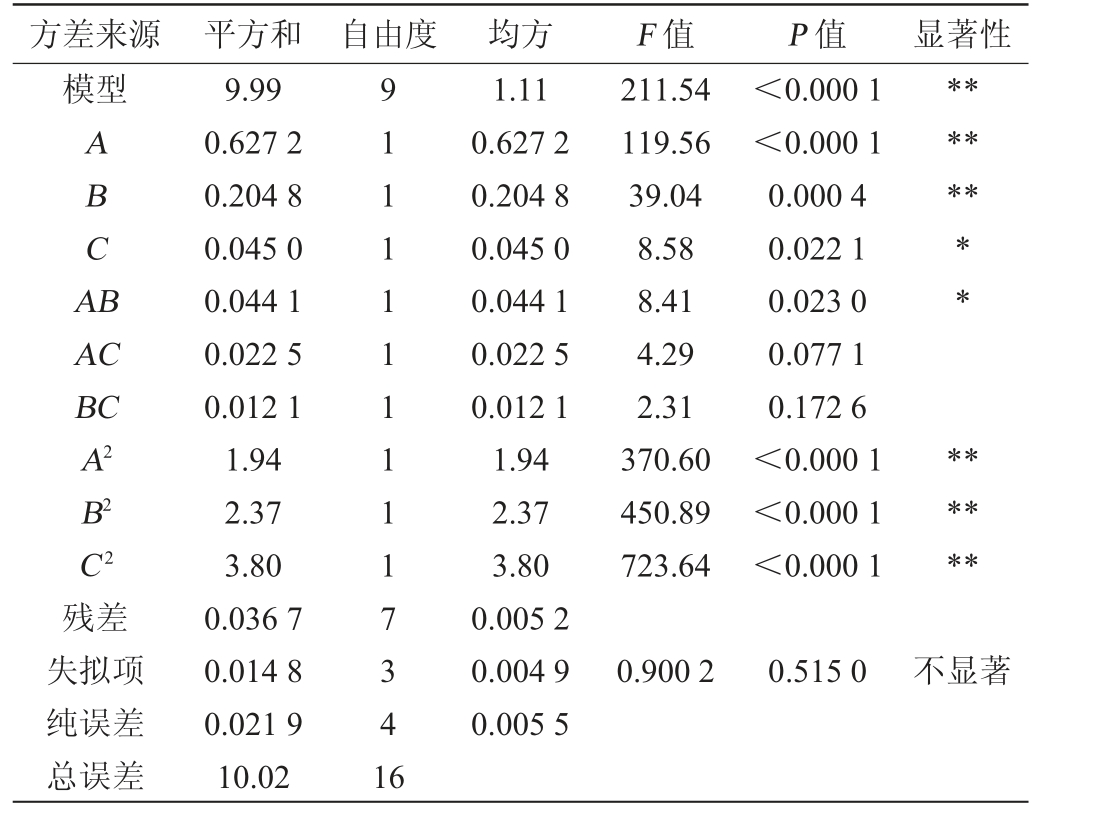
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B******AC BC A2 B2 C2残差失拟项纯误差总误差9.99 0.627 2 0.204 8 0.045 0 0.044 1 0.022 5 0.012 1 1.94 2.37 3.80 0.036 7 0.014 8 0.021 9 10.02 91111111117341 6 1.11 0.627 2 0.204 8 0.045 0 0.044 1 0.022 5 0.012 1 1.94 2.37 3.80 0.005 2 0.004 9 0.005 5 211.54 119.56 39.04 8.58 8.41 4.29 2.31 370.60 450.89 723.64<0.000 1<0.000 1 0.000 4 0.022 1 0.023 0 0.077 1 0.172 6<0.000 1<0.000 1<0.000 1** ******0.900 2 0.515 0不显著
通过二次多项式回归拟合分析,构建了各影响因素间交互作用对结果影响的响应曲面,结果见图2。由图2可知,发酵时间、葡萄糖与液固比两两之间的响应曲面在所选范围内存在极值。 葡萄糖和发酵时间的响应面扭曲最大,说明发酵时间和葡萄糖之间具有明显交互作用,且随发酵时间变化,黄酮得率变化明显。而发酵时间和液固比、葡萄糖和液固比交互作用并不显著,这与方差分析的结果一致。
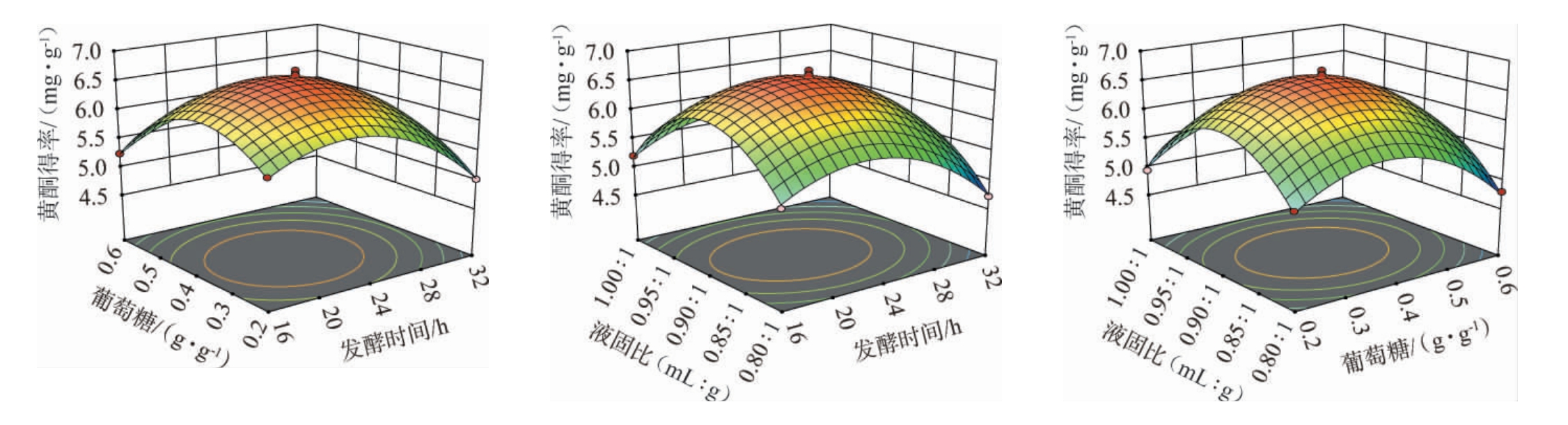
图2 各因素间交互作用对黄酮得率影响的响应曲面及等高线
Fig.2 Response surface plots and contour lines of the effect of the interaction between various factors on the yield of flavonoids
根据回归模型得到最优发酵条件理论值为发酵时间24.343h,葡萄糖添加量0.037398g/g,液固比0.8962∶1(mL∶g),在此条件下预测黄酮得率为6.66 mg/g。 为方便实际操作,修正发酵条件为:发酵时间24 h,葡萄糖0.04 g/g,液固比0.9∶1(mL∶g),在此条件下进行枳椇子发酵的验证试验,获得FHDT的黄酮得率实际值为6.44 mg/g,与预测值相差不大。结果表明,利用米根霉1006对枳椇子进行发酵,实现生物辅助处理,达到了显著提升枳椇子黄酮得率的目的。
2.2 枳椇子黄酮对酿酒酵母抗逆性能的影响
在酒精发酵过程中,乙醇浓度的升高会对酿酒酵母形成胁迫,限制其生长和代谢效率。由图3a可知,与空白对照组相比,添加HDT和FHDT不同程度地提高了酿酒酵母的乙醇耐受性,且FHDT作用更明显。在乙醇体积分数为20%时,添加FHDT的酿酒酵母存活率为61.63%,而空白对照组为52.13%。
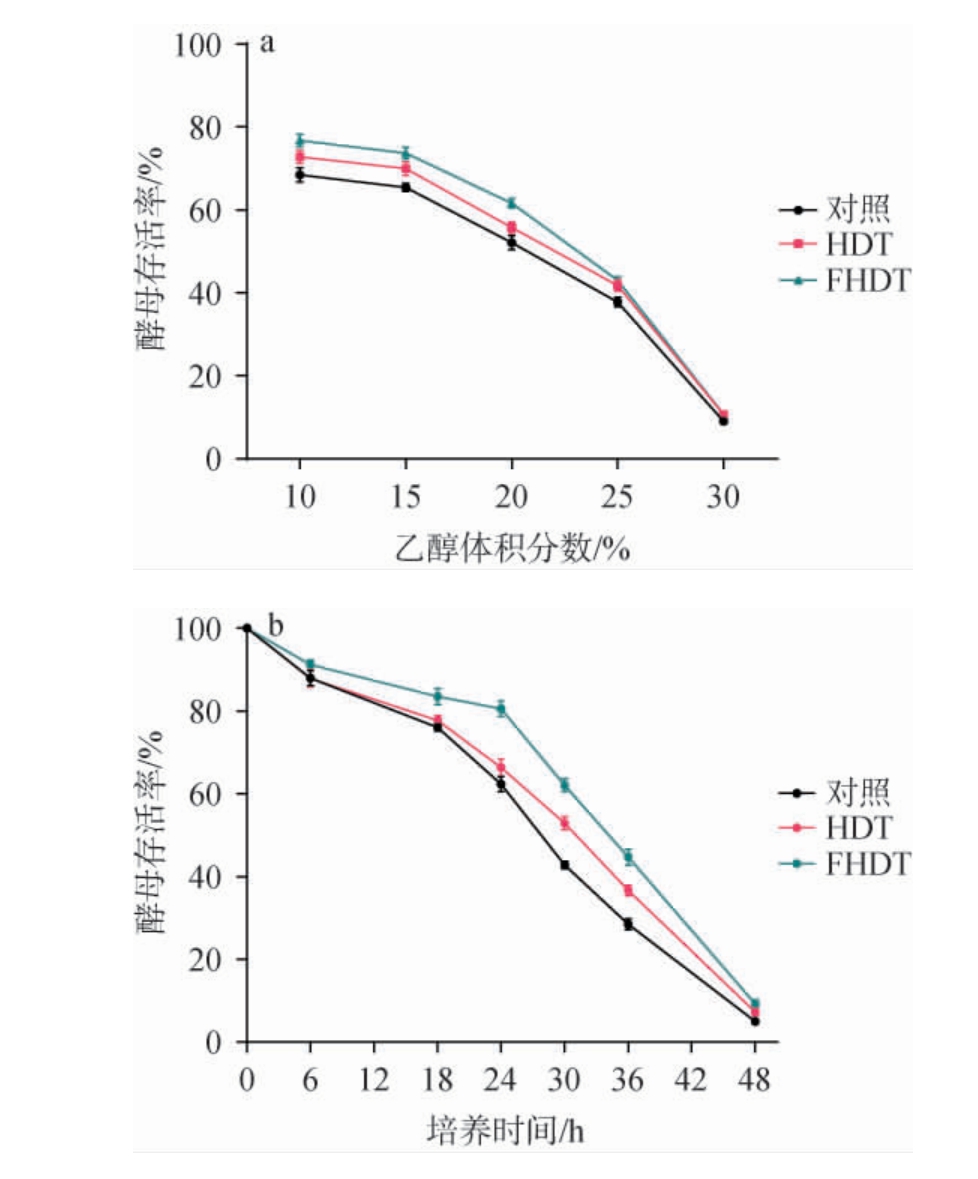
图3 枳椇子黄酮对酿酒酵母抗逆性能的影响
Fig.3 Effect of flavonoids from Hovenia dulcis on the stress resistance of Saccharomyces cerevisiae
a:乙醇体积分数对酿酒酵母存活率的影响;
b:40 ℃条件下处理不同时间对酿酒酵母存活率的影响。
高温环境对酵母生长和代谢构成挑战,降温导致成本升高,限制了酿酒酵母的工业应用。 通过研究枳椇子黄酮对酿酒酵母耐高温性能的影响,为酿酒酵母在高温条件下的发酵开辟一条新的途径。 由图3b可知,与空白对照组相比,添加HDT和FHDT不同程度地提高了酿酒酵母的温度耐受性,且FHDT作用更明显。 在40 ℃条件下培养24 h时,添加FHDT的酿酒酵母与对照相比存活率提高18.18%。
2.3 枳椇子黄酮对黄酒抗氧化性能的影响
枳椇子具有良好的保肝解酒作用,比较添加发酵前后枳椇子黄酮对黄酒抗氧化性能的影响,结果见图4。由图4可知,添加HDT和FHDT的黄酒均表现出对DPPH、ABTS自由基的显著清除和对Fe3+良好的还原能力。当添加量为8μg/mL时,含FHDT黄酒的DPPH、ABTS自由基清除率为96.77%、95.12%,含HDT黄酒的DPPH、ABTS自由基清除率为93.98%、93.29%,且对DPPH和ABTS自由基清除能力与VC接近。添加量为8 μg/mL时,对Fe3+还原力测定中,含FHDT黄酒的吸光度值为0.506,含HDT黄酒的吸光度值为0.454。

图4 添加枳椇子黄酮黄酒的体外抗氧化性能
Fig.4 In vitro antioxidant properties of Huangjiu added with flavonoids from Hovenia dulcis
2.4 发酵前后枳椇子黄酮的非靶向组分分析
为探究米根霉发酵对枳椇子黄酮生物活性影响的机理,利用UPLC-QTOF-MS对发酵前后枳椇子黄酮进行非靶向组学分析。 数据采集后,利用主成分分析(principal component analysis,PCA)确定独立性特征并去除数据中干扰,共检出148种类黄酮代谢物。 两组主成分分析模型的二维散点图见图5。由图5可知,各组内的重复性好于组间,表明发酵前后枳椇子黄酮组分之间存在显著差异。
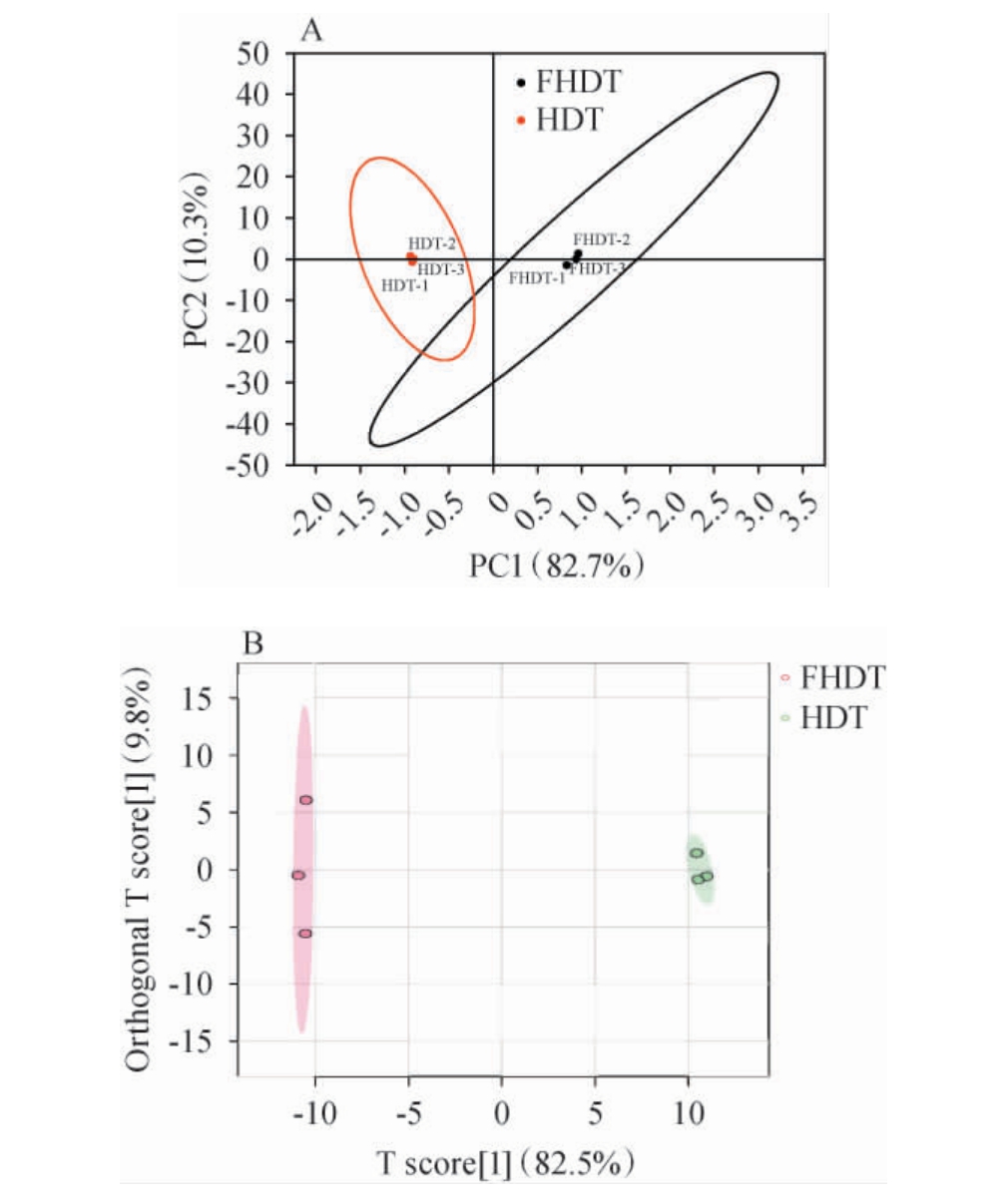
图5 发酵前后枳椇子黄酮主成分分析得分散点图(A)和正交偏最小二乘法判别分析(B)
Fig.5 Scatter plot of principal component analysis (A) and orthogonal partial least squares discriminant analysis (B) of flavonoids from Hovenia dulcis before and after fermentation
通过结合正交偏最小二乘法判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA)模型的差异倍数(fold change,FC)和变量投影重要性(variable importance in projection,VIP)值筛选差异黄酮类物质,结果见图6。 筛选的标准包括FC≥2或≤0.5且VIP值≥1。
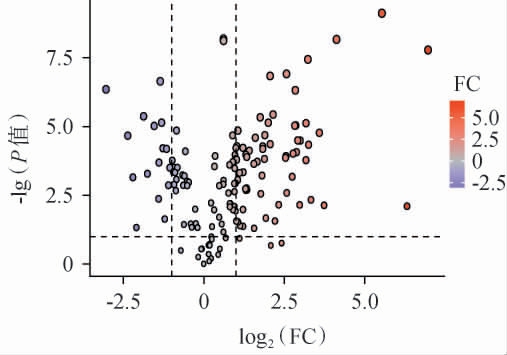
图6 发酵前后枳椇子黄酮差异代谢物火山图
Fig.6 Volcano map of differential metabolites of flavonoids from Hovenia dulcis before and after fermentation
由图6可知,灰色点代表检测到的但无显著差异的物质,而紫色和橙色点分别代表显著下调的代谢物和上调的代谢物;其中有77种显著不同的类黄酮代谢物(16种下调,61种上调),71种没有变化。 生物辅助前处理能有效地提高FHDT中汉黄芩素、芹菜素7-葡萄糖醛酸苷、芦丁、杨梅素3-O-α-L-吡喃阿拉伯糖苷、槲皮素3,4'-二甲醚、山奈酚3-O-洋槐糖苷等黄酮类化合物的含量。此外,经过发酵前处理,出现一些新类黄酮,如3,4-二羟基黄酮、4',5-二羟基黄酮、金圣草黄素、线蓟素、异山柰酚、绒毛素等;而α-萘黄酮消失了。FHDT中含量最高的几种类黄酮为1,3,6-三羟基-5-甲氧基黄酮、2',3'-二氢-2'-羟基原芹菜酮、芹菜素7-O-β-洋槐糖苷、地奥司明、芦丁、3',4',7-三羟基黄酮、汉黄芩素等。WANG F等[24]研究表明,芹菜素能减轻酒精引起的肝脂肪变性,同时也可以降低酒精引起的血清低密度脂蛋白胆固醇升高值;槲皮素3,4'-二甲醚为槲皮素的3,4'-二甲醚衍生物,是一种三羟基黄酮和一种二甲氧基黄酮,具有抗肿瘤活性[25],它在功能上与槲皮素有关。杨梅素3-O-α-L-吡喃阿拉伯糖苷也是一种槲皮素衍生物,槲皮素能减轻酒精引起的肝脂肪变性,此外还能降低血清总胆固醇和甘油三酯浓度,最终恢复细胞活力[26]。山奈酚3-O-洋槐糖苷是一种天然的化合物,它的化学结构由山奈酚和3-O-洋槐糖组成,是一种山奈酚衍生物;现有研究表明,山奈酚3-O-洋槐糖苷通过调节Nrf2/NF-κB和JNK/ASK-1/caspase-3信号传导对对乙酰氨基酚引起的肝损伤具有肝脏保护能力[27]。以上结果表明,米根霉1006发酵可以提高发酵枳椇子中黄酮类化合物含量,对治疗酒精性肝病有积极作用。
3 结论
本研究采用米根霉1006发酵枳椇子,通过单因素和响应面试验确定最佳发酵条件为发酵时间24 h、孢子悬液添加量0.04 mL/g、液固比0.9(mL∶g)、发酵温度28 ℃、葡萄糖添加量0.04 g/g、硫酸铵添加量0.002 g/g。在此条件下,FHDT的黄酮得率达到6.44 mg/g,较对照提高36.17%。此外,枳椇子黄酮对酿酒酵母的生长和耐受性能均有显著提升作用;当在黄酒中添加枳椇子黄酮时,HDT与FHDT对DPPH和ABTS自由基也均表现出良好的清除能力和对铁离子的还原能力,当黄酮添加质量浓度为8 μg/mL时,含FHDT的黄酒的自由基清除率为96.77%(DPPH)、95.12%(ABTS),而含HDT黄酮的黄酒的自由基清除率为93.98%(DPPH)、93.29%(ABTS),对Fe3+还原力测定中,含FHDT黄酒的吸光度值为0.506,含HDT黄酒的吸光度值为0.454。生物辅助前处理能有效地提高FHDT中汉黄芩素等黄酮类化合物的含量,并通过生物转化作用,产生了一些新的化合物,部分具有良好生物学活性的黄酮类物质如1,3,6-三羟基-5-甲氧基黄酮、2',3'-二氢-2'-羟基原芹菜酮等显著提升。生物辅助处理提升天然产物得率和改变其生物活性方面展现了巨大的发展前景,必将成为行业未来的重要发展方向。
[1]LIM S J, KIM M, RANDY A, et al.Inhibitory effect of the branches of Hovenia dulcis Thunb.and its constituent pinosylvin on the activities of IgE-mediated mast cells and passive cutaneous anaphylaxis in mice[J].Food Funct,2015,6(4):1361-1370.
[2]DE GODOI R S,GARCIA A L H,BORGES M S,et al.Protective effect of Hovenia dulcis T hunb.leaf extracts against ethanol-induced DNA damage in SH-SY5Y cells[J].J Ethnopharmacol,2023,304:116042.
[3]HYUN T K, EOM S H, YU C Y, et al. Hovenia dulcis--an Asian traditional herb[J].Planta Med,2010,76(10):943-949.
[4]WANG M,ZHU P,JIANG C,et al.Preliminary characterization,antioxidant activity in vitro and hepatoprotective effect on acute alcohol-induced liver injury in mice of polysaccharides from the peduncles of Hovenia dulcis[J].Food Chem Toxicol,2012,50(9):2964-2970.
[5]CHOI R Y,WOO M J,HAM J R,et al.Anti-steatotic and anti-inflammatory effects of Hovenia dulcis Thunb.extracts in chronic alcohol-fed rats[J].Biomed Pharmacother,2017,90:393-401.
[6]余萍.葛根枳椇子洛神花本草酵素的解酒护肝作用研究[J].中国酿造,2023,42(7):154-159.
[7]FU X,TAN Y,SHI M,et al.Multi-Index comprehensive assessment optimized critical flavonoids extraction from Semen Hoveniae and their in vitro digestive behavior evaluation[J].Foods,2023,12(4):773.
[8]ZHAO S L, ZHANG Y, DING H, et al.Lutein prevents liver injury and intestinal barrier dysfunction in rats subjected to chronic alcohol intake[J].Nutrients,2023,15(5):1229.
[9]AHMAD S B, RASHID S M, WALI A F, et al.Myricetin (3,3',4',5,5',7-hexahydroxyflavone) prevents ethanol-induced biochemical and inflammatory damage in the liver of Wistar rats[J].Hum Exp Toxicol,2022,41:9603271211066843.
[10]张永昕,俞发.枳椇子总黄酮治疗酒精性肝病及其作用机制研究[J].中药材,2010,33(11):1782-1785.
[11]QIU P,DONG Y,ZHU T,et al.Semen hoveniae extract ameliorates alcohol-induced chronic liver damage in rats via modulation of the abnormalities of gut-liver axis[J].Phytomedicine,2019,52:40-50.
[12]MENG X, TANG G Y, ZHAO C N, et al.Hepatoprotective effects of Hovenia dulcis seeds against alcoholic liver injury and related mechanisms investigated via network pharmacology[J].World J Gastroenterol,2020,26(24):3432-3446.
[13]QU Y L,XIE D,HU C Y,et al.Direct steam injection pretreatment improves microwave-assisted extraction yield for total flavonoids and myricetin from Hovenia dulcis Thunb.[J].Food Sci Technol,2021,41(1):334-342.
[14]ZHANG X,ZHANG L,ZHANG Y,et al.Extracting myricetin and dihydromyricetin simultaneously from Hovenia acerba seed by ultrasoundassisted extraction on a lab and small pilot-scale[J].Ultrason Sonochem,2023,93:106304.
[15]BOATENG I D,LI F,YANG X M,et al.Combinative effect of pulsedlight irradiation and solid-state fermentation on ginkgolic acids,ginkgols,ginkgolides, bilobalide, flavonoids, product quality and sensory assessment of Ginkgo biloba dark tea[J].Food Chem,2024,456:139979.
[16]JU X,CHEN T,DING Y,et al.Effects of rhizopus-arrhizus-31-assisted pretreatment on the extraction and bioactivity of total flavonoids from Hibiscus manihot L.[J].Molecules,2024,29(5):1046.
[17]PINTO J T, ALVARENGA L F, OLIVEIRA D, et al.Elaboration and characterization of Japanese Raisin Tree(Hovenia dulcis Thumb.)pseudofruits fermented alcoholic beverage[J].Food Sci Technol Int,2017,37:101-108.
[18]孙露露,王紫媛,葛金山,等.超微粉碎中草药发酵前后活性成分变化及对蛋鸡产蛋性能、蛋品质和血清生化指标的影响[J].饲料工业,2025,46(7):34-42.
[19]蒋丙婷,李如蕊,方越,等.乳酸菌发酵对铁皮石斛抗氧化活性和酚类化合物的影响[J].农业工程学报,2025,41(2):328-337.
[20]文为,张洪,曾嵘.枳椇子总黄酮提取工艺的优化[J].医药导报,2008(1):77-79.
[21]AYELE D T, AKELE M L, MELESE A T.Analysis of total phenolic contents, flavonoids, antioxidant and antibacterial activities of Croton macrostachyus root extracts[J].BMC Chem,2022,16(1):30.
[22]ARNAO M B, CANO A, ACOSTA M.The hydrophilic and lipophilic contribution to total antioxidant activity[J].Food Chem, 2001, 73(2):239-244.
[23]RAZA A,LI F,XU X,et al.Optimization of ultrasonic-assisted extraction of antioxidant polysaccharides from the stem of Trapa quadrispinosa using response surface methodology[J].Int J Biol Macromol,2017,94:335-344.
[24]WANG F, LIU J C, ZHOU R J, et al.Apigenin protects against alcohol-induced liver injury in mice by regulating hepatic CYP2E1-mediated oxidative stress and PPARα-mediated lipogenic gene expression[J].Chem Biol Interact,2017,275:171-177.
[25]TOUME K,NAKAZAWA T,OHTSUKI T,et al.Cycloartane triterpenes isolated from Combretum quadrangulare in a screening program for death-receptor expression enhancing activity[J].J Nat Prod, 2011, 74(2):249-255.
[26]ZHAO X,GONG L,WANG C,et al.Quercetin mitigates ethanol-induced hepatic steatosis in zebrafish via P2X7R-mediated PI3K/Keap1/Nrf2 signaling pathway[J].J Ethnopharmacol,2021,268:113569.
[27]MOHAMED G A,EL-AGAMY D S,ABDALLAH H M,et al.Kaempferol sophoroside glucoside mitigates acetaminophen-induced hepatotoxicity:Role of Nrf2/NF-κB and JNK/ASK-1 signaling pathways[J].Heliyon,2024,10(10):e31448.