氧化应激是活性氧与抗氧化系统失衡引发的病理状态,其诱导的脂质过氧化、基因损伤等过程与癌症、代谢综合征等疾病密切相关[1-2]。 开发高效低毒的天然抗氧化剂成为生物医学领域的重要方向。竹叶黄酮(bamboo leaf flavonoids,BLF)作为淡竹叶提取的天然黄酮复合物,以异牡荆苷、异荭草苷为核心成分,兼具多糖、酚酸等协同组分[3]。其苯并γ-吡喃酮骨架及多羟基结构赋予显著抗氧化能力:一方面通过激活细胞核因子信号通路上调超氧化物歧化酶、谷胱甘肽过氧化物酶等酶的表达[4];另一方面通过辅酶Q10增强线粒体功能,形成多途径抗氧化网络[5-6]。 此外,BLF还可通过调节丝裂原活化蛋白激酶自噬通路延缓细胞衰老[7]、激活假定蛋白激酶和泛素连接酶等清除受损或多于的线粒体缓解肝损伤[8],抑制含pyrin结构域家族蛋白引发炎症小体介导的细胞焦亡[9],以及对诱导心肌细胞损伤有保护作用[10],展现出跨病理模型的抗氧化潜力。由于常喝白酒会引发体内氧化自由基过多,而导致身体出现各种疾病,如酒精肝等,但若以白酒为酒基,添加竹叶黄酮后即可成为具有辅助健康功能的露酒,利用竹叶黄酮的功效减少体内自由基的生成,并减轻白酒对体内器脏的损坏。
黄酮类物质的抗氧化效能常受到螯合过渡金属离子的影响。BLF中的邻苯二酚基团可结合Fe2+/Cu2+,阻断芬顿反应产生的羟基自由基(OH·)[11-12]。然而,金属络合可能引发双重效应:①结构稳定性方面,金属离子与黄酮的配位会改变分子共轭体系,导致紫外吸收光谱位移(如Al3+络合引起溶液褐变)[13-14],这种显色特性虽被用于黄酮定量检测[15],但可能影响其制剂色泽稳定性;②生物活性层面,络合可能增强或抑制自由基清除能力,如BLF与Zn2+/Cu2+结合后体外抗氧化活性显著提升[16];③细胞毒性风险,过量Cu2+可通过氧化硫醇基团破坏线粒体功能[17],提示需系统评估金属络合对BLF生物利用度的影响,在食品安全方面,根据露酒国家标准规定[18],露酒中Fe3+的含量应≤8.0 mg/L,欧盟食品安全局(European food safety and authority,EFSA)确定每周Al3+的有效摄入量为1 mg/kg体质量[19]。
露酒作为一种添加健康草本食材的白酒,通常会含有黄酮类、多糖类等功能成分,产品的感官与功效同为重要,而金属离子在传统白酒中可赋予白酒更多风味,尤其是陈年老酒,金属离子含量更高但风味也更复杂[20]。因此,本研究选取Al3+、Fe3+等6种白酒中常见且含量相对较高的金属离子与竹叶黄酮在醇溶液中相互反应,并先从光谱学揭示金属-竹叶黄酮络合物在醇溶液中发生的颜色变化及规律,筛选出能与竹叶黄酮较快络合的金属离子,其次结合自由基清除实验评价金属络合后对竹叶黄酮抗氧化活性的影响。旨在为以竹叶黄酮为主的露酒的生产优化和质量控制提供理论依据。
1 材料与方法
1.1 材料与试剂
竹叶黄酮提取物(纯度≥80%):劲牌持正堂有限公司;氢氧化钠、无水乙醇(均为分析纯):天津市永大化学试剂有限公司;盐酸、30%过氧化氢(均为分析纯):烟台市双双化工有限公司;1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基;5,5-二甲基-1-吡咯啉-N-氧化物(5,5-dimethyl-1-pyrroline-N-oxide,DMPO)(均为分析纯):上海麦克林生化科技有限公司;二甲基亚砜(分析纯):天津市富宇精细化工有限公司;硫酸亚铁(分析纯):天津市化学试剂三厂;甲醇(分析纯):天津市致远化学试剂有限公司;铝、铁、铜、钠、钾、钙单元素标准溶液(1 000 μg/mL):中国计量科学研究院;乙醇(分析纯):国药集团化学试剂公司。
1.2 仪器与设备
E-scanBruker电子顺磁共振波谱仪:德国布鲁克科技(北京)有限公司;Tecan Spark 20M多功能微孔板读数仪:瑞士Tecan公司;KQ3200DA型超声波清洗器:昆山市超声仪器有限公司;ME204E电子天平:梅特勒-托利多科学仪器(上海)有限公司;CS-820N台式分光测色仪:杭州彩谱科技有限公司;iCAP RQ型电感耦合等离子体质谱仪:美国赛默飞世尔科技有限公司;PRO型微波消解仪:奥地利安东帕有限公司;ELGA纯水机:英国威立雅公司。
1.3 方法
1.3.1 竹叶黄酮醇溶液的配制
将体积分数95%的乙醇与超纯水调制成体积分数45%的乙醇溶液,添加竹叶黄酮提取物搅拌溶解后经0.45 μm膜过滤,制备总黄酮含量为200 mg/L的竹叶黄酮醇溶液。
1.3.2 金属离子-竹叶黄酮复合醇溶液的颜色及其稳定性实验
(1)金属离子-竹叶黄酮络合实验
在总黄酮含量为200 mg/L的竹叶黄酮醇溶液中添加1 mL的金属离子单元素标准溶液,共制备7个100 mL的竹叶黄酮-金属离子复合醇溶液样品,其中样品1#为不添加任何金属离子标准溶液,作为空白对照,金属离子含量为0;6个样品分别添加不同的金属离子单元素标准溶液,分别标记为2#,3#,4#,5#,6#,7#,各自添加的金属离子含量均为10 mg/L,样品信息见表1。
表1 竹叶黄酮-金属离子复合醇溶液样品信息
Table 1 Information on bamboo leaf flavonoid-metal ion composite alcohol solution samples
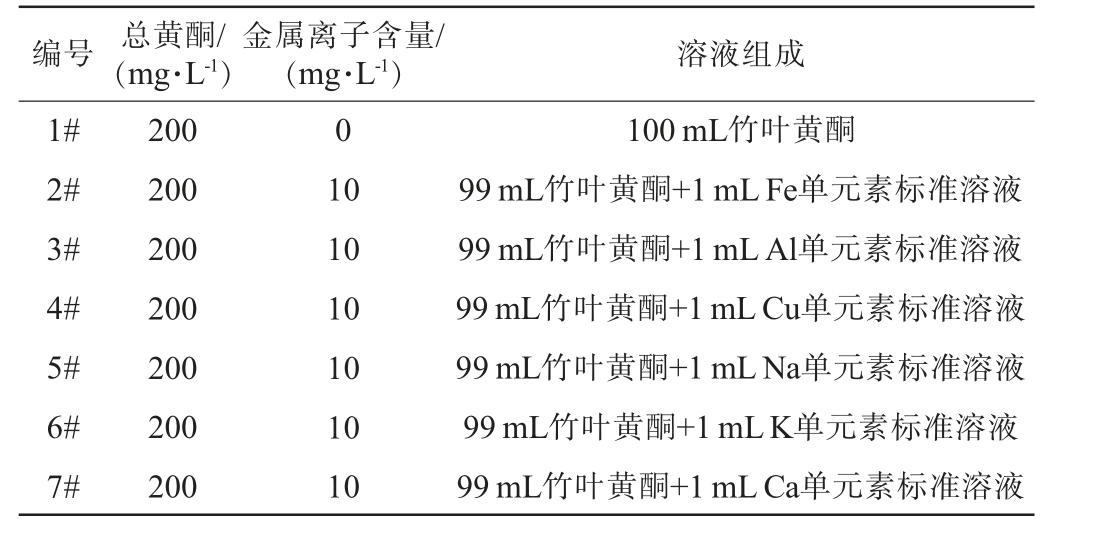
编号 总黄酮/(mg·L-1)金属离子含量/(mg·L-1) 溶液组成1#2#3#4#5#6#7#200 200 200 200 200 200 200 0 10 10 10 10 10 10 100 mL竹叶黄酮99 mL竹叶黄酮+1 mL Fe单元素标准溶液99 mL竹叶黄酮+1 mL Al单元素标准溶液99 mL竹叶黄酮+1 mL Cu单元素标准溶液99 mL竹叶黄酮+1 mL Na单元素标准溶液99 mL竹叶黄酮+1 mL K单元素标准溶液99 mL竹叶黄酮+1 mL Ca单元素标准溶液
(2)高温加速实验
所有样品经台式分光测色仪检测色度值,数据记为加速前;放置在40 ℃恒温培养箱中培养7 d,再次经台式分光测色仪检测色度,数据记为加速后。
(3)色差的计算
对金属离子-竹叶黄酮络合实验样品、样品高温加速前与加速后的色差值(ΔE)进行计算,衡量样品的颜色变化情况,色差值(ΔE)计算公式如下:
式中:L*代表标样的明亮度;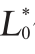 代表试样的明亮度;a*代表标样的红绿值;
代表试样的明亮度;a*代表标样的红绿值;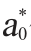 代表试样的红绿值;b*代表标样的黄蓝值;
代表试样的红绿值;b*代表标样的黄蓝值;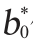 代表试样的黄蓝值。
代表试样的黄蓝值。
1.3.3 金属离子对竹叶黄酮醇溶液抗氧化活性的影响试验
将质量浓度为200 mg/L的竹叶黄酮醇溶液记为K;在100 mL的竹叶黄酮醇溶液中添加0.01 mL的Al单元素标准溶液,并记为Ka;在100 mL竹叶黄酮醇溶液中添加0.01 mL Fe单元素标准溶液,记为Kf。
(1)DPPH自由基清除率测定
吸取0.5 mL的K、Ka、Kf醇溶液加入到具塞棕色带盖试管中,并加入1 mL的0.5 mmol/L的DPPH醇溶液并涡旋振荡1 min。混匀后暗反应40 min立即放入电子顺磁共振波谱仪的谐振腔中,待仪器调谐后开始测量。测量参数[21]:频率9.79 GHz,功率5.00 mW,中心磁场278 960 A/m,扫描宽度8 000 A/m,调制幅度181.6 A/m,调制频率86.00 kHz,时间常数40.96,扫描时间83.88 s(20.97 s×4次),横坐标点数512,接收机增益为3.17×103,时间扫描:间隔2 min扫描一次电子自旋共振谱图,共计扫描120 min(单次扫描时间20.97 s、扫描间隔时间99.03 s、累计扫描次数60次)。将扫描的谱图导入至WINEPR-Processing,选取磁场强度276 000~282 000 A/m区域对DPPH自由基的电子顺磁共振波谱仪(electron paramagnetic resonance,EPR)谱图进行2重积分,积分值记为As[22]。 在相同操作条件下,以0.5 mL无水乙醇溶液代替作为空白组,并记录其二重积分值,记为Ac。DPPH自由基清除能力计算公式如下[23]:
(2)羟基自由基清除率测定
2.5 mL离心管中依次加入50 μL K、Ka、Kf醇溶液再加入20 μL DMPO、420 μL去离子水、20 μL 5 mmoL/L FeSO4并用涡旋仪振荡40s。 测量参数;频率9.79GHz,调制幅度80.8A/m,时间常数20.48,扫描时间10.49 s,扫描间隔时间19.51 s,接收机增益为1.00×103,中心磁场278 960 A/m,功率5.00 mW,扫描宽度8 000 A/m,调制频率86.00 kHz,横坐标点数512。以等量无水乙醇作为空白组。随后吸取20 μL50 mmol/L H2O2并计时,暗反应100 min开始测量并记录第二主峰峰高。空白组记为Ac,实验组记为As。羟基自由基清除率计算公式如下:
(3)超氧阴离子清除率测定
依照ZHANG J T等[24]制备的碳点和钯共修饰自掺杂二氧化钛(CDs/Pd/Ti3+-TiO2)纳米材料,取20 mg纳米材料加20 mL无水甲醇溶液、50 μL DMPO混合后,加入200 μL 30%H2O2处理25 min,用0.22 μm尼龙膜过滤。 用毛细管虹吸23.77 μL滤液于2 min开始测量,每隔2 min扫描一次,共测60min,并记录第一条主峰峰高。测量参数:频率9.793810GHz,中心磁场强度278 960 A/m,调制幅度161.6 A/m,时间常数20.48,扫描时间10.49 s,扫描间隔时间19.51 s,接收机增益为1.42×103,氙灯功率300 W,其余参数同DPPH自由基测量参数。于2.5 mL离心管中加入250 μL上述光照材料滤液、10 μLK、Ka、Kf,以等量无水乙醇作为空白组。 暗反应10 min后开始测量并记录谱图二重积分值。 空白组记为Ac,实验组记为As。超氧阴离子自由基清除率计算公式如下:
1.3.4 数据分析
所有的试验均做3次平行,采用WINEPR-Processing、Origin 8.0及其相关方法进行处理并作图,样品的色差数据采用SPSS 23进行差异显著性分析。
2 结果与分析
2.1 金属离子-竹叶黄酮络合实验
基于方法1.3.2共制备7个100 mL的样品,样品1#为对照样,样品2#~7#单个金属离子含量均为10 mg/L,所有样品经台式分光测色仪检测,以样品1#为标样计算出样品2#~6#与标样之间的色差值,结果见表2。
表2 金属离子-竹叶黄酮络合实验样品色差
Table 2 Color difference of samples in metal ion-bamboo leaf flavonoid complexation assay
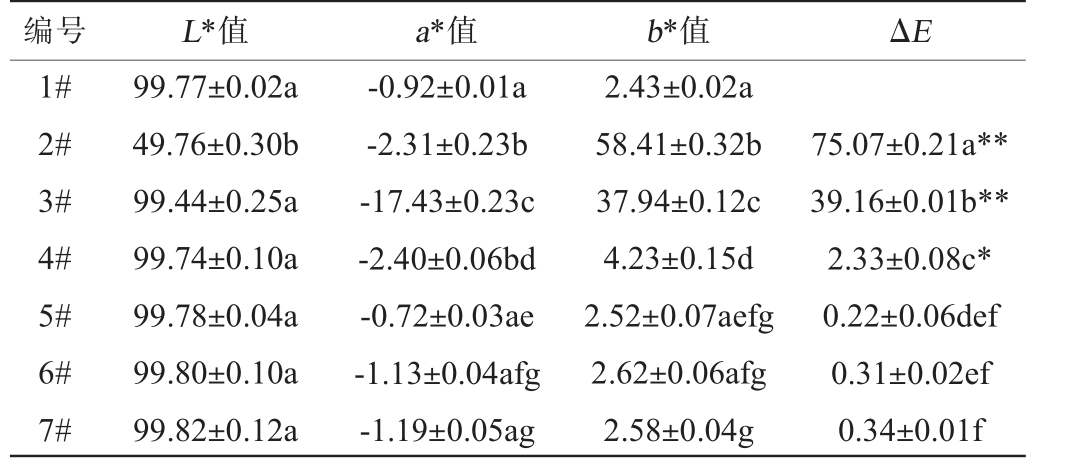
注:L*、a*、b*代表样品的检测值,ΔE代表各样品以样品1#为标样计算的色差值,其中ΔE*代表有显著性的颜色差异(0.5<ΔE<1)(P<0.05);ΔE**代表有极显著性的颜色差异(ΔE>1)(P<0.01),不同样品L*、a*、b*的检测值和ΔE的计算值中相同字母的上标表示无显著性差异(P>0.05)。下同。
编号 L*值 a*值1#2#3#4#5#6#7#99.77±0.02a 49.76±0.30b 99.44±0.25a 99.74±0.10a 99.78±0.04a 99.80±0.10a 99.82±0.12a-0.92±0.01a-2.31±0.23b-17.43±0.23c-2.40±0.06bd-0.72±0.03ae-1.13±0.04afg-1.19±0.05ag b*值 ΔE 2.43±0.02a 58.41±0.32b 37.94±0.12c 4.23±0.15d 2.52±0.07aefg 2.62±0.06afg 2.58±0.04g 75.07±0.21a**39.16±0.01b**2.33±0.08c*0.22±0.06def 0.31±0.02ef 0.34±0.01f
由表2可知,与1#对照样相比,样品2#的色差值为75.07,样品3#的色差值为39.16,与1#对照样的颜色参数差异极显著(P<0.01),说明添加Al3+、Fe3+能够快速与竹叶黄酮发生络合反应,使其分子结构发生变化,吸收光谱发生相对较大的位移,导致竹叶黄酮醇溶液颜色发生变化最大;其次是样品4#,色差值为2.33,说明添加Cu2+也改变了竹叶黄酮的颜色,但颜色的变化差异明显弱于Al3+、Fe3+,有可能是Cu2+与竹叶黄酮络合反应较慢,但也有可能并没有发生络合反应,而是溶液中Cu2+含量过高而导致颜色发生变化,因为Cu2+本身也带有颜色;样品5#、6#、7#的色差值均<0.5,属于肉眼不可分辨的颜色差异,说明添加Na+、K+、Ca2+金属离子不会改变竹叶黄酮醇溶液的颜色。
2.2 金属离子-竹叶黄酮醇溶液的高温加速实验
高温可以加速金属离子与竹叶黄酮之间的络合反应。将7个样品放入40 ℃的高温培养箱中加速观察7 d,并对比每个样品在加速前与加速后的颜色差异,结果见表3。由表3可知,样品1#经过高温加速7 d后色差值为0.24,说明竹叶黄酮在没有金属离子干扰的情况下,其溶液基本不会变色,同样,样品5#、6#、7#在相同环境下色差值均在0.2左右,说明Na+、K+、Ca2+金属离子确实不会与竹叶黄酮发生络合反应并改变其分子结构,让竹叶黄酮醇溶液发生颜色变化;样品4#高温加速后色差值为2.39,由于该样品加速前的颜色就比样品1#、2#颜色浅,后期加速后颜色变化也仅与样品2#差不多,说明Cu2+确实能与竹叶黄酮发生络合反应,但是反应时间非常缓慢;样品2#与3#加速后的颜色差异说明,Fe3+不仅能够快速与竹叶黄酮络合,且反应时间持续性长,说明Fe3+能与竹叶黄酮多个位点结合,导致络合反应持续不断,而Al3+虽能够快速与竹叶黄酮发生络合,但络合后基本趋于稳定,颜色变化相对不大。 因此,可以确定Al3+、Fe3+会快速的与竹叶黄酮发生络合反应,与其分子结构位点结合,让其结构发生改变;Cu2+在高温加速后虽也能与竹叶黄酮络合,但络合相对缓慢,考虑到白酒中Cu2+含量比Fe3+还少,一般在0.003 mg/L左右,可以确定对竹叶黄酮结构位点影响较小;Na+、K+、Ca2+等金属离子基本不会与竹叶黄酮发生络合反应,因此后期只考察Al3+、Fe3+对竹叶黄酮醇溶液抗氧化活性的影响。
表3 7个样品高温加速反应后的色差
Table 3 Color difference of 7 samples after high-temperature acceleration reaction

编号 检测时段1#0.24±0.04 2#35.94±1.20**3#3.44±0.30**4#2.39±0.20**5#0.37±0.10 6#0.25±0.11 7#加速前加速后加速前加速后加速前加速后加速前加速后加速前加速后加速前加速后加速前加速后L*值 a*值99.77±0.02 99.67±0.05 49.76±0.30 74.48±0.53*99.44±0.25 99.42±0.41 99.74±0.10 99.62±0.27 99.78±0.04 99.68±0.10 99.80±0.10 99.83±0.13 99.82±0.12 99.83±0.07-0.92±0.01-0.98±0.03-2.31±0.23-6.56±0.49*-17.43±0.23-16.11±0.33-2.40±0.06-3.85±0.19*-0.72±0.03-0.95±0.13-1.13±0.04-0.89±0.07-1.19±0.05-1.08±0.13 b*值 ΔE值2.43±0.02 2.66±0.04*58.41±0.32 32.67±0.54*37.94±0.12 34.76±0.31*4.23±0.15 6.13±0.21*2.52±0.07 2.24±0.09 2.62±0.06 2.55±0.16 2.58±0.04 2.76±0.09 0.21±0.03
2.3 金属离子对竹叶黄酮抗氧化活性的影响试验
Al3+、Fe3+对竹叶黄酮清除DPPH·、OH·和O2-·能力的影响见图1。由图1A可知,无水乙醇的峰值最高、其DPPH·的含量最多。 但在醇溶液中添加竹叶黄酮以及Fe3+、Al3+等金属离子后,竹叶黄酮醇溶液以及金属离子-竹叶黄酮的复合醇溶液的峰值均发生改变,其中Ka(竹叶黄酮添加Al3+,DPPH·清除率为52.35%)>K(竹叶黄酮醇溶液,DPPH·清除率为49.87%)>Kf(竹叶黄酮添加Fe3+,DPPH·清除率为46.99%)。 Fe3+本就具备强氧化性能力,可直接氧化黄酮分子并使其结构发生变化,从而削弱了竹叶黄酮部分的清除DPPH·能力。Al3+能提高竹叶黄酮抗氧化活性,原因可能是竹叶黄酮中的酚羟基可作为自由基的供氢体,与Al3+鳌合后能够增强自身与自由基的结合,从而提高抗氧化活性[25]。因此,竹叶黄酮在醇溶液中具有清除DPPH·的能力,但添加Fe3+后会削弱竹叶黄酮的清除能力,而Al3+能提高竹叶黄酮的清除能力。

图1 Fe3+和Al3+对竹叶黄酮清除DPPH·(A)、OH·(B)和O2-·(c)的影响
Fig.1 Effect of Fe3+and Al3+on DPPH·(A)、OH·(B)和O2-·(c)clearance by bamboo leaf flavonoids
由图1B可知,无水乙醇溶液仍是峰值最高,OH·含量最多。 在添加竹叶黄酮和Fe3+、Al3+等金属离子后,三种不同黄酮醇溶液样品对OH·清除能力大小由强到弱依次为;K(竹叶黄酮醇溶液,OH·清除率42.24%)>Ka(竹叶黄酮添加Al3+,OH·清除率41.45%)>Kf(竹叶黄酮添加Fe3+,OH·清除率40.30%)。 OH·反应极快且无选择性,主要依赖直接的氢原子转移,Al3+的络合可能降低黄酮分子提供氢原子的能力,因此削弱了竹叶黄酮清除OH·的能力。 而Fe3+依旧是强氧化性破坏了竹叶黄酮分子的结构,削弱了其抗氧化活性,同时Fe3+能够通过Fenton反应催化产生OH·,即使黄酮本身清除自由基,Fe3+的存在也会持续生成新的OH·,提高自由基初始量,导致抗氧化效果被抵消[26]。 因此Al3+、Fe3+与竹叶黄酮络合后均能削弱竹叶黄酮清除OH·能力。
由图1C可知,相较无水乙醇溶液的峰值,其他三种不同醇溶液对O2-·的清除能力分别为:Ka(竹叶黄酮添加Al3+,O2-·清除率为74.62%)>K(竹叶黄酮醇溶液,O2-·清除率为60.79%)>Kf(竹叶黄酮添加Fe3+,O2-·清除率为58.78%),该结果与清除DPPH·相似。Al3+与黄酮分子中的邻苯二酚羟基(如3',4'-二羟基结构)形成的稳定络合物能增强其单电子转移能力,从而更高效地中和DPPH·和O2-·,而Fe3+因其强氧化性破坏了该结构,导致削弱竹叶黄酮醇溶液对O2-·清除能力[27]。 因此,Al3+提高竹叶黄酮醇溶液对O2-·的清除能力,而Fe3+削弱了竹叶黄酮醇溶液对O2-·的清除能力。
3 结论
基于考察6种白酒中常见的且含量相对较高的金属离子与竹叶黄酮的显色反应以及高温加速后的颜色变化,确定Fe3+、Al3+、Cu2+能与竹叶黄酮配位络合,从而显著改变竹叶黄酮的颜色及后期颜色稳定性,且影响力是Fe3+>Al3+>Cu2+。Al3+促进竹叶黄酮醇溶液清除DPPH·、O2-·能力,削弱了清除OH·能力,即Al3+可通过优化黄酮的电子分布增强DPPH·、O2-·的清除能力,但因遮蔽活性位点又削弱对OH·的清除能力,具有“双重作用”;Fe3+同时削弱了竹叶黄酮醇溶液的DPPH·、OH·、O2-·清除能力,即Fe3+因其氧化活性和对黄酮结构的破坏导致抗氧化活性的降低,同时Fenton反应加剧了氧化压力,削弱了竹叶黄酮在醇溶液中的抗氧化活性。
综合以上结果,Al3+和Fe3+在醇溶液中会影响竹叶黄酮的抗氧化活性,但是影响的机制和效果不同。因此,在以竹叶相关的露酒中,需要在生产过程中关注Al3+、Fe3+等金属离子对产品的感官和功效方面产生影响,尤其是以陈年老酒为酒基时,虽然其中的Al3+、Fe3+等金属离子并不会与竹叶黄酮发生如此快速的反应,但经过长时间的储存,产品的颜色和抗氧化能力会逐步产生影响。
[1]FORMAN H J,ZHANG H.Author correction:Targeting oxidative stress in disease: Promise and limitations of antioxidant therapy[J].Nat Rev Drug Discovery,2021,20(8):652.
[2]TELEANU D M,NICULESCUU A G,LUNGU I I,et al.An overview of oxidative stress, neuroinflammation, and neurodegenerative diseases[J].Int J Mol Sci,2022,23(11):5938.
[3]SHAO S Y,WANG J,YAO X,et al.Characterization and identification of major flavonoids of bamboo leaf extract by HPLC/ESI-QTOF-MS/MS[J].J Asian Nat Prod Res,2024,26(10):1147-1159.
[4]YU Y,LI Z,CAO G,et al.Bamboo leaf flavonoids extracts alleviate oxidative stress in HepG2 cells via naturally modulating reactive oxygen species production and Nrf2-mediated antioxidant defense responses[J].J Food Sci,2019.84(6):1609-1620.
[5]CHENG Y,WAN S,YAO L,et al.Bamboo leaf:A review of traditional medicinal property,phytochemistry,pharmacology,and purification technology[J].J Ethnopharmacol,2023,306:116166.
[6]NIE X, DONG X, HU Y, et al.Coenzyme Q10 stimulate reproductive vatality[J].Drug Des Devel Ther,2023,17:2623-2637.
[7]GU Y,XUE F,XIAO H,et al.Bamboo leaf flavonoids suppress oxidative stress-induced senescence of HaCaT Cells and UVB-Induced photoaging of mice through p38 MAPK and autophagy signaling[J].Nutrients,2022,14(4):793.
[8]吴超,卢姝婉,史雪艳,等.竹叶黄酮对敌草快应激大鼠肝脏损伤、抗氧化功能及相关基因表达的影响[J].中国兽医学报,2024,44(7):1498-1506.
[9]王靖,关淑文,赵小博,等.竹叶黄酮对H2O2诱导奶牛乳腺上皮细胞焦亡的保护作用[J].畜牧兽医学报,2025,56(1):281-294.
[10]张浩,石艳宾,武文双.淡竹叶黄酮组分分析及其对AngⅡ诱导心肌细胞损伤的保护作用[J].粮食与油脂,2025,38(1):131-138.
[11]JOMOVA K, VALKO M.Advances in metal-induced oxidative stress and human disease[J].Toxicology,2011,283(2-3):65-87.
[12]ISLAM F,SHOHAG S,AKHTER S,et al.Exposure of metal toxicity in Alzheimer's disease: An extensive review[J].Front Pharmacol, 2022,13:903099.
[13]韩倩迪,汪青,王涛,等.槐米和槐花提取物染色性能研究[J].针织工业,2022 (5):56-61.
[14]杨开友,邓小宽,江秀平,等.竹叶总黄酮测定方法优化[J].四川大学学报(自然科学版),2019,56(6):1182-1186.
[15]MULYANINGSIH R D, PRATIWI R, HASANAH A N.An update on the use of natural pigments and pigment nanoparticle adducts for metal detection based on colour response[J].Biosensors (Basel),2023,13(5):554.
[16]董丽娟,田迪英.竹叶黄酮与金属离子配合物清除亚硝酸盐能力研究[J].食品科技,2014,39(7):215-218.
[17]SAPORITO-MAGRINA C,MUSACCO-SEBIO R,ACOSTA J M,et al.Copper(II)and iron(III) ions inhibit respiration and increase free radical-mediated phospholipid peroxidation in rat liver mitochondria:Effect of antioxidants[J].J Inorg Biochem,2017,172:94-99.
[18]国家质量监督检验检疫总局,国家标准化管理委员会.GB/T 27588—2011 露酒[S].北京:中国标准出版社,2011.
[19]GIVELET L,AMLUND H,LOESCHNER K,et al.Aluminium determination in foodstuffs by ICP-MS: influence of microwave digestion parameters on the recovery[J].Food Anal Meth,2024,17(7):1038-1045.
[20]郑逸龙,许德富,明红梅,等.钾离子与铝离子对不同年份浓香型白酒中挥发性风味物质的影响[J].中国酿造,2025,44(2):101-107.
[21]章银良,黄天琪,郭浩彬,等.基于ESR和比色法的美拉德产物抗氧化活性对比研究[J].中国调味品,2022,47(7):36-42.
[22]章银良,黄天琪,张陆燕,等.基于电子顺磁共振波谱法的美拉德反应产物抗氧化活性研究[J].中国调味品,2022,47(5):55-59,74.
[23]章银良,黄天琪,王悦,等.利用电子顺磁共振技术研究美拉德产物对不同自由基清除活性的影响[J].中国调味品,2022,47(8):35-40.
[24]ZHANG J T,LIU S R,WANG X Y,et al.Highly efficient Ti3+self-doped TiO2 co-modified with carbon dots and palladium nanocomposites for disinfection of bacterial and fungi[J].J Hazard Mat,2021,413(5):1-10.
[25]刘科梅,聂挺,潘栋梁,等.4种异黄酮抗氧化活性的构效关系[J].食品科学,2016,37(23):1-6.
[26]赵文斌.大豆异黄酮在猪禽养殖中的应用[J].吉林畜牧兽医,2023,44(1):113-114.
[27]张悦茹.Fe3+/H2O2氧化体系降解邻苯二酚的过程机制研究[D].西安:西安建筑科技大学,2024.