浓香型白酒是中国十二大香型白酒之一,其总产量占据白酒产业产量的70%以上[1],是中国白酒市场的半壁江山。在浓香型白酒酿造工艺中,窖池有着举足轻重的地位,窖泥作为关键组成,其含有丰富的微生物群落,是导致浓香型白酒具有“窖香优雅、绵甜净爽”特点的原因之一[2]。浓香型白酒行业中常说“好窖产好酒”、“酒好全凭窖池老”,所以好的窖池就必须有优质的窖泥[3]。而一般来说优质窖泥需要通过不断的酿酒富集微生物和营养成分,因此传统的方法培养窖泥需要大量时间,目前通过时间驯化窖泥微生物已经无法适应日益增加的白酒产量需求。为缩短窖泥的培养时间,已有利用现代微生物技术等来制作人工窖泥的例子[4],靳喜庆等[5]利用基于超高通量的宏基因技术研究人工窖泥及其产酒过程中微生物群落,发现在白酒生产过程中细菌属多样性增加,真菌属微生物减少。 人工窖泥在酿造过程中容易老化,因此在人工培养的过程中加入协调全面的菌种以及各种合理的营养物质缩短窖泥成熟时间,从而保证人工窖泥的质量[6]。
优质窖泥中的核心微生物大多为耐热厌氧菌,但在发酵初期人工窖泥中含有大量不耐热微生物如乳酸菌、乙酸菌等,这些微生物在生长繁殖过程中会使窖泥核心微生物处于弱势地位,导致窖泥质量有所欠缺。老窖泥中的微生物以己酸菌和丁酸菌等耐热厌氧微生物为主,且菌群协调代谢稳定[7],己酸菌和丁酸菌所产酸类物质通过酵母和其他微生物的共同作用下将酒精生成乙酸乙酯和己酸乙酯。在浓香型白酒中己酸乙酯和乙酸乙酯的比例>1[8],己酸和乙酸是前者的前体物质,说明其含量比例也>1。乳酸由一些不耐热的乳酸菌生成,是乳酸乙酯的前体物质,但是若窖泥中乳酸含量过高会与窖泥中的金属离子结合生成乳酸钙、乳酸铁、乳酸铜等结晶[9],导致窖泥退化产己酸能力下降[10],所以在培养人工窖泥时需要降低乙酸菌、乳酸菌的数量或者活力避免窖泥成熟后乙酸和乳酸含量过多导致在窖泥后续使用时老化,同时也使得窖泥中的己酸乙酸之比协调。目前人工窖泥培养工艺多样,但使用水浴热处理常见于窖泥中产己酸菌分离筛选以及功能菌液纯化,在人工窖泥培养中使用较少。
由于产己酸菌群芽孢具有耐热性[11],而乳酸菌、乙酸菌在70 ℃以上会被杀灭[12]。 因此,该研究通过对制作完成的人工窖泥进行80 ℃水浴5 min的热处理[13],对比窖泥的理化性质、己酸和乙酸比例、白酒风味差异,并与某酒厂随机取样的20个窖泥(特级、优级、合格)样品的酸类物质平均含量进行对比,旨在为人工窖泥培养提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
窖泥样品:采自四川某名酒厂窖池,窖池等级分别为特级、优级、合格;优质黄土:来自宜宾某酒厂;大曲、糟醅、黄水:来自泸州同一酒厂。
功能菌液:为课题组从泸州某酒厂优质老窖泥中富集培养所得。
1.1.2 试剂
氢氧化钠、碘化汞、碘化钾、酒石酸钾钠、硫酸亚铁铵、高锰酸钾、浓硫酸、重铬酸钾、邻菲咯啉、盐酸、氟化铵、钼酸铵、氯化亚锡、磷酸二氢钾等(均为分析纯):成都市科隆化学品有限公司。
1.1.3 培养基
强化棱菌(reinforced Clostridium medium,RCM)培养基:蛋白胨10.0 g/L、牛肉粉10.0 g/L、酵母粉3.0 g/L、葡萄糖5.0 g/L、可溶性淀粉1.0 g/L、氯化钠5.0 g/L、醋酸钠3.0 g/L、半胱氨酸盐酸盐0.5 g/L、琼脂0.5 g/L、pH值6.8±0.1,121 ℃高压蒸汽灭菌20 min。
LB培养基:胰蛋白胨10 g/L、酵母浸粉5 g/L、氯化钠10 g/L、琼脂15 g/L,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
T6新世纪紫外可见分光光度计:北京普析通用仪器有限公司;Starter 2100实验室pH计:奥豪斯仪器(上海)有限公司;7890B-7000D气相色谱质谱联用(gas chromatographymass spectrometry,GC-MS)仪、悟空K2025高效液相色谱仪:海能未来技术集团股份有限公司;GC2200型气相色谱仪:云铂仪器(成都)有限公司。
1.3 试验方法
1.3.1 人工窖泥的制作
本试验人工窖泥配方以优质黄土为主要原料,添加大曲、糟醅、黄水、功能菌液、营养盐(添加量以黄土质量为基准计算),具体配方见表1。
表1 人工窖泥基础配方
Table 1 Basic formula of artificial pit mud
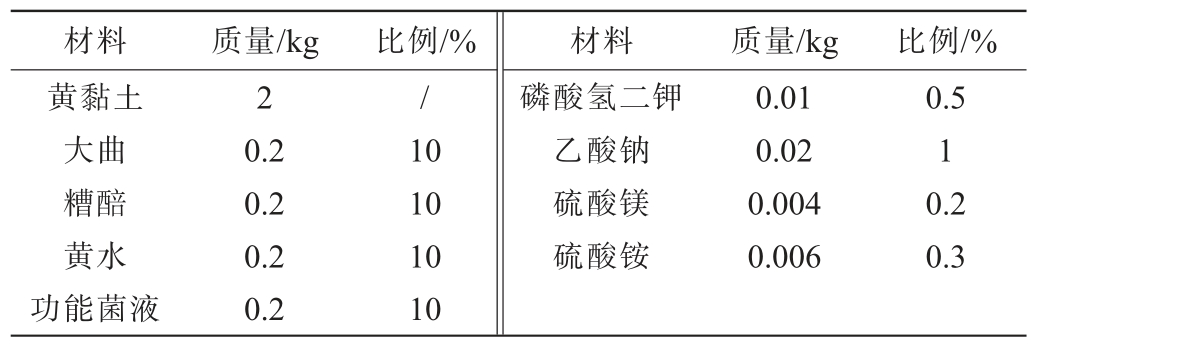
材料 质量/kg黄黏土大曲糟醅黄水功能菌液2 0.2 0.2 0.2 0.2比例/% 材料 质量/kg 比例/%/10 10 10 10磷酸氢二钾乙酸钠硫酸镁硫酸铵0.01 0.02 0.004 0.006 0.5 1 0.2 0.3
1.3.2 人工窖泥培养
对照组:按照表1的配方制得人工窖泥后,补去离子水至总体水分达到40%,混合均匀放入发酵罐中37 ℃厌氧培养30 d。
热处理组:原料混合后,在80 ℃水浴条件下将混合均匀的窖泥搅拌5 min[13],取出后放入发酵罐中37 ℃厌氧培养30 d。
1.3.3 试验窖泥与酒厂窖泥取样
试验窖泥:培养完成后对发酵罐中的窖泥上层、中层、下层进行取样,每层取样50 g混合均匀。
酒厂窖泥取样:取窖底中心点5 cm的窖泥,取样完成后混合均匀并迅速密封通过冰盒运输至实验室。
1.3.4 理化指标检测
水分含量:采用烘干法测定;pH值:采用pH计测定[14];铵态氮含量:采用纳氏试剂比色法测定;有效磷含量:采用钼氨酸比色法测定;腐殖质含量:采用油浴法测定。以上述方法均参考团体标准T/SDBJXH 0001—2024《白酒窖泥》。
1.3.5 微生物数量检测
窖泥厌氧细菌:采用RCM培养基稀释涂布后在37 ℃厌氧条件下培养3 d后计数。
窖泥好氧细菌:采用LB培养基稀释涂布后在37 ℃下培养1~2 d后计数。
1.3.6 窖泥乙酸、丁酸、己酸、乳酸的测定
乙酸、丁酸、己酸的检测:称取5 g样品加入到50 mL离心管中,加入15 mL去离子水振荡均匀,离心后取400 μL上清液、400 μL二乙基丁酸(1 g/mL)作为内标、1 160 μL无水乙醇、40 μL甲酸振荡均匀后12 000 r/min离心7 min,最后过水相滤膜,使用气相色谱进行检测。气相色谱条件:毛细管色谱柱为LZP-930(30 m×0.32 mm×10 μm),不分流,进样量1 μL,进样口温度为230 ℃;程序升温:50 ℃保持6 min,从5 ℃/min升温至170 ℃,保持5 min;载气为高纯度氮气(N2)(>99.99%),载气压力0.04 MPa。根据内标法定量。
乳酸的检测:取1 mL窖泥液12 000 r/min离心7 min,取上清液400 μL,加入560 μL超纯水和40 μL H2O2静置60 min后12 000 r/min离心2 min最后过水相滤膜,使用高效液相色谱进行检测。高效液相色谱条件:流动相甲醇5%;磷酸二氢钾95%;柱温30 ℃,波长215 nm;流速1 mL/min,进样量10 μL。结合测定的色谱峰面积和回归方程,计算出样品中的乳酸含量。
1.3.7 酒样挥发性风味物质检测
酒样前处理:取50 mL酒样,加入NaCl至溶液饱和后,用90 mL乙醚:正戊烷(体积比1∶1)分3次提取,有机相混合均匀加入适量无水Na2SO4,静置过夜以吸收水分。取1 mL,加入30 μL混合内标进行GC-MS检测。将顶空瓶置于50 ℃水浴中平衡20 min然后使用50/30 DVB/CAR/PDMS萃取头,吸附30 min。吸附完成后,快速插入气相色谱入口,洗脱5 min。
气相色谱和质谱条件:参考文献[16]的方法。
定性定量方法:根据保留指数定性,根据内标法定量(混合内标各组分的质量浓度分别为:n-戊酸25.628 mg/mL,2-辛醇27.361 mg/mL,2-乙基丁酸17.366 mg/mL)。
1.3.8 数据处理
所有试验组均进行3次平行试验,试验结果以数据以“平均值±标准差”形式表示;采用SIMCA 14.1和Origin 2022绘制图形;采用SPSS 22.0对数据进行分析。
2 结果与分析
2.1 热处理对人工窖泥理化性质的影响
热处理对人工窖泥理化性质的影响见表2。 水分对于窖泥十分重要,是微生物代谢的基础,但是窖泥的水分应该控制在合理的范围内,过低导致窖泥板结退化,过高则会导致窖池倒塌,窖泥中的微生物在发酵过程中也需要水的参与[17]。本试验通过对两组人工窖泥含水量进行检测发现:热处理组和对照组的水分都在合理范围内且无显著差异(P>0.05)。
表2 热处理对人工窖泥理化性质的影响
Table 2 Effect of heat treatment on the physicochemical properties of artificial pit mud

注:“*”表示差异显著(P<0.05)。下同。
水分/% pH值 铵态氮/(mg·kg-1)腐殖质/%对照组热处理组有效磷/(mg·kg-1)33.94±0.21 33.66±0.31 4.33±0.57 4.73±0.57*1 335.10±53.81 1 605.94±57.67*1 753.52±77.39 2 396.30±47.43*6.56±0.21 6.54±0.08
合适的pH值不仅能促进窖泥己酸、丁酸、乙酸和乳酸的产生,影响窖泥功能菌群的生长繁殖,还可以促进酒精发酵有利于酯的合成[18]。本试验对发酵前人工窖泥经过短暂热处理后的pH值进行检测:发现热处理组的pH值显著高于对照组(P<0.05),这可能是热处理后使得某些不耐高温的产酸微生物活力受到抑制或死亡,减少其微生物总量,使得窖泥产酸能力下降,并导致热处理组的pH值升高。
铵态氮是能够直接被微生物吸收利用的氮源,可以促进代谢,同时铵态氮含量与窖泥中pH值具有一定的相关性[19]。本试验对热处理后窖泥铵态氮含量进行检测,发现热处理后的人工窖泥铵态氮含量显著高于对照组(P<0.05),说明经过热处理后窖泥中氮类代谢比较旺盛。
磷元素是微生物细胞的重要组成成分,窖泥中磷元素主要来自原料中的磷以及微生物死亡后降解,有效磷的含量在一定程度上也反应了微生物活动的剧烈程度[20]。试验对两组人工窖泥有效磷含量进行检测,发现热处理后的人工窖泥有效磷含量显著高于对照组(P<0.05),表明热处理后的人工窖泥微生物活动更为剧烈,微生物在培养过程中被驯化。
腐殖质含量随着窖泥培养时间的延长而增多,在某种程度上反应了窖泥质量的优劣。本试验对两组人工窖泥腐殖质含量进行检测,发现热处理后的窖泥腐殖质含量与对照组无显著差异(P>0.05),证明热处理对窖泥中腐殖质等物质的生成与代谢没有影响。
综上,热处理对窖泥的水分含量和腐殖质含量没有显著影响(P>0.05),对窖泥pH、氨态氮、磷有显著影响(P<0.05)。
2.2 热处理对人工窖泥微生物数量的影响
窖泥中的微生物种类复杂丰富[21],在窖泥中有乳杆菌属(Lactobacillus)、甲烷短杆菌属(Methanobrevibacter)、甲烷杆菌属(Methanobacterium)、产己酸菌属(Caproiciproducens)、梭菌属(Clostridium)等[22],好氧菌主要以芽孢杆菌和乳杆菌为主,厌氧菌以甲烷杆菌纲(Methanobacteria)及梭菌纲(Clostridia)等为主。本试验对两组人工窖泥好氧微生物和厌氧微生物数量进行检测,结果见图1。 由图1可知,热处理组的好氧菌数量显著低于对照组(P<0.05),厌氧菌数量热处理组显著多于对照组(P<0.05),证明热处理可以减少好氧微生物,增加了厌氧微生物,厌氧微生物在窖泥培养过程中对营养物质吸收代谢的竞争能力得到提升,使得厌氧微生物能够充分的生长繁殖。
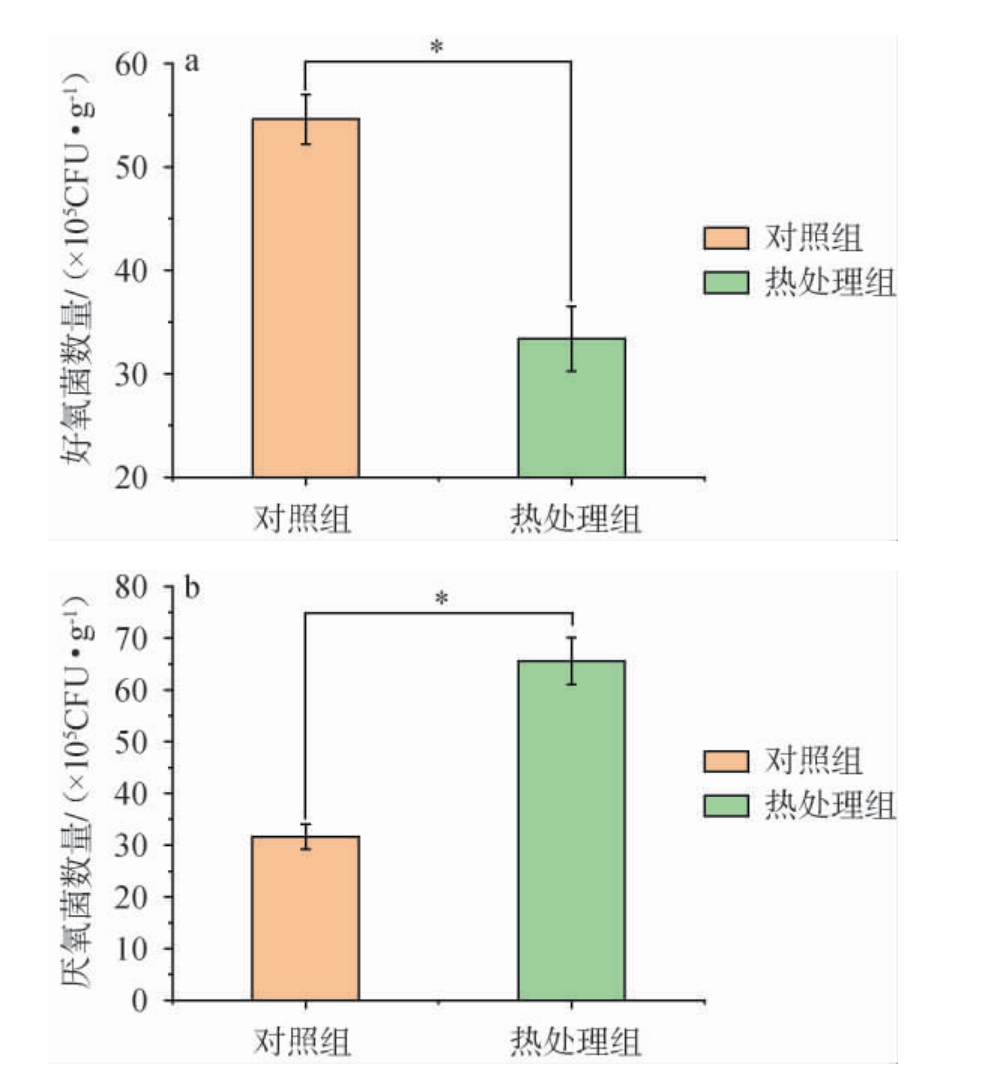
图1 对照组与热处理组窖泥好氧(a)及厌氧(b)物数量
Fig.1 Quantities of aerobic (a) and anaerobic (b) microorganisms in pit mud of control group and heat treatment group
“*”表示差异显著(P<0.05),下同。
2.3 试验窖泥与酒厂窖泥酸类含量对比
有机酸是合成浓香型白酒中酯类的前体物质[23],有机酸含量与有机酸比例能够在一定程度上反应窖泥质量的好坏。窖泥中有机酸是作为合成浓香型白酒主要酯类的前体物质,在发酵过程中要控制乙酸和己酸的量,保证己酸乙酯和乙酸乙酯比例协调,因此在白酒生产和窖泥养护过程中都应该注意乙酸、己酸含量和比例。 本试验对窖泥四大酸(乙酸、丁酸、己酸、乳酸)含量进行检测,计算乙酸与己酸比例,并与酒厂的特级、优级和合格窖泥进行比较,结果见图2。
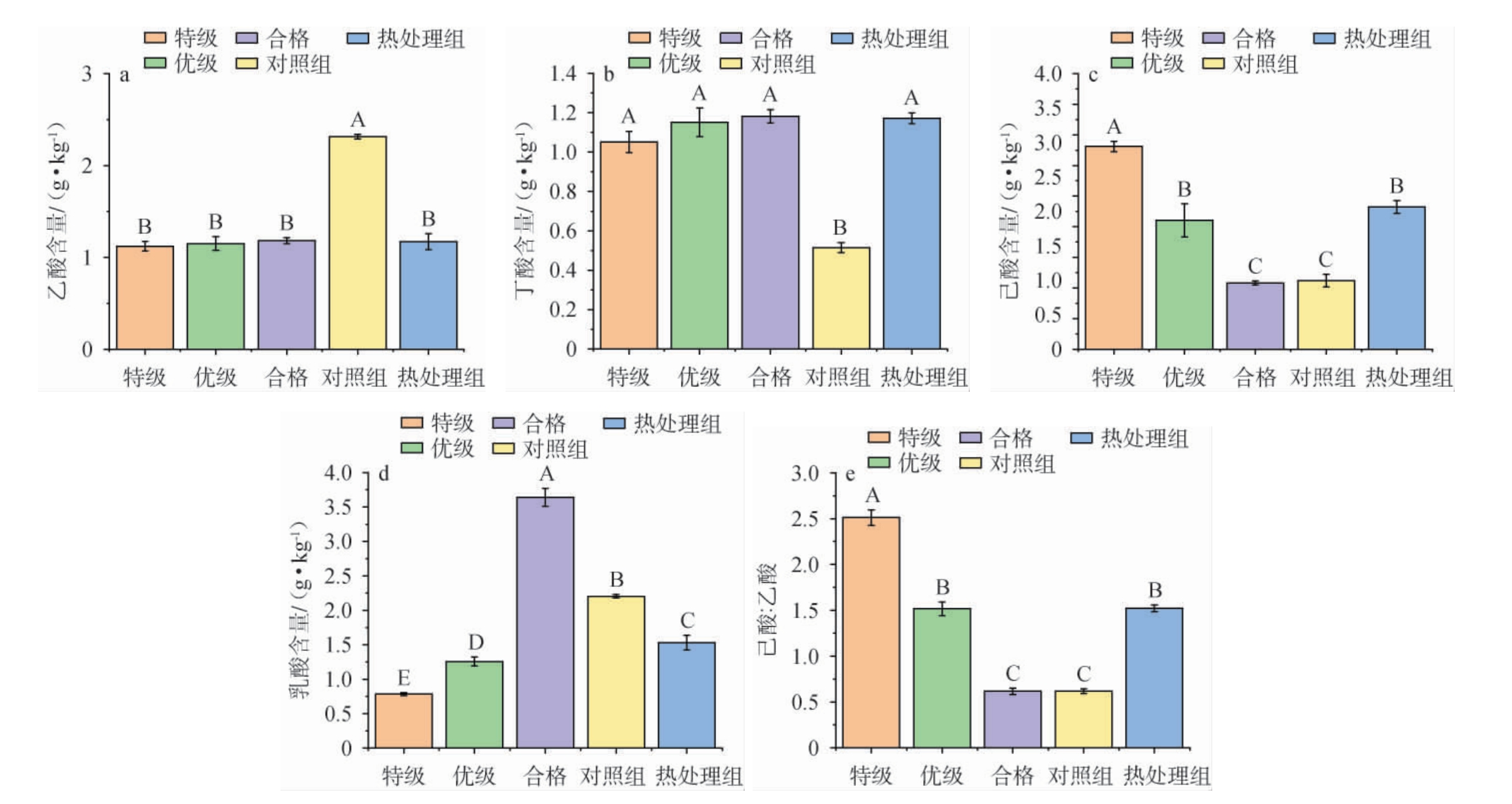
图2 试验窖泥和酒厂窖泥中主要酸类物质差异
Fig.2 Difference of main acids in test pit mud and distillery pit mud
不同大写字母表示差异显著(P<0.05)。
由图2a可知,热处理组与酒厂窖泥乙酸含量无显著差异(P>0.05),对照组乙酸含量显著高于其他4组(P<0.05)。由图2b可知,热处理组丁酸含量与酒厂窖泥无显著差异(P>0.05),但对照组丁酸含量显著低于酒厂窖泥(P<0.05)。由图2c可知,热处理窖泥己酸含量与酒厂优级窖泥无显著差异(P>0.05),对照组己酸含量与酒厂合格窖泥无显著差异(P>0.05),优级和特级窖泥己酸含量显著多于合格窖泥(P<0.05)。由图2d可知,对照组与热处理组乳酸含量差异显著(P<0.05),且这两组窖泥乳酸含量显著低于合格窖泥(P<0.05),但与优级和特级窖泥还有一定的差距。由图2e可知,热处理组与优级窖泥己酸:乙酸无显著差异(P>0.05),对照组与合格窖泥无显著差异(P>0.05),说明热处理后可以减少窖泥中产乙酸能够降低乙酸和乳酸含量,促进丁酸和己酸的生成,并且其己酸含量和己酸:乙酸能够达到某酒厂优级窖泥水平,可能是热处理使得不耐热的乳酸菌和乙酸菌在培养初数量减少,使得具有产己酸和丁酸功能的菌群在培养过程中生长繁殖处于优势地位。
2.4 热处理窖泥对白酒挥发性风味物质的影响
目前在浓香型白酒中已经发现了2 000多种风味物质,主要包括酸类、酯类、醇类、酮醛类以及少量的氨基酸,它们都对白酒风味产生了重要的作用[24]。利用GC-MS对对照组和热处理组人工窖泥所产基酒的挥发性风味物质进行分析,共检测出46种挥发性风味物质,其中醇类有8种,酯类26种,酸类8种,醛类2种,其他物质2种。 对不同处理的窖泥所产白酒挥发性风味物质进行偏最小二乘分析(partial least squares discriminant analysis,PLS-DA),结果见图3。
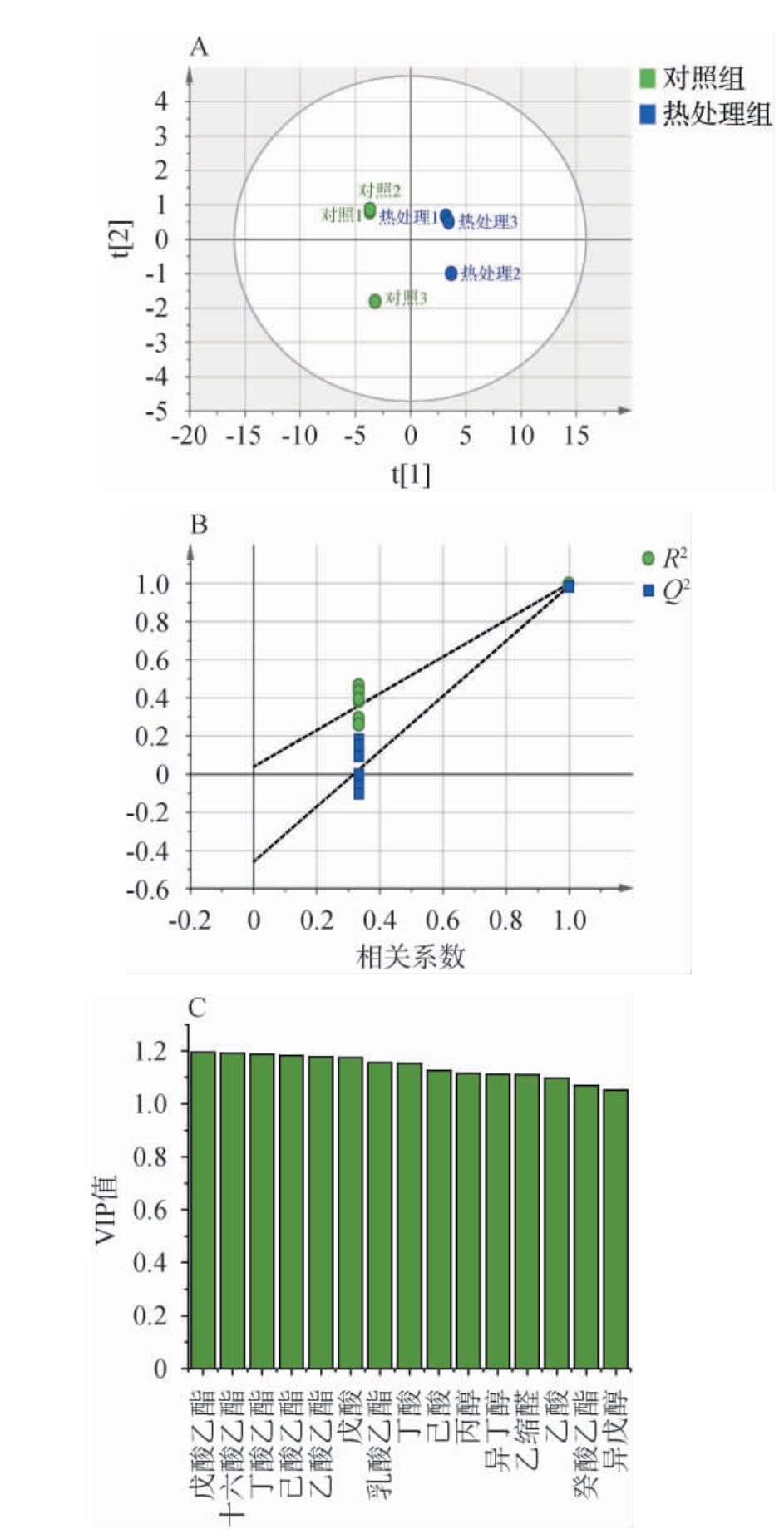
图3 挥发性风味物质偏最小二乘判别分析散点图(A)、置换检验结果(B)及变量重要性投影值(C)
Fig.3 Partial least squares-discriminant analysis scatter plot (A),permutation test results (B) and variable importance in the projection values (C) of volatile flavor compounds
由图3A可知,对照组位于X轴左侧,热处理组位于X轴右侧,本次分析中R2X为0.659,R2Y为0.996,模型预测系Q2为0.882,均>0.5,表明模型有较好的解释率和预测率,模型模拟结果可接受,说明两种酒样风味差异明显,PLS-DA能将不同处理的酒样进行区分。 此外,对其进行了随机分组200次的置换检验(图3B),其中Q2为-0.451,说明此模型具有有效性,不存在过拟合,模型验证有效;利用变量重要性投影(variable importance projection,VIP)值>1作为白酒关键差异化合物的筛选标准,筛选到了15个关键差异组分(图2C),分别为戊酸乙酯、十六酸乙酯、丁酸乙酯、己酸乙酯、乙酸乙酯、戊醇、乳酸乙酯、丁酸、己酸、丙醇、异丁醇、乙缩醛、乙酸癸酸乙酯、异戊醇。
对15种VIP>1的关键差异物质的含量进行显著性分析,结果见图4。
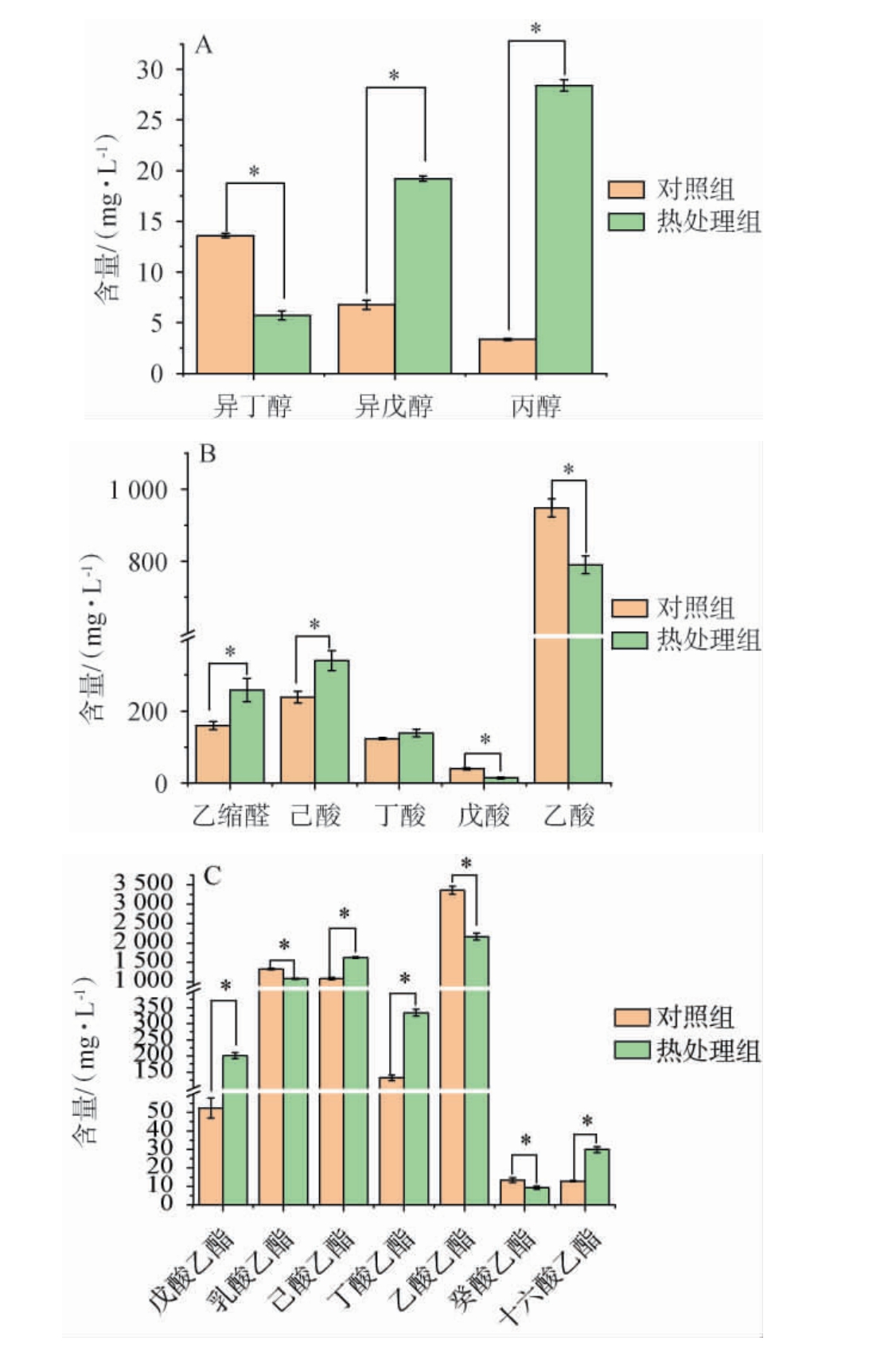
图4 热处理对白酒关键差异物质含量的影响
Fig.4 Effect of heat treatment on the content of key different substances in Baijiu
由图4A可知,热处理后具有甜苦味的异戊醇、较苦的丙醇含量显著上升(P<0.05),特苦的异丁醇含量显著下降(P<0.05)[25],说明经过热处理后的人工窖泥会降低某些杂醇,减少苦味;由图4B可知,窖泥热处理后白酒中的酸类物质除了赋予“窖香”味的丁酸含量差异不显著(P>0.05),乙酸和戊酸含量显著下降(P<0.05),形成关键香味的己酸含量增加(P<0.05)[26],乙缩醛含量也显著增加(P<0.05),说明热处理后的人工窖泥白酒在酸类方面能够起到增己降乙的作用;由图4C可知,对于浓香型白酒而言,己酸乙酯、乳酸乙酯、乙酸乙酯与丁酸乙酯是构成酒体的重要酯类,占到总酯含量的90%以上,对浓香型白酒风味起着重要作用[27],热处理后的人工窖泥能够显著减少白酒中的乙酸乙酯、乳酸乙酯和具有微甜口感和类似葡萄或白兰地的水果香气的癸酸乙酯(P<0.05),显著增加己酸乙酯、丁酸乙酯、戊酸乙酯和十六酸乙酯的含量(P<0.05),前3种酯的香气贡献在五粮液和剑南春中最为突出[28],而十六酸乙酯对白酒风味和滋味有着重要影响,说明热处理后的人工窖泥能够对酒体起着积极作。
3 结论
通过对人工窖泥进行热处理,使得发酵初期人工窖泥中不耐热微生物被部分杀灭,以期达到培养结束后窖泥中核心耐热微生物为优势菌群,提高窖泥理化质量,降低窖泥中乙酸和乳酸含量,提升己酸:乙酸的目的。比较热处理后的人工窖与对照组的理化指标及微生物数量差异,某酒厂窖泥(特级、优级、新窖)的四大酸和己酸乙酸之比以及两种窖池白酒风味差异,结果表明,经过热处理的人工窖泥其pH值、铵态氮含量、有效磷含量显著增加(P<0.05),好氧菌数量显著低于对照组(P<0.05),厌氧菌数量显著高于对照组(P<0.05),且其四大酸含量及己酸:乙酸达到了某酒厂优级窖泥水平;将对照组和热处理人工窖泥用于筑窖产酒,通过GC-MS对其基酒风味进行检测,共检测出46种挥发性风味物质,其中醇类有8种,酯类26种,酸类8种,醛类2种,其他物质2种。PLS-DA结果表明,这两种白酒有明显差异。根据VIP>1,筛选出白酒中关键差异化合物15种,通过定量分析,发现热处理后人工窖泥所产白酒中丙醇、异戊醇、己酸乙酯、丁酸乙酯、乙缩醛、己酸的含量有显著增加(P<0.05),乳酸乙酯、乙酸乙酯、乙酸的含量显著下降(P<0.05),说明热处理可以提升人工窖泥的质量。
[1]张应刚,许涛,郑蕾,等.窖泥群落结构及功能微生物研究进展[J].微生物学通报,2021,48(11):4327-4343.
[2]QIN D,SHEN Y,YANG S Q,et al.Whether the research on ethanol-water microstructure in traditional Baijiu should be strengthened[J].Molecules,2022,27(23):8290.
[3]ZHENG X W, HAN B Z. Baijiu, Chinese liquor: History, classification and manufacture[J].J Ethnic Foods,2016,3(1):19-25.
[4]冯潜,刘绪兴,文章,等.新老窖泥细菌群落结构差异及其对酿造白酒质量的影响[J].中国酿造,2021,40(9):128-133.
[5]靳喜庆,冯亮,张无疾,等.白酒人工窖泥培养方法研究进展[J].中国酿造,2024,43(7):7-13.
[6]马龙,林一心,尉军强,等.西北地区人工窖泥与老窖泥细菌群落结构差异[J].中国酿造,2023,42(11):104-108.
[7]LIU M K, LIU C Y, TTIAN X H, et al.Bioremediation of degraded pit mud by indigenous microbes for Baijiu production[J].Food Microbiol,2022,108:104096.
[8]LIU M K, TANG Y M, GUO X J, et al.Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J].Food Res Int,2017,102:68-76.
[9]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:7-8.
[10]张家庆.浓香型白酒窖泥养护与制曲关键技术研究[D].武汉:湖北工业大学,2015.
[11]WEI J L, NIE Y, DU H, et al.Serine improves lactic acid stress tolerance and ethanol production in Zygosaccharomyces bailii in Baijiu fermentation[J].J Agr Food Chem,2023,71(50):20295-20303.
[12]毛豪,王家胜,赵婷,等.酒醅及窖泥中乳酸菌的筛选及产酸特性研究[J].酿酒科技,2022(11):17-23.
[13]冯文聪,陈继威,夏博宇,等.产己酸微生物筛选及其在浓香型白酒窖泥养护中的应用研究[J].中国酿造,2024,43(11):41-45.
[14]张敏,郭敬,杨玉珍,等.窖泥中高产己酸功能菌的分离筛选及代谢功能的研究[J].酿酒科技,2020(6):56-60,64.
[15]曾波,邹永芳,饶家权,等.浓香型白酒窖底泥和窖壁泥细菌群落结构差异性分析[J].食品科学,2023,44(18):223-230.
[16]牟薏,卫春会,曾波,等.基于黄水线上下层酒醅及基酒的风味特征分析[J].食品与发酵工业,2024,50(19):321-330.
[17]姜雨函.不同配方人工窖泥的特性比较及应用研究[D].成都:四川大学,2021.
[18]雷翔云,沈小娟,丁海龙,等.浓香型白酒窖泥质量评价研究进展[J].酿酒,2024,51(2):9-13.
[19]朱莉莉,罗惠波,黄治国,等.浓香型白酒窖泥质量评价理化指标的筛选[J].中国酿造,2018,37(12):33-39.
[20]吴浪涛,丁文骏,谢专,等.不同时期窖泥理化因子、风味物质和细菌组成的相关性[J].微生物学通报,2022,49(3):1030-1047.
[21]卢萌萌,任聪,聂尧,等.白酒酿造窖泥未培养微生物菌群的可培养化策略[J].食品与发酵工业,2020,46(19):9-16.
[22]邹斐,叶力,冯亮,等.窖泥微生物多样性及窖泥评价与养护研究进展[J].食品科学,2024,45(16):320-328.
[23]贺雨杰,唐雨润,蒋小清,等.泸州产区浓香型白酒酿造微环境-风味相关性分析[J].中国酿造,2024,43(2):98-105.
[24]WANG P P,LI Z,QI T T,et al.Development of a method for identification and accurate quantitation of aroma compounds in Chinese Daohuaxiang liquors based on SPME using a sol-gel fibre[J].Food Chem,2015,169(4):230-240.
[25]王尹叶.白酒中挥发性呈苦和/或涩味物质研究[D].无锡:江南大学,2018.
[26]张方,张宿义,苏占元,等.有机酸对浓香型白酒品质及其酿造过程影响的研究进展[J].酿酒科技,2016(1):94-97,102.
[27]肖冬光.白酒酿造过程中酯类物质形成机理探讨[J].酿酒科技,2022(9):17-24.
[28]FAN W,QIAN M C.Characterization of aroma compounds of Chinese"Wuliangye"and"Jiannanchun"liquors by aroma extract dilution analysis[J].J Agr Food Chem,2006,54(7):2695-2704.