蜜柑鲜果及加工产品因其独特风味和丰富营养价值广受欢迎[1]。我国新余市2024年蜜橘总产量约24万t,石门县蜜橘销量突破21万t。 从全球范围来看,蜜柑年产量、消费量稳步上升。然而,蜜柑鲜食存在诸多问题,部分人群食用后易过敏,过量食用还会消化不良[2]。蜜柑在室温下还易腐烂变质,难于储存和运输[3-4]。 为降低鲜果损耗并提升附加值,蜜柑加工已涵盖罐头、果汁、果茶、果酒、果醋等多个领域[5]。其中,蜜柑酒在美国、欧洲和亚洲市场消费量持续增长,全球市场份额迅速扩大[6]。
蜜柑果胶含量高,可达119.97 mg/g[7]。加工过程中,果肉压碎后因高果胶呈现高黏性,显著降低果汁出汁率[8]。因此,果胶酶在果酒酿造过程中被广泛应用[9]。果胶酶是一类能够分解果胶类物质的复合酶,主要包括果胶甲酯酶(pectin methyl esterase,PME)、果胶乙酰酯酶(pectin acetyl esterase,PAE)、果胶裂解酶(pectin lyase,PL)和聚半乳糖醛酸酶(polygalacturonase,PG)[10-11]。虽然果胶酶能够通过分解果胶提高果汁产量,但其使用会显著增加果酒中的甲醇含量[12]。其中,PME催化果胶甲酯键脱酯化,形成果胶酸与甲醇,是果酒中甲醇的主要生成途径[13]。甲醇危害人体健康,刺激呼吸道黏膜组织,严重时可致呼吸衰竭[14],对眼部毒性大,会影响视网膜代谢、破坏视觉神经细胞,甚至造成永久性失明[15]。 鉴于甲醇的危害性,国际葡萄与葡萄酒组织(International Vine and Wine Organization,OIV)规定,红葡萄酒中甲醇含量不得超过400 mg/L,白葡萄酒或桃红葡萄酒中甲醇含量不得超过250 mg/L[16]。 柑橘酒(蜜柑酒)通常参考葡萄酒标准。
果胶酶的应用已成为提升果酒品质的重要手段。在葡萄酒、苹果酒、梨酒等果酒酿造研究中,果胶酶能提升果汁出汁率、促进色素及风味物质溶出[17]、降低体系黏度、提高澄清度、缩短酿造周期[18],效果显著且理论与实践体系相对成熟。但这些研究多聚焦果胶酶对果酒品质指标的正向调控,忽视了其引发的甲醇生成问题[19]。实际生产中,果酒甲醇含量偏高的现象普遍存在,部分采用常规果胶酶酿造的果酒甲醇含量甚至超出国家标准限定值[20]。在此背景下,开发低PME活性果胶酶用于果酒酿造的研究尤为重要。
该研究使用低PME活性果胶酶生产蜜柑酒,以不添加果胶酶组及添加两种市售商品果胶酶组作为对照,通过测定果汁、经过果胶酶处理前后的成品酒中甲醇含量、果汁出汁率、澄清度,以及果酒的理化性质、总酚、总黄酮含量、抗氧化性和感官特性等指标,深入探究低PME活性果胶酶对蜜柑酒甲醇含量及综合品质的影响。为提升蜜柑酒的市场竞争力,推动蜜柑以及其他高果胶含量水果的加工生产提供支持。
1 材料与方法
1.1 材料与试剂
蜜柑:大连市本地农贸市场;WP果胶酶:实验室保藏的贝莱斯芽胞杆菌(Bacillus velezensis)WP菌株制备并纯化[21](其果胶甲酯酶活性为(0.59±0.11)U/mL);酿酒酵母(Saccharomycescerevisiae)SY:湖北宜昌安琪酵母有限公司。
FDY-2212夏盛商品果胶酶(10 000 U/g):北京夏盛生物科技开发有限公司;Pectinex Ultra Clear诺维信果胶酶(30 000 U/g):诺维信生物技术有限公司;乙醇酶膜、生物缓冲液:山东省科学院生物研究所;食用葡萄糖、氢氧化钠、酚酞(均为分析纯):天津市大茂化学试剂有限公司;偏重亚硫酸钾、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)、2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)(均为分析纯):上海阿拉丁生化科技股份有限公司;氯化铝(分析纯)、维生素E、没食子酸(均为色谱纯)、福林酚(分析纯):上海麦克林生化科技有限公司;芦丁(纯度>98%):上海源叶生物科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):索莱宝科技(北京)有限公司。
1.2 仪器与设备
GC2030岛津气相色谱仪:日本SHIMAZU公司;Infinite M200多功能酶标仪:瑞士TECAN公司;CR22N冷冻高速离心机:日本Hitachi公司;HSU-32手持式折射仪:精密科学仪器有限公司;FE-28pH计:梅特勒-托莱多国际贸易有限公司;SBA-90三通道生物传感分析仪:山东科学院生物研究所;WBL2501B美的水果榨汁机:美的集团股份有限公司。
1.3 方法
1.3.1 蜜柑果酒发酵工艺流程及操作要点

操作要点:选取成熟度良好的蜜柑,去除橘皮后切半,使用电动榨汁机打浆制得蜜柑果浆。添加食品级葡萄糖调节可溶性固形物含量至18.00 °Bx,并添加偏重亚硫酸钾使SO2质量浓度达到60 mg/L。将200 mL蜜柑汁分装至250 mL无菌玻璃瓶,于97 ℃条件下进行巴氏灭菌1 min,冷却至24 ℃。添加果胶酶,果胶酶用量为6 000 U/L,酶解条件为50 ℃、4 h,酶解后过滤,测定出汁率及发酵前甲醇含量。 冷却至24 ℃后,以1%接种量接种活化好的酿酒酵母S.cerevisiae SY,于24 ℃恒温发酵。发酵过程中每日监测可溶性固形物含量及CO2质量损失,当连续3 d可溶性固形物及CO2质量损失<0.2 g/d时终止发酵。发酵结束后,蜜柑果酒于8 000 r/min离心10 min,上清液于-20 ℃储存待测。
1.3.2 实验设置
实验设置4组样品,每组包含3个平行样品,具体分组如下:①不添加果胶酶组(NP);②添加诺维信(Novozymes)公司果胶酶组(NW);③添加北京夏盛酶技术有限公司果胶酶组(XS);④添加贝莱斯芽胞杆菌(B.velezensis)WP果胶酶组(WP)。 各组果胶酶添加量均调整为6 000 U/L。WP、XS和NW的果胶甲酯酶活性分别为(0.59±0.11)U/mL、(7.73±1.04)U/mL和(13.37±0.71)U/mL。
1.3.3 理化指标测定
CO2质量损失的测定:发酵过程中每24 h测定蜜柑果酒质量并记录数据,计算CO2释放量;可溶性固形物含量(soluble solids content,SSC)测定:使用手持式折射仪测定;可滴定酸度(totalacid,TA):参考GB/T 12456—2021《酸碱指示剂滴定法》测定;乙醇含量:采用三通道生物传感分析仪测定[22];还原糖含量:采用3,5-二硝基水杨酸法测定[23]。
1.3.4 出汁率和澄清度测定
(1)果汁出汁率的测定
果汁出汁率为蜜柑果汁量与所占水果总量的比例,通常以百分比表示。果汁出汁率计算公式如下:

(2)澄清度的测定
以蒸馏水为参比,使用多功能微孔板读取仪测量蜜柑汁样品在波长680 nm处的吸光度值。 澄清度以吸光度值(×100%)表示。
1.3.5 甲醇含量测定
甲醇含量测定参考李惠民等[24]的方法并稍作修改。顶空参数:平衡温度为80 ℃,平衡时间为40 min,传输线温度为105 ℃,定量环温度为100 ℃。 气相色谱条件:色谱柱为HP-FFAP(30 m×0.32 mm×0.25 μm);载气为高纯氦气(He),流速为2 mL/min。进样口温度和检测器温度分别为220 ℃和235 ℃;分流比为29.8∶1;分流流量为24 mL/min。 温度程序:40 ℃保持3 min,以3.5 ℃/min的速率升温至65 ℃,再以20 ℃/min升温至220 ℃保持5 min。
1.3.6 总酚和总黄酮含量测定
总酚含量测定参考福林酚比色法[25],结果以每升样品中没食子酸当量(gallic acid equivalent,GAE)表示;总黄酮含量测定参考氯化铝比色法[26],结果以每升蜜柑酒中的芦丁当量(rutin equivalent,RE)表示。
1.3.7 抗氧化活性测定
蜜橘果酒的抗氧化活性通过测定DPPH和ABTS自由基清除能力进行评估,DPPH和ABTS自由基清除能力测定参考章慧等[27]的方法。 DPPH自由基清除能力以每升蜜柑酒中没食子酸当量表示,ABTS自由基清除能力以每升蜜柑酒中维生素E当量(tocopherol equivalent,TE)表示。
1.3.8 感官评价
感官评价参考胡亚康等[28]的方法稍作修改。每组样品随机分配到酒杯中。采用五分制对口感、香气、色泽、可接受性、酸甜适宜性进行评价,评分标准为:1=非常弱,2=弱,3=中等,4=强,5=很强。
1.3.9 数据分析
所有实验均设置3次平行,结果以“平均值±标准偏差”表示。 实验数据使用SPSS 27.0进行统计分析,采用单因素方差分析和邓肯检验确定各组间的显著差异,当P<0.05时,认为结果具有统计学意义。使用GraphPad Prism 9和Origin 2021绘图。
2 结果与分析
2.1 发酵动力学
蜜柑果酒发酵过程中CO2质量损失及可溶性固形物含量的动态变化结果见图1。 由图1A可知,在发酵初期(第1~4天),CO2质量损失迅速增加,表明发酵速率较高,第4天后,CO2质量损失变化逐渐趋于稳定。 由图1B可知,可溶性固形物含量(SSC)在前4 d内从18.00°Bx迅速下降至5.93~6.07°Bx。 第4天后,SSC变化逐渐趋于稳定,表明发酵速率显著降低。这一现象与酿酒酵母通过糖酵解和丙酮酸发酵途径将糖转化为乙醇和CO2的过程密切相关,导致大量乙醇和CO2释放到发酵环境中。第9天发酵结束,蜜柑果酒的SSC稳定在5.53~5.70°Bx范围内。 与未添加果胶酶的NP组相比,添加果胶酶组的CO2质量损失更高,SSC更低,表明其对糖的利用更为充分,这与DIANO N等[29]的研究结果一致。
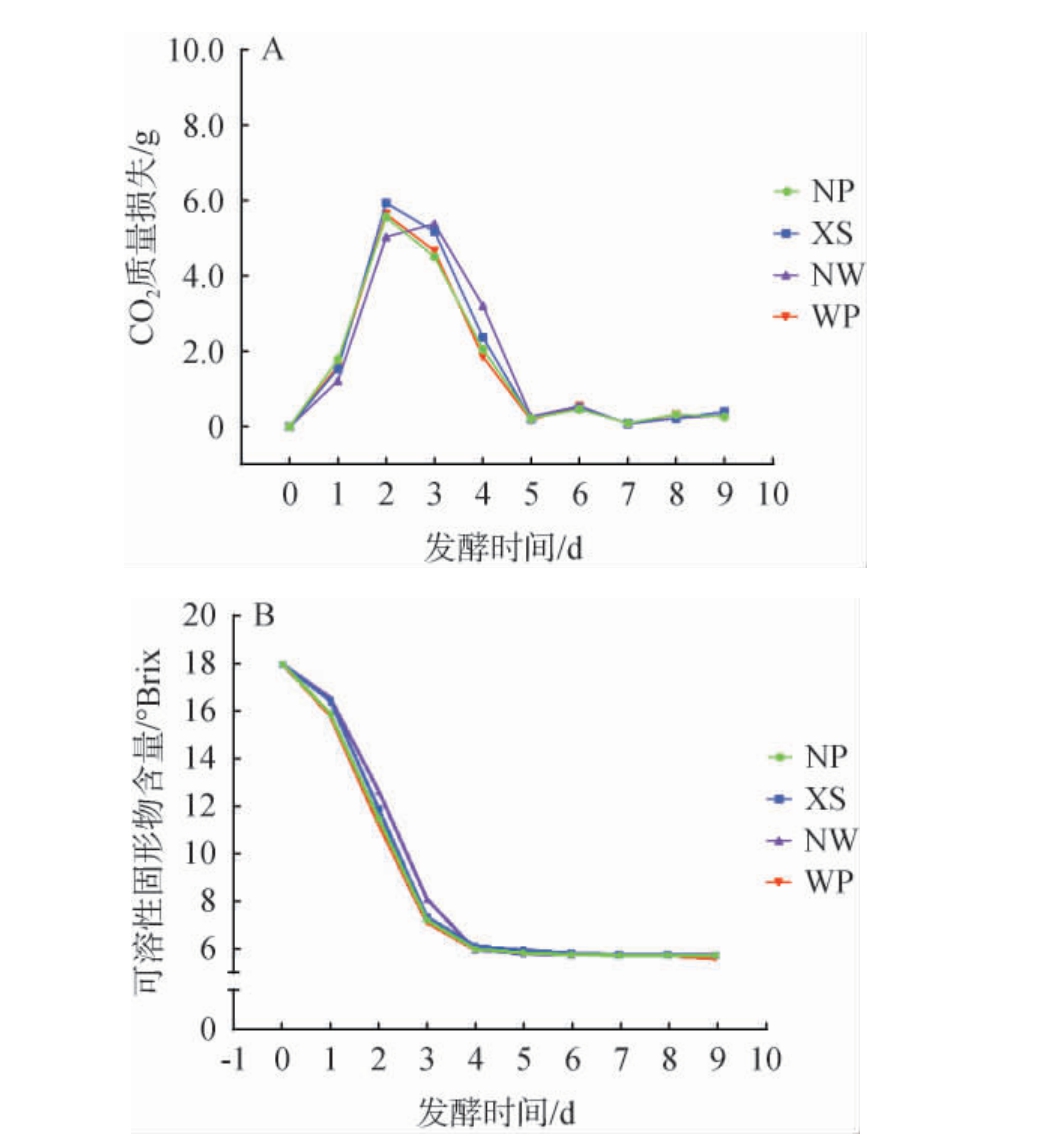
图1 蜜柑果酒发酵过程中二氧化碳质量损失(A)和可溶性固形物含量(B)变化趋势
Fig.1 Changing trends of carbon dioxide mass loss (A) and soluble solids contents (B) during fermentation process of mandarin fruit wine
综上,蜜柑果酒发酵前4天CO2损失迅速增加,SSC从18.00°Bx迅速下降至5.93~6.07°Bx,4 d后二者变化趋于稳定,说明底物消耗与产物生成达平衡,可以作为发酵终点的标准。此外,添加果胶酶组CO2损失更高、SSC更低,也说明了果胶酶能够有效提升糖的利用率。
2.2 理化指标
蜜柑果汁及果酒的理化指标测定结果见表1。由表1可知,未发酵的蜜柑汁乙醇含量为(0.35±0.07)%,发酵后,未添加果胶酶的NP组乙醇含量(7.69±0.17)%,显著低于添加果胶酶的各组(P<0.05),这表明NP组的可发酵糖利用率较低,影响了酒精生成效率。相比之下,添加XS果胶酶的乙醇含量最高(9.54±0.10)%,这归因于XS的高效酶解作用,更充分地释放了果胶中的半乳糖醛酸甲酯和果胶多糖,为酵母提供了更丰富的可发酵底物[30]。NW、WP果胶酶处理组的乙醇含量虽不及XS组,但仍显著高于NP组(P<0.05),显示出其在促进酒精发酵方面的潜力。
表1 蜜柑果汁和4种蜜柑果酒的理化指标
Table 1 Physicochemical indexes of mandarin fruit juice and four types of mandarin fruit wines

注:同一指标中上标字母不同表示数值差异显著(P<0.05)。下同。
参数 蜜柑果汁乙醇含量/%pH总酸/(g·L-1)还原糖/(g·L-1)可溶固形物/°Bx CO2质量损失/g蜜柑果酒NP XS NW WP 0.35±0.07e 4.12±0.01a 3.88±0.10c 139.05±1.11a 12.30±0.36a—7.69±0.17d 3.72±0.01b 5.16±0.10b 2.56±0.19b 5.67±0.06b 15.24±0.57b 9.54±0.10a 3.68±0.01c 5.40±0.04a 2.64±0.17b 5.67±0.06b 16.42±0.64a 9.24±0.55b 3.72±0.01b 5.06±0.13b 2.38±0.07b 5.70±0.10b 16.25±0.04a 8.43±0.09c 3.70±0.01c 5.16±0.10b 2.19±0.09b 5.53±0.15b 15.15±0.60b
发酵组的pH值均低于蜜柑果汁组,总酸含量则高于原果汁,这反映了发酵过程中有机酸的积累。XS组pH值最低(3.68±0.01),总酸含量最高(5.40±0.04)g/L,可能是由于更完全的发酵代谢或果胶酶作用释放出更多酸性物质。NP组的pH值(3.72±0.01)和总酸含量(5.16±0.10)g/L介于果汁和XS组之间,表明其酸度变化相对温和。NW组和WP组的pH值和总酸含量与NP组相近,表明NW、WP果胶酶对发酵体系酸度的影响相对较小。
还原糖的消耗是评估发酵程度的另一重要指标。发酵组的还原糖含量均显著低于果汁(P<0.05),表明糖类被有效利用。值得注意的是,NW组和WP组的还原糖残留量甚至略低于NP组和XS组,这表明WP果胶酶在促进底物中糖类更完全地转化为乙醇或其他代谢产物方面可能具有更佳的表现。
未发酵的蜜柑果汁可溶性固形物含量为(12.30±0.36) °Bx,显著高于各发酵组(P<0.05),表明发酵过程中糖类等物质被消耗,导致可溶固形物降低。发酵后,NP、XS、NW、WP组可溶固形物含量稳定在5.53~5.70°Bx范围内。与未添加果胶酶的NP组相比,添加果胶酶WP组的SSC更低,表明其对糖的利用更为充分[31]。
CO2质量损失与发酵过程中酵母代谢产气量相关,能够间接反映发酵活跃程度。 与未添加果胶酶的NP组相比,发酵组中添加果胶酶的XS和NW组的CO2质量损失更高,表明果胶酶处理会促进底物的释放,提高酵母发酵代谢的强度,进而导致CO2质量损失增加[32]。
综上,果胶酶的添加能够促进糖利用,从而提升发酵速率。其中市售果胶酶XS在提升乙醇含量方面效果较好,而WP果胶酶可以降低乙醇含量,表明WP果胶酶具有开发低醇果酒的潜力;此外,WP果胶酶酸度和pH适宜。因此,果胶酶的添加能够影响蜜柑果酒的理化指标,其中WP对蜜柑酒的具有积极的影响作用。
2.3 果汁出汁率和澄清度
不同果胶酶处理蜜柑果汁的出汁率和澄清度测定结果见图2。由图2可知,经过果胶酶处理后,蜜柑果汁的出汁率均显著提升(P<0.05)。 未添加果胶酶的NP组出汁率为(52.53±0.58)%,而WP果胶酶处理的蜜柑果汁出汁率达到(74.45±1.03)%,显著高于市售果胶酶XS组(69.14±0.21)%和NW组(71.76±0.29)%(P<0.05),比未添加果胶酶的对照组高出21.87%。果胶酶通过分解植物细胞壁上的多糖基质,增加汁液的自流性;将果胶分解成小分子化合物,软化果肉组织;降低果肉黏度,改善破碎性能,从而提高出汁率[33]。
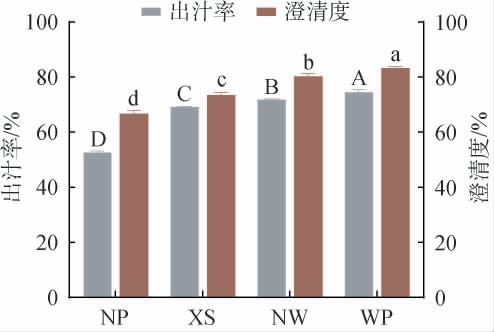
图2 不同果胶酶处理蜜柑果汁的出汁率和澄清度
Fig.2 Juice yield and clarification of mandarin fruit with different pectinases treatment
不同大写或小写字母代表不同指标间差异显著(P<0.05)。下同。
在澄清度方面,未添加果胶酶的NP组为(66.59±1.14)%,而WP处理组的果汁澄清度达到(83.16±0.58)%,显著高于XS组(73.44±1.01)%和NW组(80.23±1.01)%(P<0.05),比未添加果胶酶的对照组高出16.57%。
综上,果胶酶能显著提升蜜柑果汁出汁率和澄清度,改善果汁品质,其中WP组出汁率达(74.45±1.03)%,澄清度达(83.16±0.58)%,均显著优于其他组,表明果胶酶WP提高果汁产量和澄清度能力最显著。
2.4 甲醇含量
蜜柑果汁和蜜柑果酒的甲醇含量测定结果见图3。 由图3可知,蜜柑果汁经过果胶酶酶解后(0 d),甲醇含量显著上升(P<0.05)。未发酵时,未添加果胶酶的NP组果汁甲醇含量为(15.50±0.99)mg/L,而经过果胶酶处理的果汁甲醇含量均显著增加(P<0.05),这与ZHANG H等[34]的研究结果一致。其中,WP处理的果汁甲醇含量为(16.85±0.92)mg/L,显著低于XS组[(35.85±0.64)mg/L]和NW组[(25.20±0.57)mg/L](P<0.05),分别降低了53.00%和33.13%的甲醇生成,表明低果胶酯酶活性的WP果胶酶能够有效降低甲醇的生成。
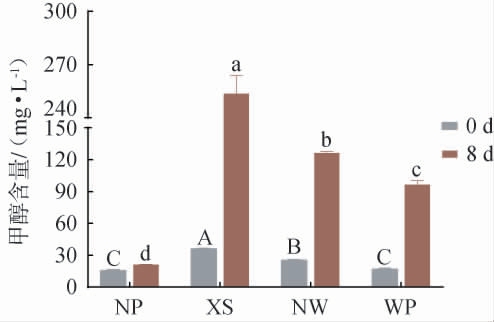
图3 四种蜜柑果酒发酵前后甲醇含量
Fig.3 Methanol contents of four mandarin wines before and after fermentation
发酵8 d后,WP处理的果酒甲醇含量仅为(96.55±3.61)mg/L。由于WP果胶酶的果胶甲酯酶活性较低,其甲醇主要来源于果酒发酵时S.cerevisiae SY的代谢作用。 相比之下,市售果胶酶XS组[(253.55±10.25)mg/L]和NW组[(126.20±1.84)mg/L]的甲醇含量显著更高(P<0.05),其中XS组甚至超出了OIV规定的白葡萄酒或桃红葡萄酒甲醇含量不得超过250 mg/L的标准。WP组果酒的甲醇含量远低于OIV标准,相比XS和NW组分别低61.91%和23.49%。
果酒中的甲醇主要来源于果胶的分解。市售果胶酶XS和NW由于果胶甲酯酶活性较高,能够催化果胶中半乳糖醛酸聚糖线性链C-6处的甲酯键水解,导致甲醇和质子的释放[35]。而WP果胶酶的PME活性较低,在酶解处理过程中极大减少了甲醇的释放。因此,WP果胶酶在蜜柑果汁加工和蜜柑酒生产中的应用中可显著降低甲醇含量,提高产品的安全性。
2.5 总酚和总黄酮含量
蜜柑果汁和四种蜜柑果酒的总酚和总黄酮含量测定结果见图4。由图4可知,蜜柑果酒中的总酚和总黄酮含量较果汁显著降低(P<0.05),这一发现与QI Y M等[36]的研究结果相一致。具体而言,蜜柑果酒的总酚含量在1 029.80~1 465.01 mg GAE/L范围内,其中WP处理组的总酚含量最高[(1 465.01±16.10)mg GAE/L],显著高于NP组[(1 029.80±25.18)mg GAE/L]、XS组[(1 256.73±19.21) mg GAE/L]和NW组[(1 341.64±10.66)mg GAE/L](P<0.05)。类似地,果酒中的总黄酮含量在92.78~153.95 mg GAE/L之间,其中WP处理组[(153.95±3.34)mg GAE/L]同样表现出最高的黄酮含量。 结果表明,经果胶酶处理的果酒其总酚和总黄酮含量均显著高于未酶解组(NP),这一现象可能归因于果胶酶能够更有效破坏果肉组织结构,从而促进细胞壁中类黄酮的释放[37]。果胶酶处理能够通过分解果胶物质,将聚合态多酚转化为生物可利用性更高的游离态多酚[38]。
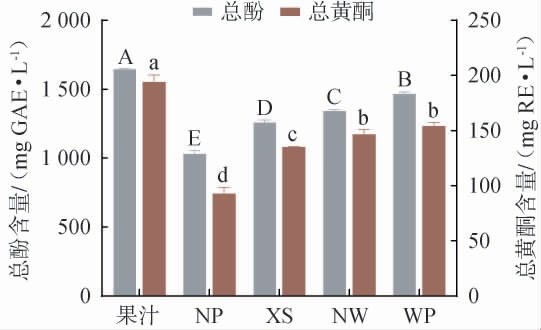
图4 蜜柑果汁和四种蜜柑果酒总酚和总黄酮含量
Fig.4 Total phenolic and total flavonoid contents of mandarin fruit juice and four mandarin wines
2.6 抗氧化性结果分析
蜜柑果汁及其果酒的DPPH自由基及ABTS自由基清除能力测定结果见图5。
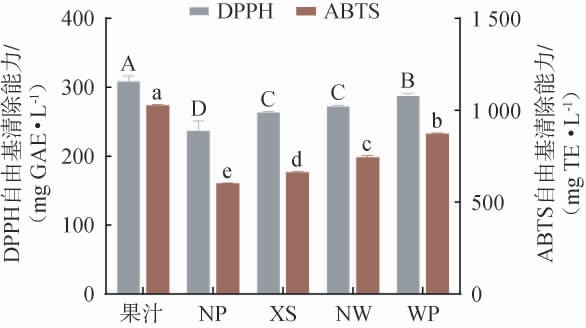
图5 蜜柑果汁和四种蜜柑果酒ABTS和DPPH自由基清除能力
Fig.5 ABTS and DPPH free radical scavenging abilities of mandarin fruit juice and four mandarin wines
由图5可知,蜜柑果汁和不同果胶酶处理组果酒的抗氧化活性存在显著差异(P<0.05)。未发酵的蜜柑果汁组DPPH和ABTS自由基清除能力分别为(305.22±7.59)mg GAE/L、(1026.37±4.61)mgTE/L。未添加果胶酶时,果胶难以被充分降解,导致细胞壁结构保持完整。这会阻碍细胞内多酚类物质(如花青素、黄酮、单宁等)的释放,而这些化合物正是果酒抗氧化活性的主要来源[39]。在发酵果酒组中,WP组蜜柑酒的DPPH和ABTS自由基清除能力分别为(287.25±3.15)mgGAE/L和(872.46±4.50)mg TE/L,显著高于其他处理组果酒(P<0.05),这一现象可能与WP果胶酶处理能够有效降解细胞壁结构,促进抗氧化物质的释放和保留有关[40]。综上所述,蜜柑果酒发酵前添加果胶酶处理能够显著提高蜜柑果酒的DPPH和ABTS自由基清除能力,WP果胶酶对果酒的抗氧化性的提升最显著。
2.7 感官分析与评价
蜜柑果汁和4种蜜柑果酒口感、色泽、香气、可接受性以及酸甜适宜性的感官评定结果见图6。由图6可知,不同果胶酶处理组的蜜柑果酒在各项感官指标上存在差异。WP组在各项感官指标上均表现最佳,其中口感(3.83分)、色泽(4.38分)和酸甜适宜性(3.89分)评分高于其他组,表明WP果胶酶处理的蜜柑果酒在风味和外观品质上具有明显优势。 相比之下,NP组在口感和可接受度方面评分较低(分别为2.22分和2.56分),表明未添加果胶酶的果酒在感官品质上存在一定缺陷。XS和NW组的感官评分介于NP和WP组之间,其中NW组在香气方面表现较好(3.5分),但整体评分仍低于WP组(3.61分)。综上所述,WP果胶酶处理显著提升了蜜柑果酒的感官品质,尤其是在口感、色泽和酸甜适宜性方面表现突出。
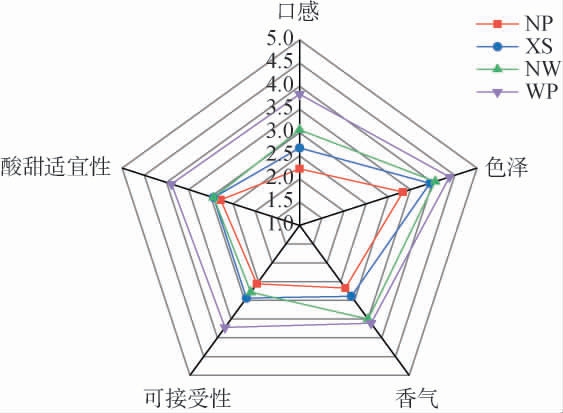
图6 四种蜜柑果酒感官评价结果
Fig.6 Sensory evaluation results of four mandarin fruit wines
3 结论
为考察贝莱斯芽胞杆菌(Bacillus velezensis)产的低果胶甲酯酶活性果胶酶(WP)在蜜柑果酒发酵中的应用,该研究比较了添加WP组与不添加果胶酶组(NP)及添加市售果胶酶组(XS、NW)蜜柑果汁出汁率、澄清度,果酒及果汁的理化指标、甲醇含量、总酚与总黄酮含量、抗氧化活性和感官评价等的差异。研究发现,具有低果胶酯酶活性的WP果胶酶在蜜柑果酒发酵应用中,不仅在提高果汁出汁率和澄清度方面具有显著的提升效果,而且显著降低了果胶酶处理后的果汁及成品果酒中的甲醇含量,极大减少了甲醇的生成,同时表现出良好的抗氧化性,有效保留了蜜柑原有风味与营养成分,在感官评价中口感、色泽和酸甜适宜性方面也表现突出;证明了应用低果胶甲酯酶活性的果胶酶能够成功酿造出低甲醇、高品质的蜜柑酒,有效提升蜜柑酒的综合品质;为蜜柑酒及蜜柑果汁加工的安全性提供了技术支撑,也将为低甲醇、高品质果酒的研发以及其他高果胶含量水果的加工提供重要参考依据。
[1]冉梦阳.柑橘果汁营养保价值评价及其膳食风险评估研究[D].重庆:西南大学,2022.
[2]李岩,姚鑫洁.饮食因素对功能性消化不良的影响[J].中国中西医结合消化杂志,2023,31(10):747-750.
[3]GAO Y,KAN C,CHEN M,et al.Effects of chitosan-based coatings enriched with cinnamaldehyde on mandarin fruit cv.ponkan during roomtemperature storage[J].Coatings,2018,8:372.
[4]ZHONG Y,CHENG C,JIANG B,et al.Digital gene expression analysis of Ponkan mandarin (Citrus reticulata Blanco) in response to Asia citrus psyllid-vectored Huanglongbing infection[J].Int J Mol Sci, 2016, 17:1063.
[5]方修贵.柑橘加工实用技术[M].北京:中国农业出版社,2023:5-10.
[6]SELLI S, CANBAS A, VARLET V, et al.Characterization of the most odor-active volatiles of orange wine made from a Turkish cv.Kozan(Citrus sinensis L.Osbeck)[J].J Agr Food Chem,2008,56:227-234.
[7]HOANG B, NGO T, TRAN T, et al.Biological activity and pectin content in orange, lemon, tangerine, grapefruit and kumquat peels in Vietnam[J].Asian J Chem,2023,36(1):255-262.
[8]GONZALES E A,AGRASAR A T,CASTRO L P.Production and characterization of distilled alcoholic beverages obtained by solid-state fermentation of black Mulberry(Morus nigra L.) and Black Currant (Ribes nigrum L.)[J].J Agr Food Chem,2010,58:2529-2535.
[9]ANDREA O,ENCARNA G,PAULA P,et al.Revisiting the use of pectinases in enology:A role beyond facilitating phenolic grape extraction[J].Food Chem,2022,372:131282.
[10]罗钰,刘咏雪,付杨楠,等.绿茶天然果胶的酶法提取及其组成、结构与性质[J].中国食品学报,2024,24(1):160-168.
[11]GWANPUA S G, VERLINDEN B E, HERTOG M, et al.A transcriptomics-based kinetic model for enzyme-induced pectin degradation in apple(Malus×domestica)fruit[J].Postharvest Biol Technol,2017,130:64-74.
[12]CABAROGLU T.Methanol contents of Turkish varietal wines and effect of processing[J].Food Control,2005,16:177-181.
[13]宿智聪,杜金华.皂土、硫酸处理对苹果汁发酵过程中果胶甲酯酶活性以及苹果蒸馏酒甲醇含量的影响[J].中国酿造,2022,41(8):149-155.
[14]刘思琪,吴正云,刘巧,等.发酵酒和蒸馏酒中甲醇的研究进展[J].中国酿造,2025,44(2):1-6.
[15]张志兵.苹果蒸馏酒中甲醇含量及香气成分研究[D].杨凌:西北农林科技大学,2022.
[16]EELLS J T,MCMARTIN K E,BLACK K,et al.Formaldehyde poisoning:rapid metabolism to formic acid[J].JAMA,1981,246(11):1237-1238.
[17]董书甲,任辉,刘露,等.葡萄酒酿造中常用辅料及应用研究[J].安徽农业科学,2024,52(22):1-7,19.
[18]郝倩,邓乾春,周彬,等.植物细胞壁多糖高效酶解技术及其在食品加工中应用研究进展[J].食品科学,2024,45(12):304-314.
[19]熊双.猕猴桃复合酒的制作工艺优化及品质变化分析[D].重庆:重庆三峡学院,2025.
[20]李浩正.山楂发酵酒中甲醇降低的技术研究[D].泰安:山东农业大学,2024.
[21]WEI X,HAO J,XIONG K,et al.Effect of pectinase produced by Bacillus velezensis W17-6 on methanol content and overall quality of kiwifruit wine[J].Food Biosci,2024,59:104180.
[22]QIU S, CHEN K, LIU C, et al.Non-Saccharomyces yeasts highly contribute to characterisation of flavour profiles in greengage fermentation[J].Food Res Int,2022,157:111391.
[23]刘玉成,张俊琴.沙棘果酒低温发酵还原糖指标的动力学研究[J].酿酒科技,2022(6):26-29.
[24]李惠民,冯锁民,张博,等.气相色谱法测定桑葚酒中甲醇限度及乙醇含量[J].中国食品添加剂,2019,30(7):204-208.
[25]钟轲,肖建,汤晓宏,等.非酿酒酵母对脐橙果酒品质的影响[J].中国酿造,2025,44(1):148-155.
[26]WU Y, XU L, LIU X, et al.Effect of thermosonication treatment on blueberry juice quality: Total phenolics, flavonoids, anthocyanin, and antioxidant activity[J].LWT-Food Sci Technol,2021,150:112021.
[27]章慧,宋林东,张梦璐,等.8种发酵型果酒的抗氧化活性和风味物质研究[J].中国酿造,2024,43(1):159-116.
[28]胡亚康,何永艳,王发明.探讨不同工艺条件对猕猴桃果酒感官评价的影响[J].酿酒科技,2019(1):65-70.
[29]DIANO N,GRIMALD T,BIANCO M,et al.Apple juice clarification by immobilized pectolytic enzymes in packed or fluidized bed reactors[J].J Agr Food Chem,2008,56(23):11471-11477.
[30]谷艺明.果胶酶高产菌株的筛选、发酵优化及酶学性质的研究[D].常州:常州大学,2021.
[31]张龙,邓娜娜,周存山.桑椹酒质量安全控制技术研究进展[J].中国酿造,2022,41(10):8-12.
[32]梁韦武,张治婷,黄旭泉,等.低甲醇含量百香果果皮果酒酵母菌的筛选及鉴定[J].中国酿造,2025,44(2):115-120.
[33]任曼妮,姜辰昊,彭中兰,等.果胶酶处理对花红清汁出汁率和澄清度的影响[J].食品工业,2019(6):47-50.
[34]ZHANG H,WOODAMS E E,HANG Y D,et al.Influence of pectinase treatment on fruit spirits from apple mash,juice and pomace[J].Process Biochem,2011,46(10):1909-1913.
[35]JOLIE R P, DUVETTER T, LOYE A M, et al.Pectin methylesterase and its proteinaceous inhibitor:A review[J].Carbohydr Res,2010,345:2583-2595.
[36]QI Y M,LIU M M,YANG K,et al.Effect of skin maceration treatment on aroma profiles of kiwi wines elaborated with Actinidia deliciosa"Xuxiang"and A.chinensis"Hort16A"[J].J AOAC Int,2019,102(2):683-685.
[37]OSZMIANSKI J,WOJDYLO A,KOLNIAK J.Effect of pectinase treatment on extraction of antioxidant phenols from pomace,for the production of puree-enriched cloudy apple juices[J].Food Chem,2011, 127:623-631.
[38]高建德,朱晓玉,宋开蓉,等.星点设计-效应面法优化果胶酶酶解提取枸杞总黄酮的工艺[J].中药材,2017,40(2):421-424.
[39]卫晓涵,张玉姣,纪超凡,等.低果胶酯酶活性果胶酶生产菌株的筛选及应用[J].中国食品学报,2025,25(2):213-223.
[40]钱伟,阳斌,邵博,等.超声辅助酶法降解枳实果胶及其衍生物抗氧化性能[J].日用化学工业,2024,54(8):947-955.