腺苷作为一种重要的内源性嘌呤核苷类物质,广泛分布于各个人体细胞,腺苷作为重要前体物质参与单磷酸腺苷(adenosine monophosphate,AMP)和高能化合物三磷酸腺苷(adenosine triphosphate,ATP)的生物合成过程,腺苷作为核苷代谢和能量代谢的关键调控分子,在维持细胞正常生理功能中发挥着不可替代的作用[1]。研究表明,腺苷是多种传统名贵中药材(如冬虫夏草、灵芝和人参等)的重要生物活性成分之一[2],其药理活性与这些药材的保健功效密切相关。 由于腺苷具有广泛的生理功能,目前已在医药制剂、功能食品、营养补充剂以及动物饲料添加剂等多个领域得到重要应用[3-5]。在工业化生产方面,当前腺苷的主要制备方法包括化学合成法、核糖核酸(ribonucleic acid,RNA)水解法以及微生物发酵法等。 化学合成法是以肌苷、次黄嘌呤等为初始原料,经过一系列的化学反应合成,但收率和产量相对较低,成本较高。RNA水解法是从培养出的酵母菌体中分离出RNA,随后利用磷酸二酯酶对RNA水解得到单磷酸腺苷(AMP),再去磷酸化得到腺苷,但反应过程繁琐,原料来源受限。 微生物发酵法是通过诱变和基因工程方法筛选腺苷生产菌株,再经发酵和分离纯化得到腺苷,具有生产效率高、反应条件易控、原料获取渠道广泛的优点,是工业化生产的首选方法[6-7]。
微生物发酵法生产腺苷的研究主要集中在菌种选育和发酵优化方面。菌种选育旨在通过自然或人工手段改良微生物的遗传特性,以获得更优性能的菌株,如袁红梅等[8]使用常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变、紫外线(ultraviolet,UV)-氯化锂(LiCl)复合诱变枯草芽孢杆菌(Bacillus subtilis)得到一株抗6-巯基嘌呤(6-mercaptopurine,6-MP)的突变株,腺苷产量提高了16.1%。刘玥等[9]在腺苷生产菌B.subtilis XGL中利用温敏质粒过表达嘌呤操纵子中purF、purM、purN、purH和purD基因,腺苷产量提高了9.7%。发酵优化方面旨在通过改进发酵工艺条件和过程控制,使目标产物的产量最大化,如梅漫莉等[10]以腺苷生产菌B.subtilis XGL为出发菌株,研究了黄嘌呤和谷氨酰胺对腺苷产量的影响,通过底物添加、补料流加的发酵方式加入黄嘌呤和谷氨酰胺,腺苷产量提高了33%。孙鹏杰等[11]以腺苷生产菌B.subtilis XGL为出发菌株,通过在发酵过程中添加复合B族维生素(维生素B1(vitamin B1,VB1)、VB3、VB5、VB7、VB12,腺苷产量提高了19%。任韶霞等[12]以B.subtilis DI4-24为出发菌株,通过向补充培养基中加入叶酸、胡萝卜素等物质,并降低培养温度和时间,腺苷产量提高了9%。
针对现有腺苷生产菌株选育周期长、改造难度大、发酵调控繁琐等问题,本研究以一株腺苷生产菌株B.subtilis XGL作为出发菌株,使用常压室温等离子体(ARTP)诱变技术进行诱变处理,通过深孔板培养和酶标仪快速分析检测筛选高产腺苷菌株。利用Plackett-Burman试验、最陡爬坡试验及响应面试验优化高产腺苷筛选菌株发酵培养基,并采用两阶段溶氧(dissolved oxygen,DO)控制策略高效生产腺苷。旨在为腺苷生产提供更优菌种资源、降低成本、为工业化发酵生产提供重要的理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株枯草芽孢杆菌(B.subtilis)XGL:天津科技大学生物工程学院选育和保藏[13]。
1.1.2 试剂
葡萄糖(分析纯):阜丰集团有限公司;味精(谷氨酸钠)(纯度≥99%):梅花生物科技集团股份有限公司;酵母粉(生化试剂):赛默飞世尔科技(中国)有限公司;葡萄糖酸钠、硫酸铵、七水硫酸镁、磷酸二氢钾、氯化钙(均为分析纯):天津市鑫铂特化工有限公司;玉米浆(生化试剂):北京鸿润宝顺科技有限公司。
1.1.3 培养基
LB液体培养基[14]:酵母粉2.0 g/L、蛋白胨4.0 g/L、氯化钠4.0 g/L,pH为6.8~7.0。121 ℃灭菌20 min。
LB固体培养基[14]:酵母粉2.0 g/L、蛋白胨4.0 g/L、氯化钠4.0 g/L、琼脂粉8.0 g/L,pH为6.8~7.0。121 ℃灭菌20 min。
平板复苏培养基[15]:酵母膏5.0 g/L、牛肉膏5.0 g/L、蛋白胨10.0 g/L、氯化钠5.0 g/L、琼脂2.5 g/L,pH为7.0~7.2。121 ℃灭菌25 min。
深孔板发酵培养基[16]:葡萄糖50.0 g/L、酵母粉5.0 g/L、蛋白胨10.0 g/L、柠檬酸钠1 g/L、MgSO4·7H2O 1.5 g/L、硝酸钠(NaNO3)10 g/L、磷酸二氢钾(KH2PO4)1 g/L、K2HPO4 2.5 g/L,pH为6.6~7.0。115 ℃灭菌15 min。
种子培养基[9]:葡萄糖50.0 g/L、酵母粉10.0 g/L、蛋白胨10.0 g/L、MgSO4·7H2O 1.5 g/L、K2HPO42.5 g/L,pH为7.0~7.2。115 ℃灭菌15 min。
发酵培养基[9]:葡萄糖85.0 g/L、酵母粉18.0 g/L、味精4.0 g/L、葡萄糖酸钠1.0 g/L、(NH4)2SO412.0 g/L、MgSO4·7H2O 1.3 g/L、K2HPO4 2.0 g/L、CaCl2 1.3 g/L、玉米浆15 g/L,pH为7.0~7.2。115 ℃灭菌15 min。
1.2 仪器与设备
BIOTECH-15JS-30JS-30JS三连不锈钢发酵罐(30 L):上海宝兴生物工程设备有限公司;722型分光光度计:上海舜宇恒平科学仪器有限公司;Waters e2695高效液相色谱(high performance liquid chromatography,HPLC) 系统:美国Waters公司;SBA-40E生物传感分析仪:山东省科学院生物研究所;MPMS多功能等离子体诱变系统:北京伟恩斯技术有限公司。SpectraMax i3X多功能酶标仪:美谷分子仪器(上海)有限公司;UNIVERSAL 320R低温高速离心机:德国安德烈亚斯·黑蒂希公司。
1.3 方法
1.3.1 ARTP诱变选育
(1)菌种培养
首先从保菌管中接菌至LB摇管中37 ℃培养12 h,然后三区划线,挑选生长较好的单菌落接摇管进行活化培养;在接种量1%,37 ℃、220 r/min振荡条件下摇瓶培养3~6 h。
(2)菌悬液制备
将摇瓶培养后的菌体在低温离心机中离心,并用无菌生理盐水洗涤2~3次,最终使用同样生理盐水将菌悬液的OD600nm值控制在0.6~0.8之间。
(3)ARTP诱变[17]
将处理好的菌悬液取10 μL涂在载片上,载片位于气流端口2 nm处,气流速度为10 L/min,功率为120 W,处理时间为30 s。 诱变后立即将载片在无菌环境下放入1.5 mL含有无菌生理盐水的离心管中,然后将离心管置于振荡器上振荡3 min,得到菌悬液,再将装有菌悬液的离心管置于冰上1 h。 最后将处理后的菌悬液涂布于平板复苏培养基上,将平板复苏培养基放至37 ℃培养箱中培养8~10 h。
1.3.2 菌株培养方法
深孔板培养[16-17]:从平板复苏培养基上挑选长势优异的单菌落接种至提前标记好的LB平板上,并在培养后转接至装有400 μL无菌LB液体培养基的深孔板中过夜培养10 h,将培养后的菌液吸取40 μL转接到装有360 μL深孔板培养基对应的深孔板中,37 ℃、220 r/min条件下振荡培养24 h。培养结束后,将菌液离心,留取上清液稀释50倍,取500 μL放至酶标板中,在检测样品最大吸收波长条件下测定吸光度值,将吸光度值较高的菌株进行保藏,进一步摇瓶复筛。
菌种活化及摇瓶培养:
①菌种活化:取保藏菌种,接种于斜面培养基,在37 ℃条件下培养16 h,作为活化种子。②摇瓶种子培养:接8环长势良好的斜面菌种至装液量为30 mL/500 mL种子培养基中,于摇床转速100 r/min、温度37 ℃条件下振荡培养12 h。③摇瓶发酵培养:将种子液按10%接种量接至装液量为30 mL/500 mL发酵培养基中,于摇床转速220 r/min、温度37 ℃条件下振荡培养36 h。
30 L发酵罐两阶段溶氧控制发酵:
①种子罐发酵:使用5 L自控发酵罐进行种子罐发酵,种子罐初始装液量为2.7 L,灭菌温度115 ℃,灭菌时间30 min。于超净工作台中使用100 mL无菌水将茄形瓶中培养的菌种重悬,在罐体接种口放置火圈,使罐体接种口附近处于无菌环境。近火焰倒入100 mL菌悬液及200 mL底糖。种子罐发酵过程中控制发酵温度37 ℃,pH 6.9,溶解氧(DO)维持在35%。 ②发酵罐发酵:使用30 L自控发酵罐进行发酵,发酵液装量为12 L,灭菌温度115 ℃,灭菌时间30 min。当种子罐菌液OD600 nm值达到15~20时,按10%接种量接入发酵罐中。发酵过程中控制发酵温度37 ℃,pH7.0,根据不同的溶氧控制策略调整通风量及搅拌速度。发酵过程中流加80%葡萄糖,发酵周期45 h。
1.3.3 发酵培养基优化
(1)Plackett-Burman(PB)试验设计
PB试验设计基于不完全平衡区组设计原理,从多变量体系中快速筛选出对目标响应具有显著性影响的关键因子[18-19]。以发酵培养基为基础[9],选用试验次数N=12的试验设计,对葡萄糖(X1)、味精(X2)、酵母粉(X3)、葡萄糖酸钠(X4)、(NH4)2SO4(X5)、MgSO4·7H2O(X6)、K2HPO4(X7)、CaCl2(X8)、玉米浆(X9)等培养基组分添加量为影响因素,每个因素分两个水平,高水平取低水平的1.5倍,以腺苷产量为评价指标。利用Design-Expert 13.0软件进行数据分析。发酵培养基优化PB试验设计因素与水平见表1。
表1 发酵培养基优化Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman experiments design for fermentation medium optimization g/L

水平 X1葡萄糖 X2味精 X3酵母粉 X4葡萄糖酸钠 X5(NH4)2SO4 X6MgSO4·7H2O X7K2HPO4 X8CaCl2 X9玉米浆-1 1 85 130 46 18 27 1.0 1.5 12 18 1.3 2.0 23 1.3 2.0 15.0 22.5
(2)最陡爬坡试验
响应面拟合方程只在考察的紧接领域才能充分近似真实情形。因此,在构建可靠的响应面模型前,首先通过优化方法逼近最优参数空间。本研究采用最陡爬坡法进行参数优化,依据试验数据的梯度变化方向确定探索路径,且根据各因素的效应强度动态调整搜索步长,确定高效定位最优参数区域[20]。
(3)响应面试验
响应面试验设计能够考察各因素之间的交互作用,并且通过拟合方程描述在一定区域内响应值随响应变量的变化情况[21-22]。根据最陡爬坡试验结果,选取结果影响因素较大的因素葡萄糖(A)、味精(B)和MgSO4·7H2O(C)添加量为自变量,以腺苷产量为响应值,采用中心组合试验设计(centralcompositedesign,CCD)进行3因素3水平Box-Behnken响应面试验,Box-Behnken试验设计因素及水平见表2。
表2 发酵培养基优化Box-Behnken试验因素与水平
Table 2 Factors and levels of Box-Behnken experiments for fermentation medium optimization

水平 A 葡萄糖/(g·L-1) B 味精/(g·L-1) C MgSO4·7H2O/(g·L-1)-1 0 1 136 139 142 10 12 14 4 5 6
1.3.4 指标检测方法
菌体浓度的测定:发酵液经去离子水稀释后,采用分光光度计检测波长600 nm条件下的吸光度值(OD600 nm值),保证OD600 nm值在0.3~0.8区间,吸光度值与稀释倍数的乘积即为菌体浓度。
葡萄糖质量浓度的测定:取100 μL发酵上清液,用无菌水稀释100倍后,取稀释液25 μL放入生物传感分析仪中测定葡萄糖浓度,其数值与稀释倍数乘积即为发酵罐中葡萄糖浓度,并依据该数值对发酵罐中补糖速度进行调控。
腺苷产量的测定:取100 μL发酵上清液加入900 μL无菌水进行稀释及过膜处理后,使用HPLC法测定腺苷产量。高效液相色谱条件[23]:Kromasil C18色谱柱(250 mm×4.6 mm,5 μm),柱温30 ℃,紫外检测波长260 nm,进样量20 μL,流动相磷酸盐∶甲醇=85∶15,流速为0.8 mL/min。腺苷标准品以0.1 g/L、0.5 g/L、1.0 g/L、2 g/L、4 g/L、6 g/L质量浓度进样,以腺苷质量浓度(x)为横坐标,响应峰面积(y)为纵坐标绘制标准曲线,按照标准曲线回归方程计算样品腺苷产量。
糖苷转化率计算:腺苷总产量(g)/补糖总量(g)×100%。
1.3.5 数据处理
所有试验均进行3次重复,结果以“平均值±标注差”表示,试验数据处理均采用Excel 2019进行整理汇总,并采用Origin 2024软件及Visio 2016进行绘图,采用Design-Expert 13.0软件分析响应面试验结果。
2 结果与分析
2.1 ARTP诱变选育腺苷高产菌种
2.1.1 ARTP诱变结合酶标仪初筛腺苷高产突变株
首先建立发酵液中腺苷质量浓度的快速检测方法。使用酶标仪全波长分析腺苷发酵液,结果发现在波长260nm处有最大吸收,因此,确定吸光度值检测波长为260 nm。将腺苷质量浓度(x)和吸光度值(OD260 nm值)(y)的对应关系进行线性回归,得到回归方程:y=0.034 23x+0.166 1,相关系数R2=0.999 3。在20~100 mg/L质量浓度范围内,腺苷质量浓度与OD260nm值呈正相关,表明可以通过快速检测发酵液中腺苷质量浓度确定高产腺苷突变菌株。
ARTP诱变育种是一种新型微生物基因组快速突变的物理方法[24-25],该技术通过等离子体作用于微生物细胞表面,在不损伤细胞完整性的前提下,可诱导细胞膜结构发生改变,导致细胞表面电荷分布变化和膜通透性增强。这种物理刺激会进一步影响胞内蛋白功能,并引起基因损伤。部分微生物会通过自身的修复系统存活,并在这一过程中产生基因突变,进而产生显著的表观性状。 本试验以B.subtilis XGL为出发菌株,经过ARTP诱变处理后,将复苏平板长出的突变菌依次对点到深孔板中进行培养,使用酶标仪测定深孔板发酵液的OD260nm值,结果见图1。由图1可知,在挑选的99个突变菌中,突变菌株XGL47、XGL52、XGL65和XGL85的OD260nm值提升幅度较大,相比出发菌株XGL分别提高了16.6%、15.7%、14.4%和16.3%。因此,将上述4株菌株保藏并进行摇瓶复筛和传代稳定性测试。
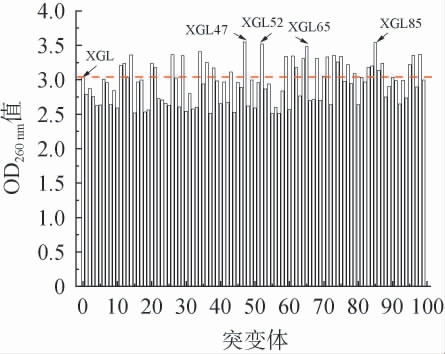
图1 高产腺苷突变株初筛结果
Fig.1 Primary screening results of high-yield adenosine mutant strains
2.1.2 摇瓶复筛及传代稳定性测试
以菌株XGL作为对照,对初筛高产腺苷突变菌株XGL47、XGL52、XGL65和XGL85进行摇瓶复筛及遗传稳定性实验,结果见图2。 由图2a可知,采用高效液相色谱测定摇瓶发酵液中的腺苷产量,突变菌株XGL47、XGL52、XGL65和XGL85的摇瓶发酵腺苷产量分别为8.15 g/L、10.71 g/L、10.42 g/L、9.75 g/L、11.32 g/L,与出发菌株XGL相比,分别提高了32.7%、29.3%、21.2%和39.5%。 因此,选择突变菌株XGL85进一步进行遗传稳定性实验。
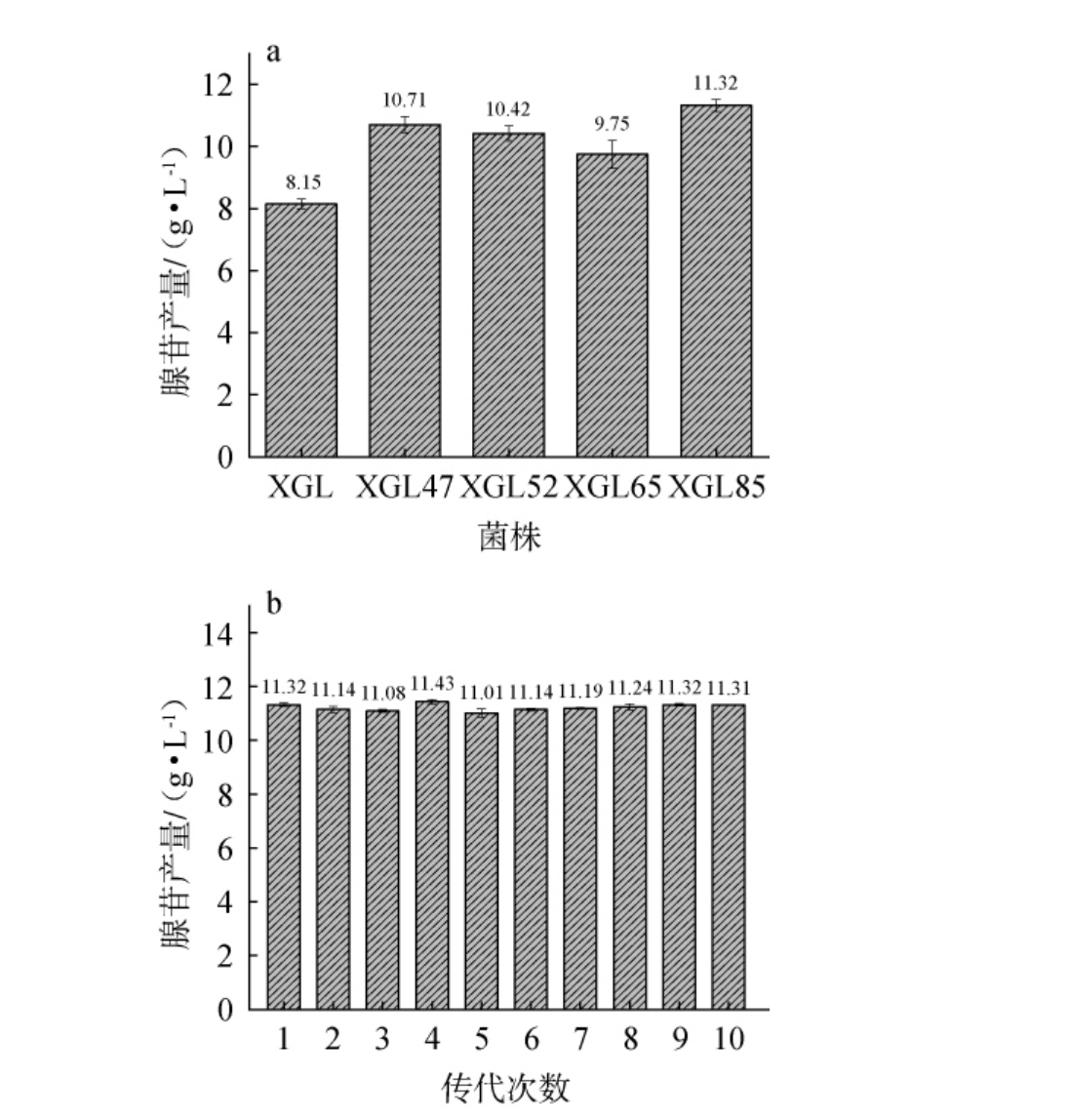
图2 高产腺苷突变菌株摇瓶复筛结果(a)及菌株XGL85传代稳定性测试结果(b)
Fig.2 Shake flask re-screening results of high-yield adenosine mutant strains (a) and passaging stability tests results of strain XGL85 (b)
为保证获取的腺苷高产菌株在连续传代过程中的遗传稳定性和表型稳定性,确保长期应用的可靠性。由图2b可知,菌株XGL85在连续10代的传代过程中腺苷产量保持稳定,均在11.01~11.43 g/L范围内波动,表现出较好的遗传稳定性和表型稳定性。对菌株XGL85的嘌呤核苷合成途径相关基因进行测序,发现purH基因中第31位碱基、第261位碱基、第306位碱基发生突变,其编码的氨基酸分别由赖氨酸、谷氨酰胺、天冬酰胺变为谷氨酸、组氨酸、赖氨酸,其他基因如purM、purN、purE、purD、purC、purL、purQ、purT、purI和purB均没有发生突变,推测其他关联代谢途径的基因突变也会影响腺苷的产量,后续需利用全基因组测序技术进一步揭示菌株XGL85高产腺苷的遗传机制。
2.2 菌株XGL85腺苷发酵培养基优化
2.2.1 PB试验
PB试验设计及结果见表3,效应分析见表4。由表4可知,葡萄糖、味精、MgSO4·7H2O均对腺苷产量有显著影响(P<0.05)。因此选取葡萄糖、味精、MgSO4·7H2O这3个因素进行最陡爬坡试验。
表3 Plackett-Burman试验设计及结果
Table 3 Design and results of Plackett-Burman experiments
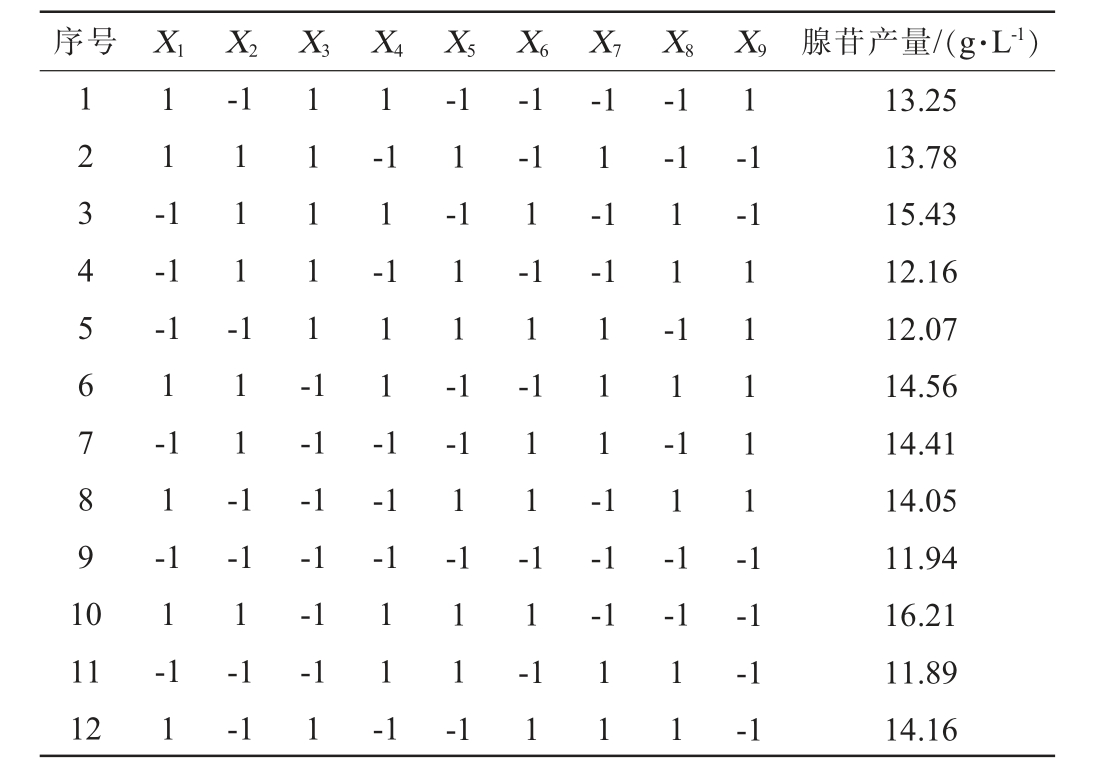
序号 X1 X2 X3 X4 X5 X6 X7 X8 X9 腺苷产量/(g·L-1)123 456 7891 0 1 1 -1 -1-1 1 1 1 1 1 -11111-1-1 1-1-1 1-1-1 1-1-1-1-1-1-1 1 1 1 -1 1 1 -1-1-1 1-1 1-1-1 1-1 1-1 1-1 1 1 1 -1 1 1 1 -1 1 1 -1 1 --1-1-1-1-1 1-1 1-1-1-1-1-1 1-1 1 1--1-1 1 1 -1 111 11-1 1 1 -1 1 1 -1 1 1 --1 11 12 11 11 11-1-1-1 13.25 13.78 15.43 12.16 12.07 14.56 14.41 14.05 11.94 16.21 11.89 14.16
表4 Plackett-Burman试验结果显著性分析
Table 4 Significance analysis of Plackett-Burman experiments results
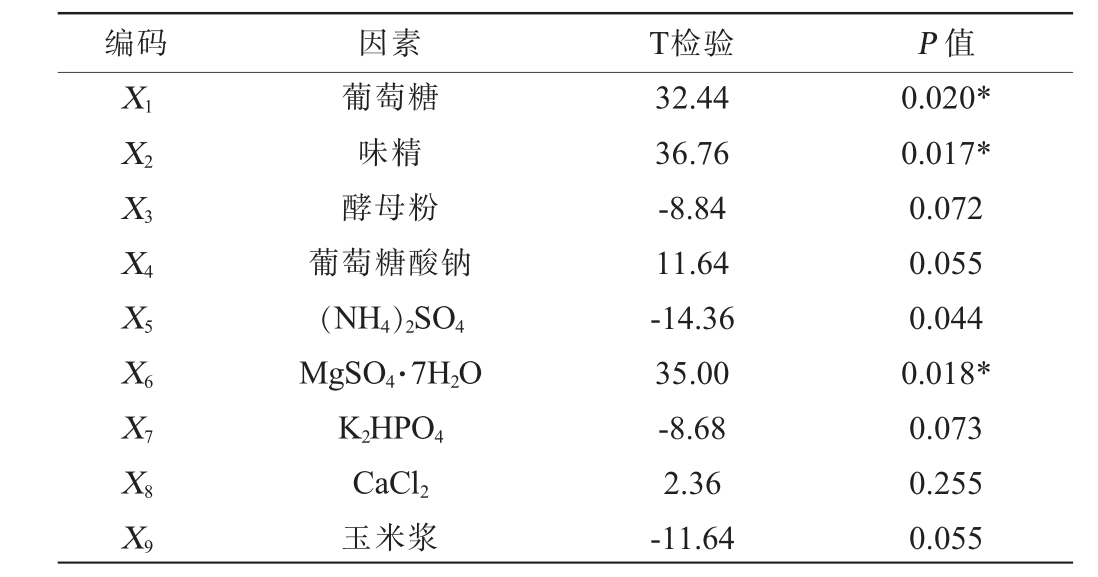
注:“*”表示对结果影响显著(P<0.05)。
编码 因素 T检验 P 值X1X2X3X4X5X6X7X8X9葡萄糖味精酵母粉葡萄糖酸钠(NH4)2SO4 MgSO4·7H2O K2HPO4 CaCl2玉米浆32.44 36.76-8.84 11.64-14.36 35.00-8.68 2.36-11.64 0.020*0.017*0.072 0.055 0.044 0.018*0.073 0.255 0.055
2.2.2 最陡爬坡试验
对葡萄糖、味精、MgSO4·7H2O这3个显著因素进行最陡爬坡试验,结果见表5。 由表5可知,第4组试验条件的腺苷响应值达到峰值,表明该区域可能存在最优解,故后续选择该组参数作为响应面分析的中心点进行响应面试验。
表5 最陡爬坡试验设计及结果分析
Table 5 Design and results of the steepest ascent experiments
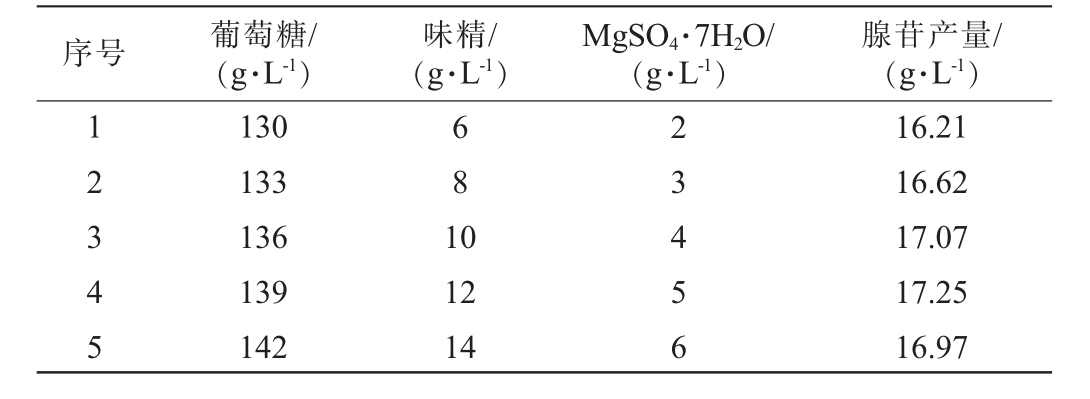
序号 葡萄糖/(g·L-1)味精/(g·L-1)MgSO4·7H2O/(g·L-1)腺苷产量/(g·L-1)12345 130 133 136 139 142 681 0 12 14 23456 16.21 16.62 17.07 17.25 16.97
2.2.3 响应面试验
根据PB试验及最陡爬坡试验结果,选择对腺苷产量影响较大的因素葡萄糖(A)、味精(B)、MgSO4·7H2O(C)为自变量,以腺苷产量(Y)为响应值,设计Box-Behnken响应面试验,Box-Behnken试验设计及结果见表6,方差分析结果见表7。
表6 发酵培养基优化Box-Behnken试验设计及结果
Table 6 Design and results of Box-Behnken experiments for fermentation medium optimization
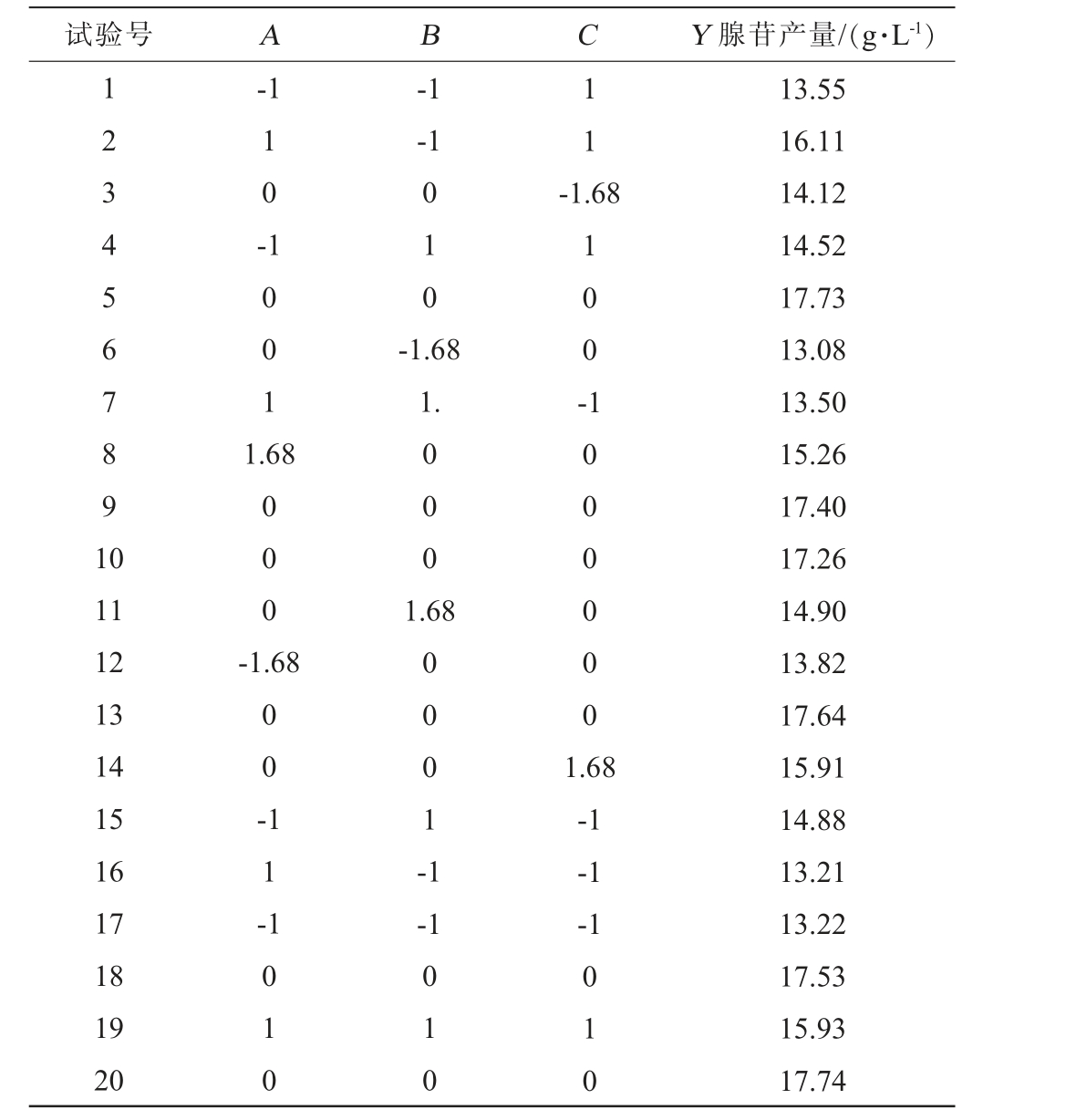
试验号 A B C Y 腺苷产量/(g·L-1)1234567891 0-1 1 0 --1-1 1 1-1.68 1001 010-1.68 1.1 0 0 -1.68 000 11 12 13 14 15 16 17 18 19 20 000 1.68-1.68 0 0 -1000000 1 1 -0 0 0 1 -1 1010-1 1.68-1-1-1 010 010 13.55 16.11 14.12 14.52 17.73 13.08 13.50 15.26 17.40 17.26 14.90 13.82 17.64 15.91 14.88 13.21 13.22 17.53 15.93 17.74
表7 回归模型方差分析
Table 7 Variance analysis of regression model
注:“**”表示对结果影响极显著(P<0.01)。
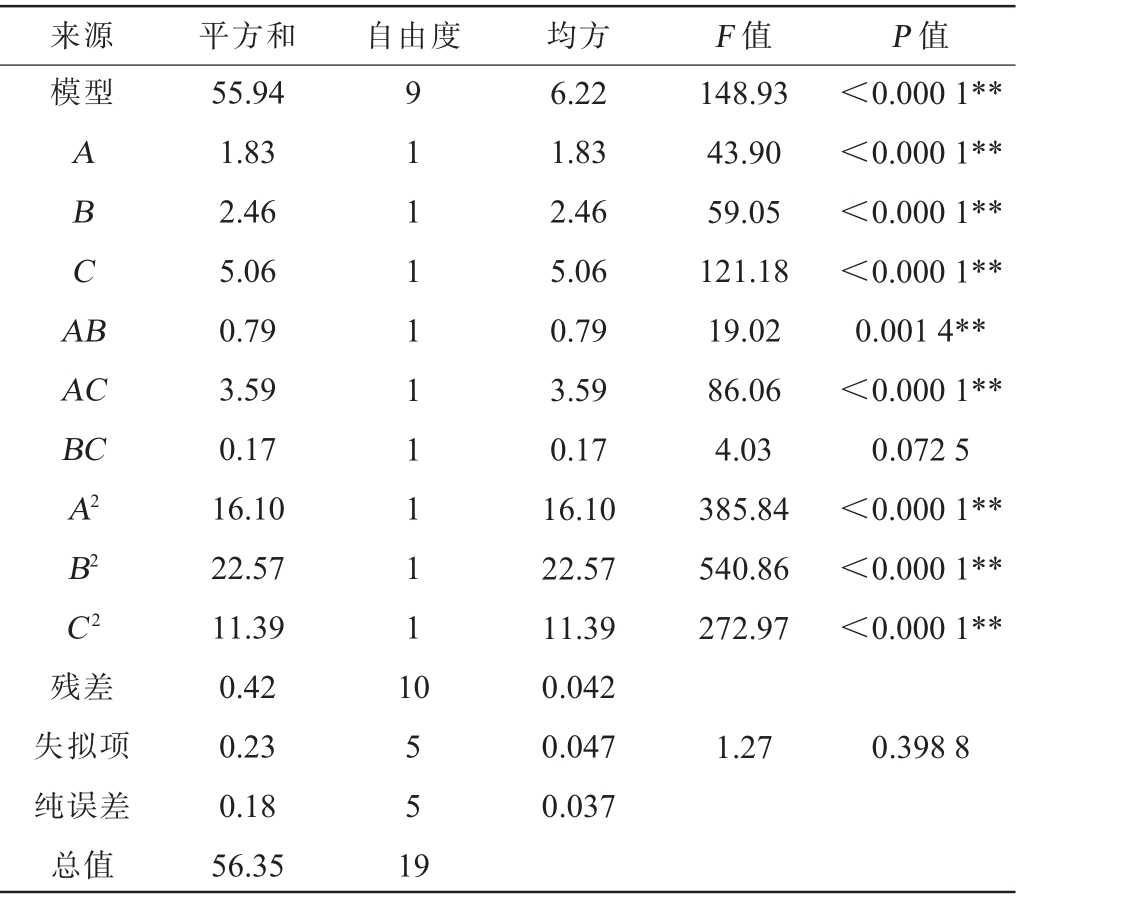
来源 平方和 自由度 均方 F 值 P 值模型ABCA B AC BC A2 B2 C2残差失拟项纯误差总值55.94 1.83 2.46 5.06 0.79 3.59 0.17 16.10 22.57 11.39 0.42 0.23 0.18 56.35 9 1 1 1 1 1 1 1 1 1 1 148.93 43.90 59.05 121.18 19.02 86.06 4.03 385.84 540.86 272.97<0.000 1**<0.000 1**<0.000 1**<0.000 1**0.001 4**<0.000 1**0.072 5<0.000 1**<0.000 1**<0.000 1**0 5 5 1 9 6.22 1.83 2.46 5.06 0.79 3.59 0.17 16.10 22.57 11.39 0.042 0.047 0.037 1.27 0.398 8
使用Design-Expert 13.0软件对表6数据进行多元二次回归拟合,得到腺苷产量(Y)与因素A、B、C之间的多元二次回归方程如下:
由表7可知,该模型的F值为148.93,P值<0.000 1,在统计学中该模型具有极显著性;失拟项P值=0.398 8>0.05,表明该模型非常理想可靠。模型的决定系数R2=0.992 6,调整决定系数R2adj=0.986 0,说明模型模型拟合度良好。变异系数(coefficient of variation,CV)值代表试验的精确度,CV值越低代表模型可靠性越高。CV=1.33%,说明模型预测可信度较高。 Adeq Precisior代表信噪比,通常情况下其值应>4,本试验信噪比为30.371,进一步说明该模型在试验设计的范围内可以很好的反映响应值随响应变量的变化趋势。由P值可知,一次项A、B、C,交互项AB、AC,二次项A2、B2、C2对结果影响极显著(P<0.01)。由F值可知,3个因素对结果影响顺序为硫酸镁(C)>味精(B)>葡萄糖(A)。
各因素间交互作用对结果影响的响应面越陡峭,等高线越趋于椭圆形,表明交互作用对结果影响越强;反之,响应面越平缓,等高线越趋于圆形,表明交互作用对结果影响越弱。 葡萄糖、味精以及硫酸镁添加量交互作用对腺苷产量影响的响应面及等高线见图3。
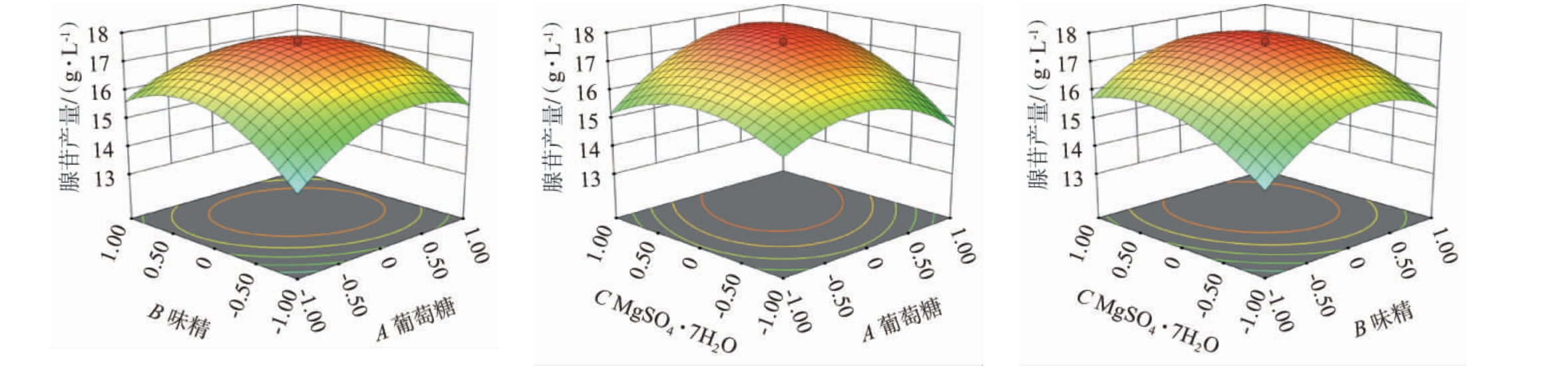
图3 葡萄糖、味精以及MgSO4·7H2O添加量间交互作用对腺苷产量影响的响应面及等高线
Fig.3 Response surface plots and contour lines of effect of interaction between glucose, monosodium glutamate and MgSO4·7H2O addition on adenosine yield
由图3可知,葡萄糖(A)与味精(B)以及葡萄糖(A)与硫酸镁(C)添加量交互作用对结果影响的响应面陡峭,等高线趋于椭圆形,表明AB、AC对腺苷产量影响显著;味精(B)与硫酸镁(C)添加量交互作用对结果影响的响应面平缓,等高线趋于圆形,表明BC对腺苷产量影响不显著。这与表7方差分析结果一致。
通过Design-Expert 13.0软件分析模型,预测出最优的发酵培养基,葡萄糖、味精以及硫酸镁的添加量分别为139.96 g/L,12.15 g/L和5.08 g/L。 在此条件下,腺苷产量预测值为17.74 g/L。 考虑实际操作可行性,修正最佳发酵培养基为:葡萄糖140 g/L,味精12 g/L,MgSO4·7H2O 5 g/L。在此优化条件下进行3次平行验证试验,腺苷产量实际值为17.51 g/L,与预测值较为接近。经优化后摇瓶发酵腺苷产量较未优化培养基时提高了54.7%,说明营养物的组成配比能够显著影响腺苷的合成代谢[26-27]。
2.3 发酵过程中溶解氧水平的优化
在发酵过程中,溶解氧(DO)是一个关键参数,尤其是在好氧微生物发酵或需氧代谢的发酵过程中,溶解氧的浓度将直接影响微生物的生长以及代谢产物的产出,进而影响发酵效率[28]。 不同溶解氧水平(10%、20%、30%、40%)对发酵过程中菌体生长及腺苷产量的影响,结果见图4。
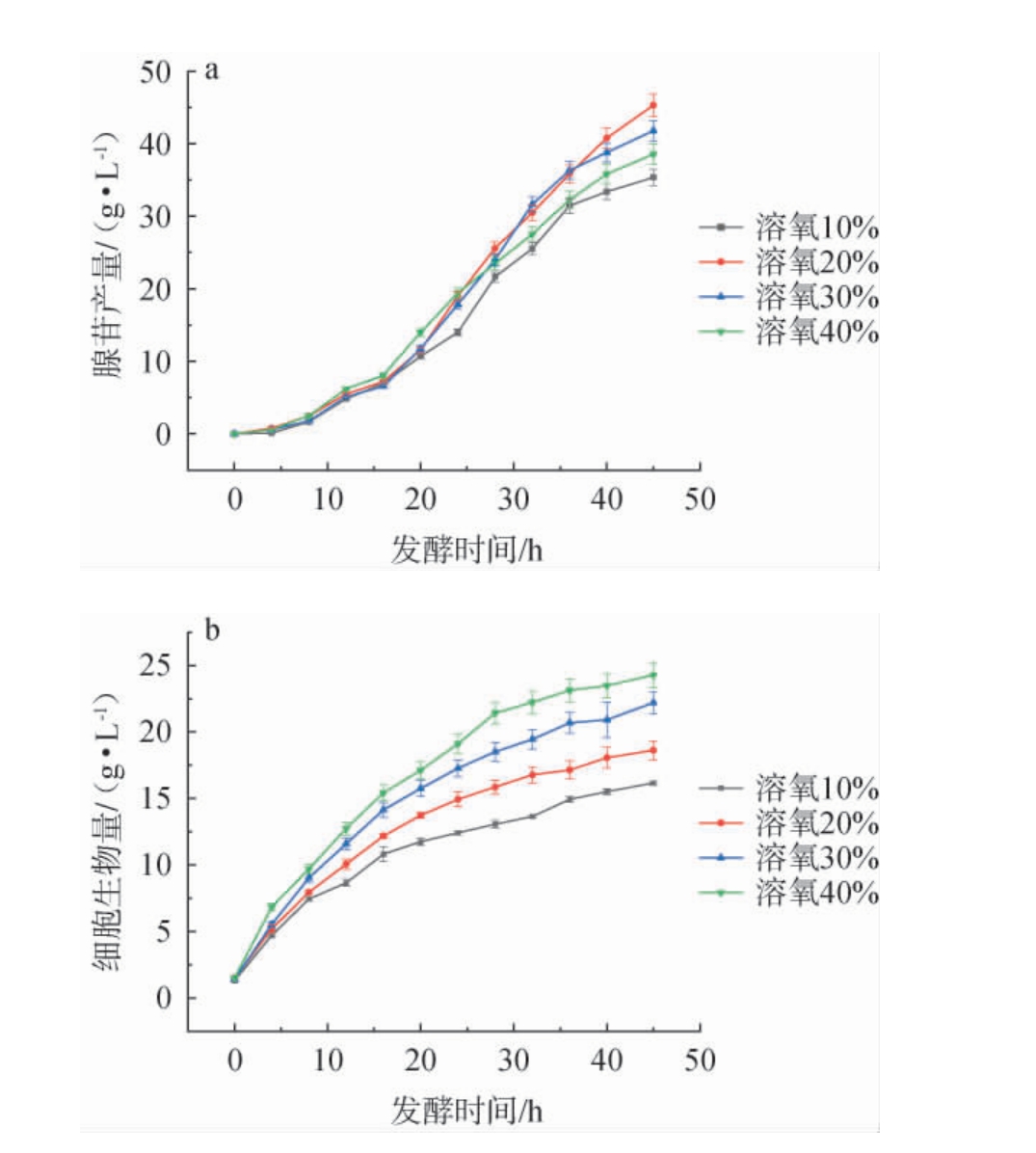
图4 不同溶氧水平对腺苷产量(a)和细胞生物量(b)的影响
Fig.4 Effects of different dissolved oxygen levels on adenosine yields (a) and cell biomass (b)
由图4a可知,腺苷产量在20%溶氧条件下最高,为46.2g/L,与10%、30%和40%溶氧条件相比,分别提高了28.2%、8.4%和17.5%。 由图4b可知,当溶解氧从10%提升至40%时,发酵终点细胞生物量分别达到16.4 g/L、18.8 g/L、22.5 g/L和24.6 g/L,表明提高溶氧水平能有效促进菌体增殖。
结果表明,虽然高溶氧水平(40%)有利于菌体生长和糖代谢,但可能引起代谢流重新分配,反而抑制了腺苷的生物合成;而过低的溶氧水平(10%)则可能限制菌体的正常代谢功能。
2.4 两阶段溶氧控制发酵
为了进一步保证发酵过程中菌体的正常生长和腺苷产量,采用两阶段溶解氧控制发酵策略:在发酵初期(0~20 h)控制溶氧水平为40%,确保菌体生物量快速积累,使腺苷合成酶系充分表达,为后续产物产出提供基础;20 h至发酵结束,控制溶氧水平为20%,促进糖代谢向腺苷合成方向转化。两阶段溶氧控制策略下菌株XGL85产腺苷发酵过程曲线见图5。由图5可知,两阶段控制溶氧策略下,在发酵时间45 h时,腺苷的产量达到51.8 g/L,糖苷转化率达到20.4%,菌体生物量达到21.6 g/L。与20%的单一溶氧控制相比,两阶段溶氧控制的菌体生物量提高了15.9%,腺苷产量提高了13.3%;与40%的单一溶氧控制相比,两阶段溶氧控制的菌体生物量降低了11.1%,腺苷产量提高了44.8%,表明两阶段溶氧控制策略可有效平衡菌体生长与产物合成的关系,使得碳代谢更多流向腺苷合成。
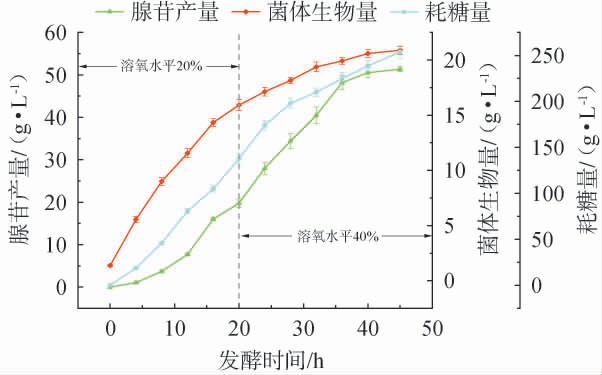
图5 两阶段溶氧控制策略下菌株XGL85产腺苷发酵过程曲线
Fig.5 Fermentation process curves of strain XGL85 for adenosine production under two-stage dissolved oxygen control strategy
3 结论
本研究建立了适用于腺苷生产菌株的高通量诱变筛选方法,通过常压室温等离子体诱变(ARTP)结合高通量筛选,突变株XGL85的腺苷摇瓶发酵产量较出发菌株提高了39.5%。采用响应面试验优化发酵培养基,确定了最佳发酵培养基:葡萄糖140 g/L,味精12 g/L,酵母粉18 g/L,葡萄糖酸钠1 g/L,(NH4)2SO4 12 g/L,MgSO4·7H2O 5 g/L,K2HPO4 2 g/L,CaCl2 1.3 g/L,玉米浆15 g/L,在优化培养基条件下腺苷摇瓶产量提升了54.7%。 考虑到溶氧对于菌体生长和产物合成的不同影响,并结合单一溶氧控制发酵条件下腺苷产量及细胞生物量结果,开发了两阶段溶氧控制策略,在保证菌体生长的同时使更多的碳代谢流向腺苷合成。30 L发酵罐发酵45 h时腺苷产量达51.8 g/L,糖苷转化率达到20.4%,展现出良好的工业化应用潜力。
[1]KAZEMZADEH-NARBAT M,ANNABI N,TAMAYOL A,et al.Adenosine-associated delivery systems[J].J Drug Target,2015,23(7-8):580-596.
[2]钱正明,李春红,李文庆,等.在线提取HPLC法测定两种虫草中腺苷和虫草素的含量[J].今日药学,2018,28(6):387-390.
[3]MARCHI E,MURACA I,BERTEOTTI M,et al.Adenosine in interventional cardiology:physiopathologic and pharmacologic effects in coronary artery disease[J].Int J Mol Sci,2024,25(11):5852.
[4]孙硕,李培尧,张文杰,等.补喂腺苷对伊犁马运动性能、血液载氧能力和抗氧化能力的影响[J].动物营养学报,2024,36(9):5848-5859.
[5]ZHANG T,LI Y J,MA T.The immunomodulatory function of adenosine in sepsis[J].Front Immunol,2022,13:936547.
[6]张群.腺苷微生物发酵生产技术研究[J].食品与生物技术学报,2018,37(5):560.
[7]LI B,YAN Z Y,LIU X N,et al.Increased fermentative adenosine production by gene-targeted Bacillus subtilis mutation[J].J Biotechnol, 2019,298:1-4.
[8]袁红梅,薛正莲,杨心萍.常压室温等离子体和紫外诱变选育腺苷高产菌株[J].发酵科技通讯,2019,48(2):100-105.
[9]刘玥,何菊华,谢希贤,等.枯草芽孢杆菌嘌呤合成途径的修饰对腺苷积累的影响[J].微生物学报,2014,54(6):641-647.
[10]梅漫莉,李国华,徐庆阳.黄嘌呤和谷氨酰胺对枯草芽孢杆菌XGL产腺苷的影响[J].中国酿造,2020,39(4):98-102.
[11]孙鹏杰,余子辰,徐庆阳.B族维生素对枯草芽孢杆菌发酵生产腺苷的影响[J].中国酿造,2022,41(4):93-98.
[12]任韶霞,刘磊,常利草,等.腺苷高产菌株Bacillus subtilis DI4-24退化的遗传机制与控制研究[J].工业微生物,2017,47(2):24-28.
[13]ZHANG C L, DU S S, LIU Y, et al.Strategy for enhancing adenosine production under the guidance of transcriptional and metabolite pool analysis[J].Biotechnol Lett,2015,37(7):1361-1369.
[14]吴开水,刘韪玮,马零,等.系统代谢工程改造谷氨酸棒状杆菌CP提高L-亮氨酸生产[J].食品与发酵工业,2025,51(7):48-57.
[15]闫更轩,刘伟,刘春燕,等.ARTP诱变选育高产腺苷菌株及发酵条件优化[J].中国调味品,2024,49(8):63-68.
[16]周剑,江红,林风.基于深孔板培养高通量筛选rakicidin B1高产菌的研究[J].中国抗生素杂志,2019,44(12):1352-1355.
[17]KUMADA Y,TAKASE Y,SASAKI E,et al.High-throughput,high-level production of PS-tag-fused single-chain Fvs by microplate-based culture[J].J Biosci Bioeng,2011,111(5):569-573.
[18]董殿波,张华山,王伟平,等.应用LH与PB设计筛选影响Candida shehatae乙醇产量的无机盐因子[J].中国酿造,2010,29(2):100-103.
[19]MANSOUR M, ALI S, HASSAN M, et al.Optimization of citrulline production from a Bacillus subtilis BH-01 isolated from raw buffalo milk[J].BMC Microbiol,2025,25(1):71.
[20]NIU F X,HUANG Y B,SHEN Y P,et al.Enhanced production of pinene by using a cell-free system with modular cocatalysis[J].J Agr Food Chem,2020,68(7):2139-2145.
[21]WITEK-KROWIAK A, CHOJNACKA K, PODSTAWCZYK D, et al.Application of response surface methodology and artificial neural network methods in modelling and optimization of biosorption process[J].Bioresource Technol,2014,160:150-160.
[22]ZHANG H Y,YANG Y T,ZHANG X Q,et al.Optimization of the enrichment medium for recombinant ChIL-4-ChIL-2 in Lactococcus lactis through response surface methodology[J].Poultry Sci, 2025, 104(5):105025.
[23]张鑫喆,赵琳琳,徐方旭,等.HPLC不同流动相测定蛹虫草中虫草素和腺苷的比较[J].黑龙江农业科学,2018(4):130-132.
[24]ZHU Z R, CHEN W H, ZHOU H B, et al.ARTP and NTG compound mutations improved Cry protein production and virulence of Bacillus thuringiensis X023[J].Appl Microbiol Biotechnol,2022,106(11):4211-4221.
[25]QIU L,NIE S X,HU S J,et al.Screening of Beauveria bassiana with high biocontrol potential based on ARTP mutagenesis and high-throughput FACS[J].Pestic Biochem Phys,2021,171:104732.
[26]袁红梅.腺苷发酵高产菌株的选育及其工艺优化[D].芜湖:安徽工程大学,2019.
[27]陈华强.添加柠檬酸钠与次黄嘌呤的腺苷发酵工艺研究[J].发酵科技通讯,2020,49(4):211-214.
[28]刘剑,徐达.溶解氧控制对枯草芽孢杆菌发酵生产腺苷的影响[J].食品与发酵工业,2012,38(7):86-89.