葡萄酒的品质主要体现在平衡性、浓郁度、复杂度、回味和香气等方面,其中香气是评价葡萄酒品质的重要指标[1]。 葡萄酒中含有超过1 300种香气物质,主要包括C6醇、萜烯类、降异戊二烯类、挥发性酚类、高级醇、有机酸、醛类、酮类、酯类等,这些物质的种类、含量、感官阈值、组合比例的不同,赋予葡萄酒不同的特征[2-3]。
酯类是由醇类或酚类物质的羟基与有机酸的羧基缩合形成的,被认为是葡萄酒挥发性香气中最重要的成分之一,其含量仅次于高级醇[4]。酯类物质具有不同的香气阈值和香气特征,在葡萄酒酒精发酵、苹果酸乳酸发酵、陈酿和贮藏过程中,通过微生物合成作用或化学反应产生,通常以微量存在,一般不超过100 mg/L,占总挥发性物质的30%[5],赋予了葡萄酒独特且复杂的香气,代表了葡萄酒典型的果香、花香、糖果香气[6],且香气优雅,这是高质量葡萄酒所具备的重要特征。
中链脂肪酸乙酯(medium-chain fatty acid ethyl ester,MCFAEE)是中链脂肪酸与乙醇反应生成的酯类香气物质[7],包括丁酸乙酯、己酸乙酯、辛酸乙酯和癸酸乙酯,赋予葡萄酒复杂且优雅的果香和花香。 与葡萄酒中其他酯类物质相比,中链脂肪酸乙酯的香气阈值较低(丁酸乙酯:10 μg/L;己酸乙酯:8.5 μg/L;辛酸乙酯:6 μg/L;癸酸乙酯:243 μg/L)[8-9],其浓度的微小变化都会对葡萄酒感官质量产生显著影响。此外,其挥发性较低,这一特性使得葡萄酒香气更为持久[1]。 然而,目前对葡萄酒中链脂肪酸乙酯的调控研究尚不成熟,难以实现对其含量的精准调控。
该文总结了葡萄酒中链脂肪酸乙酯来源,并阐述了其在酒精发酵、苹果酸乳酸发酵和陈酿过程及MAFAEE的分子生物学调控机制的研究进展,旨在为其在葡萄酒酿造中的精准调控提供理论依据,并为提高葡萄酒的感官质量和产品质量提供科学指导。
1 葡萄酒中链脂肪酸乙酯的来源
葡萄果实中含有中链脂肪酸乙酯,但其含量较低,对葡萄酒中链脂肪酸乙酯的含量几乎没有影响[10]。在葡萄酒中,中链脂肪酸乙酯可分为两类:一类是在酵母生物代谢过程中通过酶促反应形成的,另一类是在葡萄酒陈酿过程中,乙醇与中链脂肪酸在低pH条件下发生化学酯化反应形成的[5]。
在酵母中,中链脂肪酸乙酯主要通过中链脂肪酰基辅酶A与乙醇在醇酰基转移酶(alcohol acyltransferase,AATase)的介导下发生缩合反应而合成[11],其合成代谢途径如图1所示。
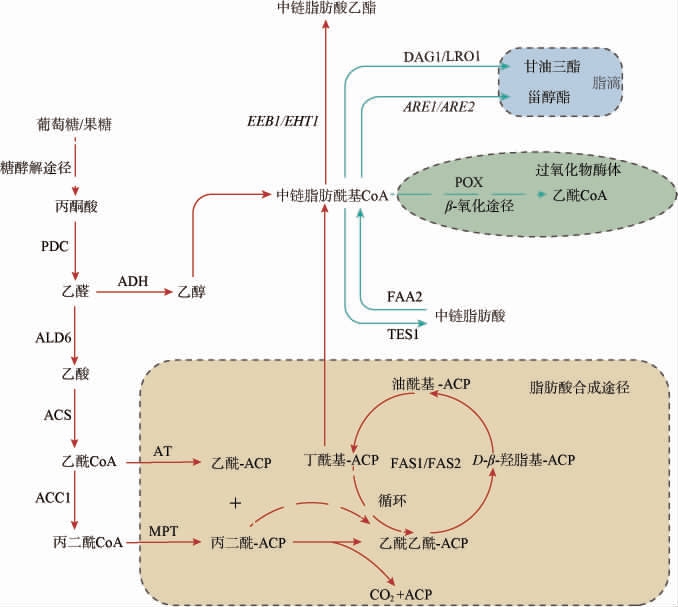
图1 酵母中中链脂肪酸乙酯的合成代谢途径
Fig.1 Metabolic pathway of medium-chain fatty acid ethyl ester synthesis in yeast
丙酮酸脱羧酶(pyruvate decarboxylase,PDC1);乙醛脱氢酶(cytosolic aldehyde dehydrogenase,ALD);乙酰辅酶A合成酶(acetyl-coA synthetase,ACS1);乙酰辅酶A羧化酶(acetyl-coA carboxylase,ACC);脂肪酸合成酶亚基(fatty acid synthase subunits,FAS);乙酯生物合成酶/乙醇己酰转移酶(ethyl ester biosynthesis/ethanol hexanoyl transferase,EEB/EHT);脂肪酰基辅酶A合成酶(fatty acyl-CoA synthetase,FAA);乙酰转移酶(acetyl transferase,AT);丙二酰/棕榈酰转移酶(malonyl/palmitoyl transferase,MPT);硫酯酶(thioesterase,TES);脂肪酰基辅酶A氧化酶(fatty acyl-CoA oxidase,POX);甾醇酰基转移酶相关酶(sterol acyltransferase-related enzymes,ARE);二酰甘油酰基转移酶(diacylglycerol acyltransferase,DGA)。
中链脂肪酰基CoA主要通过细胞内从头合成脂肪酸的途径产生,该途径主要在细胞质脂肪酸合成酶系统(fatty acid synthase system,FAS)中进行。 酵母细胞质脂肪酸合成酶由FAS1(β亚基)和FAS2(α亚基)组成,这两个亚基形成一个六聚体复合物(α6β6)[12]。当乙酰辅酶A在乙酰辅酶A羧化酶(ACC1)催化下转化为丙二酰辅酶A时,中链脂肪酰辅酶A的合成开始[13]。 乙酰辅酶A和丙二酰辅酶A随后进入FAS复合物的反应中心,分别转化为乙酰-ACP和丙二酰-ACP。脱羧后的丙二酰-ACP与乙酰-ACP缩合形成更长的酰基链[14]。葡萄酒发酵过程通常在厌氧条件下进行,当氧气供应不足时,乙酰辅酶A羧化酶的活性受到抑制,脂肪酸合成酶复合体释放中链脂肪酰基辅酶A[15]。 最后,中链脂肪酰基辅酶A在醇酰基转移酶的催化下,与乙醇合成中链脂肪酸乙酯,并分泌到细胞外[3]。
中链脂肪酸乙酯在葡萄酒陈酿过程中会发生水解与酯化的可逆动力学反应。中链脂肪酸乙酯在酵母发酵过程中经过酶促积累后,通常会超过平衡浓度,并且在陈酿期间会逐渐水解[16]。中链脂肪酸、乙醇和酯的相对比例会在葡萄酒贮存期间逐渐趋于平衡[17]。
2 葡萄酒酒精发酵过程中中链脂肪酸乙酯的调控
葡萄酒的酒精发酵过程中,酵母的新陈代谢不仅产生乙醇和CO2,还生成一些次级代谢产物,其中包括中链脂肪酸乙酯[18]。发酵过程中产生的中链脂肪酸乙酯含量受到多种因素的影响,包括酵母菌种、发酵温度、氮源供应和溶氧量等。
2.1 非酿酒酵母及其胞外提取物对中链脂肪酸乙酯的影响
中链脂肪酸乙酯主要由酵母发酵产生。 一般情况下,酿酒酵母与非酿酒酵母混合发酵相比于酿酒酵母纯发酵能产生更多的中链脂肪酸乙酯。酯类的合成与相互转化是通过酶促反应进行的。混合发酵和非酿酒酵母胞外提取物处理也能有效增加中链脂肪酸乙酯的含量[19]。HU K等[20]使用酿酒酵母与葡萄汁有孢汉逊酵母进行混合发酵,使中链脂肪酸乙酯的含量提高了37%。ZHANG B等[21]使用三株本土非酿酒酵母混合发酵葡萄酒,其中戴尔有孢圆酵母和耐热拉钱斯氏酵母的混合发酵显著增加了中链脂肪酸乙酯的含量。毕赤酵母属的多种酵母与酿酒酵母混合发酵也可以增加葡萄酒中链脂肪酸乙酯含量。MA D C等[22]使用不同比例的发酵毕赤酵母与酿酒酵母混合发酵,结果显示混合发酵可以显著提高中链脂肪酸乙酯的含量,且非酿酒酵母所占比例越高,中链脂肪酸乙酯含量提高越多。 罗来庆等[23]使用毕赤克鲁维酵母混合发酵干红葡萄酒,显著增加了己酸乙酯和辛酸乙酯的含量。SCANSANI S等[24]使用库德里阿兹威毕赤酵母与酿酒酵母混合发酵,显著提高了中链脂肪酸乙酯的含量。 毕赤酵母属酵母具有较高的酯化活性,这可能是其能够提高中链脂肪酸乙酯含量的原因之一。 除上述酵母外,假丝酵母属[25]、梅奇酵母属[26]、接合酵母属[27]等非酿酒酵母与酿酒酵母混合发酵都可以增加葡萄酒中的中链脂肪酸乙酯含量,非酿酒酵母对葡萄酒中链脂肪酸乙酯的影响如表1所示。然而,一些非酿酒酵母与酿酒酵母混合发酵无法增加中链脂肪酸乙酯的含量[28-29],或者在某些发酵体系下不能增加中链脂肪酸乙酯的含量[30],这需要研究者深入探究混合发酵条件下中链脂肪酸乙酯释放的调控机制。
表1 非酿酒酵母对葡萄酒中链脂肪酸乙酯含量的影响
Table 1 Effect of non-Saccharomyces cerevisiae on medium-chain fatty acid ethyl ester contents in wine

非酿酒酵母属 非酿酒酵母 对中链脂肪酸含量的影响 参考文献有孢圆酵母属汉逊酵母属戴尔有孢圆酵母葡萄有孢汉逊酵母葡萄有孢汉逊酵母季也蒙有孢汉逊酵母仙人掌有孢汉逊酵母假丝酵母属耐渗透压有孢汉逊酵母星形假丝酵母克鲁斯假丝酵母泽普林假丝酵母接合酵母属毕赤酵母属梅奇酵母属克鲁维酵母属拜尔接合酵母发酵毕赤酵母毕赤克鲁维酵母库德里阿兹威毕赤酵母美极梅奇酵母耐热拉钱斯氏酵母马克斯克鲁维酵母提高中链脂肪酸乙酯含量提高中链脂肪酸乙酯含量不提高中链脂肪酸乙酯含量提高丁酸乙酯含量降低中链脂肪酸乙酯含量,提高丁酸乙酯含量降低中链脂肪酸乙酯含量提高中链脂肪酸乙酯含量提高中链脂肪酸乙酯含量提高己酸乙酯、辛酸乙酯含量提高辛酸乙酯、癸酸乙酯含量提高中链脂肪酸乙酯含量提高中链脂肪酸乙酯含量提高中链脂肪酸乙酯含量提高中链脂肪酸乙酯含量提高中链脂肪酸乙酯含量提高中链脂肪酸乙酯含量降低中链脂肪酸乙酯含量提高中链脂肪酸乙酯含量[21][20][21,28-29][31][31][32][33][34][35][36][25][27][22][23][24][37][21][30][38]
多数非酿酒酵母与酿酒酵母混合发酵能显著增加葡萄酒中链脂肪酸乙酯含量,但过高的非酿酒酵母接种比例可能导致葡萄酒产生不良风味,从而影响发酵过程的稳定性[22]。MA D C等[22]使用不同比例的发酵毕赤酵母酿制葡萄酒,发现过高比例的非酿酒酵母(10∶1)会导致葡萄酒中脂肪酸含量过高使葡萄酒香气质量下降。 ZHANG B Q等[39]研究表明,较高比例的非酿酒酵母导致乙酸乙酯含量过高,葡萄酒出现溶剂味。非酿酒酵母的胞外提取物在葡萄酒增香中起着关键作用,使用非酿酒酵母胞外提取物处理葡萄酒不仅能防止非酿酒酵母对葡萄酒香气带来负面影响,还可以提高葡萄酒中链脂肪酸乙酯含量。KONG C L等[40]在黑比诺葡萄酒发酵过程中分别添加了发酵毕赤酵母和胶红酵母的胞外提取物,显著提高了中链脂肪酸乙酯的含量,并在瓶贮期间减少了中链脂肪酸乙酯的水解,胞外提取物对中链脂肪酸乙酯的生成和稳定性具有积极作用。 尹荐等[41]将其应用于干白葡萄酒酿造,证明了胞外提取物处理在干白葡萄酒酿造过程中对中链脂肪酸乙酯生成的积极作用。
2.2 非酿酒酵母与酿酒酵母细胞间接触对中链脂肪酸乙酯浓度的影响
葡萄酒混菌发酵体系下存在酿酒酵母与非酿酒酵母之间的细胞接触,细胞间接触机制会影响酵母菌株代谢,进而影响葡萄酒中链脂肪酸乙酯的含量。细胞间接触对中链脂肪酸乙酯含量的影响存在菌株特异性。 PETITGONNET C等[42]使用双室系统隔离耐热拉钱斯氏酵母和酿酒酵母进行混合发酵。 结果显示,细胞间接触介导了糖和氮代谢的外代谢组的显著差异,显示出许中链脂肪酸乙酯的产量减少。 而HU K等[43]研究表明,毕赤克鲁维酵母与酿酒酵母的细胞间接触作用可以提高葡萄酒中链脂肪酸乙酯含量。周得刚等[44]将戴尔有孢圆酵母与酿酒酵母进行双室混菌发酵,结果显示细胞间的物理接触显著增加了葡萄酒中链脂肪酸乙酯的含量。但目前关于细胞间物理接触作用对中链脂肪酸乙酯的调控机制尚不明确,未来需要将转录组学结合蛋白组学进行深入研究。
2.3 发酵温度对中链脂肪酸乙酯的影响
发酵温度会影响酵母代谢,从而影响中链脂肪酸乙酯的合成。DEED R C等[45]使用四种不同的酵母菌株,在25 ℃和12.5 ℃条件下发酵长相思葡萄酒,发现低温条件下中链脂肪酸乙酯的含量更高。SCHWINN M等[46]研究了雷司令葡萄酒发酵过程中不同温度对香气化合物形成的影响,结果表明,在19 ℃时,中链脂肪酸乙酯浓度最高。徐超等[47]研究表明,13 ℃的发酵条件下,酿酒酵母中与线粒体短链脂肪酸合成相关的基因相较于25 ℃时有所上调,说明温度可调节酵母中脂肪酸代谢途径进而影响中链脂肪酸乙酯的合成。
2.4 添加可同化氮对中链脂肪酸乙酯的影响
葡萄汁中含有酵母发酵所需的可同化氮,氮源的充足与否直接影响香气物质的组成和含量。 当氮源不足时,葡萄酒发酵过程可能会停滞[48],但当人工添加氮源(不超过500 mg/L),葡萄酒中链脂肪酸乙酯的含量显著增加[49]。 研究表明,推迟添加氮源的时机有助于提高酿酒酵母中链脂肪酸乙酯的生成[50]。HU K等[51]研究表明,添加氮源可改变酵母碳通量的分配,激活了中链脂肪酸及其乙酯的生成,并且氮源添加的时机对中链脂肪酸乙酯的生成具有显著影响。SEGUINOT P等[52]研究表明,氮源添加的时机对葡萄酒香气物质的影响大于氮源的组成,其中在静息期添加氮源能够显著提高己酸乙酯的含量。
2.5 氧气对中链脂肪酸乙酯的影响
葡萄酒中的溶氧量不仅能调节酵母的新陈代谢,还能影响酵母对中链脂肪酸及其乙酯的合成[50]。BARDI L等[53]研究了在模拟葡萄汁中接入酿酒酵母的情况,发现溶氧浓度与中链脂肪酸乙酯的含量密切相关。低溶氧浓度能够诱导中链脂肪酸乙酯的合成,并且在氧气限制条件下,不同发酵阶段中链脂肪酸乙酯的表现各异。 当溶氧量较高时,中链脂肪酸乙酯的含量较低;随着酵母的繁殖,溶氧量迅速下降,中链脂肪酸乙酯的含量逐渐上升,并在发酵中期达到最大值,随后开始下降。 MARCHESINI S等[54]研究表明,在氧气限制条件下,乙酰辅酶A羧化酶的活性被抑制,导致不饱和脂肪酸合酶的合成受限。此时,中链脂肪酸通过脂肪酰延长反应提前从脂肪酸合酶中释放出来,进而直接参与中链脂肪酸乙酯的合成。 氧化还原电位(oxidationreduction potential,ORP)作为溶氧状态的灵敏指示参数,其动态变化与体系氧含量呈现显著相关性。通过实时监测ORP的波动轨迹,能够精准量化曝气操作引入的溶解氧水平,进而通过氧化还原代谢调控网络调控葡萄酒中链脂肪酸乙酯的含量。XUE S J等[55]通过测定不同ORP下酵母中链脂肪酸乙酯代谢相关基因的表达量,揭示了发酵过程中ORP调控中链脂肪酸乙酯生成的机制,并将ORP作为曝气开关应用于混合发酵的香气调控,研究发现,在不同混合发酵体系中,生成最多中链脂肪酸乙酯时的ORP值有所不同[56]。靳国杰等[57]对酒精发酵过程中对ORP的阶段性控制进行了研究,发现在0~48 h将ORP控制在0 mV,随后调整为自然ORP时葡萄酒中链脂肪酸乙酯的含量显著提高。
2.6 添加外源脂肪酸对中链脂肪酸乙酯的影响
发酵体系中不同的脂肪酸成分会影响酒精发酵过程中酵母的生长、脂肪酸的重新合成及相关酶的活性[18]。脂肪酸作为中链脂肪酸乙酯的前体物质,其浓度也会影响葡萄酒中链脂肪酸乙酯的合成[58]。早期研究表明,酒精发酵过程中添加中链脂肪酸会抑制酵母生长[59],当细胞生长减缓且脂质合成受阻时,乙酯的合成与释放更为显著[53]。SAERENS S M G等[11]研究表明,在野生酿酒酵母发酵过程中添加高浓度的己酸和辛酸,能够显著提高中链脂肪酸乙酯的水平,提升幅度可达数倍。近期,LIU P T等[60]报告指出,在酒精发酵中添加41~410 mg/L的不饱和脂肪酸(如亚油酸、油酸、亚麻酸)可能导致乙醇O-酰基转移酶(由EEB1基因编码)的过表达,从而促进中链脂肪酸乙酯的生物合成。 KONG C L等[61]在发酵的不同阶段向葡萄酒中添加中链脂肪酸,研究结果表明,在发酵中期添加中链脂肪酸能更有效地促进中链脂肪酸乙酯的生成,可能是因为此时酵母细胞的代谢活性和酯合成酶的活性较高,从而有利于中链脂肪酸乙酯的合成与积累。
3 葡萄酒苹果酸乳酸发酵和陈酿过程中的调控
3.1 苹果酸乳酸发酵过程中中链脂肪酸乙酯的调控
苹果酸乳酸发酵(malolactic fermentation,MLF)是酒精发酵结束后进行的二次发酵过程,能够改变葡萄酒的化学成分,生成己酸乙酯、辛酸乙酯等物质,降低酒精度和酸度,进而提高生物稳定性[62]。以往的研究已经证明,乳酸菌与酿酒酵母的混合发酵可以提高葡萄酒中链脂肪酸乙酯含量[63]。 近年来,研究者开始使用多种酵母混合发酵来调控苹果酸乳酸发酵过程,从而提高葡萄酒中链脂肪酸乙酯的含量。ZHAO H Y等[64]使用发酵毕赤酵母、酒类酒球菌与酿酒酵母的混合发酵显著提高了中链脂肪酸乙酯的含量。HU K等[65]使用发酵毕赤酵母、短乳杆菌与酿酒酵母混合发酵,证明了发酵毕赤酵母能够增强短乳杆菌的活性,并提高中链脂肪酸乙酯的浓度。DEVI A等[66]研究了在酒精发酵过程中不同时间点接种酒酒球菌和植物乳杆菌对葡萄酒中挥发性化合物的影响。 结果表明,与单独进行酒精发酵的对照组相比,MLF处理的葡萄酒中己酸乙酯、辛酸乙酯和癸酸乙酯的含量有所增加。尤其是在酒精发酵后早期接种乳酸菌的葡萄酒中,这些酯类化合物的含量增加尤为显著。 ZHANG B等[67]将多株本土酒酒球菌与植物乳杆菌、酿酒酵母共接种进行混合发酵,结果表明,共接种能够提高中链脂肪酸乙酯的产量。
3.2 陈酿过程中中链脂肪酸乙酯的调控
在葡萄酒的成熟陈酿过程中,总酯的含量受到多种因素的影响,包括酯化作用、水解作用、酵母和乳酸菌细胞的溶解与释放化合物,以及酯类物质之间的相互作用等[68]。葡萄酒在陈酿过程中,酯类物质的组分会发生变化,通常中链脂肪酸乙酯呈现减少趋势[47]。为了解决这一问题,有研究表明,在葡萄酒储存过程中,咖啡酸和N-乙酰半胱氨酸能够抑制中链脂肪酸乙酯的水解[69],而谷胱甘肽则通过抑制氧化作用减少酯类物质的水解[70]。 ŠUKLJE K等[71]研究发现,在储藏期间,癸酸乙酯的含量会减少,而在低SO2含量的情况下,添加咖啡酸能够有效阻止辛酸乙酯、癸酸乙酯的水解。近年来,葡萄酒生产商和科研人员尝试设计和开发高效、快速且低成本的人工陈酿技术,以加速红葡萄酒的陈酿过程[72],并解决传统橡木桶陈酿过程中果香难以维持以及中链脂肪酸乙酯含量较低的问题[8]。 GRANJASOARES J等[73]采用微氧陈酿和橡木块相结合的方法,在不锈钢罐中构建了一种新的陈酿体系,从而提高了葡萄酒中链脂肪酸乙酯的含量。 GARCÍA R M等[74]证明了陈酿过程中添加酒泥能够提高葡萄酒中链脂肪酸乙酯的含量,但结合超声或者微波进行辅助陈酿时,则会降低其含量。此前的实验中也观察到类似现象,可能的原因是超声和微波能量的加热效应,加速了中链脂肪酸乙酯的挥发[75-76]。
4 中链脂肪酸乙酯的分子生物学调控
4.1 中链脂肪酸乙酯合成相关基因对中链脂肪酸乙酯的调控
相较于乙酸酯,中链脂肪酸乙酯的生物合成研究起步较晚,且主要集中在酿酒酵母的醇酰基转移酶上。MASON A B等[77]在分析乙酸酯合成酶(ATF1,LgATF1,ATF2)后,提出了第四种酯合成酶—乙醇己酰转移酶,该酶催化乙醇和己酰CoA合成己酸乙酯。VERSTREPEN K J等[78]研究了atf1Δ和atf2Δ双基因缺失菌株和野生菌株,发现两者产生的中链脂肪酸乙酯含量相同,从而证明了ATF1和ATF2基因并未参与中链脂肪酸乙酯的合成。SAERENS S M G等[11]研究两种乙醇O-酰基转移酶EEB1和EHT1,结果表明,与野生菌株相比,酿酒酵母BY4741 eeb1Δ菌株中,己酸乙酯、辛酸乙酯、癸酸乙酯的含量分别减少了88%,45%,40%。在eeb1Δ菌株中,缺失EHT1基因对癸酸乙酯的生产没有影响,仅导致己酸乙酯减少了36%,辛酸乙酯减少了20%。 酿酒酵母BY4741 eht1Δeeb1Δ双基因缺失菌株与eeb1Δ单基因缺失菌株相比,己酸乙酯、癸酸乙酯的含量相似,但辛酸乙酯的含量减少约30%。 这表明,Eht1对中链脂肪酸乙酯的合成起着次要作用,而Eeb1则是中链脂肪酸乙酯合成中最重要的酶。在eht1Δeeb1Δ双基因缺失菌株中,进一步缺失YMR210w基因,导致己酸乙酯和辛酸乙酯的含量进一步显著减少,表明YMR210w基因也参与中链脂肪酸乙酯的合成。SAERENS S M G等[7]研究发现,添加辛酸能够诱导EEB1和EHT1基因过表达,但EEB1或EHT1基因的过表达并未显著提高中链脂肪酸乙酯的含量。此外,研究表明,酰基转移酶Eht1和Eeb1受到中链脂酰辅酶A的诱导调控[79]。葡萄酒中链脂肪酸乙酯的浓度取决于其底物—中链脂酰辅酶A的浓度,因此,中链脂酰辅酶A浓度是中链脂肪酸乙酯合成的限制因素[11]。但近期的研究表明,过表达EEB1基因可以提高中链脂肪酸乙酯的产量。YINH等[80]在巴斯德酵母中过表达EEB1基因,显著提高了己酸乙酯和辛酸乙酯的含量。LIU P等[48]在酿酒酵母中过表达EEB1基因,显著提高了辛酸乙酯和癸酸乙酯的含量。添加不饱和脂肪酸后,这些酯类的含量进一步增加。然而,过量添加不饱和脂肪酸导致己酸乙酯和辛酸乙酯的含量下降。此外,在不同量的不饱和脂肪酸添加下,EEB1基因的表达量保持一致,这一结果推翻了SAERENS S M G等[11]之前的假设。通过过表达EEB1基因对中链脂肪酸乙酯浓度的提高有限,SHI W等[81]将草莓中的乙醇酰基转移酶引入酿酒酵母并使其稳定表达,进一步提高了中链脂肪酸乙酯的产量。
4.2 中链脂肪酸乙酯前体物质相关基因对中链脂肪酸乙酯前体物质调控
中链脂肪酰基辅酶A是中链脂肪酸乙酯合成的关键前体物质。减少其转化为其他化合物并提高其合成效率,均可有效提升中链脂肪酸乙酯的产量。CHEN Y等[82]通过敲除酿酒酵母中的FAA1基因,显著提高了己酸乙酯的产量。FAA1基因主要控制着大多数外源长链脂肪酸的活化。当外源脂肪酸过高时,酵母细胞内源长链酯酰辅酶A的浓度增加,进而抑制乙酰辅酶A羧化酶的活性。这一过程导致脂肪酸合成酶复合体系释放的中链脂肪酸及其酯酰辅酶A的浓度下降,从而抑制中链脂肪酸乙酯的合成。THOMPSON R A等[83]在酿酒酵母中联合敲除了FAA2和PXA2基因,这两个基因参与酯酰辅酶A运输至过氧化物酶体进行β-氧化。 通过敲除这些基因,减少了酯酰辅酶A的β-氧化过程,使得更多的酯酰辅酶A可用于中链脂肪酸乙酯的合成。DE JONG B W等[84]通 过 敲 除DGA1、LRO1、ARE1、ARE2和POX1基因,减少了脂肪酰基辅酶A向三酰甘油、甾醇酯和乙酰辅酶A的转化。 除减少中链脂肪酸乙酯前体物质流向其他代谢途径外,通过提高其合成量也可以提高中链脂肪酸乙酯的产量。过表达FAS1和FAS2基因可以提高中链脂肪酰基辅酶A的产量,进而提高中链脂肪酸乙酯的产量[83,85]。DE JONG B W等[86]通 过 过 表 达ADH2、ALD6、acsSEL641P、ACC1S1157A,S659A和ACB1基因,增加了乙酰辅酶A的供应以及酰基辅酶A的合成,提高了中链脂肪酸乙酯的产量。
5 总结与展望
中链脂肪酸乙酯是葡萄酒中的重要香气物质,对其感官品质具有显著影响。发酵条件,尤其是温度、氮源和氧气控制等因素,对中链脂肪酸乙酯的含量具有直接的调节作用,显著影响其形成与稳定性。在现有研究中,酵母发酵仅能在特定环境下提升中链脂肪酸乙酯含量,而环境变化往往导致其含量发生显著波动。这种现象限制了工艺优化在实际生产中的应用。 未来,研究应重点选育对环境变化不敏感且增香效果稳定的酵母,以更好地应对复杂多变的葡萄酒酿造条件,从而稳定提升中链脂肪酸乙酯的含量。
在葡萄酒的陈酿过程中,中链脂肪酸乙酯的形成对于香气的复杂度和持久性具有显著影响。未来的研究应综合考虑多种因素对陈酿过程中中链脂肪酸乙酯含量的潜在影响。通过构建数学模型并运用先进的分析方法,可深入探究各变量单独或协同作用对中链脂肪酸乙酯含量的影响。此类研究不仅能深化对葡萄酒陈酿过程中化学变化的理解,还能为实际生产提供指导,优化工艺流程,从而提升葡萄酒的感官品质。
由于国家法律限制葡萄酒酿造中工程改造菌株的使用,中链脂肪酸乙酯的分子生物学调控研究主要集中于生物柴油领域。此外,由于酵母在不同发酵介质和条件下的代谢特性存在差异,当前许多关于中链脂肪酸乙酯调控的研究难以直接应用于葡萄酒酿造。未来研究应结合葡萄酒发酵体系,应用多组学技术,从分子机制层面深入解析酵母的代谢途径。这将有助于深入解析酵母中链脂肪酸乙酯的生成机制,提升工程菌株在葡萄酒发酵中的安全性,确保其可安全应用于葡萄酒酿造,从而增加中链脂肪酸乙酯的含量,最终增强葡萄酒的感官品质和市场竞争力。
[1]LI N,WANG L,YIN J,et al.Adjustment of impact odorants in Hutai-8 rose wine by co-fermentation of Pichia fermentans and Saccharomyces cerevisiae[J].Food Res Int,2022,153:110959.
[2]LIU S,LOU Y,LI Y,et al.Aroma characteristics of volatile compounds brought by variations in microbes in winemaking[J].Food Chem,2023,420:136075.
[3]KUMAR Y, RICCI A, PARPINELLO G P, et al.Dealcoholized wine: a scoping review of volatile and non-volatile profiles,consumer perception,and health benefits[J].Food Bioprocess Technol, 2024, 17(11): 3525-3545.
[4]HE Y,WANG X,LI P,et al.Research progress of wine aroma components:A critical review[J].Food Chem,2023,402:134491.
[5]SUMBY K M, GRBIN P R, JIRANEK V.Microbial modulation of aromatic esters in wine: Current knowledge and future prospects[J].Food Chem,2010,121(1):1-16.
[6]ARITOMI K,HIROSAWA I,HOSHIDA H,et al.Self-cloning yeast strains containing novel FAS2 mutations produce a higher amount of ethyl caproate in Japanese sake[J].Biosci Biotechnol Biochem,2004, 68(1):206-214.
[7]SAERENS S M G,DELVAUX F,VERSTREPEN K J,et al.Parameters affecting ethyl ester production by Saccharomyces cerevisiae during fermentation[J].Appl Environ Microbiol,2008,74(2):454-461.
[8]LI N,LI G,LI A,et al.Synergy effect between fruity esters and potential odorants on the aroma of Hutai-8 rose wine revealed by threshold,S-curve,and σ-τ plot methods[J].J Agr Food Chem,2023,71(37):13869-13879.
[9]ZHANG J,WANG X,ZHANG F,et al.Influence of an indigenous yeast,CECA,from the Ningxia wine region of China, on the yeast community dynamics and aroma of Cabernet Sauvignon wines[J].LWT-Food Sci Technol,2023,189:115506.
[10]SLEGERS A,ANGERS P,OUELLET É,et al.Volatile compounds from grape skin, juice and wine from five interspecific hybridgrape cultivars grown in Québec(Canada)for wine production[J].Molecules,2015,20(6):10980-11016.
[11]SAERENS S M G,VERSTREPEN K J,VAN LAERE S D M,et al.The Saccharomyces cerevisiae EHT1 and EEB1 genes encode novel enzymes with medium-chain fatty acid ethyl ester synthesis and hydrolysis capacity[J].J Biol Chem,2006,281(7):4446-4456.
[12]RUNGUPHAN W, KEASLING J D.Metabolic engineering of Saccharomyces cerevisiae for production of fatty acid-derived biofuels and chemicals[J].Metab Eng,2014,21:103-113.
[13]SHI S,CHEN Y,SIEWERS V,et al.Improving production of malonyl coenzyme A-derived metabolites by abolishing Snf1-dependent regulation of Acc1[J].mBio,2014,5(3):e01130-1114.
[14]HUSSAIN S A,HAMEED A,KHAN M A K,et al.Engineering of fatty acid synthases(FASs)to boost the production of medium-chain fatty acids(MCFAs)in Mucor circinelloides[J].Int J Mol Sci,2019,20(3):786.
[15]DUFOUR J P,MALCORPS P H,SILCOCK P.Control of ester synthesis during brewery fermentation[J].Brew Yeast Ferment Perform,2003:213-233.
[16]ECHAVE J,BARRAL M,FRAGA-CORRAL M,et al.Bottle aging and storage of wines:A review[J].Molecules,2021,26(3):713.
[17]RAMEY D D,OUGH C S.Volatile ester hydrolysis or formation during storage of model solutions and wines[J].J Agr Food Chem,1980,28(5):928-934.
[18]LILLY M,LAMBRECHTS M G,PRETORIUS I S.Effect of increased yeast alcohol acetyltransferase activity on flavor profiles of wine and distillates[J].Appl Environ Microbiol,2000,66(2):744-753.
[19]WANG X,FAN G,PENG Y,et al.Mechanisms and effects of non-Saccharomyces yeast fermentation on the aromatic profile of wine[J].J Food Compost Anal,2023,124:105660.
[20]HU K,JIN G J,MEI W C,et al.Increase of medium-chain fatty acid ethyl ester content in mixed H.uvarum/S.cerevisiae fermentation leads to wine fruity aroma enhancement[J].Food Chem,2018,239:495-501.
[21]ZHANG B,TANG C,YANG D,et al.Effects of three indigenous non-Saccharomyces yeasts and their pairwise combinations in co-fermentation with Saccharomyces cerevisiae on volatile compounds of Petit Manseng wines[J].Food Chem,2022,368:130807.
[22]MA D C,YAN X,WANG Q Q,et al.Performance of selected P.fermentans and its excellular enzyme in co-inoculation with S.cerevisiae for wine aroma enhancement[J].LWT-Food Sci Technol,2017,86:361-370.
[23]罗来庆,林海明,焦宇知,等.非酿酒酵母与酿酒酵母混合发酵对葡萄酒香气的影响[J].中国酿造,2022,41(10):89-94.
[24]SCANSANI S, VAN WYK N, NADER K B, et al.The film-forming Pichia spp.in a winemaker's toolbox:A simple isolation procedure and their performance in a mixed-culture fermentation of Vitis vinifera L.cv.Gewürztraminer must[J].Int J Food Microbiol,2022,365:109549.
[25]RUSSO P, TUFARIELLO M, RENNA R, et al.New insights into the oenological significance of Candida zemplinina: Impact of selected autochthonous strains on the volatile profile of Apulian wines[J].Microorganisms,2020,8(5):628.
[26]VICENTE J,RUIZ J,BELDA I,et al.The genus Metschnikowia in enology[J].Microorganisms,2020,8(7):1038.
[27]CIOCH-SKONECZNY M,GRABOWSKI M,SATORA P,et al.The use of yeast mixed cultures for deacidification and improvement of the composition of cold climate grape wines[J].Molecules,2021,26(9):2628.
[28]FRESNO J M D,LOIRA I,ESCOTT C,et al.Application of Hanseniaspora vineae yeast in the production of rosé wines from a blend of Tempranillo and Albillo grapes[J].Fermentation,2021,7(3):141.
[29]VALERA M J,OLIVERA V,BOIDO E,et al.Wine aroma characterization of the two main fermentation yeast species of the apiculate genus Hanseniaspora[J].Fermentation,2021,7(3):162.
[30]HRANILOVIC A,ALBERTIN W,CAPONE D L,et al.Impact of Lachancea thermotolerans on chemical composition and sensory profiles of Merlot wines[J].Food Chem,2021,349:129015.
[31]BADURA J, KIENE F, BREZINA S, et al.Aroma profiles of Vitis vinifera L.cv.Gewürztraminer must fermented with co-cultures of Saccharomyces cerevisiae and seven Hanseniaspora spp.[J].Fermentation,2023,9(2):109.
[32]FILIPPOUSI M E,CHALVANTZI I,MALLOUCHOS A,et al.The use of Hanseniaspora opuntiae to improve 'Sideritis' wine quality, a lateripening Greek grape variety[J].Foods,2024,13(7):1061.
[33]ALBERICO G, CAPECE A, MAURIELLO G, et al.Influence of microencapsulation on fermentative behavior of Hanseniaspora osmophila in wine mixed starter fermentation[J].Fermentation,2021,7(3):112.
[34]刘文翰,王斌,姬茹婕,等.星形假丝酵母在强化赤霞珠葡萄酒玫瑰香气中的应用[J].中国酿造,2021,40(12):45-51.
[35]LI J C,WILKINSON K L,FORD C M,et al.Effect of non-Saccharomyces yeast strains on 3-isobutyl-2-methoxypyrazine concentration and aroma properties in Sauvignon Blanc wines during fermentation[J].Aust J Grape Wine Res,2022,28(4):607-620.
[36]FRANCESCA N, NASELLI V, PRESTIANNI R, et al.Impact of two new non-conventional yeasts,Candida oleophila and Starmerella lactiscondensi, isolated from sugar-rich substrates, on Frappato wine aroma[J].Food Biosci,2024,57:103500.
[37]BINATI R L,MAULE M,LUZZINI G,et al.From bioprotective effects to diversification of wine aroma:Expanding the knowledge on Metschnikowia pulcherrima oenological potential[J].Food Res Int,2023,174:113550.
[38]BARONEE,PONTICELLOG,GIARAMIDAP,etal.UseofKluyveromyces marxianus to increase free monoterpenes and aliphatic esters in white wines[J].Fermentation,2021,7(2):79.
[39]ZHANG B Q,LIU H,XUE J,et al.Use of Torulaspora delbrueckii and Hanseniaspora vineae co-fermentation with Saccharomyces cerevisiae to improve aroma profiles and safety quality of Petit Manseng wines[J].LWT-Food Sci Technol,2022,161:113360.
[40]KONG C L,LI A H,JIN G J,et al.Evolution of volatile compounds treated with selected non-Saccharomyces extracellular extract during Pinot noir winemaking in monsoon climate[J].Food Res Int,2019,119:177-186.
[41]尹荐,陶永胜,孙玮璇,等.优选非酿酒酵母胞外酶增香酿造干白葡萄酒效果[J].农业工程学报,2020,36(4):278-286.
[42]PETITGONNET C,KLEIN G L,ROULLIER-GALL C,et al.Influence of cell-cell contact between L.thermotolerans and S.cerevisiae on yeast interactions and the exo-metabolome[J].Food Microbiol,2019,83:122-133.
[43]HU K, ZHAO H, EDWARDS N, et al.The effects of cell-cell contact between Pichia kluyveri and Saccharomyces cerevisiae on amino acids and volatiles in mixed culture alcoholic fermentations[J].Food Microbiol,2022,103:103960.
[44]周得刚,徐彬艳,王青霞,等.戴尔有孢圆酵母与酿酒酵母细胞间接触对‘赤霞珠’葡萄酒风味品质的影响[J].中国农业科学,2024,57(16):3264-3282.
[45]DEED R C, FEDRIZZI B, GARDNER R C.Influence of fermentation temperature, yeast strain, and grape juice on the aroma chemistry and sensory profile of Sauvignon blanc wines[J].J Agr Food Chem,2017,65(40):8902-8912.
[46]SCHWINN M,DURNER D,WACKER M,et al.Impact of fermentation temperature on required heat dissipation, growth and viability of yeast,on sensory characteristics and on the formation of volatiles in 'Riesling'[J].Aust J Grape Wine Res,2019,25(2):173-184.
[47]徐超,胡文效,陈明光,等.葡萄酒发酵香气物质调控研究进展[J].中外葡萄与葡萄酒,2024(1):81-93.
[48]LIU P,WANG Y,YE D,et al.Effect of the addition of branched-chain amino acids to non-limited nitrogen synthetic grape must on volatile compounds and global gene expression during alcoholic fermentation[J].Aust J Grape Wine Res,2018,24(2):197-205.
[49]董书甲,秦伟帅,刘灿珍,等.低氮对酿酒酵母发酵过程中酯类物质合成的影响[J].中国酿造,2018,37(1):149-154.
[50]UGLIANO M, SIEBERT T, MERCURIO M, et al.Volatile and color composition of young and model-aged Shiraz wines as affected by diammonium phosphate supplementation before alcoholic fermentation[J].J Agr Food Chem,2008,56(19):9175-9182.
[51]HU K, JIN G J, XU Y H, et al.Enhancing wine ester biosynthesis in mixed Hanseniaspora uvarum/Saccharomyces cerevisiae fermentation by nitrogen nutrient addition[J].Food Res Int,2019,123:559-566.
[52]SEGUINOT P, ROLLERO S, SANCHEZ I, et al.Impact of the timing and the nature of nitrogen additions on the production kinetics of fermentative aromas by Saccharomyces cerevisiae during winemaking fermentation in synthetic media[J].Food Microbiol,2018,76:29-39.
[53]BARDI L, CRIVELLI C, MARZONA M.Esterase activity and release of ethyl esters of medium-chain fatty acids by Saccharomyces cerevisiae during anaerobic growth[J].Can J Microbiol,1998,44(12):1171-1176.
[54]MARCHESINI S, POIRIER Y.Futile cycling of intermediates of fatty acid biosynthesis toward peroxisomal β-oxidation in Saccharomyces cerevisiae[J].J Biol Chem,2003,278(35):32596-32601.
[55]XUE S J,ZHANG J R,ZHANG R X,et al.Oxidation-reduction potential affects medium-chain fatty acid ethyl ester production during wine alcohol fermentation[J].Food Res Int,2022,157:111369.
[56]XUE S J,WANG L,CHEN S,et al.Controlled aeration driven by oxidation-reduction potential affects ester profile in wine alcohol fermentation with different starter cultures[J].Aust J Grape Wine Res, 2023,2023(1):5667458.
[57]靳国杰,王馨茹,瞿嘉宁,等.ORP阶段性控制提高葡萄酒中链脂肪酸乙酯和高级醇含量研究[J].农业机械学报,2024,55(2):353-362.
[58]FARIÑA L, MEDINA K, URRUTY M, et al.Redox effect on volatile compound formation in wine during fermentation by Saccharomyces cerevisiae[J].Food Chem,2012,134(2):933-939.
[59]VIEGAS C A,ROSA M F,SÁ-CORREIA I,et al.Inhibition of yeast growth by octanoic and decanoic acids produced during ethanolic fermentation[J].Appl Environ Microbiol,1989,55(1):21-28.
[60]LIU P T,ZHANG B Q,DUAN C Q,et al.Pre-fermentative supplementation of unsaturated fatty acids alters the effect of overexpressing ATF1 and EEB1 on esters biosynthesis in red wine[J].LWT-Food Sci Technol,2020,120:108925.
[61]KONG C L,MA N,YIN J,et al.Fine tuning of medium chain fatty acids levels increases fruity ester production during alcoholic fermentation[J].Food Chem,2021,346:128897.
[62]PÉREZ-MARTÍN F,IZQUIERDO-CAÑAS P M,SESEÑA S,et al.Aromatic compounds released from natural precursors by selected Oenococcus oeni strains during malolactic fermentation[J].Eur Food Res Technol,2015,240:609-618.
[63]YANG L,ZHU X,MAO Y,et al.Effect of different inoculation strategies of mixed culture Saccharomyces cerevisiae/Oenococcus oeni on the aroma quality of Chardonnay wine[J].Food Res Int,2024,190:114636.
[64]ZHAO H Y, LI Y Q, LIU L X, et al.Effects of inoculation timing and mixed fermentation with Pichia fermentans on Oenococcus oeni viability,fermentation duration and aroma production during wine malolactic fermentation[J].Food Res Int,2022,159:111604.
[65]HU K,ZHAO H Y,KANG X,et al.Fruity aroma modifications in Merlot wines during simultaneous alcoholic and malolactic fermentations through mixed culture of S.cerevisiae, P.fermentans, and L.brevis[J].LWT-Food Sci Technol,2022,154:112711.
[66]DEVI A, ANU-APPAIAH K A, LIN T F.Timing of inoculation of Oenococcus oeni and Lactobacillus plantarum in mixed malo-lactic culture along with compatible native yeast influences the polyphenolic,volatile and sensory profile of the Shiraz wines[J].LWT-Food Sci Technol,2022,158:113130.
[67]ZHANG B,LIU D,LIU H,et al.Impact of indigenous Oenococcus oeni and Lactiplantibacillus plantarum species co-culture on Cabernet Sauvignon wine malolactic fermentation:Kinetic parameters,color and aroma[J].Food Chem: X,2024,22:101369.
[68]ANCÍN-AZPILICUETA C,GONZÁLEZ-MARCO A,JIMÉNEZ-MORENO N.Evolution of esters in aged Chardonnay wines obtained with different vinification methods[J].J Sci Food Agr,2009,89(14):2446-2451.
[69]ROUSSIS I G,LAMBROPOULOS I,PAPADOPOULOU D.Inhibition of the decline of volatile esters and terpenols during oxidative storage of Muscat-white and Xinomavro-red wine by caffeic acid and N-acetylcysteine[J].Food Chem,2005,93(3):485-492.
[70]ANDU′JAR-ORTIZ I, CHAYA C, MARTÍN-ÁLVAREZ P J, et al.Impact of using new commercial glutathione enriched inactive dry yeast oenological preparations on the aroma and sensory properties of wines[J].Int J Food Prop,2014,17(5):987-1001.
[71]ŠUKLJE K,ANTALICK G,BUICA A,et al.Inactive dry yeast application on grapes modify Sauvignon Blanc wine aroma[J].Food Chem,2016,197:1073-1084.
[72]MA T, WANG J, WANG H, et al.Wine aging and artificial simulated wine aging:Technologies,applications,challenges,and perspectives[J].Food Res Int,2022,153:110953.
[73]GRANJA-SOARES J,ROQUE R,CABRITA M J,et al.Effect of innovative technology using staves and micro-oxygenation on the odorant and sensory profile of aged wine spirit[J].Food Chem,2020,333:127450.
[74]GARCÍA R M, MARTÍNEZ-LAPUENTE L, GUADALUPE Z, et al.Ultrasound and microwave techniques for assisting ageing on lees of red wines[J].Food Chem,2023,426:136660.
[75]LUKIC′ K,BRNCˇIC′ M,C′URKO N,et al.Effects of high power ultrasound treatments on the phenolic,chromatic and aroma composition of young and aged red wine[J].Ultrason Sonochem,2019,59:104725.
[76]DAI N,ZHANG X,CAI Z,et al.The effect of different pulsed magnetic field and microwave composite treatment on the aroma compounds and sensory characteristics of soy-sauce flavor Chinese liquor[J].CyTA-J Food,2021,19(1):793-804.
[77]MASON A B,DUFOUR J P.Alcohol acetyltransferases and the significance of ester synthesis in yeast[J].Yeast,2000,16(14):1287-1298.
[78]VERSTREPEN K J,VAN LAERE S D M,VANDERHAEGEN B M P,et al.Expression levels of the yeast alcohol acetyltransferase genes ATF1,Lg-ATF1, and ATF2 control the formation of a broad range of volatile esters[J].Appl Environ Microbiol,2003,69(9):5228-5237.
[79]LILLY M,BAUER F F,LAMBRECHTS M G,et al.The effect of increased yeast alcohol acetyltransferase and esterase activity on the flavour profiles of wine and distillates[J].Yeast,2006(23):641-659.
[80]YIN H, LIU L P, YANG M, et al.Enhancing medium-chain fatty acid ethyl ester production during beer fermentation through EEB1 and ETR1 overexpression in Saccharomyces pastorianus[J].J Agr Food Chem,2019,67(19):5607-5613.
[81]SHI W, LI J, CHEN Y, et al.Enhancement of C6-C10 fatty acid ethyl esters production in Saccharomyces cerevisiae CA by metabolic engineering[J].LWT-Food Sci Technol,2021,145:111496.
[82]CHEN Y,FU C Y F, LI F, GUO J, et al.Enhanced ethyl caproate production of Chinese liquor yeast by overexpressing EHT1 with deleted FAA1[J].J Ind Microbiol Biotechnol,2014,41(3):563-572.
[83]THOMPSON R A,TRINH C T.Enhancing fatty acid ethyl ester production in Saccharomyces cerevisiae through metabolic engineering and medium optimization[J].Biotechnol Bioeng,2014,111(11):2200-2208.
[84]DE JONG B W,SIEWERS V,NIELSEN J.Physiological and transcriptional characterization of Saccharomyces cerevisiae engineered for production of fatty acid ethyl esters[J].FEMS Yeast Res,2016,16(1):fov105.
[85]BENNIS N X,BIESEMAN J,DARAN J M G.Unlocking lager's flavour palette by metabolic engineering of Saccharomyces pastorianus for enhanced ethyl ester production[J].Metab Eng,2024,85:180-193.
[86]DE JONG B W, SHI S, VALLE-RODRÍGUEZ J O, et al.Metabolic pathway engineering for fatty acid ethyl ester production in Saccharomyces cerevisiae using stable chromosomal integration[J].J Ind Microbiol Biot,2015,42(3):477-486.