番木瓜(Carica papaya L.)是番木瓜科番木瓜属的热带亚热带木质大型草本植物,因其成熟果肉味甜香且营养丰富,誉为“岭南果王”,在我国广西、广东、海南以及云南等地广泛种植,其中广西主产于横州、平南等地[1]。番木瓜亦是果蔬兼用型水果,未成熟果实可用于酱腌菜加工[2]。番木瓜酱菜是广西特色传统酱腌菜,以番木瓜干丝配辅料调味腌制而成[3]。 现有研究表明,酱腌菜加工过程中微生物群落差异对其风味品质至关重要,不同酱腌菜产品的微生物菌群差异大且发酵过程中生物代谢产生的代谢物较为复杂[4]。因此,研究番木瓜酱菜不同腌制阶段的微生物群落变化规律,筛选优势发酵菌群,是优化番木瓜酱菜制作工艺的关键。
目前,关于番木瓜的基础研究多集中于品种栽培品质调控和木瓜蛋白酶活提升[5-7];而在加工研究层面,现有研究多依托番木瓜的鲜食水果的特性,以饮料、干果等系列产品的加工工艺研究为主[8-10],关于番木瓜酱菜加工研究报道较少。酱腌菜产品的质量主要取决其微生物群落的代谢活性,微生物群落的演变模式决定了不同腌制阶段的菌群组成,通过不同优势菌群的发酵作用,最终形成酱腌菜的独特风味品质[11]。近年来,随着微生物测序技术的发展,发酵食品中微生物的分类与鉴定已从传统的依赖培养的方法演变为不依赖培养的方法[12-13],如16S rRNA测序技术已广泛应用于酸豇豆[14]、酸菜[15]、大头菜[16]等中国传统酱腌菜的微生物群落结构和演替规律研究。 此外,有研究表明酱腌菜的腌制过程中微生物菌群变化受温度、原料、时间等因素影响较大[17],适宜的低温(0~15 ℃)环境可使优势菌群发酵缓慢,延长菌种代谢周期,从而促进代谢反应完全,提高挥发性成分丰富度[18]。然而,目前关于番木瓜酱菜低温腌制过程的微生物群落变化规律尚未明确。
为了解番木瓜酱菜低温腌制过程的菌群构成及变化,本研究以番木瓜果肉干丝为材料,通过控制腌制低温(14±1)℃的方法进行酱菜腌制,利用16S rRNA高通量测序技术解析腌制过程的菌群动态变化,旨在准确分析番木瓜酱菜低温腌制期间的菌群,为建立发酵菌群数据库和优化腌制工艺提供理论基础。
1 材料与方法
1.1 材料与试剂
番木瓜果肉干丝:广西鸿榆农业有限公司;酱油、小米辣、蒜米、冰糖、山梨酸钾、味精等调味品原料:市售。
氯化钙(分析纯):国药集团化学试剂有限公司;土壤脱氧核糖核酸(deoxyribonucleicacid,DNA)提取试剂盒(Soil DNA Kit 50):美国Omega生物技术公司;微生物高通量测序试剂盒:北京诺禾致源公司。
1.2 仪器与设备
MT202电子计量秤:深圳市美孚电子有限公司;HH-S6数显恒温水浴锅:金坛市医疗仪器厂;MC-22MC01电磁炉:美的集团控股有限公司。
1.3 方法
1.3.1 番木瓜酱菜低温腌制工艺流程及操作要点
番木瓜果肉干丝→静置复水→调制→酱腌→翻拌→装罐密封→腌制→成品
操作要点:参照苏艳兰等[3]的方法,并适当修改。称取适量番木瓜果肉干丝于灭菌不锈钢盆,按1∶5(g∶mL)的料液比加煮沸放凉的酱油液,盖保鲜膜室温复水5 h。将复水后番木瓜丝捞出,并拌入酱油、小米椒等调味品进行调味,搅拌均匀地样品盖保鲜膜室温放置2 d,室温放置的前12 h内每隔2 h翻拌一次。 随后将番木瓜丝装罐、压实、密封,于(14±1)℃、相对湿度20%~30%的冷库避光腌制20 d,即得番木瓜酱菜。
1.3.2 样品采集
在低温腌制0、5 d、10 d和20 d,分别取腌制番木瓜丝于无菌操作台,用无菌滤纸擦净样品表面,并剪成3 cm大小,液氮速冻后,放入冻存管,分别编号CP0、CP5、CP10、CP20,每个时间点样品均分为3个平行重复,-80 ℃保存备用。
1.3.3 样品DNA提取及聚合酶链式反应扩增
按试剂盒操作说明提取样品的细菌基因组DNA,通过凝胶电泳检测DNA的纯度和浓度。 以基因组DNA为模板,使用带barcode的16S rRNA基因V3-V4可变区的特异扩增引物341F(5'-CCTAYGGGRBGCASCAG-3')和806R(5'-GGACTACNNGGGTATCTAAT-3'),同时进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系(25 μL):模板2 μL,上下游引物(10 μmol/L)各0.5 μL,12.5μL2×Taq PCRMasterMix,双蒸水(ddH2O)补足至25 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,扩增30个循环;最后72 ℃终延伸5 min。扩增产物用2%琼脂糖凝胶电泳检测后,按产物浓度等量混样,用2%的琼脂糖凝胶电泳再次检测合格后,用胶回收试剂盒回收目的片段。 使用TruSeq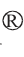 DNA PCR-Free Sample Preparation Kit试剂盒构建文库,经Qubit和Q-PCR定量检测合格后,在Illumina NovaSeq6000平台进行双端测序。
DNA PCR-Free Sample Preparation Kit试剂盒构建文库,经Qubit和Q-PCR定量检测合格后,在Illumina NovaSeq6000平台进行双端测序。
1.3.4 生物信息学分析
测序下机数据去除barcode和引物序列后,使用FLASH(V1.2.11)软件拼接序列读段获得原始序列(Raw Tags)。使用Fastp软件对Raw Tags进行质控过滤,得到高质量序列(Clean Tags)。再经USEARCH软件去除嵌合体,获得用于后续分析的有效序列(Effective Tags)。使用QIIME2软件的DADA2模块进行序列校正纠错和扩增子序列变体(amplicon sequence variant,ASV)聚类。 同时通过该模块降噪并过滤掉丰度<5的序列,最终获得ASVs及特征表。 使用Mothur软件将ASVs与参考数据库比对,得到各ASV的物种注释信息。Alpha多样性和Beta多样性的比较分析均通过R软件(version 4.2.2)完成计算。
1.3.5 数据分析
采用R软件(version 4.2.2)计算Weighted Unifrac距离矩阵,构建平均聚类分析法(unweighted pair group method with arithmetic mean,UPGMA)样品聚类树。 采用R软件的ade4和ggplot2软件包进行主成分分析(principal component analysis,PCA),WGCNA、stats和ggplot2软件包用于主坐标分析(principal coordinate analysis,PCoA),vegan软件包用于无度量多维标定法(non-metric multidimensional scaling,NMDS)分析,lefse软件包用于线性判别大小(linear discrim inant analysis effect size,LEfSe)分析。 采用Origin Pro 2021进行相关性分析并绘图。
2 结果与分析
2.1 测序结果
不同腌制时间的番木瓜酱菜样品微生物的16S rRNA测序数据经拼接、质控及嵌合体滤除后结果见表1。由表1可知,4个不同腌制时间的番木瓜酱菜样品的有效序列条数占原始序列比列均超过90%,GC含量约53%,碱基质量值Q20(测序错误率<1%)和Q30(测序错误率<0.1%)均大于95%,平均测序错误率约0.4%,表明测序结果可靠、质量较高。
表1 样品测序数据质控结果
Table 1 Quality control results of sample sequencing data

样品 原始序列数/条有效序列数/条合并率/%GC含量/%Q20质量值/%Q30质量值/%平均错误率/%CP0-1 CP0-2 CP0-3 CP5-1 CP5-2 CP5-3 CP10-1 CP10-2 CP10-3 CP20-1 CP20-2 CP20-3 149 075 134 893 149 171 149 327 149 320 149 396 149 415 149 356 149 401 149 335 149 418 149 419 136 294 123 305 139 281 142 936 141 989 143 084 143 431 143 147 143 520 142 765 143 105 143 355 91.43 91.41 93.37 95.72 95.09 95.77 96.00 95.84 96.06 95.60 95.77 95.94 52.95 52.92 53.01 53.14 53.11 53.28 53.01 53.01 52.97 52.85 52.90 52.89 98.88 98.92 98.96 98.93 98.93 98.94 98.99 98.93 99.03 98.88 98.90 98.98 95.83 95.95 96.10 96.05 96.08 96.09 96.24 96.07 96.37 95.89 95.96 96.22 0.45 0.44 0.42 0.43 0.43 0.43 0.41 0.43 0.40 0.45 0.44 0.41
2.2 番木瓜酱菜菌群物种分布
基于不同腌制时间的番木瓜酱菜样品的物种注释及丰度信息,选取在门、属和种分类水平相对丰度排名前10的物种绘制相对丰度柱形叠加图,并将相对丰度>1%的物种定义为优势门、属、种,结果见图1。
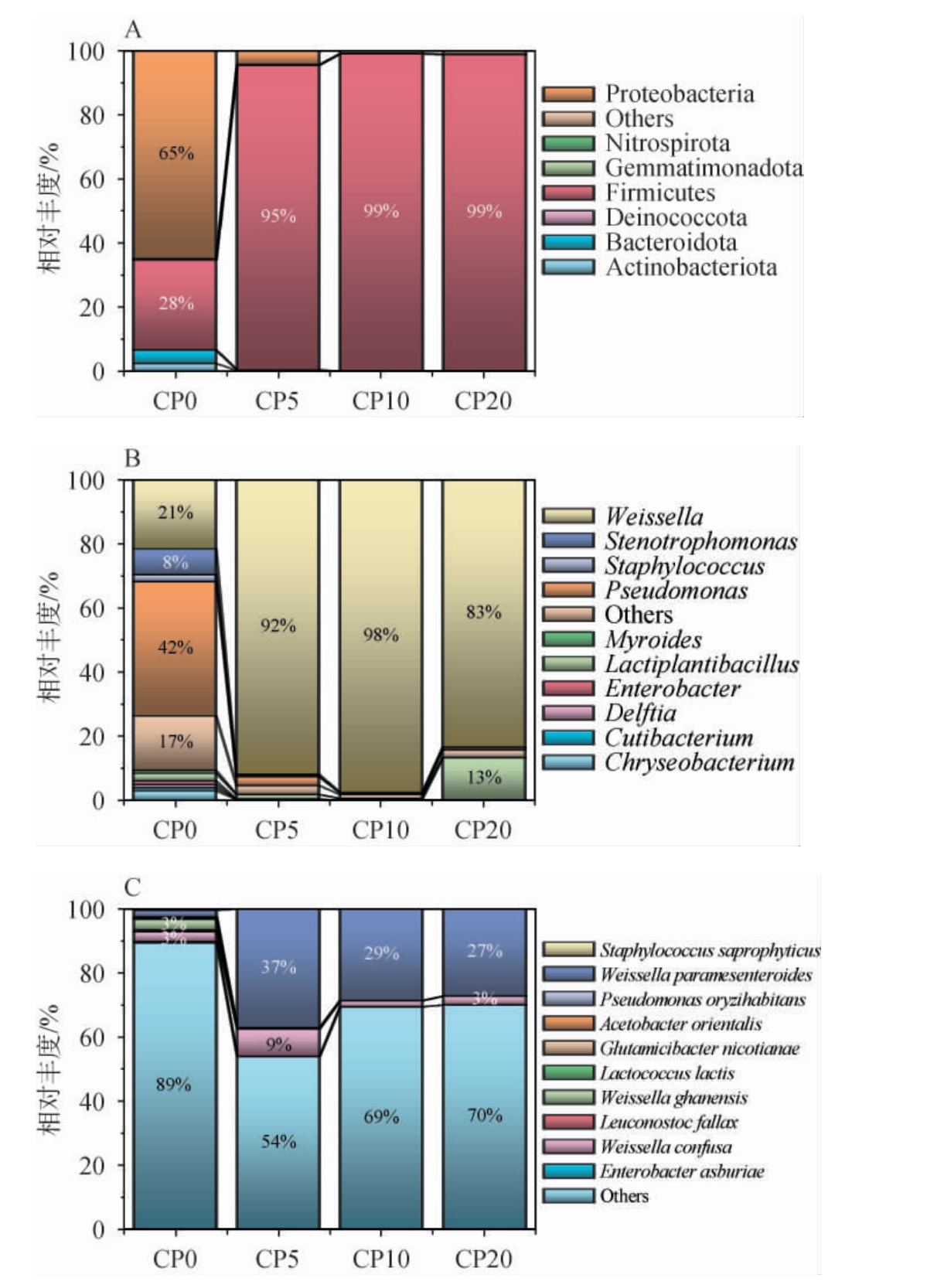
图1 基于门(A)、属(B)及种(C)水平不同腌制期的番木瓜酱菜样品菌群结构分析
Fig.1 Analysis of microflora structure of papaya pickles samples with different pickling periods based on phylum (A), genus (B) and species (C) level
由图1A可知,番木瓜酱菜低温腌制过程中的菌门共有7类,主要为厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)。在发酵开始时(CP0)厚壁菌门和变形菌门的相对丰度分别为28.12%和64.87%,两者总相对丰度均高于93.00%,但在腌制启动后菌群结构发生显著变化,变形菌门相对丰度快速降至5.00%以下,厚壁菌门则是迅速升至95.00%。其中厚壁菌门(Firmicutes)在低温腌制启动后(CP5、CP10、CP20)始终保持在95.00%以上。 LIU D Q等[19]研究发现,国内10种传统酱腌菜发酵过程中,厚壁菌门和变形菌门的相对丰度维持在88.2%~99.3%,可作为优势菌门。四川豇豆腌制品的16S rRNA测序结果亦显示厚壁菌门相对丰度>90%时,可作为四川豇豆腌制品的优势菌门,对腌制品风味品质形成起着至关重要的作用[20]。本研究结果与已有研究相似,推测厚壁菌门主导番木瓜酱菜腌制发酵过程,可能是其风味品质形成的关键影响因素。
由图1B可知,低温腌制过程中菌属分别为金黄杆菌属(Chryseobacterium)、表皮杆菌属(Cutibacterium)、代尔夫特 菌 属(Delftia)、肠 杆 菌 属(Enterobacter)、乳 植 杆 菌 属(Lactiplantibacillus)、类香味菌属(Myroides)、假单胞菌属(Pseudomonas)等。 CP0样品的优势菌属为假单胞菌属(Pseudomonas)(41.96%)、寡养单胞菌属(Stenotrophomonas)(7.99%)、魏斯氏菌属(Weissella)(21.47%);CP5和CP10的优势菌属均为魏斯氏菌属(Weissella)(91.96%、97.66%);CP20优势菌属为乳植杆菌属(Lactiplantibacillus)(13.15%)和魏斯氏菌属(Weissella)(83.49%)。本研究中魏斯氏菌属(Weissella)物种丰度在腌制起始阶段(0 d)已达21.47%,腌制过程未添加食盐,仅添加了酱油。酱油成品中通常存在大量的魏斯氏菌属菌种[21],番木瓜酱菜起始阶段(0 d)魏斯氏菌属物种主要来源于酱油,这可能是导致该属在腌制起始阶段呈较高丰度的主要原因。此外,番木瓜酱菜腌制期CP5、CP10和CP20样品的魏斯氏菌属菌群相对丰度始终维持在83.00%以上。 魏斯氏菌属微生物具有较强的耐低温耐酸,且兼性厌氧特性,可快速适应低温高酸环境并繁殖[22-23]。
由图1C可知,低温腌制过程的优势菌种为融合魏斯氏菌(Weissella confusa)、加纳魏斯氏菌(Weissella ghanensis)和副肠膜状魏斯氏菌(Weissella paramesenteroides)。其中,CP0样品中三者分布均匀(3.13%、3.46%、2.02%);腌制后,加纳魏斯氏菌相对丰度在5 d降至0.12%,优势菌种仅为混淆魏斯氏菌和副肠膜状魏斯氏菌,两者相对丰度随腌制时间延长呈先增后减变化趋势;此外,CP5、CP10和CP20样品的副肠膜状魏斯氏菌相对丰度始终高于27%,处于优势地位。
基于平均相对丰度排名前30的属和种绘制不同腌制阶段番木瓜酱菜样品菌群的热图,结果见图2。
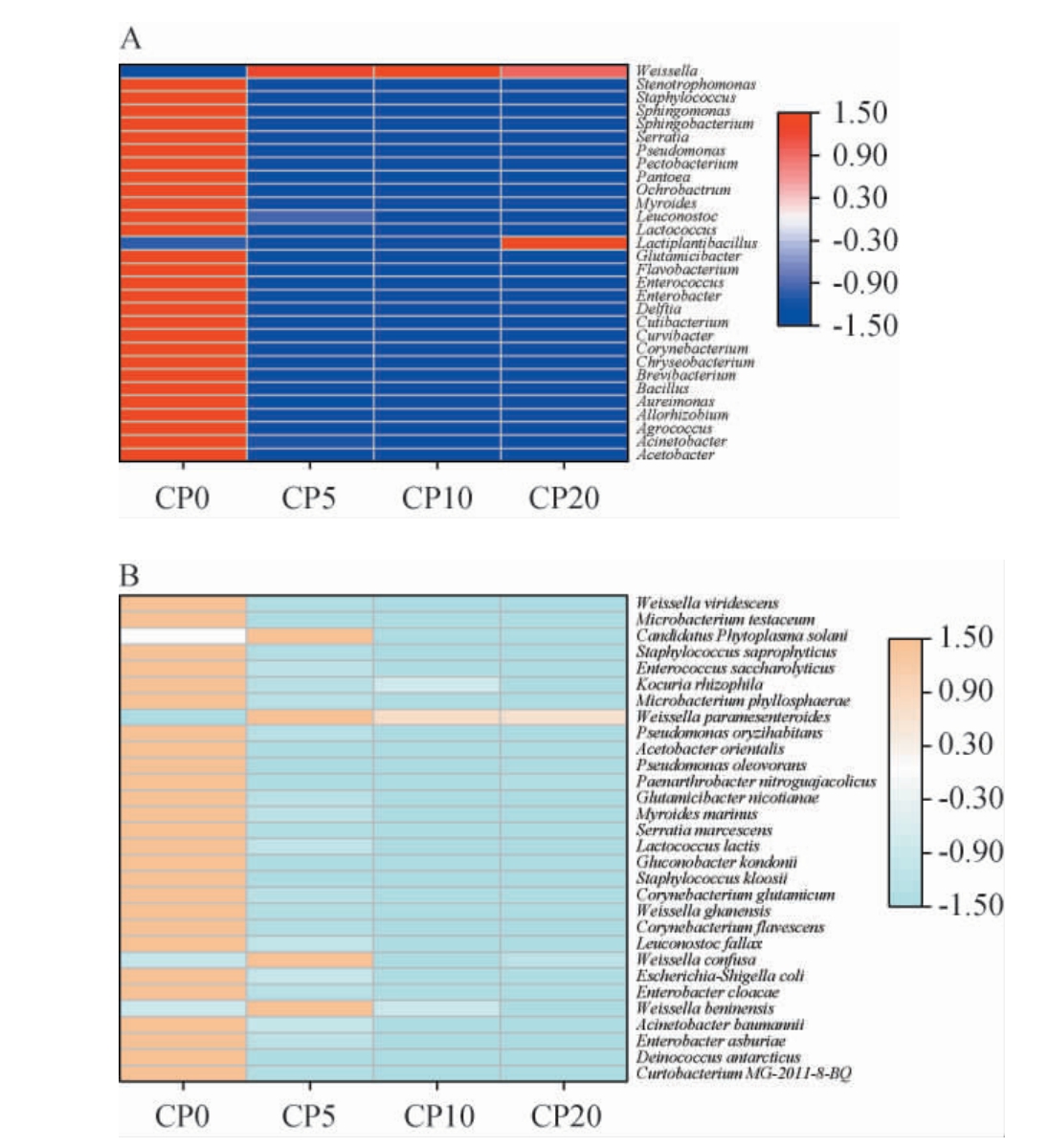
图2 基于属(A)和种(B)水平不同腌制期的番木瓜酱菜样品菌群相对丰度热图
Fig.2 Heat map of the relative abundance of bacterial flora in papaya pickle samples with different pickling periods based on genus (A) and species (B)
由图2可知,CP0菌群的丰度值分布与CP5、CP10、CP20差异明显。以相对丰度标准化数据(热图色阶系数)≥0.3作为高丰度的判定标准,由图2A可知,在属分类水平上,CP0样品中表现出高丰度值的菌属有28个,CP5和CP10仅为魏斯氏菌属(Weissella),CP20有2个,分别为魏斯氏菌属(Weissella)和乳植杆菌属(Lactiplantibacillus)。 由图2B可知,在种分类水平上,CP0样品中表现出高丰度值的菌种有26个,CP5有4种,分别为Candidatus phytoplasma solani、贝宁魏斯氏菌(Weissella beninensis)、融合魏斯氏菌(Weissella confusa)以及副肠膜状魏斯氏菌(Weissella paramesenteroides),而CP10和CP20仅有副肠膜状魏斯氏菌。
结合ASV聚类分析依据不同样品菌群间共有、特有的ASV数绘制韦恩图,结果见图3。由图3可知,4个腌制期(CP0、CP5、CP10和CP20)酱菜样品菌群共有的ASV为279个,CP5、CP10和CP20共有ASV为308个,而CP0、CP5、CP10和CP20特有ASV个数分别为63、0、0和1。此外,CP5、CP10和CP20共有37个微生物物种不存在于CP0中。

图3 不同腌制期的番木瓜酱菜样品中扩增子序列变体的韦恩图
Fig.3 Venn diagram of amplicon sequence variant in papaya pickle samples with different pickling periods
综上所述,番木瓜酱菜低温腌制过程的菌群以厚壁菌门和变形菌门为主,优势菌属和菌种类型、丰度在腌制的CP0和CP5期间发生明显变化,推测可能是腌制环境条件变化导致了不同腌制时间段样品优势菌属和菌种的变化。韦恩图显示有37个微生物物种不存在于CP0中,推测这些菌种可能参与了番木瓜酱菜低温发酵过程。
2.3 番木瓜酱菜样品菌群群落多样性
2.3.1 样品内菌群Alpha多样性指数分析
Alpha多样性指数(如Observed、Chao1、ACE、Shannon、Simpson和InvSimpson等)常用于评估样品内的微生物群落丰富度和多样性差异[24]。 Observed指数为每个样品中的菌群物种数目直接观测值,其数值越大,物种数目越多。不同腌制天数番木瓜酱菜样本内菌群Alpha多样性指数测定结果见图4。 由图4A可知,CP5、CP10、CP20的观测物种数较CP0均显著减少(P<0.05),呈先降后升变化,CP10的指数最低。Chao1和ACE指数越高,代表样品中菌群物种总数和低丰度物种越多,由图4B和图4C可知,CP0的两个指数值均显著大于CP5、CP10、CP20(P<0.05),且CP0、CP5的两个指数均与CP10、CP20指数呈显著差异(P<0.05);Shannon、Simpson和InvSimpson指数为样品菌群物种丰富度和均匀度的表征数值,其指数值越大,表明物种的丰富度和均匀度越好,样品菌群多样性越高,由图4D~4F可知,除CP20的Simpson指数外,CP0的这3个指数值均显著高于CP5、CP10、CP20(P<0.05),且CP10的指数最低。
图4 不同腌制期的番木瓜酱菜样本内菌群Alpha多样性分析结果
Fig.4 Results of Alpha diversity analysis of microflora in papaya pickle samples with different pickling periods
不同小写字母表示差异显著(P<0.05)。
由上述结果可知,番木瓜酱菜CP0样品的所有Alpha多样性指数值均最大,表明其菌群物种数目丰富度和均匀度最好、多样性最高。0~20 d的低温腌制期内,随着腌制时间延长,酱菜的菌群Alpha多样性指数整体呈先下降后上升变化趋势,这与郝卓莉等[25-26]对酸菜发酵期菌群变化研究结果相似。 CP10为拐点,表明低温腌制10 d可能是发酵菌群变化的关键节点。
2.3.2 样品内菌群物种多样性曲线
不同腌制期的番木瓜酱菜稀释曲线见图5。由图5可知,随着测序数据量增加,检出物种数先迅速增加后趋于平滑;测序序列量>50 000时,曲线已趋平,表明测序数据量合理,有效序列基本涵盖腌制期内样品的菌群。 平滑线的纵轴高度间接反映物种丰富程度,腌制各时间点样品的菌群丰富度排序为:CP0>CP5>CP20>CP10。上述结果表明本次试验16S rRNA高通量测序技术有助于解析番木瓜酱菜菌群的组成。
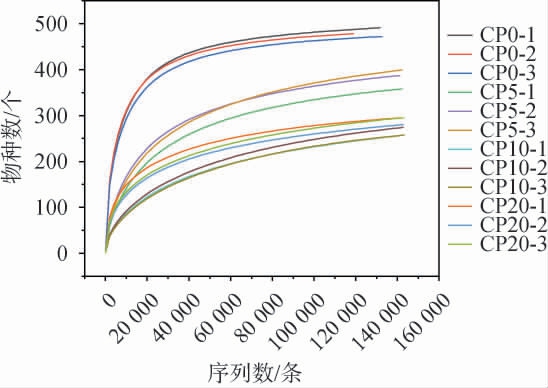
图5 不同腌制期的番木瓜酱菜样品菌群的稀释曲线
Fig.5 Rarefaction curves of the microflora in papaya pickles samples with different pickling periods
Rank Abundance曲线可直观的反映样品中物种的丰富度和均匀度[27]。不同腌制时间的番木瓜酱菜菌群的Rank Abundance曲线见图6。 由图6可知,在水平方向CP0横轴跨度最大,CP10最小,跨度越大表明物种丰富度越高;在垂直方向CP0曲线最平滑,CP10最差,曲线平缓度可反映物种均匀程度,曲线越平缓,物种分布越均匀。
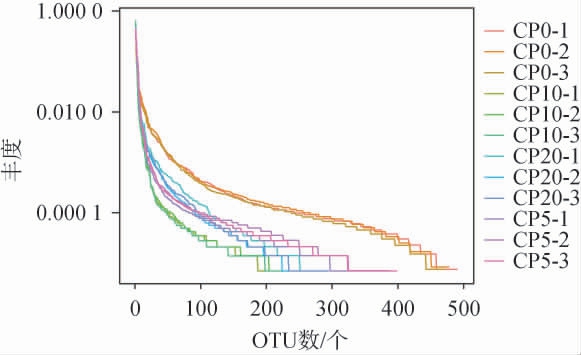
图6 不同腌制期的番木瓜酱菜样品菌群的丰度等级曲线
Fig.6 Rank abundance curves of the microflora in papaya pickles samples with different pickling periods
物种累积箱线图常用于评估样本量充分程度和物种丰富度,箱形图位置急剧上升表明物种数显著增加,此时样本量不足需要增加抽样量,箱线图位置无变化表明物种数不随样本量增加而增多,样本量充分可用于菌群物种数据分析。不同腌制期的番木瓜酱菜物种累积箱线图见图7。由图7可知,当样本量<5时,箱线图随样本量增加急剧上升,当样本量≥9时基本无变化,本试验选取四个腌制时间段,各设3次重复共12个样本,抽样量充分,观测到的570个ASV可覆盖样品的菌群物种,多样性分析结果有效。
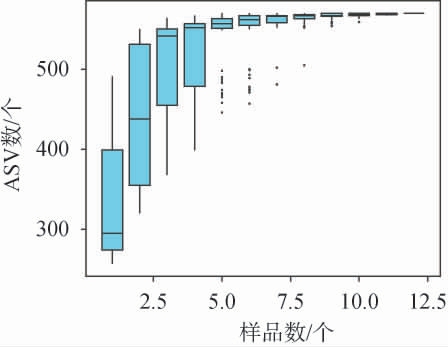
图7 不同腌制期的番木瓜酱菜样品菌群的物种累积箱线图
Fig.7 Species cumulative boxplots of the microflora in papaya pickles samples with different pickling periods
2.4 样品间的菌群构成多样性比较分析
先基于ASV信息水平对样品进行主成分分析,然再根据物种注释和ASV丰度计算Unifrac距离,构建Weighted Unifrac距离矩阵[28-30]。 基于此矩阵,通过主坐标分析法、无度量多维标定法、平均聚类分析法等多变量统计学方法,结合组间差异物种分析,研究不同腌制期番木瓜酱菜的菌落构成差异。
2.4.1 主成分分析
不同腌制期的番木瓜酱菜菌群PCA见图8。由图8可知,主成分1方差贡献率为69.40%,主成分2方差贡献率为26.80%,累计方差贡献率为96.2%,表示模型可完全解释所有样品的物种构成。CP0与CP5、CP10、CP20明显分开,表明四个腌制时期的样品间菌群物种多样性差异明显,低温腌制过程菌群结构发生明显变化;CP5与CP10、CP20明显分开,而CP10与CP20空间距离较近,表明低温腌制前期菌群差异变化强于后期。 因此,主成分分析可有效区分不同腌制时间番木瓜酱菜样品。
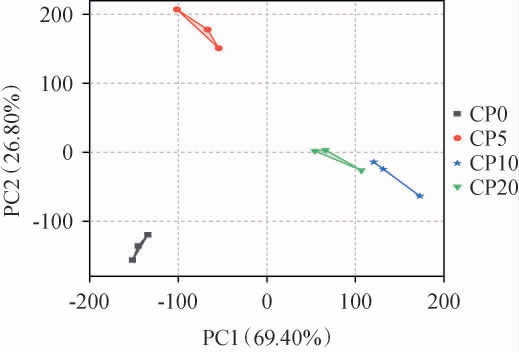
图8 不同腌制期的番木瓜酱菜样品菌群的主成分分析
Fig.8 Principle component analysis of microflora in papaya pickles samples with different pickling periods
2.4.2 主坐标分析
不同腌制期的番木瓜酱菜菌群构成PCoA分析结果见图9。由图9可知,主坐标1方差贡献率为88.80%,主坐标2方差贡献率为7.90%,两者合计96.70%,表明模型可解释样本菌群大部分物种构成。CP0与其余样本主坐标距离最远,表明CP0菌群物种构成与其余样本相比差异显著;CP5与CP10、CP20距离较远,表明CP5菌群物种构成与两者差异明显;而CP10和CP20的距离接近,表明两者菌群物种构成相似。此外,CP5、CP10和CP20位于主坐标1正轴,对其呈正向调节,三者均属于腌制进程期,表明主坐标1可能是影响番木瓜酱菜腌制期菌群变化的主要因素,且正相关。
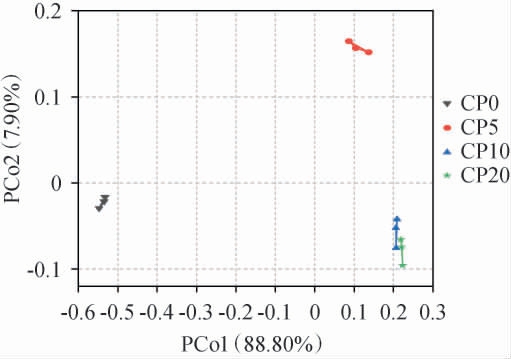
图9 不同腌制期的番木瓜酱菜样品菌群的主坐标分析
Fig.9 Principal coordinate analysis of microflora in papaya pickles samples with different pickling periods
2.4.3 聚类分析
基于Weighted Unifrac距离矩阵的UPGMA聚类分析见图10。由图10可知,CP0、CP5各聚为一类,CP10和CP20聚为一类,表明CP0与CP5、CP10、CP20菌群组成均有差异,而CP10和CP20的菌群构成无显著差异。聚类距离上,CP0与CP20最远,其次是CP10,最后是CP5,说明番木瓜酱菜低温腌制过程中菌群与腌制起始期的菌群差异随腌制时间延长逐渐扩大。
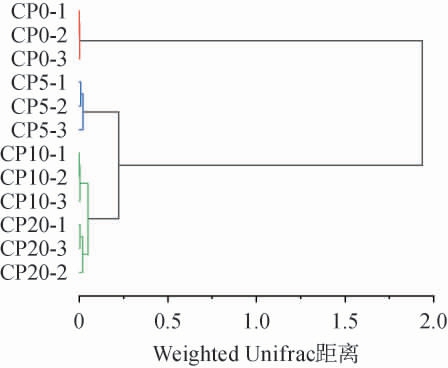
图10 不同腌制期的番木瓜酱菜样品菌群的聚类分析
Fig.10 Cluster analysis of microflora in papaya pickles with different pickling periods
2.4.4 非度量多维尺度法分析
NMDS是非线性模型,可克服PCA、PCoA等线性模型缺点反映物种分布的非线性结构[31]。基于Weighted Unifrac距离矩阵的NMDS分析见图11。由图11可知,不同腌制时间样本的菌群分布不同,CP0与其余样本的坐标距离偏差最大,表明CP0的菌群物种构成差异最显著。 此外,CP5与CP0、CP10的菌群组成差异明显,CP10与CP20坐标点几乎重合,两者的菌群结构相似。结果表明,腌制10 d内的样本中菌群动态变化明显,超过10d后趋于稳定。各样本的重复样品均聚在一起,样本组内差异小。 本次试验NMDS的Stress=0.000 1(<0.2),表明分析结果准确性高,可准确反映样品间菌群物种差异程度。
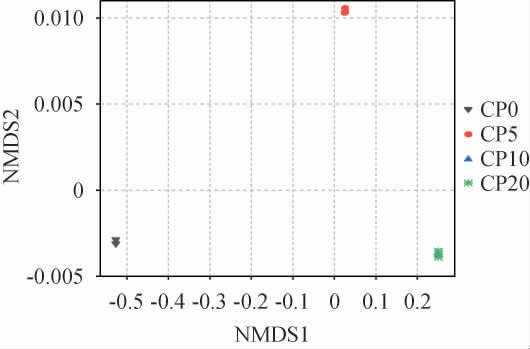
图11 不同腌制期的番木瓜酱菜样品菌群的非度量多维尺度法分析
Fig.11 Non-metric multidimensional scaling analysis of microflora in papaya pickles with different pickling periods
2.4.5 线性判别效应大小分析
LEfSe可用于组间丰度差异的标志性物种[32-33]。试验依据ASV物种注释及关联性,经LEfSe软件计算LDA值,选取LDA值>4的物种绘制柱状图,结果见图12,柱体数量代表组间丰度差异显著的物种,长度则代表差异物种的影响大小(即LDA Score)。由图12可知,不同腌制期的特征细菌物种数量依次是CP0(22个)、CP10(5个)、CP5(2个)、CP20(1个)。各腌制时期影响最大的特征细菌物种分别归属为:CP0为变形菌门(Proteobacteria),CP5为副肠膜状魏斯氏菌(Weissella paramesenteroides),CP10为魏斯氏菌属(Weissella),CP20为乳植乳杆菌属(Lactiplantibacillus)。
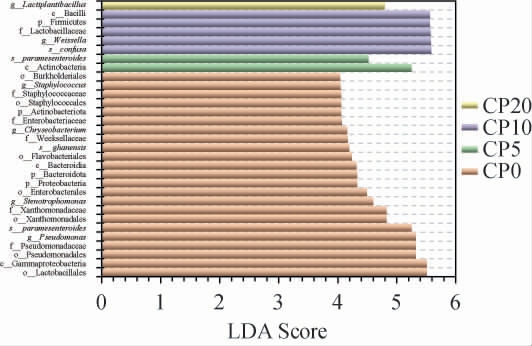
图12 不同腌制时间番木瓜酱菜菌群的LEfSe分析
Fig.12 LEfSe analysis of microflora in papaya pickles with different pickling periods
本研究中5种多变量统计学方法综合分析结果显示,番木瓜酱菜低温腌制过程各个时期样品菌群构成均存在明显差异,特征细菌物种数量随腌制时间延长呈递减趋势。进一步分析发现,CP10和CP20样品间的菌群结构较CP0、CP5相似,CP10样品中影响最大的特征细菌物种为魏斯氏菌属(Weissella),而CP20则为乳植杆菌属(Lactiplantibacillus)。 前人研究表明,魏斯氏菌属可与乳植乳杆菌属菌种通过协同发酵作用,增加酱腌菜中挥发性风味物质种类和含量,提升产品的风味口感[34-35]。在番木瓜酱菜腌制过程中调控魏斯氏菌属和乳植杆菌属菌种的种类及数量比例,可能有助于改善和提升番木瓜酱菜风味。
2.5 腌制过程中主要菌属间的相关性分析
为进一步分析番木瓜酱菜低温腌制期主要微生物菌属间相对丰度水平变化的相关性,取属水平相对丰度排前十的物种,基于Pearson系数法,以相关系数R≥0.8、显著性P≤0.05绘制相关性网络图,结果见图13。图中红色连线为正相关,蓝色连线为负相关。
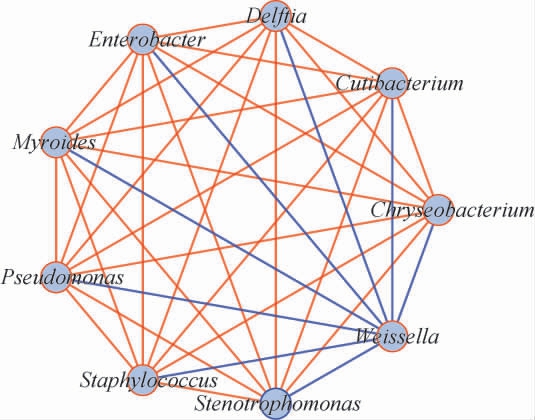
图13 不同腌制期的番木瓜酱菜样品中主要优势菌属间相关性分析
Fig.13 Correlation analysis of main dominant bacteria in pickled papaya samples with different pickling periods
由图13可知,番木瓜酱菜中魏斯氏菌属(Weissella)与金黄杆菌属(Chryseobacterium)、表皮杆菌属(Cutibacterium)、代尔夫特菌属(Delftia)、肠杆菌属(Enterobacter)、乳植乳杆菌属(Lactiplantibacillus)、类香味菌属(Myroides)、假单胞菌属(Pseudomonas)、葡萄球菌属(Staphylococcus)、寡养单胞菌属(Stenotrophomonas)呈显著负相关,负相关系数绝对值均超过0.8,具统计学意义且相关程度高。 魏斯氏菌属是番木瓜酱菜低温腌制进程的主要优势菌属,而其余8种菌属为腌制起始期(第0天)的优势菌属,表明番木瓜酱菜低温腌制中的发酵由魏斯氏菌属(Weissella)主导。
3 结论
本研究通过16S rRNA高通量测序探究了番木瓜酱菜低温腌制过程4个阶段(发酵0、5d、10d、20d)的细菌群落变化规律。研究结果显示,低温腌制过程4个阶段的酱菜样品菌群结构与多样性存在明显差异,但整个腌制过程以厚壁菌门和变形菌门为主要优势菌门;有37个菌种可能参与了番木瓜酱菜低温腌制过程;魏斯氏菌属在腌制中后期(CP5、CP10、CP20)占绝对主导,相对丰度始终高于83%,低温可能有利于维持魏斯氏菌属菌群的稳定生长,且通过调控腌制过程中魏斯氏菌属和乳植杆菌属菌种的种类和数量比例,可作为改善和提升番木瓜酱菜风味的一种有效手段。
[1]LEE P R,ONG Y L,YU B,et al.Evolution of volatile compounds in papaya wine fermented with three Williopsis saturnus yeasts[J].Int J Food Sci Technol,2010,45:2032-2041.
[2]李昌宝,辛明,林波,等.保脆剂对番木瓜酱菜理化性质及质构特性的影响[J].食品工业科技,2017,38(10):318-322.
[3]苏艳兰,刘功德.番木瓜酱菜加工技术研究[J].食品科技,2006(8):91-93.
[4]LIU Z G,LI J Y,WEI B L,et al.Bacterial community and composition in Jiang-shui and Suan-cai revealed by high-throughput sequencing of 16S rRNA[J].Int J Food Microbiol,2019,306:108271.
[5]韩佳钰,黄业传,代雯,等.蔗糖对木瓜蛋白酶活性影响及其分子机制[J].粮食与油脂,2025,38(1):151-156.
[6]胡霄,黄业传,管思彤,等.分子动力学模拟NaCl对木瓜蛋白酶活性的影响[J].中国酿造,2025,44(1):163-168.
[7]周双云,刘增亮,唐文忠,等.施硼方式对番木瓜光合特性和果实品质的影响[J].经济林研究,2024,42(4):117-123.
[8]赵广河,沈俊明.番木瓜生姜复合饮料工艺研究[J].江苏农业科学,2013,41(7):250-252.
[9]伍亚华,孟苗,赵永春,等.营养型宣木瓜果汁加工过程中的关键工艺[J].食品与发酵工业,2014,40(1):222-224.
[10]赵翾,李红良,秦诗韵.番木瓜果酒的酿造工艺研究[J].中国酿造,2010,224(11):180-182.
[11]ZHANG Y L,ZHU X,WANG N,et al.Synergy of traditional practices and modern technology:Advancing the understanding and applications of microbial resources and processes in fermented foods[J].Trends Food Sci Tech,2025,157:104891.
[12]王兴春,杨致荣,王敏,等.高通量测序技术及其应用[J].中国生物工程杂志,2012,32(1):109-114.
[13]马艺莹.东北酸菜发酵过程中细菌多样性及有机酸的变化规律[D].哈尔滨:东北农业大学,2019.
[14]ZHANG G,WANG Y R,XIANG F F,et al.Bacterial diversity in pickled cowpea(Vigna unguiculata[Linn.]Walp)as determined by Illumina MiSeq sequencing and culture-dependent methods[J].Curr Microbiol,2021,78(4):1-12.
[15]孙全敏,王严,王晓辉,等.大蒜汁对东北酸菜发酵中细菌菌群结构的影响[J].中国食品添加剂,2024,35(4):153-162.
[16]朱俊喆,邓晓茜,胡晓淞,等.应用Illumina MiSeq高通量测序技术分析来凤地区腌制大头菜叶中微生物多样性[J].中国酿造,2021,40(9):134-138.
[17]WANG Y Y, ZHANG C H, LIU F S, et al.Ecological succession and functional characteristics of lactic acid bacteria in traditional fermented foods[J].Crit Rev Food Sci Nutr,2022,63(22):11-15.
[18]张钰麟,陈泓帆,赵志平,等.新型工业化生产低温腌制大头菜挥发性风味物质分析[J].食品工业科技,2021,42(22):268-275.
[19]LIU D Q,TONG C.Bacterial community diversity of traditional fermented vegetables in China[J].LWT-Food Sci Technol,2017,86:40-48.
[20]RAO Y, QIAN Y, TAO Y F, et al.Characterization of the microbial communities and their correlations with chemical profiles in assorted vegetable Sichuan pickles[J].Food Control,2020,113:107174.
[21]韩月婷,蔡静,邱鹤翔,等.酱油曲发酵过程中微生物群落演替及其与挥发性风味物质的相关性[J].食品科学,2024,45(19):57-64.
[22]ASPASIA N, DIMITRA D, MARIA-EVANGELIA F, et al. Weissella uvarum sp.nov.,isolated from wine grapes[J].Int J Syst Evolut Microbiol,2014,64(11):3885-3890.
[23]MUN S Y, CHANG H C.Characterization of Weissella koreensis SK isolated from Kimchi fermented at low temperature(around 0 ℃)based on complete genome sequence and corresponding phenotype[J].Microorganisms,2020,8(8):1-17.
[24]LI B,ZHANG X X,GUO F,et al.Characterization of tetracycline resistant bacterial community in saline activated sludge using batch stress incubation with high-throughput sequencing analysis[J].Water Res,2013,47(13):4207-4216.
[25]郝卓莉.酸菜发酵期间细菌群落结构动态变化分析[J].中国酿造,2020,39(7):56-61.
[26]XIONG S J,XU X Y,ZHANG L L,et al.Integrated metatranscriptomics and metabolomics reveal microbial succession and flavor formation mechanisms during the spontaneous fermentation of Laotan Suancai[J].Food Res Int,2024,177:113865.
[27]DEREK S L,SCOTT Y,PIOTR M,et al.Practical innovations for highthroughput amplicon sequencing[J].Nat Meth,2013,10(10):999-1002.
[28]LOZUPONE C, KNIGHT R.UniFrac: A new phylogenetic method for comparing microbial communities[J].Appl Environ Microbiol,2005,71(12):8228-8235.
[29]LOZUPONE C,LLADSER M E,KNIGHTS D,et al.UniFrac:An effective distance metric for microbial community comparison[J].ISME J,2011,5(2):169.
[30]LOZUPONE C A,HAMADY M,KELLEY S T,et al.Quantitative and qualitative β diversity measures lead to different insights into factors that structure microbial communities[J].Appl Environ Microbiol,2007,73(5):1576-1585.
[31]NOVAL RIVAS M,BURTON O T,Wise P,et al.A microbita signature associated with experimental food allergy promotes allergic senitization and anaphylaxis[J].J Allergy Clin Immunol,2013,131(1):201-212.
[32]WARTON D I,WRIGHT T W,WANG Y.Distance-based multivariate analyses confound location and dispersion effects[J].Meth Ecol Evolut,2012,3:89-101.
[33]NICOLA S, JACQUES I, LEVI W, et al.Metagenomic biomarker discovery and explanation[J].Genome Biol,2011,12(6):R60.
[34]XIANG W L,ZHANG N D,LU Y,et al.Effect of Weissella cibaria coinoculation on the quality of Sichuan pickle fermented by Lactobacillus plantarum[J].LWT-Food Sci Technol,2020,121:108975.
[35]张楠笛,祝林,许琴,等.食窦魏斯氏菌协同植物乳杆菌改善四川泡菜风味[J].食品科学,2020,41(14):102-108.