泡菜是通过蔬菜(如结球白菜、卫青萝卜、线辣椒等)在盐溶液中经乳酸菌发酵制成的传统食品[1-2],具有独特风味及抗氧化、抗炎、调节免疫等健康功效[3-6],深受消费者喜爱。传统泡菜依赖自然微生物群落发酵,发酵周期长,微生物菌群复杂多样,其品质易受季节、加工环境等影响。因此,自然发酵的泡菜产品存在品质不稳定,安全性无法保证等缺点[7]。而现代工艺为满足品质与功能需求,逐渐引入具备益生特性的优良发酵剂菌株,如耐酸、耐胆盐及抑菌活性等,与传统发酵相比,人工接种益生特性的优良发酵菌种,可以调节泡菜风味、缩短发酵周期、降低污染风险、同时提升产品的质量和安全性,助力泡菜规模化生产[8]。
从泡菜中筛选出高耐受性菌株的研究已有报道,如耐受质量浓度为10%NaCl的鼠李糖乳杆菌(Lactobacillus rhamnosus)[9],耐胆盐(0.3%胆盐中生长效率为7.41%)和胃酸(pH3,存活率为94.73%)的植物乳植杆菌(Lactiplantibacillus plantarum)[10],以及耐酸、耐胆盐且存活率高(pH2,0.3%胆盐,存活率均>80%)的植物乳植杆菌[11]。同时,发酵食品微生物耐药性问题引发关注,许女等[12]发现泡菜中乳酸菌存在广泛耐药现象,凸显安全菌种筛选的重要性。此外,泡菜源乳酸菌的抑菌性、酶活性等功能特性也受到广泛研究[13-17],表明其可优化发酵过程并降低食品安全风险。自然发酵泡菜中功能乳酸菌的分离较多,其中乳酸菌菌种资源和生物特性还有待进一步挖掘。
本研究采用溶钙圈法从甘肃临夏地区泡菜中分离乳酸菌,采用形态学观察、生理生化实验及分子生物学技术对其进行鉴定,并分析其对酸、胆盐、食盐、温度耐受性,通过产蛋白酶和β-半乳糖苷酶能力、溶血性、药敏性和抑菌性分析其特性。旨在丰富乳酸菌菌种资源,为新型益生发酵剂开发提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
农家自制泡菜(主要以结球白菜(Brassicarapavar.glabra Regel)、卫青萝卜(Raphanus sativus L.var.longipinnatus Bai ley)、线辣椒(Capsicum annuum L.var.Longum Sendt)混合制作而成):采集自甘肃临夏地区;金黄色葡萄球菌(Staphylococcus aureus)、大肠杆菌(Escherichia coli):均由河西学院生命科学与工程学院实验中心微生物实验室保存。
1.1.2 试剂
葡萄糖:天津市大茂化学试剂厂;浓硫酸:扬州市华富化工有限公司;无水乙醇:国中山市华士达化工有限公司;牛胆盐(纯度99.8%):西格玛奥德里奇上海贸易有限公司;盐酸、氢氧化钠:河南中斌化工科技有限公司;四环素片:桂林南药股份有限公司;氨苄西林、左氧氟沙星:珠海联邦制药股份有限公司;克林霉素:康普药业股份有限公司;脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:生工生物工程(上海)股份有限公司;氯霉素:远大医药(中国)有限公司;庆大霉素:山西利丰华瑞制药有限公司;邻硝基苯酚β-D-半乳吡喃糖苷(o-nitrophenyl-β-D-galactopyranoside,ONPG):南京亿迅生物科技有限公司;邻硝基苯酚(o-nitrophenol,ONP):宁夏德昊科技产业有限公司;5-溴-4氯-3-吲哚-B-D-半乳糖苷(5-bromo-4-chloro-3-indolylβ-D-galactopyranoside,X-gal):青岛捷世康生物科技有限公司;二甲基甲酰胺(N,N-dimethylformamide,DMF):山东中徽枫宇化工贸易有限公司。所用试剂均为分析纯或生化试剂。
1.1.3 培养基
MRS液体培养基[18]:牛肉膏10 g,蛋白胨10 g,酵母粉5 g,葡萄糖20 g,硫酸镁0.1 g,硫酸锰0.05 g,柠檬酸二铵2 g,磷酸氢二钾2 g,吐温80 1 mL,用1 000 mL蒸馏水溶解(MRS固体培养基添加2%的琼脂)。
CaCO3-MRS固体培养基:蛋白胨10 g,牛肉膏10 g,酵母粉5 g,葡萄糖20 g,硫酸镁0.1 g,硫酸锰0.05 g,柠檬酸三铵2 g,无水乙酸钠5 g,磷酸氢二钾2 g,吐温80 1 mL,CaCO3 10 g,用1 000 mL蒸馏水溶解。
PY生化特性鉴定培养基:每1 000 mL添加5 g蛋白胨,10 g酵母提取物,5 g大豆蛋白胨,40 mL盐溶液(每1 L添加0.2 g氯化钙,0.48 g硫酸镁,1 g磷酸二氢钾,1 g磷酸氢二钾,10 g碳酸氢钠,2 g氯化钠)。
产蛋白酶筛选固体培养基:蛋白胨5 g,酵母粉5 g,葡萄糖10 g,磷酸氢二钾4 g,琼脂20 g,脱脂奶粉或酪蛋白20 g,1 000 mL蒸馏水溶解,调节pH为7.0。
LB培养基:蛋白胨10 g、酵母提取物5 g、氯化钠10 g、5 mol/L NaOH 0.2 mL、琼脂20 g,用1 000 mL蒸馏水溶解。
β-半乳糖苷酶初筛培养基:乳糖1 g,酵母粉0.5 g,蛋白胨1 g,NaCl 0.5 g,琼脂1.5 g,蒸馏水100 mL,pH 6.8,灭菌后冷却至60 ℃,加入X-gal(使用前用DMF稀释至20 mg/mL)。
β-半乳糖苷酶复筛培养基:乳糖1 g,酵母粉0.5 g,蛋白胨1 g,NaCl 0.5 g,蒸馏水100 mL溶解,pH 6.8。
哥伦比亚血琼脂培养基:每升含蛋白胨23.0 g、玉米淀粉1.0 g、氯化钠5.0 g、琼脂粉15.0 g、酵母浸出粉5.0 g、脱纤维羊血50 mL。
以上培养基均121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SKJH2112型双人单面超净工作台:上海苏坤实业有限公司;GR85DF高温高压蒸汽灭菌锅:致微(厦门)仪器有限公司;5804R型高速大容量冷冻离心机:德国Eppendorf公司;SPH-200B台式恒温摇床:上海世平实验设备有限公司;HHLY-180恒温振荡培养箱:上海跃进医疗器械有限公司。
1.3 方法
1.3.1 乳酸菌的分离与纯化
分别取1 mL泡菜发酵液样品,用无菌水梯度稀释,取10-3、10-4、10-5稀释液各100 μL,均匀涂布于1%CaCO3-MRS固体培养基,置于37 ℃恒温箱培养48 h。 挑取出有溶钙圈且形态特征不同的单菌落,在MRS固体平板上通过平板划线法进一步分离纯化,并进行过氧化氢酶实验,将过氧化氢酶阴性的菌株初步认定为乳酸菌[19]。
1.3.2 乳酸菌的鉴定
形态学观察:将纯化好的菌株在MRS固体培养基上进行平板划线,37 ℃静置培养24 h,观察菌落形态、颜色、边缘等形态特征,挑取单菌落进行革兰氏染色,通过镜检观察菌体形态,具体参照《乳酸细菌分类鉴定及实验方法》[20]。
生理生化实验:以《伯杰细菌鉴定手册》(第八版)[21]为参考依据,进行山梨醇、纤维二糖、七叶苷、乳糖、蔗糖、葡萄糖等生理生化实验。
分子生物学鉴定:将筛选出的优势乳酸菌通过试剂盒进行总DNA提取后,以细菌通用引物对乳酸菌进行16S rDNA扩增[22],其正向引物为27f(5'-AGAGTTTGATCCTGGCTCAG-3');反向引物为1492r(5'-AAGGAGGTGATCCAGCC-3')。PCR扩增体系(50 μL):2×EasyTaq PCR Super Mix 25 μL,上下游引物各1 μL,模板DNA 2 μL,双蒸水(ddH2O)补至50 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸90 s,循环30次;72 ℃末端延伸5 min,4 ℃保温。PCR扩增产物经1%琼脂糖凝胶电泳检测后,测序工作由上海派森诺生物科技有限公司完成,测序结果上传至美国国家生物技术信息中心(nationalcenterforbiotechnology information,NCBI)GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对分析,并用MEGA 11.0软件的邻接(neighbor-joining,NJ)法构建系统发育树,分析其亲缘关系和分类学地位。
1.3.3 乳酸菌益生特性分析
种子液的制备:将分离纯化得到的乳酸菌接种到MRS液体培养基中,37 ℃、160 r/min振荡培养24 h,得到乳酸菌种子液,为后续实验备用。
为考察菌株的耐酸、耐胆盐、耐盐能力,将菌株种子液按4%(V/V)的接种量接种于不同pH(2.0、3.0、4.0、5.0、6.0、6.5)[23]、不同胆盐质量浓度(0、0.1 g/L、0.3 g/L、0.5 g/L、0.7 g/L)[24]、不同食盐质量分数(0、2.0%、4.0%、6.0%、8.0%、10.0%、12.0%、14.0%)[25]的MRS液体培养基中,于37 ℃、160 r/min振荡培养24 h,测定菌液的OD600 nm值,计算菌株存活率,其存活率计算公式如下:
耐热能力的测定:将种子液按质量分数4%(V/V)的接种量接种于MRS液体培养基中,分别于37 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃条件下热处理20 min[26],以37 ℃正常培养作对照,于37 ℃、160 r/min振荡培养24 h后测定菌液的OD600nm值,计算其存活率。
1.3.4 乳酸菌产酶能力检测
乳酸菌产蛋白酶能力的测定:参照张伟等[27]的方法,略作调整:取10 μL种子液均匀涂布到产蛋白酶筛选固体培养基平板上提前标记的小圈内(直径为17 mm)[27],使菌液均匀分布在小圈内,静置1 h,倒置于37 ℃恒温培养箱培养24 h后,用游标卡尺测量各菌落直径(d)和菌落四周透明圈(D)的直径。以透明圈直径与菌落直径的比值(D/d)作为衡量菌株产酶能力的指标,D/d值越高说明产酶能力越强。
乳酸菌产β-半乳糖苷酶菌株筛选[28]:将活化后的菌株通过平板划线法接种到β-半乳糖苷酶初筛培养基上,37 ℃静置培养24 h并观察。 选取可在β-半乳糖苷酶初筛培养基上产生蓝色菌落的菌株,接种于β-半乳糖苷酶复筛培养基,37 ℃、160 r/min条件下培养24 h后取发酵液测定酶活力。ONP标准曲线的绘制[29]:以ONP质量浓度(x)为横坐标,以吸光度值(OD420 nm值)(y)为纵坐标绘制标准曲线,所得标准曲线回归方程为y=0.674 4x+0.002 4,相关系数为R2=0.999 7。β-半乳糖苷酶定义为:在55 ℃条件下每毫升粗酶液每分钟内催化水解ONPG生成1 μmol ONP所需的酶量定义为一个酶活力单位(U/mL)。
β-半乳糖苷酶活力测定:将1 mL待测的酶液(即发酵液)加入到1 mL已预先加热至55 ℃的2 mol/L ONPG溶液中。此ONPG溶液由0.1 mol/L的磷酸缓冲液配制而成,并保持pH值为6.5。随后,将其在55 ℃的水浴条件下保温10 min,加入3mL的1mol/LNa2CO3以终止反应。反应体系静置5min,用0.1 mo1/L、pH 6.5的磷酸盐缓冲液替代酶液作为对照。在420 nm波长条件下测定各组溶液的OD420nm值。
1.3.5 乳酸菌生长代谢特性分析
乳酸菌的溶血能力检测:参考武芷伊等[30]的方法,将活化后的菌株点接于哥伦比亚血琼脂培养基平板上,37 ℃培养24 h。以金黄色葡萄球菌作为阳性对照,观察并记录菌落周围溶血圈情况。
乳酸菌的抗生素敏感性检测:将活化后的菌株涂布接种于MRS培养基平板上,分别在其中放入四环素(50μg/片)、氨苄西林(10 μg/片)、克林霉素(20 μg/片)、氯霉素(30 μg/片)、庆大霉素(10 μg/片)、左氧氟沙星(5 μg/片)的药敏纸片(直径6 mm),37 ℃培养24 h,用游标卡尺测定其培养基中空白环的大小,筛选其抗药敏能力优良的乳酸菌[32]。
乳酸菌的抑菌能力检测:采用纸片扩散法评估乳酸菌对大肠杆菌的抑菌活性。取活化后的大肠杆菌菌液200 μL,均匀地涂布于LB培养基表面,将完全用乳酸菌发酵液浸湿的饱和纸片放置于LB培养基上,其中纸片直径(d)为15 mm,然后将平板在37 ℃下培养24 h,并用游标卡尺测量抑菌圈直径(D),以D/d值作为衡量菌株抑菌能力的指标,D/d值越高说明抑菌能力越强。
乳酸菌对金黄色葡萄球菌的抑菌活性检测:采用琼脂孔扩散法[33],取活化后的金黄色葡萄球菌菌液200 μL均匀地涂布于LB培养基平板上,用9 mm打孔器打孔,吸取乳酸菌活化后的种子液70 μL于小孔中,在37 ℃培养24 h后,用游标卡尺测量抑菌圈直径(D),以D/d值作为衡量菌株抑菌能力的指标,D/d值越高说明抑菌能力越强。
1.3.6 数据处理与统计分析
运用SPSS 26.0软件进行方差分析(analysis of variance,ANOVA),P<0.05为差异显著,采用Origin2024软件对数据进行可视化处理。
2 结果与分析
2.1 乳酸菌的分离筛选
从临夏传统泡菜的发酵液中共分离得到形态特征不同的菌株10株,形成溶钙圈且过氧化氢酶试验为阴性的菌株7株,初步确定为乳酸菌,分别命名为B2-3-1~B2-3-4和B2-3-6~B2-3-8。
2.2 筛选乳酸菌的鉴定
2.2.1 乳酸菌的形态学观察
从甘肃临夏地区泡菜中分离纯化获得7株菌株,形态学鉴定结果见图1。 由图1可知,除菌株B2-3-3颜色为淡黄色外,其他菌株均为乳白色;菌株B2-3-1、B2-3-4等菌体形态为球状,菌株B2-3-7等菌体形态为杆状。7株菌株菌落表面光滑、湿润、边缘整齐且均不透明,经革兰氏染色呈紫色,确定为革兰氏阳性菌,符合乳酸菌菌体特征。
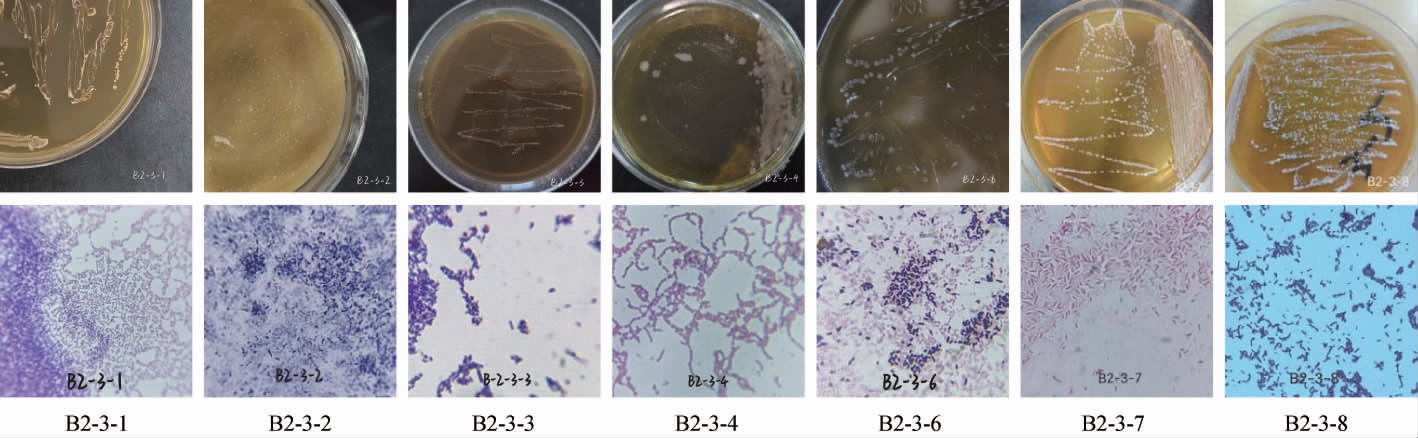
图1 7株筛选菌株的菌落及细胞形态
Fig.1 Colony and cell morphology of 7 screened strains
2.2.2 生理生化实验
筛选菌株的生理生化实验鉴定结果见表2。由表2可知,依据《乳酸细菌的分类鉴定及实验方法》[20]和《伯杰细菌鉴定手册》[21],筛选出的7株乳酸菌生理生化实验结果均符合乳酸菌特征。7株乳酸菌均能发酵利用蔗糖和葡萄糖,只有菌株B2-3-1、B2-3-2、B2-3-4能够利用山梨醇,其他菌株均不能利用,菌株B2-3-1、B2-3-2、B2-3-4、B2-3-7、B2-3-8均能利用纤维二糖;菌株B2-3-2、B2-3-7、B2-3-8可以利用七叶苷,其余菌株均不能利用;只有菌株B2-3-8可以利用乳糖,其余菌株不可利用。
表1 筛选菌株的生理生化实验结果
Table 1 Physiological and biochemical experiments results of screened strains
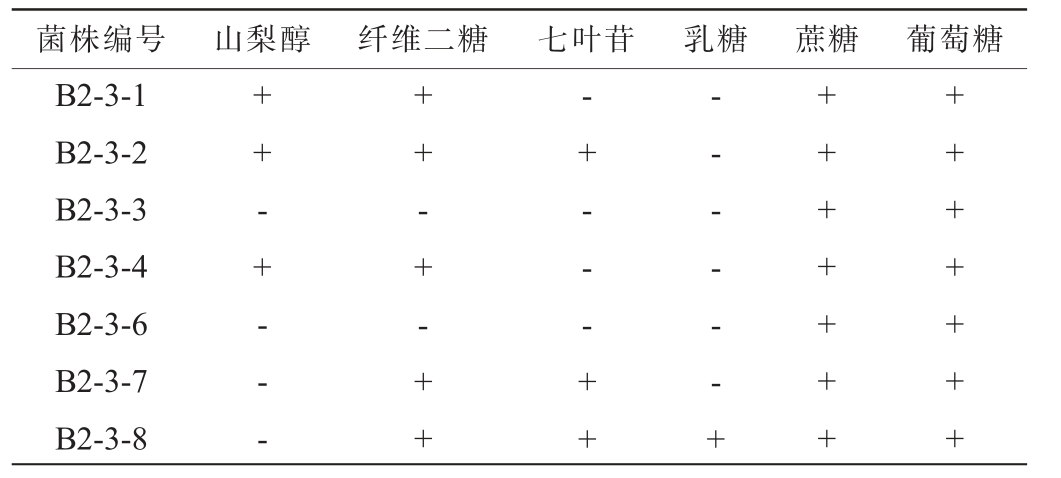
注:“+”代表结果呈阳性,“-”代表结果呈阴性。
菌株编号 山梨醇 纤维二糖 七叶苷 乳糖B2-3-1 B2-3-2 B2-3-3 B2-3-4 B2-3-6 B2-3-7 B2-3-8蔗糖 葡萄糖++ - + - - -++-+-++-+ - - - + +-- - - - - +++++++++++++++
表2 乳酸菌抗生素敏感性检测结果
Table 2 Detection results of antibiotic sensitivity of lactic acid bacteria
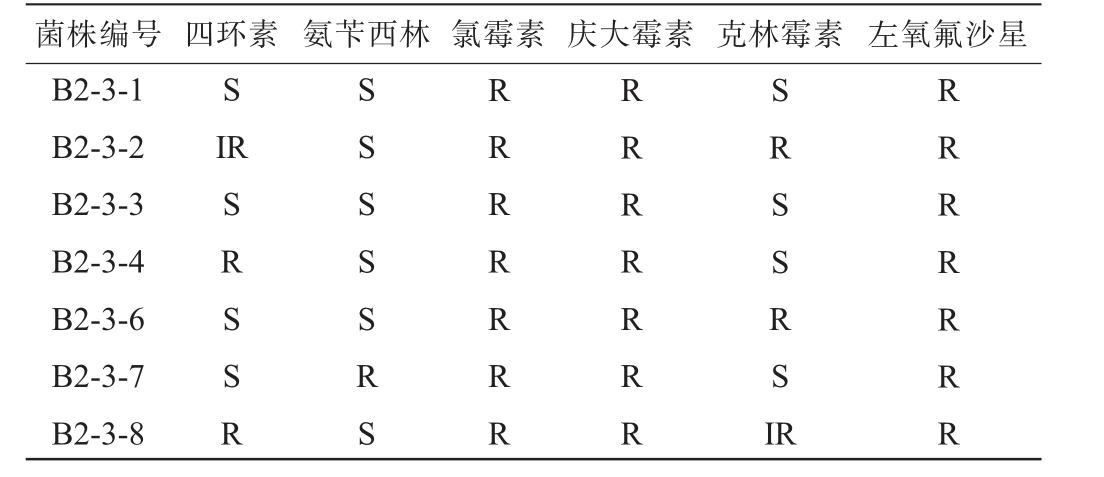
注:抗生素药敏性的抑制程度分为R(低敏感性,抑制直径≤14 mm)、IR(中等敏感性,抑制直径15~19 mm)、S(高敏感性,直径≥20 mm)。
菌株编号 四环素 氨苄西林 氯霉素 庆大霉素 克林霉素 左氧氟沙星B2-3-1 B2-3-2 B2-3-3 B2-3-4 B2-3-6 B2-3-7 B2-3-8 S IR SRSSR SSSSSRS RRRRRRR RRRRRRR SRSSRSI R RRRRRRR
2.2.3 分子生物学鉴定
基于16S rDNA基因序列构建筛选菌株的系统发育树,结果见图2。

图2 基于16S rDNA基因序列筛选菌株的系统发育树
Fig.2 Phylogenetic tree of screened strains based on 16S rDNA gene sequences
由图2可知,菌株B2-3-1与Wessella confusa strain 1305处于同一分支,亲缘关系最近,鉴定其为融合魏斯氏菌(Weissellaconfusa);菌株B2-3-2与Leuconostoc lactis strain A4247处于同一分支,亲缘关系最近,鉴定其为乳酸明串珠菌(Leuconostoc lactis);菌株B2-3-3与Leuconostoc lactis strain A4152处于同一分支,亲缘关系最近,鉴定其为乳酸明串珠菌(Leu conostoclactis);菌株B2-3-4与Streptococcusthermophilusstrain GZDY-5处于同一分支,亲缘关系最近,鉴定其为嗜热链球菌(Streptococcus thermophilus);菌株B2-3-6与Lactiplantibacillus plantarum strain HR-23处于同一分支,亲缘关系最近,鉴定其为植物乳植杆菌(Lactiplantibacillus plantarum);菌株B2-3-7与Lactobacillus paracasei strain 6363处于同一分支,亲缘关系最近,鉴定其为副干酪乳杆菌(Lactobacillus paracasei);菌株B2-3-8与Lactiplantibacillus plantarum strain PMO08处于同一分支,亲缘关系最近,鉴定其为植物乳植杆菌(Lactiplantibacillus plantarum)。
2.3 筛选乳酸菌的益生特性分析
2.3.1 耐酸能力
乳酸菌对酸的耐受性能是评价益生菌株的一个重要指标[34]。 筛选菌株在不同pH值条件下的存活率见图3。 由图3可知,菌株B2-3-1~B2-3-4和菌株B2-3-6在pH 5、pH 6条件下存活率较高,其存活率范围为50.79%~96.88%;菌株B2-3-7、B2-3-8在pH 4、pH 5、pH 6条件下存活率较高,存活率>66.54%;在其他pH值条件下,存活率均<20%,其中菌株B2-3-8在pH3、pH2时存活率较高,分别为20.62%、10.86%,优于其他菌株;其他菌株在pH 3、pH 2条件下存活率均<7%。该研究与魏明智等[24]从酸汤子中筛选得到的乳酸菌耐酸性结果相近。综合考虑,菌株B2-3-8酸耐受性最好。
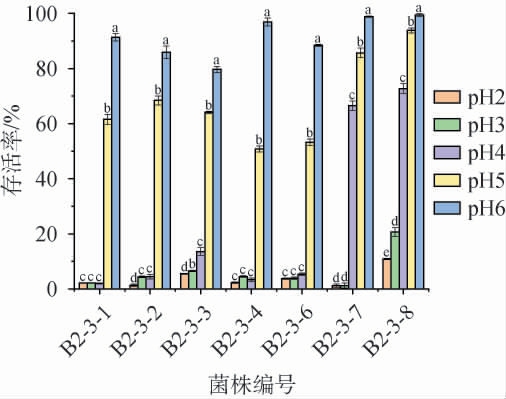
图3 筛选菌株在不同pH值条件下的存活率
Fig.3 Survival rates of screened strains under different pH conditions
不同字母表示组间差异显著(P<0.05)。下同。
2.3.2 耐胆盐能力
哺乳动物肠道胆盐浓度约为0.03%~0.30%[35]。筛选菌株在不同胆盐浓度条件下的存活率见图4。由图4可知,菌株B2-3-6在胆盐质量浓度为0.1~0.5 g/L范围内存活率较高,存活率>73.1%;菌株B2-3-8仅在胆盐质量浓度为0.1 g/L时,存活率较高,为81%,在其他胆盐浓度条件下,存活率均<47%;菌株B2-3-1~B2-3-4和B2-3-7在胆盐质量浓度为0.1~0.7 g/L条件下,存活率均<48%;但菌株B2-3-3、B2-3-6和B2-3-8在0.7 g/L胆盐条件下存活率相对较高,分别为16.7%、32.1%和30.6%,而其他菌株耐受性较差,存活率均<7%。该研究筛选菌株耐受性低于赵小茜等[34]的研究结果;但菌株B2-3-6和B2-3-8在不同胆盐浓度条件下的培养时间均超过食物在肠道内停留时间。 综合考虑,菌株B2-3-6和B2-3-8耐胆盐能力较佳。
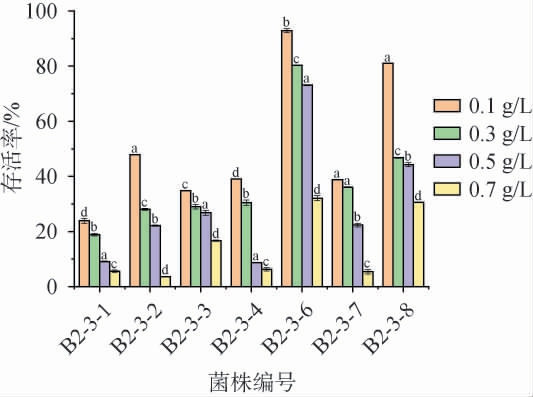
图4 筛选菌株在不同胆盐质量浓度条件下的存活率
Fig.4 Survival rates of screened strains under different bile salt mass concentration conditions
2.3.3 耐盐能力
筛选菌株在不同盐含量条件下的存活率见图5。由图5可知,菌株B2-3-8在盐含量为2%~6%条件下存活率较高,其存活率范围为66.2%~85.6%;菌株B2-3-2、B2-3-3和B2-3-6仅在盐含量为2%时,存活率较高,存活率分别为50.9%、67.4%和78%;菌株B2-3-1、B2-3-4和B2-3-7在盐含量2%、4%条件下存活率较高,存活率>57%;在其他盐含量下,存活率均较低,存活率<50%;在盐含量为12%条件下,菌株B2-3-1、B2-3-6和B2-3-8存活率相对较高,分别为8.74%、8.06%和11.66%,其余菌株存活率均<5%,筛选菌株耐盐能力优于何航等[32]在泡菜中得到的乳酸菌。综合考虑,菌株B2-3-1、B2-3-6、B2-3-8耐盐性能较佳。
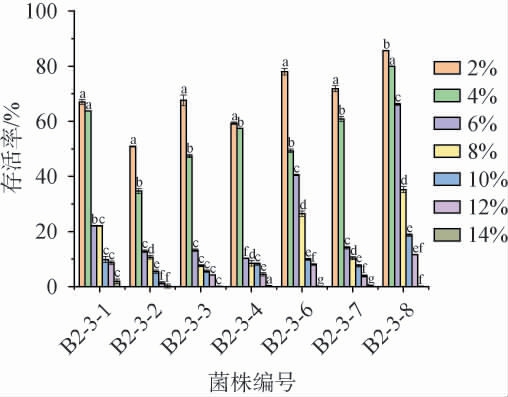
图5 筛选菌株在不同盐含量条件下的存活率
Fig.5 Survival rates of screened strains under different salt contents conditions
2.3.4 耐热能力
筛选菌株在不同温度条件下的存活率见图6。由图6可知,菌株B2-3-1、B2-3-4、B2-3-6、B2-3-8在温度37~60 ℃条件下存活率较高,其存活率范围为59.5%~99.81%;菌株B2-3-2、B2-3-3、B2-3-7仅在温度37~50 ℃条件下存活率较高,其存活率范围为84.02%~99.76%;筛选菌株在其他温度条件下,菌株存活率均较低,存活率<23%,但在温度80 ℃条件下,菌株B2-3-3、B2-3-6、B2-3-7、B2-3-8存活率相对较高,其存活率分别为10.08%、11.44%、6.95%、7.30%,其余菌株存活率均<5%;推测可能是温度过高抑制了三磷酸腺苷酶等关键酶的活性,从而影响了乳酸菌的代谢[35]。本研究结果明显优于魏明智等[24]的研究结果。 综合考虑,菌株B2-3-3、B2-3-6的耐热能力较高。
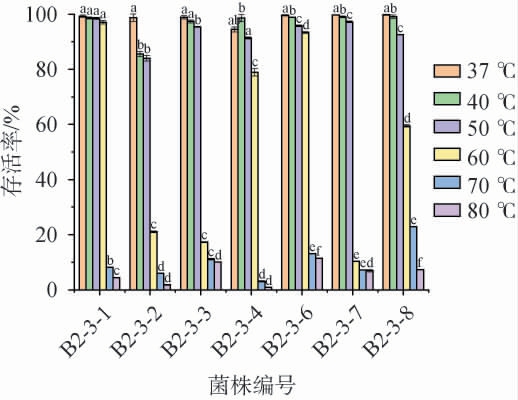
图6 筛选菌株在不同温度条件下的存活率
Fig.6 Survival rates of screened strains under different temperature conditions
2.4 筛选乳酸菌的产酶能力
2.4.1 乳酸菌产蛋白酶能力
乳酸菌产的蛋白酶不仅可以促进营养的吸收,而且可以丰富发酵食品的风味。 研究发现,除菌株B2-3-1不产蛋白酶外,其他菌株均具有产酶能力,其中,菌株B2-3-7产酶能力最强,透明圈直径(D)和菌落直径(d)比值为2.18;菌株B2-3-4、B2-3-6、B2-3-8产酶能力次之,透明圈直径(D)和菌落直径(d)比值分别为1.47、1.59、1.56;菌株B2-3-2、B2-3-3产酶能力最小且相差不大,透明圈直径(D)和菌落直径(d)比值分别为1.32、1.35;综上,不同菌株产蛋白酶的能力有差异,菌株B2-3-7产蛋白酶能力最强。
2.4.2 乳酸菌产β-半乳糖苷酶能力
将7株筛选菌株的种子液点接在添加X-gal的β-半乳糖苷酶初筛培养基中经37 ℃静置培养48 h后发现,菌株B2-3-6、B2-3-7、B2-3-8能使X-gal变蓝,说明3株菌株具备产β-半乳糖苷酶能力,因此,测定其产β-半乳糖苷酶的酶活力。结果表明,菌株B2-3-8、B2-3-7、B2-3-6所产的胞内β-半乳糖苷酶活力分别为36.720 U/mL、5.841 U/mL、2.181 U/mL,菌株B2-3-8酶活高于李欣等[36]的研究结果。因此,菌株B2-3-8产β-半乳糖苷酶能力最强
2.5 筛选乳酸菌的生长代谢特性
2.5.1 乳酸菌的抗生素敏感性
乳酸菌对抗生素的敏感性检测结果见表2。由表2可知,7株菌株对氯霉素、庆大霉素、左氧氟沙星均表现出低敏性。菌株B2-3-1对四环素、氨苄西林、克林霉素表现出了高敏感性;菌株B2-3-2对氨苄西林表现出了高敏感性,对四环素表现出了中敏感性,克林霉素表现出了低敏感性;菌株B2-3-3对四环素、氨苄西林、克林霉素表现出了高敏感性;菌株B2-3-4对四环素表现出了低敏感性,对氨苄西林、克林霉素表现出了高敏感性;菌株B2-3-6对四环素、氨苄西林表现出了高敏感性,对克林霉素表现了低敏感性。菌株B2-3-7对四环素、克林霉素表现出了高敏感性,对氨苄西林表现出了低敏感性;菌株B2-3-8对氨苄西林表现出了高敏感性,对四环素表现出了低敏感性,对克林霉素表现出了中敏感性。综上,7株菌株对抗生素敏感性具有菌株特异性。
2.5.2 乳酸菌的抑菌能力测定
乳酸菌抑菌作用在抑制泡菜发酵过程中杂菌生长、提高酸菜品质方面具有积极意义[37]。 菌株B2-3-3、B2-3-7、B2-3-8对大肠杆菌具有抑制作用,抑菌圈直径(D)和纸片直径(d)比值分别为1.80、1.53、3.00,其他菌株对大肠杆菌无抑制作用;除菌株B2-3-2外,其他菌株均对金黄色葡萄球菌具有抑制作用,其中菌株B2-3-3、B2-3-8抑制作用较强,抑菌圈直径(D)和小孔直径(d)比值分别为1.94、1.83,菌株B2-3-1、B2-3-4、B2-3-7抑制作用相对较弱,抑菌圈直径(D)和小孔直径(d)比值分别为1.33、1.22、1.11;菌株B2-3-3、B2-3-7、B2-3-8对两种菌都具有抑制作用,其中菌株B2-3-8对两种菌抑制作用最强。综合考虑,菌株B2-3-8抑菌能力最强。
2.5.3 乳酸菌的溶血能力
溶血在动物细菌性疾病的发病过程中起着不容轻视的作用[38],溶血现象可分为:完全溶血、不完全溶血和不溶血。完全溶血也称为β-溶血,使平板中菌落周围出现透明色圈,有致病性;不完全溶血也称为α-溶血,使平板中菌落周围出现草绿色圈,为条件致病菌;不溶血,平板中菌落周围不会有任何变化,无致病性。 在筛选得到的7株菌株中,菌株B2-3-2、B2-3-3、B2-3-6为β-溶血,即完全溶血。其余菌株均为不溶血,无致病性。
3 结论
本研究以甘肃临夏地区泡菜为研究对象,共分离得到7株乳酸菌菌株,1株(B2-3-1)被鉴定为融合魏斯氏菌(Weissella confusa),2株(B2-3-2和B2-3-3)被鉴定为乳酸明串珠菌(Leuconostoc lactis),1株(B2-3-4)被鉴定为嗜热链球菌(Streptococcus thermophilus),2株(B2-3-6和B2-3-8)被鉴定为植物乳植杆菌(Lactiplantibacillus plantarum),1株(B2-3-7)被鉴定为副干酪乳杆菌(Lactobacillus paracasei)。其中,菌株B2-3-8耐酸性最好,菌株B2-3-6和B2-3-8耐胆盐能力较好;菌株B2-3-1、B2-3-6、B2-3-8耐盐能力较好,菌株B2-3-3和B2-3-6温度耐受能力较好;菌株B2-3-7具有产蛋白酶能力(D/d=2.18);菌株B2-3-8产胞内β-半乳糖苷酶活性最高为36.72 U/mL;7株菌株对抗生素存在菌株特异性;菌株B2-3-3、B2-3-7、B2-3-8对金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli)均有抑制作用;菌株B2-3-1、B2-3-4、B2-3-7、B2-3-8均没有溶血现象。 综上所述,菌株B2-3-8在耐受性及产β-半乳糖苷酶方面特性优良,可用于食品加工等行业。
[1]陈功,张其圣,李恒,等.中国泡菜发酵态相对稳定性的研究及应用[J].食品与发酵科技,2020,56(1):54-63,72.
[2]刘巧,罗强,张明,等.利用16S rDNA分析不同地区传统发酵泡菜的细菌多样性[J].食品与发酵工业,2020,46(22):91-97.
[3]陈嘉佳,李璐,余元善,等.发酵蔬菜抗氧化活性的研究进展[J].中国酿造,2022,41(1):13-18.
[4]曹阳.泡菜源乳酸菌筛选及其合生元干预小鼠溃疡性结肠炎的效果研究[D].雅安:四川农业大学,2022.
[5]张雅雯,钟源,郭爱玲,等.泡菜中功能性乳酸菌的筛选及其应用研究进展[J].中国调味品,2022,47(5):197-200,205.
[6]TIAN Y, DENG F M, ZHAO L Y, et al.Characterization of extractable components of fresh and fermented Huarong large-leaf mustard and their inhibitory effects on human colon cancer cells[J].Food Biosci,2021,43:101280.
[7]刘诗美,温岚,林登蕃,等.传统与接种发酵泡菜的微生物菌群及品质差异研究进展[J].中国酿造,2025,44(2):20-25.
[8]陈磊.泡姜关键挥发性风味物质的鉴定及形成机理研究[D].成都:西华大学,2021.
[9]夏勒合特·巴克尔拜,刘晶晶,贺红军,等.新疆传统泡菜中乳酸菌的分离鉴定及其益生性能评价[J].保鲜与加工,2021,21(11):87-93.
[10]曾维友,周於强,池浩.泡菜中乳酸菌的分离鉴定及抗性筛选[J].中国酿造,2021,40(10):163-167.
[11]赵山山,杨园园,周玉岩,等.贵州泡菜中乳酸菌的分离鉴定及其在泡菜发酵中的应用[J].中国酿造,2020,39(12):113-119.
[12]许女,李雅茹,王超宇,等.传统发酵食品中乳酸菌的抗生素耐药性评估及耐药基因分析[J].中国食品学报,2020,20(7):160-171.
[13]杜秋,周晓,覃业优,等.发酵蔬菜源食品用益生乳酸菌的筛选及降胆固醇能力评价[J].食品与生物技术学报,2023,42(11):63-73.
[14]刘玉凌,任亭,彭玉梅,等.老盐水中乳酸菌的筛选鉴定及其在青菜头泡菜中的应用[J].食品与发酵工业,2020,46(2):208-213.
[15]刘宏宇,汪立平,艾连中,等.乳酸菌的抗氧化活性和耐酸耐胆盐性能的研究[J].食品工业科技,2014,35(2):92-96,99.
[16]HUANG J,YANG G,CHEN K,et al.Anti-fungal effects of lactic acid bacteria from pickles on the growth and sterigmatocystin production of Aspergillus versicolor[J].Int J Food Microbiol,2024,422:110809.
[17]崔国艳.耐高温乳酸菌的筛选、鉴定及发酵条件的研究[D].保定:河北农业大学,2019.
[18]顾娜泥.东北传统酱腌菜中耐盐乳酸菌的分离鉴定及发酵特性研究[D].哈尔滨:哈尔滨商业大学,2020.
[19]国立东,毛吾丽旦·米吉提,王丽群,等.新疆传统酸马奶源乳酸菌的分离、鉴定及其益生特性研究[J].中国酿造,2025,44(6):100-108.
[20]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:117-129.
[21]BUCHANAN R E,GIBBONS N E.伯杰细菌鉴定手册(第八版)[M].北京:科学出版社,1984:677-821.
[22]胡丹丹,吴祖芳,孙志栋,等.腌制叶用芥菜发酵菌分离鉴定及应用研究[J].核农学报,2022,36(6):1174-1182.
[23]GROSSKELWING S E,VIVAS R I R,GONZÁLEZ B E M,et al.Withdrawal notice to:"First morphological and molecular characterisation of Spirometra mansoni(Cestoda,Diphyllobothriidae)in a domestic cat from Veracruz,Mexico"[J].Vet Parasitol Reg Stud Rep,2024,56:101156.
[24]魏明智,王维浩,全志刚,等.酸汤子中乳酸菌和酵母菌益生特性[J].中国粮油学报,2024,39(9):27-36.
[25]陈颖,杨炫康,王陈晨,等.高产γ-氨基丁酸乳酸菌的筛选及益生特性研究[J].食品与发酵工业,2025,51(17):40-46.
[26]陈穗莲,张伟,黄云,等.一株香猪源乳酸菌的分离鉴定及生物学特性研究[J].饲料工业,2024,45(10):113-118.
[27]张伟,金庭飞,黎旭,等.新疆传统乳制品中产蛋白酶乳酸菌的筛选及产酶条件优化[J].中国酿造,2021,40(7):101-106.
[28]孟繁一.β-半乳糖苷酶产生菌的筛选与发酵[D].大连:大连工业大学,2013.
[29]张宇洁,王丽军,关波,等.新疆回民自制酸泡菜中产转糖基活性β-半乳糖苷酶菌株的筛选和鉴定[J].安徽农业科学,2018,46(25):159-161,178.
[30]武芷伊,魏玥,李瑜,等.云南香格里拉地区牦牛乳中乳酸菌的分离及耐盐菌株筛选[J].食品与发酵工业,2025,51(20):291-298.
[31]刘阳.汉中浆水发酵过程中微生物群落演替及乳酸菌筛选和基因组解析[D].汉中:陕西理工大学,2024.
[32]何航,周月珺,赵智远,等.泡菜盐水中植物乳杆菌的分离鉴定及发酵性能研究[J].重庆工商大学学报(自然科学版),2025,42(5):11-17.
[33]仇聪蕊,舒祥力,张云飞,等.一株猪源罗伊氏黏液乳杆菌的分离鉴定及其益生特性研究[J].中国兽医科学,2025,55(9):1216-1226.
[34]赵小茜,魏旭丹,陈戴玲,等.产多糖植物乳杆菌的耐酸耐胆盐能力[J].乳业科学与技术,2016,39(3):1-3.
[35]MEJIA-BARAJAS J A,MONTOYA-PEREZ R,SALGADO-GARCIGLIA R, et al.Oxidative stress and antioxidant response in a thermotolerantyeast[J].Braz J Microbiol,2017,48(1):936-940.
[36]李欣,张秋涵,马子尧,等.源于奶酪的产β-半乳糖苷酶乳酸片球菌的筛选及其合成低聚半乳糖特性[J].食品工业科技,2025,46(6):170-178.
[37]LIU W X,WANG J J,XIAO X K,et al.Antimicrobial effects and metabolomics analysis of cell-free supernatant produced by Pediococcus acidilactici LWX 401 isolated from Yunnan traditional pickles[J].LWTFood Sci Technol,2024,191:115626.
[38]卢博雨,王永奔,张朋,等.藏香猪粪便中益生性乳酸菌的筛选和鉴定[J].动物营养学报,2025,37(7):4849-4862.