中国白酒文化历史久远,通常以粮谷作为主要原料,辅以大曲、小曲、麸曲、酶制剂或酵母等为糖化发酵剂,经过蒸煮、糖化、发酵、蒸馏、陈酿、勾调而成[1]。中高温大曲主要被用作浓香型白酒的糖化发酵,也称浓香型大曲。 俗话说“美酒必备佳曲”,曲的质量对白酒的质量具有举足轻重的作用,因此,提高并稳定曲的质量也是白酒生产中的重要环节[2]。大曲用量占浓香型白酒投粮的20%左右,其微生物是酒醅微生物的重要来源,研究制曲过程中微生物的群落结构与质量指标对阐明大曲及白酒特性皆有重要意义。
随着生物技术的发展,高通量测序已成为大曲微生物研究最常用的手段之一,如张倩等[3]采用高通量测序解析浓香包包曲微生物群落结构,并探究大曲的理化指标与微生物间的关联性,结果表明,曲皮和曲心微生物群落结构差异明显,根霉属(Rhizopus)、毛霉属(Mucor)主要在曲皮,而嗜热真菌属(Thermomyces)主要在曲心;邓灿等[4]将普级与优级大曲微生物群落、理化指标及风味进行对比研究,为大曲质量标准体系建设提供了理论依据;吴树坤等[5]采用高通量测序技术对四川不同地区所产浓香大曲的真菌落结构进行研究,结果表明,不同地区大曲主要以嗜热子囊菌属(Thermoascus)、嗜热真菌属(Thermomyces)及曲霉属(Aspergillus)为优势菌属,但各地区间优势菌属丰度具有较大差异,为解释不同地区浓香白酒差异提供有效理论支持;张芸曌[6]通过对大曲发酵过程中的环境因子、理化指标以及微生物群落特征进行相关性分析,得出大曲液化力与糖化力之间呈正相关关系,而酸度与水分间呈负相关关系,同时真菌与酸度的关系最为密切;刘能等[7]研究发现,酵母菌、醋酸菌、乳酸菌数量在发酵过程中先上升后下降,在发酵后期数量较少,霉菌、芽孢杆菌数量较为波动,在发酵后期数量较多。通过对大曲发酵过程的研究有助于深入了解微生物在发酵过程中的作用机理,发现生产工艺中存在的问题和不足,现在白酒行业机械制曲越来越普遍,但仍存在皮张较厚,易出现板结等问题,同时对机制与人工大曲差异的研究还较少。
因此,本研究采用高通量测序技术及常规理化检测研究机制与人工踩制中高温大曲发酵过程中的真菌群落结构及理化指标,分析大曲真菌群落结构与理化指标的演替规律,同时探究真菌菌群之间及其与理化指标间的关联性,以期解析机制与传统人工制曲方式对大曲的影响,为促进大曲机械化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
中高温大曲样品:四川泸州某酒厂,分别在曲胚发酵时间为0 d(入房)、7 d、14 d、21 d、28 d、出房验收时取样,机制曲样品分别标记为J1、J2、J3、J4、J5、J6,人工曲样品分别标记为R1、R2、R3、R4、R5、R6。取样时采用五点取样法,机制曲和人工曲各取3间曲房,每间曲房各取5块大曲,将3间曲房的样品粉碎后混合均匀,用四分法取得所需样品量。
1.1.2 试剂
氢氧化钠、冰醋酸、可溶性淀粉、浓硫酸、蔗糖、硫酸铵、硫酸铜(均为分析纯):成都科龙化工试剂厂;乙二胺四乙酸、十二烷基硫酸钠、十六烷基三甲基溴化铵(均为分析纯):天津市大陆化学试剂厂;AxyPrep脱氧核糖核酸(deoxyribonucleic acid,DNA)凝胶回收试剂盒、E.Z.N.ATM Mag-Bind Soil DNA Kit提取试剂盒:美国Qiagen公司。其他试剂均为国产分析纯或生化试剂。
1.2 仪器与设备
Pico-21台式离心机:美国Thermo Fisher Scientific公司;GL-88B漩涡混合器:海门市其林贝尔仪器制造有限公司;DYY-6C电泳仪:北京市六一仪器厂;FR-1000凝胶成像系统:海复日科技有限公司;ETC 811聚合酶链式反应(polymerase chain reaction,PCR)仪:北京东胜创新生物科技有限公司;DHG-9140A鼓风干燥箱:常州润滑电器有限公司。
1.3 方法
1.3.1 理化指标的检测
参考QB/T 4257—2011《酿酒大曲通用分析方法》测定中高温大曲样品的酸度、水分、发酵力、糖化力、液化力[8]。
1.3.2 真菌菌群多样性分析
使用E.Z.N.ATMMag-Bind Soil DNA Kit提取试剂盒提取大曲样品中的微生物基因组总DNA,以其为模板,采用引物ITS1(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2(5'-GCTGCGTTCTTCATCGATGC-3')PCR扩增真菌菌群的ITS区基因序列。PCR扩增体系:基因组总DNA 1 μL,2×Hieff Robust PCR Master Mix 10 μL,上、下游引物各0.5 μL,双蒸水(ddH2O)8 μL。PCR扩增参数:95 ℃预变性3 min;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,共25个循环;72 ℃再延伸5 min。采用2%琼脂糖凝胶电泳检测PCR扩增产物文库大小,再使用Qubit3.0荧光定量仪检测文库浓度,以保证测序数据的均匀和高质量,最终将达到测序要求的PCR扩增产物委托上海生工生物工程股份有限公司在Miseq高通量测序平台上进行高通量测序分析。
1.3.3 数据处理
利用FLASH软件对测序原始数据进行拼接,利用QIIME 2软件进行过滤,得到有效序列,利用Uparse软件对样本进行聚类,以97%一致性将序列聚类为操作分类单元(operational taxonomic unit,OTU),将OTU中频数最高的序列选为代表序列,利用Mothur方法与Silva数据库对OTU进行分类学注释,利用QIIME 2软件对样品进行多样性分析[9]。 采用SPSS 26.0及Excel 2024处理数据,结果用“平均值±标准差”表示,根据高通量测序结果利用生科云平台(https://www.bioincloud.tech/standalone-task-ui/network)进行LEfse分析、相关性分析并绘图。
2 结果与分析
2.1 不同工艺中高温大曲理化指标的分析
理化指标是衡量大曲质量的重要依据之一,长期被用以指导生产。中高温大曲发酵过程中理化指标的测定结果见表1。
表1 不同工艺中高温大曲发酵过程中理化指标的测定结果
Table 1 Determination results of physicochemical indexes of medium-high temperature Daqu during the fermentation process with different processes
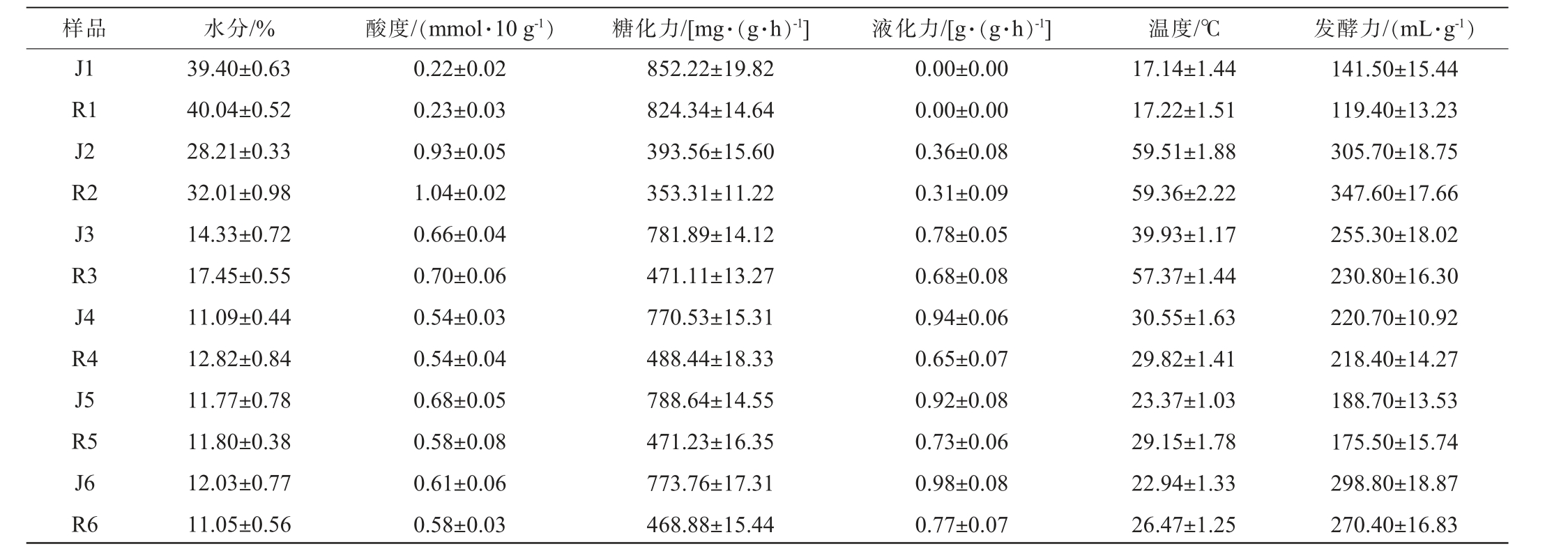
样品 水分/% 酸度/(mmol·10 g-1) 糖化力/[mg·(g·h)-1] 液化力/[g·(g·h)-1] 温度/℃ 发酵力/(mL·g-1)J1 R1 J2 R2 J3 R3 J4 R4 J5 R5 J6 R6 39.40±0.63 40.04±0.52 28.21±0.33 32.01±0.98 14.33±0.72 17.45±0.55 11.09±0.44 12.82±0.84 11.77±0.78 11.80±0.38 12.03±0.77 11.05±0.56 0.22±0.02 0.23±0.03 0.93±0.05 1.04±0.02 0.66±0.04 0.70±0.06 0.54±0.03 0.54±0.04 0.68±0.05 0.58±0.08 0.61±0.06 0.58±0.03 852.22±19.82 824.34±14.64 393.56±15.60 353.31±11.22 781.89±14.12 471.11±13.27 770.53±15.31 488.44±18.33 788.64±14.55 471.23±16.35 773.76±17.31 468.88±15.44 0.00±0.00 0.00±0.00 0.36±0.08 0.31±0.09 0.78±0.05 0.68±0.08 0.94±0.06 0.65±0.07 0.92±0.08 0.73±0.06 0.98±0.08 0.77±0.07 17.14±1.44 17.22±1.51 59.51±1.88 59.36±2.22 39.93±1.17 57.37±1.44 30.55±1.63 29.82±1.41 23.37±1.03 29.15±1.78 22.94±1.33 26.47±1.25 141.50±15.44 119.40±13.23 305.70±18.75 347.60±17.66 255.30±18.02 230.80±16.30 220.70±10.92 218.40±14.27 188.70±13.53 175.50±15.74 298.80±18.87 270.40±16.83
由表1可知,发酵过程中机制曲与人工曲均在发酵7 d时达到顶温,但在发酵14 d时,机制曲温度已降至39.93 ℃,人工曲还能维持57.37 ℃,随后温度缓慢下降直至出房,整个过程中机制曲曲心温度低于人工曲。 发酵28 d以前机制曲水分均低于同期的人工曲,且发酵前14 d机制曲水分下降速度更快,发酵过程中水分与曲心温度变化趋势印证,即发酵前期曲心温度上升,水分加速挥发,发酵后期水分较低,微生物代谢强度减弱,发酵热也相应下降,但机制曲水分与温度下降快,推测其原因可能是由于机制曲压制时没有提浆过程,曲块保水能力差,导致前期升温快、水分挥发快、曲皮粗糙,后期保温保水能力弱。 发酵过程中,机制曲与人工曲的酸度均呈现先上升后下降的趋势,刚入房时酸度最低,酸主要来自原料和水,随着发酵的进行,微生物代谢产生酸类物质,导致酸度上升,而后代谢减弱,许多低沸点挥发酸开始稳步降低并趋于稳定。 刚入房时,机制曲和人工曲的液化力均为0,分析原因可能是原料不含液化酶所致[6],但伴随发酵的进行,霉菌开始生长,机制曲和人工曲的液化力逐渐上升,且机制曲始终高于人工曲。刚入房时,机制曲和人工曲的糖化力均处于最高,分别为852.22 mg/(g·h)、824.34 mg/(g·h),但伴随顶温的到来糖化力均在发酵7 d降至最低值,分别为393.56 mg/(g·h)、353.31mg/(g·h),此后有一定回升,机制曲稳定在770mg/(g·h)左右,人工曲稳定在470 mg/(g·h)左右。
2.2 不同工艺中高温大曲真菌菌群多样性分析
2.2.1 Alpha多样性分析
稀释曲线可以用来比较测序样品中物种的丰富度,也可以用来说明样品的测序数据量是否合理[10]。不同工艺中高温大曲发酵过程中真菌菌群OTU数稀释曲线见图1。由图1可知,随着测序量的增加检测出的OTU数目呈先升高后趋于稳定的趋势,说明测序深度足够,测序结果能真实反映样品中的真菌菌群多样性,同时反映了刚入房时中高温大曲的真菌菌群丰富度更高,分析原因可能是原料中带入的真菌,但经过发酵的高温与低水活度筛选后有所降低。
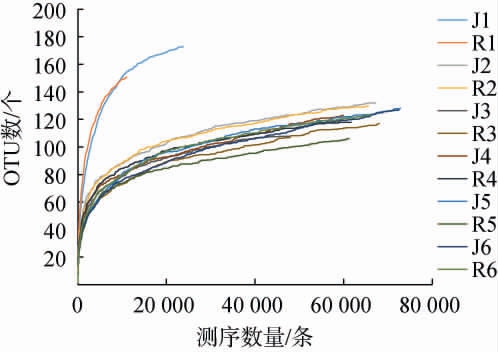
图1 不同工艺中高温大曲发酵过程中真菌菌群操作分类单元数稀释曲线
Fig.1 Operational taxonomic unit number dilution curve of fungal community in medium-high temperature Daqu with different processes during the fermentation process
不同工艺中高温大曲发酵过程中真菌菌群的Alpha多样性分析结果见表2。
表2 不同工艺中高温大曲发酵过程中真菌菌群Alpha多样性分析结果
Table 2 Alpha diversity analysis results of fungal community in medium-high temperature Daqu with different processes during the fermentation process
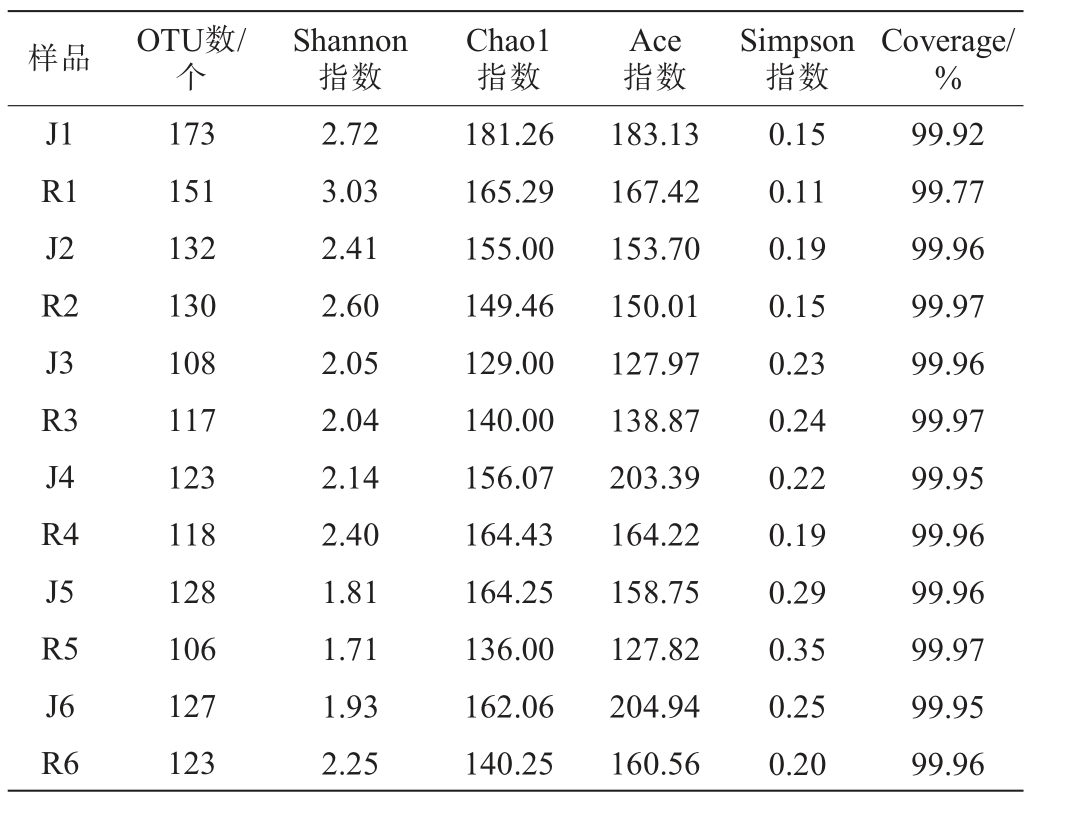
样品 OTU数/个Shannon指数Chao1指数Ace指数Simpson指数Coverage/%J1 R1 J2 R2 J3 R3 J4 R4 J5 R5 J6 R6 173 151 132 130 108 117 123 118 128 106 127 123 2.72 3.03 2.41 2.60 2.05 2.04 2.14 2.40 1.81 1.71 1.93 2.25 181.26 165.29 155.00 149.46 129.00 140.00 156.07 164.43 164.25 136.00 162.06 140.25 183.13 167.42 153.70 150.01 127.97 138.87 203.39 164.22 158.75 127.82 204.94 160.56 0.15 0.11 0.19 0.15 0.23 0.24 0.22 0.19 0.29 0.35 0.25 0.20 99.92 99.77 99.96 99.97 99.96 99.97 99.95 99.96 99.96 99.97 99.95 99.96
由表2可知,所有样品的Coverage均>99%,进一步说明各样品文库覆盖率足够,测序结果能够真实反映大曲样品中真菌菌群的多样性。Shannon指数与Simpson指数被用来反映试样中微生物的多样性,Shannon指数值越大表示微生物群落的多样性更高,Simpson指数值则相反,数值越大表明多样性更低[11]。在发酵过程中,机制曲与人工曲的真菌菌群多样性都在不断变化,总体趋势上呈先减少后略微增加。Chao1指数和Ace指数用于反应微生物群落的丰富度,数值越高,表明微生物群落丰富度越高[11]。机制曲与人工曲发酵过程中Chao1指数和Ace指数均呈现一个波浪式的变化,表明两种中高温大曲真菌群落的丰富度相对稳定,但是随着生长环境的改变以及菌群间相互竞争使之呈现出此起彼伏的状态。
2.2.2 真菌群落结构分析
从不同工艺中高温大曲发酵过程中共注释到6个真菌门和105个真菌属。 基于门水平不同工艺中高温大曲发酵过程中真菌菌群结构的变化见图2。由图2可知,入房时两种中高温大曲的优势真菌门(相对丰度≥1%)均为子囊菌门(Ascomycota)(J1为74.7%,R1为71.8%)、毛霉菌门(Mucoromycota)(J1为7.7%,R1为16.0%)、担孢子门(Basidiomycota)(J1为16.6%,R1为11.2%),出房时优势真菌门均为子囊菌门(J6为53.9%,R6为66.0%)、毛霉菌门(J6为45.6%,R6为33.5%)。 入房时子囊菌门为绝对优势真菌门,之后相对丰度有一定程度下降并稳定在50%以上,毛霉菌门入房时相对丰度较低,但经过发酵其相对丰度上升到40%左右,担孢子门主要来自原料,发酵开始可能因高温被迅速淘汰。子囊菌门和毛霉菌门是大曲中的重要微生物,在过去的研究中已被多次报道[12-13],说明这两个真菌门在大曲中普遍存在。
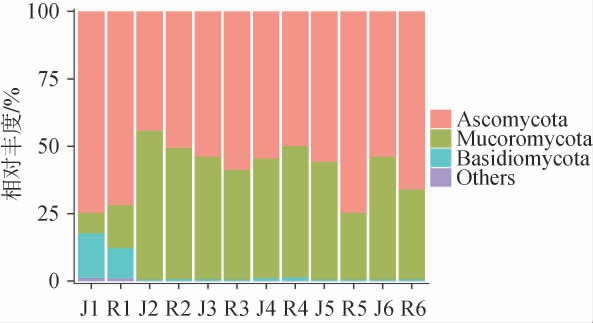
图2 基于门水平不同工艺中高温大曲发酵过程中真菌菌群结构的变化
Fig.2 Changes in fungal community structure in medium-high temperature Daqu with different processes during the fermentation process based on phylum level
Others表示相对丰度<1%的真菌门和无法鉴定到的真菌门。
进一步在属水平上对不同工艺中高温大曲发酵过程中的真菌群落结构进行分析,结果见图3。由图3可知,刚入房时两种中高温大曲中的优势真菌属均为链格孢属(Alternaria)(J1为32.7%,R1为26.7%)、嗜热真菌属(Thermomyces)(J1为6.5%,R1为12.9%)、毛霉属(Rhizomucor)(J1为5.2%,R1为10.5%)、木拉克属(Mrakia)(J1为12.6%,R1为7.3%)、曲霉属(Aspergillus)(J1为12.6%,R1为6.3%)、根霉属(Rhizopus)(J1为1.9%,R1为4.3%)、丝孢毕赤酵母属(Hyphopichia)(J1为1.3%,R1为4.1%)、镰刀菌属(Fusarium)(J1为10.3%,R1为3.7%)、伊萨酵母属(Issatchenkia)(J1为1.1%,R1为2.3%)。伴随发酵进行,发酵环境迅速改变,大曲微生物群落结构开始演替,发酵14 d时整个菌群达到相对稳定的状态,出房时两种中高温大曲中的优势真菌属均为嗜热真菌属(J6为36.9%,R6为35.3%)、毛霉属(J6为31.3%,R6为26.1%)、丝孢毕赤酵母属(J6为6.2%,R6为7.5%)、曲霉属(Aspergillus)(J6为4.8%,R6为6.3%)、双足囊菌属(Dipodascus)(J6为0.3%,R6为6.3%)、根霉属(J6为12.1%,R6为5.4%)、孢圆酵母属(Torulaspora)(J6为0.6%,R6为4.1%)、横梗霉属(Lichtheimia)(J6为1.8%,R6为1.4%)。
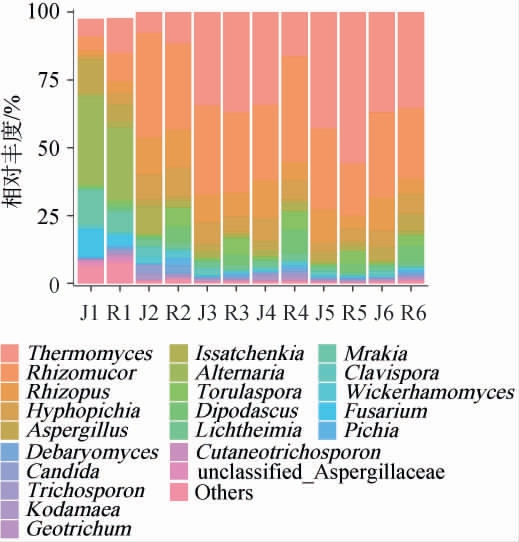
图3 基于属水平不同工艺中高温大曲发酵过程中真菌菌群结构的变化
Fig.3 Changes in fungal community structure in medium-high temperature Daqu with different processes during the fermentation process based on genus level
Others表示相对丰度<1%的真菌属和无法鉴定到的真菌属。
在中高温大曲的整个培菌发酵过程中,入房时相对丰度较高的链格孢属、木拉克属、镰刀菌属在发酵7 d时相对丰度均降至低于1%的水平,并直到发酵结束。链格孢属是广泛分布于土壤、植物、食品上的腐生菌,其最适生长温度为20~30 ℃,最适生长湿度为98%~100%,最适pH为7~8,结合其特性可以推断出其主要来自原料和水,伴随生长条件的改变迅速被淘汰。嗜热真菌属、毛霉属、根霉属的相对丰度则从入房时相对较低的水平上升至前三的位置,三者累计相对丰度达到70%左右,成为绝对优势菌群,为大曲风味物质的生成发挥重要作用。 嗜热真菌属具有产淀粉酶、脂肪酶、纤维素酶、蛋白酶的能力,且具有高温适应性和热稳定性[14-15],能在大曲发酵和酿酒时保持稳定的酶活,推动高分子多糖及蛋白质的降解,提高微生物对酿酒原料的利用率,同时促进微生物生长繁殖与产酒产香[16-17]。此外,蛋白质被分解为氨基酸后,在高温条件下与还原糖发生美拉德反应,也是大曲风味物质的重要来源[18]。 毛霉属产生的α-淀粉酶具有较好的pH耐受性及热稳定性[19-20],此外其还与大曲风味中酯类物质的形成呈正相关[21]。毛霉属产生的脂肪酶可催化水解、酯化、酯交换等反应,被广泛应用于食品、药物、生物柴油等行业[22]。根霉属作为大曲发酵过程中的优势真菌属,对曲块质量起到举足轻重的作用,曲块表面可以看到的网状菌丝体主要就有根霉,所以大曲“穿衣”也与根霉有关。根霉属所产酶类大多具备糖化发酵的能力,其中部分菌种还具有酯化力,同时产生大量乳酸,影响着酒中乳酸乙酯的含量,也有的可以转化甾族化合物,用于生产甾体激素、延胡索酸及酶制剂等[23]。
从同时期两种不同工艺的角度解析可以得出人工曲嗜热真菌属相对丰度几乎一直高于机制曲,这与人工曲顶温更高、维持时间更长相呼应,从而筛选出耐高温菌株并扩大菌株优势,产生许多风味物质,使人工曲闻香更好;机制曲中根霉属的相对丰度高于人工曲,研究表明根霉属具有很强的产液化酶、糖化酶的能力[24],在对人工与机制大曲发酵过程中理化指标跟踪监测已证实机制曲的糖化力与液化力均高于同期的人工曲,进一步肯定了根霉属对糖化力、液化力的产生具有重要贡献与调控作用。
2.2.3 不同工艺中高温大曲真菌群落差异分析
为探究机制和人工踩制两种生产方式下大曲真菌群落结构的差异性,根据得到的OTU物种分类信息对两种中高温大曲进行LEfse分析,结果见图4。 由图4可知,两种中高温大曲发酵过程中共检测出26种差异真菌(lg LDA得分>2)。在属水平上,机制曲与人工曲中存在差异的真菌主要有双足囊菌属(Dipodascus)、孢圆酵母属(Torulaspora)、德巴利氏酵母属(Debaryomyces)等15个真菌属,但其中优势菌真菌属仅有双足囊菌属(Dipodascus)、棒孢酵母属(Clavispora)、孢圆酵母属(Torulaspora)及链格孢属(Alternaria)。研究表明,无论是大曲还是酒醅中双足囊菌属都一直存在,赵志平等[1]在对发酵结束后的酒醅微生物研究中发现双足囊菌属为优势真菌,而邓长阳等[25]研究指出其在曲皮中相对含量显著高于曲心,是造成曲皮曲心微生物差异的真菌之一。 孢圆酵母属与酿酒酵母相比能产生更高浓度的高级醇、萜烯类、酚醛类等物质,可以给大曲及酒体带来花果香,增加感官丰富性和层次感[26],也有研究指出孢圆酵母属可以在一定程度上减少酒中乙醛及乙酸的生成,提高己酸乙酯等酯类物质的含量[27]。棒孢酵母属是一种产酯酵母属,同时拥有良好的产醇能力,与单菌发酵相比,其与米曲霉(Aspergillus oryzae)混合发酵可合成新的有机酸,并促进乙酸、异戊酸的消耗,使用其对大曲进行强化能显著提高大曲己酸乙酯含量,还能产生许多对优质白酒起关键作用的风味物质,对改善白酒品质具有重要价值[28]。 链格孢属来自润粮水,入房时无论是机制曲还是人工曲其均为相对丰度最高的真菌属,但随着发酵相对丰度开始迅速降至低于1%的水平,对大曲后期风味及理化的影响较小。
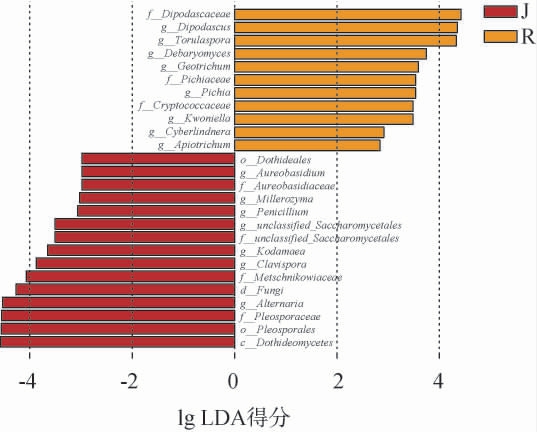
图4 不同工艺中高温大曲差异真菌线性判别分析效应大小分析结果
Fig.4 Linear discriminant analysis effect size analysis results of differential fungi in medium-high temperature Daqu with different processes
2.3 相关性分析
2.3.1 大曲中真菌属间相关性分析
微生物间存在竞争与互利关系,也是大曲微生物群落演替的重要动力,选取两种大曲平均相对丰度最高的15个真菌属进行相关性分析,揭示大曲真菌属之间的相互联系,为解释大曲发酵过程中微生物群落演替提供理论支持。
由图5可知,毛霉属与丝孢毕赤酵母属、根霉属、横梗霉属呈极显著正相关(P<0.01),与曲霉属呈极显著负相关(P<0.01);双足囊菌属与孢圆酵母属、地霉属(Geotrichum)、毕赤酵母属、德巴利酵母属呈极显著或显著正相关(P<0.01或P<0.05);嗜热真菌属、曲霉属与大部分真菌属都呈负相关,且曲霉属与毛霉属、丝孢毕赤酵母属、横梗霉属呈极显著或显著负相关(P<0.01或P<0.05);丝孢毕赤酵母属与威克汉姆酵母属(Wickerhamomyces)、根霉属、横梗霉属呈极显著或显著正相关(P<0.01或P<0.05);孢圆酵母属与地霉属、毕赤酵母属、德巴利酵母属呈极显著正相关(P<0.01);伊萨酵母属与假丝酵母属、威克汉姆酵母属、横梗霉属呈极显著或显著正相关(P<0.01或P<0.05),同时有研究发现,威克汉姆酵母属、伊萨酵母属、假丝酵母属与酒化力均呈正相关,推测三者具有代谢产酒精的能力,是酒精发酵中的重要菌属[29]。
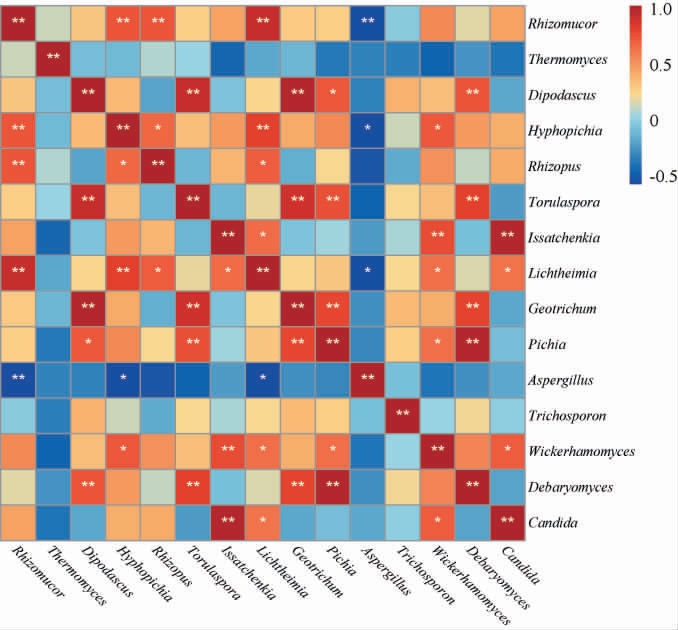
图5 基于属水平中高温大曲真菌菌群间相关性分析结果
Fig.5 Results of correlation analysis between the fungal communities in medium-high temperature Daqu based on genus level
“*”表示显著相关(P<0.05),“**”表示极显著相关(P<0.01)。下同。
2.3.2 大曲真菌属与理化指标之间的相关性分析
中高温大曲培养过程中环境条件直接影响大曲微生物的生长代谢,同样微生物又反作用于环境条件,两者间相互影响,如制曲过程中高温条件会筛选出耐高温的嗜热菌,而微生物产生的各种酶又表现在大曲理化指标上,如糖化力、液化力、发酵力等。因此,选取两种大曲中相对丰度最高的15个真菌属探究机制与人工大曲的真菌属与理化指标间的相互关系,进一步明确大曲微生物与各项外部条件关联性的强弱,结果见图6。
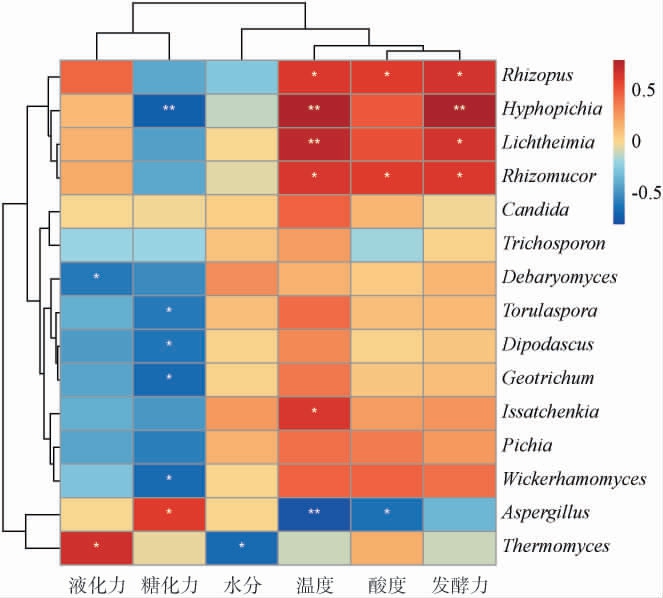
图6 基于属水平中高温大曲真菌菌群与理化指标间的相关分析分析结果
Fig.6 Results of correlation analysis between the fungal communities and physicochemical indexes of medium-high temperature Daqu based on genus level
由图6可知,微生物与环境因子相关性可分为两类,一类是温度、酸度、发酵力、水分,其在制曲过程中与大部分真菌属呈正相关,其中,根霉属、丝孢毕赤酵母属、横梗霉属、毛霉属与温度和发酵力呈极显著或显著相关(P<0.01或P<0.05),根霉属、毛霉属与酸度呈显著相关(P<0.05),伊萨酵母属于水分呈显著相关(P<0.05)。另一类是糖化力、液化力,其与大部分真菌属呈负相关,糖化力仅与曲霉属呈显著正相关(P<0.05),液化力仅与嗜热真菌属呈显著正相关(P<0.05)。 嗜热真菌属与水分呈显著负相关(P<0.05),可利用嗜热真菌属制成多种酶制剂,包括淀粉酶、纤维素酶、脂肪酶、蛋白酶等,嗜热真菌属生产的酶制剂拥有优良的热稳定性、高效的催化速率、室温下易保存等优点,可促进白酒独特风味的形成[30]。 曲霉属与温度、酸度呈极显著或显著负相关(P<0.01或P<0.05),研究表明其主要产生蛋白水解酶或其他水解酶类,有助于淀粉糖化、蛋白质水解和类黄酮的形成[31],被广泛运用于酱油、酒类、豆酱等行业。 确定与大曲理化指标相关性显著的微生物,针对性调整制曲工艺,对提高大曲质量具有重要意义。
3 结论
本研究采用高通量测序对比解析机制与人工两种中高温大曲的真菌群落结构,并分析真菌群落间及其与理化指标间的相关性。 结果表明,与人工曲相比,发酵过程中,机制曲的糖化力、液化力及发酵力相对较高,而酸度、水分、曲心温度相对较低。 入房时链格孢属、木拉克属、镰刀菌属相对丰度较高,随发酵进行嗜热真菌属、根霉属、毛霉属逐渐演变成优势菌属,且嗜热真菌属在人工曲中相对丰度较高,根霉属在机制曲中相对丰度较高。 机制与人工曲中存在差异的真菌主要有双足囊菌属、孢圆酵母属、德巴利氏酵母属等15个真菌属。 大曲中各真菌属间及其与理化指标间均存在一定的相关性。基于高通量测序与理化指标分析,初步探究了机制与人工大曲发酵过程中真菌群落与理化指标的演变,进一步揭示两种制曲方式下曲醅微生物、理化间的差异与相关性,为机械化制曲提供了一定的理论依据。
[1]赵志平,陈泓帆,韩煦,等.浓香型白酒发酵结束后不同层酒醅的微生物多样性分析[J].食品与发酵科技,2021,57(5):17-21.
[2]HOU Q C,WANG Y R,CAI W C,et al.Metagenomic and physicochemical analyses reveal microbial community and functional differences between three types of low-temperature Daqu[J].Food Res Int,2022,156:111-167.
[3]张倩,韩保林,李子健,等.浓香型白酒包包曲微生物种群多样性及形成机制[J].食品与发酵工业,2021,47(18):99-106.
[4]邓灿,高瑞杰,赵永威,等.高温大曲感官指标与理化指标、微生物群落和挥发性物质的关联[J].食品与发酵工业,2022,48(23):78-85.
[5]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[6]张芸曌.中高温大曲主发酵期微生物群落与环境因子及理化性质的关联性研究[D].自贡:四川轻化工大学,2019.
[7]刘能,何朝玖,陈杰,等.浓香型大曲培菌期主要微生物变化及挥发性风味物质合成影响因素研究[J].酿酒科技,2023(9):17-25.
[8]刘超,何平,罗明有,等.中偏高温机制与人工大曲主要生物理化指标比较研究[J].酿酒科技,2022(7):52-59.
[9]刘慧,涂璇,吕育财,等.中高温大曲在制曲过程中微生物区系演替特征及功能研究[J].食品与发酵工业,2022,48(22):180-186.
[10]WAN W,ZHU A S,XU J,et al.Dynamic changes in the microbial community,flavour components in jiupei of a novel Maotai-Luzhou-flavoured liquor under various daqu blending modes and their correlation analysis[J].LWT-Food Sci Technol,2022,172:114-167.
[11]陈茜,吕阳,周雨薇,等.中国东北地区10座城市室内外细颗粒物渗透系数及细菌组分、多样性、来源研究[J].环境化学,2020,39(5):169-180.
[12]ZHU Q I,CHEN L Q,PENG Z,et al.Analysis of environmental driving factors on core functional community during Daqu fermentation[J].Food Res Int,2022,157:111-286.
[13]ZHU M,ZHENG J,XIE J,et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Res Int,2022,153:110-955.
[14]张正盈, 江贤章.腐生丝状嗜热真菌分泌的嗜热纤维素水解酶研究进展[J].生物化工,2021,7(1):137-138.
[15]JAIN K K, DEY T B, KUMAR S, et al.Production of thermostable hydrolases(cellulases and xylanase)from Thermoascus aurantiacus RCKK:a potential fungus[J].Bioproc Biosyst Eng,2015,38(4):787-796.
[16]郭敏,黄永光,邱树毅,等.高通量测序在酱香白酒微生态多样性研究中的应用[J].中国酿造,2017,36(5):146-151.
[17]TANG H L, LIANG H B, SONG J K, et al.Comparison of microbial community and metabolites in spontaneous fermentation of two types Daqu starter for traditional Chinese vinegar production[J].J Biosci Bioeng,2019,128(3):307-315.
[18]李申奥.兼香型白酒高温大曲微生物群落演替规律的研究[D].武汉:华中农业大学,2016.
[19]LIU W H,CHAI L J,WANG H M,et al.Bacteria and filamentous fungi running a relay race in Daqu fermentation enable macromolecular degradation and flavor substance formation[J].Int J Food Microbiol,2023,390:110-118.
[20]何正贵,尹燕辰,毛佑志,等.微小根毛霉耐热α-淀粉酶基因的克隆与高效表达[J].南方农业学报,2014,45(2):165-172.
[21]HE M,JIN Y,ZHOU R,et al.Dynamic succession of microbial community in Nongxiangxing daqu and microbial roles involved in flavor formation[J].Food Res Int,2022,159:111-559.
[22]周清华.解脂耶氏酵母中基于基因整合新工具的米黑根毛霉脂肪酶高效表达[D].武汉:华中科技大学,2021.
[23]程伟,陈雪峰,陈兴杰,等.基于高通量测序解析浓香型大曲真菌群落结构及其与质量指标的关联性分析[J].食品与发酵工业,2022,48(22):194-200,212.
[24]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,2017:91-99.
[25]邓长阳,黎婷玉,刘文汇,等.襄阳地区中高温大曲曲皮和曲心真菌多样性解析[J].中国酿造,2021,40(6):65-69.
[26]原苗苗,姜凯凯,孙玉霞,等.戴尔有孢圆酵母对葡萄酒香气的影响[J].食品科学,2018,39(4):99-105.
[27]周洪江,姜文广,阮仕立,等.三种非酿酒酵母对贵人香白葡萄酒发酵进程及挥发性组分的影响[J].食品工业科技,2022,43(20):163-172.
[28]汪继伟,阎春悦,马春蕾,等.两种非酿酒酵母与米曲霉互作特性研究[J].食品工业科技,2023,44(4):171-180.
[29]杜向军,明红梅,马浩,等.机制与人工大曲曲块部位间微生物群落结构差异及其关键影响因素[J].食品与发酵工业,2023,49(3):83-91.
[30]ZHU M,ZHENG J,XIE J,et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Res Int,2022,153:110-955.
[31]HU Y L,DUN Y H,LI S A,et al.Changes in microbial community during fermentation of high-temperature Daqu used in the production of Chinese “Baiyunbian” liquor[J].J I Brewing,2017,123(4):594-599.