扣囊复膜酵母(Saccharomycopsis fibuligera)又称扣囊复膜孢酵母,隶属于子囊菌门(Ascomycota)中的酵母科(Saccharomycopsidaceae),通过多极出芽和形成菌丝体进行增殖,是一类产子囊孢子的二形态酵母[1],普遍存在于各类酒曲中,如甜酒曲[2]、白酒曲[3-5]等,是白酒发酵过程重要的功能菌之一。研究表明,扣囊复膜酵母可产淀粉酶[6-7]、有机酸[8-9],也具有一定产香产酯及产酒能力[10-12],可提升红枣酒的酒度及改善风味[13],强化小曲中糖化酶和酸性蛋白酶[14],应用于小曲白酒时可增酯降醇,提高小曲白酒的品质[15],应用于清香型麸曲酒发酵时能增加风味物质的种类及含量,使得原酒的绵甜感有不同程度的增强,改善了原酒的口感[9]。在发酵食品领域,扣囊复膜酵母可有效促进风味物质生成,具有良好的应用价值。
米香型白酒是中国白酒四大基础香型之一,是以大米为原料,小曲为糖化发酵剂,以米饭前期固态培菌糖化,后期加水转缸半液态发酵,液态蒸馏而成,具有小曲米香的蒸馏酒[16]。其感官风味相较于其他香型,呈味物质较少,口感较寡淡[17-18]。目前,虽有研究表明扣囊复膜酵母可提升白酒酒体的绵柔感、醇甜感,改善原酒品质[19],但大都是清香型、酱香型及浓香型方面的研究,而扣囊复膜酵母在米香型白酒方面的发酵特性及对酒质风味影响研究极少,且不同地域来源的同种非酿酒酵母微生物菌株,在不同酿造工艺下其遗传多样性和发酵特性均存在较大差异[20]。本研究从广西传统小曲中分离的一株扣囊复膜酵母A制成小曲,对扣囊复膜酵母A进行菌落形态观察及耐受性分析,对小曲的理化指标及酶活力进行检测,并将其应用于米香型白酒酿造。旨在解析扣囊复膜酵母在米香型白酒酿造工艺下对原酒风味物质的影响,研究其在米香型白酒工艺下的发酵性能及应用效果,为提升米香型白酒纯种酒曲品质、原酒口感与风味提供研究方向。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
大米、麸皮、米曲汁(米饭经米根霉糖化得到的糖液)、标样酒曲(2号酒曲):广西天龙泉酒业有限公司;扣囊复膜酵母A:广西天龙泉酒业有限公司米香型白酒菌种库。
1.1.2 试剂
酵母浸粉(生化试剂):北京博奥森生物技术有限公司;麦芽糖、蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;琼脂粉(生化试剂):广东环凯微生物科技有限公司;葡萄糖、氢氧化钠、硫酸铜、酒石酸钾钠、亚铁氰化钾、盐酸、碘、碘化钾、磷酸氢二钠、柠檬酸(均为分析纯)、可溶性淀粉(生化试剂):西陇科学股份有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:北京奥博星生物技术有限责任公司。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)固态培养基:酵母浸粉10.0 g/L、葡萄糖20.0 g/L、蛋白胨20.0 g/L、琼脂粉23.33 g/L,蒸馏水1 000 mL。121 ℃灭菌30 min。
YPD液态培养基:酵母浸粉10.0 g/L、葡萄糖20.0 g/L、蛋白胨20.0 g/L、蒸馏水1 000 mL。121 ℃灭菌30 min。
YPD液态无糖培养基:酵母浸粉10.0 g/L、蛋白胨20.0 g/L,蒸馏水1 000 mL。121 ℃灭菌30 min。
米曲汁培养基:取天龙泉酿造车间糖化米饭的成熟糖液,调节糖度至13~16°Bx。121 ℃灭菌10~15 min。
1.2 仪器与设备
JM-B50002电子天平:余姚市纪铭称重校验设备有限公司;YM-100立式压力蒸汽灭菌锅:上海三申医疗器械有限公司;MJP-250恒温培养箱、DHG-9076A电热恒温鼓风干燥箱:上海精宏实验设备有限公司;ZDP-250恒温培养摇床:上海一恒科学仪器有限公司;YE18BAL0202593移液枪:上海求精生化试剂仪器有限公司;PHS-3E PH计:上海仪电科学仪器股份有限公司;UV-5600紫外/可见分光光度计:上海元析仪器有限公司;DK-II电子万用炉:天津天泰仪器有限公司;7890B气相色谱(gas chromatography,GC)仪:美国安捷伦科技(中国)有限公司。
1.3 方法
1.3.1 扣囊复膜酵母形态学观察
将保存在YPD固态培养基上的扣囊复膜酵母A接种至灭菌后的YPD 液态培养基中,于30 ℃、140 r/min条件下振荡培养24 h后,静置培养24 h,再使用移液枪吸取100 μL至装有900 μL的离心管中进行稀释,稀释至10-4或10-5后,吸取100 μL稀释样液于YPD 、PDA固态培养基上进行涂布,置于培养箱中30 ℃倒置培养48~72 h,观察扣囊复膜酵母A单个菌落形态。
1.3.2 扣囊复膜酵母强化小曲制备
取米饭糖化后的糖液即米曲汁,作为扣囊复膜酵母A种子液原料,加蒸馏水调节米曲汁糖度为13~16°Bx,121 ℃灭菌10~15 min,挑取约1 cm扣囊复膜酵母A菌体于已灭菌的米曲汁中,置于30 ℃、140 r/min条件下振荡培养24 h后,静置培养24 h,即得种子液。将350 kg麸皮倒入灭菌锅中,105 ℃灭菌2.0~2.5 h,将灭菌后的麸皮摊凉,当温度降至28~37 ℃时,将3 500~4 000 mL种子液均匀撒至已灭菌的麸皮中拌匀,再添加40%~50%的无菌水搅拌混匀,分装入簸箕中再转入培养房,于28~36 ℃环境下培养40~48 h,培养期间根据菌种生长情况进行排潮、翻曲。培养结束转入烘房于45 ℃条件下干燥至水分<12%,即得扣囊复膜酵母小曲。
1.3.3 扣囊复膜酵母强化小曲理化指标及酶活力检测
糖化力的测定:采用化饭法[21]。糖化力定义为每1 g酒曲糖化100 g大米饭24 h所生成的葡萄糖的质量,单位为g/100 g。
酒化力的测定:参考江威等[22]的方法。酒化力定义为每1 g酒曲糖化100 g大米饭24 h后,取其90 g米饭进行发酵3 d所生成的酒精换算成20 ℃时的酒精度,单位为%vol。
α-淀粉酶活:参考李习[23]的方法。α-淀粉酶活定义:在40 ℃、pH=6.0,5 min水解1 mg可溶性淀粉的酶量,即为一个酶活力单位(U/mL)。
1.3.4 耐受性实验
将扣囊复膜酵母A种子液按5%(V/V)接种量分别加入不同耐受条件的YPD培养基中,培养48 h后用紫外分光光度计测定其在波长600 nm 处的吸光度值(OD600nm值),研究其在不同温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)、葡萄糖含量(0、10%、20%、30%、40%、50%、60%、70%)、乙醇体积分数(0、3%、6%、9%、12%、15%)及pH值(2.0、3.0、4.0、5.0、6.0、7.0)环境下的生长情况,以此评价扣囊复膜酵母A对温度、葡萄糖含量、乙醇体积分数、酸度的耐受能力。
1.3.5 扣囊复膜酵母与标样酒曲复配发酵小试
以标样酒曲为对照,在标样酒曲中加入30%的扣囊复膜酵母A进行混合,再以大米200 g、米饭水分54%~58%、下曲量0.8%~1%、下曲品温30~34 ℃、30 ℃下糖化及发酵、加水量120%、发酵13 d、摘酒头25 mL进行小试实验,再以实验室常压蒸馏方式进行蒸馏,摘酒头后取100 mL馏出液进行理化指标测定。
1.3.6 扣囊复膜酵母A在米香型白酒生产中的应用
米香型白酒生产工艺流程如下:
原料→浸泡→加水、蒸煮→降温→下曲→糖化→发酵→蒸馏→摘酒头→原酒
在全机械化米香型白酒酿造车间进行投料,以大米(20 t)/批为原料,加自来水浸泡20~30 min,蒸煮后的米饭水分53%~58%,待降温至28~30 ℃,按0.8%比例加入含有扣囊复膜酵母A的强化小曲,拌匀后输送至糖化设备中,糖化24~30 h,糖化温度45 ℃,糖化结束后按原料质量加入120%的水,搅拌均匀后抽入不锈钢发酵罐中,在27~32 ℃温度下发酵13 d,发酵结束后将酒醅抽入蒸馏釜蒸馏,摘取120~150 L酒头,馏酒温度30 ℃,取酒精度54%vol~55%vol的原酒进行理化指标测定。
1.3.7 米香型白酒原酒基本理化指标测定
酒精度:参照GB 5009.225—2023《食品安全国家标准酒和食用酒精中乙醇浓度的测定》进行检测[24];总酸:参照GB12456—2021 《食品安全国家标准食品中总酸的测定》进行检测[25];总酯、乙酸乙酯、乳酸乙酯、乙酸、异丁醇、异戊醇、正丙醇及β-苯乙醇参照GB/T 10345—2022《白酒分析方法》中的方法[26]。出酒率计算公式:出酒率=折度后(65度)原酒总质量/原料总质量×100%。
1.3.8 数据处理
采用安捷伦MSD ChemStation软件处理气相色谱数据;WPS Office 2023进行数据分析与绘图。
2 结果与分析
2.1 扣囊复膜酵母形态特征
将菌种库中活化好的扣囊复膜酵母A分别在PDA、YPD培养基平板上涂布,分别在30 ℃条件下培养48~96 h其菌落形态见图1。

图1 扣囊复膜酵母A在不同培养基上的菌落形态
Fig.1 Colony morphology of Saccharomycopsis fibuligera A on different media
由图1可知,扣囊复膜酵母A在PDA培养基平板上呈白色,规则圆形,干燥不透明,表面覆放射状长绒毛,稀疏,似盛开的蒲公英状;在YPD培养基平板上呈白色或米黄色(随培养时间延长变黄),规则圆形,干燥不透明,表面覆盖有短绒毛,稠密,向上凸起似山坡状。结果表明,扣囊复膜酵母A在不同培养基上的菌落形态略有不同,但均为凸起圆形、干燥不透明、表面覆有绒毛,不易挑取及随培养时间延长绒毛下塌,可作为该酵母培养条件优化提供形态学依据,同时建立基于菌落形态的快速鉴别标准。
2.2 扣囊复膜酵母强化小曲理化指标及酶活力检测
扣囊复膜酵母可以分泌淀粉酶、葡萄糖淀粉酶、酸性蛋白酶和β-葡萄糖苷酶,在食品、发酵、生物燃料和医药行业有很多的应用[27]。将扣囊复膜酵母A制成强化小曲后分别检测其糖化力、酒化力、α-淀粉酶活情况,结果见表1。
表1 扣囊复膜酵母A强化小曲理化指标及α-淀粉酶活力检测结果
Table 1 Determination results of physicochemical indexes and α-amylase activity of Saccharomycopsis fibuligera A fortified Xiaoqu

项目 糖化力/(g·100 g-1)α-淀粉酶活/(U·mL-1)扣囊复膜酵母A 3.0±1.0 19.0±2.0 8.0±4.0酒化力/%vol
由表1可知,扣囊复膜酵母A可产糖化酶、淀粉酶,也具有产酒能力,扣囊复膜酵母A强化小曲酒化力为19%vol,但糖化力及α-淀粉酶活性不高,糖化力仅3.0 g/100 g、α-淀粉酶活为8.0 U/mL,单独使用时糖化及发酵效果不佳,无法将大米中的淀粉物质充分转化为糖类,需与米根霉复配使用。
2.3 耐受性分析
白酒酿造是一个相对复杂的过程,高温、高糖、低pH、高乙醇浓度等环境均会影响菌株的活性及繁殖代谢[12,28],结合生产条件对扣囊复膜酵母A耐温、耐酸、耐糖及耐乙醇性能进行研究,掌握其最适生长环境及应用时针对性调控,保证菌株性能及其代谢活动。扣囊复膜酵母A对温度、葡萄糖含量、乙醇体积分数、酸度的耐受性试验结果见图2。
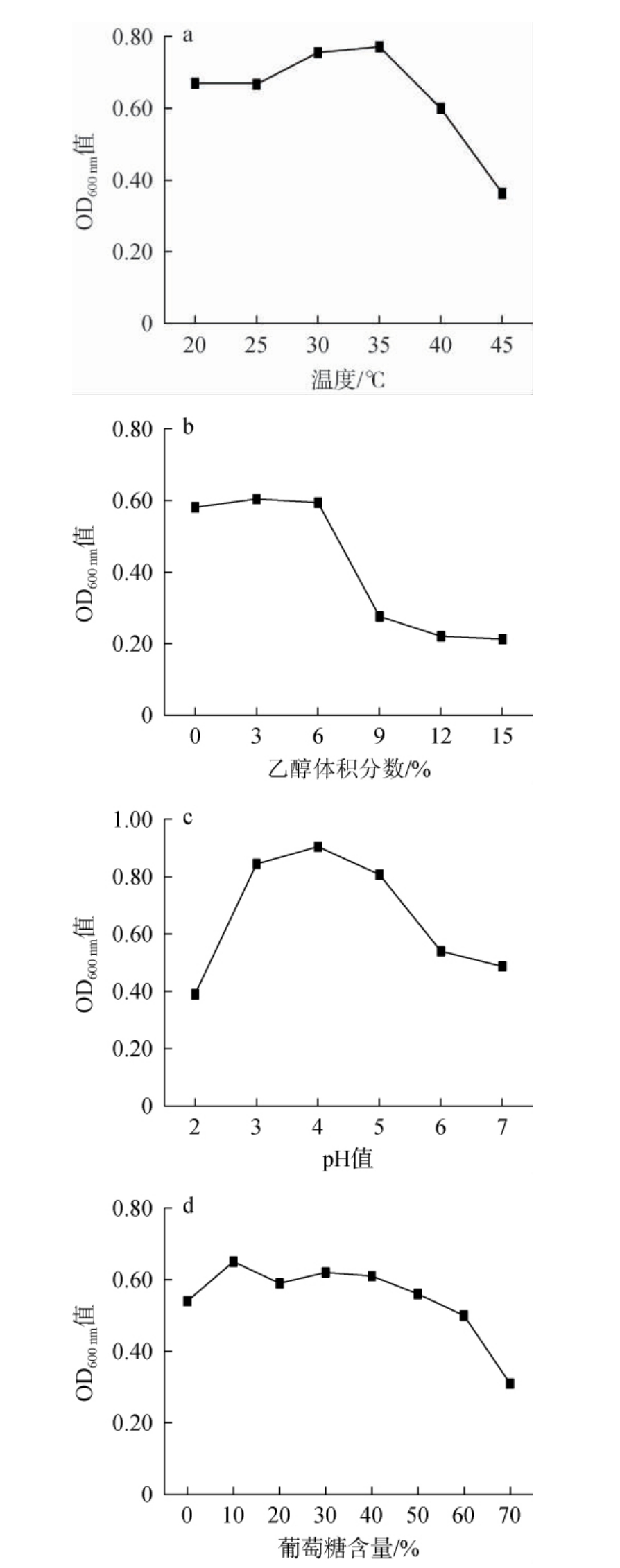
图2 扣囊复膜酵母A对温度(a)、乙醇体积分数(b)、酸度(c)及葡萄糖(d)的耐受性
Fig.2 Tolerance of Saccharomycopsis fibuligera A to temperature(a), ethanol volume fraction (b), acidity (c) and glucose (d)
由图2a可知,扣囊复膜酵母A在温度35 ℃时生物量最高,而后随温度升高生长开始受抑制,但在45 ℃条件下仍有活性。因此扣囊复膜酵母A能耐受温度45 ℃。由图2b可知,扣囊复膜酵母A在乙醇体积分数0~6%时可正常生长,当乙醇体积分数>6%时,菌株生物量显著下降;当乙醇体积分数>6%之后,扣囊复膜酵母A生长受到抑制,但均可生长。因此,扣囊复膜酵母A能耐受乙醇体积分数为15%。由图2c可知,扣囊复膜酵母A随培养基中的pH值在2.0~7.0范围内升高呈先升后降趋势,其在pH为4.0时生物量最高,pH 2.0~3.0时生长受到显著抑制。因此,菌株A能耐受pH值为2.0。由图2d可知,扣囊复膜酵母A在葡萄糖含量10%~60%时均能正常生长,当葡萄糖含量>60%之后,生物量显著下降,但在70 ℃时可正常生长。因此,扣囊复膜酵母A可耐受70%的葡萄糖含量。
2.4 扣囊复膜酵母小试发酵结果分析
为了解扣囊复膜酵母A对米香型小曲强化效果,以标样酒曲(2号酒曲)为对照,将其与标样酒曲按3∶7比例混合后以半固态发酵方式进行发酵性能实验,比对小试原酒酒精度、总酸、总酯及杂醇油(异戊醇、异丁醇的总量计)情况,结果见表2。
表2 扣囊复膜酵母A与米香型小曲混合小试发酵原酒酒精度、总酸、总酯及杂醇油测定结果
Table 2 Determination results of alcohol content, total acids, total ester and fusel oil in original liquor fermented with Saccharomycopsis fibuligera A and rice-flavor Xiaoqu in small-scale
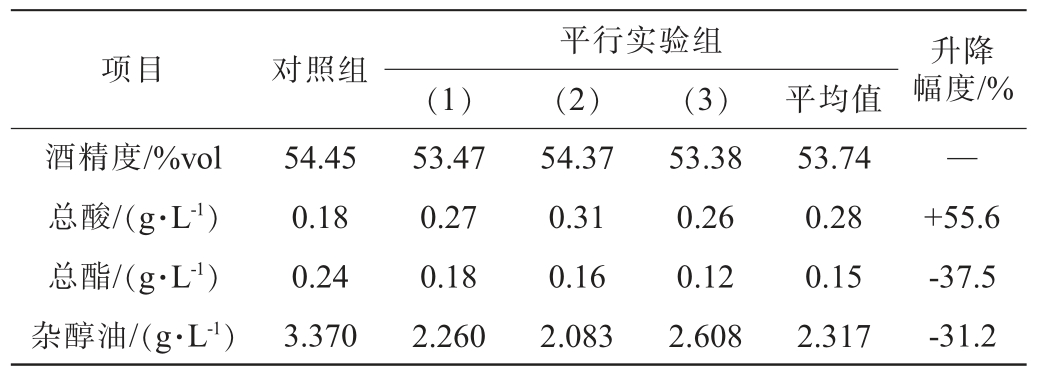
项目 对照组 升降幅度/%平行实验组(1)(2)(3)平均值酒精度/%vol总酸/(g·L-1)总酯/(g·L-1)杂醇油/(g·L-1)54.45 0.18 0.24 3.370 53.47 0.27 0.18 2.260 54.37 0.31 0.16 2.083 53.38 0.26 0.12 2.608 53.74 0.28 0.15 2.317—+55.6-37.5-31.2
由表2可知,标样酒曲中加入扣囊复膜酵母A,总酯含量下降,可能与扣囊复膜酵母在发酵过程中对底物的利用具有偏向性[11]以及产酯能力较弱[29]有关;原酒总酸含量较标样酒曲提升55.6%,与扣囊复膜酵母可促进乙酸的生成有关[8];杂醇油降低31.2%,具有降异丁醇和异戊醇的作用,这与刘霄等[15]研究结果一致。实验室小试酒质数据显示扣囊复膜酵母A与标样酒曲混合使用可促进酸类物质生成及减少杂醇油生成,在标样酒曲中加入扣囊复膜酵母具有一定强化作用,但需结合实际生产进行验证。
2.5 扣囊复膜酵母在米香型白酒生产中的应用
为进一步明确扣囊复膜酵母A发酵性能及其在米香型白酒全机械化大生产中的应用情况,以扣囊复膜酵母A与标样酒曲按3∶7比例复配进行实验,以标样酒曲为对照组,添加扣囊复膜酵母A的酒曲为试验组。
2.5.1 糖化过程中温度的变化
对照组和试验组糖化过程中温度变化见图3。
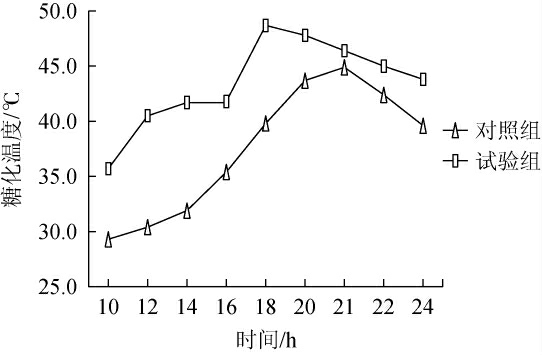
图3 对照组和试验组糖化过程中温度变化
Fig.3 Temperature changes of the control group and the experimental group during saccharification process
由图3可知,添加扣囊复膜酵母A的试验组较对照组糖化升温快(糖化12 h后温度普遍在38 ℃以上)且高温糖化持续时间长,其上层饭温可达48~50 ℃,温度过高不利于主体酵母繁殖代谢,影响酒率,需优化糖化设备进行控制,同时糖化时间为(26±3)h(冬季糖化时间较长)。添加扣囊复膜酵母A的酒曲在糖化过程升温快,易出现高温,进而影响其他酿酒微生物的活性,故应用过程需注意该菌添加量及糖化过程降温。
2.5.2 发酵过程中理化指标的变化
对照组和试验组发酵过程中理化指标的变化结果见图4。
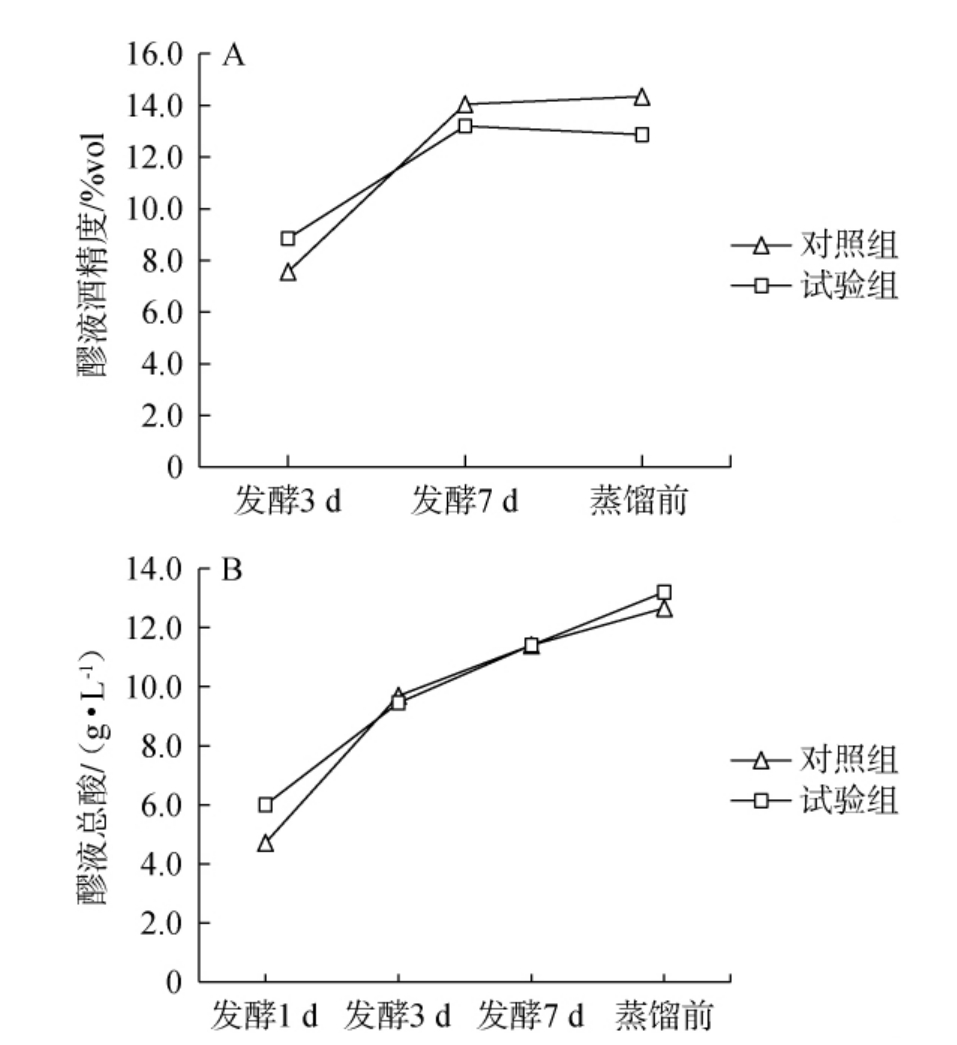
图4 对照组和试验组发酵过程中醪液酒精度(A)和总酸(B)的变化
Fig.4 Changes of alcohol content (A) and total acid (B) of the fermented mash of the control group and the experimental group
由图4A可知,添加扣囊复膜酵母A的试验组在发酵前3 d醪液酒精度略高于对照组,但均在10%vol内,且发酵7 d后试验组醪液酒精度渐趋于稳定,在12%vol~14%vol之间,其成熟发酵醪液酒精度较对照组(14%vol~15%vol)低。由图4B可知,试验组醪液总酸(13~14 g/L)与对照组(12~13 g/L)相当,且上升趋势几近相同。
2.5.3 原酒主要品质指标及出酒率
对照组和试验组原酒主要品质指标及出酒率结果见表3。
表3 对照组和试验组原酒主要品质指标及出酒率检测结果
Table 3 Determination results of main quality indicators and liquor yields of original liquor of the control group and the experimental group
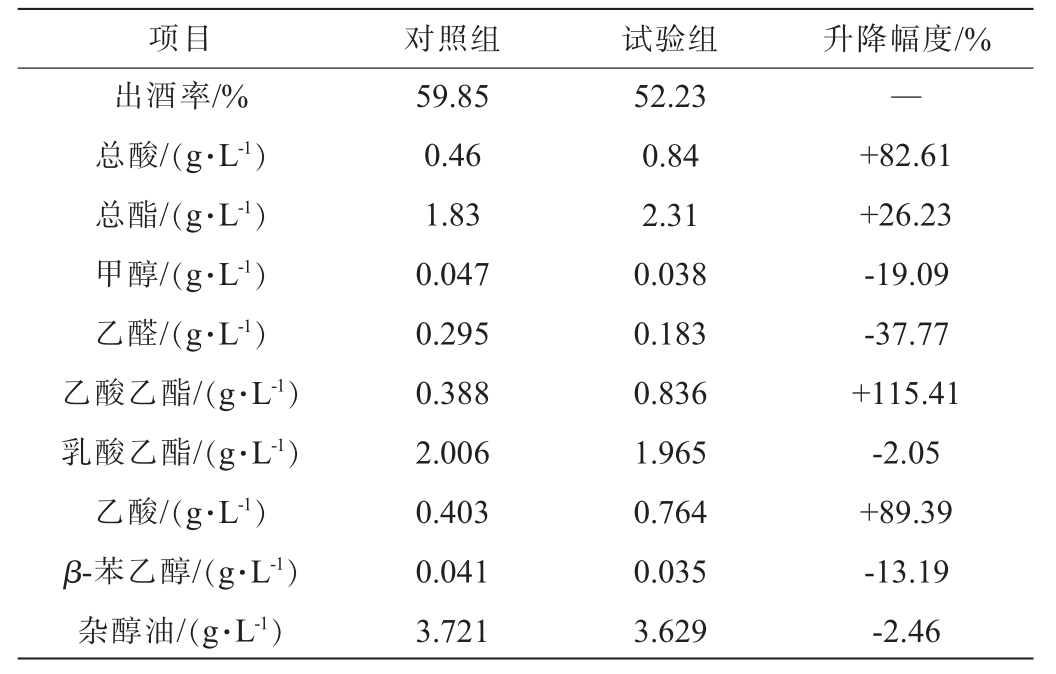
项目 对照组 试验组 升降幅度/%出酒率/%总酸/(g·L-1)总酯/(g·L-1)甲醇/(g·L-1)乙醛/(g·L-1)乙酸乙酯/(g·L-1)乳酸乙酯/(g·L-1)乙酸/(g·L-1)β-苯乙醇/(g·L-1)杂醇油/(g·L-1)59.85 0.46 1.83 0.047 0.295 0.388 2.006 0.403 0.041 3.721 52.23 0.84 2.31 0.038 0.183 0.836 1.965 0.764 0.035 3.629—+82.61+26.23-19.09-37.77+115.41-2.05+89.39-13.19-2.46
由表3可知,添加30%扣囊复膜酵母A的试验组产酒能力有所降低,对照组出酒率为59.85%,试验组出酒率为52.23%,出酒率较对照组下降7~8个百分点,分析原因为添加扣囊复膜酵母A的酒曲在糖化过程品温过高,抑制酿酒酵母增殖或导致部分菌体失活,且高温可能改变酿酒酵母代谢路径,未转化为酒精,进而降低出酒率。但原酒中的酸类、酯类风味物质含量高且甲醇、乙醛含量均低于对照组,其中总酸提升82.61%(其中乙酸提升89.39%)、总酯提升26.23%(其中乙酸乙酯提升115.41%)、甲醇降低19.09%、乙醛降低37.77%,而乳酸乙酯、杂醇油与对照组相差较小,均在2.0%~2.5%之间。结果表明,米香型纯种酒曲中添加扣囊复膜酵母A利于提升原酒中的乙酸、乙酸乙酯及改善酒体香气与感官,乙酸乙酯是小曲白酒的主体香气成分,具有菠萝香和苹果香气,赋予小曲白酒清甜的特点[27],且可降低原酒中甲醇及乙醛,该菌对提升原酒风味物质具有强化作用,应用潜力较好。
3 结论
本研究将从广西传统小曲中分离的扣囊复膜酵母A制成小曲进行研究,以深入了解扣囊复膜酵母基础特性及其在米香型白酒工艺下对原酒风味物质的影响。经菌落形态观察,扣囊复膜酵母A在不同培养基上的菌落形态略有不同,但均为凸起圆形、干燥不透明、表面覆有绒毛,不易挑取及随培养时间延长绒毛下塌。通过制成纯种小曲检测理化,扣囊复膜酵母A糖化力为3.0 g/100 g、α-淀粉酶活为8.0 U/mL,单菌使用时糖化不佳,需与米根霉复配使用;其具有一定产酒能力,酒化力19.0%vol。耐受性实验结果显示,扣囊复膜酵母A具有良好的耐受性,能在温度45 ℃、乙醇体积分数15%、pH为2.0、葡萄糖含量70%的条件下生长。经米香型白酒酿造大试工艺验证,研究表明,添加30%扣囊复膜酵母A的酒曲糖化升温快、高温糖化时间长,上层饭温可达48~50 ℃,应用过程需注意该菌添加量;其成熟发酵醪液酒精度为12%vol~14%vol、总酸13~14 g/L,醪液酒精度与总酸基本持平;原酒中的乙酸可提升89.39%、乙酸乙酯提升115.41%、甲醇降低19.09%、乙醛降低37.77%,扣囊复膜酵母A对提升原酒风味物质具有强化作用,有较好应用前景。
[1]BONETE D E E,TOLENTINO J H G,NOVERO A U.Determination of the cDNA sequence and in silico functional analysis of a glucoamylase gene from Saccharomycopsis fibuligera 2074[J].Philippine J Sci,2018,147(2):261-273.
[2]姚淑敏,陈璐,闫华文.应用PCR-DGGE 方法研究甜酒曲中真菌多样性[J].中国酿造,2016,35(11):44-48.
[3]ZHENG X W, YAN Z, ROBERT NOUT M J, et al.Characterization of the microbial community in different types of Daqu samples as revealed by 16S rRNA and 26S rRNA gene clone libraries[J].World J Microb Biot,2015,31(1):199-208.
[4]YANG J G,DOU X,HAN P J,et al.Microbial diversity in Daqu during production of Luzhou flavored liquor[J].J Am Soc Brewing Chem,2017,75(2):136-144.
[5]王春晓,唐佳代,吴鑫颖,等.酿酒小曲中功能微生物的研究进展[J].食品科学,2019,40(17):309-316.
[6]周阳子,边名鸿,刘文艺,等.高温大曲中一株产淀粉酶酵母的分离鉴定及其特性研究[J].食品与发酵工业,2020,46(2):79-84.
[7]孙雅芳,张静洁,郭天芬,等.一株高产淀粉酶扣囊复膜酵母的生理特性研究[J].中国酿造,2024,43(10):118-123.
[8]王春晓,袁国亿,苏伟,等.白酒制曲环境和成品曲中产酸微生物分析[J].食品科学,2020,41(18):120-126.
[9]马美荣,刘小改,李洪媛,等.两种扣囊复膜酵母在清香型麸曲白酒生产中的应用[J].食品工业科技,2021,42(21):133-139.
[10]苏畅,马莹莹,杨建刚.扣囊复膜酵母在酿酒中的应用研究进展[J].食品研究与开发,2018,39(1):205-209.
[11]杨子琳,伍时华,黄翠姬,等.扣囊复膜酵母与酿酒酵母混合液态发酵改善糯米酒风味的研究[J].广西科技大学学报,2016,27(30):95-100.
[12]王居伟,韩培杰,王雪薇,等.白酒发酵过程中常见酵母菌扣囊复膜酵母的研究进展[J].广西科学,2020,27(1):1-9.
[13]雷炎,刘梦琦,易秦振,等.扣囊复膜酵母在红枣酒中的应用[J].食品研究与开发,2021,42(5):131-136.
[14]SU C, ZHANG K Z, YANG J G, et al.Effects of Saccharomycopsis fibuligera and Saccharomyces cerevisiaeinoculation on small fermentation starters in Sichuan-style Xiaoqu liquor[J].Food Res Int,2020,137(1):1-12.
[15]刘霄,黄治国,卫春会,等.扣囊复膜酵母麸曲制备及其在小曲白酒中的应用[J].食品科学,2025,46(1):56-63.
[16]WEI Y, ZOU W, SHEN C H, et al.Basic flavor types and component characteristics of Chinese traditional liquors: A review[J].J Food Sci,2020,85(12):4096-4107.
[17]唐取来.米香型白酒新工艺的研究[D].天津:天津科技大学,2016.
[18]王星凯.米酒液态发酵原料预处理及发酵条件优化[D].广州:华南理工大学,2018.
[19]王乃军,马美荣.扣囊复膜酵母在白酒生产中的应用研究进展[J].酿酒科技,2023(3):115-119.
[20]MARSIT S, DEQUIN S.Diversity and adaptive evolution of Saccharomyces wine yeast:A review[J].FEMS Yeast Res,2015,15(7):67.
[21]唐洁,杨强,刘源才,等.高糖化力米根霉G1培养条件优化[J].中国酿造,2022,41(7):173-178.
[22]江威,章刚,张龙,等.添加中药材对绿衣观音土曲品质影响及相关性分析[J].中国酿造,2024,43(1):169-173.
[23]李习.高产α-淀粉酶地衣芽孢杆菌的筛选及重组质粒的构建[D].武汉:湖北工业大学,2014.
[24]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 5009.225—2023 食品安全国家标准酒和食用酒精中乙醇浓度的测定[S].北京:中国标准出版社,2023.
[25]中国人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 12456—2021 食品安全国家标准 食品中总酸的测定[S].北京:中国标准出版社,2021.
[26]国家市场监督管理总局,国家标准化管理委员会.GB/T 10345—2022白酒分析方法[S].北京:中国标准出版社,2022.
[27]CHI Z M,CHI Z,LIU G,et al.Saccharomycopsis fibuligera and its applications in biotechnology[J].Biotechnol Adv,2009,27(4):423-431.
[28]WANG D K, HE M W, ZHANG M, et al.Food yeasts: Occurrence,functions,and stress tolerance in the brewing of fermented foods[J].Crit Rev Food Sci Nutr,2023,63(33):12136-12149.
[29]陈玉香,叶汶坤,何冬萍,等.酵母菌对红曲黄酒风味物质形成的影响[J].中国食品学报,2015,15(7):218-224.
[30]KONG Y,WU Q,ZHANG Y,et al.In situ analysis of metabolic characteristics reveals the key yeast in the spontaneous and solidstate fermentation process of Chinese light-style liquor[J].Appl Environ Microbiol,2014,80(12):3667-3676.