酚酸是一类重要的植物次生代谢产物,具有抗氧化、抗炎及神经保护等多种健康益处[1-2]。植物中的酚酸类物质主要分为游离态酚酸和结合态酚酸,且多数以结合态形式存在[3]。根据酚酸的成键物质不同,将结合态酚酸中以酯形式存在的称为酯键合态酚酸(esterified phenolic acids,EPAs),以糖苷键结合形式存在的称为糖苷键合态酚酸(glycosided phenolic acids,GPAs)[4]。不同形态的酚酸类物质在植物中的分布和生物活性各不相同[5],沙棘种皮中游离态酚酸含量占比高于其种仁和果浆[6];韩雅盟[7]研究发现,藜麦中的游离态酚酸对α-葡萄糖苷酶的抑制活性高于结合态。
红枣中的酚酸类物质主要有没食子酸(gallic acid,GA)、原儿茶酸(protocatechuic acid,PA)、绿原酸(chlorogenic acid,CGA)、对羟基苯甲酸(p-hydroxybenzoic acid,PHBA)、咖啡酸(caffeic acid,CA)、对香豆酸(p-coumaric acid,PCA)、阿魏酸(ferulic acid,FA)及肉桂酸(cinnamic acid,CNA)等[4]。这些酚酸类物质有的呈游离态,更多的则是以结合态的形式存在于红枣中[8-10]。近年来,为增强酚酸类物质的生物可及性,将富含酚酸的原料进行发酵,可促使结合态酚酸发生降解或生物转化,以提高其生理功能和生物可及性[11-12]。PAN X等[13]研究发现,嗜热链球菌(Streptococcus thermophilus)发酵会增加红枣泥中大多数酚类物质的含量,经体外动态胃肠道消化试验,发现在相同消化时间下,发酵红枣泥中大多数酚酸类化合物浓度及抗氧化活性均高于未发酵样品,表明发酵可提高酚类化合物的稳定性,增强其生物可及性。张江宁等[14]使用乳酸菌和酵母菌单一及联合发酵红枣汁,发现部分游离态酚酸含量有所增加,表明发酵促进了结合态酚酸向游离态酚酸转化,且混合发酵效果更好。然而,目前关于红枣汁中键合态酚酸类化合物在乳酸菌发酵过程中的变化规律及其与抗氧化活性的相关性研究较少。
本研究采用植物乳植杆菌(Lactiplantibacillusplantarum)发酵红枣汁,利用高效液相色谱(high performance liquid chromatography,HPLC)对红枣汁发酵过程中的EPAs及GPAs含量进行跟踪检测,通过主成分分析(principal component analysis,PCA)确定随发酵时间变化的关键酚酸物质种类,并将其与抗氧化能力进行相关性分析,旨在为乳酸菌发酵红枣汁中酚酸类物质变化与抗氧化活性的研究提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株
灰枣:采自新疆尉犁;植物乳植杆菌(Lactiplantibacillus plantarum)CICC 20022:中国工业微生物菌种保藏管理中心。
1.1.2 试剂
Na2CO3(食品级):浙江汇泉生物科技有限公司;乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、维生素C(vitamin C,VC)(均为分析纯):天津大茂化学试剂厂;2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、1,1-二 苯基-2-三 硝 基 苯 肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度均>98%):上海阿拉丁生化科技股份有限公司;果胶酶(100 000 U/g)、纤维素酶(50 000 U/g):江苏锐阳生物科技有限公司;酚酸类物质(没食子酸、阿魏酸、原儿茶酸、绿原酸、咖啡酸、对香豆酸、肉桂酸及对羟基苯甲酸)标准品(纯度均>98%):上海源叶生物科技有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
MRS琼脂培养基、MRS肉汤培养基:北京奥博星生物技术有限责任公司。
1.2 仪器与设备
SW-CT-IBV型无菌操作台:上海浦东荣丰科学仪器有限公司;LDZX-50KBS型立式压力蒸汽灭菌锅:上海申安医疗器械厂;DNP-9052A型电热恒温培养箱:上海鸿都电子科技有限公司;Agilent 1260 LC型高效液相色谱仪:安捷伦科技(中国)有限公司;KQ-700DE超声波清洗机:中国昆山超声仪器有限公司;HC-3618R高速冷冻离心机:安徽中科中佳科学仪器有限公司;HH-S4数显温水浴:江苏省金坛市医疗仪器厂。
1.3 方法
1.3.1 植物乳植杆菌的活化
取1 mL保存在甘油中的植物乳植杆菌,接种到100 mL MRS肉汤培养基中,37 ℃恒温培养48 h,连续活化培养2次后,4 ℃、6 000 r/min条件下离心15 min,收集菌种沉淀,采用无菌水洗涤沉淀物两次,制备成菌体浓度为9.48 lg(CFU/mL)的菌悬液,备用。
1.3.2 发酵红枣汁的制备
灰枣清洗后,于50 ℃烘干48 h后磨成粉,以料液比为1∶4(g∶mL)加入去离子水,混匀,加入2.4 g/L酶制剂(果胶酶∶纤维素酶=1∶2),于40 ℃恒温水浴4 h,85 ℃灭酶15 min,离心(4 ℃,3 000 r/min,10 min),弃去沉淀后得到红枣清汁[15]。采用Na2CO3和饮用水将红枣汁的初始pH值和糖度分别调整到5.0和15°Bx[16],121 ℃高压蒸汽灭菌20 min。冷却到室温后,以3%(V/V)的接种量接种植物乳植杆菌菌悬液,37 ℃条件下培养48 h。
1.3.3 发酵红枣汁中键合态酚酸含量的测定
样品前处理:分别取10 mL发酵0 h、12 h、24 h、36 h、48 h的红枣汁样品于50 mL离心管中,依次加入30 mL体积分数为80%冰乙醇,超声(700 W,25 ℃)提取15 min,2 500 r/min离心10 min,残渣重复提取2次[17-18]。合并3次提取液,35 ℃旋转蒸发至50 mL,取其中25 mL置于烧杯,用6 mol/L的HCl调pH至2.0,然后加入等体积的乙酸乙酯溶液振荡提取后分液,重复提取5次。最后保留下层水相,用于提取键合态酚酸。
EPAs的提取[4]:向下层水相(25mL)中加入10mL4 mol/L NaOH溶液(含有10 mmol/L的EDTA和1%VC),快速充入氮气,于25 ℃下振荡提取4 h后,用6 mol/L的HCl调pH至2.0,再加入等体积(25 mL)的乙酸乙酯溶液重复提取5次,合并有机相。将合并的有机相旋转蒸发至干(35 ℃),注入10 mL体积分数为80%的甲醇溶解,于35 ℃旋转蒸发至干,复溶于1 mL体积分数为80%甲醇并过0.22 μm滤膜,得到EPAs。
GPAs的提取[4]:向经乙酸乙酯提取EPAs之后的下层水相(25 mL)中加入4 mL6 mol/L的HCl,于85 ℃水解30 min,再加入等体积(25 mL)的乙酸乙酯溶液重复提取5次后同上,得到GPAs[10]。
检测:采用HPLC法测定EPAs及GPAs含量。色谱条件参考魏肖鹏[19]的方法并做适当修改,具体条件为Eclipse Plus C18色谱柱(4.6 mm×250 mm,5 μm),进样量10 μL,流动相A为甲醇/乙腈/水(1∶1∶1,V/V/V),流动相B为0.1%甲酸,洗脱程序为0~3min,5%A;3~10min,5%~40%A;10~25min,40%~80%A;25~30 min,80%~5%A。流速为1 mL/min,柱温为35 ℃,检测波长为280 nm。通过保留时间进行定性,采用外标法进行定量。
1.3.4 抗氧化能力测定
DPPH自由基清除能力的测定:参考张素芳等[20]的方法;ABTS自由基清除能力的测定:参考肖默艳等[21]的方法;总抗氧化能力的测定:参考ZHAO X X等[22]采用铁离子还原/抗氧化能力法(Ferric ion reducing antioxidant power,FRAP)。以不同浓度的FeSO4·7H2O(X)为横坐标,吸光度值(Y)为纵坐标绘制标准曲线,得到总抗氧化能力的标准曲线回归方程为Y=0.31X+0.08,R2=0.999 6。
1.3.5 数据处理与统计分析
使用SPSS 26.0软件处理数据并进行方差分析,结果以“平均值±标准差”表示;利用Origin 2021软件绘图。
2 结果与分析
2.1 红枣汁发酵过程中键合态酚酸含量的变化
红枣汁发酵过程中键合态酚酸含量的变化见表1。由表1可知,红枣汁发酵过程中,E-GA、E-PA、E-CGA、E-PHBA和E-CAN的含量整体呈先下降后上升的趋势,而E-PCA的含量呈先上升后下降的趋势,E-CA及E-FA一直未检出。发酵48 h时,E-GA的含量显著增加(P<0.05),E-PA含量显著降低(P<0.05),E-PHBA、E-CGA、E-PCA及E-CNA的含量无显著变化(P>0.05),其中E-CGA含量最高,为15.95 μg/mL。由表1亦可知,红枣汁发酵过程中,G-GA、G-PA、G-FA含量整体呈先下降后上升的趋势,而G-PCA含量变化与之相反;G-CGA、G-PHBA和G-CA含量呈下降趋势;G-CAN一直未检出。发酵48 h时,G-PA的含量显著增加(P<0.05),G-GA、G-PCA和G-FA的含量无显著变化(P>0.05),G-PHBA、G-CGA和G-CA的含量显著减少(P<0.05),其中G-PA含量最高,为82.19 μg/mL。整体上,经植物乳植杆菌发酵后的红枣汁,GPAs总含量显著降低(P<0.05),EPAs总含量无显著变化(P>0.05),8种键合态酚酸总含量显著下降(P<0.05)。LIANG Z J等[23]分别用黑曲霉(Aspergillus niger)、植物乳植杆菌和酿酒酵母(Saccharomyces cerevisiae)对5种常见的酚类化合物(阿魏酸、多苷、花青素-3-O-葡萄糖苷、芦丁、单宁酸)进行发酵,结果表明,发酵过程中酚类化合物中的糖苷键被水解形成GA、PA等酚类代谢物。赖婷等[24]研究发现,桂圆肉经7种不同乳酸菌发酵后结合态单体酚含量显著下降,其中结合态没食子酸在发酵后下降了80%~88.3%,与本研究结果基本一致。因此,乳酸菌发酵过程中会产生多种分解大分子有机物的酶,可将结合态酚酸转化为游离态酚酸,这可能是GPAs减少的原因[25]。
表1 红枣汁发酵过程中键合态酚酸类化合物含量的变化
Table 1 Changes of bonded phenolic acid compounds contents during jujube juice fermentation

注:同行不同小写字母表示差异显著(P<0.05),“ND”表示未检出。E-GA为酯键合态没食子酸,G-EA为糖苷键合态没食子酸。下同。
种类 酚酸类物质含量/(μg·mL-1)0 h 12 h 24 h 36 h 48 h酯键合态酚酸糖苷键合态酚酸E-GA E-PA E-CGA E-PHBA E-CA E-PCA E-FA E-CNA总计G-GA G-PA G-CGA G-PHBA G-CA G-PCA G-FA G-CNA总计总和9.58±0.51bc 5.99±0.08a 14.51±0.15a 5.35±0.14a ND 0.10±0.01ab ND 0.88±0.07a 36.40±0.57a 6.66±0.30a 70.48±5.47b 75.60±0.06a 43.38±3.49a 72.78±1.12a 51.69±2.37ab 3.33±0.20b ND 323.92±5.64a 360.32±5.15a 8.68±0.69c 4.18±0.06b 11.47±0.38b 3.35±0.06b ND 0.12±0.01a ND 0.09±0.01b 27.88±0.14b 4.06±0.09b 67.64±2.36b 68.27±3.59a 30.83±2.74b 54.47±4.71b 59.31±3.21a 2.41±0.24c ND 286.98±0.91b 314.86±0.4b 11.59±0.25a 6.03±0.35a 14.89±0.27a 5.86±0.40a ND 0.10±0.01ab ND 0.09±0.01b 38.55±0.89a 4.86±0.39b 63.44±1.28b 27.64±2.90b 27.35±3.29b 53.22±1.66b 46.63±4.61b 3.82±0.16b ND 226.96±7.25c 265.51±7.74c 10.79±0.23ab 6.14±0.18a 14.49±0.80a 5.21±0.35a ND 0.07±0.01b ND 0.73±0.07a 37.42±1.13a 4.99±0.15b 59.54±1.48b 15.20±0.33c 10.01±1.17c 27.13±0.72c 42.92±0.71b 5.66±0.37a ND 165.44±2.13d 202.86±5.27d 12.05±0.62a 4.71±0.36b 15.95±1.12a 5.11±0.11a ND 0.08±0.01b ND 0.81±0.02a 38.70±1.54a 7.61±0.16a 82.19±0.59a 10.68±0.08c 1.48±0.97c 11.17±0.89c 40.84±0.30b 3.94±0.25b ND 157.9±1.14d 196.6±3.27d
2.2 红枣汁发酵过程中抗氧化能力的变化
红枣汁发酵过程中抗氧化活性的变化见图1。由图1可知,红枣汁发酵过程中DPPH自由基清除率呈先升高后下降的趋势,当发酵12 h时,DPPH自由基清除率最高,显著高于发酵0 h、36 h及48 h组(P<0.05)。然而,红枣汁发酵过程中ABTS自由基清除能力基本无显著性变化(P>0.05)。总抗氧化能力整体呈先升高后下降的趋势,当发酵24 h时最强,但发酵前后总抗氧化能力无显著差异(P>0.05)。胡贝多等[26]采用植物乳植杆菌发酵红枣汁后,ABTS自由基清除能力显著增强;采用瑞士乳杆菌(Lactobacillus helveticus)发酵红枣汁后,总抗氧化能力升高;二者混合发酵红枣汁后,DPPH自由基清除能力显著增强,这与本研究结果存在差异,这种差异性可能与菌株种类、发酵基质、发酵工艺等相关。结合红枣汁发酵过程中酚酸类化合物含量的变化可知,红枣汁发酵12 h时,DPPH自由基清除能力最强,可能是由于G-PCA含量增高促使其将部分PCA转化为抗氧化活性更强的3-丙酸导致的[27]。当发酵至24 h时,总抗氧化能力最强,这可能与E-GA和E-PHBA含量增加有关。高抗氧化活性的酚酸大多存在于GPAs和不溶性酚类物质中,而GPAs含量呈显著降低的状态,可能造成了抗氧化能力变化不明显的现象。
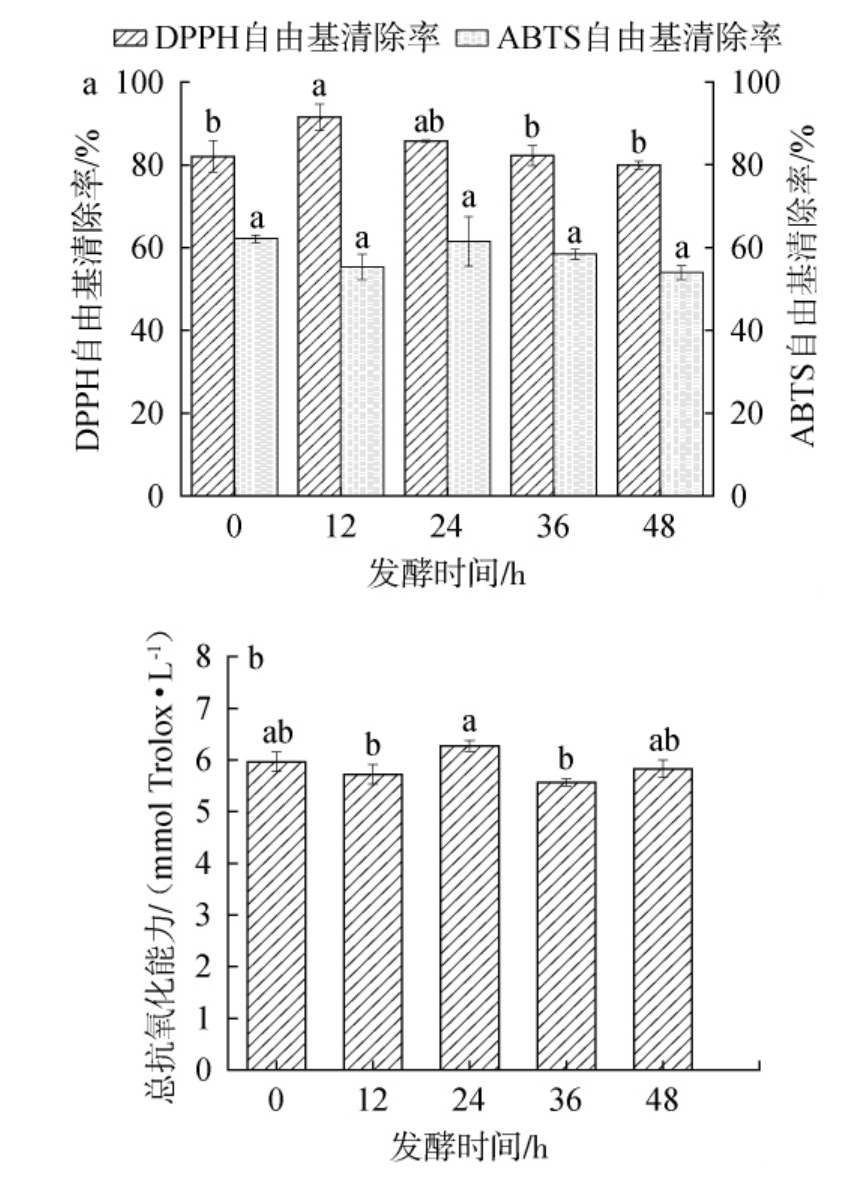
图1 红枣汁发酵过程中抗氧化能力的变化
Fig.1 Changes of antioxidant capacities during jujube juice fermentation
不同小写字母表示差异显著(P<0.05)。
2.3 红枣汁发酵过程中酚酸类化合物的主成分分析
由于植物乳植杆菌发酵红枣汁过程中,键合态酚酸类化合物变化种类较多,为找出主要的酚酸类化合物,对检出的13种键合态酚酸类化合物进行主成分分析,提取特征值>1的主成分,得到4个主成分,结果见表2。
表2 主成分特征值和方差贡献率
Table 2 Principal component eigenvalues and variance contribution rates
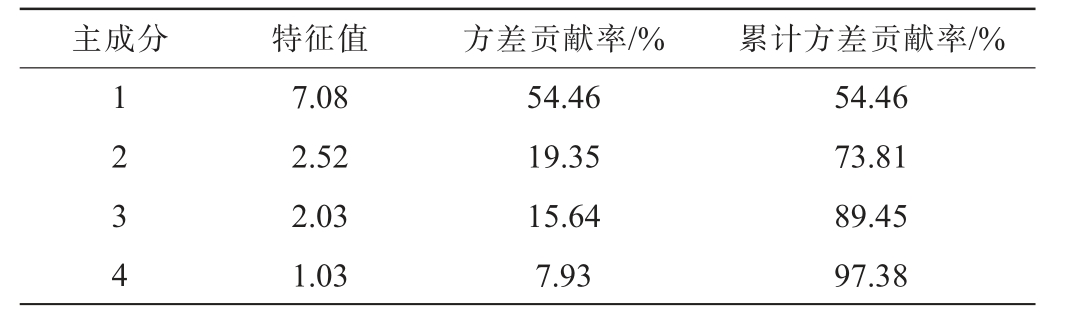
主成分 特征值 方差贡献率/% 累计方差贡献率/%1 2 3 4 7.08 2.52 2.03 1.03 54.46 19.35 15.64 7.93 54.46 73.81 89.45 97.38
由表2可知,主成分1(principal component 1,PC1)的方差贡献率为54.46%,主成分2(PC2)的方差贡献率为19.35%,前两个主成分的累计方差贡献率为73.81%,说明前两个主成分可以反映红枣汁发酵过程中键合态酚酸类化合物变化的绝大部分信息。因此,对PC1和PC2进行载荷分析,结果见图2。由图2可知,与PC1高度正相关的键合态酚酸类化合物有E-GA、E-CGA和G-FA;与PC2高度正相关的键合态酚酸类化合物有E-PA、E-PHBA和G-CA。综上,E-GA、E-CGA、G-FA、G-CA、E-PA和E-PHBA是植物乳植杆菌发酵红枣汁过程中的关键键合态酚酸化合物(贡献较大的键合态酚酸类物质)。因此,将关键键合态酚酸类化合物与发酵红枣汁抗氧化能力进行相关性分析,确定键合态酚酸类化合物含量变化与发酵红枣汁抗氧化能力的相关性。
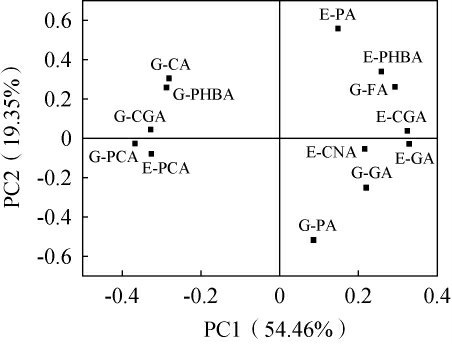
图2 红枣汁发酵过程中13种键合态酚酸类化合物的主成分分析因子载荷图
Fig.2 Principal component analysis factor loading plots of 13 bonded phenolic acid compounds during jujube juice fermentation
2.4 关键键合态酚酸类化合物与抗氧化能力的相关性分析
为明晰红枣汁发酵过程中关键键合态酚酸类化合物含量变化与抗氧化能力之间的关系,对发酵期间红枣汁中筛选出的关键键合态酚酸类化合物与红枣汁抗氧化活性进行相关性分析,结果见图3。由图3可知,红枣汁发酵过程中关键键合态酚酸类化合物含量变化与发酵枣汁抗氧化能力之间存在一定相关性。其中,E-GA、E-CGA、E-PHBA和G-FA与DPPH自由基清除能力呈显著负相关(P<0.01或P<0.05),相关系数分别为-0.64、-0.84、-0.70和-0.61。G-CA与ABTS自由基清除能力呈显著正相关(P<0.05),且相关系数为0.54。E-GA、E-CGA与ABTS自由基清除能力呈显著负相关(P<0.01或P<0.05),相关系数分别为-0.85和-0.65。E-PHBA与总抗氧化能力呈显著正相关(P<0.05),相关系数为0.54。由此可见,红枣汁发酵过程中键合态酚酸含量变化与抗氧化能力之间关系较为复杂,E-PHBA和G-CA贡献最大,E-PHBA和G-CA含量升高分别会引起总抗氧化能力和ABTS自由基清除能力增强。
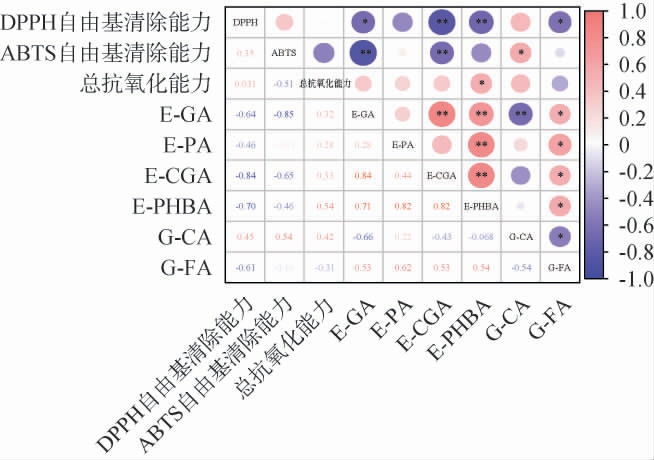
图3 红枣汁发酵过程中关键酚酸类化合物含量变化与抗氧化能力的相关性分析
Fig.3 Correlation analysis of the contents changes of key phenolic acid compounds and antioxidant capacities during jujube juice fermentation
“*”表示显著相关(P<0.05),“**”表示极显著相关(P<0.01)。
3 结论
当植物乳植杆菌发酵红枣汁48 h后,GPAs总量显著降低(P<0.05),EPAs总量无显著变化(P>0.05)。其中,酯键合态没食子酸含量显著升高(P<0.05),酯键合态原儿茶酸显著降低(P<0.05);糖苷键合态原儿茶酸含量显著升高(P<0.05),糖苷键合态绿原酸、对羟基苯甲酸和咖啡酸含量显著下降(P<0.05)。糖苷键合态咖啡酸、酯键合态对羟基苯甲酸分别与ABTS自由基清除能力、总抗氧化能力呈显著正相关(P<0.05)。由此可见,发酵红枣汁中糖苷键合态酚酸物质的生物转化、代谢降解与红枣汁功能特性的制约关系将可能是未来的研究方向。
[1]LAFAY S, GIL-LZQUIERDO A.Bioavailability of phenolic acids[J].Phytochem Rev,2008,7(2):301-311.
[2]高媛,马帅,代敏,等.果蔬酚酸生物合成及代谢调控研究进展[J].食品科学,2018,39(9):286-293.
[3]PEREZ-JIMENEZ J,LLUIS TORRES J.Analysis of nonextractable phenolic compounds in foods: The current state of the art[J].J Agr Food Chem,2011,59(24):12713-12724.
[4]王毕妮.红枣多酚的种类及抗氧化活性研究[D].杨凌:西北农林科技大学,2012.
[5]邢晨,王俐娟,王晓琴.可食用植物不同形态酚类化合物研究进展[J].食品科学,2020,41(5):266-275.
[6]吕兆林,袁玮琼,张柏林,等.沙棘果实中主要活性成分质量分布[J].北京林业大学学报,2021,43(1):144-152.
[7]韩雅盟.不同加工方式对藜麦酚类物质及其抗氧化活性的影响[D].太原:山西大学,2019
[8]丁胜华,王蓉蓉,吴继红,等.枣果实中生物活性成分与生物活性的研究进展[J].现代食品科技,2016,32(5):332-348,321.
[9]韩雪,王毕妮,张富新,等.不同乳酸菌发酵对红枣浆游离态酚酸及其抗氧化性的影响[J].食品与发酵工业,2018,44(3):121-127.
[10]WANG B N,LIU H F,ZHENG J B,et al.Distribution of phenolic acids in different tissues of jujube and their antioxidant activity[J].J Agr Food Chem,2011,59(4):1288-1292.
[11]刘原野,蔡文超,张琴,等.乳酸菌对沙棘汁中酚酸及挥发性化合物的影响研究[J].食品与发酵工业,2022,48(11):156-161.
[12]孙百虎.不同乳酸菌对发酵桑葚汁酚类物质含量及抗氧化能力的影响[J].中国酿造,2022,41(1):92-97.
[13]PAN X,LI J,LAO F,et al.Phenolic characterization of fermented jujube puree by HPLC-MS/MS and their release during in vitro dynamic digestion[J].Food Chem,2023,413:135630.
[14]张江宁,叶峥,杨春.在红枣汁中乳酸菌、酵母菌单一及偶联发酵特征物质差异分析[J].现代食品科技,2024,40(5):64-72.
[15]张丽华,刘世豪,靳学远,等.不同处理对发酵红枣汁键合态香气释放的影响[J].精细化工,2023,40(12):2714-2722.
[16]LI T L, JIANG T, LIU N, et al.Biotransformation of phenolic profiles and improvement of antioxidant capacities in jujube juice by select lactic acid bacteria[J].Food Chem,2021,339:127859.
[17]XU G H,YE X Q,LIU D H,et al.Composition and distribution of phenolic acids in Ponkan (Citrus poonensis Hort.ex Tanaka) and Huyou (Citrus paradisi Macf. Changshanhuyou) during maturity[J].J Food Compos Anal,2008,21:382-389.
[18]TIAN R R, PAN Q H, ZHAN J C, et al.Comparison of phenolic acids and flavan-3-ols during wine fermentation of grapes with different harvest times[J].Molecules,2009,14(2):827-838.
[19]魏肖鹏.脱落酸调控猕猴桃果实损伤木栓化的作用机理[D].杭州:浙江大学,2022.
[20]张素芳,肖安风,杨远帆,等.柚苷酶处理对琯溪蜜柚果汁抗氧化活性的影响[J].中国食品学报,2016,16(9):60-67.
[21]肖默艳,黄燕芬,王东伟,等.红心火龙果果肉中活性成分与其抗氧化能力的相关性研究[J].食品工业科技,2020,41(11):98-103,133.
[22]ZHAO X X,TANG F X,CAI W C,et al.Effect of fermentation by lactic acid bacteria on the phenolic composition,antioxidant activity,and flavor substances of jujube-wolfberry composite juice[J].LWT-Food Sci Technol,2023,184:114884.
[23]LIANG Z J,HUANG Y Z,ZHANG P Z,et al.Impact of fermentation on the structure and antioxidant activity of selective phenolic compounds[J].Food Biosci,2023,56:103147.
[24]赖婷,刘磊,张名位,等.不同乳酸菌发酵对桂圆肉中酚类物质及抗氧化活性的影响[J].中国农业科学,2016,49(10):1979-1989.
[25]杨艳,杨荣玲,邹宇晓,等.肠道微生物菌群生物转化天然多酚类化合物研究进展[J].食品科学,2014,35(17):319-325.
[26]胡贝多,刘鑫磊,战相君,等.益生菌发酵对红枣汁抗氧化活性、营养品质及香气的影响[J].中国酿造,2020,39(2):44-50.
[27]GAO H,WEN J J,HU J L,et al.Momordica charantia juice with Lactobacillusplantarumfermentation:Chemicalcomposition,antioxidantproperties and aroma profile[J].Food Biosci,2019,29:62-72.