中国白酒历史悠久,包括十二种香型,其中酱香型白酒是四大基本香型白酒之一,其以“酱味突出、优雅细腻、柔和醇厚、回味悠长”的独特风味深受消费者喜爱[1]。酱香型白酒生产工艺较为独特,一年为1个完整的生产周期,含2次投粮、9次蒸煮、8次发酵、7次取酒,即为“12987”工艺[2],其中堆积发酵是酱香型白酒生产中必不可少的关键工艺环节[3],主要起到网罗环境中的微生物、生成重要酱香风味化合物或前体物质以及糖化发酵作用[4],直接影响酱香型白酒的质量和产量[5]。而造沙阶段在整个酱香型白酒生产工艺中起到“承上启下”的关键作用,因此,探究造沙轮次堆积发酵过程中微生物多样性及演变规律,对稳定酱香型白酒品质具有重要意义。
特征风味物质是影响白酒质量的关键,追溯发酵过程,复杂的微生物通过各自的代谢作用改变发酵体系的环境,微生物菌群结构的动态演替影响物质代谢,从而影响发酵食品的特征风味。近几年关于堆积发酵过程中微生物与风味物质的研究受到广泛关注[6],陈卓等[7]对洞酿酱香型白酒第三轮次酒醅进行研究,发现曲霉属(Aspergillus)与大多数酯类物质呈极显著正相关(P<0.01),普赖斯酵母属(Priceomyces)和乳酸杆菌属(Lactobacillus)与十七烷酸乙酯呈极显著正相关(P<0.01)。林彩霞等[8]对洞酿酱香型白酒第五轮次酒醅进行研究发现,克罗彭斯特菌属(Kroppenstedtia)、红曲霉属(Monascus)、芽孢杆菌属(Bacillus)与接合酵母菌属(Zygosaccharomyces)对风味物质具有显著影响。吴成等[9]对酱香型白酒4轮次堆积酒醅进行研究发现,酵母菌主要与醇类物质如丙醇、异丁醇、异戊醇、β-苯乙醇等呈显著正相关(P<0.05),而丝状真菌和细菌主要与酸类和酯类物质如乙酸、丙酸、异丁酸、乳酸乙酯、油酸乙酯、己酸丁酯等呈显著正相关(P<0.05)。由此可见,阐明传统发酵食品中微生物多样性及其演替规律,发现其与风味形成的相关性,有利于提升由复杂菌群发酵的传统食品的安全及品质。
本研究以酱香型白酒造沙轮次堆积发酵酒醅为研究对象,采用宏基因组测序技术分析酒醅中微生物群落结构组成及多样性,同时采用顶空固相微萃取-气相色谱-质谱(headspace solid-phase microextraction-gas chromatographymass spectrometry,HS-SPME-GC-MS)技术检测酒醅中挥发性风味物质,探究微生物群落组成与挥发性风味物质之间的相关性,以期为进一步研究酱香型白酒堆积发酵机理提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
堆积发酵酒醅:取自贵州省茅台镇某制酒车间。取样方法[10]:造沙阶段堆积发酵完成收堆时记为发酵0 h,间隔24 h采集堆积发酵酒醅样品一次,取样位置为堆积酒醅上(离顶点约30 cm)、中(堆积酒醅高度1/2处)、下(外层酒醅往内深入约30 cm),并将上、中、下层取得酒醅分别编号1、2、3,取这三个位置堆积发酵第24小时、第48小时、第72小时酒醅样品共9个,每个点采集约500 g,依次编号为ZSF-1、ZSF-2、ZSF-3、ZSS-1、ZSS-2、ZSS-3、ZST-1、ZST-2、ZST-3,其中ZSF表示造沙堆积发酵第一天,ZSS为造沙堆积发酵第二天,ZST表示造沙堆积发酵第三天。
1.1.2 试剂
CretMagTM Power Soil Kit基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)抽提试剂盒、全能型DNA建库试剂盒:美国Omega Bio-Tek公司;NEXTflexTM Rapid DNASeqKitDNA建库试剂盒:美国BiooScientific公司;双链DNA(double-stranded DNA,dsDNA)荧光定量检测试剂盒:美国赛默飞世尔公司;DNA分选磁珠:翊圣生物科技(香港)有限公司;氯化钠(分析纯):国药集团化学试剂有限公司;正己烷(分析纯):德国Merck公司;3-己酮标准品(纯度>98%):美国Sigma-Aldrich公司。
1.2 仪器与设备
covaris M220非接触式超声破碎仪:美国Covaris公司;Qubit4.0荧光定量仪:美国Thermo Fisher公司;XH-1微型漩涡混合仪:上海沪西分析仪器厂有限公司;Agilent 2100生物分析仪、8890-7000D GC-MS、DB-5MS毛细管色谱柱(30m×0.25mm×0.25μm)、DVB/CWR/PDMS萃取头(120μm):美国Agilent公司;Illumina NovaSeq高通量测序平台:美国Illumina公司。
1.3 方法
1.3.1 造沙轮次堆积发酵酒醅微生物群落分析
DNA提取、PCR扩增与宏基因组测序:称取0.5 g的酒醅,利用CretMagTM Power Soil DNA Kit试剂盒提取样品中微生物宏基因组DNA。PCR扩增条件为:95 ℃预变性3 min;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,共25 次循环;72 ℃稳定延伸5 min降至4 ℃。分别利用TBS-380、NanoDrop 200、1%琼脂糖凝胶电泳检测DNA的浓度、纯度及完整性。通过超声破碎仪将DNA片段化,筛选约400 bp的片段,使用NEXTflexTM Rapid DNA-Seq试剂盒构建Pair-end文库。将检测合格的产物委托武汉百奥维凡生物科技有限公司采用Illumina NovaSeq测序平台进行宏基因组测序。
生物信息学分析:基于QIME分析平台对序列进行校准对齐,根据97%相似度划分操作分类单元(operational taxonomic unit,OTU),使用Diamond v0.8.35(http://www.diamondsearch.org/index.php)将非冗余基因集的氨基酸序列与非冗余数据库(non-redundant database,NR)进行比对,基于细菌Greengenes数据库[11]和真菌UNITE数据库[12]分别对样品细菌和真菌OTU代表序列进行物种分类学注释,然后使用物种对应的基因丰度总和计算该物种的丰度,并计算相同测序深度下微生物的α多样性指数,包括超1(Chao1)指数、香农(Shannon)指数和辛普森(Simpson)指数。
1.3.2 挥发性风味物质检测
样品前处理:从-80 ℃冰箱中取出样品进行液氮研磨,涡旋混合均匀,每个样本称取约500 mg(液体1 mL)于顶空瓶中,分别加入2 mL饱和NaCl溶液,20 μL质量浓度为10 μg/mL的内标(3-己酮)溶液,全自动顶空固相微萃取系统进行样本萃取,以供GC-MS分析。
气相色谱条件:采用DB-5MS毛细管色谱柱(30 m×0.25 mm×0.25 μm),载气为高纯氦气(He)(纯度≥99.999%),恒流流速1.2 mL/min,进样口温度250 ℃,不分流进样,溶剂延迟3.5 min。程序升温:40 ℃保持3.5 min,以10 ℃/min升至100 ℃,再以7 ℃/min 升至180 ℃,最后以25 ℃/min升至280℃,保持5 min。
质谱条件:电子电离(electron ionization,EI)源,离子源温度230 ℃,四级杆温度150 ℃,接口温度280 ℃,电子能量70 eV,扫描方式为选择离子监测(selective ion monitoring,SIM)模式,定性定量离子参考GB 23200.8—2016《食品安全国家标准水果和蔬菜中500种农药及相关化学品残留量的测定气相色谱-质谱法》。
定性定量分析:通过查询美国国家标准与技术研究院(national institute of standards and technology,NIST)数据库确定待测物的保留时间,再结合文献报道对挥发性风味物质定性。选择一种同位素为内标,计算其相对含量,计算公式如下[13]:
式中:Xi为待测样品中化合物的含量,μg/g;Vs为内标物体积,μL;Cs为内标物质量浓度,μg/mL;M为待测样品质量,g;Is为内标物峰面积;Ii为待测样品中化合物的峰面积。
1.3.3 数据处理
使用R语言中Vegan计算α多样性指数,ggplot2绘制箱线图和物种组成柱状图,使用heatmap软件绘制物种分布热图,使用ggVennDiagram软件绘制韦恩图,采用Cytoscape v3.9.1软件构建微生物和代谢物相关性网络。
2 结果与分析
2.1 酱香型白酒造沙轮次堆积发酵酒醅微生物多样性分析
2.1.1 微生物测序结果
韦恩图能够直观展示不同样品间共有和独有的OTU[14]。造沙轮次堆积发酵酒醅第一天(ZSF)、第二天(ZSS)和第三天(ZST)在细菌和真菌群落上的差异见图1。由图1(a)可知,三个组共有的细菌OTU为1 840个。堆积发酵第一天酒醅中独有的细菌OTU最多(203个),堆积发酵第二天和第三天酒醅中独有细菌OTU数量相对较少,分别为55个和53个。由图1(b)可知,三个组共有的真菌OTU为653个,堆积发酵第一天酒醅中独有的真菌OTU最多(28个),堆积发酵第二天和第三天酒醅中独有真菌OTU较少,分别为14个和6个。
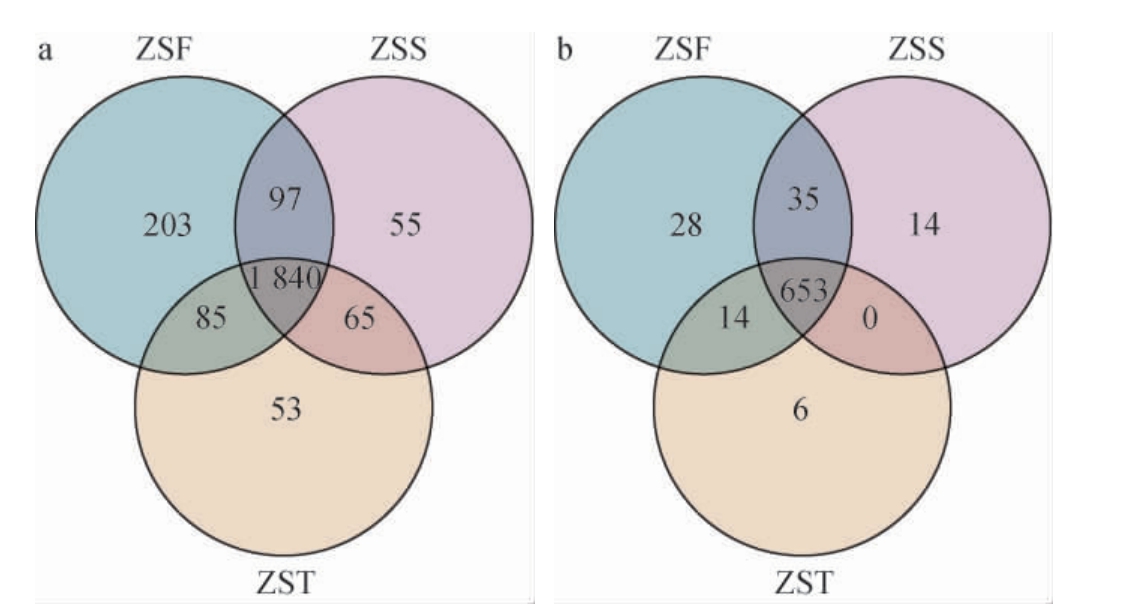
图1 酱香型白酒造沙轮次堆积发酵酒醅中细菌(a)和真菌(b)操作分类单元韦恩图
Fig.1 Venn diagram of the operational taxonomic unit of bacteria (a)and fungi (b) in the fermented grains during the stacking fermentation of Zaosha round of the sauce-flavor Baijiu
2.1.2 微生物群落Alpha多样性分析
Alpha多样性反映了生境内物种丰富度和多样性,包括Chao1指数、Shannon指数和Simpson指数。Chao1指数越大,表明物种丰富度越高;Shannon指数越大,Simpson指数值越小,表明物种多样性、均匀度越高[15]。酱香型白酒造沙轮次堆积发酵酒醅中微生物群落Alpha多样性分析结果见图2。
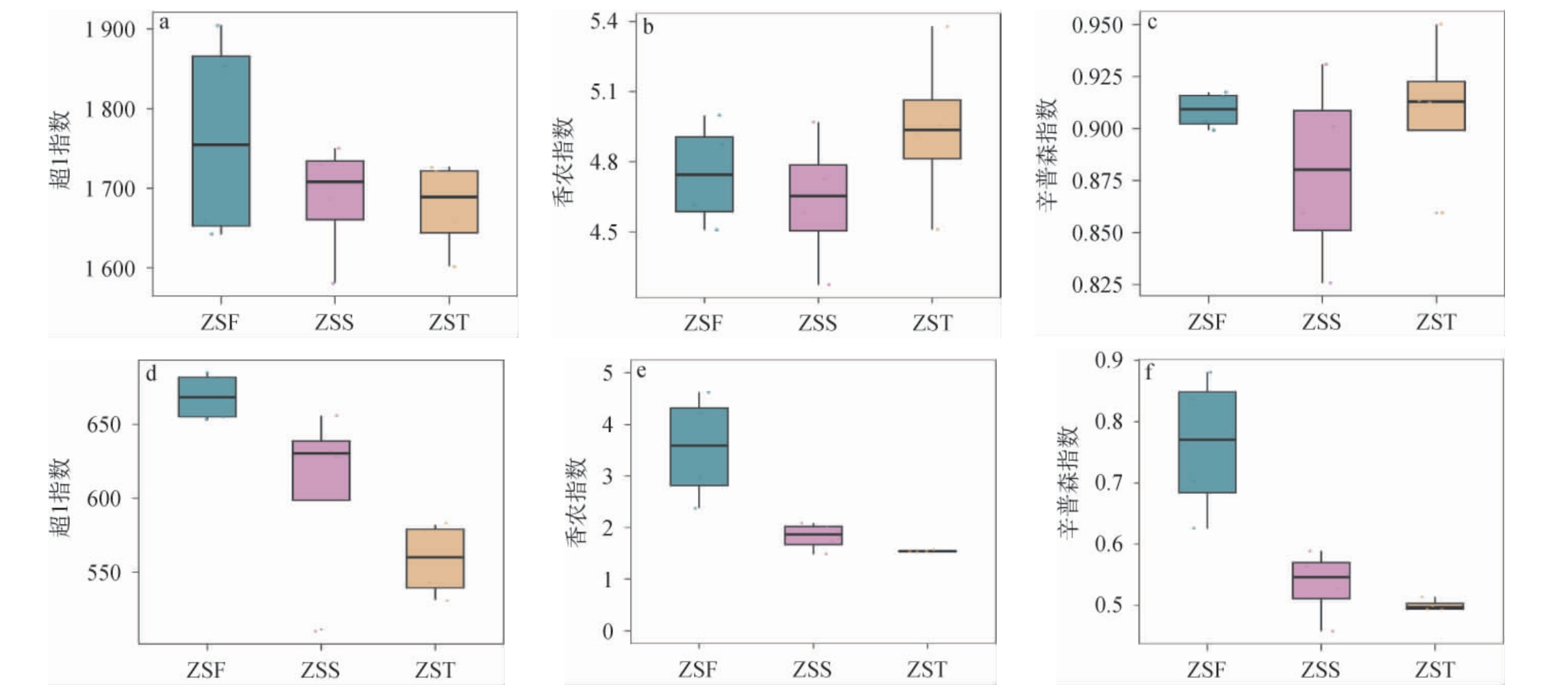
图2 酱香型白酒造沙轮次堆积发酵酒醅中细菌(a,b,c)和真菌(d,e,f)群落α多样性分析结果
Fig.2 Analysis results of α-diversity of bacterial (a, b, c) and fungal (d, e, f) communities in the fermented grains during the stacking fermentation of Zaosha round of the sauce-flavor Baijiu
由图2(a,b,c)可知,随着堆积发酵时间的增加,三组酒醅样品细菌的超1指数均呈下降趋势,ZSF组的Chao1指数最高,说明其物种丰富度最高,相反,ZST组的细菌物种丰富度最低,可能是因为在堆积发酵过程中微生物代谢不断产生热量,致使发酵后期温度不断升高,甚至超过50 ℃,从而造成细菌的酶系统失活,细胞结构受损,导致大量死亡[16]。Shannon指数和Simpson指数则进一步展示了物种的多样性和均匀性,随着堆积发酵时间的增加,三组酒醅样品细菌的Shannon指数、Simpson指数均呈先下降后上升的趋势,ZST组最高,说明其细菌群落的多样性和均匀度最高。其次是ZSF组,表明其细菌群落不仅丰富,且物种间分布较为均匀。
由图2(d,e,f)可知,随着堆积发酵时间的增加,三组酒醅样品真菌的Chao1指数、Shannon指数和Simpson指数均呈下降趋势。ZSF组最高,表明其真菌种类丰富,物种多样性较高。相反,ZST组的真菌群落则表现出最低的物种丰富度和多样性,这与吴成等[9,17]研究结果一致。以上结果表明,不同堆积时间酒醅中细菌和真菌丰富度和多样性存在明显差异,这可能与不同堆积时间发酵环境的温度、酸度等因素有关[8]。
2.1.3 微生物群落Beta多样性分析
为了分析不同堆积发酵时间酒醅微生物群落结构组成差异,对不同堆积时间酒醅中细菌和真菌进行主坐标分析(principal coordinate analysis,PCoA),结果见图3。
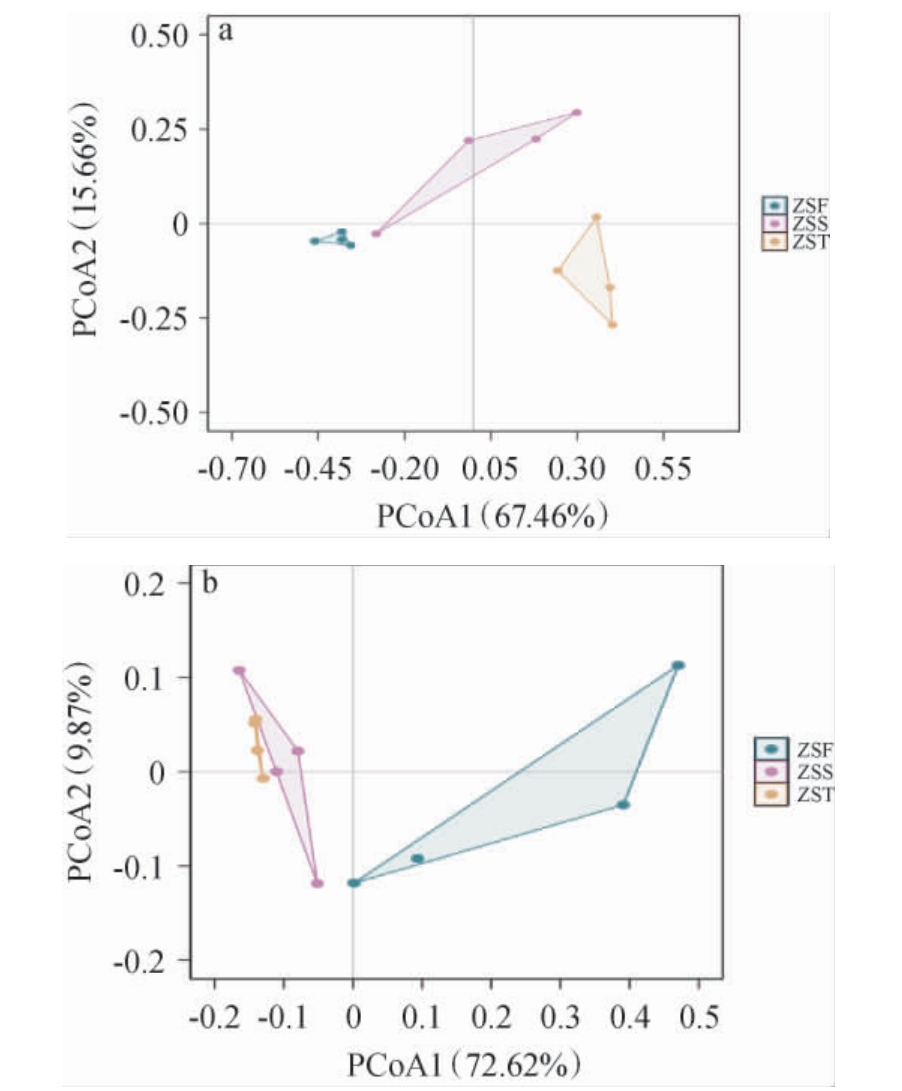
图3 酱香型白酒造沙轮次堆积发酵酒醅中细菌(a)和真菌(b)群落主坐标分析结果
Fig.3 Results of principal coordinate analysis of bacterial (a) and fungal (b) communities in the fermented grains during the stacking fermentation of Zaosha round of the sauce-flavor Baijiu
由图3(a)可知,PCoA1解释了67.46%的变异,PCoA2解释了15.66%的变异,共解释了83.12%的细菌群落变异量。ZSF组细菌群落在PCoA1和PCoA2维度上相对集中,表明堆积发酵第一天细菌群落结构较为相似且稳定。相反,ZSS组和ZST组细菌群落更为分散,在PCoA1上明显与ZSF组分离,并且在PCoA2维度上也相距较远,表明这两组细菌群落结构具有差异。
由图3(b)可知,PCoA1解释了72.62%的变异,PCoA2解释了9.87%的变异,共解释了82.49%的变异。ZSF组、ZSS组和ZST组在真菌群落的PCoA1维度上均呈现明显的分离,其中,ZSF组真菌群落在PCoA1和PCoA2维度上比较分散,说明堆积发酵第一天的真菌群落结构稳定性较差。ZSS组和ZST组的真菌群落在PCoA1维度上靠近,表明其真菌群落结构更为相似。
2.1.4 酱香型白酒造沙轮次堆积发酵酒醅样品微生物群落结构分析
(1)微生物菌群归类分析
基于细菌Greengenes数据库[10]和真菌UNITE数据库[11]分别对三组样品细菌和真菌OTU代表序列进行物种分类学注释,结果见表1。由表1可知,除属水平外,三组样品在其他水平上所呈现的物种差异性不大。在属水平上,各组细菌属数量顺序依次为ZSF(561个)>ZST(498个)>ZSS(491个),真菌属数量顺序依次为ZSF(362个)>ZSS(347个)>ZST(338个),表明ZSF组在微生物的多样性上具有显著优势,ZSS组和ZST组的多样性相对接近。可能是因为堆积发酵第一天微生物主要来源于酒曲、环境等,发酵后期为开放式的自然发酵,环境因素如温度、水分、酸度会直接影响酒醅微生物群落组成和丰度[18-19],因此不同堆积发酵时间酒醅中微生物群落结构差异较大。
表1 酱香型白酒造沙轮次堆积发酵酒醅中微生物菌群归类分析结果
Table 1 Classification analysis results of microbial flora of the fermented grains during the stacking fermentation of Zaosha round of the sauce-flavor Baijiu
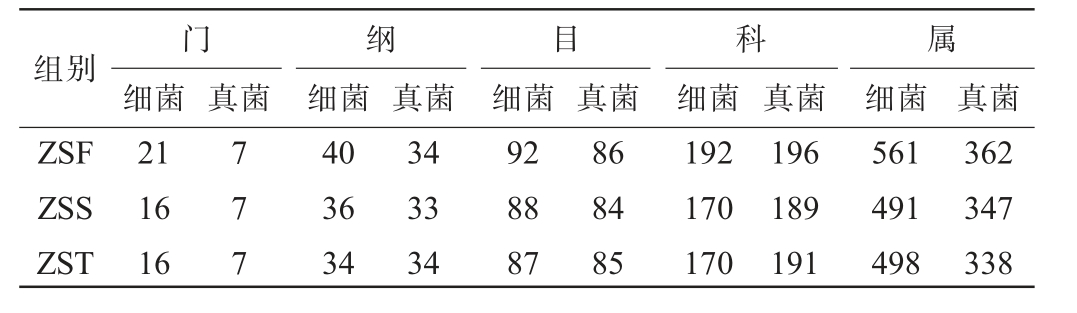
组别ZSF ZSS ZST门纲目科属细菌真菌 真菌 真菌 真菌细菌细菌细菌细菌 真菌21 16 16 777 40 36 34 34 33 34 92 88 87 86 84 85 192 170 170 196 189 191 561 491 498 362 347 338
(2)基于门水平酱香型白酒造沙轮次堆积发酵酒醅样品微生物群落结构组成
由图4(a)可知,在门水平下,ZSF组、ZSS组、ZST组酒醅中优势细菌门均为芽孢杆菌门(Bacillota),相对丰度分别为74.3%、89.2%、93.6%。此外,堆积发酵第一天酒醅中有较多的假单胞菌门(Pseudomonadota)、放线菌门(Actinomycetota),在随后两天中大量减少。由图4(b)可知,ZSF组、ZSS组、ZST组酒醅中优势真菌门均为子囊菌门(Ascomycota),相对丰度分别为94.5%、98.2%、98.8%。ZSF组和ZSS组中可以观察到少量的担子菌门(Basidiomycota)和毛霉门(Mucoromycota)。Mucoromycota一般从阴暗、潮湿、低温环境中产生,多为感染菌[20]。ZST组中,Ascomycota的相对丰度进一步增加,其他真菌门几乎完全消失。综上,Bacillota和Ascomycota是堆积发酵酒醅中的优势细菌门和真菌门,这与张春林等[17]研究结果基本一致。
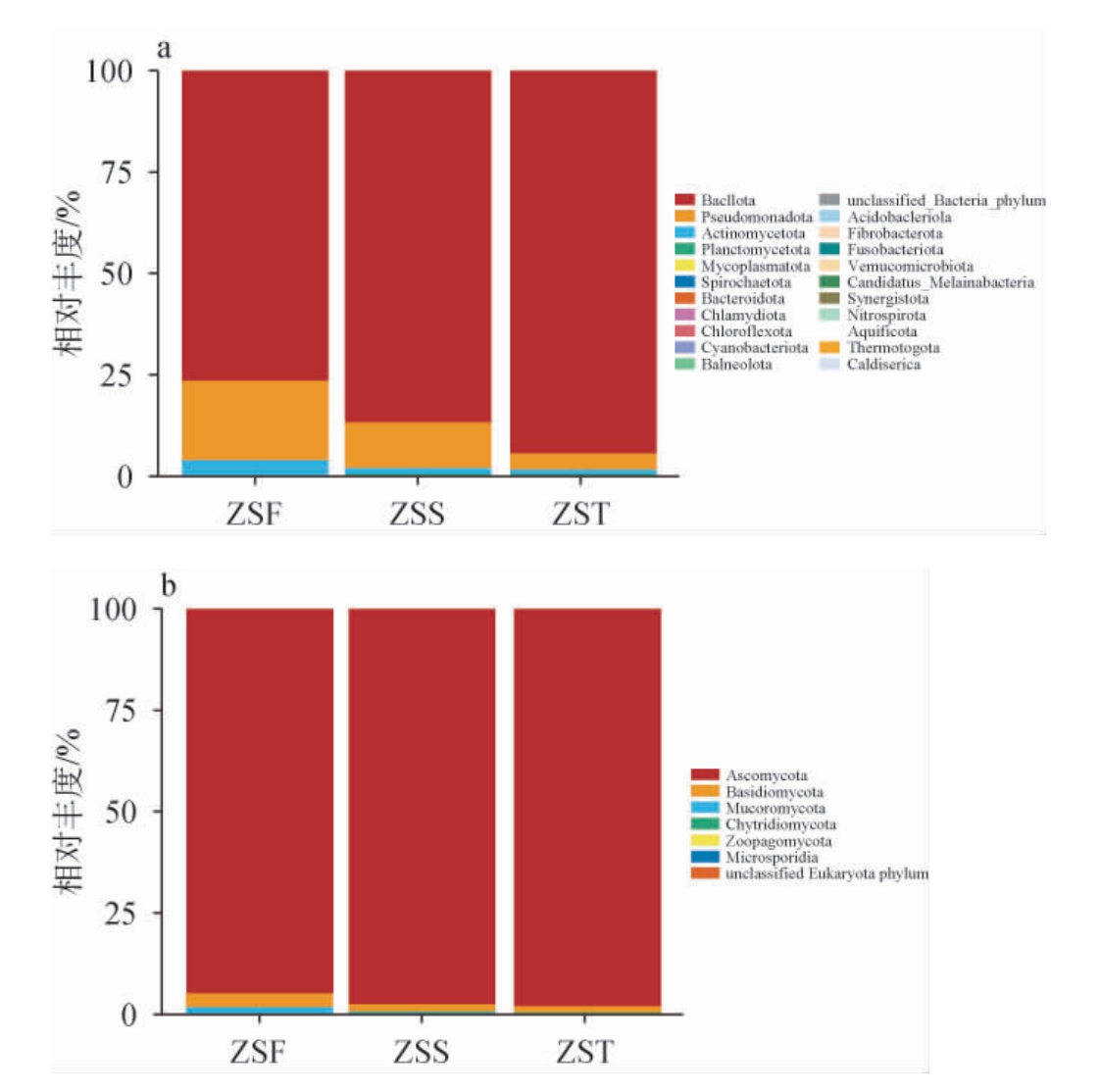
图4 基于门水平酱香型白酒造沙轮次堆积发酵酒醅中细菌(a)及真菌(b)群落结构组成
Fig.4 Community structure composition of bacteria (a) and fungi (b)of the fermented grains during the stacking fermentation of Zaosha round of the sauce-flavor Baijiu at the phylum level
(3)基于属水平酱香型白酒造沙轮次堆积发酵酒醅样品微生物群落结构组成
在属水平下,相对丰度前20的细菌和真菌群落结构组成见图5。
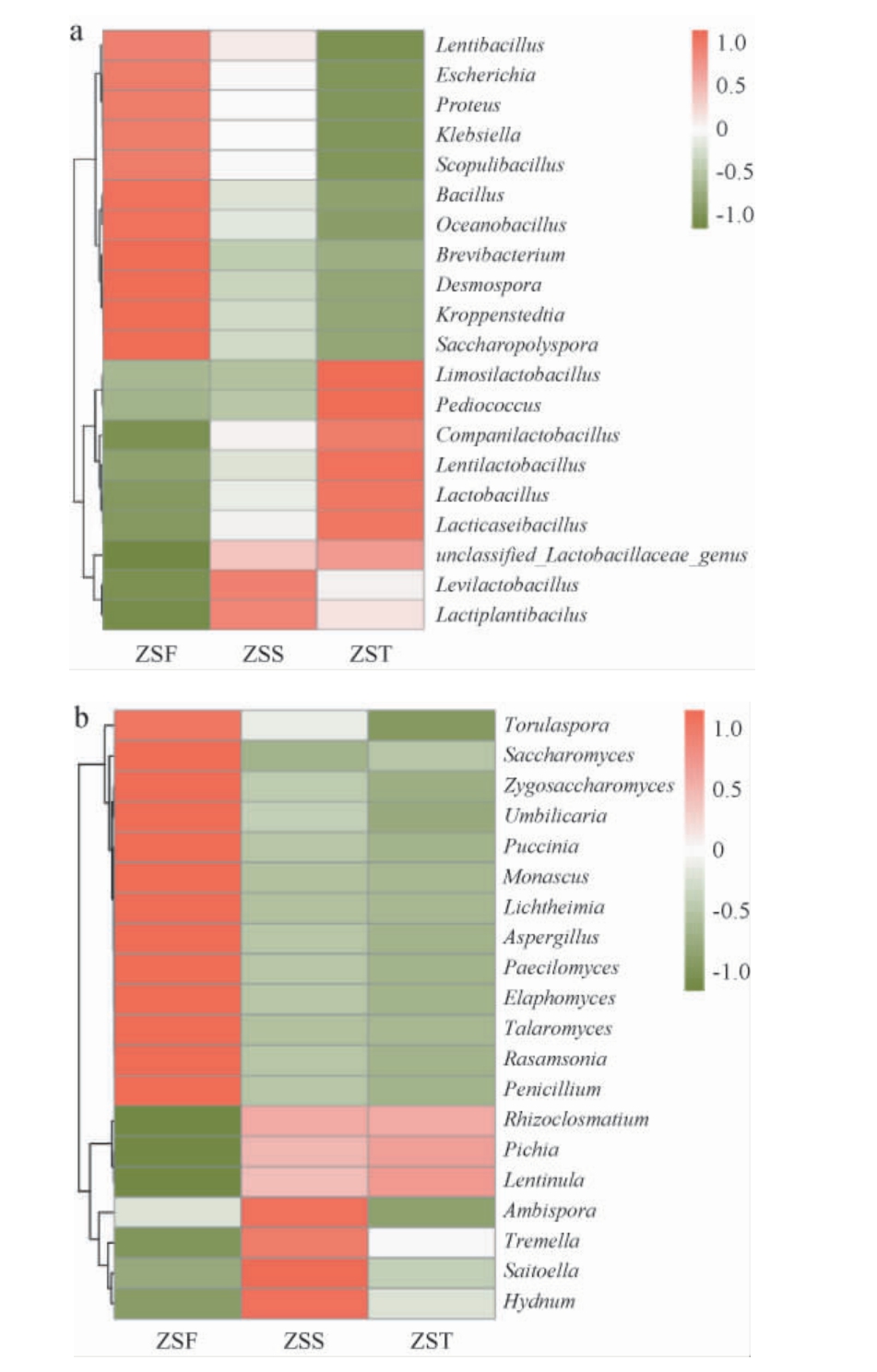
图5 基于属水平酱香型白酒造沙轮次堆积发酵酒醅中相对丰度top20的细菌(a)和真菌(b)群落结构组成
Fig.5 Community structure composition of the top 20 bacteria (a)and fungi(b)of the fermented grains during the stacking fermentation of Zaosha round of the sauce-flavor Baijiu at the genus level
由图5(a)可知,ZSF组主要优势细菌属为芽孢杆菌属(Bacillus)(23.3%)、克罗彭斯特菌属(Kroppenstedtia)(19.5%)、大洋芽孢杆菌属(Oceanobacillus)(18.2%)等;ZSS组主要优势细菌属为发酵剂乳杆菌属(Levilactobacillus)(21.5%)、乳植杆菌属(Lactiplantibacillus)(18.1%)、unclassified-Lactobacillaceae-genus(7.8%)等;ZST组主要优势细菌属为黏液乳杆菌属(Limosilactobacillus)(24.1%)、片球菌属(Pediococcus)(23.6%)、Levilactobacillus(21.6%)等。研究结果显示堆积发酵第二天开始大量产生乳酸菌,这是由于堆积发酵属于开放式发酵,为乳酸菌的引入和生长提供了完美的条件,并且白酒生产需要适量的乳酸菌,否则无乳酸及其酯类,就无法形成白酒风味[20]。细菌属的丰度变化规律与吴成等[9,17,21]研究结果基本一致。
由图5(b)可知,ZSF组主要优势真菌属有酵母菌属(Saccharomyces)(28.0%)、曲霉属(Aspergillus)(27.3%)、罗萨氏菌属(Rasamsonia)(25.9%)、拟青霉属(Paecilomyces)(25.6%)等,它们在堆积发酵第一天中相对丰度较高,但在随后两天相对丰度大幅下降。ZSS组主要优势真菌属为斋藤氏酵母属(Saitoella)(23.2%)、双型囊霉属(Ambispora)(22.4%)、齿菌属(Hydnum)(21.1%)等;ZST组主要优势真菌属为香菇属(Lentinula)(17.6%)、毕赤酵母属(Pichia)(15.9%)、球囊菌属(Rhizoclosmatium)(13.5%)等。
2.1.5 酱香型白酒造沙轮次堆积发酵酒醅微生物差异分析
线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)是指通过LEfSe软件计算组间物种的相对丰度,获得具有代表性且差异显著的物种,常用于筛选微生物群落的生物标记物[22]。基于LEfSe阈值>2确定本研究中三组样品微生物群落的差异物种,结果见图6。
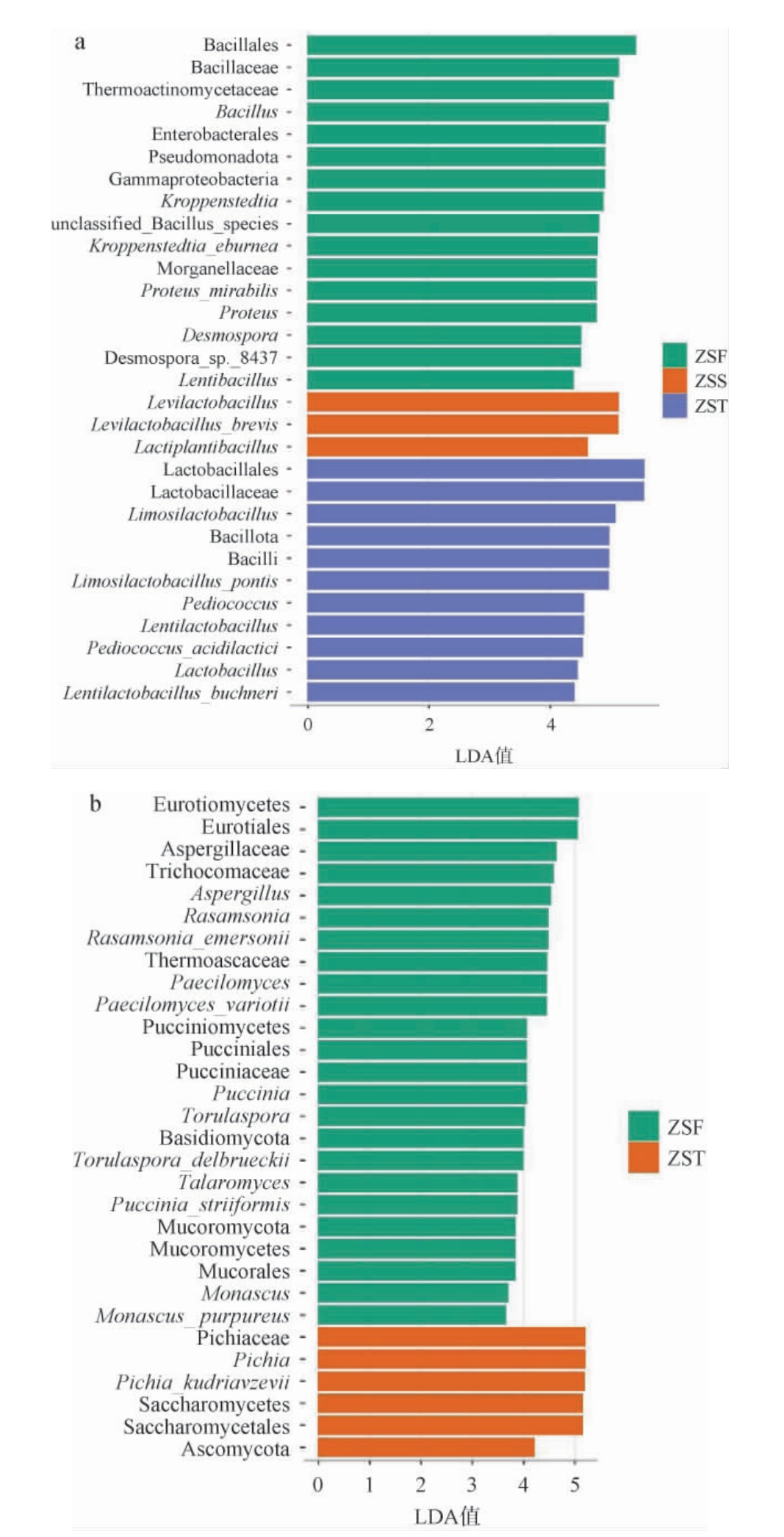
图6 酱香型白酒造沙轮次堆积发酵酒醅中细菌(a)和真菌(b)群落差异分析
Fig.6 Differential analysis of bacterial (a) and fungal (b) communities of the fermented grains during the stacking fermentation of Zaosha round of the sauce-flavor Baijiu
由图6(a)可知,细菌群落中筛选得到ZSF组主要差异细菌为芽孢杆菌目(Bacillales)、芽孢杆菌科(Bacillaceae),这些类群多为环境中常见的微生物;ZSS组主要差异细菌为发酵剂乳杆菌属(Levilactobacillus)、乳植杆菌属(Lactiplantibacillus),这表明乳酸菌群在堆积发酵第二天开始富集;ZST组主要差异细菌为乳酸杆菌目(Lactobacillales),乳杆菌科(Lactobacillaceae)、粘液乳杆菌属(Limosilactobacillus),这些菌的产生可能与发酵酒醅中酸度和温度逐渐升高有关。
由图6(b)可知,真菌群落中筛选得到ZSF组主要差异真菌为散囊菌纲(Eurotiomycetes)、散囊菌目(Eurotiales)等,这些真菌可能来源于酱香大曲;ZSS组没有显著富集的优势真菌属(LEfSe阈值<2),可能原因是这一阶段发酵环境中酸度增加,氧气消耗大,部分好氧、常温真菌不耐受环境逐渐死亡,而下一阶段优势菌群尚未形成[6];ZST组主要差异真菌为毕赤酵母科(Pichiaceae)、毕赤酵母属(Pichia)、库德里阿兹威毕赤酵母(Pichiakudriavzevill)、酵母纲(Saccharomycetes)等。这些真菌属于耐高温酵母菌,是酒醅发酵过程中产醇和酯的功能菌[23]。
2.2 酱香型白酒造沙轮次堆积发酵酒醅中挥发性风味物质分析
通过HS-SPME-GC-MS检测酱香型白酒造沙轮次堆积发酵酒醅中挥发性风味物质,结果表明,共检测到挥发性风味物质1 380种,包括157种酮类、74种醛类、115种醇类、155种杂环化合物、48种胺类、249种萜类、285种酯类、65种酚类、28种芳烃类、67种烃类、80种酸类、30种醚类、16种含氮化合物、4种含硫化合物和7种卤代烃。酯类化合物相对含量最高(20.5%),其次是萜类物质(17.9%),然后是羰基类化合物(16.5%)及杂环类化合物(11.1%),与张春林等[17]研究结果相比,本研究发酵酒醅中有较多萜类物质和杂环化合物。
酒醅样品中相对丰度top50的挥发性风味物质热图见图7。颜色由红到蓝表示代谢物在不同组中的丰度梯度,其中红色表示高丰度,蓝色表示低丰度。由图7可知,ZSF组主要富集醛类、酯类物质,如3-甲基戊醛、2,2-二甲基丁醛、十六酸乙酯等。ZSS组主要富集吡嗪类物质,包括四甲基吡嗪、3-乙基-2,5-二甲基吡嗪、2-乙基-3,5-二甲基吡嗪、2,6-二乙基吡嗪等,吡嗪类物质为酱香型白酒带来焦香或坚果香[24]。ZST组主要富集醛类、酯类、醇类物质,如(E)-4-4壬烯醛、2,6,6-三甲基-2-环己烯-1-1甲醛,2-羟基丙酸乙酯,2-茨醇等。
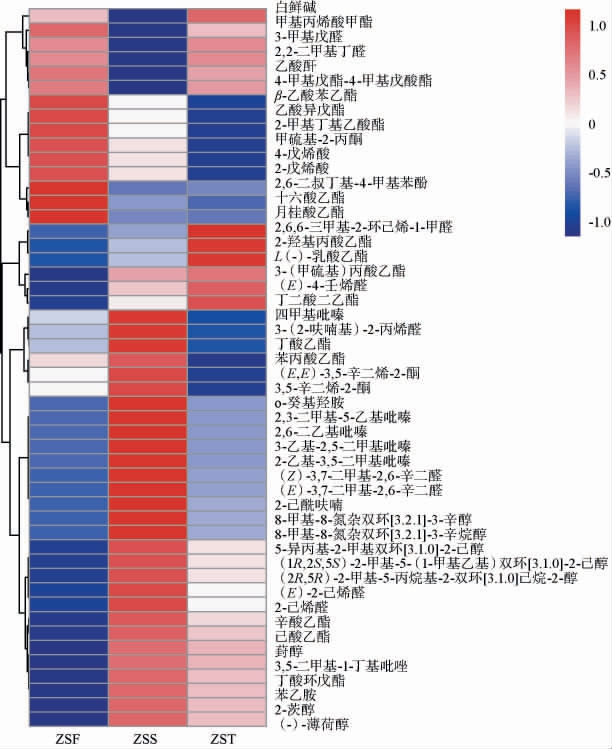
图7 酱香型白酒造沙轮次堆积发酵酒醅相对丰度top50挥发性风味物质热图
Fig.7 Heat map of relative abundance of the top50 volatile flavor substances of the fermented grains during the stacking fermentation of Zaosha round of the sauce-flavor Baijiu
2.3 酱香型白酒造沙轮次堆积发酵酒醅中微生物与挥发性风味物质相关性分析
选取酒醅中相对丰度top20的细菌和真菌与相对丰度top50的挥发性风味物质进行相关性分析,结果见图8。由图8可知,酱香型白酒堆积发酵过程中,同类微生物可代谢多种挥发性风味化合物,而同一种挥发性风味化合物也可能源自不同微生物的代谢作用,两者之间存在复杂的构效关系[25]。
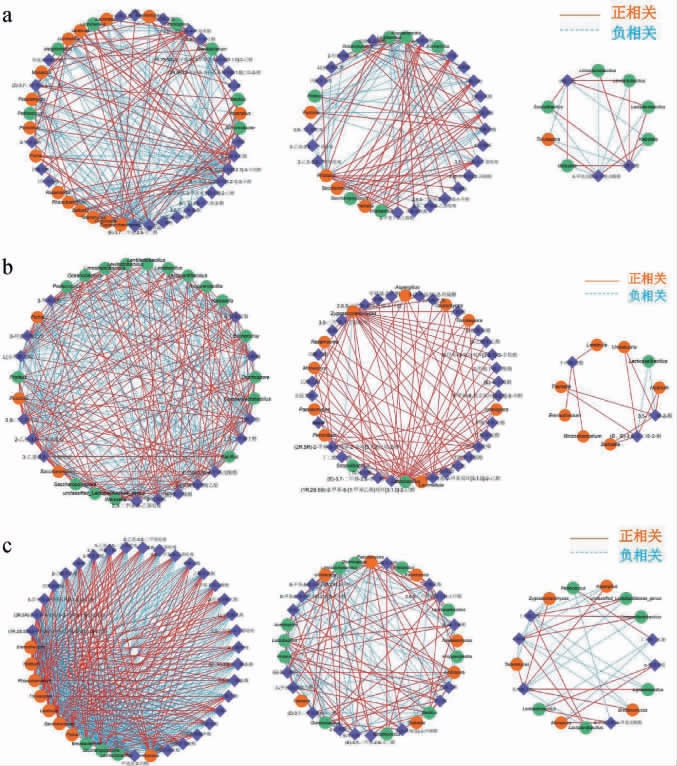
图8 酱香型白酒造沙轮次堆积发酵第一天(a)、第二天(b)、第三天(c)酒醅挥发性风味物质与微生物群落相关性网络图
Fig.8 Correlation network diagrams of volatile flavor substances and microbial communities of the fermented grains on the first day(a),the second day(b),and the third day(c)during the stacking fermentation of Zaosha round of the sauce-flavor Baijiu
紫色代表挥发性风味物质,绿色代表细菌,橘色代表真菌。
由图8(a)可知,ZSF组细菌属中Kroppenstedtia、Bacil-lus、Oceanobacillus、糖多孢菌属(Saccharopolyspora)与酯类、醛类物质呈正相关;慢生芽孢杆菌属(Lentibacillus)、Proteus等与酯类物质呈负相关。真菌属中Zygosaccharomyces、Saccharomyces等与酯类、萜类物质呈正相关,而Rhizopus、Lichtheimia与吡嗪类物质呈负相关。
由图8(b)可知,ZSS组细菌属中Lactobacillus、Proteus等与多种酯类、醇类和吡嗪类物质(如乙酸-2-苯乙酯、1-丁醇-3-甲基-乙酸酯、3,5-二甲基-1-丁基吡唑等)呈正相关,Bacillus与吡嗪类物质(如3-乙基-2,5-二甲基吡嗪、2-乙基-3,5-二甲基吡嗪)呈正相关,Kroppenstedtia与萜类化合物呈正相关;Levilactobacillus与多种吡嗪类化合物(如3-乙基-2,5-二甲基吡嗪、2,3-二甲基-5-乙基吡嗪等)呈负相关,Oceanobacillus与乙酸等酸类物质呈负相关。真菌属中,Zygosaccharomyces、Saccharomyces与酯类、醛类物质呈正相关,银耳属(Tremella)与3,5-辛二烯-2-酮等化合物呈正相关;Pichia与吡嗪类化合物(如2,6-二乙基吡嗪)呈负相关,Lachnellula与醛类化合物(如2-己烯醛)呈负相关。
由图8(c)可知,ZST组结果与ZSS组基本一致,但堆积发酵第二天比第三天Lactobacillus和Lentibacillus占比较多,从前面分析中发现堆积发酵第三天吡嗪类物质减少,可能是因为乳酸等的抑制作用[26]。
3 结论
本研究采用宏基因组测序技术分析茅台镇酱香型白酒造沙轮次堆积发酵酒醅中微生物群落结构,采用HSSPME-GC-MS技术检测酒醅中挥发性风味物质,并探究其与微生物间的相关性。结果表明,不同堆积发酵时间的酒醅中微生物群落结构存在较大差异。堆积发酵酒醅样品中优势细菌门为芽孢杆菌门(Bacillota),优势真菌门为子囊菌门(Ascomycota)。主要优势细菌属ZSF组为芽孢杆菌属(Bacillus)(23.3%)、ZSS组为发酵剂乳杆菌属(Levilactobacillus)(21.5%)、ZST组为黏液乳杆菌属(Limosilactobacillus)(24.1%);主要优势真菌属ZSF组为酵母菌属(Saccharomyces)(28.0%)、ZSS组为斋藤氏酵母属(Saitoella)(23.2%)、ZST组为香菇属(Lentinula)(17.6%)。LEfSe分析结果表明,堆积发酵第1~3天的差异物种为毕赤酵母科(Pichiaceae)、毕赤酵母属(Pichia)、芽孢杆菌目(Bacillales)。共检测到1 380种挥发性风味物质,包括157种酮类、74种醛类、115种醇类、155种杂环化合物、48种胺类、249种萜类、285种酯类、65种酚类、28种芳烃、67种烃类、80种酸、30种醚、16种含氮化合物、4种含硫化合物和7种卤代烃。相关性分析表明,ZSF组细菌属Kroppenstedtia、Bacillus、Oceanobacillus、Saccharopolyspora等与酯类、醛类呈正相关,Lentibacillus、Proteus等与酯类物质呈负相关;真菌属Zygosaccharomyces、Saccharomyces等与酯类、萜类物质呈正相关,而Rhizopus、Lichtheimia等与吡嗪类物质呈负相关。ZSS组和ZST组相关性结果相似,Bacillus、Kroppenstedtia、Tremella分别与吡嗪类、萜类和酮类物质呈正相关,Levilactobacillus、Oceanobacillus分别与吡嗪类、酸类物质呈负相关。研究结果为进一步研究酱香型白酒堆积发酵机理提供理论参考。
[1]WANG M, YANG J G, ZHAO Q S, et al.Research progress on flavor compounds and microorganisms of Maotai flavor Baijiu[J].J Food Sci,2019,84(1):6-18.
[2]沈怡方.《白酒生产技术全书》[M].北京:中国轻工业出版社,2020:357-359.
[3]赵侨,杨花,田茂玲,等.酱香型白酒堆积发酵微生物与风味物质相关性研究进展[J].中国酿造,2024,43(12):6-12.
[4]WANG Q,ZHANG H X,LIU X.Microbial community composition associated with Maotai liquor fermentation[J].J Food Sci, 2016, 81(6):1485-1494.
[5]YANG L,XIAN C,LI P,et al.The spatio-temporal diversity and succession of microbial community and its environment driving factors during stacking fermentation of Maotai-flavor Baijiu[J].Food Res Int, 2023, 169:112892.
[6]付庆凯,陈帆,孟廷淋,等.酱香型白酒不同轮次发酵酒醅差异性研究[J].食品与发酵工业,2025,51(18):322-329.
[7]陈卓,苏伟,母应春,等.洞酿酱香型白酒第三轮次酒醅发酵过程中微生物与挥发性风味物质相关性分析[J].中国酿造,2024,43(5):32-40.
[8]林彩霞,苏伟,母应春,等.洞酿酱香酒五轮次酿造过程中微生物与挥发性风味物质的相关性[J].食品工业科技,2023,44 (21):127-136.
[9]吴成,程平言,谢丹,等.酱香型白酒4轮次堆积发酵理化因子、风味物质与微生物群落相关性分析[J].食品科学,2023,44 (2):240-247.
[10]黄廷财,柴丽娟,时伟,等.酱香型白酒第2、3轮次堆积发酵有机酸代谢规律与菌群结构及其相关性解析[J].食品科学,2024,45(18):106-115.
[11]QUAST C,PRUESSE E,YILMAZ P,et al.The SILVA ribosomal RNA gene database project:Improved data processing and web-based tools[J].Nucleic Acids Res,2013,41(D1):D590-D596.
[12]KOLJALG U,NILSSON R H,ABARENKOV K,et al.Towards a unified paradigm for sequence-based identification of fungi[J].Mol Ecol,2013,22(21):5271-5277.
[13]VALENTINA L, ANGIOLA F, SARA P P, et al.HS-SPME-GC-MS metabolomics approach for sperm quality evaluation by semen volatile organic compounds(VOCs)analysis[J].Biomed Physic Eng Express,2018,5(1):015006.
[14]BINGOLBALI E,DEMIR G,MONAGHAN J D.Knowledge of sets:A didactic phenomenon[J].Int J Sci Mathe Edu,2021,19(6):1187-1208.
[15]刘玥佳,韩业君,彭文君,等.基于高通量测序技术分析蜂粮微生物多样性[J].食品科学,2020,41(10):94-100.
[16]安凯园,杜艳红,聂建光,等.酱香型白酒生产堆积酒醅中微生物、理化因子以及风味物质研究进展[J].中国酿造,2025,44(6):20-25.
[17]张春林,杨亮,李喆,等.酱香型白酒酒醅堆积微生物多样性及其与风味物质的关系[J].食品科技,2022,47(4):111-118.
[18]LI P,LIN W F,LIU X,et al.Environmental factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese Daqu starter[J].Front Microbiol,2016,7:1237.
[19]DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].Int J Food Microbiol,2019,297:32-40.
[20]肖冬光,赵树欣,陈叶福,等.白酒生产技术[M].北京:化学工业出版社,2019:18-21.
[21]吕锡斌,吴耀领,郝飞,等.高通量测序技术分析酱香型白酒下造沙轮次的微生物多样性[J].酿酒科技,2019(3):52-58,64.
[22]SHAYAN L,MEZERJI N M G,SHAYAN L,et al.Prediction of depression in cancer patients with different classification criteria,linear discriminant analysis versus logistic regression[J].Global J Health Sci,2015,8(7):41.
[23]ZHANG H,WANG L,TAN Y,et al.Effect of Pichia on shaping the fermentation microbial community of sauce-flavor Baijiu[J].Int J Food Microbiol,2021,336:108898.
[24]孙细珍,熊亚青,倪兴婷,等.吡嗪类化合物对酱香型白酒香气特征的影响分析[J].食品与发酵工业,2024,3(3):1-9.
[25]牟穰.清爽型黄酒酿造微生物群落结构及其与风味物质相关性研究[D].无锡:江南大学,2015.
[26]谢丹,吴成,赵雯宇,等.酱香型白酒一轮次堆积过程微生物多样性及风味分析[J].食品研究与开发,2025,46(1):194-201.