葡萄是重要的经济作物之一,我国主要栽培的葡萄品种多属欧亚种[1-2](Vitis vinifera L.),其果实品质优良,但抗病性较差。葡萄栽培过程中受到各种病原菌的侵染,主要为真菌病害(如灰霉病、霜霉病、白腐病等),对葡萄及葡萄酒的质量产生了严重影响。葡萄白腐病是世界范围内的重要病害之一,每年可导致葡萄减产20%~30%,严重威胁葡萄生产[3-6]。该病的病原菌有白腐垫壳孢(Coniella diplodiella)、草莓垫壳孢(C.fragariae)、白腐壳座孢(Pilidiella castanei-cola)和葡萄白腐菌(Coniella vitis)[7-8]。CHETHANA K W T等[9]明确了C.vitis是我国葡萄白腐病的主要病原菌。葡萄白腐病的发生与环境条件密切相关。越冬菌丝和分生孢子在适宜条件下通过伤口、皮孔侵入果梗、叶片和枝条。果粒病斑初为淡褐色水渍状,后变褐软烂,严重时果穗及果梗枯萎。降雨和高湿环境易引发病害大面积爆发[10]。
病害一般通过两种方式影响果实品质:一是感染花序、轴和叶子,导致落花落果和提前落叶,二是直接引起浆果生理和化学成分的变化[11],大多数真菌病害会对葡萄和葡萄酒的质量产生负面影响,但有时也会使葡萄酒的糖、酸、酒精、多酚和挥发性有机化合物产生正向变化,使葡萄酒产生独特的香气、风味和口感属性来影响葡萄酒的风格[12-13]。LI X Y等[14-15]研究表明,白腐病干扰了葡萄果实的正常代谢,感病导致赤霞珠葡萄果实酸含量上升,小芒森葡萄果实的可溶性固形物含量上升,二者的酚类物质和维生素C含量下降,感官特性和挥发性化合物组成改变,影响葡萄果实品质。
浸渍是酿造葡萄酒的关键工艺之一,通常指原料破碎后到发酵启动前对葡萄原料的提取过程,对葡萄酒品质有着至关重要的影响。目前常用的浸渍方式包括传统浸渍、低温冷浸渍[16-17]、热浸渍[18-20]、CO2浸渍[21-22]、微波浸渍等[23]。通过浸渍,葡萄皮和葡萄籽中的酚类物质、有机酸、挥发性化合物等成分能够溶解到葡萄汁中,影响葡萄酒的风味特征[24-25]。浸渍时间、温度和方式等都会对葡萄酒的品质产生影响,科学的选择适宜的浸渍工艺有助于改善葡萄酒的品质[26-27]。传统的白葡萄酒酿造多采用长时间低温浸渍(10 ℃以下),以提取原料中的多酚与芳香物质,同时避免葡萄醪氧化。热浸渍通常是将葡萄原料加热至70 ℃以上浸渍数小时,短暂的高温使葡萄原料携带的病原微生物及氧化酶系失活,防止葡萄醪氧化[28]。热浸渍还会改变成品酒香气组分的构成,包括增加新的风味物质和改变已有风味物质含量[29]。微波处理作为常见的杀菌方式,具有加热时间短、温度上升快、杀菌均匀等优势,杀菌后食品的营养成分损失少且理化指标稳定[30]。超声处理是典型的非热杀菌方式,不仅能在非常短的时间内破坏和杀灭微生物,还能对液体产生催陈、均质等作用[31]。研究发现,超声浸渍能促进葡萄皮籽中酚类物质的提取,改善了葡萄酒的色泽特征,与传统浸渍相比可以节约50%以上的时间,还可增加多糖的溶解,对葡萄酒的胶体性质产生积极影响[32]。
为了研究葡萄白腐病菌(C.vitis)感染对‘霞多丽’葡萄酒品质的影响,‘霞多丽’葡萄人工接种白腐病菌后,分别采用热浸渍、低温浸渍、超声浸渍和微波浸渍处理果实并酿酒,并比较不同浸渍工艺下葡萄酒的理化特征、酚类物质含量、抗氧化活性以及感官品质,旨在为选择适当的浸渍工艺改善感病原料带来的不良风味提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
‘霞多丽’葡萄:于2024年8月24日采自宁夏葡鼎酒庄(还原糖含量126.64 g/L,可滴定酸含量(以酒石酸计)为9.28 g/L,pH为3.74);白腐菌株(Coniella vitis):山东省葡萄研究院葡萄植保与生态创新团队;活性干酵母(EC1118)、LALLZYME EX果胶酶(酶活力18 000 U/g):法国拉曼集团。
1.1.2 试剂
氢氧化钠、无水葡萄糖、酒石酸钾钠、五水硫酸铜、邻苯二甲酸氢钾、磷酸氢二钠、柠檬酸、无水碳酸钠、醋酸铵等(均为分析纯):国药集团化学试剂有限公司;福林酚、对二甲氨基肉桂醛(p-dimethylaminocinnamaldehyde,p-DMACA)、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、2,2'-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)diammonium salt,ABTS)、1,1-二 苯 基-2-三 硝 基 苯 肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、新亚铜(分析纯):上海源叶生物科技有限公司;儿茶素、过硫酸钾(均为分析纯):上海麦克林生化科技股份有限公司;无水乙醇(分析纯):天津市富宇精细化工有限公司。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基[33]:马铃薯200 g、葡萄糖20 g、琼脂20 g、水1 000 mL,121 ℃、130 kPa灭菌20 min,用于培养葡萄灰白腐菌。
1.2 仪器与设备
TU-1900双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;PB-10型pH计:广州博勒泰科技有限公司;LB-32T型手持糖度计:广州市速为电子科技有限公司;GL-3250A型电磁搅拌器:海门市其林贝尔仪器制造有限公司;YXQ-50A高压蒸汽灭菌锅:上海博讯实业有限公司;SPX-380型生化培养箱:宁波江南仪器厂。
1.3 方法
1.3.1 孢子悬浮液的制备与接种
白腐病菌(C.vitis)在马铃薯葡萄糖琼脂培养基上活化后培养14 d产孢,参照刘博等[33]的方法制备孢子悬浮液,调整浓度至1×106个/mL。葡萄果实在75%vol酒精中浸泡10 min消毒后自然干燥,喷施孢子悬浮液,接种后于25 ℃培养3 d,培养期间每12 h喷水一次,保持果实表面湿润,空气相对湿度保持在90%以上。
1.3.2 干白葡萄酒酿造工艺及操作要点[34]
葡萄分选→接种培养→除梗破碎→添加SO2和果胶酶→不同浸渍处理→分离取汁→添加酵母→酒精发酵→添加SO2终止发酵→澄清过滤→干型白葡萄酒→低温储存
操作要点:
葡萄分选:对葡萄进行人工筛选,去除病果、腐烂果、青粒、异物等,确保原料质量。
接种培养:果实消毒后,通过喷施孢子悬浮液将白腐病菌接种至葡萄果粒表面,无菌环境下培养3 d,调整感病葡萄果实比例约25%。
添加SO2:葡萄除梗破碎,添加60 mg/L SO2。
浸渍处理:浸渍同时添加30 mg/L果胶酶,根据实验设计,分别采用冷浸渍、常温浸渍或热浸渍等不同方式处理葡萄皮渣。
分离取汁:将葡萄皮渣和清汁过滤分离,放在室温中回温。
发酵:干酵母活化后以200 mg/L酵母添加到葡萄汁中,启动发酵,发酵温度为18~20 ℃。
终止发酵:每天早中晚测量比重及温度,待比重降至0.996且稳定不变后,添加60 mg/L SO2终止发酵。
澄清储存:在终止发酵后的原酒中加入1 000 mg/L膨润土澄清过滤,即得干白葡萄酒,装瓶4 ℃条件储存。
1.3.3 葡萄酒浸渍处理方法
采用不同的浸渍方法对葡萄酒进行浸渍处理,以不接种白腐病菌、在25 ℃浸渍1 d的处理为空白,以接种白腐病菌、在25 ℃浸渍1 d的处理为对照(CV),试验组分别采用热浸渍(T1)、低温浸渍(T2)、超声浸渍(T3)和微波浸渍(T4)处理[23,35-36],具体操作方法见表1。
表1 葡萄酒浸渍处理方法
Table 1 Maceration treatment of wine

组别 操作方法 病果比例/%空白CV T1(热浸渍)T2(低温浸渍)T3(超声浸渍)T4(微波浸渍)25 ℃,1 d 25 ℃,1 d 70 ℃浸渍6 h 4 ℃浸渍2 d 600 W,45 kHz,30 min 1 024 W,5 min-25 25 25 25 25
1.3.4 基本理化指标测定
可滴定酸、还原糖、总糖、酒精度的测定:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》;pH的测定:采用pH计测定。
1.3.5 酚类物质含量测定
总酚含量的测定:采用福林-肖卡法[37],结果以没食子酸当量(gallic acid equivalent,GAE)(μg GAE/mL)表示;总黄烷-3-醇的含量测定:采用p-DMACA-盐酸法[38],结果以(+)-儿茶素当量(catechin equivalent,CE)(μg CE/mL)表示。
1.3.6 色度及色调测定
取10 mL样品,用相同pH值的磷酸氢二钠-柠檬酸缓冲液稀释10倍,分别测定稀释后样品在波长420 nm、520 nm、620 nm处的吸光度值。色调及色度计算公式如下:
色调=A420nm/A520nm
色度=A420nm+A520nm+A620nm
1.3.7 葡萄酒抗氧化活性测定
DPPH和ABTS自由基清除能力和铜离子还原能力的测定,参考王晓宇[39]的方法进行,结果以Trolox当量表示。
1.3.8 感官评价
组织9名受过专业训练的品尝人员组成品评小组。对6种酒样随机编号,品评葡萄酒的外观(15分)、香气(30分)、口感(45分)和综合品质(10分),总分分为5个等级,分别为优秀(85~100分)、很好(80~85分)、好(70~80分)、一般(50~70分)、有缺陷(<50分)。通过盲品对各样品的香气特征进行描述,并记录香气强度,由弱到强赋分1~5,结果以雷达图呈现。
1.3.9 数据处理
采用Microsoft Excel 2021软件进行基本数据统计;利用SPSS 27.0软件对数据进行显著性分析(P<0.05);使用GraphPad Prism 8软件绘图。
2 结果与分析
2.1 白腐病感染与不同浸渍工艺对葡萄酒基本理化性质的影响
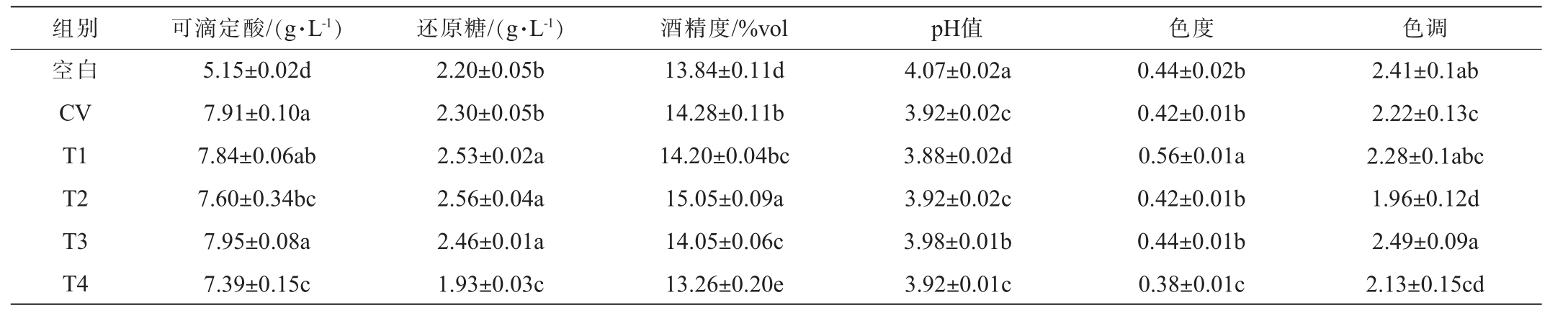
白腐病感染与不同浸渍工艺对‘霞多丽’葡萄酒基本理化指标的影响,结果见表2。由表2可知,与空白组相比,CV组显著提高了葡萄酒的可滴定酸和酒精度(P<0.05),显著降低了葡萄酒的pH值(P<0.05),其中可滴定酸含量的变化最为显著,提高了53.59%。两种处理的还原糖含量和色度值并没有表现出显著差异(P>0.05),CV组的色调显著低于空白组(P<0.05),说明白腐病的感染主要影响了葡萄酒颜色的黄绿色调,而对葡萄酒颜色的饱和度没有显著影响(P>0.05)。
表2 不同浸渍工艺对‘霞多丽’葡萄酒基本理化指标的影响
Table 2 Effect of different maceration processes on basic physicochemical indexes of 'Chardonnay' wine
注:同列指标间不同字母表示差异显著(P<0.05)。
组别 可滴定酸/(g·L-1)还原糖/(g·L-1)酒精度/%vol pH值 色度 色调空白CV T1 T2 T3 T4 5.15±0.02d 7.91±0.10a 7.84±0.06ab 7.60±0.34bc 7.95±0.08a 7.39±0.15c 2.20±0.05b 2.30±0.05b 2.53±0.02a 2.56±0.04a 2.46±0.01a 1.93±0.03c 13.84±0.11d 14.28±0.11b 14.20±0.04bc 15.05±0.09a 14.05±0.06c 13.26±0.20e 4.07±0.02a 3.92±0.02c 3.88±0.02d 3.92±0.02c 3.98±0.01b 3.92±0.01c 0.44±0.02b 0.42±0.01b 0.56±0.01a 0.42±0.01b 0.44±0.01b 0.38±0.01c 2.41±0.1ab 2.22±0.13c 2.28±0.1abc 1.96±0.12d 2.49±0.09a 2.13±0.15cd
就不同浸渍处理而言,与CV组相比,低温浸渍(T2)、微波浸渍(T4)处理显著降低了葡萄酒的可滴定酸含量(P<0.05),但对pH影响不显著(P>0.05)。热浸渍T1、T2、T3组均显著提高了葡萄酒的还原糖含量,T4组则显著降低16.09%(P<0.05)。T2组酒精度最高为15.05%vol,显著高于CV组(P<0.05),T3、T4组均显著低于CV组。不同浸渍工艺对与葡萄酒的色度和色调有着不同影响,与CV组相比,T1组显著提高了葡萄酒的色度,T4组显著降低了色度(P<0.05),但二者对色调无显著影响(P>0.05)。与之不同的是,T3组显著提高了葡萄酒的色调,T2组则显著降低了色调(P<0.05),二者对色度无显著影响(P>0.05)。
综上所述,白腐病感染可能改变了葡萄果实的代谢途径,导致酸度的上升,CV与空白组的还原糖含量无显著差异(P>0.05),但前者的酒精度升高了0.44%vol,可能是白腐菌感染导致了糖类物质的升高,后经酵母菌发酵为乙醇,升高的酸度和酒精度可能导致口感的不平衡,给葡萄酒风味带来不良影响。不同浸渍工艺对‘霞多丽’葡萄酒的理化指标有不同影响,总的来说,低温浸渍(T2组)降低可滴定酸含量的同时提高了还原糖含量,微波浸渍(T4组)降低可滴定酸含量的同时降低了酒精度,二者可能有助于葡萄酒口感的平衡。
2.2 葡萄白腐病与不同浸渍工艺对葡萄酒酚类物质的影响
葡萄白腐病与不同浸渍工艺对‘霞多丽’葡萄酒酚类物质含量的影响见图1。
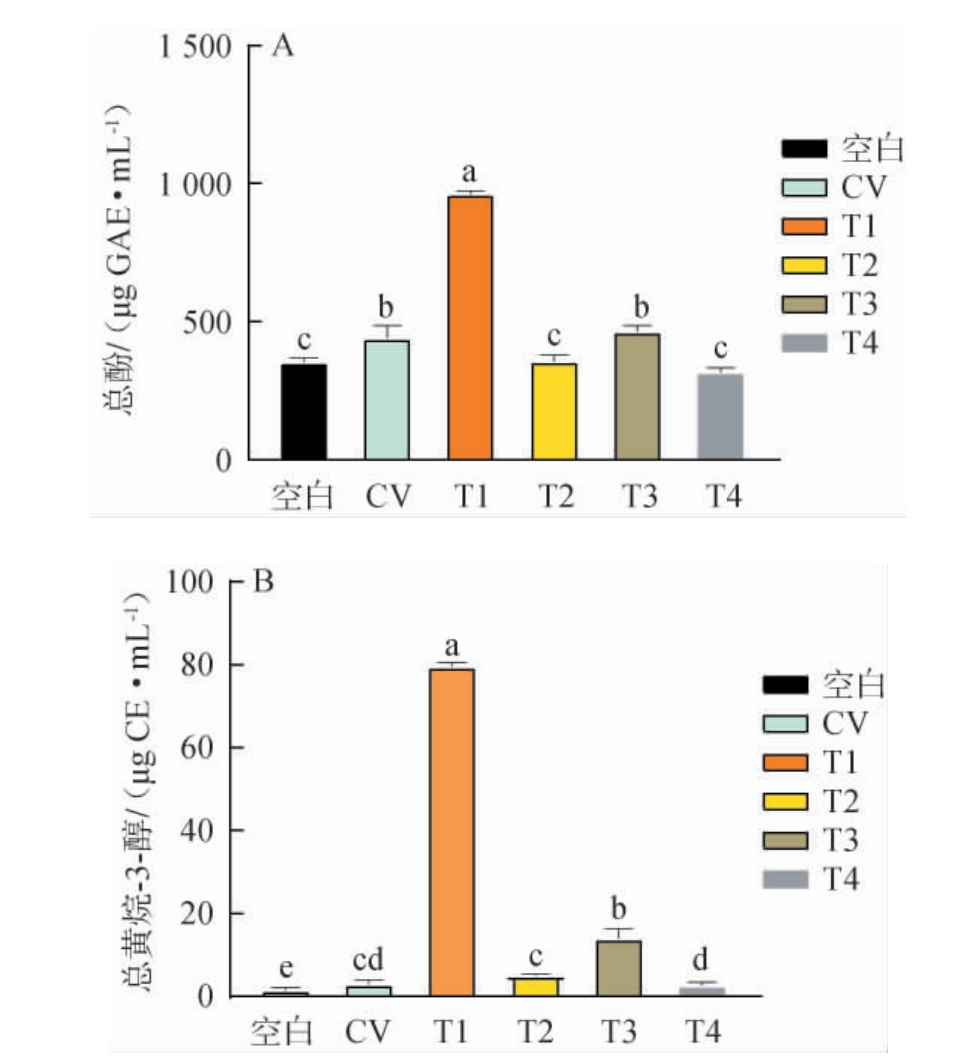
图1 不同浸渍工艺对‘霞多丽’葡萄酒中总酚(A)及总黄烷-3-醇(B)含量的影响
Fig.1 Effect of different maceration processes on the contents of total phenols (A) and total flavanol-3-alcohol (B) in‘Chardonnay’wines
不同字母表示两种处理之间存在显著差异(P<0.05)。下同。
由图1可知,与空白组相比,CV组显著提高了葡萄酒总酚和总黄烷-3-醇的含量(P<0.05),分别增加了24.86%和32.37%。浸渍工艺同样显著影响了葡萄酒的酚类物质含量。由图1A可知,在4种浸渍处理中,T1组总酚含量最高,为962.67μg/mL,与CV组相比显著提高了117.79%(P<0.05),其次为T3组,与CV组无显著差异(P>0.05);而T2和T4组的葡萄酒总酚含量则相对较低,分别为356.67 μg GAE/mL、318.67μg GAE/mL,显著低于CV组(P<0.05)。由图1B可知,T1组的总黄烷-3-醇含量同样显著高于其他处理(P<0.05),达79.57 μg CE/mL,其次是T3组,显著高于CV组(P<0.05);T2和T4组含量较低,与CV组无显著差异(P>0.05)。有研究表明,葡萄酒中的酚类物质可能受到葡萄品种、酿造方式以及病害侵染的影响而发生改变[40]。本研究中,白腐菌感染显著提高了葡萄酒中总酚和总黄烷-3-醇的含量,这可能是由于病原菌侵染后,葡萄果实中的自由基含量上升,细胞处于氧化胁迫条件,酚类物质由于其强自由基清除能力,作为应对生物胁迫的重要次生代谢产物,在感染组织中大量合成,以对抗病原菌的侵染[41]。不同浸渍工艺对葡萄酒酚类物质含量影响各异,其中T1组酚类物质含量显著高于其他组(P<0.05),是由于热浸渍工艺能通过提高温度来促进葡萄皮和籽中酚类物质的溶解,从而增加了总酚含量。
2.3 葡萄白腐病与不同浸渍工艺对‘霞多丽’葡萄酒抗氧化活性的影响
葡萄白腐病与不同浸渍工艺对‘霞多丽’葡萄酒抗氧化活性的影响见图2。由图2可知,CV组的DPPH自由基清除能力和ABTS自由基清除能力显著低于空白组,而铜离子还原能力显著高于空白组(P<0.05)。由图2A可知,与CV组相比,4种浸渍处理中,DPPH自由基清除能力最强的为T1组,比CV组显著增加了158.56%(P<0.05),其他几个处理的DPPH自由基清除能力从高到低依次为T3>T2>CV>T4,其中T2与CV组无显著差异(P>0.05)。由图2B可知,4种浸渍处理的铜离子还原能力均显著高于CV组(P<0.05),最高的为T1组,铜离子还原能力达6 076.27 μmol/mL,与CV组相比提高了170.74%,同时显著高于其他处理(P<0.05),其他几组从高到低依次为T3>T4>T2。由图2C可知,与CV组相比,T1和T3组显著提高了葡萄酒的ABTS自由基清除能力,增幅分别为7.13%和7.58%,T4组显著降低(P<0.05),而T2组无显著影响(P>0.05)。
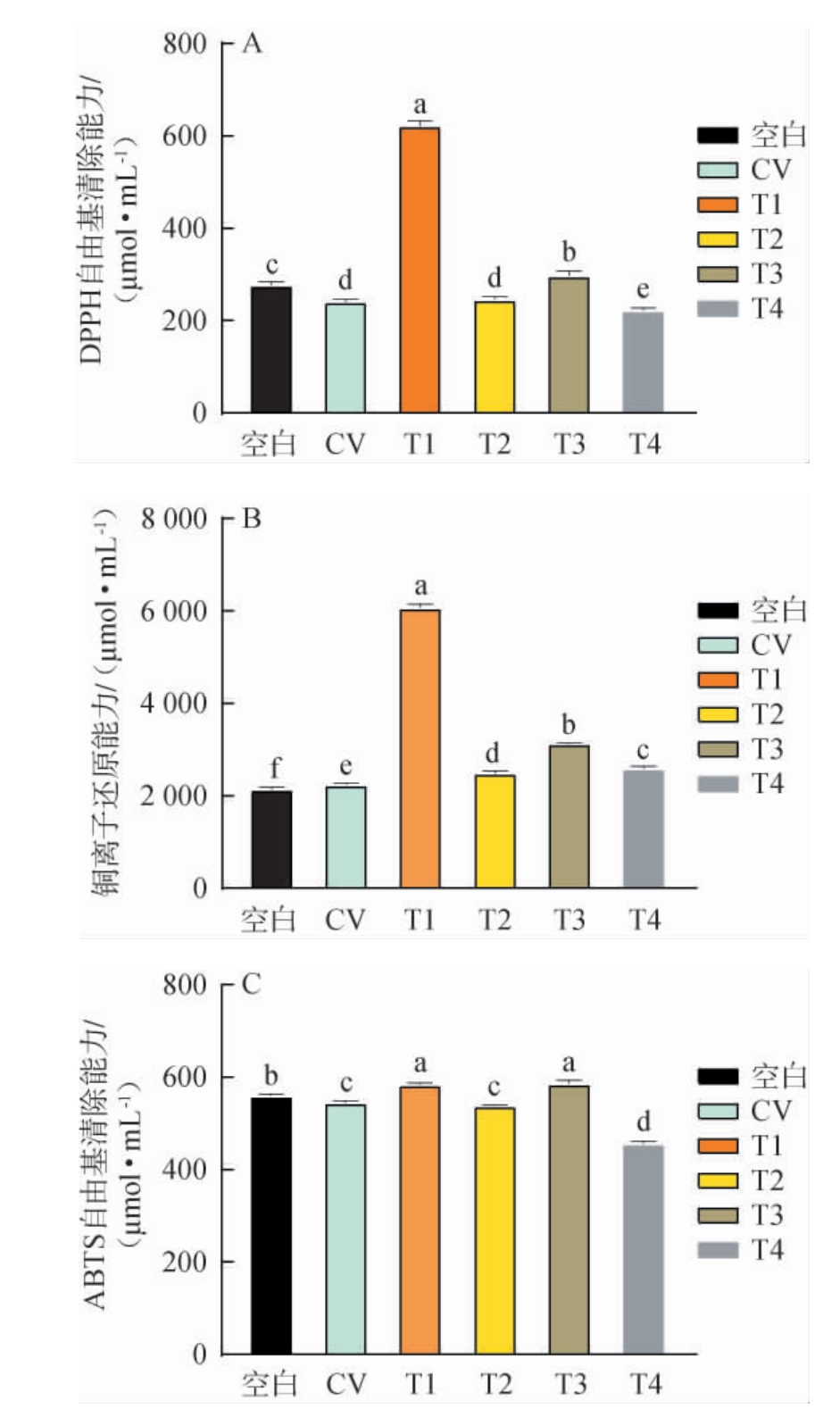
图2 不同浸渍工艺对‘霞多丽’葡萄酒抗氧化活性的影响
Fig.2 Effect of different maceration processes on antioxidant activities of 'Chardonnay' wine
不同浸渍处理下葡萄酒抗氧化活性的差异主要表现在T1处理与其他组间,热浸渍大幅度提升了DPPH自由基清除能力和铜离子还原能力,这可能与其丰富的总酚和总黄烷-3-醇含量有关。相比之下,低温浸渍和微波处理在总酚含量和抗氧化活性方面表现较差,超声处理比二者稍高,但仍逊色于热浸渍处理。葡萄酒作为一个复杂的化学系统,其抗氧化性除了来源于酚类物质,还可能来源于抗坏血酸等物质,且不同结构的单体酚清除自由基的能力也有所不同,各处理之间的抗氧化性差异与酚类物质总量有关,但也受单体酚组成的影响。方川川等[42]通过不同方法测定了干红葡萄酒的总酚含量、总类黄酮含量、总抗氧化能力和抗超氧阴离子能力,相关性分析显示,不同产区同种葡萄酒的总酚与总抗氧化能力、抗超氧阴离子能力的相关系数分别为0.754、0.943,为正相关关系,而在同一年份不同品种葡萄酒中,总酚与总抗氧化能力、抗超氧阴离子能力的相关系数却截然相反,分别为0.122和-0.883,这也反映了酚类物质与抗氧化能力并不总是正相关。综上,葡萄白腐病降低了葡萄酒的DPPH自由基清除能力和ABTS自由基清除能力,提高了铜离子还原能力,但整体幅度较小,热浸渍和超声浸渍处理可以显著提升葡萄酒的DPPH、ABTS自由基清除能力和铜离子还原能力。
2.4 白腐病感染与不同浸渍工艺对‘霞多丽’葡萄酒感官质量的影响
对6个处理的葡萄酒进行感官评价,结果见表3。由表3可知,空白组的外观评分、香气评分和口感评分均高于CV组,但没有显著差异(P>0.05),空白组总分显著高于CV组(P<0.05)。不同的浸渍处理对葡萄酒的感官影响也有很大区别。与CV组相比,T2与CV组在总分上无显著差异(P>0.05),T1、T3和T4组总分均显著高于CV组(P<0.05),对感染白腐病‘霞多丽’所酿葡萄酒的感官评价具有积极影响,其中热浸渍处理的葡萄酒在外观、香气和口感方面均表现优异,得分最高,具有明显优势。
表3 葡萄白腐病与不同浸渍工艺对‘霞多丽’葡萄酒感官评分的影响
Table 3 Effect of grape white rot and different maceration processes on sensory score of 'Chardonnay' wines
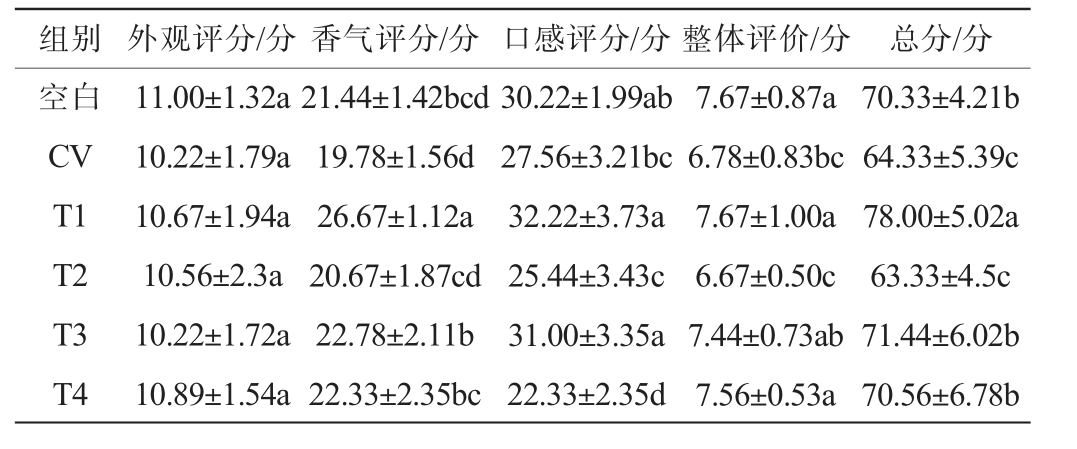
组别 外观评分/分 香气评分/分 口感评分/分 整体评价/分 总分/分空白CV T1 T2 T3 T4 11.00±1.32a 10.22±1.79a 10.67±1.94a 10.56±2.3a 10.22±1.72a 10.89±1.54a 21.44±1.42bcd 19.78±1.56d 26.67±1.12a 20.67±1.87cd 22.78±2.11b 22.33±2.35bc 30.22±1.99ab 27.56±3.21bc 32.22±3.73a 25.44±3.43c 31.00±3.35a 22.33±2.35d 7.67±0.87a 6.78±0.83bc 7.67±1.00a 6.67±0.50c 7.44±0.73ab 7.56±0.53a 70.33±4.21b 64.33±5.39c 78.00±5.02a 63.33±4.5c 71.44±6.02b 70.56±6.78b
各处理葡萄酒的感官特征雷达图见图3。由图3可知,未感病的‘霞多丽’葡萄酒(空白组)最突出的香气描述词是绿色水果和草本植物,强度达到3分以上,其次表现出明显的果香,包括柑橘、核果、热带水果、煮熟水果等,带有少量花香和香辛料的特征,呈现出‘霞多丽’干白的典型香气轮廓。而感病‘霞多丽’葡萄酒(CV组)最突出的香气描述词为面团和不良气味(动物、泥土、化学试剂),与空白组相比,其果香强度减弱,不良风味、香辛料特征增强,花香特征消失,二者存在明显区别。在香气轮廓方面,与CV组相比,T1组给葡萄酒带来了更多煮熟水果的香气,增加了柑橘类、核果类和热带水果的香气,减弱了绿色水果和草本植物的气味,而没有表现出辛香料、面团、花香的特征,说明热浸渍葡萄酒的特点是浓郁、成熟的果香风格。T2组则表现为突出的面团香气和泥土、动物等不良气味,柑橘类、核果和草本植物香气增加,煮熟水果、绿色水果香气减少,花香、辛香料特征消失,说明低温浸渍葡萄酒增强了白腐菌带来的香气特征,对葡萄酒香气起到负面作用。与CV组相比,T3和T4组均略微增强了柑橘类、核果和草本植物香气,保留了较高的辛香料香气与泥土、动物等不良气味,使葡萄酒重新表现出花香,降低了煮熟水果和绿色水果的香气,其中T3组还有较强的热带水果香气,T4组则带有较强的面团香气,综合来看二者在各香气描述词上表现均为中等,没有显著香气特征,对白腐菌感染带来的各香气特征影响不大。
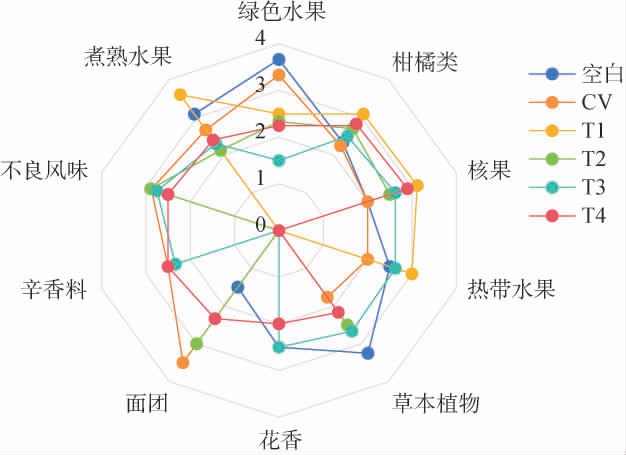
图3 ‘霞多丽’葡萄酒感官特征雷达图
Fig.3 Radar chart for sensory analysis of 'Chardonnay' wine
综上所述,白腐菌感染使‘霞多丽’葡萄酒的整体评分降低,葡萄酒质量下降,并使果香强度减弱,花香特征消失,而表现出更多的辛香料、面团等香气特征也表现出泥土、动物等不良风味。热浸渍(T1组)增强了葡萄酒的果香,减弱了绿色水果和草本植物等生青气味,消除了白腐菌带来的不良气味,感官评分显著高于其他处理(P<0.05),对葡萄酒感官品质具有一定的改善作用。
3 结论
通过人工接种白腐病菌后的小容器发酵试验,系统地研究了葡萄白腐病菌感染对‘霞多丽’干白葡萄酒质量的影响,以及不同浸渍工艺对受感染葡萄酿造的干白葡萄酒品质的改善作用。研究结果表明,白腐病菌感染对葡萄酒的基本理化性质有显著影响(P<0.05),提高了可滴定酸含量和酒精度,可能影响葡萄酒的口感平衡,也提高了酚类物质含量,但降低了抗氧化能力,使葡萄酒果香减弱,花香消失,表现出泥土、面团和香辛料等香气特征。不同浸渍工艺对受感染葡萄酿造的干白葡萄酒品质有一定地改善作用,其中低温浸渍和微波浸渍显著降低了葡萄酒的可滴定酸含量,有助于口感平衡,但香气质量不佳;热浸渍处理提高了还原糖含量和酒精度,但同时提高了总酚含量和抗氧化活性,整体表现出浓郁、成熟的果香,降低了白腐菌感染带来的香气特征,可以作为改善感染白腐病‘霞多丽’干白葡萄酒优先选择的发酵工艺。
[1]高圣华.辽宁省葡萄白腐病发生规律及防治措施[J].园艺与种苗,2024,44(9):28-29.
[2]郝雨.葡萄炭疽菌与抗感葡萄种质互作中的侵染特性及寄主防卫反应研究[D].杨凌:西北农林科技大学,2022.
[3]尹向田,季萍,袁丽芳,等.葡萄白腐病研究进展[J].落叶果树,2023,55(6):71-74.
[4]陈彦,刘长远,赵奎华,等.葡萄白腐病菌生物学特性研究[J].沈阳农业大学学报,2006,51(6):840-844.
[5]符丽珍,党攀峰.葡萄白腐病发生规律与防治措施[J].西北园艺(果树),2019,32(6):33-34.
[6]黄宇飞,赵奎华,刘长远,等.辽宁地区葡萄白腐病菌遗传多样性分析[J].沈阳农业大学学报,2015,46(1):37-41.
[7]LIU R,WANG Y,LI P,et al.Genome assembly and transcriptome analysis of the fungus Coniella diplodiella during infection on Grapevine(Vitis vinifera L.)[J].Front Microbiol,2021,11:599150.
[8]袁丽芳,尹向田,蒋锡龙,等.山东省葡萄白腐病病原菌鉴定[J].植物病理学报,2023,53(4):729-733.
[9]CHETHANA K W T,ZHOU Y,ZHANG W,et al.Coniella vitis sp.nov.is the common pathogen of white rot in Chinese vineyards[J].Plant Dis,2017,101(12):2123-2136.
[10]李鹏.葡萄抗白腐病QTL定位与候选基因功能验证[D].武汉:华中农业大学,2023.
[11]BRUNO G, SPARAPANO L.Effects of three esca-associated fungi on Vitis vinifera L.: V.Changes in the chemical and biological profile of xylem sap from diseased cv.Sangiovese vines[J].Physiol Mol Plant Path, 2008, 71(4): 210-229.
[12]PONS A,MOUAKKA N,DELIERE L,et al.Impact of Plasmopara viticola infection of Merlot and Cabernet Sauvignon grapes on wine composition and flavor[J].Food Chem,2018,239:102-110.
[13]ZAPPAROLI G,LORENZINI M,TOSI E,et al.Changes in chemical and sensory properties of Amarone wine produced by Penicillium infected grapes[J].Food Chem,2018,263:42-50.
[14]LI X Y,LI T G,LI M M,et al.Effect of pathogenic fungal infestation on the berry quality and volatile organic compounds of Cabernet Sauvignon and Petit Manseng Grapes[J].Front Plant Sci,2022,13:942487.
[15]HAN X, WEI Y, YUAN L, et al.Characterization of flavor profiles of wines produced with Coniella vitis-infected grapes by GC-MS, HPLC,and sensory analysis[J].Food Chem,2025,471:142820.
[16]王清扬,罗峻渲,甘丛康,等.非酿酒酵母结合冷浸渍对干红葡萄酒品质的影响[J].中国酿造,2024,43(7):99-103.
[17]蔡明,段伟,匡阳甫,等.低温浸渍对“北玫”桃红葡萄酒主要品质特征的影响研究[J].特种经济动植物,2024,27(4):23-27,30.
[18]张莉,王华,李华.发酵前热浸渍工艺对干红葡萄酒质量的影响[J].食品科学,2006,27(4):134-137.
[19]李超,王家琪,魏滨生,等.浸渍对红葡萄酒颜色品质的影响研究进展[J].中国酿造,2024,43(1):14-19.
[20]周鹤.分汁法酿造西拉甜型桃红葡萄酒工艺优化的研究[D].乌鲁木齐:新疆农业大学,2022.
[21]桂长莉.发酵前处理工艺对干红葡萄酒品质影响的研究[D].银川:北方民族大学,2017.
[22]曹栋杰.发酵前处理与陈酿方式对赤霞珠红葡萄酒品质的影响研究[D].杨凌:西北农林科技大学,2022.
[23]梅源,苏周晨星,谭立杭,等.浸渍方式对高海拔‘赤霞珠’葡萄酒挥发性风味物质的影响[J].中外葡萄与葡萄酒,2024,49(1):65-73.
[24]李震,张乐宏,崔旋旋,等.不同浸渍工艺对夏黑葡萄醪理化指标及颜色的影响[J].中国酿造,2020,39(10):152-156.
[25]程艺超,姜娇,秦义,等.压榨处理对美乐葡萄汁CO2浸渍发酵特性及品质的影响[J].中国食品学报,2024,24(6):177-189.
[26]钟宝,文连奎.北冰红山葡萄酒CO2浸渍发酵工艺研究[J].中国酿造,2016,35(3):32-35.
[27]赖钰婷,原江锋,陈卓瑶,等.微波技术对葡萄酒中酚类和有机酸类的影响[J].河南科技大学学报(自然科学版),2022,43(2):77-83,91,9.
[28]张莉,王华,李华.发酵前热浸渍工艺对干红葡萄酒质量的影响[J].食品科学,2006(4):134-137.
[29]GEFFROY O,LOPEZ R,SERRANO E,et al.Changes in analytical and volatile compositions of red wines induced by pre-fermentation heat treatment of grapes[J].Food Chem,2015,187:243-253.
[30]李婧,胡文忠.微波灭菌对干红葡萄酒质量影响的初步研究[J].食品工业科技,2014,35(15):144-146.
[31]谢晶,陆文轩,许天胜,等.声动力技术及声敏剂在食品杀菌中的应用[J].中国食品学报,2025,25(6):1-13.
[32]LETICIA M,ZENAIDA G,MANUEL H,et al.Effect of pre-fermentative treatments on polysaccharide composition of white and Rosé Musts and Wines[J].J Agr Food Chem,2024,72(4):1928-1937.
[33]刘博,尹向田,关心,等.不同葡萄品种对白腐病菌的抗性研究[J].中外葡萄与葡萄酒,2025,50(1):38-44.
[34]惠淼,韩星,董新义,等.酿酒葡萄爱格丽、媚丽在夏县地区的栽培适应性研究[J].中国酿造,2023,42(4):40-45.
[35]张清安,徐博文,陈博宇,等.超声降低红酒中高级醇含量对酒体风味特性的影响[J].中国农业科学,2021,54(8):1772-1786.
[36]孙俪娜.加工方法对葡萄浓缩汁品质影响的研究[D].乌鲁木齐:新疆农业大学,2011.
[37]JAYAPRAKASHA G, SINGH R, SAKARIAH K.Antioxidant activity of grape seed (Vitis vinifera) extracts on peroxidation models in vitro[J].Food Chem,2001,73(3):285-290.
[38]ARNOUS A, MAKRIS P D, KEFALAS P.Correlation of pigment and flavanol content with antioxidant properties in selected aged regional wines from Greece[J].J Food Compos Anal,2002,15(6):655-665.
[39]王晓宇.葡萄酒抗氧化活性及其检测方法的研究[D].杨凌:西北农林科技大学,2008.
[40]JERMINI M,BLAISE P,GESSLER C,et al.Response of'Merlot'(Vitis vinifera)grapevine to defoliation caused by downy mildew(Plasmopara viticola)during the following growing season[J].J Grapevine Res,2010,49(4):161-166.
[41]XU W,XU X Y,HAN R,et al.Integrated transcriptome and metabolome analysis reveals that flavonoids function in wheat resistance to powdery mildew[J].Front Plant Sci,2023,141:125194.
[42]方川川,刘宗昭,王晓军,等.不同方法测定干红葡萄酒抗氧化性的比较分析[J].食品安全导刊,2023(12):95-98.