发酵型果酒在酿造过程中较好地留存了水果中的各类天然成分,如多酚类化合物、氨基酸、维生素等,这些营养成分赋予了发酵型果酒良好的风味与保健功效[1]。同时,由于水果中含有大量的有机酸如柠檬酸、苹果酸、酒石酸等,有时微生物在发酵过程中也会产生有机酸,如乳酸、琥珀酸、丙酮酸等[2-3],较高的酸度会影响果酒的口感和品质[4-5],有必要进行降酸处理。
果酒降酸的方法包括物理法、化学法和生物法[6]。物理降酸法包括低温冷冻法和稀释降酸法。低温冷冻法主要利用冷冻设备使酒体中的酒石酸盐类结晶沉淀,从而达到降酸的目的;低温冷冻降酸法保证了酒原有的品质,但其主要是降低酒中游离的酒石酸,而对乳酸和苹果酸无作用;稀释降酸法成本低且操作工艺简便,但降酸效果并不理想。利用碳酸钙、碳酸氢钾、酒石酸钾、双盐等进行化学降酸,具有操作方便、易控制且降酸效果明显等优点,但其化学反应往往会影响酒液的口感和色泽,同时由于金属离子的大量溶入,可能会带来酒液的不稳定,如失光、浑浊等现象。生物降酸法包括乳酸菌降酸法和酵母菌降酸法。乳酸菌降酸法是利用乳酸菌将果酒中的苹果酸和柠檬酸转化为乳酸,从而实现降酸的目的。该方法不会影响果酒的营养成分和风味,但是乳酸菌降酸需要时间较长才能达到理想的降酸效果,同时乳酸菌的生长需要一定的温度和pH环境。酵母菌降酸法是利用酵母菌将果酒中的有机酸转化为二氧化碳和乙醇,从而实现降酸的目的,该方法操作简单,降酸效果显著。陈思睿等[7]从红树莓果园土壤和鲜果中分离得到的陆生伊萨酵母(Issatchenkia terricola)具有较好的降解柠檬酸能力;JIANG Y等[8]从红树莓果实中分离到1株降解柠檬酸的陆生伊萨酵母;LIU X等[9]从刺梨上分离得到1株对柠檬酸有较好耐受性且能降低刺梨酒中挥发酸的异常威克汉姆酵母(Wickerhamomyces anomalus);包怡红等[10]从蓝靛果中分离得到的季也蒙迈耶氏酵母(Meyerozyma guilliermondii)降解柠檬酸和苹果酸能力明显优于降解酒石酸能力。适度降酸能改善果汁、果酒等饮料的口感,不同酵母菌对有机酸的降解能力和改善水果饮料口感的能力都有所不同[11];刘俊丽等[12]筛选得到具有降酸能力的东方伊萨酵母(Issatchenkia orientalis)GS1-1并用于猕猴桃果酒发酵,有效降低了发酵液中的柠檬酸和总酸,并调节了果酒风味和口感;GAO L等[13]研究发现,降酸酵母可以增加果酒中的咖啡酸、对香豆酸、表儿茶素、总酯种类等风味物质的含量;WANG J等[14]通过将酿酒酵母与具有苹果酸降解性能的粟酒裂殖酵母(Schizosaccharomyces pombe)连续接种发酵,促进了沙棘中苹果酸和奎宁酸的降解,同时改善了沙棘汁的色泽、抗氧化性和风味特性;LIU S等[15]用德尔布有孢酵母(Torulaspora delbrueckii)、粟酒裂殖酵母等非酿酒酵母与酿酒酵母混合发酵越橘果酒,栗酒酵母可几乎完全消耗苹果酸,并增加花青素、羟基肉桂酸衍生物的浓度。因此,筛选优良降酸酵母对改善果汁、果酒口感具有极为重要的意义。
本研究以柠檬、橘子、葡萄等水果为原材料,采用稀释涂布平板法从其自然发酵液中分离筛选具有有机酸降解能力的酵母菌株,通过生理生化试验、分子生物学技术对筛选菌株进行鉴定,对其进行发酵特性和耐受性试验,研究其在不同柠檬酸质量浓度下生长性能和降酸效果,并对筛选酵母菌株降解有机酸的能力进行评价。以期为高有机酸含量水果进行果酒发酵时生物降酸提供菌种资源,对高酸水果资源开发利用具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
柠檬、橘子、葡萄鲜果:购买于校园水果店。
1.1.2 试剂
葡萄糖、一水合柠檬酸、硫酸铵、酒石酸、磷酸二氢钾、硫酸镁、磷酸、溴甲酚绿(均为分析纯):国药集团化学试剂有限公司;DL-苹果酸(分析纯):西陇科学股份有限公司;无氨基酵母氮源(yeast nitrogen base without amino acids,YNB)(纯度99%):上海源叶生物科技有限公司;酵母基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:北京索莱宝科技有限公司;聚合酶链式反应(polymerase chain reaction,PCR)引物、2×San Taq PCR Mix:生工生物工程(上海)股份有限公司。
1.1.3 培养基
酵母浸出粉蛋白胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:葡萄糖20 g/L,酵母浸粉10 g/L,蛋白胨20 g/L,蒸馏水1 000 g/L。YPD固体培养基:YPD液体培养基中添加20 g/L琼脂粉。121 ℃高压蒸汽灭菌20 min。
酵母浸粉蛋白胨柠檬酸(yeast extract peptone citric acid,YPC)液体培养基:柠檬酸10 g/L,酵母浸粉10 g/L,蛋白胨20 g/L。121 ℃高压蒸汽灭菌20 min。
苹果酸降解指示培养基[16]:DL-苹果酸10 g/L,YNB 1.7 g/L,硫酸铵5 g/L,溴甲酚绿0.1 g/L。121 ℃高压蒸汽灭菌20 min。
有机酸发酵培养基:柠檬酸、苹果酸或酒石酸24 g/L,酵母浸粉10 g/L,蛋白胨20 g/L,硝酸铵3 g/L,磷酸二氢钾4 g/L,硫酸镁0.5 g/L,蒸馏水1 000 mL。121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SN-MJX-26B霉菌培养箱:上海一恒科学仪器有限公司;PHS-3C型pH计、721N紫外分光光度计:上海仪电科仪器有限公司;Vanquish高效液相色谱(high performance liquid chromatography,HPLC)(配有二极管阵列检测器(diode array detector,DAD))仪:赛默飞世尔(中国)科技有限公司;聚合酶链式反应(PCR)仪:加拿大BBI公司;DYY-7B电泳仪:北京六一生物科技有限公司;SC850凝胶成像系统:上海山富科学仪器有限公司。
1.3 方法
1.3.1 降酸酵母菌的分离纯化
柠檬、橘子、葡萄用无菌水进行清洗,充分破碎后按10%添加葡萄糖作为碳源,28 ℃下进行自然发酵,于发酵旺盛期(72 h)发酵液按10倍制进行梯度稀释至10-7,分别吸取10-5、10-6、10-7稀释液100 μL,涂布于苹果酸降解指示培养基上,28 ℃条件下静置培养10 d,从平板上挑选具有酵母菌落特征、颜色为黄绿色至蓝色的菌落[17],接种于苹果酸降解指示培养基进行培养,直至得到单一形态的单菌落,编号后保存于-80 ℃冰箱。
1.3.2 降酸酵母的筛选
将分离筛选的酵母菌株接种至YPC液体培养基中,28℃条件下静置培养15 d,测定发酵液的酸度,以未接种YPC培养基为对照,选择降酸率较高的菌株。降酸率计算公式如下:
式中:D表示降酸率,%;A1表示初始的酸度,mol/L;A2表示最终的酸度,mol/L。
1.3.3 筛选酵母的生理生化试验[18]
碳源同化试验:以葡萄糖、果糖、淀粉、蔗糖、麦芽糖为碳源,以酵母膏和蛋白胨为氮源,接种筛选降酸酵母后28 ℃培养1~2 d,观察是否生长。
氮源同化试验:以硝酸铵、碳酸铵、硫酸铵、硝酸钠、蛋白胨为氮源,以葡萄糖为碳源,接种降酸酵母后28 ℃培养1~2 d,观察是否生长。
1.3.4 降酸酵母的分子生物学鉴定
按照酵母基因组DNA提取试剂盒说明书的操作方法提取筛选得到的降酸酵母菌株的基因组DNA,以其为模板,采用酵母通用引物NL1(5'-GCATATCAATAGCGGAGGAAAAG-3')与NL4(5'-GGTCCGTGTTTCAA GACGG-3')对菌株的26S rDNA D1/D2区基因序列进行PCR扩增。PCR扩增体系为2×2×San Taq PCR Mix 12.5 μL、基因组DNA 1.0 μL、引物NL1(10 μmol/L)1.0 μL、引物NL4(10 μmol/L)1.0 μL,补充双蒸水(ddH2O)至25.0 μL。PCR扩增条件为94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸45 s,共30个循环;72 ℃再延伸5 min。PCR产物经2%琼脂糖电泳进行验证后,送至生工生物工程(上海)股份有限公司进行测序。将测序得到的序列提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对分析,根据MEGA 7.0软件中邻接(neighbor joining,NJ)法构建系统系统发育树,对菌株进行菌种鉴定。
1.3.5 降酸酵母耐受性试验
种子培养液的制备:以YPD培养基为种子培养基,接种筛选降酸酵母后,28 ℃静置培养12 h,得到种子培养液。
糖耐受性试验:配制葡萄糖质量浓度为20 g/L、100 g/L、200 g/L、400 g/L、600 g/L、800 g/L的YPD液体培养基,按1%接种量接种至筛选降酸酵母种子培养液,28 ℃下静置培养48 h[19],测定培养液在波长600 nm处的吸光度值,每组试验设置3个重复,考察筛选降酸酵母糖耐受性。
乙醇耐受性试验:配制乙醇体积分数为4%、8%、12%、14%、16%的YPD液体培养基,按1%接种量接种至筛选降酸酵母种子培养液,28 ℃下静置培养48 h[20],测定培养液在波长600 nm处的吸光度值,每组试验设置3个重复,考察筛选降酸酵母乙醇耐受性。
二氧化硫耐受性试验:配制二氧化硫质量浓度为30mg/L、60 mg/L、90 mg/L、120 mg/L、150 mg/L、180 mg/L的YPD液体培养基,按1%接种量接种至筛选降酸酵母种子培养液,28 ℃下静置培养48 h[21],测定培养液在波长600 nm处的吸光度值,每组试验设置3个重复,考察筛选降酸酵母二氧化硫耐受性。
1.3.6 柠檬酸质量浓度对降酸酵母生长性能及降酸效果的影响
柠檬汁高酸低pH的环境导致生物降酸难以实现,研究筛选降酸菌株在不同柠檬酸质量浓度下的生长性能及降酸效果,可为筛选降酸菌株在高酸果汁中的实际应用提供理论参考。配制柠檬酸质量浓度为0、2 g/L、4 g/L、6 g/L、8 g/L、10 g/L的YPC培养基,添加0.5%葡萄糖为补充碳源,按1%接种量接种降酸酵母种子培养液,28 ℃下静置培养48 h,测定培养液总酸及在波长600 nm处的吸光度值,每组试验设置3个重复,考察不同柠檬酸质量浓度对筛选降酸酵母的生长性能及降酸效果的影响。
1.3.7 降酸酵母有机酸降解能力试验
制备筛选降酸酵母的种子培养液,按照106个/mL的接种量接种到以柠檬酸、苹果酸和酒石酸为碳源的有机酸发酵培养基中,参照CHEN Q等[22]的方法,28 ℃静置培养7 d,分别测定发酵液中剩余柠檬酸、苹果酸和酒石酸的质量浓度,并计算各有机酸的降解率,其计算公式如下:
式中:Y 表示各有机酸的降解率,%;C0表示未加菌液的有机酸质量浓度,g/L;C1表示加入菌液后的有机酸质量浓度,g/L。
1.3.8 分析检测
总酸(以柠檬酸计):按照国标GB 12456—2021《食品中总酸的测定》中酸碱指示剂滴定法测定;有机酸:按照国标GB 5009.157—2016《食品中有机酸的测定》中的HPLC法测定。
1.3.9 数据分析处理
利用SPSS18.0进行数据处理及统计分析,并使用Origin 9.5进行绘图。
2 结果与分析
2.1 降酸酵母的分离纯化
采用稀释涂布平板法从橘子、柠檬、葡萄自然发酵液中分离筛选,共得到33株具有降酸能力的酵母菌株,分别编号为AR1~AR33。其中颜色呈黄绿色的共21株、蓝绿色的12株。结果表明,从柠檬自然发酵液中筛选出10株降酸能力的酵母(颜色呈黄绿色的共8株(AR2、AR4、AR9、AR11、AR13、AR28、AR29、AR30)、蓝绿色的2株(AR19、AR21)),橘子自然发酵液中筛选出14株降酸能力的酵母(颜色呈黄绿色的共7株(AR1、AR5、AR6、AR8、AR10、AR26、AR32)、蓝绿色的7株(AR15、AR17、AR18、AR22、AR23、AR24、AR25)),葡萄自然发酵液中筛选到9株降酸能力的酵母(颜色呈黄绿色的共6株(AR3、AR7、AR12、AR14、AR27、AR31)、蓝绿色的3株(AR16、AR20、AR33))。
2.2 降酸酵母的筛选
不同酵母接种于苹果酸降解指示培养基,按照降酸能力的从强至弱,培养后酵母呈现的颜色依次为蓝色、绿色、黄绿色、黄色[17]。以未接种YPC培养基为对照,将分离纯化得到的颜色呈蓝绿色的12株降酸酵母接种至YPC液体培养基中,28 ℃培养15 d,各培养液降酸率见图1。由图1可知,与对照培养液相比,接种12株筛选降酸酵母菌培养液的酸度都有一定程度减少,说明均具有降酸能力,其中菌株AR25和AR33培养液降酸率最高,分别为91.82%和91.19%。因此,选取降酸能力较强的菌株AR25和AR33进行后续试验。
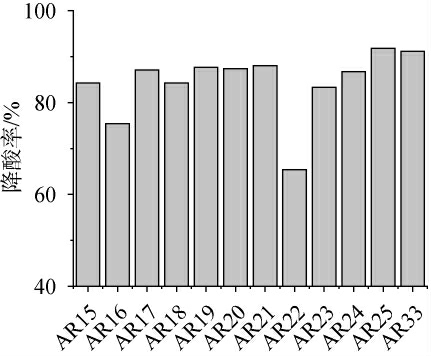
图1 降酸酵母菌的筛选结果
Fig.1 Screening results of acid-reducing yeasts
2.3 降酸酵母的生理生化试验
菌株AR25、AR33生理生化试验结果表明,它们都能够利用葡萄糖、果糖、淀粉、蔗糖、麦芽糖等碳源进行生长,能够以硝酸铵、硫酸铵、硝酸钠、蛋白胨为氮源进行生长,均不能利用碳酸铵。
2.4 降酸酵母的分子生物学鉴定
在NCBI网站上,将菌株AR25、AR33测序所得的26S rDNA D1/D2区域序列进行同源序列比对,采用MEGA 7.0软件中邻接(NJ)法构建系统进化树,结果见图2。由图2可知,菌株AR25、AR33与间型假丝酵母(Sungouiella intermedia)同源性最高。因此,菌株AR25和AR33均被鉴定为间型假丝酵母(Sungouiella intermedia)。

图2 基于26S rDNA基因序列的菌株AR25和AR33系统发育树
Fig.2 Phylogenetic tree of strains AR25 and AR33 based on 26S rDNA gene sequence
2.5 降酸酵母耐受性分析
将菌株AR25、AR33接种到不同质量浓度或体积分数的葡萄糖、乙醇或二氧化硫的YPD中培养,其对葡萄糖、乙醇及二氧化硫的耐受性试验结果见图3。
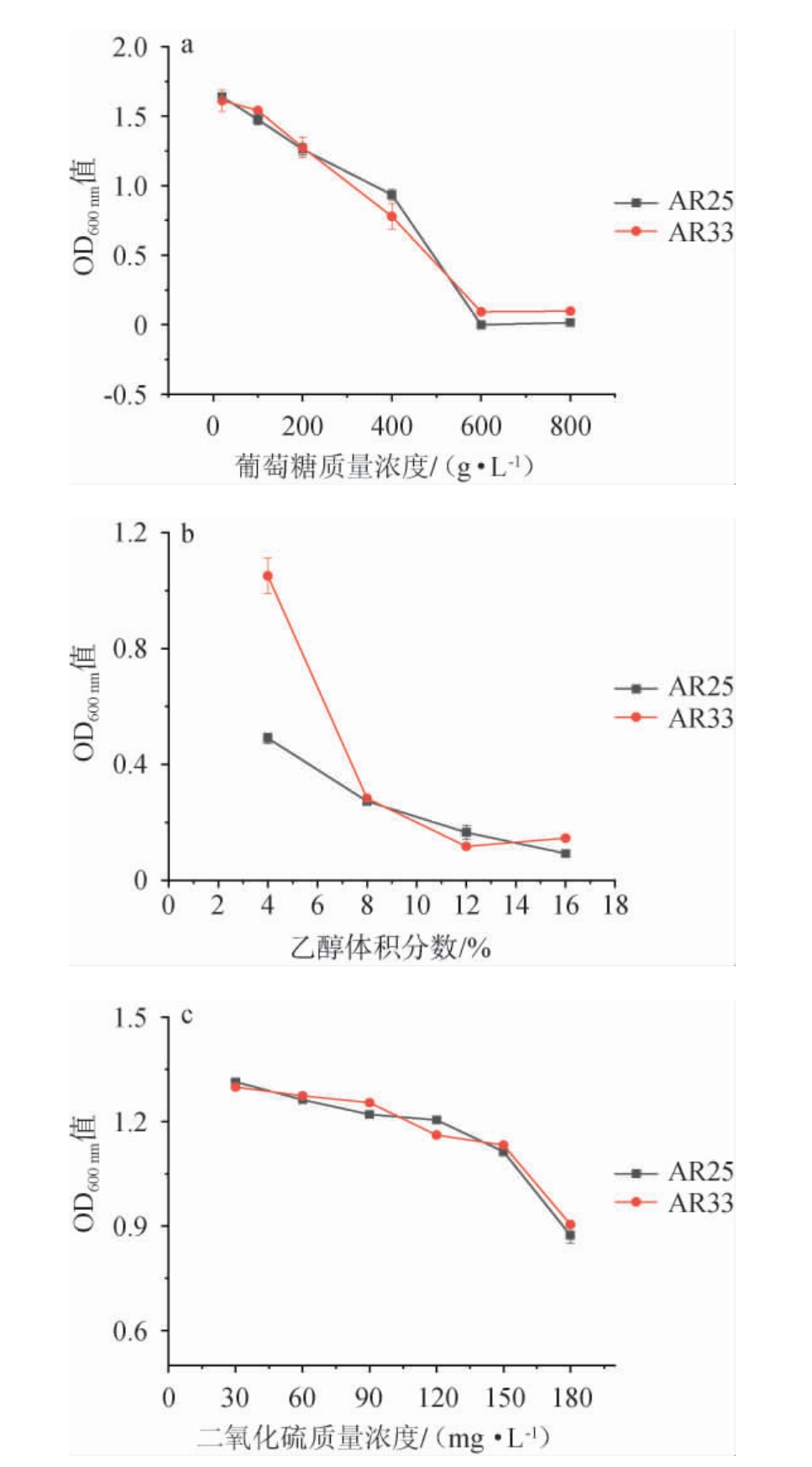
图3 降酸酵母AR25和AR33对葡萄糖(a)、乙醇(b)和二氧化硫(c)的耐受性试验结果
Fig.3 Tolerance tests results of acid-decreasing yeasts AR25 and AR33 to glucose (a), ethanol (b) and sulfur dioxide (c)
由图3a可知,随着葡萄糖质量浓度升高,菌株AR25和AR33的吸光度值呈下降趋势,葡萄糖质量浓度为600 g/L时,吸光度值均接近为0,说明酵母细胞没有增殖。因此,两个菌株可耐受的葡萄糖质量浓度为400 g/L。由图3b可知,乙醇体积分数为4%时,菌株AR25的吸光度值明显低于菌株AR33,说明乙醇体积分数对菌株AR25的胁迫作用更强;乙醇体积分数为8%时,菌株AR25和AR33的吸光度值接近,说明AR33对乙醇体积分数的增加较为敏感;乙醇体积分数继续增大,两个菌株培养液的吸光度值较小且变化不大,规律基本一致。因此,两个菌株可耐受的乙醇体积分数为8%。由图3c可知,随着二氧化硫质量浓度的增大,菌株AR25和AR33的吸光度值变化规律基本一致,呈较为平滑的下降趋势;二氧化硫质量浓度为180 mg/L时,吸光度值仍然较高。因此,两个菌株能够耐受180 mg/L的二氧化硫质量浓度。结果表明,菌株AR25和AR33能够耐受400 g/L葡萄糖、8%(V/V)乙醇、180 mg/L二氧化硫的环境条件,且菌株AR25对乙醇的敏感度较高。
2.6 柠檬酸浓度对降酸酵母生长情况及降酸效果的影响
将菌株AR25、AR33接种至含不同质量浓度柠檬酸的培养液中,培养48 h后,菌株AR25、AR33生长情况及降酸效果见图4。由图4a可知,随着柠檬酸质量浓度的增加,菌株AR25和AR33的吸光度值整体上都呈现下降趋势,但变化范围较小(1.983~2.016);柠檬酸质量浓度6~10 g/L时,吸光度值有小幅度增加;说明不同柠檬酸浓度下,两株菌株的生长受到一定影响但影响不大。由图4b可知,柠檬酸质量浓度为2 g/L时,菌株AR25和AR33的降酸率最高,分别为53.42%、56.16%;柠檬酸质量浓度较低时,菌株AR33的降酸率略高于菌株AR25,柠檬酸质量浓度为10 g/L时两个菌株的降酸率一致。综上,菌株AR25和AR33在柠檬酸质量浓度为2 g/L时的降酸率最高;低浓度柠檬酸培养液中,菌株AR33的生长性能及降酸效果优于菌株AR25。
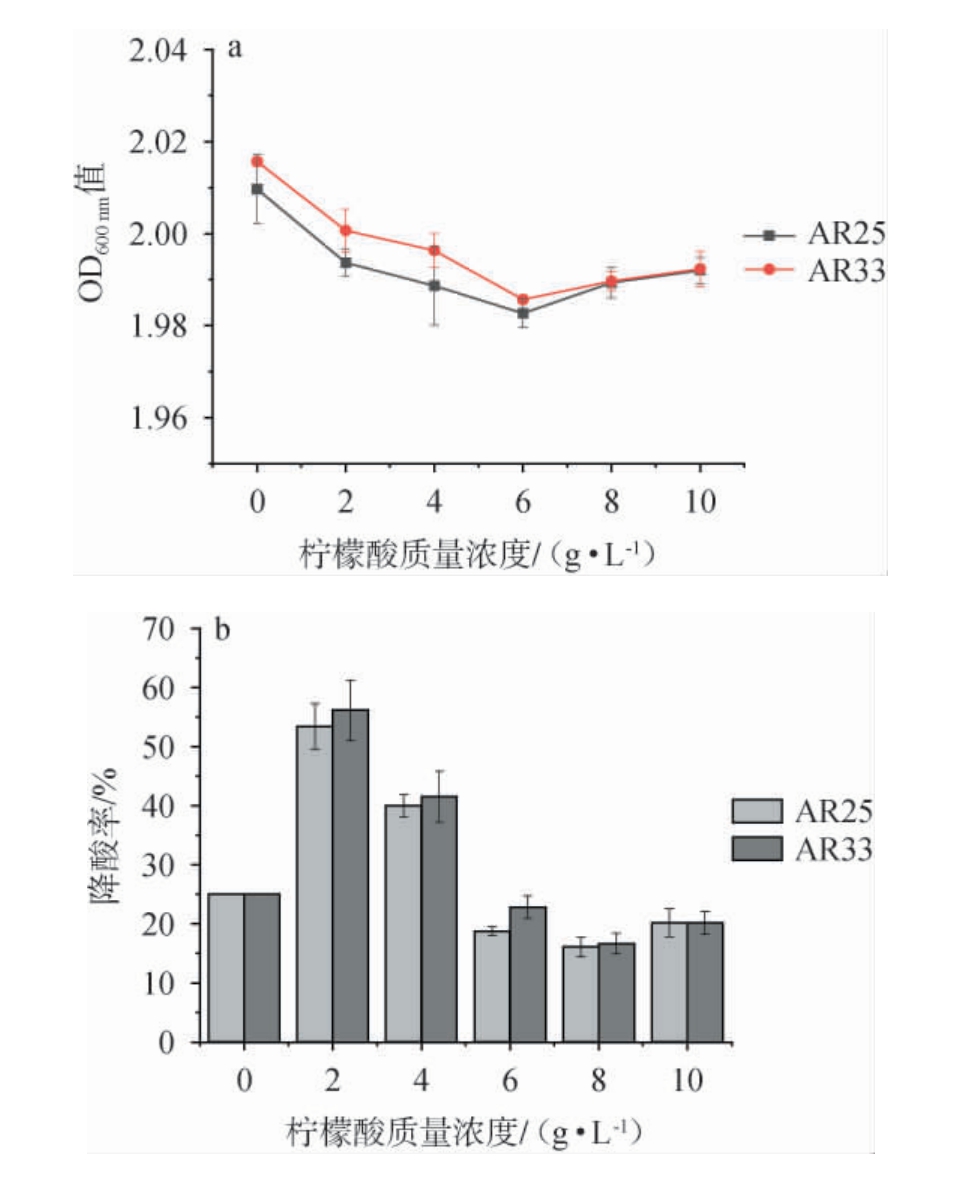
图4 降酸酵母AR25和AR33在不同柠檬酸质量浓度下生长性能(a)及降酸效果(b)
Fig.4 Growth performance (a) and acid degradation effect (b) of acid-decreasing yeasts AR25 and AR33 under different citric acid mass concentrations
2.7 降酸酵母对有机酸的降解能力
分别向含有柠檬酸、苹果酸、酒石酸的有机酸发酵培养基中接种菌株AR25和AR33,培养7 d后测定各有机酸含量并计算有机酸的降解率,结果见表1。由表1可知,降酸酵母对有机酸的降解能力存在明显差异,接种AR25至有机酸发酵培养基中,发酵结束后,各发酵液中有机酸含量从高到低依次为酒石酸(12.03 g/L)>苹果酸(1.32 g/L)>柠檬酸(0.39 g/L)。因此,菌株AR25对柠檬酸、苹果酸、酒石酸的降解率分别为98.36%、94.49%、49.89%。接种AR33的有机酸发酵培养基发酵结束后,各发酵液中有机酸含量从高到低依次为酒石酸(11.93 g/L)>柠檬酸(2.65 g/L)>苹果酸(0.90 g/L),菌株AR33对柠檬酸、苹果酸、酒石酸的降解率分别为88.96%、96.25%、50.28%。对有机酸的降解能力上,菌株AR25对柠檬酸的降解能力极显著高于菌株AR33(P<0.01),菌株AR33对苹果酸和酒石酸的降解能力高于菌株AR25,但不具有显著性(P>0.05)。菌株AR25和AR33均对柠檬酸和苹果酸的降解能力远高于对酒石酸的降解能力;AR25对柠檬酸的降解率极显著高于AR33(P<0.01),但对苹果酸、酒石酸的降解率低于AR33。
表1 降酸酵母AR25和AR33对有机酸的降解效果
Table 1 Degradation effect of acid-decreasing yeasts AR25 and AR33 on organic acids

注:“**”表示菌株AR25与AR33对有机酸降解率差异极显著(P<0.01)。
菌株编号柠檬酸降解率/% 苹果酸降解率/% 酒石酸降解率/%AR25 AR33 98.36±0.04**88.96±1.29 94.49±0.40 96.25±2.44 49.89±0.91 50.28±1.50
卢思言等[23]分离得到的二孢结合酵母(Zygosaccharomyes bisporus)对苹果酸、柠檬酸、酒石酸的降解率分别为42.60%、18.28%、13.09%,均明显低于菌株AR25和AR33;吴叶等[24]分离得到Saturnispora diversa SD-59可使柠檬汁中的苹果酸和柠檬酸分别减少了100%和95.9%;唐莹等[20]研究表明,在最佳条件下,陆生伊萨酵母WJL-G4对柠檬酸降解率为91.82%;WANG J等[14,25]将粟酒裂殖酵母沙棘果汁发酵,对苹果酸的降解率分别为43.67%、68.90%,明显低于菌株AR25和AR33,可能与果汁成分较为复杂有关。研究显示[26],裂殖酵母、假丝酵母属酵母菌可通过三羧酸循环和乙醛酸循环实现柠檬酸、琥珀酸、苹果酸、富马酸、乙醛酸等物质的相互转化达到降酸的效果,且酵母会优先利用糖之后才以柠檬酸为碳源进行分解,糖浓度对酵母菌降解柠檬酸、苹果酸等有机酸的效果影响较大[27]。
间型假丝酵母广泛存在于自然环境[28-29]与传统发酵酒类[30-31],在葡萄酒发酵过程中通过产生抗菌肽对腐败酵母具有杀菌活性[32-33],并具有一定的益生潜在活性[34]。因此,菌株AR25和AR33都具有作为果酒酿造生物降酸菌株的潜力。
3 结论
该研究分离筛选得到2株具有降酸能力的酵母菌株AR25和AR33,经鉴定2株酵母菌均为间型假丝酵母(Sungouiella intermedia);2株酵母菌都能够耐受400 g/L葡萄糖、8%(V/V)乙醇、180 mg/L二氧化硫;在不同质量浓度柠檬酸环境下,菌株AR25和AR33均能够有效降低培养液的总酸,且在柠檬酸质量浓度为2 g/L时降酸率最高,分别为53.42%、56.16%;对不同有机酸的降解率上,菌株AR25对柠檬酸的降解率极显著高于AR33(P<0.01),但对苹果酸和酒石酸的降解率低于菌株AR33。2个酵母菌株均具有应用于果酒降酸处理的潜力。
[1]梁艳玲,陈麒,伍彦华,等.果酒的研究与开发现状[J].中国酿造,2020,39(12):5-9.
[2]曾朝珍,慕钰文,袁晶,等.发酵方式对苹果草莓酒理化成分和抗氧化活性的影响研究[J].中国酿造,2025,44(1):212-218.
[3]宗凌丽,孙小杰,应月,等.全自动固相萃取-超高效液相色谱-串联质谱法测定果酒中14种有机酸[J].食品安全质量检测学报,2024(10):270-278.
[4]张倩茹,殷龙龙,尹蓉,等.果酒主要成分及其功能性研究进展[J].食品与机械,2020(4):226-230,236.
[5]王龙瑞,周连玉,孙文娟,等.果酒有机酸变化及复合降酸技术的研究进展[J].酿酒科技,2024(1):90-94,101.
[6]舒翔,邱奇琦.果酒降酸专利技术分析[J].安徽农学通报,2024,30(4):97-101.
[7]陈思睿,唐琳琳,冯建文,等.高效降解柠檬酸酵母菌的筛选鉴定及其在红树莓果汁中降酸特性[J].食品科学,2020,41(22):133-139.
[8]JIANG Y,LUO T,TANG Y,et al.Isolation of a novel characterized Issatchenkia terricola from red raspberry fruits on the degradation of citric acid and enrichment of flavonoid and volatile profiles in fermented red raspberry juice[J].Food Sci Hum Well,2022,11(4):1018-1027.
[9]LIU X,LI Y,ZHAO H,et al.Identification and fermentative properties of an indigenous strain of Wickerhamomyces anomalus isolated from Rosa roxburghii Tratt[J].Brit Food J,2021,123(12):4069-4081.
[10]包怡红,梁爽,骆嘉原.蓝靛果果酒降酸酵母菌的筛选鉴定及其发酵特性[J].现代食品科技,2024,40(9):74-86.
[11]于潇淳,徐晶,李明,等.葡萄酒生物降酸机制及发酵策略研究进展[J].中国酿造,2023,42(8):28-32.
[12]刘俊丽,孙广玲,黄蓉,等.微通氧条件下东方伊萨酵母对猕猴桃酒的降酸效果[J].中国食品学报,2023,23(4):283-294.
[13]GAO L,LI Y,YANG S,et al.Effects of an inoculation dose of Issatchenkia terricola WJL-G4 on physicochemical properties,active substances,and antioxidant capacity of black,red,and white currant juice[J].J Sci Food Agr,2024,104(11):6405-6416.
[14]WANG J, ZHANG Y, ZHANG B, et al.Optimization of the quality of sea buckthorn juice by enzymatic digestion and inoculation sequence[J].Food Chem,2025,470:142623.
[15]LIU S,LAAKSONEN O,KORTESNIEMI M,et al.Chemical composition of bilberry wine fermented with non-Saccharomyces yeasts(Torulaspora delbrueckii and Schizosaccharomyces pombe)and Saccharomyces cere-visiae in pure,sequential and mixed fermentations[J].Food Chem,2018,266:262-274.
[16]吕银德,赵俊芳,秦令祥.鲜食葡萄降酸酵母菌的筛选、鉴定及酿造特性研究[J].中国酿造,2023,42(9):120-124.
[17]白玉峰,张文霞,田亚楠,等.宁夏贺兰山东麓降L-苹果酸葡萄酒酵母的筛选[J].中国酿造,2021,40(1):49-54.
[18]肖明春.降酸酵母菌株的筛选及对山楂挥发性风味物质的影响研究[D].秦皇岛:河北科技师范学院,2024.
[19]唐雨杰,王祖文,赵品瑶,等.青脆李野生酵母菌的筛选鉴定与耐受性研究[J].食品与发酵工业,2025,51(13):117-125.
[20]唐莹,王金玲,卢志全,等.陆生伊萨酵母WJL-G4降解柠檬酸的条件研究[J].中国食品学报,2021,21(8):46-56.
[21]刘熙,佀胜利,杨坤凡.蓝莓果实野生酵母菌株的分离鉴定及发酵性能研究[J].安徽农学通报,2025,31(3):110-115.
[22]CHEN Q,WANG C,ZHANG Z,et al.Targeting indigenous Schizosaccharomyces japonicus for genotype exploration and organic acid degradation analysis[J].Front Microbiol,2025,16:1569585.
[23]卢思言,曾祥玉,王鑫源,等.蓝靛果中可降解有机酸的酵母菌株筛选及鉴定[J].食品工业科技,2021,42(20):126-133.
[24]吴叶,陈星光,杨华,等.降酸酵母的筛选及其在柠檬汁降酸中的应用[J].食品与生物技术学报,2025,44(2):80-89.
[25]李小瑛,文芳,李先腾,等.沙棘原浆粟酒裂殖酵母降酸工艺优化及品质评价[J/OL].食品与发酵工业:1-11[2025-07-04].https://doi.org/10.13995/j.cnki.11-1802/ts.043394.
[26]TIAN J,LIN Y,SU X,et al.Effects of Saccharomyces cerevisiae quorum sensing signal molecules on ethanol production in bioethanol fermentation process[J].Microbiol Res,2023,271:127367.
[27]苏晓佳,罗小叶,王晓丹.降酸微生物在发酵饮品领域应用研究进展[J].中国酿造,2024,43(12):1-5.
[28]SESSOU P,MC S,PAUL L,et al.Yeasts in milk and dairy products[M].New York:Academic Press,2022:611-617.
[29]DE OLIVEIRA P,LIMA F R,PASSAMANI F R,et al.Fungal and bacterial diversity present on the rind and core of Natural Bloomy Rind Artisanal Minas Cheese from the Canastra region,Brazil[J].Food Res Int,2025,202:115724.
[30]YAN S, TONG Q,GUANG J.Yeast dynamics and changes in volatile compounds during the fermentation of the traditional Chinese strongflavor Daqu[J].LWT-Food Sci Technol,2019,106:57-63.
[31]SANTIAGO-URBINA J, ARIAS-GARCÍA J, RUIZ-TERÁN F.Yeast species associated with spontaneous fermentation of taberna,a traditional palm wine from the southeast of Mexico[J].Ann Microbiol,2015,65(1):287-296.
[32]PENA R,VILCHES J,G-POBLETE C,et al.Effect of Candida intermedia LAMAP1790 antimicrobial peptides against wine-spoilage yeasts Brettanomyces bruxellensis and Pichia guilliermondii[J].Fermentation-basel,2020,6(3):65.
[33]TENEA G, CAJAS B A, SANCHEZ B C.Inhibitory-like substances produced by yeasts isolated from Andean blueberries: prospective food antimicrobials[J].Foods,2023,12(13):2435.
[34]PIRAINE R E A,RETZLAF G M,GONCALVES V S,et al.Brewing and probiotic potential activity of wild yeasts Hanseniaspora uvarum PIT001,Pichia kluyveri LAR001 and Candida intermedia ORQ001[J].Eur Food Res Technol,2023,249(1):133-148.