肌苷是一种重要的嘌呤核苷类化合物,在医药、食品及饲料工业中具有广泛的应用价值[1]。在医药领域,肌苷是合成抗病毒药物(如阿昔洛韦)和免疫调节剂(如异丙肌苷)的关键物质;在食品工业中,是增鲜剂5'-呈味核苷酸二钠的重要前体,市场需求广泛[2]。目前,肌苷的生产主要依赖微生物发酵法。尽管枯草芽孢杆菌(Bacillus subtilis)因其遗传背景清晰、代谢途径明确、工业化培养条件成熟等优势,已成为肌苷生产的理想宿主菌株[3],然而野生型菌株复杂的代谢途径限制了其在生产中的应用。因此,通过诱变育种或分子改造等手段提升菌株的肌苷生产能力,是提高生产效率的有效途径。
近年来,微生物诱变育种技术在工业菌株改良中取得了显著进展。传统诱变方法(如紫外诱变和化学诱变)通常结合抗性筛选策略(如8-氮鸟嘌呤或6-巯基嘌呤抗性筛选)来获得肌苷高产菌株[4]。相比之下,常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变技术因其独特的优势在工业菌株改造中展现出巨大潜力。研究表明,ARTP诱变能够产生更丰富的突变谱,其突变多样性显著优于传统方法,这为菌株性能改良和新型遗传标记的挖掘提供了宝贵资源[5-7]。随着分子生物学的发展,代谢工程领域已开发出多种提高肌苷产量的有效策略。朱彦凯等[8]运用成簇规律间隔短回文重复序列及其相关蛋白9(clustered regularly interspaced short palindromic repeats and CRISPR-associated protein 9,CRISPR/Cas9)技术对大肠杆菌(Escherichia coli)中肌苷合成途径进行系统改造,通过敲除rihA等基因、过表达pbuE等基因获得了一株稳定高效的肌苷重组菌株,上罐发酵48 h肌苷产量达到20.2 g/L。SHIMAOKA M等[9]研究发现,在大肠杆菌中过表达purF基因突变体能够解除终产物的反馈抑制,增加磷酸核糖焦磷酸(phosphoribosyl pyrophosphate,PRPP)等前体物质的供给,从而增强嘌呤合成途径的代谢流,肌苷产量提升至3.6 g/L。此外,LI M等[10]通过敲除purA基因阻断了腺苷合成途径,改造后的菌株的肌苷产量在72 h内提高至7.6g/L,但生物量仅为对照的50%。ZHANG X等[11]通过ARTP诱变结合高通量筛选,获得对尿苷单磷酸结构类似物具有高耐受性和良好遗传稳定性的突变大肠杆菌NXBG-11-F34,随后通过CRISPR/Cas9基因编辑技术敲除参与胞苷分解代谢的udk和rihA基因,构建重组菌株大肠杆菌NXBG-13,在5 L生物反应器中胞苷效价达15.7 g/L。尽管相关研究在竞争途径基因敲除、反馈抑制解除以及前体供应强化等方面取得了显著进展,然而,对于枯草芽孢杆菌这一重要工业微生物在关键代谢节点的动态调控和工业化菌株的稳定性维持等方面仍存在挑战,亟需开发更精准的遗传改造策略以充分发挥其在工业生产中的潜力。
本研究通过常压室温等离子体(ARTP)诱变技术对枯草芽孢杆菌(Bacillus subtilis)020进行诱变选育,通过突变位点挖掘与代谢工程相结合的策略,解析高产突变株的基因组变异特征与关键功能突变位点,并基于此构建基因过表达重组菌株,评估其发酵生产肌苷能力,实现从传统随机诱变向基于分子设计进行精准改造的转化。旨在为微生物细胞工厂的理性设计提供新策略,同时为工业微生物的高效改造和应用奠定坚实基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒和引物
枯草芽孢杆菌(B.subtilis)020:肇东星湖生物科技有限公司提供,现保存于广东省微生物菌种保藏中心,保藏编号为GDMCC No:1.976;大肠杆菌(Escherichia coli)DH5α感受态细胞:北京天根生化科技有限公司。本研究所用的菌种与质粒见表1,引物见表2。
表1 本研究所用的菌种与质粒
Table 1 Strains and plasmids used in this study
菌种或质粒 属性 来源菌株E.coli DH5α B.subtilis 020 B.subtilis 1684 B.subtilis 0861 B.subtilis 0309 B.subtilis 0137 B.subtilis 2056 B.subtilis S195 B.subtilis S1951质粒pHT43 pHT43-prsA转化原始肌苷生产菌株ARTP诱变菌株ARTP诱变菌株ARTP诱变菌株ARTP诱变菌株ARTP诱变菌株ARTP诱变菌株过表达prsA的重组菌株天根生化科技有限公司肇东星湖生物科技有限公司诱变获得诱变获得诱变获得诱变获得诱变获得诱变获得本实验室构建空载体prsA瞬时表达质粒本实验室保存本实验室构建
表2 本研究所用的引物序列
Table 2 Primer sequence used in this study
引物 序列(5'→3')目的ClonExpressprsA-F ClonExpressprsA-R prsA-F prsA-R AAAACATCAGCCGTAGGATCCATGTCTAACGAATACGGAGATAAGAATT CCCGGGGACGTCGACTCTAGATTAGCTGAATAAATAGCTGACAGATTGT ATGTCTAACGAATACGGAGATAAGAATT TTAGCTGAATAAATAGCTGACAGATTGT无缝克隆引物验证prsA基因
1.1.2 试剂
葡萄糖(分析纯)、酵母浸粉、胰蛋白胨、酵母膏、琼脂(均为生化试剂):北京奥博星生物技术有限公司;七水硫酸镁、磷酸氢二钾、维生素B1、维生素B3、维生素B5、维生素B12、七水硫酸亚铁、次黄嘌呤、柠檬酸钠、尿素、氯化钠(均为分析纯):北京索莱宝科技有限公司;山梨醇、甘露醇、甘油、聚乙二醇6000(均为分析纯)、氨苄青霉素纳(845~988 μg/mg):上海生工生物工程股份有限公司;肌苷标准品(纯度>98%)、乙腈(色谱纯):美国Sigma公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒、DNA纯化试剂盒、质粒小提试剂盒和琼脂糖凝胶回收试剂盒:美国Omega Bio-Tek公司;限制性核酸内切酶、T4 DNA连接酶:大连宝生物工程有限公司;2×Phanta Master Mix、DNA Marker、无缝克隆试剂盒:南京诺唯赞生物科技股份有限公司。
1.1.3 培养基
枯草芽孢杆菌培养基:葡萄糖20 g/L,蛋白胨15 g/L,氯化钠5 g/L,牛肉膏0.5 g/L,琼脂20 g/L,蒸馏水1 000 mL。121 ℃灭菌20 min。
LB液体培养基:酵母浸粉5.00 g/L,胰蛋白胨10.00 g/L,氯化钠10.00 g/L,蒸馏水1 000 mL。121 ℃灭菌20 min。
LB固体培养基:酵母浸粉5.00 g/L,胰蛋白胨10.00 g/L,氯化钠10.00 g/L,琼脂20 g/L,蒸馏水1 000 mL。121 ℃灭菌20 min。
肌苷发酵培养基[12]:葡萄糖100 g/L,蛋白胨10 g/L,酵母膏10 g/L,维生素B1 2 mg/L,维生素B3 2 mg/L,维生素B5 2 mg/L,维生素B12 1.5 mg/L,七水硫酸亚铁10 mg/L,七水硫酸镁2 g/L,磷酸氢二钾2 g/L,磷酸二氢钾2 g/L,次黄嘌呤2 g/L,柠檬酸钠5 g/L,尿素5 g/L,pH值为7,蒸馏水1 000 mL。115 ℃灭菌20 min。
ARTP诱变菌株的培养及筛选采用含有分解代谢抑制物超优肉汤(super optimal broth with catabolite repression,SOC)液体培养基:北京奥博星生物技术有限公司。
SOC 固体培养基:SOC 液体培养基中添加琼脂20.00 g/L。115 ℃灭菌20 min。
氨苄青霉素抗性平板:酵母浸粉5.00 g/L,胰蛋白胨10.00 g/L,氯化钠10.00 g/L,琼脂20 g/L,氨苄青霉素钠50 mg/L,蒸馏水1 000 mL。121 ℃灭菌20 min。(抗生素为灭菌后冷却至50~60 ℃时无菌加入)
1.2 仪器与设备
ARTP-II型常压室温等离子体诱变育种仪:无锡源清天木生物科技有限公司;TU-1901紫外可见分光光度计:北京普析通用仪器有限责任公司;ZQLY-300V恒温摇床:上海知楚仪器有限公司;Nanodrop型微量分光光度计:美国赛默飞世尔科技有限公司;FR-1000凝胶成像系统:上海复日科技有限公司;ETC821聚合酶链式反应(polymerase chain reaction,PCR)仪:北京东胜创新生物科技有限公司;HWS-26恒温水浴锅:上海一恒科学仪器有限公司;JA2003分析天平:上海良平仪器仪表有限公司;1260型高效液相色谱(high performance liquid chromatography,HPLC)仪:安捷伦科技(中国)有限公司;Ultimate AQ-C18色谱柱(4.6 mm×250 mm,5 μm):上海月旭科技有限公司。
1.3 方法
1.3.1 ARTP诱变
将-80 ℃甘油保藏的枯草芽孢杆菌020在斜面上活化两次,再接种于SOC液体培养基中,于37 ℃、180 r/min条件下振荡培养24 h至对数生长期。离心收集菌体,用无菌水将菌体重悬,并植被为菌浓度为106~108 CFU/mL的菌悬液。在超净台内取10 μL菌悬液均匀涂布在多个无菌载片表面。用无菌镊子将载片放到ARTP诱变仪对应凹槽中,设置诱变参数:电源功率100 W,气流量8 L/min,作用距离2 mm,诱变处理时间分别为0(未处理)、15 s、30 s、45 s、60 s、75 s、90 s、120 s,以未处理作为对照组。样品诱变处理完毕,用无菌镊子将载片分别放至装有1 mL无菌水的1.5 mL无菌离心管振荡洗脱,形成新的菌悬液。对新的菌悬液进行适当稀释,取100 μL涂布于SOC平板,于37 ℃培养24 h。待菌落长出后,采用平板计数法统计菌落数量并计算致死率,确定最适诱变条件。致死率计算公式如下[13]:
式中:A1为在不同照射时间处理的活菌数,个;A0为对照组活菌数,个。
1.3.2 高产肌苷突变菌株的筛选
配制不同质量浓度的肌苷标准品溶液(5 g/L、10 g/L、15 g/L、20 g/L、30 g/L),利用高效液相色谱(HPLC)法[14]进行肌苷含量测定,以肌苷标准溶液质量浓度(x)为横坐标,峰面积(y)为横坐标绘制肌苷标准曲线,得到标准曲线回归方程y=0.015 6x-5.943 9,相关系数R2为0.998 5。
HPLC条件:流动相为10%乙腈,柱温为30 ℃,流速为1 mL/min,紫外检测波长为254 nm,进样量为10 μL。
挑取不同诱变时间的单菌落,分别接种至装液量为10 mL/250 mL SOC液体培养基中,在37 ℃、200 r/min条件下振荡培养72 h。培养结束后,以3 000 r/min离心菌液并保留上清。上清液通过0.22 μm滤膜过滤2次,稀释至一定浓度后通过高效液相色谱法对发酵液中的肌苷产量进行检测,按照标准曲线回归方程计算样品中肌苷含量,筛选高产肌苷突变菌株。
1.3.3 全基因组重测序
参考细菌基因组DNA提取试剂盒说明书提取突变菌基因组DNA,采用Illumina Hiseq 2000测序平台完成全基因组重测序,使用FastQC对测序数据质量评估并使用Cutadapt清理低质量数据及接头序列,使用拼接软件elet1.2.10完成序列拼接。采用序列对比软件Mummer3.23将突变株的序列比对到枯草芽孢杆菌020的基因组序列上,使用Samtools与GATK的Unified Genotyper模块分析基因组,检测单碱基变异(single nucleotide variant,SNV)与插入缺失(insertion and deletion,InDel)。
1.3.4 prsA基因的克隆与载体构建
采用细菌基因组DNA提取试剂盒提取突变菌株S195的基因组DNA。设计特异性引物prsA-F/R扩增prsA基因,聚合酶链式反应(PCR)使用2×Phanta Master Mix体系。PCR扩增产物经凝胶电泳分离后回收纯化。以pHT43质粒为骨架(具有氨苄青霉素抗性),采用BamHI和XbaI双酶切处理获得线性化载体。利用无缝克隆试剂盒将prsA基因片段与线性化pHT43载体进行重组连接,连接产物转化至DH5α感受态细胞中,通过氨苄青霉素抗性平板筛选阳性克隆。挑取阳性单克隆,进行菌落PCR验证,获得重组表达载体pHT43-prsA。
1.3.5 枯草芽孢杆菌电转化
参照张爽等[15]的方法稍作修改,将获得重组表达载体pHT43-prsA导入枯草芽孢杆菌020宿主细胞中。配制电转化细胞缓冲液(含0.5 mol/L山梨醇、0.5 mol/L甘露醇、10%甘油)。将突变菌株S195接种至含0.5 mol/L山梨醇的装液量为50 mL/500 mL LB液体培养基中,37 ℃、180 r/min条件下振荡培养14 h。菌液置于冰中放置10 min,以5 000 r/min离心15 min收集菌体。将菌体用预冷的电转化缓冲液洗涤3次后,用含14%聚乙二醇6000的缓冲液重悬菌体,菌体终浓度应为109~2×1010 CFU/mL。电转化参数设置为电压2 000 V、电容25 μF、脉冲电阻200 Ω。转化后菌体在含0.5 mol/L山梨醇的LB液体培养基中复苏2 h,涂布于含50 μg/mL氨苄青霉素的LB平板,37 ℃培养24 h,筛选获得含有pHT43-prsA载体的枯草芽孢杆菌重组菌株S1951。
1.3.6 枯草芽孢杆菌重组菌发酵产肌苷测定
将保存的原始菌株020及1.3.5构建的重组菌株S1951分别划线接种于LB固体平板上,37 ℃培养24 h。挑取单菌落接种于装液量为50 mL/500 mL LB液体培养基中,于37 ℃、180r/min条件下振荡培养24h,得到一级种子液。按10%(V/V)的接种量,将一级种子液转接至装液量为50 mL/500 mL肌苷发酵培养基中,于37 ℃、110 r/min条件下振荡培养72 h,于10 000 r/min条件下离心5 min,收集上清液并稀释至相应倍数,采用高效液相色谱法测定肌苷含量。
1.3.7 数据处理与统计分析
每个试验均进行3次重复,结果以“平均值±标准差”表示,采用Primer 5.0进行引物设计,用Origin 2024作图。
2 结果与分析
2.1 枯草芽孢杆菌020常压室温等离子体诱变
诱变处理时长是决定微生物存活率和突变效率的关键参数。合理的诱变处理时长能够在保证较高致死率的同时,筛选出具有潜在优良性状的突变菌,为后续的菌株改良和应用研究奠定了坚实的基础[16-17]。枯草芽孢杆菌020经不同时间常压室温等离子体诱变后的致死曲线见图1。
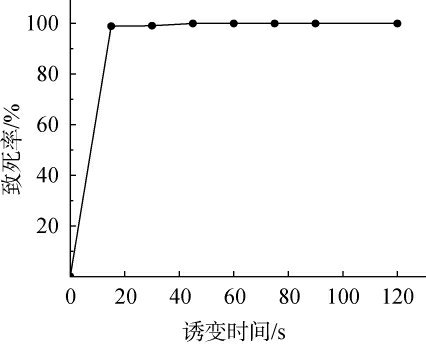
图1 常压室温等离子体诱变处理条件下枯草芽孢杆菌020致死率曲线
Fig.1 Mortality curve of Bacillus subtilis 020 under atmospheric and room temperature plasma mutagenesis treatment conditions
由图1可知,随着ARTP诱变处理时间的延长,枯草芽孢杆菌020菌体死亡率不断升高。当ARTP诱变当ARTP诱变处理时间达到15 s时,枯草芽孢杆菌020致死率高达98.90%;当ARTP诱变处理时间为30 s时,枯草芽孢杆菌020致死率上升至99.10%。因此,选择ARTP诱变处理时间为30 s。
2.2 高产肌苷的突变菌株筛选
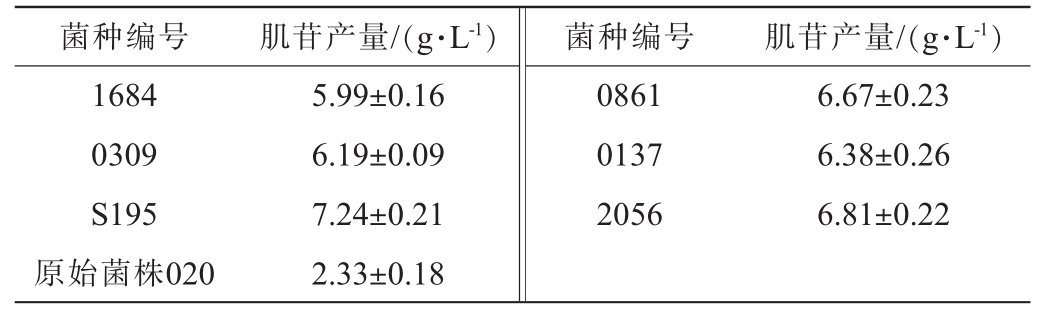
对原始菌株020及其通过诱变处理获得的2 732个突变菌株,进行肌苷产量HPLC检测,成功筛选出了158个肌苷产量显著增加的正突变菌株,正突变率达到了5.8%。在筛选出的正突变菌株中,有6株代表突变菌株表现尤为突出,其肌苷产量测定结果见表3。由表3可知,6株突变菌株(编号分别为1684、0309、S195、0861、0137、2056)肌苷产量均>6 g/L,远高于普通菌株,在发酵过程中具有显著的优势[9]。其中,突变菌株S195的表现最佳,其肌苷产量达到了7.24 g/L,较出发菌株020的肌苷产量提高了3.11倍,展现出优异、高效的发酵性能。因此,选择突变菌株S195进行下一步实验。
表3 代表突变菌株肌苷产量测定结果
Table 3 Determination results of inosine yield of representative mutant strains
菌种编号 肌苷产量/(g·L-1)菌种编号 肌苷产量/(g·L-1)1684 0309 S195原始菌株020 5.99±0.16 6.19±0.09 7.24±0.21 2.33±0.18 0861 0137 2056 6.67±0.23 6.38±0.26 6.81±0.22
2.3 突变菌株S195遗传稳定性
在工业化生产中,菌株的稳定性是确保产品质量和生产效率的关键因素之一[18]。为确保S195突变株的工业适用性,通过连续5代的传代培养实验,监测各代次菌株的产物积累情况,以评估S195突变株的遗传稳定性,结果见图2。由图2可知,突变菌株S195在各代次中均保持稳定的生长特性,肌苷产量为6.69~7.24 g/L。结果表明,突变菌株S195具有良好的遗传稳定性,这为后续的放大生产奠定了基础。
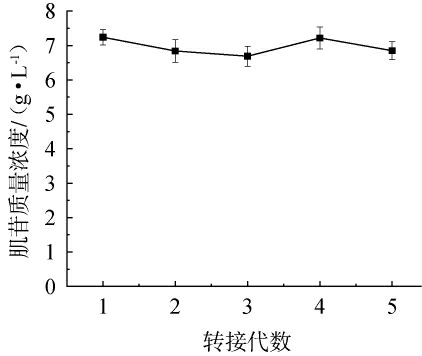
图2 突变菌株S195遗传稳定性实验结果
Fig.2 Results of genetic stability experiments of mutant strain S195
2.4 突变菌株S195全基因组重测序及突变位点分析
为深入探究突变菌株S195促进肌苷合成的分子机制,以原始菌株020的基因组作为参考基因组,对突变菌株S195进行了基因组重测序和突变位点分析。经过系统测序和比对分析,结果见表4。由表4可知,突变菌株S195在多个基因位点发生了突变,这些突变包括点突变和插入突变,但未检测到缺失突变。其中,编码磷酸核糖基转移酶的deoB发生了插入突变。磷酸核糖基转移酶是一种重要的酶,能够催化D-磷酸核糖转化为D-5-磷酸核糖,而D-5-磷酸核糖是合成核苷的核心物质补PRPP的前体[18]。此外,参与葡萄糖代谢与转运过程的glcP基因在突变菌株S195中也发生了插入突变。葡萄糖是细胞代谢的主要能量来源,其代谢过程的改变可能会对整个细胞的代谢网络产生连锁反应,进而影响到肌苷的合成[20]。尽管这一突变的具体影响机制尚需进一步研究,但它可能通过改变细胞的能量代谢状态或代谢中间产物的供应,间接影响肌苷的合成效率。
表4 S195突变位点分析
Table 4 Analysis of S195 mutation sites
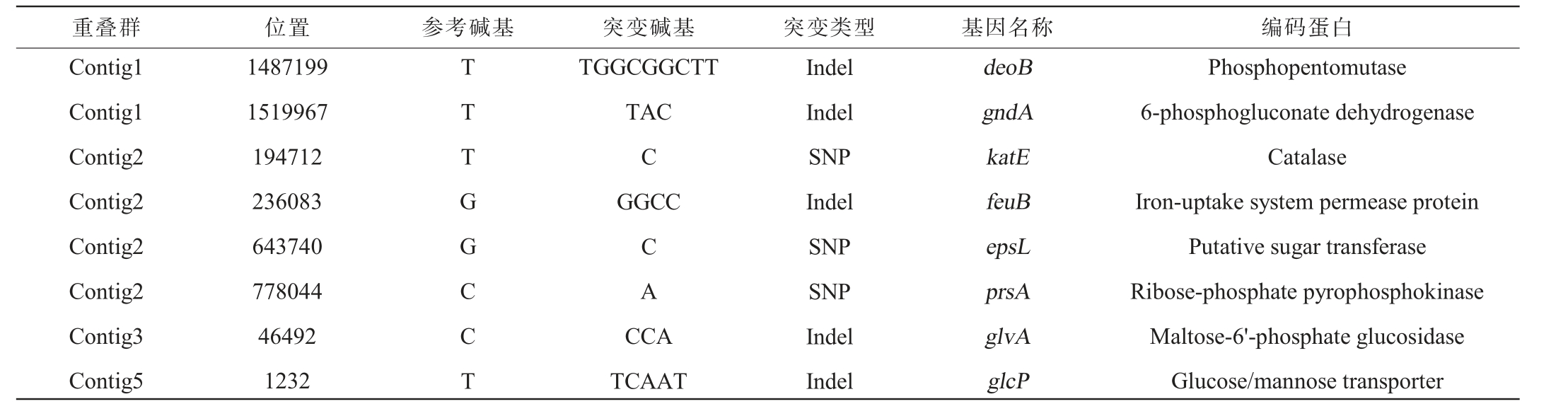
重叠群 位置 参考碱基 突变碱基 突变类型 基因名称 编码蛋白Contig1 Contig1 Contig2 Contig2 Contig2 Contig2 Contig3 Contig5 1487199 1519967 194712 236083 643740 778044 46492 1232 TTTGGCCT TGGCGGCTT TAC C GGCC CA CCA TCAAT Indel Indel SNP Indel SNP SNP Indel Indel deoB gndA katE feuB epsL prsA glvA glcP Phosphopentomutase 6-phosphogluconate dehydrogenase Catalase Iron-uptake system permease protein Putative sugar transferase Ribose-phosphate pyrophosphokinase Maltose-6'-phosphate glucosidase Glucose/mannose transporter
值得注意的是,在deoB基因下游负责编码磷酸核糖焦磷酸激酶的prsA基因发生了单碱基突变。该基因第344位的C碱基突变为A碱基,这一突变导致翻译后的氨基酸由丙氨酸变为天冬氨酸。磷酸核糖焦磷酸激酶是一种在核苷合成途径中起核心作用的酶,它能够催化PRPP的合成[21-23]。prsA基因的这种突变可能直接改变了PRPP的合成效率或代谢流向,从而对肌苷的合成产生了显著的促进作用。
2.5 过表达prsA基因重组菌株对肌苷产量的影响
鉴于prsA基因编码的磷酸核糖焦磷酸激酶直接催化生成肌苷合成的关键前体PRPP,在代谢网络中占据核心调控位点,本研究优先选择该基因作为代谢工程改造的靶点。为进一步阐明prsA基因在肌苷生物合成途径中的调控作用,构建了prsA基因过表达重组菌株。通过分子克隆技术,将来源于突变菌株S195的prsA基因插入到表达载体pHT43的多克隆位点,成功构建了pHT43-prsA表达载体。通过电转化技术将表达载体pHT43-prsA导入枯草芽孢杆菌宿主细胞中,获得含有pHT43-prsA载体的枯草芽孢杆菌重组菌株,命名为S1951。经菌株PCR产物电泳验证确认质粒构建的正确性,结果见图3。由图3可知,重组菌株S1951的prsA基因过表达PCR产物电泳在约950 bp位置出现单一明亮条带,与预期prsA基因片段大小(954 bp)完全吻合,且无任何非特异性扩增条带,表明插入片段长度正确、质粒构建成功。氨苄青霉素抗性平板筛选结果表明,电转化后的菌株在含50 mg/L氨苄青霉素的LB平板上能够正常生长并形成形态均一、边缘整齐的单菌落,进一步证实表达载体pHT43-prsA已成功导入宿主菌,成功获得了含有目的基因的重组菌株S1951。
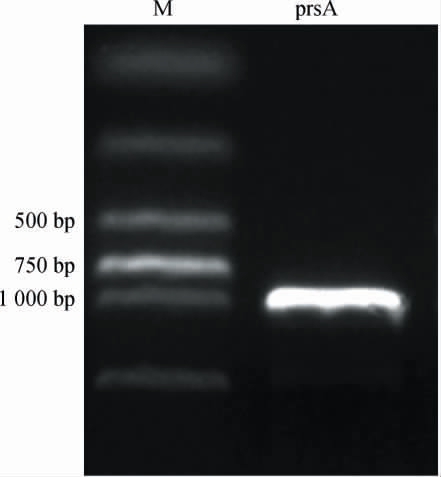
图3 prsA基因过表达聚合酶链式反应产物的电泳验证
Fig.3 Electrophoresis verification of polymerase chain reaction products of prsA gene overexpression
M 为DL2 000 DNA marker,prsA为磷酸核糖焦磷酸激酶基因。
2.6 重组菌株S1951发酵生产肌苷能力
肌苷发酵培养基的促进作用可能源于以下几个方面:①碳氮源配比优化。高浓度葡萄糖为肌苷合成提供了充足的碳骨架,而蛋白胨和酵母膏的合理搭配平衡了菌体生长与产物合成的需求[24]。②关键辅因子补充。维生素B族(B1、B3、B5、B12)的添加可能强化了嘌呤合成途径中相关酶的活性,其中维生素B1是转酮酶的辅因子,直接影响磷酸戊糖途径的通量[25]。③前体供应增强。次黄嘌呤作为肌苷的直接前体,能够通过反馈抑制的解除或代谢流再分配促进肌苷积累[25]。此外,柠檬酸钠可能通过调节三羧酸循环(tricarboxylic acid cycle,TCA)中间代谢物,间接支持嘌呤合成[27]。④理化条件改善。磷酸盐缓冲体系和硫酸镁的添加稳定了胞内pH与离子平衡,而尿素可以通过调节氮代谢效率进一步优化产物合成[11]。
为了评估prsA基因过表达重组菌株S1951对肌苷生物合成的影响,分别在SOC培养基、肌苷发酵培养基中对原始菌株020和重组菌株S1951进行了摇瓶发酵实验,培养条件为37 ℃、110 r/min,振荡培养72 h,考察重组菌株S1951发酵生产肌苷能力,结果见图4。由图4a可知,发酵72 h后,原始菌株020的肌苷产量为4.00 g/L,相较于SOC培养基中提升了71.67%。由图4b可知,过表达prsA基因的重组菌株S1951在优化培养基中发酵72 h后,肌苷产量为11.15 g/L,较020菌株在SOC培养条件中提高了4.79倍。
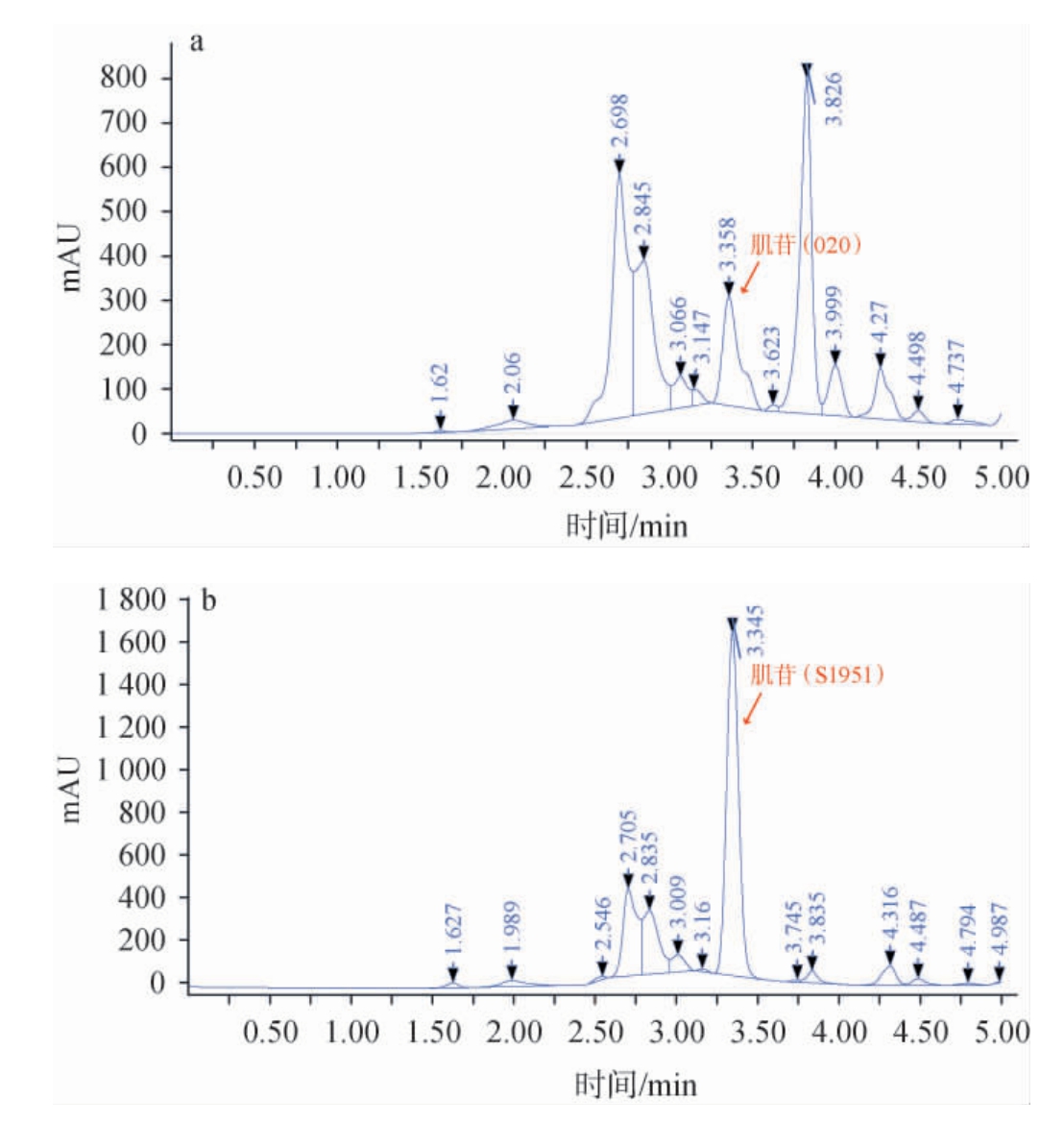
图4 原始菌株020(a)及重组菌株S1951(b)发酵产肌苷高效液相色谱图
Fig.4 High performance liquid chromatography of inosine produced by the original strain 020 (a) and the recombination strain S1951 (b) fermentation
结果表明,prsA基因的过表达能够显著增强肌苷的生物合成能力。作为嘌呤合成的限速酶,增强prsA基因编码的磷酸核糖焦磷酸激酶的表达,直接增加了PRPP的供应,而PRPP既是肌苷合成的前体,也是嘌呤途径的通用活化分子,能够全局提升代谢流。通过靶向改造中心代谢节点和优化培养条件,重组菌株S1951实现了产量跨越式提升,为后续放大发酵和工艺开发提供了可靠基础,也证实了理性遗传修饰在代谢途径调控中的高效性。
3 结论
本研究通过ARTP诱变技术对工业肌苷生产菌株枯草芽孢杆菌020进行改造,成功获得6株高产突变株,其中突变菌株S195肌苷产量最高,为7.24 g/L。全基因组重测序分析揭示了三个关键突变基因:deoB、glcP和prsA,这些基因分别参与磷酸核糖代谢、葡萄糖转运和PRPP合成,其中prsA基因编码的磷酸核糖焦磷酸激酶在肌苷合成途径中发挥着核心调控作用。通过构建prsA过表达重组菌株S1951并优化其发酵条件,其肌苷产量提升至11.15 g/L,较原始菌株020提高了4.79倍。这一结果不仅验证了增强PRPP供应是突破产量瓶颈的有效策略,也为工业菌株改造提供了新的分子靶点。
本研究构建的重组菌株S1951展现出良好的工业化应用潜力。未来研究可在现有成果基础上,进一步探索多基因协同调控策略,如结合deoB和glcP的改造来优化代谢网络;同时通过蛋白质工程技术对prsA进行定向进化,可能获得更高活性的酶变体。此外,开发与之配套的新型发酵工艺,如两阶段pH控制策略等,将有助于充分发挥重组菌株的生产潜力。
[1]刘铁重,高志强,侯德欣,等.大肠杆菌肌苷酸节点代谢优化高效合成肌苷[J].食品与发酵工业,2024,50(4):44-50.
[2]黎琪,李晓敏,姜德铭,等.高效液相色谱法检测熟制猪肉中呈味核苷酸[J].肉类研究,2022,36(3):26-31.
[3]孙鹏杰,余子辰,徐庆阳.B族维生素对枯草芽孢杆菌发酵生产腺苷的影响[J].中国酿造,2022,41(4):93-98.
[4]吴飞,史建明,谢希贤,等.鸟苷产生菌解淀粉芽孢杆菌的选育[J].天津科技大学学报,2010,25(2):1-4.
[5]古永红,付少虎,廖蓓,等.ARTP-MMC高通量筛选耐木质纤维素预处理抑制物酿酒酵母的研究[J].中国酿造,2024,43(9):99-104.
[6]闫更轩,刘伟,刘春燕,等.ARTP诱变选育高产腺苷菌株及发酵条件优化[J].中国调味品,2024,49(8):63-68.
[7]王国琴,任怡卓,张捷,等.ARTP诱变筛选增香、高产酒精的富硒酵母菌[J].食品工业科技,2024,45(18):146-156.
[8]朱彦凯,刘铁重,伍法清,等.代谢工程改造大肠杆菌生产肌苷[J].食品与发酵工业,2022,48(24):1-9.
[9]SHIMAOKA M,TAKENAKA Y,KURAHASHI O,et al.Effect of amplification of desensitized purF and prs on inosine accumulation in Escherichia coli[J].J Biosci Bioeng,2007,103(3):255-261.
[10]LIU M,FU Y,GAO W,et al.Highly effcient biosynthesis of hypoxanthine in Escherichia coli and transcriptome-based analysis of the purine metabolism[J].ACS Synth Biol,2020,9(3):525-535.
[11]ZHANG X, LIU L, MA C, et al.Improving the level of the cytidine biosynthesis in E.coli through atmospheric room temperature plasma mutagenesis and metabolic engineering[J].J Appl Microbiol, 2024,135(6):133.
[12]杨尚彤,肖安风,倪辉,等.枯草芽孢杆菌JMUKC2产肌苷摇瓶发酵培养基的优化[J].食品科学,2012,33(11):167-171.
[13]王国琴,任怡卓,张捷,等.ARTP诱变筛选增香、高产酒精的富硒酵母菌[J].食品工业科技,2024,45(18):146-156.
[14]秦心睿,聂晓兵,袁高阳,等.HPLC-FP法同时测定新品富硒竹笋中10种核苷类成分的含量[J].食品工业科技,2024,45(8):254-262.
[15]张爽,薛正莲,陈环,等.一种电击转化枯草芽孢杆菌方法的优化[J].重庆理工大学学报(自然科学版),2014,28(8):60-63,80.
[16]康竞艺,艾奕伶,刘秀霞,等.常压室温等离子体结合高通量筛选技术在微生物育种方面的研究进展[J].微生物学通报,2025,52(1):78-89.
[17]唐晨旻,张劲松,刘艳芳,等.常压室温等离子体诱变育种与微生物液滴培养筛选技术应用进展[J].微生物学通报,2022,49(3):1177-1194.
[18]CAO S, ZHOU X, JIN W, et al.Improving of lipid productivity of the oleaginous microalgae Chlorella pyrenoidosa via atmospheric and room temperature plasma(ARTP)[J].Bioresource Technol,2017,244:1400-1406.
[19]ZHOU M,LI Y,CAI Y,et al.Development of an inosine hyperproducer from Bacillus licheniformis by systems metabolic engineering[J].J Agr Food Chem,2023,71(50):20210-20221.
[20]LIU Y,ZHU Y,WANG H,et al.Strategies for enhancing microbial production of 2'-fucosyllactose,the most abundant human milk oligosaccharide[J].J Agr Food Chem,2022,70(37):11481-11499.
[21]SCHULTHEISZ H L,SZYMCZYNA B R,SCOTT L G,et al.Pathway engineered enzymatic de novo purine nucleotide synthesis[J].ACS Chem Biol,2008,3(8):499-511.
[22]ZHAO N,XU J,JIAO L,et al.Acid adaptive response of Alicyclobacillus acidoterrestris:A strategy to survive lethal heat and acid stresses[J].Food Res Int,2022,157:111364.
[23]范江涛,石海,白林霞,等.一种用于生产肌苷的基因工程菌及其构建方法与应用:CN117821349A[P].2024-04-05.
[24]马聪聪,马锐,王云山,等.地衣芽胞杆菌ACCC 01957产芽胞碳源组合研究[J].微生物学杂志,2024,44(4):40-47.
[25]孙亚丽,唐家琪,毛馨晨,等.植物维生素B1生物合成及生物强化的研究进展[J].安徽农业科学,2024,52(2):5-9,14.
[26]ZHAO S, SHI T, LI L, et al.The metabolic engineering of Escherichia coli for the high-yield production of hypoxanthine[J].Microb Cell Fact,2024,23(1):309.
[27]李志刚,张朝辉,谭海,等.辅助能量物质与谷胱甘肽协同作用促进环磷酸腺苷发酵生产[J].食品工业科技,2021,42(20):119-125.