中国白酒是以谷物为原料,在开放式环境下通过微生物群落的共同发酵,并经蒸馏、贮存、勾调而成。在此过程中的微生物群落演替规律深刻影响白酒的风味形成与最终品质[1],因此,解析微生物群落演替规律是优化传统酿造工艺的核心。随着高通量测序技术的发展,浓香、酱香、清香等香型白酒发酵过程中微生物群落的演变规律得到了研究[2-4]。且研究证实,白酒酿造过程中的微生物群落演替规律受区域、香型、季节、工艺及窖池空间位置等多重因素影响[5-8],其中季节性环境温度差异塑造了独特的气候环境,导致同区域同香型白酒发酵过程中优势微生物种类与演替速率发生改变[9],如浓香型白酒醅细菌群落的多样性在冬、夏季较高,而真菌群落在夏、秋季更突出,且季节对真菌群落的影响通常大于细菌群落[10],不同季节细菌群落结构也存在差异[11]。同时窖池内上、中、下层因氧气梯度、温度差和黄水渗透形成差异化的微生态位,驱动微生物演替路径分化[12-13]。
针对夏季高温易引发发酵异常的问题,绵柔型白酒采用压窖工艺(夏季停止生产入池,保持长期发酵状态)。该工艺不仅能有效规避夏季高温发酵风险,适度的长期压窖还有利于促进原酒风味物质的生产和积累,提升原酒品质[14]。绵柔型白酒夏季采用180 d超长期压窖缓慢发酵工艺,使酒醅与窖泥充分作用,实现有益微生物的驯化富集及风味物质的深度积累,最终形成“窖香突出、醇甜绵厚、回味悠长”风格的“绵柔头排”优质基酒。然而,目前对绵柔型白酒压窖发酵过程中多维度(尤其时间与空间)的微生物演替规律,以及窖池上、中、下三层酒醅微生物群落间的互作机制缺乏系统研究。
本研究以洋河绵柔型白酒夏季压窖窖池酒醅为研究对象,通过高通量测序技术结合多元统计分析系统揭示压窖过程中不同空间位置(上、中、下层)酒醅微生物群落的演替规律与互作机制,以期深入解析绵柔型白酒独特风味的微生物发酵基础,为优化酿造工艺、提升原酒品质提供关键理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酒醅样品:采集自洋河股份洋河基地窖龄10年的绵柔型白酒夏季压窖窖池。
1.1.2 试剂
DNeasy PowerSoil Pro Kit:凯杰企业管理(上海)有限公司;AMPPure XP:美国贝克曼公司;KAPA HiFi HotStart ReadyMix:罗氏诊断产品(上海)有限公司。
1.2 仪器与设备
QubitTM 4蛋白核酸荧光定量仪、Veriti聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Thermo Fisher Scientific公司;Qsep1生物碎片分析仪:光鼎生物科技(江苏)有限公司;Miseq高通量测序仪:美国Illumina公司;H3-16KR台式高速冷冻离心机:湖南可成仪器设备有限公司。
1.3 方法
1.3.1 酒醅取样方法
随机选取洋河股份洋河基地绵柔型窖龄10年的窖池3口,分别从下层(距窖底约0.5 m,X)、中层(距窖底约1 m,Z)、上层(距窖池顶部约0.5 m,S)按照发酵时间0 d(入池)、3 d、7 d、10 d、15 d、21 d、28 d、37 d、58 d、70 d、180 d(出池)进行取样,样品充分混匀,于-80 ℃冰箱中保存备用。
1.3.2 酒醅微生物群落多样性分析
脱氧核糖核酸(deoxyribonucleic acid,DNA)提取与质控:采用DNeasy PowerSoil Pro Kit提取酒醅样品(约5 g)微生物群落的总基因组DNA,使用1%琼脂糖凝胶电泳检测DNA的完整性,通过QubitTM 4荧光计和Qsep1生物片段分析仪检测提取基因组DNA的浓度并验证片段大小(主条带>15 kb),将合格的基因组DNA于-20 ℃下保存备用。
PCR扩增与文库构建:以提取的基因组DNA为模板,采用引物338F(5'-ACTCCTACGGGAGGCAGCA-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')PCR 扩 增 细 菌 菌群的16S rDNA V3-V4区基因序列[15];采用引物ITS3F(5'-GCATCGATGAAGAACGCAGC-3')和ITS4R(5'-TCCTCCGCTTATTGATATGC-3')PCR扩增真菌菌群的ITS2区基因序列[16]。PCR扩增体系(25 μL):2.5 μL样品DNA、0.5 μL(10 μmol/L)引物、12.5 μL 2×KAPA HiFi HotStart ReadyMix,9 μL三羟甲基氨基甲烷-乙二胺四乙酸(tris-ethylene diamine tetraacetic acid,TE)缓冲液(pH 8.0)。PCR扩增条件:95 ℃预变性3 min,循环扩增25次(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),72 ℃最终延伸5 min,4 ℃保存。PCR扩增产物经AMPPure XP磁珠纯化后,进行加接头index PCR、二次磁珠纯化及浓度均一化,构建双端测序文库。
高通量测序:在Illumina MiSeq平台上进行2×300 bp双端测序(600 cycles),产出序列。
1.3.3 生物信息学分析
使用Fastp(v0.20.1)进行质控,即切除低质量碱基(Q<20)、接头及短读长(<150 bp)[17]。采用QIIME2(v2021.2)修剪引物。利用DADA2管道去噪、去嵌合体并生成扩增子序列变异体(amplicon sequence variants,ASV)[18]。细菌ASV基于SILVA(v138)数据库分类[19],真菌ASV基于UNITE(v28)数据库分类[20]。使用QIIME2软件计算样本丰度与α多样性指数。
1.3.4 数据处理与统计分析
采用R语言进行数据分析,采用单因素方差分析(analysis of variance,ANOVA)和Duncan多重比较检验进行α多样性指数差异显著性分析;采用ggplot2、ggalluvial包绘制物种相对丰度堆积柱状冲击图;采用Spearman进行相关系数|ρ|计算,生成节点、边数据,使用Gephi软件(v0.10.1)绘制微生物互作网络图。
2 结果与分析
2.1 绵柔型白酒窖池夏季压窖发酵过程中各层酒醅细菌菌群多样性分析
2.1.1 细菌菌群α多样性分析
绵柔型白酒窖池夏季压窖发酵过程中,各层酒醅细菌群落的Good's coverage指数值均≥0.99(其中压窖15 d下层酒醅的Good's coverage指数值为0.99±0.01,其余样品的Good's coverage指数值均为0.99),表明测序深度合理,能够充分的反映绵柔型白酒窖池夏季压窖发酵过程中各层酒醅细菌群落结构。基于此,对绵柔型白酒窖池夏季压窖发酵过程中各层酒醅的细菌菌群进行α多样性分析,结果见表1。
表1 绵柔型白酒窖池夏季压窖发酵过程中各层酒醅细菌菌群α多样性分析结果
Table 1 Analysis results of α-diversity of bacterial flora in each layer of fermented grains during the extended-period pit fermentation of
Mianrou-flavor Baijiu in summer

注:/前不同字母表示同列数据间差异显著(P<0.05),/后不同字母表示相同时间同一指标差异显著(P<0.05)。下同。
指数 发酵时间/d 上层酒醅中层 下层0 3 7 1 0 Chao1指数15 21 28 37 58 70 180 0 3 7 1 0 Shannon指数15 21 28 37 58 70 180 1 554.06±140.62cd/a 1 114.14±103.01ef/b 1 646.11±136.80c/a 957.68±111.34f/b 1 489.11±130.24cd/a 1 351.90±114.72de/a 2 079.88±163.66b/a 2 368.41±195.87a/a 1 676.10±161.43c/a 2 217.04±189.73ab/a 1 618.12±152.52cd/a 4.86±0.44d/a 3.24±0.82f/b 6.03±0.50bc/a 0.87±0.10h/b 1.58±0.35gh/a 2.11±0.18g/b 4.76±0.41de/a 5.42±0.57cd/a 6.66±0.50ab/a 6.98±0.63a/a 3.89±0.52ef/a 1 119.04±84.50cd/b 1 575.20±145.22b/a 1 505.41±149.52b/a 1 470.98±112.83b/a 1 631.00±166.09b/a 1 550.46±124.49b/a 1 165.13±89.73c/b 1 645.32±138.50b/b 1 895.91±165.45a/a 1 918.22±162.25a/ab 863.17±77.22d/b 5.44±0.45ab/a 5.24±0.72abc/a 5.18±0.61abc/a 2.08±0.26de/a 1.80±0.31de/a 2.53±0.21d/a 2.39±0.20d/b 4.73±0.91bc/a 4.36±0.40c/b 6.10±0.81a/a 1.32±0.51e/c 1 189.13±159.38de/b 1 414.20±133.84cd/a 1 525.89±128.72bc/a 1 164.88±117.75e/b 576.17±74.00f/b 1 041.45±86.06e/b 1 201.17±93.79de/b 1 515.20±131.66bc/b 1 863.52±128.50a/a 1 864.26±135.49a/b 1 726.25±180.73ab/a 5.52±0.59a/a 2.84±0.30b/b 5.04±0.65a/a 0.83±0.10de/b 0.23±0.03e/b 1.24±0.04d/c 2.05±0.16c/b 3.04±0.31b/b 3.26±0.34b/c 4.93±0.49a/b 2.81±0.47b/b
由表1可知,发酵过程中,上、中、下层酒醅细菌群落的Chao1指数(丰富度)分别为957.68~2 368.41、863.17~1 918.22、576.17~1 864.26,整体上,发酵0~70 d,Chao1指数呈波动上升趋势,并于28~37 d显著上升(P<0.05),出池时(180 d)显著下降(P<0.05);上、中、下层酒醅细菌群落的Shannon指数(多样性)分别为0.87~6.98、1.32~6.10、0.23~5.52,整体上,发酵0~10 d,Shannon指数值波动较大(在7 d出现峰值),发酵10~70 d持续上升(在70 d出现峰值),发酵28~37 d显著上升(P<0.05),至出池时显著下降(P<0.05)。与浓香型白酒常规发酵过程细菌物种丰富度与多样性先升高后下降[2,21]及汾香型热季酒醅的先下降后上升[22]趋势存在明显差异。
绵柔型白酒窖池夏季压窖发酵过程中酒醅细菌菌群的丰富度与多样性在发酵28~37 d显著上升(P<0.05),表明细菌群落进入新的活跃阶段。各层酒醅细菌物种丰富度与多样性均在发酵58~70 d达到峰值,且发酵28 d起上层酒醅细菌群落的丰富度与多样性普遍显著高于中、下层(P<0.05),这一现象可能与绵柔型白酒独特的压窖工艺及窖内环境存在显著的分层效应有关[13]。
2.1.2 细菌群落结构分析
基于门水平绵柔型白酒窖池夏季压窖发酵过程中各层酒醅细菌相对丰度见图1。由图1可知,从绵柔型白酒窖池夏季压窖发酵过程的酒醅中共鉴定出54个细菌门,其中6个细菌门的平均相对丰度>1%,分别为厚壁菌门(Firmicutes)(66.45%)、变形菌门(Proteobacteria)(19.13%)、拟杆菌门(Bacteroidota)(8.19%)、螺旋体门(Spirochaetota)(1.70%)、放线菌门(Actinobacteriota)(1.61%)、绿弯菌门(Chloroflexi)(1.10%)。在门水平上,绵柔型白酒窖池夏季压窖过程中酒醅细菌群落呈规律性时空演替:发酵前期(0~7 d)变形菌门占优势(平均相对丰度为46.94%),发酵中后期(10~180 d)厚壁菌门成为绝对优势细菌门,其平均相对丰度随窖池深度逐渐递增(上、中、下层平均相对丰度分别为70.07%、74.69%、86.16%),变形菌门、拟杆菌门相对丰度呈回升趋势。与已有研究发酵中后期厚壁菌门单一主导(平均相对丰度>90%)的群落结构[2,21-22]不同,本研究观测到厚壁菌门未形成绝对垄断(平均相对丰度为76.97%)。
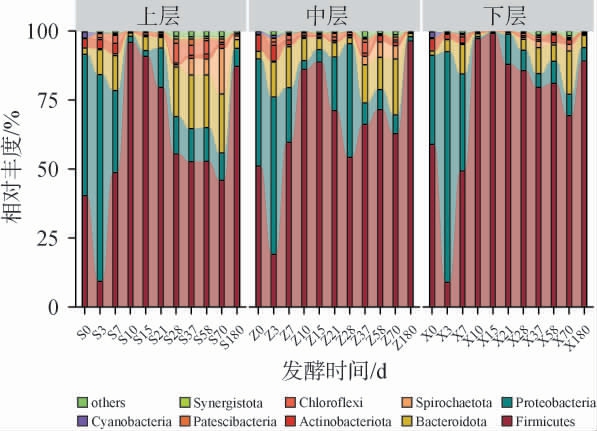
图1 基于门水平绵柔型白酒窖池夏季压窖发酵过程中各层酒醅细菌群落结构
Fig.1 Bacterial community structure of the fermented grains in each layer during the extended-period pit fermentation of Mianrouflavor Baijiu in summer at the phylum level
基于属水平绵柔型白酒窖池夏季压窖发酵过程中各层酒醅细菌相对丰度见图2。由图2可知,从绵柔型白酒窖池夏季压窖发酵过程的酒醅中共鉴定出1 070个细菌属,其中7个细菌属的平均相对丰度>1%,分别为乳酸杆菌属(Lactobacillus)(54.50%)、醋酸杆菌属(Acetobacter)(13.65%)、未定义菌属(uncultured)(4.00%)、普氏菌属(Prevotella)(1.75%)、芽孢杆菌属(Bacillus)(1.64%)、密螺旋体属(Treponema)(1.57%)、己酸菌属(Caproiciproducens)(1.42%)。发酵前期(0~7 d),各层酒醅均以醋酸杆菌属(平均相对丰度为36.20%)为优势菌协同乳酸杆菌属、普氏菌属、芽孢杆菌属等发酵,其中醋酸杆菌属的相对丰度呈先升高后下降的趋势(发酵3 d时达到峰值),其他菌属相对丰度先下降后升高;发酵前期乳酸杆菌属与醋酸杆菌属协同发酵可以产生以乙酸、乳酸为主的多种风味物质及其前体物质,为原酒风味物质的形成奠定良好的基础[11]。发酵10~15 d窖内产生的酸类物质影响非耐酸菌群的生长繁殖,加之该阶段酒醅中氧气含量减少,抑制了好氧微生物的生长繁殖[23],各层酒醅中乳酸杆菌属均为绝对优势菌属,其平均相对丰度达到91.00%。发酵21~70 d,细菌菌群多样性较前期(10~15 d)增加,与常规发酵排次形成以乳酸杆菌属为绝对优势菌的发酵规律不同[2,12,24-26];各层酒醅发酵规律有明显差异,上层酒醅中乳酸杆菌属、醋酸杆菌属的相对丰度逐渐降低,未知菌属、密螺旋菌属、己酸菌属、嗜蛋白菌属(Proteiniphilum)、氢孢菌属(Hydrogenispora)、理研菌属(Petrimonas)等厌氧性菌属相对丰度逐渐增加,呈现多菌协同发酵;中、下层均以乳酸杆菌属为主要优势菌(平均相对丰度为63.17%),协同上述厌氧性优势菌属共同发酵。其中,发酵21~28 d时,各层酒醅中醋酸杆菌属的相对丰度明显增加(平均相对丰度为15.78%),后期相对丰度明显降低,分析原因可能是压窖工艺(减壳控氧、低温柔熟、缓慢发酵)导致发酵中后期乙酸含量显著增加[27],而醋酸杆菌具有良好的耐乙酸特性[4],促进其二次活跃。出池时,乳酸杆菌属的相对丰度(上层65.63%、下层76.24%)低于一些其他香型白酒常规发酵出池酒醅(平均相对丰度>90.00%)[24-26]。绵柔型白酒窖池夏季压窖发酵过程中,乳酸杆菌属在发酵后期的绝对优势地位被打破,乳酸杆菌属属于乳酸菌,可产生乳酸、乙酸,有效抑制杂菌生长,维持窖内微生态稳定;但酸过量积累,会导致酒醅中pH下降,可能导致原酒出现酸、涩、馊等异杂味[22];因此,压窖工艺通过调控细菌菌群结构,适当减少乳杆菌属相对丰度,增加醋酸杆菌属、芽孢杆菌属、己酸菌属等菌属相对丰度,促进更丰富风味物质的形成,有助于绵柔型酒体绵甜爽净的独特风格。
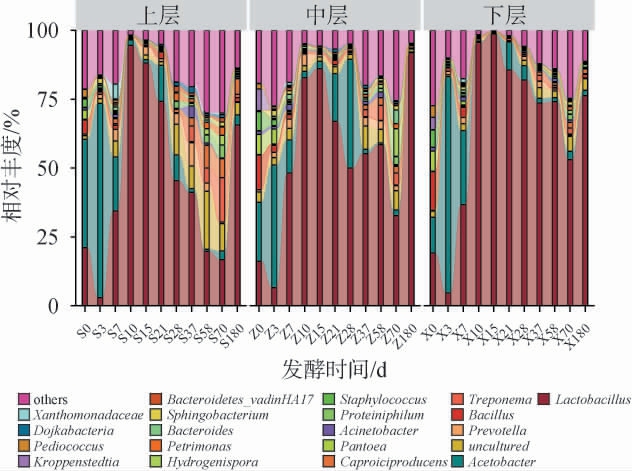
图2 基于属水平绵柔型白酒窖池夏季压窖发酵过程中各层酒醅细菌群落结构
Fig.2 Bacterial community structure of the fermented grains in each layer during the extended-period pit fermentation of Mianrouflavor Baijiu in summer at the genus level
2.2 绵柔型白酒窖池夏季压窖发酵过程中各层酒醅真菌菌群多样性分析
2.2.1 真菌菌群α多样性分析
绵柔型白酒窖池夏季压窖发酵过程中,各层酒醅真菌群落的Good's coverage指数值均为1,说明测序深度合理,能够真实反映绵柔型白酒窖池夏季压窖发酵过程中各层酒醅真菌群落结构。基于此,对绵柔型白酒窖池夏季压窖发酵过程中各层酒醅的真菌菌群进行α多样性分析,结果见表2。
表2 绵柔型白酒窖池夏季压窖发酵过程中各层酒醅真菌菌群α多样性分析结果
Table 2 Analysis results of α-diversity of fungal flora in each layer of fermented grains during the extended-period pit fermentation of Mianrou-flavor Baijiu in summer
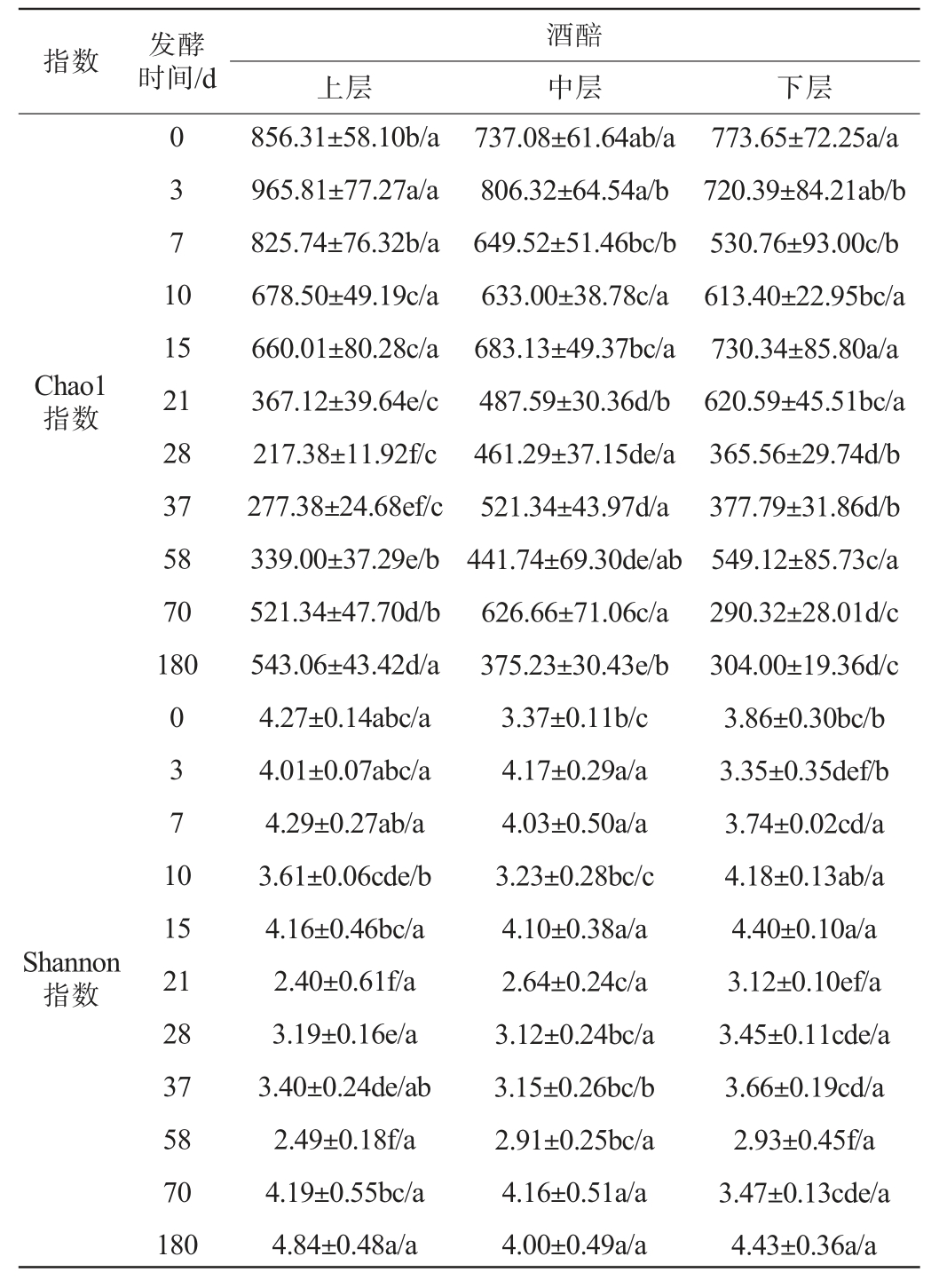
指数 发酵时间/d 上层酒醅中层 下层0 3 7 1 0 Chao1指数15 21 28 37 58 70 180 0 3 7 1 0 Shannon指数15 21 28 37 58 70 180 856.31±58.10b/a 965.81±77.27a/a 825.74±76.32b/a 678.50±49.19c/a 660.01±80.28c/a 367.12±39.64e/c 217.38±11.92f/c 277.38±24.68ef/c 339.00±37.29e/b 521.34±47.70d/b 543.06±43.42d/a 4.27±0.14abc/a 4.01±0.07abc/a 4.29±0.27ab/a 3.61±0.06cde/b 4.16±0.46bc/a 2.40±0.61f/a 3.19±0.16e/a 3.40±0.24de/ab 2.49±0.18f/a 4.19±0.55bc/a 4.84±0.48a/a 737.08±61.64ab/a 806.32±64.54a/b 649.52±51.46bc/b 633.00±38.78c/a 683.13±49.37bc/a 487.59±30.36d/b 461.29±37.15de/a 521.34±43.97d/a 441.74±69.30de/ab 626.66±71.06c/a 375.23±30.43e/b 3.37±0.11b/c 4.17±0.29a/a 4.03±0.50a/a 3.23±0.28bc/c 4.10±0.38a/a 2.64±0.24c/a 3.12±0.24bc/a 3.15±0.26bc/b 2.91±0.25bc/a 4.16±0.51a/a 4.00±0.49a/a 773.65±72.25a/a 720.39±84.21ab/b 530.76±93.00c/b 613.40±22.95bc/a 730.34±85.80a/a 620.59±45.51bc/a 365.56±29.74d/b 377.79±31.86d/b 549.12±85.73c/a 290.32±28.01d/c 304.00±19.36d/c 3.86±0.30bc/b 3.35±0.35def/b 3.74±0.02cd/a 4.18±0.13ab/a 4.40±0.10a/a 3.12±0.10ef/a 3.45±0.11cde/a 3.66±0.19cd/a 2.93±0.45f/a 3.47±0.13cde/a 4.43±0.36a/a
由表2可知,发酵过程中,真菌菌群的Chao1指数整体呈先上升后波动下降趋势,发酵21 d时显著下降(P<0.05);这种先上升后下降的趋势与邱显平等[28]研究结果相似。各层酒醅真菌菌群的Shannon指数变化趋势基本一致,发酵0~15 d时波动较小(3.23~4.40),发酵21 d时显著降低(P<0.05),维持较低水平至58 d,发酵70 d至出池期间显著回升(P<0.05);这与邱显平等[28]研究的先上升后下降再上升以及肖辰等[29]报道的小幅波动规律均存在差异。
空间分布上,发酵3~7 d上层酒醅的真菌菌群Chao1指数显著高于中、下层(P<0.05),而发酵21~37 d,中、下层显著高于上层(P<0.05),其他时间各层酒醅Chao1指数峰值在各层不断变化;各层酒醅中真菌菌群的多样性差异较小。出现丰富度的空间差异主要归因于窖内的氧气梯度:发酵初期,窖内溶氧尚可支持上层好氧真菌的较快生长;随着发酵进行,溶氧量持续降低,导致中、下层厌氧真菌逐渐占据优势;其他时间各层丰富度峰值的动态变化,可能与不同层间微生物竞争、环境因素波动和营养物质再分配有关[13,30]。而各层酒醅间真菌菌群多样性差异较小可能与微生物迁移、窖池环境趋同以及核心群落存在有关。
2.2.2 真菌群落结构分析
基于门水平绵柔型白酒窖池夏季压窖发酵过程中各层酒醅真菌相对丰度见图3。由图3可知,从绵柔型白酒窖池夏季压窖发酵过程的酒醅中共鉴定出6个真菌门,其中3个真菌门的平均相对丰度>1%,分别为子囊菌门(Ascomycota)(81.19%)、担子菌门(Basidiomycota)(10.28%)、毛霉门(Mucoromycota)(7.03%)。发酵过程中各层酒醅真菌门变化规律一致:子囊菌门是主要优势真菌门(上、中、下层酒醅中相对丰度分别为58.32%~96.86%、61.40%~94.82%、60.13%~96.30%);发酵过程中毛霉门相对丰度逐渐减小,担子菌门相对丰度则呈递增趋势;这与部分研究中子囊菌门在整个发酵过程相对丰度>90.00%不同[2,22],揭示绵柔型白酒窖池夏季压窖发酵过程具有独特的真菌群落结构特征。
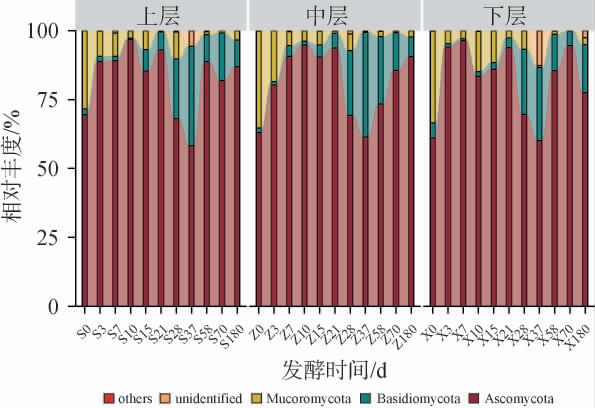
图3 基于门水平绵柔型白酒窖池夏季压窖发酵过程中各层酒醅真菌群落结构
Fig.3 Fungal community structure of the fermented grains in each layer during the extended-period pit fermentation of Mianrouflavor Baijiu in summer at the phylum level
基于属水平绵柔型白酒窖池夏季压窖发酵过程中各层酒醅真菌相对丰度见图4。由图4可知,从绵柔型白酒窖池夏季压窖发酵过程的酒醅中共鉴定出192个真菌属,其中9个真菌属的平均相对丰度>1%,分别为未定义菌属(unidentified)(26.00%)、毕赤酵母属(Pichia)(25.72%)、嗜热真菌属(Thermomyces)(8.64%)、哈萨克斯坦酵母属(Kazachstania)(8.37%)、丝孢酵母属(Trichosporon)(7.50%)、根霉菌属(Rhizopus)(5.75%)、曲霉菌属(Aspergillus)(4.82%)、酵母属(Saccharomyces)(3.06%)、威克汉姆酵母属(Wickerhamomyces)(1.29%)。压窖发酵过程中各层酒醅真菌群落结构较为相似,入池酒醅优势真菌属主要有嗜热真菌、根霉菌属(相对丰度之和>51.22%),嗜热真菌属与根霉菌属能够代谢产生纤维素酶、蛋白酶和淀粉酶等酶类,降解原料中的大分子多糖和蛋白质,从而促进发酵过程中微生物的生长及香味物质的生成[22,31]。发酵3~15 d各层酒醅中主要真菌属为未定义菌属、毕赤酵母属、嗜热真菌属、哈萨克斯坦酵母属(相对丰度之和>65.63%),毕赤酵母属和哈萨克斯坦酵母属能够利用葡萄糖代谢产生酯、酸、醛及高级醇等风味物质[28,31]。发酵21 d时各层酒醅真菌群落结构发生明显变化:嗜热真菌属和哈萨克斯坦酵母属相对丰度明显减少,发酵21~70 d各层酒醅真菌群落转为以未定义菌属、毕赤酵母属、丝孢酵母属为主。丝孢酵母属(耐酸耐酒精)在此阶段相对丰度增加,其与有机酸、乙醇和果香类物质的生成有关[31-32]。出池时,各层酒醅真菌菌群结构差异显著,上层酒醅真菌菌群以嗜热真菌属、曲霉属、威克汉姆酵母属和枝孢霉属(Cladosporium)为主(相对丰度之和>52.53%),中层酒醅真菌菌群主要为毕赤酵母属和哈萨克斯坦酵母属(相对丰度之和>60.76%),下层酒醅真菌菌群主要为曲霉属、威克汉姆酵母属和德克酵母属(Dekkera)(相对丰度之和>45.91%)。曲霉属多为糖化菌,代谢产物包括乙酸乙酯、乳酸乙酯、琥珀酸等风味物质[33],威克汉姆酵母属能提升原酒中乙酸乙酯、乳酸乙酯和β-苯乙醇的含量[31],枝孢霉属可产生乙酸乙酯、吡啶、1,3-丁二醇、邻苯二甲酸二乙酯等风味物质[34],德克酵母属与白酒有机酸、乙醇、己酸乙酯、乙酸乙酯、乳酸乙酯含量呈正相关[35],各层酒醅发酵后期至出池酒醅微生物群落差异明显,可能是形成绵柔型头排白酒复杂多层次风味特征的重要基础。
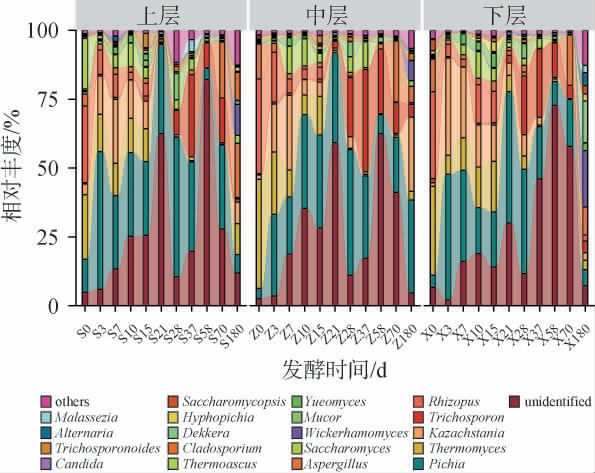
图4 基于属水平绵柔型白酒窖池夏季压窖发酵过程中各层酒醅真菌群落结构
Fig.4 Fungal community structure of the fermented grains in each layer during the extended-period pit fermentation of Mianrouflavor Baijiu in summer at the genus level
前期研究已证实不同香型、不同区域酒醅发酵过程真菌群落变化各不相同,如肖辰等[29]研究发现,浓香白酒发酵过程中哈萨克斯坦酵母属相对丰度迅速增加,后期保持在78.00%以上,曲霉属相对丰度从初始的38.05%快速下降,后期保持稳定(<6.00%);刘凡等[27]研究发现,嗜热真菌属、嗜热子囊菌属和根毛霉属是浓香型白酒酒醅中的优势真菌属;汾香型白酒冷季以覆膜孢酵母属、曲霉属为主,热季以覆膜孢酵母属和伊萨酵母属为主[22];芝麻香型白酒酒醅发酵过程中主要真菌菌群为毕赤酵母属、酵母属和曲霉属,发酵0~20 d相对丰度逐渐降低,发酵30 d相对丰度增加;酵母属和曲霉属发酵前10 d相对丰度逐渐增加,中后期保持小幅度变化[3]。这些研究表明,白酒的香型、地域以及季节等因素对发酵过程中的真菌群落结构具有显著影响,是导致不同白酒最终风味特征差异的重要因素之一。
2.3 微生物群落间互作机制
取压窖发酵过程中各层酒醅中相对丰度>1%的46个细菌属与34个真菌属(均排除未定义菌属)为主要优势微生物对压窖发酵过程中各层酒醅中的微生物群落进行Spearman相关性分析。筛选出菌属间显著相关(|ρ|>0.70且P<0.05)的关系,构建网络图,结果见图5。由图5可知,上层酒醅微生物网络中包含有73个节点(细菌60.27%,真菌39.73%)和300个边(80.00%正相关,20.00%负相关);中层酒醅微生物网络中包含67个节点(细菌62.69%,真菌37.31%)和202个边(77.23%正相关,22.77%负相关);下层酒醅微生物网络中包含69个节点(细菌62.32%,真菌37.68%)和304个边(78.95%正相关,21.05%负相关);上层和下层酒醅微生物的网络连接数(边数)均高于中层,表明这两层微生物群落内部的互作关系更复杂。
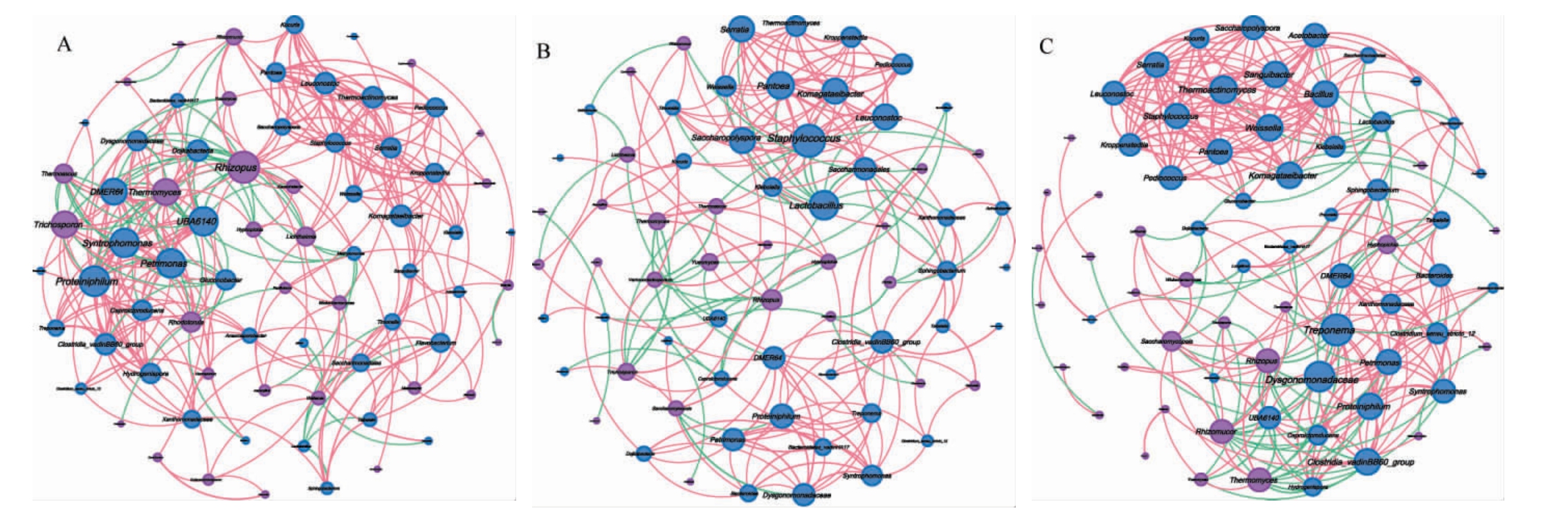
图5 各层酒醅细菌与真菌菌群Spearman相关性分析结果
Fig.5 Spearman correlation analysis between bacterial and fungal communities in each layer of fermented grains
蓝色节点代表细菌,紫色节点为真菌;红色边线代表正相关,绿色边线代表负相关。A代表上层,B代表中层,C代表下层。
各层酒醅微生物网络中,细菌菌群间的互作关系普遍比真菌菌群紧密,且细菌节点主要形成两个内部显著正相关的菌群:醋酸杆菌属、芽孢杆菌属、克罗彭斯特菌属(Kroppenstedtia)、泛菌属(Pantoea)、葡萄球菌属(Staphylococcus)、明串珠菌属(Leuconostoc)、片球菌属(Pediococcus)、魏斯氏菌属(Weissella)等为大曲中优势细菌群(简称大曲细菌群)[23,36],氢孢菌属、己酸菌属、norank_o_Clostridia_vadinBB60_group、理研菌属、嗜蛋白菌属、DMER64等为窖泥中优势细菌群(简称窖泥细菌群)[37]。根霉菌属、嗜热真菌属、月菌属(Yueomyces)、复膜孢酵母属(Saccharomycopsis)、生丝毕赤酵母属(Hyphopichia)、嗜热子囊菌属(Thermoascus)、根毛霉属(Rhizomucor)、横梗霉属(Lichtheimia)等为大曲中优势真菌群(简称大曲真菌群)[23,36],大曲真菌群与大曲细菌群呈显著正相关(P<0.05),与窖泥细菌群呈显著负相关(P<0.05)。大曲真菌、细菌菌群在酒醅发酵前、中期发挥关键作用:真菌分泌蛋白酶、淀粉酶分解原料中的淀粉与蛋白质,为微生物生长提供碳源和氮源[22,31];细菌代谢产生的有机酸降低环境的pH,抑制杂菌生长,可为真菌创造适宜的环境[11]。相比之下,发酵后期窖泥中的厌氧菌群与大曲真菌群存在生态位重叠与资源竞争(碳、氮源),两者呈负相关。上层网络中真菌菌群间及真菌与细菌菌群间互作关系较中、下层更为紧密。下层酒醅直接接触窖泥,其细菌(尤其窖泥细菌群)间互作联系较上、中层更紧密。
3 结论
本研究通量测序技术系统揭示了绵柔型白酒窖池夏季压窖发酵过程中上、中、下三层酒醅微生物群落的时空动态、演替规律。结果表明,发酵28~37 d各层酒醅细菌群落的丰富度、多样性显著上升(P<0.05),出池时显著下降(P<0.05),发酵28 d起上层酒醅的丰富度与多样性普遍显著高于中、下层(P<0.05);细菌菌群以乳酸杆菌属(Lactobacillus)(平均相对丰度54.50%)为优势菌协同多菌属发酵,发酵21~28 d醋酸杆菌属(Acetobacter)出现二次活跃期(平均相对丰度15.78%)。各层酒醅真菌群落的丰富度、多样性在发酵21 d时显著下降(P<0.05),出池时多样性显著回升(P<0.05),真菌菌群以毕赤酵母属(Pichia)、嗜热真菌属(Thermomyces)、哈萨克斯坦酵母属(Kazachstania)、丝孢酵母属(Trichosporon)(平均相对丰度7.50%~25.72%)等协同发酵,出池时各层酒醅真菌菌群差异较大。独特的菌群结构与演变规律为形成绵柔型白酒丰富协调和“窖香突出、醇甜绵厚、回味悠长”典型风味提供了微生物学基础。进一步通过多元统计分析揭示绵柔型白酒窖池夏季压窖发酵过程中上、中、下三层酒醅微生物群落的互作机制,结果发现,微生物间互作以正相关为主(77.23%~80.00%),上、下层互作网络较中层更复杂;酒醅中大曲优势真菌群与大曲优势细菌群间呈显著正相关(P<0.05),而与酒醅中窖泥优势细菌群呈显著负相关(P<0.05)。本研究结果为精准调控绵柔型白酒发酵工艺、定向优化微生物群落结构以进一步提升原酒风味品质提供了重要的科学依据。未来研究可结合宏转录组和代谢组学技术,进一步聚焦窖内菌群的代谢活性及其对特征风味物质合成的直接贡献机制。
[1]XU Y,ZHAO J,LIU X, et al.Flavor mystery of Chinese traditional fermented Baijiu:The great contribution of ester compounds[J].Food Chem,2022,369:130920.
[2]曾波,饶家权,邹永芳,等.浓香型白酒酒醅发酵过程中微生物群落结构演替及其与理化指标相关性[J].食品科学,2024,45(7):111-118.
[3]李小龙.芝麻香型白酒发酵过程微生物群落演替及其驱动因素[D].无锡:江南大学,2018.
[4]万旗钰,程玉鑫,黄永光,等.酱酒1、2轮次窖池不同醅层微生态结构与酸性化合物组成解析及其相关性预测[J].食品科学,2024,45(4):88-95.
[5]相里加雄,曹苗文,杨凯环,等.清香型白酒不同酿造工艺下环境微生物群落结构差异[J].酿酒,2022,49(1):118-123.
[6]符长彪,明红梅,张宿义,等.机械化与传统酿造方式下浓香型白酒酿造环境微生物群落结构对比分析[J].食品与发酵工业,2023,49(4):145-153.
[7]王欢,席德州,黄永光,等.酱香型白酒机械化酿造不同轮次堆积发酵细菌菌群结构多样性分析[J].食品科学,2020,41(2):188-195.
[8]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[9]ZHANG H,WANG L,WANG H,et al.Effects of initial temperature on microbial community succession rate and volatile flavors during Baijiu fermentation process[J].Food Res Int,2021,141:109887.
[10]LI L,WU J,TAO Y,et al.Seasonal dynamics of the microbial community in a strong-flavor Baijiu fermentation[J].J Sci Food Agr,2024,104(11):6605-6614.
[11]SUN W,XIAO H,PENG Q,et al.Analysis of bacterial diversity of Chinese Luzhou-flavor liquor brewed in different seasons by Illumina Miseq sequencing[J].Anna Microbiol,2016,66(3):1293-1301.
[12]胡晓龙,王康丽,余苗,等.浓香型酒醅微生物菌群演替规律及其空间异质性[J].食品与发酵工业,2020,46(10):66-73.
[13]沈才萍,李喆,敖宗华,等.泸型酒生产中不同层糟醅微生物与白酒风味的关系[J].四川理工学院学报(自然科学版),2013,26(5):14-18.
[14]谢旭.浅谈夏季压窖时间对浓香型曲酒生产的影响[J].酿酒科技,1998(4):33-34.
[15]SOERGEL D A W,DEY N,KNIGHT R,et al.Selection of primers for optimal taxonomic classification of environmental 16S rRNA gene sequences[J].ISME J,2012,6(7):1440-1444.
[16]TOJU H, TANABE A S, YAMAMOTO S, et al.High-coverage ITS primers for the DNA-based identification of Ascomycetes and Basidiomycetes in environmental samples[J].Plos One,2012,7(7):e40863.
[17]CHEN S,ZHOU Y,CHEN Y,et al.Fastp:an ultra-fast all-in-one FASTQ preprocessor[J].Bioinformatics,2018,34(17):884-890.
[18]CALLAHAN B J,MCMURDIE P J,ROSEN M J,et al.DADA2:Highresolution sample inference from Illumina amplicon data[J].Nat Methods,2016,13(7):581-583.
[19]QUAST C,PRUESSE E,YILMAZ P,et al.The SILVA ribosomal RNA gene database project:Improved data processing and web-based tools[J].Nucleic Acids Res,2012,41(D1):590-596.
[20]KÕLJALG U, ABARENKOV K, NILSSON R H, et al.The UNITE database for molecular identification and for communicating fungal species[J].Biodiversity Information Science and Standards,2019,47(1):259-264.
[21]王鹏,吴群,徐岩.中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J].微生物学报,2018,58(1):142-153.
[22]李慧.不同生产季汾香型白酒酿造微生物群落及其功能差异解析[D].太原:山西大学,2024.
[23]赵亮亮,盛伟喜,时晓,等.浓香型白酒酿造生境中微生物群落多样性及群落间相互作用[J].中国酿造,2023,42(11):15-21.
[24]乔美灵,任宇婷,张桂莲,等.传统清香型白酒发酵过程中细菌群落演替及自组装机理[J].食品科学,2023,44(22):139-148.
[25]蔡程山,白飞荣,许玲,等.国井白酒窖池发酵过程中酒醅微生物多样性及理化特性[J].中国酿造,2023,42(11):90-98.
[26]肖辰,陆震鸣,张晓娟,等.泸型酒酒醅细菌群落的发酵演替规律[J].微生物学报,2019,59(1):195-204.
[27]刘凡,周新虎,陈翔,等.洋河浓香型白酒发酵过程酒醅微生物群落结构解析及其与有机酸合成的相关性[J].微生物学报,2018,58(12):2087-2099.
[28]邱显平,黄桥,杨静,等.浓香型白酒在新、老窖池发酵过程中酒醅微生物群落结构差异分析[J].中国酿造,2024,43(1):50-56.
[29]肖辰,陆震鸣,张晓娟,等.泸型酒中层酒醅真菌群落的发酵演替规律[J].应用与环境生物学报,2018,24(5):1081-1086.
[30]赵东,乔宗伟,彭志云.浓香型白酒发酵过程中酒醅微生物区系及其生态因子演变研究[J].酿酒科技,2007(7):37-39.
[31]付丹阳.浓香型酒醅微生物群落结构解析及产酯酵母应用探究[D].郑州:郑州轻工业大学,2024
[32]赵欣,张钰婧,陈旭峰,等.山西老陈醋酒精发酵和醋酸发酵过程中微生物菌群与挥发性风味成分相关性分析[J].食品工业科技,2025,46(11):194-204.
[33]康承霞,秦辉,廖宇翔,等.浓香型白酒酿造老车间环境微生物群落演替研究[J].酿酒,2025,52(3):58-65.
[34]吕磊.芝麻香型白酒关键微生物产香分析研究[D].济南:齐鲁工业大学,2014.
[35]曹晓娟.新疆浓香型白酒酒醅微生物群落结构特征与酯类风味物质相关性分析[D].阿拉尔:塔里木大学,2024.
[36]HE M,JIN Y,ZHOU R,et al.Dynamic succession of microbial community in Nongxiangxing daqu and microbial roles involved in flavor formation[J].Food Res Int,2022,159:111559.
[37]QIAN W, LU Z M, CHAI L J, et al.Cooperation within the microbial consortia of fermented grains and pit mud drives organic acid synthesis in strong-flavor Baijiu production[J].Food Res Int,2021,147:110449.