山葡萄(Vitis amurensis Rupr.)是葡萄科葡萄属植物,原产于中国、俄罗斯及远东地区,我国主要栽植地区为东三省和内蒙地区[1]。山葡萄是优质酿酒葡萄品种,具有极强的抗寒[2-3]、抗病能力[4],并且富含丰富的单宁[5-6]、花色苷[7-10]、白藜芦醇[11]、有机酸[12]等物质。山葡萄酒是以山葡萄为原料,采用浸渍发酵工艺发酵而成的葡萄酒,较高含量的有机酸[13-16]赋予其清爽的口感[17-20]。葡萄酒中有机酸主要以酒石酸、苹果酸为主,还含有少量的柠檬酸、琥珀酸、乳酸和乙酸等小分子有机酸[21-23]。在葡萄酒酿造过程中酵母菌和乳酸菌会将发酵液中的苹果酸转化成乳酸[24],降低葡萄酒的尖酸口感,增加乳香味,从而使酒的口感柔和[25],并提升葡萄酒的微生物稳定性[26]。
目前主要采高效液相色谱(highperformanceliquidchromatography,HPLC)法[27-28]、液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法[29]、毛细管电泳(capillary electrophoresis,CE)法[30]和气相色谱-质谱等(gaschromatography-massspectrometry,GC-MS)法[31]检测其有机酸含量。LC-MS/MS灵敏度高、样品无需衍生化,但成本高[32];CE分离效率高,但重复性较差;GC-MS灵敏度和选择性高,但是样品需衍生化且成本高[33]。HPLC法具有前处理简单[34]、灵敏度高、快速、准确、成本较低的特点[35],国标GB/T 15038—2006《葡萄酒、果酒通用分析方法》中采用HPLC法测定酒中6种有机酸,存在前处理复杂,柱温过高,流动相水相比例高和流速慢等问题,降低检测效率。
本研究采用高效液相色谱(HPLC)技术建立了同时测定山葡萄酒中6种有机酸(酒石酸、琥珀酸、柠檬酸、乙酸、乳酸、苹果酸)含量的方法,测定了不同品种山葡萄酒的有机酸含量。旨在简便高效地同时测定葡萄酒中6种有机酸含量,为山葡萄酒品质评价和酿酒新品种选育提供科学的理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
不同品种山葡萄酒:不同品种山葡萄(紫晶梦露、紫晶甘露、紫晶美露、紫晶露、紫晶香露、北国紫晶、北国红)原料采自中国农业科学院特产研究所试验基地,实验室自制山葡萄酒,山葡萄酒样品分别编号为ZJ1~ZJ6、BGH。
1.1.2 化学试剂
甲醇(色谱纯):美国TEDIA试剂公司;磷酸(分析纯):北京化工厂有限责任公司;苹果酸、琥珀酸(均为色谱纯):上海源叶生物科技有限公司;柠檬酸、乙酸、乳酸、酒石酸(均为色谱纯):天津市光复精细化工研究所。
1.2 仪器与设备
配备二极管阵列检测器(diode array detector,DAD)的Agilent 1200高效液相色谱仪:德国安捷伦科技有限公司;FE20 pH计:梅特勒-托利多仪器(上海)有限公司;Milli-Q Advantage A1超纯水器:美国密理博公司。
1.3 方法
1.3.1 标准溶液的配制
分别称取有机酸标准品酒石酸0.100 09 g、琥珀酸0.020 04 g、柠檬酸0.010 10 g、乙酸0.10 mL、乳酸0.10 mL、L-苹果酸0.060 60 g于10 mL容量瓶中,用有机相甲醇溶解后定容至10mL,得到质量浓度分别为10.009 0 g/L、2.004 0 g/L、1.010 0 g/L、10.447 5 g/L、10.612 8 g/L、6.060 0 g/L的有机酸标准储备液。将6种有机酸标准储备液分别稀释2倍、4倍、8倍、10倍、16倍,得到不同质量浓度的系列标准溶液,用0.22 μm滤膜过滤,4 ℃存储备用。
1.3.2 酒样中有机酸含量的检测
采用HPLC法测定酒样中的6种有机酸。
样品前处理:将酒样10 000 r/min、20 ℃离心10 min,用水相将原酒稀释2倍,0.22 μm针头式过滤器过滤,备用。
HPLC条件:XT-C18色谱柱(4.6 mm×250 mm,5 μm),配有柱温箱,流动相为的磷酸水溶液(pH 2.6)(A)和甲醇(B),按流动相A∶B体积比为97∶3等度洗脱,DAD检测器检测波长为210 nm,柱温30 ℃,流速0.6 mL/min,进样量10 μL。
定性定量分析:利用二极管阵列检测器(DAD)检测峰的紫外-可见吸收光谱,通过比对标准品和样品中峰的光谱图对有机酸进行定性,采用外标法对有机酸进行定量。
1.3.3 色谱条件优化
在上述检测条件基础上,分别考察流动相磷酸水溶液(pH 2.6)与甲醇体积比(100∶0、97∶3、95∶5)、流动相磷酸水溶液的pH值(2.3、2.6、2.9)、流速(0.4 mL/min、0.5 mL/min、0.6 mL/min)和柱温(25 ℃、30 ℃、35 ℃)对6种有机酸分离效果和峰型的影响,确定最佳色谱条件。以相邻两组分的保留时间及两组分色谱峰的峰底宽度计算样品的分离度(R),其计算公式如下:
式中:tR2为后流出组分的保留时间,min;tR1为先流出组分的保留时间,min;W1为第一个峰的峰底宽,W2为第二个峰的峰底宽。
1.3.4 方法学考察
(1)标准曲线、检出限、定量限
选取方法1.3.1中配制的不同质量浓度的6种有机酸系列标准溶液,按照最佳HPLC条件进行测定。以峰面积(y)为纵坐标,以标准品质量浓度(x)为横坐标,绘制标准曲线,建立标准曲线回归方程。分别以3倍和10倍信噪比(signaltonoise ratio,S/N)确定方法的检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)。
(2)精密度试验
取混合有机酸标准品溶液按照1.3.3的色谱条件重复测定6次,计算精密度试验结果的相对标准偏差(relative standard deviation,RSD)。
(3)重复性试验
选取山葡萄酒样品BGH,按照1.3.3的色谱条件重复测定6次。计算重复性试验结果的RSD。
(4)稳定性试验
选取酒样ZJ6按照1.3.3的色谱条件测定其在8 h内的稳定性,每隔2 h检测一次。计算稳定性试验结果的RSD。
(5)加标回收率试验
向山葡萄酒样品BGH(其中酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸质量浓度分别为1.93 mg/mL、0.53 mg/mL、2.82 mg/mL、0.00 mg/mL、0.13 mg/mL、0.79 mg/mL)中依次添加相应质量浓度的标准溶液,按照1.3.3的色谱条件重复测定6次。计算方回收率试验结果的RSD。
1.3.5 数据处理
采用MicrosoftExcel2004进行数据处理,AdobeIllustrator 2022进行图片处理,SAS9.4进行差异显著性分析(P<0.05表示差异显著)。
2 结果与分析
2.1 色谱条件优化
2.1.1 流动相比例的选择
有机酸检测过程中有机相比例提高至10%的条件下基线波动较大,但在保护色谱柱的同时应尽可能提升响应值和柱效,可提升流动相中有机相甲醇的比例[36]。磷酸水与甲醇体积比对6种有机酸分离效果的影响见图1。由图1可知,当流动相磷酸水与甲醇体积比为95∶5时,苹果酸色谱峰前出现杂峰,且基线发生偏移。流动相磷酸水与甲醇体积比为100∶0和97∶3时未出现异常峰且基线平稳,且各个色谱峰分离度>1.5,峰型对称。考虑到增加甲醇比例可以保护色谱柱,确定最适磷酸水与甲醇体积比为97∶3。
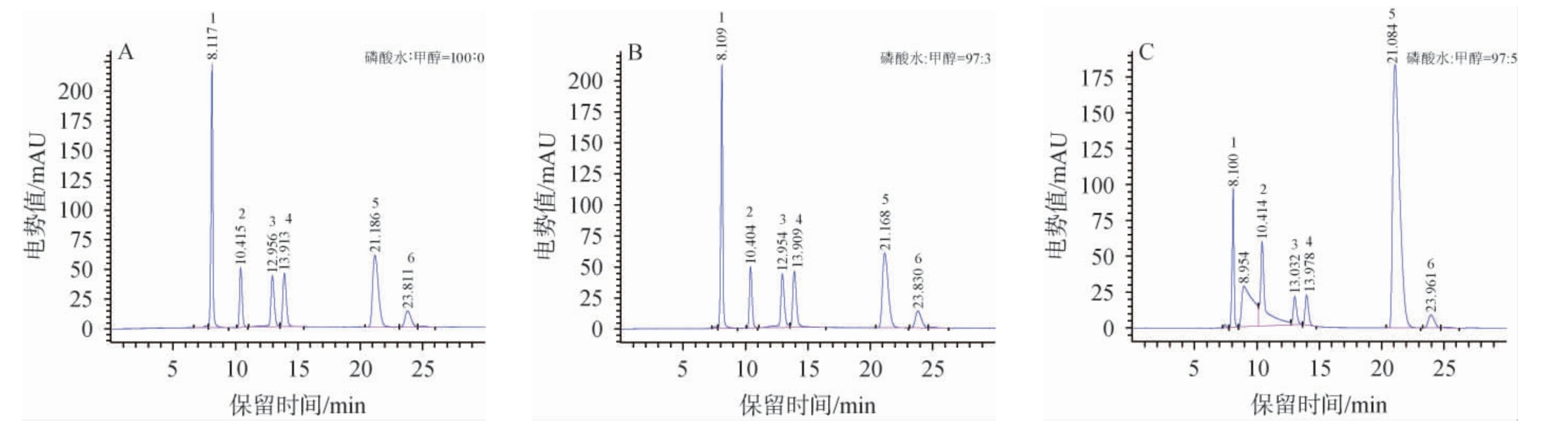
图1 磷酸水与甲醇体积比对6种有机酸分离效果的影响
Fig.1 Effect of the volume ratio of phosphoric acid water to methanol on the separation of 6 organic acids
1~6分别为酒石酸、苹果酸、乳酸、乙酸、柠檬酸和琥珀酸的色谱峰,下同。
2.1.2 流动相pH的选择
为了提高有机酸检测信号的响应值和柱效,于水相中加入磷酸,考察流动相中磷酸水溶液的pH值对有机酸分离效果,结果见图2。由图2可知,当pH值分别为2.6和2.9时,酒石酸和苹果酸的色谱峰之间出现杂峰,且pH值为2.9时基线漂移。pH值为2.3时标准物质响应值最高,色谱峰之间的分离度>1.5,峰型对称,基线平稳,明显优于pH值为2.6和2.9时的色谱峰。因此,确定最适的流动相磷酸水溶液pH值为2.3。
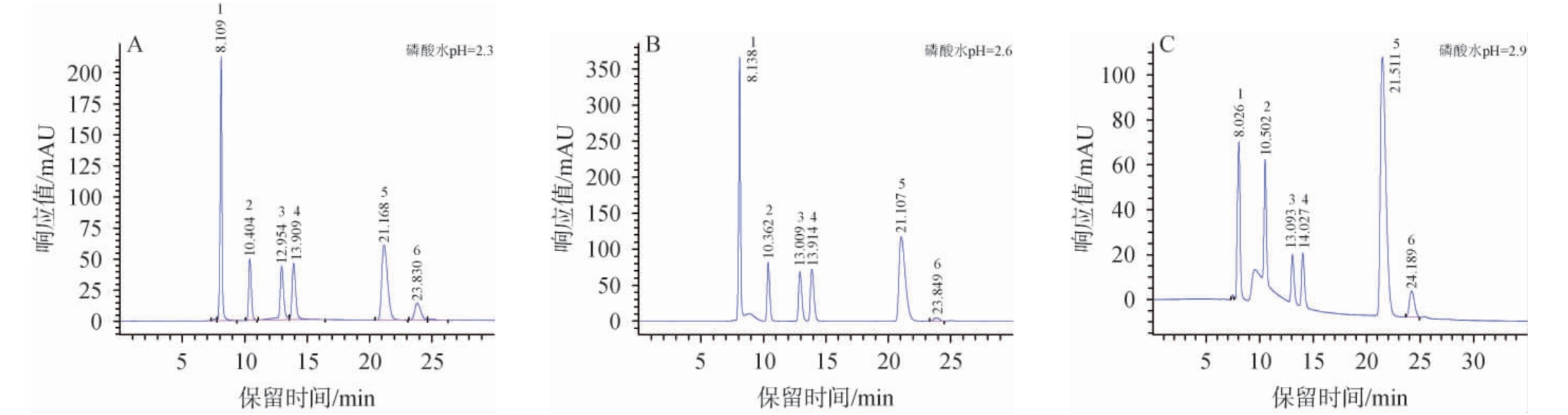
图2 流动相中磷酸水pH值对6种有机酸分离效果的影响
Fig.2 Effect of pH of phosphoric acid water in mobile phase on the separation of 6 organic acids
2.1.3 流速的选择
由图3可知,流速增大使有机酸的保留时间提前,但流速为0.5 mL/min、0.6 mL/min时酒石酸和苹果酸、乳酸和乙酸分离度降低(R<1.5),电势值也降低。柠檬酸在流速为0.5 mL/min、0.6 mL/min时色谱峰发生拖尾,峰型不对称。当流速为0.4 mL/min时,6种有机酸的分离度>1.5,且峰型对称,响应值最大。因此,最适流速为0.4 mL/min。
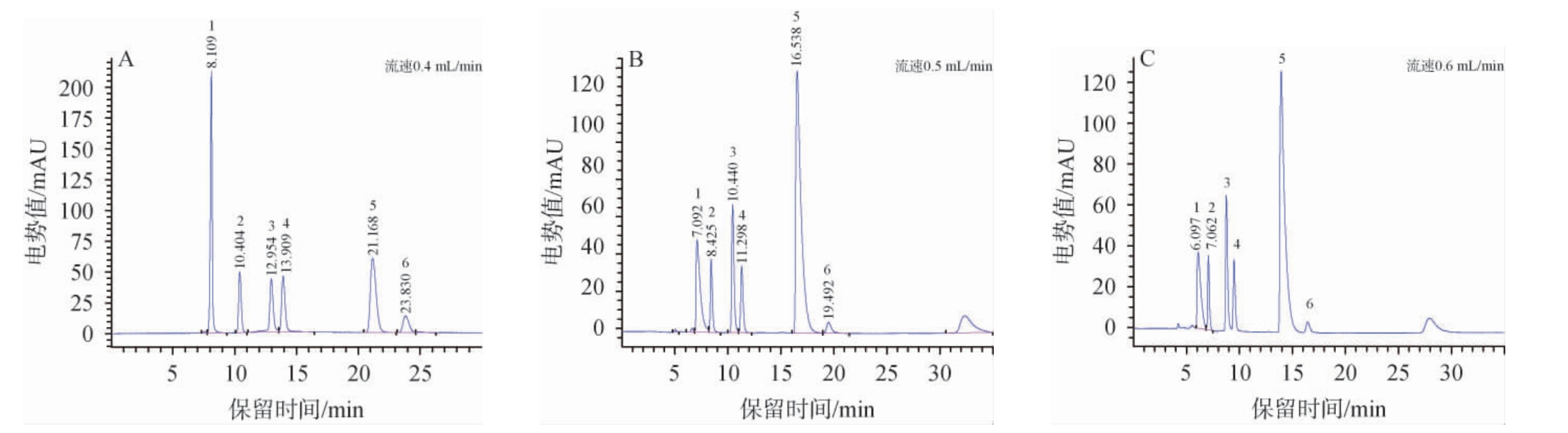
图3 流速对6种有机酸分离效果的影响
Fig.3 Effect of flow rate on the separation of 6 organic acids
2.1.4 柱温的选择
柱温对6种有机酸分离效果的影响见图4。由图4可知,不同柱温条件下各有机酸标准物质的电势值、分离度、峰型和基线表现一致,色谱图无较大差异,考虑能耗和温度对色谱柱的影响,越接近室温对色谱柱子保护效果越好。因此,最适柱温为25 ℃。
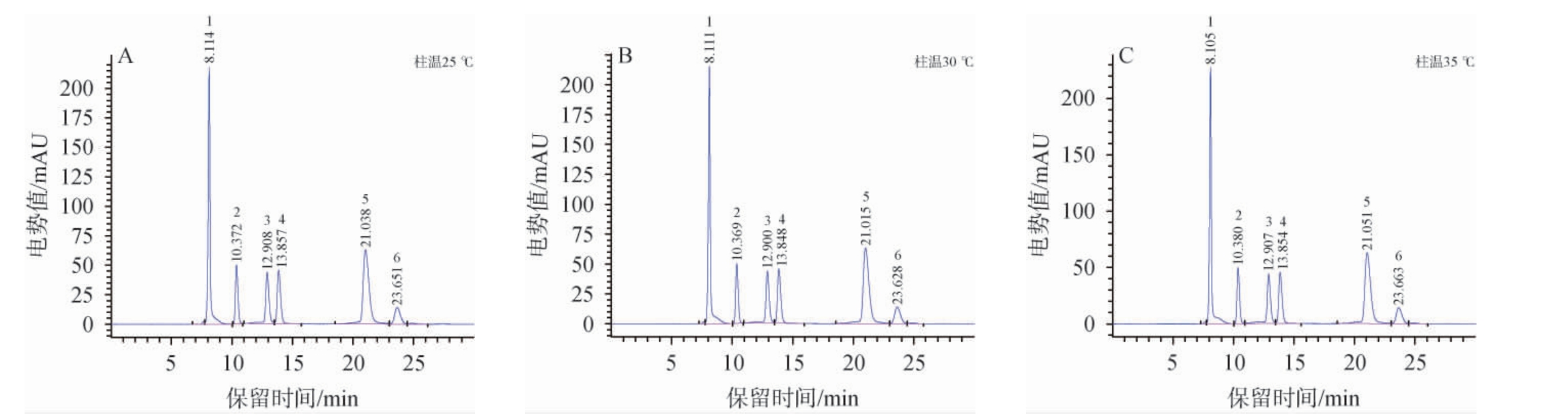
图4 柱温对6种有机酸分离效果的影响
Fig.4 Effect of column temperature on the separation of 6 organic acids
2.2 方法学考察
2.2.1 线性范围、检出限和定量限
由表1可知,酒石酸、苹果酸、乳酸和乙酸的线性范围为0.379~10.613 g/L,柠檬酸和琥珀酸的线性范围为0.063~1.106 g/L,相关系数(R2)均>0.999,6种有机酸在各自的质量浓度和峰面积之间有良好的线性关系,检出限(LOD)为0.001 5~0.015 0 g/L,定量限(LOQ)为0.005 0~0.050 1 g/L,各有机酸浓度能够在较低范围内检出。
表1 6种有机酸的线性方程、线性范围、相关系数、检出限和定量限
Table 1 Linear equation, linear range, correlation coefficient, limit of detection, and limit of quantification of 6 organic acids
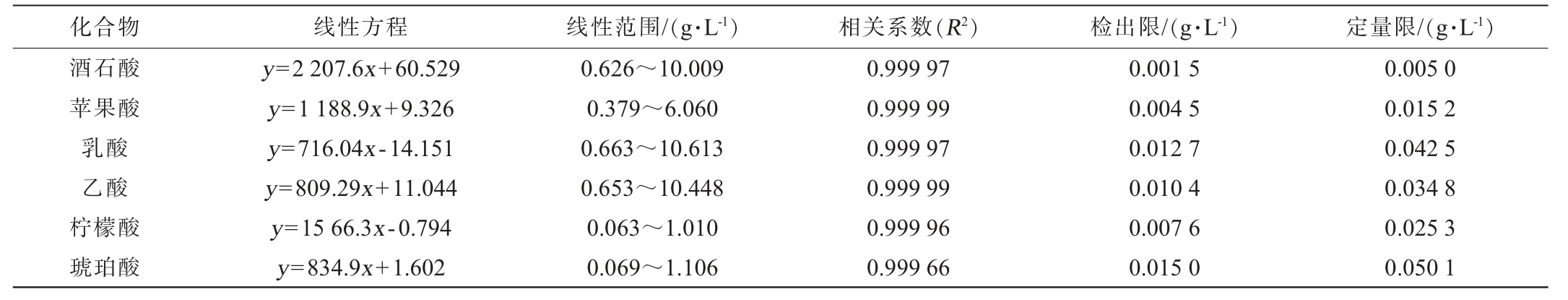
化合物 线性方程 线性范围/(g·L-1)相关系数(R2)检出限/(g·L-1)定量限/(g·L-1)酒石酸苹果酸乳酸乙酸柠檬酸琥珀酸y=2 207.6x+60.529 y=1 188.9x+9.326 y=716.04x-14.151 y=809.29x+11.044 y=15 66.3x-0.794 y=834.9x+1.602 0.626~10.009 0.379~6.060 0.663~10.613 0.653~10.448 0.063~1.010 0.069~1.106 0.999 97 0.999 99 0.999 97 0.999 99 0.999 96 0.999 66 0.001 5 0.004 5 0.012 7 0.010 4 0.007 6 0.015 0 0.005 0 0.015 2 0.042 5 0.034 8 0.025 3 0.050 1
2.2.2 精密度试验结果
6种有机酸精密度试验结果见表2。由表2可知,混标样品中酒石酸、苹果酸、乳酸、乙酸、柠檬酸和琥珀酸精密度试验结果的RSD值分别为0.94%、0.97%、3.61%、1.18%、2.22%和1.92%,RSD值均<5%,表明仪器性能稳定,精密度良好。
表2 6种有机酸的精密度试验结果
Table 2 Precision tests results of 6 organic acids
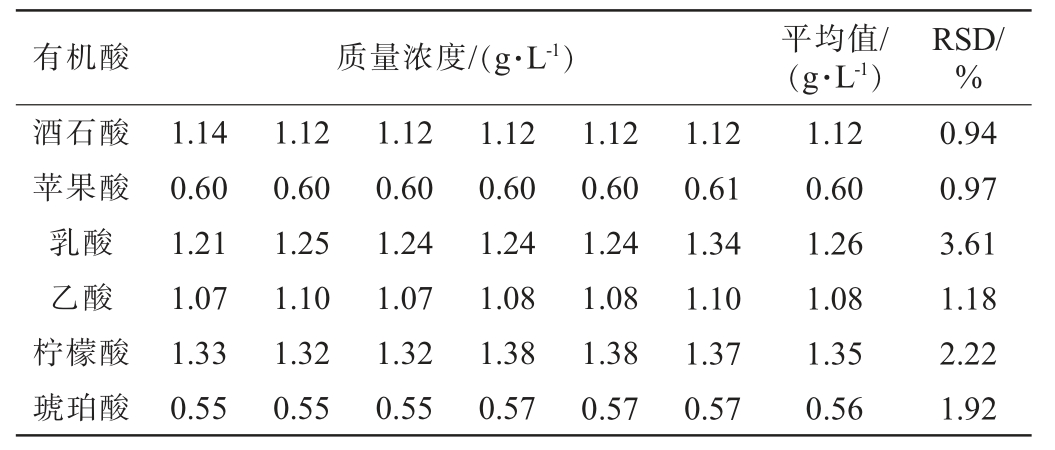
有机酸 质量浓度/(g·L-1)平均值/(g·L-1)RSD/%酒石酸苹果酸乳酸乙酸柠檬酸琥珀酸1.14 0.60 1.21 1.07 1.33 0.55 1.12 0.60 1.25 1.10 1.32 0.55 1.12 0.60 1.24 1.07 1.32 0.55 1.12 0.60 1.24 1.08 1.38 0.57 1.12 0.60 1.24 1.08 1.38 0.57 1.12 0.61 1.34 1.10 1.37 0.57 1.12 0.60 1.26 1.08 1.35 0.56 0.94 0.97 3.61 1.18 2.22 1.92
2.2.3 重复性试验
6种有机酸重复性试验结果见表3。
表3 6种有机酸的重复性试验结果
Table 3 Repeatability tests results of 6 organic acids
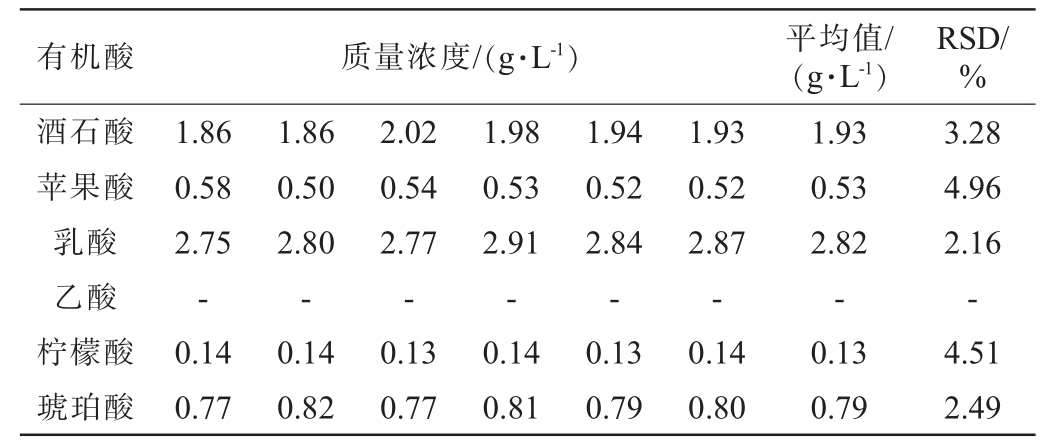
注:“-”表示未检测出该物质。下同。
有机酸 质量浓度/(g·L-1)平均值/(g·L-1)RSD/%酒石酸苹果酸乳酸乙酸柠檬酸琥珀酸1.86 0.58 2.75-0.14 0.77 1.86 0.50 2.80-0.14 0.82 2.02 0.54 2.77-0.13 0.77 1.98 0.53 2.91-0.14 0.81 1.94 0.52 2.84-0.13 0.79 1.93 0.52 2.87-0.14 0.80 1.93 0.53 2.82-0.13 0.79 3.28 4.96 2.16-4.51 2.49
由表3可知,样品中酒石酸、苹果酸、乳酸、柠檬酸和琥珀酸重复性试验结果的RSD 值分别为3.28%、4.96%、2.16%、4.51%和2.49%,RSD值均<5%,重复性良好。未检测到乙酸,可能是由于样品中不含有或含有极少含量的乙酸未达到检测限。
2.2.4 稳定性试验
6种有机酸稳定性试验结果见表4。由表4可知,样品中酒石酸、苹果酸、乳酸、柠檬酸和琥珀酸稳定性试验结果的RSD 值分别为0.28%、2.29%、0.88%、2.53%和2.99%,RSD值均<5%,稳定性良好。未检测到乙酸,可能是由于样品中不含有或含有极少含量的乙酸未达到检测限。
表4 6种有机酸的稳定性试验结果
Table 4 Stability tests results of 6 organic acids
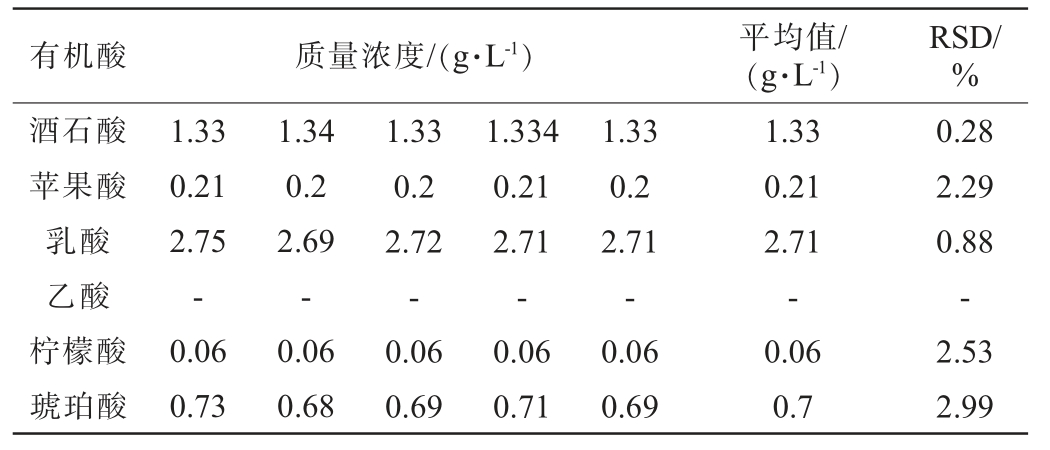
有机酸 质量浓度/(g·L-1)平均值/(g·L-1)RSD/%酒石酸苹果酸乳酸乙酸柠檬酸琥珀酸1.33 0.21 2.75-0.06 0.73 1.34 0.2 2.69-0.06 0.68 1.33 0.2 2.72-0.06 0.69 1.334 0.21 2.71-0.06 0.71 1.33 0.2 2.71-0.06 0.69 1.33 0.21 2.71-0.06 0.7 0.28 2.29 0.88-2.53 2.99
2.2.5 加标回收率试验
6种有机酸的加标回收率试验结果见表5。由表5可知,6种有机酸平均回收率为96%~113%,RSD值为0.79%~4.94%,说明该方法的准确度良好,均满足检测分析的要求。
表5 6种有机酸的加标回收率试验结果
Table 5 Spiked recovery rates tests results of 6 organic acids
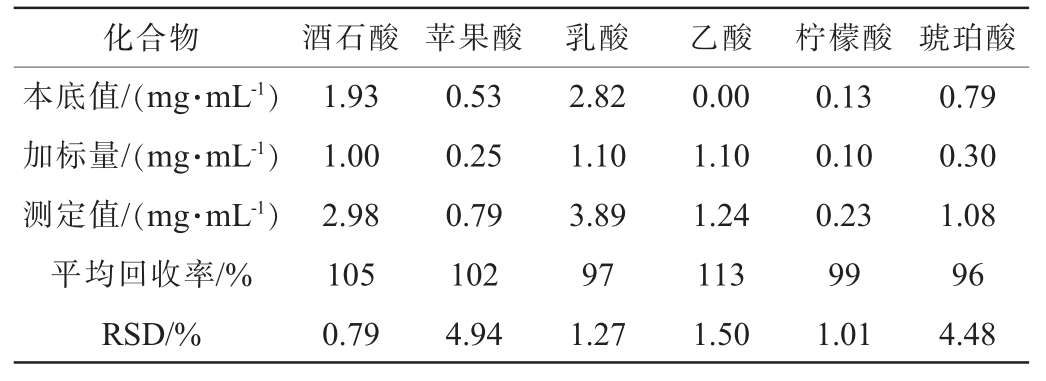
化合物 酒石酸 苹果酸 乳酸 乙酸 柠檬酸 琥珀酸本底值/(mg·mL-1)加标量/(mg·mL-1)测定值/(mg·mL-1)平均回收率/%RSD/%1.93 1.00 2.98 105 0.79 0.53 0.25 0.79 102 4.94 2.82 1.10 3.89 97 1.27 0.00 1.10 1.24 113 1.50 0.13 0.10 0.23 99 1.01 0.79 0.30 1.08 96 4.48
2.3 不同品种山葡萄酒有机酸的测定结果
不同品种山葡萄酒有机酸含量测定结果见表6。由表6可知,山葡萄酒中主要的有机酸为酒石酸、苹果酸和乳酸,酒石酸含量为1.12~2.61 g/L,苹果酸含量为0.21~2.43 g/L,乳酸含量为2.44 g/L~3.56 g/L,含有少量柠檬酸(0.06~0.47 g/L)和琥珀酸(0.14~1.26 g/L),未检测出乙酸。刘晓燕等[37]利用HPLC对赤霞珠干红葡萄酒有机酸的检测结果表明,赤霞珠葡萄酒中主要以酒石酸和乳酸为主,苹果酸含量较低,这可能与发酵微生物对苹果酸的代谢差异相关。葡萄酒中的乙酸是挥发酸的主要成分,按照GB 15037—2006国标《葡萄酒》中的要求应≤1.2 g/L[38],本研究中未检出乙酸可能是由于发酵过程中乙酸参与脂肪酸、酯类等物质的合成[39],导致其未达到检测限。
表6 山葡萄酒样品中有机酸含量测定结果
Table 6 Determination results of organic acid content in Vitis amurensis wine samples
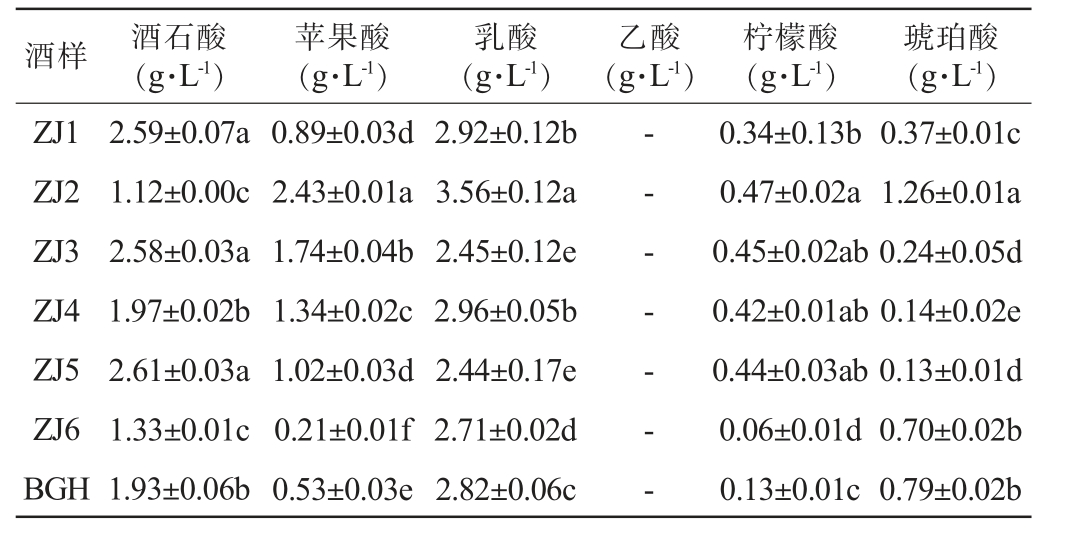
注:同列不同小写字母表示差异显著(P<0.05)。
酒样 酒石酸(g·L-1)苹果酸(g·L-1)乳酸(g·L-1)乙酸(g·L-1)柠檬酸(g·L-1)琥珀酸(g·L-1)ZJ1 ZJ2 ZJ3 ZJ4 ZJ5 ZJ6 BGH 2.59±0.07a 1.12±0.00c 2.58±0.03a 1.97±0.02b 2.61±0.03a 1.33±0.01c 1.93±0.06b 0.89±0.03d 2.43±0.01a 1.74±0.04b 1.34±0.02c 1.02±0.03d 0.21±0.01f 0.53±0.03e 2.92±0.12b 3.56±0.12a 2.45±0.12e 2.96±0.05b 2.44±0.17e 2.71±0.02d 2.82±0.06c-- - - - - -0.34±0.13b 0.47±0.02a 0.45±0.02ab 0.42±0.01ab 0.44±0.03ab 0.06±0.01d 0.13±0.01c 0.37±0.01c 1.26±0.01a 0.24±0.05d 0.14±0.02e 0.13±0.01d 0.70±0.02b 0.79±0.02b
3 结论
本研究建立了基于HPLC测定葡萄酒中6种常见有机酸含量的方法,对山葡萄酒酒样品进行检测和分析,最终确定色谱条件为:XT-C18色谱柱(4.6 mm×250 mm,5 μm),流动相磷酸水(pH 2.3)-甲醇(97∶3)等度洗脱,流速0.4 mL/min,进样量10 μL,采用二极管阵列检测器(DAD)测定,检测波长210 nm,外标法定量,30 min内即可完成检测。6种有机酸在各自质量浓度范围内线性关系良好,相关系数R2>0.999 6,检出限(LOD)为0.001 5~0.015 0 g/L,定量限(LOQ)为0.005 0~0.050 1 g/L。精密度试验结果的RSD为0.94%~3.61%,重复性试验结果的RSD值为2.16%~4.96%,稳定性试验结果的RSD值为0.28%~2.99%,平均加标回收率为96%~113%。山葡萄酒中主要的有机酸为酒石酸、苹果酸和乳酸,含有少量柠檬酸和琥珀酸,未检测出乙酸。此方法前处理简单、灵敏度高、重现性好,适于分析山葡萄酒中6种有机酸的含量。
[1]王衍莉,杨义明,范书田,等.基于SSR分子标记的73份山葡萄及杂交后代的遗传多样性分析[J].生物技术通报,2021,37(1):189-197.
[2]梁国平,曾宝珍,刘铭,等.山葡萄VaSR基因家族的鉴定及VaSR1抗寒功能验证与互作蛋白筛选[J].园艺学报,2025,52(1):37-50.
[3]赵滢,杨义明,张宝香,等.2个葡萄品种越冬抗寒性比较及其生理响应分析[J].中国果树,2021(9):30-35,41.
[4]郭俊强,张晓月,王荣花,等.葡萄品种霜霉病抗性的田间自然鉴定[J].西北农业学报,2021,30(6):914-920.
[5]曹炜玉,舒楠,温锦丽,等.不同品种酿酒葡萄果实发育期间营养物质动态变化及成熟期果实主成分分析[J].北方园艺,2022(14):16-23.
[6]WIMALASIRI P M,HARRISON R,DONALDSON I,et al.Characterisation and extractability of tannins in Pinot noir grape skin,seed,and stem:Impact of leaf removal,clone,and rootstock[J].J Food Compos Anal,2024,130:106186.
[7]LI M Y,PEI X X,SHI N,et al.Unveiling flavonoid profiles of Vitis amurensis cultivars and its hybrids with V.vinifera:Insights from two viticulture regions[J].J Food Compos Anal,2025,142:107558.
[8]ZHU L, LI X Y, HY X X, et al.Quality characteristics and anthocyanin profiles of different Vitis amurensis Grape cultivars and hybrids from Chinese germplasm[J].Molecules,2021,26(21):6696.
[9]胡丽,彭文婷,卢浩成,等.不同酿酒葡萄果实类黄酮及香气物质差异分析[J].食品科学,2020,41(14):225-233.
[10]HE Y, WEN L K, YU H S, et al.Isolation and structural identification of the main anthocyanin monomer in Vitis amurensis Rupr[J].Nat Prod Res,2018,32(7):867-870.
[11]YAN C H,YANG N,WANG X Q,et al.VqBGH40a isolated from Chinese wild Vitis quinquangularis degrades trans-piceid and enhances transresveratrol[J].Plant Sci,2021,310:110989.
[12]曹炜玉,舒楠,温锦丽,等.不同品种酿酒葡萄果实发育期间营养物质动态变化及成熟期果实主成分分析[J].北方园艺,2022(14):16-23.
[13]郭权,郭印山,郭修武.葡萄‘红地球’与‘双优’杂交后代果实糖酸的遗传规律[J].分子植物育种,2021,19(10):3424-3431.
[14]舒楠,金宇宁,谢苏燕,等.酿酒山葡萄新品种‘紫晶甘露’[J].园艺学报,2020,47(S2):2908-2909.
[15]CAO W Y,SHU N,WEN J L,et al.Widely targeted metabolomics was used to reveal the differences between non-volatile compounds in different wines and their associations with sensory properties[J].Foods,2023,12(2):290.
[16]LIU M Y,SHI L J,GUO J,et al.Determination of organic acids for predicting sourness intensity of tea beverage by liquid chromatography-tandem mass spectrometry and chemometrics methods[J].J Sep Sci,2024,47(9-10):e2300628.
[17]PENG Q,LI J C,FANG S N,et al.Enhancing the flavor quality of Chinese rice wine (Huangjiu) through inoculation with Lactobacillus plantarum and Leuconostoc mesenteroides[J].LWT-Food Sci Technol,2024,211:116935.
[18]涂世伟,陈泽敏,白卫东,等.柠檬蜂蜜酒发酵工艺优化及风味物质分析[J].中国酿造,2024,43(12):237-241.
[19]张辉,毛健,周志磊.上海地区产黄酒的风味分析研究[J].酿酒科技,2025,1-11[2025-08-25].https://link.cnki.net/urlid/52.1051.TS.20241231.1249.004.
[20]贾鑫,张珍珍,陈健,等.复合酸添加工艺对葡萄酒色泽稳定性的影响[J].食品与发酵工业,2025,51(7):129-134.
[21]任言,刘婉君,李美璇,等.鲜食葡萄果实发育过程中有机酸积累差异研究[J].中外葡萄与葡萄酒,2024(3):67-74.
[22]TORAÑA P, MARTÍN-GARCÍA A, BORDONS A, et al.Enhancing wine malolactic fermentation:Variable effect of yeast mannoproteins on Oenococcus oeni strains[J].Food Microbiol,2025,127:104689.
[23]牛生洋,刘崇怀,刘强,等.葡萄种质果实有机酸组分及其含量特性[J].食品科学,2022,43(12):228-234.
[24]白玉峰,张文霞,田亚楠,等.宁夏贺兰山东麓降L-苹果酸葡萄酒酵母的筛选[J].中国酿造,2021,40(1):49-54.
[25]TIAN M B,HU R Q,LIU Z L,et al.The pH adjustment of Vitis amuren-sis dry red wine revealed the evolution of organic acids,volatomics,and sensory quality during winemaking[J].Food Chem,2024,436:137730.
[26]RUIZ-DE-VILLA C,GOMBAU J,POBLET M,et al.Sequential inoculation of Torulaspora delbrueckii and Saccharomyces cerevisiae in rosé wines enhances malolactic fermentation and potentially improves colour stability[J].LWT-Food Sci Technol,2023,190:115540.
[27]ZHAO W H,RUAN F X,QIAN M,et al.Comparing the differences of physicochemical properties and volatiles in semi-dry Hakka rice wine and traditional sweet rice wine via HPLC,GC-MS and E-tongue analysis[J].Food Chem X,2023,20,100898.
[28]张军,姚虹.库尔勒香梨果实发育过程中有机酸代谢规律研究[J].中州大学学报,2021,38(2):107-111.
[29]宗凌丽,孙小杰,应月,等.全自动固相萃取-超高效液相色谱-串联质谱法测定果酒中14种有机酸[J].食品安全质量检测学报,2024,15(10):270-278.
[30]PONT L, BARBOSA J, BENAVENTE F.A rapid and simple method for the determination of organic acids in proteolytic enzymes by capillary electrophoresis with indirect ultraviolet detection[J].Microchem J,2020,158:105204.
[31]RANI H,BHARDWAJ D,SEN R,et al.Comprehensive and comparative profiling of sugars and organic acids in green and kilned malts of barley cultivars using GC-MS/MS and UHPLC[J].J Food Compos Anal,2024,126:105861.
[32]ALIABADI M H S, KARAMI-OSBOO R, KOBARFARD F, et al.Detection of lime juice adulteration by simultaneous determination of main organic acids using liquid chromatography-tandem mass spectrometry[J].J Food Compos Anal,2022,105:104223.
[33]BRATTHÄLL T, FIGUEIRA J, NORDING L M.Influence of divalent cations on the extraction of organic acids in coffee determined by GC-MS and NMR[J].Heliyon,2024,10(5):e26625.
[34]LIMA M M M,CHOY Y Y,TRAN J,et al.Organic acids characterization:wines of Pinot noir and juices of'Bordeaux grape varieties'[J].J Food Compos Anal,2022,114:104745.
[35]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[36]刘兰花,孙智伟,刘长庆,等.液相色谱-高分辨质谱法检测果蔬脆片中9种有机酸含量[J].食品安全质量检测学报,2025,16(15):264-272.
[37]刘晓燕,张小月,阿卜杜喀依尔·阿卜杜艾尼,等.混菌发酵、酒泥陈酿结合β-葡聚糖酶对赤霞珠干红葡萄酒有机酸含量的影响[J].食品与发酵工业,2022,48(15):55-61.
[38]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15037—2006 葡萄酒[S].北京:中国标准出版社,2006.
[39]李娜,李莹,孙悦.酿酒酵母乙醇代谢调控机制及低产乙醇菌株选育方法研究进展[J].食品与发酵工业,2024,50(15):315-323.