白酒是我国特有的一种蒸馏酒,其中水和乙醇约占98%,剩余2%左右为微量成分[1-2]。微量成分虽含量较少,但种类丰富,成分达2 400多种[3-4],形成了白酒的独特口感与香气,很大程度上决定了白酒的风味与质量[5-6]。统计国内外相关研究发现[7],白酒微量成分中酯类、吡嗪类、有机酸类、萜烯类、酚类、醇类等成分使白酒具有一定的功效。随着国民生活水平的显著提高,白酒产品逐步向“风味与品质”双导向转变。
四甲基吡嗪(tetramethylpyrazine,TTMP)又名川芎嗪,是吡嗪类衍生物中应用最广的一种生物碱,除了作为食品风味添加剂提升香气外,还有保肝护肝[8]、扩张血管、抑制血小板凝聚以及轻度降血压等重要功效[9],应用前景十分广阔[10-11]。研究表明,白酒中的TTMP是酿造过程中微生物代谢生成的乙偶姻与氨经非酶促反应而产生,且高温有利于促进该反应的发生[12]。然而,由于清香型白酒发酵过程缺少高温制曲和高温堆积环节,难以从乙偶姻转变成TTMP,导致清香型白酒中TTMP含量很低[13]。
目前,提高白酒中四甲基吡嗪含量的主要手段是通过分离筛选出高产菌株用于生产[13-14]。前期,本课题组采用传统分离方法,从清香型白酒(汾酒)大曲中筛选、鉴定出了一株产四甲基吡嗪的枯草芽孢杆菌(Bacillus subtilis)q94,对其发酵条件进行了初步分析,发现四甲基吡嗪产量受菌株特性和发酵条件影响[15]。为进一步提升清香型白酒品质及其饮用价值,本试验采用单因素和响应面试验设计对枯草芽孢杆菌q94高产TTMP的培养条件进行了优化。同时,结合生产实际对铵盐添加的影响进行了评估。以期为该高产四甲基吡嗪菌株在清香型白酒中的应用提供研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种与试剂
枯草芽孢杆菌(Bacillus subtilis)q94:30%甘油(V/V)、-80 ℃保存于山西大学生命科学学院微生物实验室。
牛肉膏、蛋白胨、酵母浸粉、蔗糖、磷酸二氢钾、乙偶姻、氯化钠、磷酸氢二铵、盐酸、氢氧化钠(均为分析纯或生化试剂)、二氯甲烷(色谱纯):天津市登丰化学品有限公司;四甲基吡嗪标品(色谱纯):上海阿拉丁生化科技股份有限公司。
1.1.2 培养基
种子培养基:牛肉膏3 g/L、蛋白胨10 g/L、氯化钠5 g/L,蒸馏水为溶剂,121 ℃高压蒸汽灭菌20 min。
发酵培养基:蛋白胨10 g/L、酵母浸粉20 g/L、蔗糖80 g/L、磷酸二氢钾15 g/L,蒸馏水为溶剂,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SW-CJ-2F超净工作台:北京东南仪诚实验室设备有限公司;HNY-1102智能恒温培养振荡器:安捷伦科技有限公司;GC-2010气相色谱仪:岛津企业管理(中国)有限公司;SP-2000UV紫外可见分光光度计:上海光谱仪器有限公司;HH-S2恒温水浴锅:常州市金坛大地自动化仪器厂;D1008E低速离心机:大龙兴创实验仪器股份公司;pHS-25 pH计:上海仪电科学仪器有限公司。
1.3 方法
1.3.1 菌株发酵培养及产物制备方法
将200 μL保藏菌株q94接种至装液量100 mL/500 mL三角瓶种子液培养基中,37 ℃,180 r/min活化培养16 h,获得菌株q94种子液。将不同接种量种子液接种于装液量100mL/500mL三角瓶发酵培养基中,培养基提前用0.01mol/L HCl或NaOH调控初始pH,在37 ℃、180 r/min条件下振荡培养发酵一定时间后,于设定温度下进行加热处理。热处理后,向100 mL发酵液中加入50 mL体积分数95%乙醇混合,模拟白酒蒸馏操作,分别蒸馏出前段蒸馏液30 mL、中段蒸馏液30 mL、后段蒸馏液40 mL,测定TTMP和乙偶姻含量,取平均值。
1.3.2 菌株培养条件优化单因素试验
设置基础条件为将种子液按6.0%(V/V)的接种量接种于50 mL/250 mL三角瓶发酵培养基中,不进行pH调控(初始pH为6.8),设定发酵温度37 ℃、180 r/min振荡培养160 h后,于室温放置4 h,测定蒸馏液、四甲基吡嗪产量。
分别改变单一变量,考察不同菌株接种量(2.0%、4.0%、6.0%、8.0%、10.0%、12.0%)、初始pH(6.0、6.5、7.0、7.5、8.0)[16]、培养时间(6 h、12 h、24 h、48 h、60 h、72 h、96 h、120 h、136 h、160 h、192 h、216 h、240 h)、热处理温度(未处理、室温、50 ℃、70 ℃、90 ℃、110 ℃)和热处理时间(0 h、1 h、2 h、3 h、4 h)对四甲基吡嗪产量的影响[17]。
1.3.3 菌株培养条件优化响应面试验
在单因素试验基础上,选取接种量(A)、初始pH值(B)、热处理时间(C)与热处理温度(D)四个因素为考察因素,以四甲基吡嗪产量(Y)为响应值,采用Design-Expert 13.0软件设计4因素3水平的Box-Behnken中心组合试验设计,对菌株q94的培养条件进行优化,试验因素与水平见表1。
表1 菌株培养条件优化Box-Behnken设计因素与水平
Table 1 Factors and levels of Box-Behnken design for strain culture condition optimization
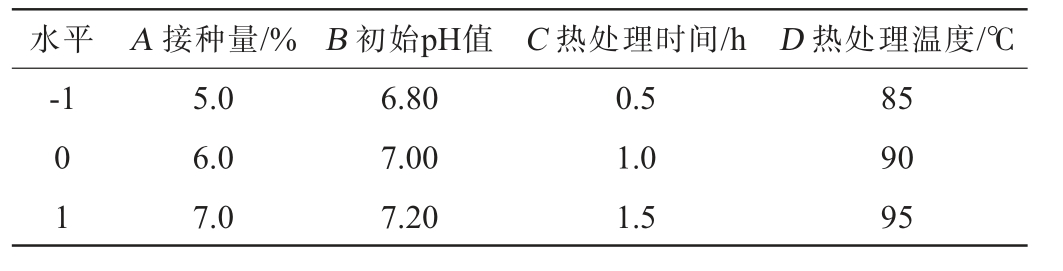
水平 A 接种量/% B 初始pH值 C 热处理时间/h D 热处理温度/℃-1 0 1 5.0 6.0 7.0 6.80 7.00 7.20 0.5 1.0 1.5 85 90 95
1.3.4 添加铵盐热处理对四甲基吡嗪产量的影响
在最优接种量、初始pH、37℃条件下发酵160h后,补加磷酸氢二铵使得其质量浓度分别为20 g/L、40 g/L、60 g/L[18],在最佳热处理温度和时间下进行热处理,测定四甲基吡嗪产量,考察添加铵盐热处理对菌株q94产四甲基吡嗪的影响[18]。
1.3.5 四甲基吡嗪产量的测定
采用气相色谱法测定四甲基吡嗪含量,色谱条件:AC-20毛细管柱(30 m×0.25 mm,0.25 μm);进样口温度250 ℃;分流比15∶1;柱流速1.0 mL/min;进样量1 μL,不分流进样;升温程序为初始温度50 ℃,以8 ℃/min升至100 ℃,保持5 min,再以10 ℃/min升至170 ℃,保持4 min[16]。
标准曲线绘制:以二氯甲烷为溶剂,分别配制10.0μg/mL、50.0 μg/mL、100.0 μg/mL、200.0 μg/mL、250.0 μg/mL、500.0 μg/mL、1 000.0 μg/mL、2 000.0 μg/mL的TTMP标准溶液,通过气相色谱技术检测不同质量浓度TTMP条件下的峰面积。然后,以TTMP质量浓度(X)为横坐标,以峰面积(Y)为纵坐标,绘制TTMP标准曲线,标准曲线回归方程为Y=1 047.5X-34 809,相关系数R2=0.999 6。根据标准曲线回归方程计算四甲基吡嗪产量。
1.3.6 乙偶姻含量的测定
采用肌酸比色法测定乙偶姻含量。以去离子水为溶剂,分别配制0.50 mg/mL、0.75 mg/mL、1.00 mg/mL、2.00 mg/mL、5.00 mg/mL乙偶姻标准溶液。分别取不同质量浓度标准溶液100 μL,加水2.4 mL、0.5%肌酸溶液0.5 mL、5.0%α-萘酚溶液0.5 mL、10.0%NaOH 0.5 mL,30 ℃水浴1 h后测定OD520 nm值。以乙偶姻质量浓度(X)和OD520 nm值(Y)分别为横、纵坐标,绘制乙偶姻标准曲线,回归方程为Y=0.076X+0.01,相关系数R2=0.999 2。取蒸馏液100 μL测定OD520nm值,根据标准曲线回归方程计算乙偶姻产量[20]。
1.3.7 数据处理
采用SPSS 27.0、Origin 8.0、Design-Expert 13.0软件进行数据分析及作图。
2 结果与分析
2.1 菌株培养条件优化单因素试验结果与分析
2.1.1 接种量对四甲基吡嗪产量的影响
接种量对四甲基吡嗪产量的影响见图1。由图1可知,菌株q94产TTMP的量随接种量增加呈现波动变化趋势。接种量为6.0%时,菌株q94的TTMP产量最高,为(3.09±0.22)g/L,显著高于其他接种量时的TTMP产量(P<0.05);而接种量<6.0%时,TTMP产量变化不大且差异不显著(P>0.05),可见发酵5 d给了菌株足够的代谢时间;当接种量>6.0%时,TTMP产量先下降后上升,但整体呈现下降趋势。其原因可能是随着菌体量逐渐增多,培养基中碳源和氮源无法满足发酵体系中TTMP的高效合成,不利于细胞的增殖,导致代谢产物含量缓慢下降,TTMP产量缓慢减少。因此,确定最佳接种量为6%。
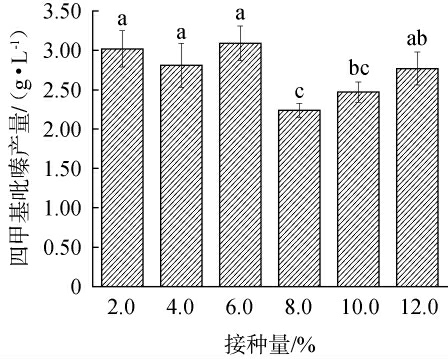
图1 接种量对四甲基吡嗪产量的影响
Fig.1 Effect of inoculum on tetramethylpyrazine yield
小写字母不同表示差异显著(P<0.05)。下同。
2.1.2 初始pH值对四甲基吡嗪产量的影响
初始pH值对四甲基吡嗪产量的影响见图2。由图2可知,菌株q94初始发酵pH值在酸性、中性条件下,TTMP产量显著高于碱性条件(P<0.05)。当调控初始发酵pH值为7.0时,TTMP产量最高为(3.07±0.12)g/L,说明微酸性条件及中性条件发酵能提升菌株q94的TTMP产量,碱性条件会抑制TTMP的产出[21]。因此,确定最佳初始pH值为7.0。
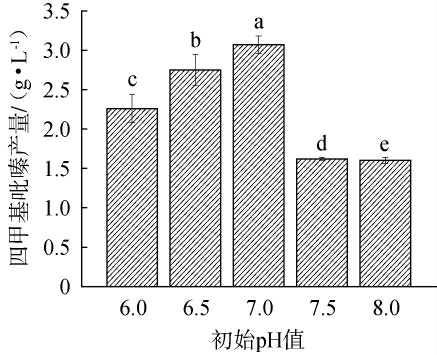
图2 初始pH值对四甲基吡嗪产量的影响
Fig.2 Effect of initial pH on tetramethylpyrazine yield
2.1.3 培养时间对四甲基吡嗪产量的影响
综合考察发酵时间对四甲基吡嗪、乙偶姻产量及pH的影响,确定最佳培养时间,结果见图3。由图3可知,菌株在发酵72 h时,开始产生TTMP;在72~240 h内,TTMP产量随着发酵时间的延长呈现增长态势;发酵至240 h时,TTMP产量增加至(6.60±0.86)g/L。然而,乙偶姻含量在160 h达到最高值后开始下降,可能是乙偶姻产生速率低于乙偶姻转变为四甲基吡嗪速率的缘故。同时,发现从TTMP产生开始,随着TTMP产量的增加,pH呈缓慢下降趋势[22],不利于TTMP产生。因此,确定160 h为菌株的最适培养时间。
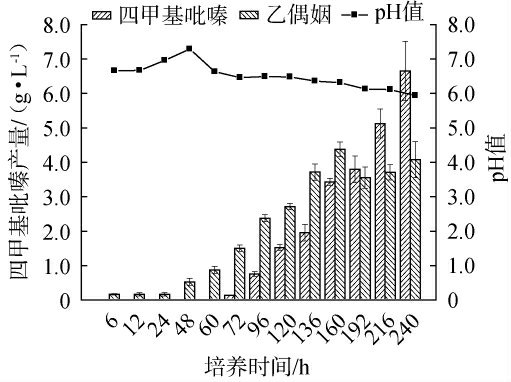
图3 培养时间对四甲基吡嗪产量的影响
Fig.3 Effect of culture time on tetramethylpyrazine yield
2.1.4 热处理温度对四甲基吡嗪产量的影响
不同热处理温度对四甲基吡嗪产量的影响见图4。由图4可知,菌株q94发酵完后进行热处理能提高四甲基吡嗪产量。当热处理温度为50~90 ℃时,四甲基吡嗪产量随着温度的升高而显著增加(P<0.05),90 ℃热处理时TTMP产量最高,可能是因为温度较低而达不到反应所需活化能,只有少量活化分子能转化为四甲基吡嗪产物;当在高温110 ℃条件下进行热处理,四甲基吡嗪产量下降,证明过高温度会抑制菌株四甲基吡嗪产率[23]。结果表明,发酵后再经90 ℃热处理,能有效提高菌株q49的TTMP产量。由此,推测出清香型白酒在酿造蒸馏过程中,适宜高温处理能有效提升其四甲基吡嗪含量,提升其饮用品质。
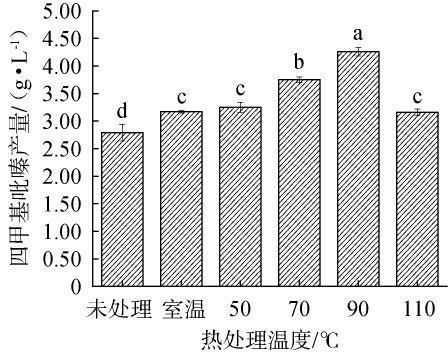
图4 热处理温度对四甲基吡嗪产量的影响
Fig.4 Effect of heat treatment temperature on tetramethylpyrazine yield
2.1.5 热处理时间对四甲基吡嗪产量的影响
不同热处理时间对四甲基吡嗪产量的影响见图5。由图5可知,菌种发酵结束后在90 ℃高温下进行热处理,随着热处理时间的延长,四甲基吡嗪产量出现先增长后下降的趋势。当热处理1h时,四甲基吡嗪产量最高,为(5.76±1.40)g/L;当热处理时间>1 h后,四甲基吡嗪含量显著下降(P<0.05);热处理2~4 h内,四甲基吡嗪含量趋于稳定,变化不显著(P>0.05)。因此,确定最佳热处理时间为1 h。
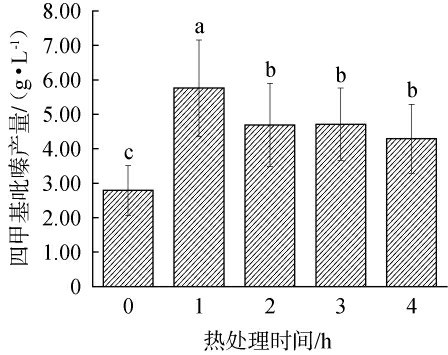
图5 不同热处理时间对四甲基吡嗪产量的影响
Fig.5 Effect of different heat treatment time on tetramethylpyrazine yield
2.2 菌株培养条件优化响应面试验结果与分析
2.2.1 回归模型建立及分析
响应面试验设计及结果见表2。采用Design-Expert 13.0对表2试验结果进行二次回归分析,得到四甲基吡嗪产量(Y)对接种量(A)、初始pH(B)、热处理时间(C)和热处理温度(D)的二次回归拟合模型方程:
表2 菌株培养条件优化响应面试验设计及结果
Table 2 Design and results of response surface experiments for strain culture condition optimization

试验序号接种量/%初始pH热处理时间/h热处理温度/℃Y 四甲基吡嗪产量/(mg·L-1)1234567891 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 6.0 7.0 6.0 6.0 5.0 5.0 5.0 7.0 5.0 5.0 6.0 6.0 6.0 7.0 7.0 7.0 6.0 6.0 6.0 5.0 6.0 6.0 6.0 7.0 6.0 6.0 6.0 6.0 6.0 7.0 7.0 7.0 7.2 7.0 7.0 7.0 7.0 6.8 7.2 7.2 7.2 6.8 6.8 7.2 7.0 7.0 7.0 7.0 7.0 6.8 7.0 7.0 7.0 6.8 7.2 7.0 6.8 7.0 1.0 1.0 0.5 1.5 1.5 0.5 1.0 1.0 1.0 1.0 0.5 1.0 0.5 1.0 1.0 1.5 1.0 1.0 1.0 1.0 1.5 1.5 1.5 0.5 1.0 1.0 1.0 1.0 0.5 90 95 85 90 90 90 85 85 90 90 90 95 90 90 90 90 90 90 90 95 90 95 85 90 85 85 90 95 95 5 441.8 2 318.9 3 495.7 4 520.1 3 838.2 3 701.4 4 004.4 3 276.9 5 305.8 4 247.2 3 166.0 2 813.5 5 210.0 5 747.3 3 365.5 3 616.6 5 353.7 5 295.5 5 832.2 2 533.1 6 014.9 3 707.9 4 333.3 3 395.3 5 665.5 4 199.2 5 963.8 4 493.2 2 688.3
Y=5 577.41-159.14A-843.76B+364.53C-535.02D-330.81AB+21.14AC+128.33AD+137.29BC-53.34BD+45.49CD-1 105.60A2+69.07B2-813.52C2-1333.20D2
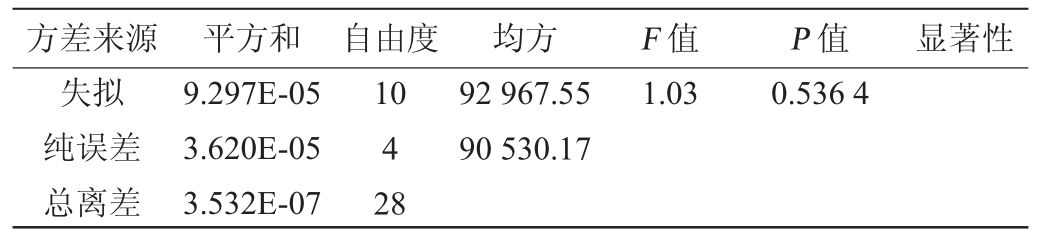
响应面试验结果方差分析见表3。由表3可知,该模型极显著(P<0.000 1),失拟项不显著(P=0.536 4>0.05),证明其他因素对试验结果的干扰较小;决定系数R2=0.963 4,说明TTMP产量的实际值与预测值之间具有较好的拟合相关性,适用于菌株q49四甲基吡嗪产量的优化及预测。变异系数为7.13%,表明试验重现性好,可靠性较高。由P值可知,一次项B、C、D,二次项A2、C2、D2对菌株q49四甲基吡嗪产量的影响极显著(P<0.01),交互项AB对菌株四甲基吡嗪产量的影响显著(P<0.05),其他项对菌株q49四甲基吡嗪产量的影响不显著(P>0.05)。由F值可知,各因素对菌株q49四甲基吡嗪产量的影响顺序为发酵初始pH>热处理温度>热处理时间>接种量。
表3 回归模型方差分析
Table 3 Variance analysis of regression model

方差来源 平方和 自由度 均方 F 值 P 值 显著性模型**14 ABCDA B*******AC AD BC BD CD A2 B2 C2 D2残差3.402E-07 3.039E-05 8.544E-06 1.596E-06 3.434E-06 4.377E-05 1 785.07 65 869.24 75 404.16 11 384.91 8 281.00 7.931E-06 30942.85 4.293E-06 1.153E-07 1.292E-06 111111111111111 4 2.429E-06 3.040E-05 8.544E-06 1.596E-06 3.434E-06 4.377E-05 1 785.07 65 869.24 75 404.16 11 384.91 8 281.00 7.931E-06 3 0942.85 4.293E-06 1.153E-07 92 271.43 26.34 3.29 92.59 17.28 37.23 4.741 0.019 4 0.710 9 0.817 3 0.123 4 0.089 7 85.93 0.335 4 46.53 124.96<0.000 1 0.091 0<0.000 1 0.001 0<0.000 1 0.047 1 0.891 5 0.412 5 0.381 3 0.730 6 0.768 9<0.000 1 0.571 6<0.000 1<0.000 1******
续表
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性失拟纯误差总离差9.297E-05 3.620E-05 3.532E-07 10 4 28 92 967.55 90 530.17 1.03 0.536 4
2.2.2 响应面试验结果
各因素间交互作用对菌株q94四甲基吡嗪产量影响的响应面图见图6。由图6可知,6组响应面均呈现开口向下的凸型曲面,表明在设定的各因素水平区间内,四甲基吡嗪产量存在极大值点。接种量与pH响应面呈凸面,等高线呈椭圆形,说明交互作用显著,这与方差分析结果一致。

图6 各因素间交互作用对四甲基吡嗪产量影响的响应面及等高线
Fig.6 Response surfaces plots and contour lines of effect of interaction between various factors on tetramethylpyrazine yield
2.2.3 验证试验
根据响应面分析软件计算得到菌株q94高产TTMP的最优培养条件为:接种量5.94%、初始pH 6.84、85.19 ℃热处理0.91 h,在此条件下,四甲基吡嗪产量预测值为5.67 g/L。为方便实际操作,将最佳发酵工艺参数调整为接种量6.0%、初始pH 6.8、热处理温度85 ℃、热处理时间1.0 h。经试验验证,菌株q94在该条件下四甲基吡嗪的产量为(5.79±0.21)g/L,此试验值与软件预测的理论值相差不大。因此,采用响应面法优化的最佳培养条件的多元回归模型符合实际。优化前菌株q94产出TTMP的含量为3.09 g/L,优化后TTMP产量比优化前提高了87.38%。
菌株q94在此最优条件下的TTMP产量明显高于已有文献报道。范恩帝等[24]从酱香型白酒大曲中筛选出的一株芽孢杆菌,TTMP产量为424 mg/L。王庆等[25]从芝麻香型大曲中筛选出的一株芽孢杆菌,经过优化培养条件后TTMP的产量为728.38 mg/L,本研究与前人研究相比,TTMP产量提高近8倍。
2.3 添加铵盐热处理对四甲基吡嗪产量的影响
添加不同质量浓度磷酸氢二铵进行热处理对四甲基吡嗪与乙偶姻产量的影响见图7。由图7可知,添加适量磷酸氢二铵盐可显著提高菌株q94的TTMP产量(P<0.05),但会显著抑制TTMP前体物质乙偶姻的生成(P<0.05),可能是适量铵盐条件下活性细胞数量的减少,TTMP合成过程中的代谢消耗及作为贮能物质被细胞重新利用所导致[25]。结果表明,发酵结束后添加40 g/L磷酸氢二铵盐进行热处理有效提高了菌株q94发酵产TTMP的能力,在此条件下菌株q94的四甲基吡嗪产量增加至(6.42±0.35)g/L。
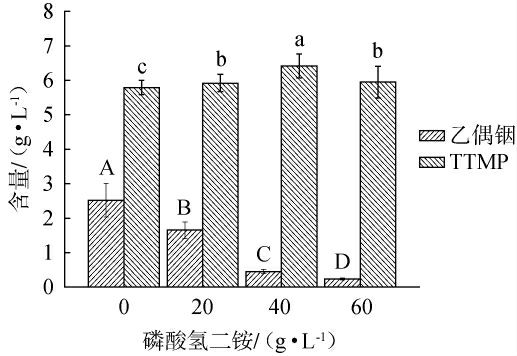
图7 添加铵盐对四甲基吡嗪与乙偶姻产量的影响
Fig.7 Effect of ammonium salt addition on tetramethylpyrazine yield
3 结论
本研究以课题组前期从清香型白酒大曲中筛选、鉴定的枯草芽孢杆菌q94为研究对象,探究接种量、发酵初始pH、发酵时间、热处理温度与热处理时间对其产四甲基吡嗪含量的影响。经单因素试验和响应面试验优化分析可知,最佳发酵条件为接种量6.0%、初始pH 6.8、发酵温度37 ℃、培养时间160 h、热处理温度85 ℃,热处理时间1 h,在此条件下,枯草芽孢杆菌q94四甲基吡嗪的产量最高为(5.79±0.21)g/L,这与模型预测值相符。多元回归方程可较好反映实际实验值,因此可用来分析其响应值变化。同时,发现在最优条件下发酵160 h后,再添加40 g/L磷酸氢二铵后于85 ℃热处理1 h,菌株q94产四甲基吡嗪的产量增加至(6.42±0.35)g/L,比未优化前(3.09 g/L)提高了107.8%。本研究通过对清香型白酒中筛选的功能菌株枯草芽孢杆菌q94的培养条件优化,有效提高了其产出四甲基吡嗪的量,为清香型白酒企业生产和开发四甲基吡嗪含量较高的高品质白酒提供了一定的参考。
[1]孙婷婷,李文艳,蒋燕明,等.白酒中风味成分对饮后舒适度影响的研究进展[J].中国酿造,2025,44(2):14-19.
[2]ZHANG L,LIU Y Q,CAI Z L,et al.Organic-acid-sensitive visual sensor array based on Fenton reagent-phenol/aniline for the rapid species and adulteration assessment of Baijiu[J].Foods,2024,13(13):2139.
[3]FENG Y,BIN Y,CAI H S,et al.Chemical analysis of the Chinese liquor Luzhoulaojiao by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J].Sci Rep-uk,2015,5(1):9553.
[4]季克良,郭坤亮,朱书奎,等.全二维气相色谱/飞行时间质谱用于白酒微量成分的分析[J].酿酒科技,2007(3):100-102.
[5]付欢,陈雪峰,赵燕妮,等.白酒成分分析的研究进展[J].食品与发酵工业,2021,47(21):320-327.
[6]徐志飞,吴宇伉,蒋瑜宏,等.气相色谱质谱联用法测定白酒中4类风味物质[J].食品与机械,2022,38(11):76-81,124.
[7]孙宝国,黄明泉,王娟,等.白酒风味化学与健康功效研究进展[J].中国食品学报,2021,21(5):1-13.
[8]龙亚飞,唐佳代,王相勇,等.中国白酒中健康因子及其富集途径的研究进展[J].中国酿造,2022,41(2):65-69.
[9]丁海龙,沈小娟,宋川,等.中国白酒健康功能成分吡嗪类化合物研究进展[J].中国酿造,2022,41(9):23-28.
[10]薛锡佳,程伟,陈雪峰,等.馥合香型白酒酿造过程中四甲基吡嗪的检测及其溯源分析[J].中国酿造,2024,43(12):38-44.
[11]王娜,沈毅,庄园,等.气相色谱-串联质谱同时测定白酒中20种吡嗪类化合物[J].中国酿造,2025,46(5):30-37.
[12]邱勇,王颖,张煨,等.高产四甲基吡嗪的菌株筛选及其麸曲制作工艺优化[J].中国酿造,2023,42(4):112-117.
[13]刘帮,王西,张亚东,等.中国白酒中四甲基吡嗪的研究进展[J].酿酒科技,2023(4):105-109.
[14]郭春生,杨舟,乔月梅,等.高产四甲基吡嗪微生物的筛选、鉴定及发酵条件优化[J].中国酿造,2022,41(9):80-85.
[15]张锦华,张潇月,白宝清,等.清香型白酒大曲中高产四甲基吡嗪菌株的筛选、鉴定及发酵培养基优化[J].中国酿造,2023,42(3):47-52.
[16]ZHU B F,XU Y.Production of tetramethylpyrazine by batch culture of Bacillus subtilis with optimal pH control strategy[J].J Ind Microbiol Biot,2010,37(8):815-821.
[17]LIU Y B, LI M K, HONG X F, et al.Screening and identification of high yield tetramethylpyrazine strains in Nongxiangxing liquor Daqu and study on the mechanism of tetramethylpyrazine production[J].J Sci Food Agr,2023,103(14):6849-6860.
[18]汤丹丹.枯草芽孢杆菌产吡嗪发酵条件的研究[D].济南:齐鲁工业大学,2015.
[19]吴建峰,徐岩.白酒细菌酒曲固态培养条件下B.subtilis S12产四甲基吡嗪的合成机制[J].食品与生物技术学报,2014,33(1):8-15.
[20]郎繁繁,夏瑶瑶,申瑾,等.不同酿造工艺对山西老陈醋乙偶姻及川芎嗪含量的影响[J].中国酿造,2024,43(6):128-132.
[21]吴建峰.白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学,2013.
[22]郭维伟.地衣芽孢杆菌发酵四甲基吡嗪条件研究[D].济南:齐鲁工业大学,2017.
[23]范恩帝,黄魏,谢丹,等.酱香大曲中高产四甲基吡嗪微生物的选育及应用研究[J].酿酒科技,2022(11):45-50,71.
[24]王庆,王超彦,徐海林,等.高温大曲中高产四甲基吡嗪芽孢杆菌的分离鉴定及发酵条件优化[J].中国酿造,2022,41(10):125-129.
[25]朱兵峰,徐岩.一种用于枯草杆菌发酵生产四甲基吡嗪的补料策略[J].酿酒科技,2011(2):17-22.