蛋白酶是指能催化多肽或蛋白质水解的一类酶的总称,作为工业酶类广泛用于制药、食品、皮革、洗涤剂和废水处理等各个行业,成本效益高、稳定性好且能与传统化学工艺兼容[1-3]。蛋白酶来源广泛,分为动物性、植物性和微生物性蛋白酶。动植物来源的蛋白酶难以满足全球工业生产需求,而微生物来源的蛋白酶因其具有高特异性、低成本、易量产和可改进等优势,成为当前研究热点,约占所有工业酶的70%[4-6]。据报道,工业化生产常用的菌株局限于细菌和霉菌的少数几个菌属,例如芽孢杆菌(Bacillus)、链霉菌(Streptomyces)、米曲霉(Aspergillus oryzae)、黑曲霉(Aspergillus niger)等[7-9],种类有限,因此需要开发新型微生物源的蛋白酶并提高其产量。
好食脉孢菌(Neurospora sitophila)是一种被美国食品药品监督管理局(Food and Drug Administration,FDA)组织认证的安全可食用的丝状真菌[10],其生长速度快,繁殖能力强,营养要求简单,具有较强的蛋白分泌能力和高效代谢系统,在食品行业及饲料工业中展现出良好的应用潜力。在我国南方传统发酵食品中,好食脉孢菌被广泛应用于豆制品生产[11],并可用于合成类胡萝卜素、纤维素酶、木聚糖酶和阿魏酸等[12-14]。近年来,研究已证实好食脉孢菌在面团品质改良[15],提升农业废弃物中的蛋白质、类胡萝卜素等生物活性成分含量,并促进可溶性膳食纤维的生成等方面具有显著效果[16-17]。相关研究主要集中在麸皮、醋糟等农业副产物的固态发酵利用[18],涉及功能成分释放、酶活性调控、发酵产物应用等,好食脉孢菌具有产蛋白酶酶系[19]性能,而关于其产蛋白酶的研究较少。好食脉孢菌利用固态发酵农业副产物时具有很强优势,可通过菌丝延伸并覆盖固体基质的表面及内部而有效利用基质,且对水分活度要求低,可降低杂菌的污染,操作简单,产量较高,产品稳定性好[20]。油菜籽是仅次于大豆的第二类重要油料作物,其榨油后产生了大量的菜籽油饼粕,含有丰富的营养成分,但是目前多用于饲料和肥料,利用率较低[21]。谷糠中含有多酚、多糖、膳食纤维等多种营养物质,谷糠年产量高,但是也未得到充分利用[22]。
因此,本研究以从山西老陈醋醋厂发酵瓶中分离筛选得到的一株产蛋白酶好食脉孢菌(Neurospora sitophila)为研究对象,以蛋白酶活力为响应值,采用单因素试验及响应面试验探究该菌株以农业副产物(菜籽油粕、谷糠)为底物进行固态发酵生产蛋白酶的最佳产酶条件,并对发酵所得粗酶液进行初步纯化,探究其酶学性质,为该蛋白酶应用提供一定理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
菜籽油粕、谷糠:市售;好食脉孢菌(Neurosporasitophila):分离于山西老陈醋醋厂发酵瓶中,保藏于本实验室。
1.1.2 化学试剂
L-酪氨酸(分析纯)、干酪素(生化试剂):上海源叶生物科技有限公司;三氯乙酸、碳酸钠、福林酚、氯化钠、氯化钾、氯化钙、氯化亚铁、磷酸二氢钠、磷酸氢二钠、乙酸钠、乙酸等试剂(均为分析纯):北京索莱宝科技有限公司;硫酸镁、硫酸锰、硫酸锌、硫酸铜(均为分析纯):重庆川东化工有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:北京索莱宝科技有限公司。
固体发酵培养基[23]:干基(菜籽油粕∶谷糠=1∶1)10 g,氯化钙0.36 g,氯化亚铁0.02 g,蒸馏水10 mL,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
TU-1950紫外分光光度计:上海元析仪器有限公司;YXQ-50G高压蒸汽灭菌锅:上海博迅医疗生物仪器股份有限公司;H2100R高速冷冻离心机:上海卢湘仪离心机仪器有限公司;SPJ-150生化培养箱:常州市金坛大地自动化仪器厂;SW-CJ-IF超净工作台:苏州净化设备有限公司。
1.3 方法
1.3.1 好食脉孢菌产蛋白酶发酵条件
将好食脉孢菌以5%的接种量接种于固体发酵培养基中,28 ℃条件下培养3 d。
1.3.2 好食脉孢菌产蛋白酶发酵条件优化单因素试验
在方法1.3.1的基础上,根据预试验结果,以蛋白酶活力为评价指标,分别考察干基(菜籽油粕与谷糠)比例(10∶0、9∶1、8∶2、7∶3、6∶4、0∶10)、料液比(2.0∶1.0、1.5∶1.0、1.0∶1.0、1.0∶1.5、1.0∶2.0,g∶mL),接种量(3%、5%、7%、10%、15%、20%)、发酵温度(26 ℃、28 ℃、30 ℃、32 ℃)、发酵时间(1 d、2 d、3 d、4 d、5 d、6 d、7 d)对好食脉孢菌产蛋白酶活力的影响。
1.3.3 好食脉孢菌产蛋白酶发酵条件优化响应面试验
根据单因素试验结果,选择对结果影响较大的因素料液比(A)、接种量(B)、发酵时间(C)为考察因素,以蛋白酶活力(Y)为响应值,利用Design-Expert 11.0软件设计3因素3水平的Box-Behnken响应面试验,试验因素与水平见表1。
表1 好食脉孢菌产蛋白酶发酵条件优化Box-Behnken响应面试验因素与水平
Table 1 Factors and levels of Box-Behnken response surface experiments for fermentation conditions optimization of protease produced by Neurospora sitophila
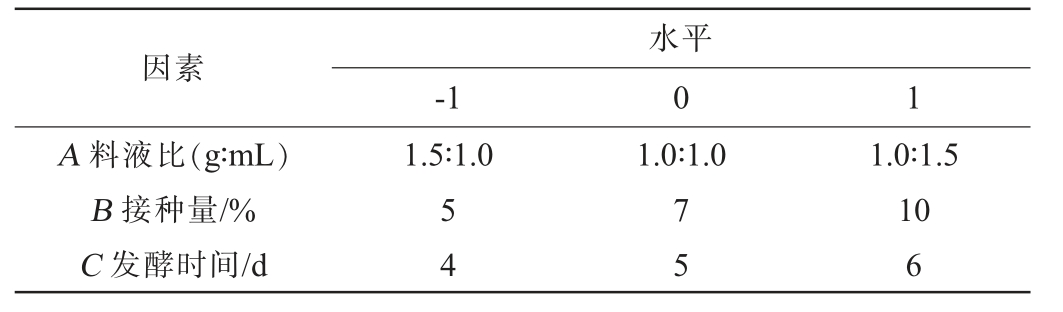
因素-1水平0 1 A 料液比(g∶mL)B 接种量/%C 发酵时间/d 1.5∶1.0 1.0∶1.0 54 75 1.0∶1.5 10 6
1.3.4 蛋白酶活力测定
发酵结束后向发酵瓶中加入50 mL 0.05 mol/L的磷酸钠缓冲液(pH 7.4),150 r/min振荡6 h,采用四层纱布过滤后,4 ℃、8 000 r/min条件下离心20 min,取上清液,参照GB/T 23527.1—2023《酶制剂质量要求 第1部分:蛋白酶制剂》,采用福林酚法测定蛋白酶活力。蛋白酶活力定义:在40 ℃、pH 7.4条件下,1 mL粗酶液1 min水解酪蛋白生成1 μg酪氨酸所需的酶量为1个酶活单位(U/mL)。
1.3.5 蛋白酶初步纯化
发酵结束后,测定发酵液的体积,确定硫酸铵分级沉淀区间使其达到饱和度分别为0~20%、20%~40%、40%~60%、60%~80%。4 ℃、10 000 r/min条件下离心15 min,弃去上清,采用0.05 mol/L的磷酸钠缓冲液(pH7.4)溶解沉淀。冰水浴4 ℃透析24 h后,4 ℃、10 000 r/min条件下离心15 min,得到初步纯化后的酶液[23]。
1.3.6 酶学性质测定
最适温度及热稳定性:分别在25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃条件下测定纯化后酶液的蛋白酶活力,将最高的酶活力定义为100%,计算相对酶活力,探究蛋白酶的最适作用温度。将待测酶液分别在30 ℃、40 ℃、50 ℃、60 ℃水浴保温30 min、60 min、90 min、120 min,然后在40 ℃下测定蛋白酶活力,将未处理的蛋白酶活力定义为100%,计算相对酶活力,探究酶的热稳定性[24]。
最适pH及pH稳定性:分别在不同pH(3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0)的条件下测定纯化后酶液的蛋白酶活力,将最高的酶活力定义为100%,计算相对酶活,探究蛋白酶的最适作用pH。将待测酶液与不同pH(7.0、8.0、9.0、10.0、11.0)的缓冲液等比例混合,对照组为待测酶液与蒸馏水等比例混合,40 ℃条件下水浴保温30 min、60 min、90 min、120 min,测定蛋白酶活力,以对照组的蛋白酶活力定义为100%,计算相对酶活力,探究酶的pH稳定性[24]。不同pH缓冲液体系的浓度均为0.05 mol/L,包括柠檬酸钠缓冲液(pH 3.0~6.0)、磷酸钠缓冲液(pH 7.0~8.0)、碳酸钠-碳酸氢钠缓冲液(pH 9.0~11.0)。
金属离子对蛋白酶活性的影响:配制含有0.01 mol/L各种金属离子(Ca2+、Na+、K+、Mg2+、Zn2+、Fe2+、Cu2+、Mn2+)的 溶液,将待测酶液与金属离子溶液等比例混合,对照组为待测酶液与蒸馏水等比例混合,常温静置60 min,以对照组的蛋白酶活力定义为100%,计算相对酶活力,探究金属离子对酶活性的影响[24]。
1.3.7 数据处理与统计分析
采用Origin 2019、Design-Expert 11.0处理试验数据,SPSS Statistic 26软件进行显著性分析(P<0.05),每组试验重复3次,结果以“平均值±标准差”表示。
2 结果与分析
2.1 好食脉孢菌产蛋白酶发酵条件优化
2.1.1 单因素试验
由图1A可知,当菜籽油粕与谷糠的比例逐渐增大时,相对酶活力呈逐渐升高的趋势,当菜籽油粕与谷糠的比例为10∶0时,相对酶活力达到最高,分析原因可能是菜籽饼粕中含有大量丰富的粗蛋白及粗纤维成分,可以满足好食脉孢菌的生长及产酶的氮源及碳源需求[25-26],若再添加谷糠可能会影响培养基中的氧气流通,导致菌体生长受阻[23],因此,选择菜籽油粕为最佳发酵底物。底物含水量对微生物生长及代谢具有重要作用,由图1B可知,相对酶活力随着料液比增大呈先升高后降低的趋势,当料液比为1∶1(g∶mL)时达到最大,分析原因可能是,底物含水量较低时,菌株生长受到抑制,同时会降低营养物质传输等,然而高水分将导致颗粒结块,影响氧气流通[27]。因此,选择最佳料液比为1∶1(g∶mL)。由图1C可知,随着接种量的升高,相对酶活力呈先升高后下降的趋势,分析原因可能是,接种量过低会延长发酵周期增加成本,然而过高可能会使发酵初期营养消耗增大,产酶阶段营养不足导致产酶量降低[28]。因此,选择最佳接种量为7%。由图1D可知,随着发酵温度的升高,相对酶活力呈先升高后下降的趋势,分析原因可能是由于微生物生长及酶的代谢合成等对温度较敏感,低温会减缓菌丝代谢速度延长生产周期,而高温则会抑制生长[23]。因此,选择最佳的发酵温度为28 ℃。因好食脉孢菌最适生长温度为28~30 ℃,且发酵温度为28 ℃条件下蛋白酶活力显著高于30 ℃条件下的蛋白酶活力(P<0.05),因此,固定发酵温度为28 ℃。由图1E可知,随着发酵时间的延长,相对酶活力呈先升高后下降的趋势,分析原因可能是,发酵时间过短会使产酶不足,时间过长则可能由于进入发酵后期,营养物质不足,微生物产酶降低[28]。因此,选择最佳发酵时间为5 d。

图1 不同单因素条件对好食脉孢菌产蛋白酶活力的影响
Fig.1 Effect of different single factor conditions on the activities of protease produced by Neurospora sitophila
不同小写字母表示差异显著(P<0.05)。下同。
2.1.2 响应面试验
Box-Behnken试验设计及结果见表2,方差分析结果见表3。
表2 好食脉孢菌产蛋白酶发酵条件优化Box-Behnken响应面试验设计及结果
Table 2 Design and results of Box-Behnken response surface experiments for fermentation conditions optimization of protease produced by Neurospora sitophila
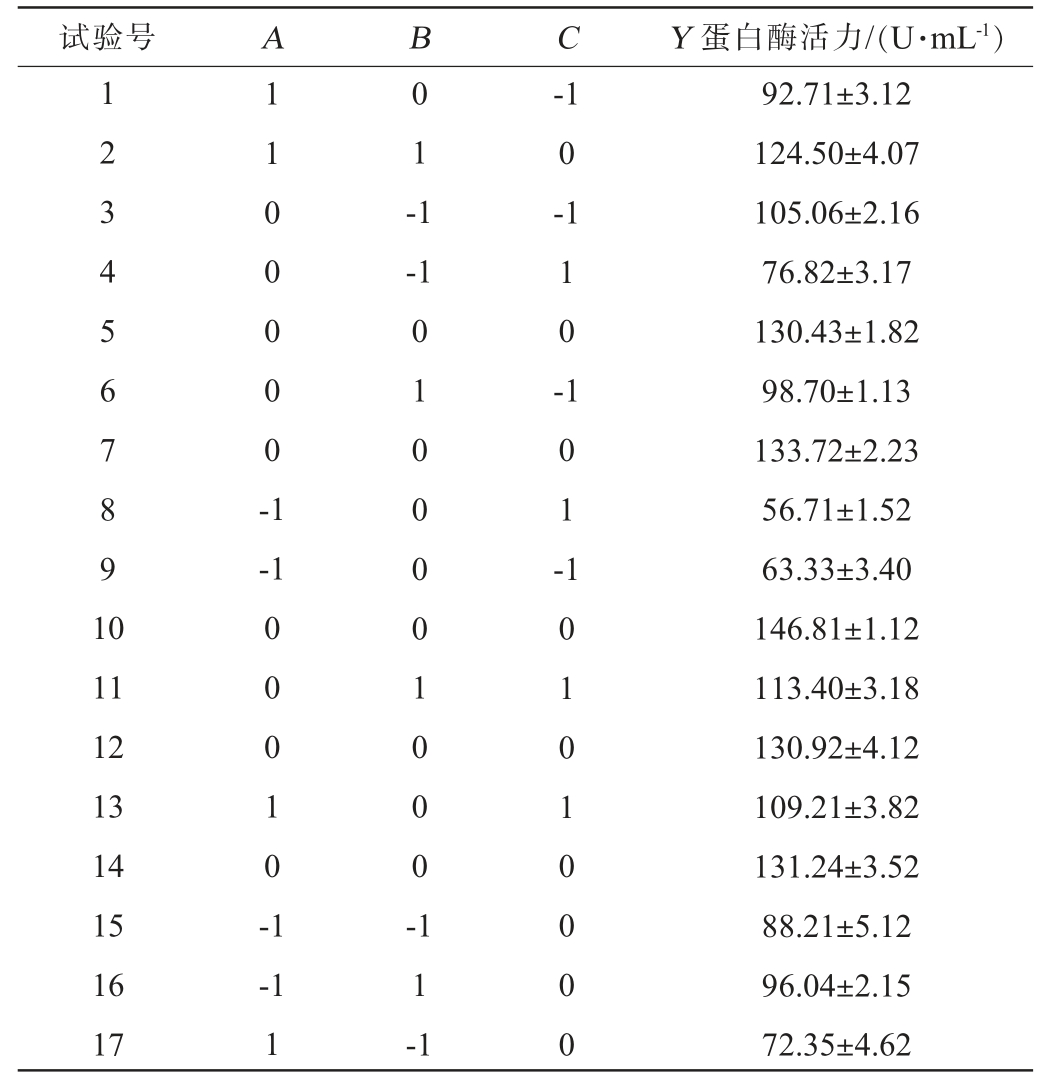
试验号 A B C Y 蛋白酶活力/(U·mL-1)1 2 3 4 5 6 7 8 9 1 0 1 1 0 0 0 0 0 -1 0 1 -1-1 0-1-1 1 0 --1 1 0 1 -11 12 13 14 15 16 17 0 0 0 1 0 -1 0 1 0 0 0 0 1 0 0 0 --1 1 1 1 -1 1 0 1 0 1 0 0 0 0 92.71±3.12 124.50±4.07 105.06±2.16 76.82±3.17 130.43±1.82 98.70±1.13 133.72±2.23 56.71±1.52 63.33±3.40 146.81±1.12 113.40±3.18 130.92±4.12 109.21±3.82 131.24±3.52 88.21±5.12 96.04±2.15 72.35±4.62
表3 回归模型方差分析结果
Table 3 Variance analysis results of the regression model
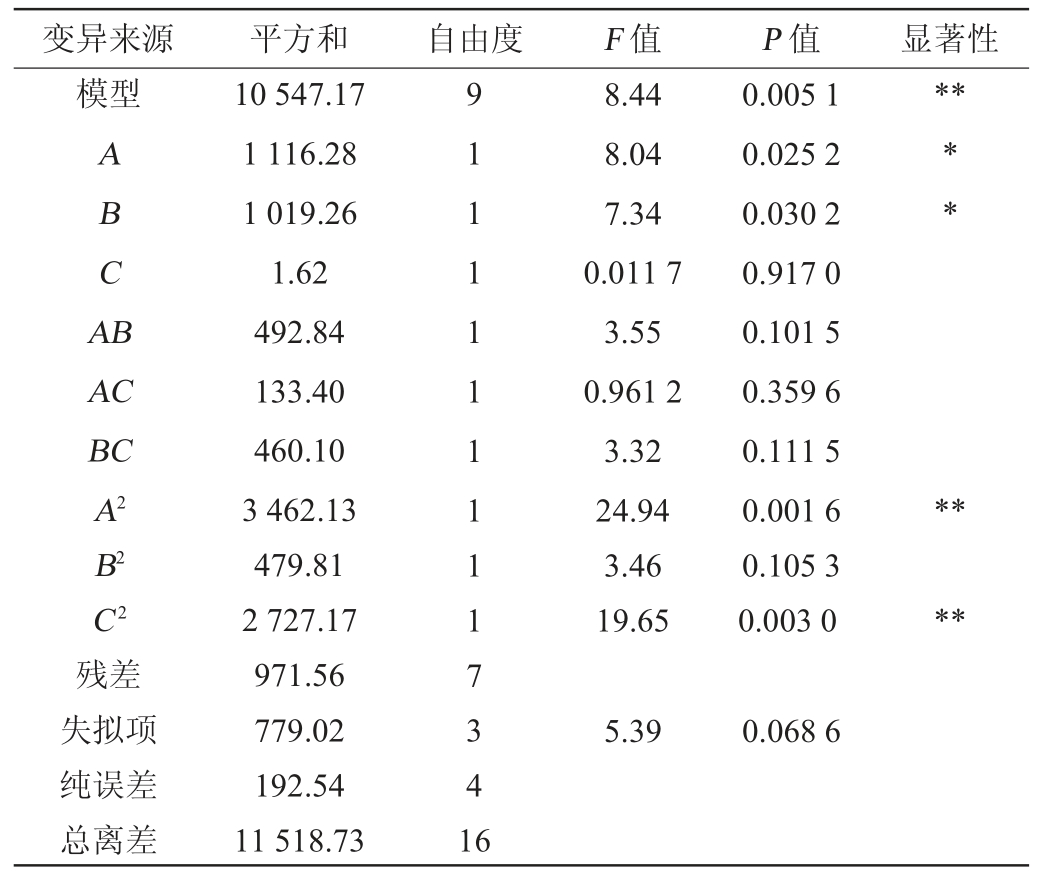
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
变异来源 平方和 自由度 F 值 P 值 显著性模型**ABCA B AC BC A2 B2 C2残差失拟项纯误差总离差10 547.17 1 116.28 1 019.26 1.62 492.84 133.40 460.10 3 462.13 479.81 2 727.17 971.56 779.02 192.54 11 518.73 9 1 1 1 1 1 1 1117341 6 8.44 8.04 7.34 0.011 7 3.55 0.961 2 3.32 24.94 3.46 19.65 0.005 1 0.025 2 0.030 2 0.917 0 0.101 5 0.359 6 0.111 5 0.001 6 0.105 3 0.003 0******5.39 0.068 6
采用Design-Expert 11软件对表2结果进行多元二次回归拟合分析,得到多元二次回归方程:Y=134.60+11.81A+11.29B-0.45C+11.10AB+5.78AC+10.73BC-28.68A2-10.67B2-25.45C2。由表3可知,模型极显著(P<0.01),失拟项不显著(P>0.05),说明模型拟合性良好,可以反映实际情况。根据F值可知,3个因素对蛋白酶活力的影响程度为:料液比>接种量>发酵时间。根据P值可知,一次项A、B对结果影响显著(P<0.05),二次项A2、C2对结果影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。采用Design-Expert 11.0软件对多元二次回归方程进行最优求解,得到最优发酵条件为料液比1.10∶1.00(g∶mL)、接种量7.50%、发酵时间5.00 d,蛋白酶活的预测值为134.60 U/mL,为便于实际操作,将最优发酵条件修订为料液比1∶1(g∶mL)、接种量7%、发酵时间5 d。在此条件下进行3次验证试验,得到蛋白酶活力为129.98 U/mL,与模型预测值接近,说明模型可靠,可以用于优化好食脉孢菌产蛋白酶条件。此外,与优化前相比,酶活力提高了60.21%。
2.2 蛋白酶酶学性质研究
2.2.1 最适作用温度及热稳定性
初步纯化后蛋白酶活力达到208.35 U/mL,比发酵液酶活力提高了60.29%。进一步考察温度对蛋白酶活性的影响,由图2A可知,随着作用温度的升高,酶促反应加快,蛋白酶活力升高;当温度为55 ℃时,蛋白酶活力达到最大值;当温度>55 ℃之后,蛋白酶活力显著降低(P<0.05),因此,确定该蛋白酶的最适作用温度为55 ℃,与目前已报道的蛋白酶性质相似[1]。由图2B可知,蛋白酶在30 ℃和40 ℃条件下分别水浴保温30 min、60 min、90 min时,酶活力较高且变化不显著(P>0.05),当保温时间120 min时,酶活力下降(P<0.05),但仍保持90%以上的酶活力;当蛋白酶在50 ℃和60 ℃条件下分别水浴保温时,随着保温时间的延长,蛋白酶活力显著降低(P<0.05),可能是由蛋白质的热变性引起,但是在50 ℃条件下保温120 min时仍具有64.30%的相对酶活力,结果表明,该蛋白酶在低于50 ℃范围内具有一定的热稳定性。热稳定性好的蛋白酶适合较高温的食品加工环节[29]。
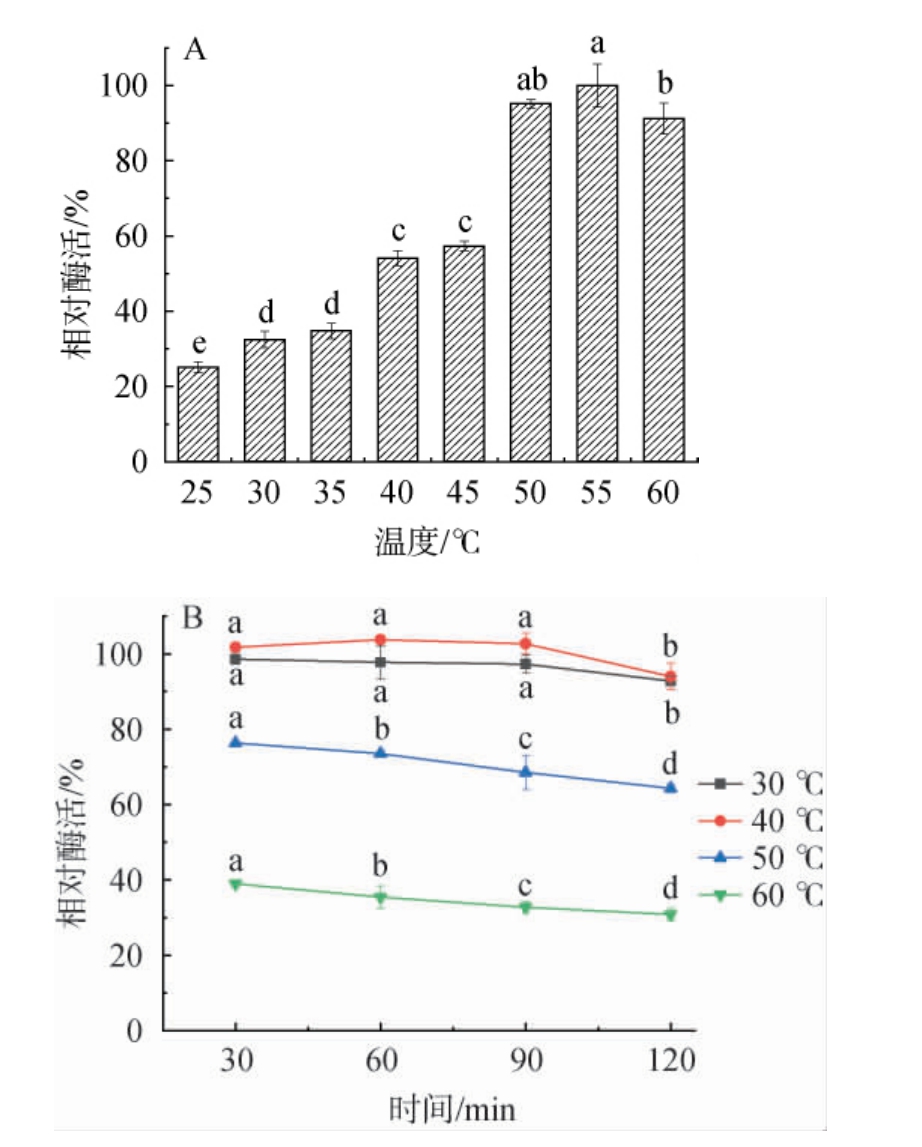
图2 好食脉孢菌产蛋白酶的最适温度(A)及温度稳定性(B)
Fig.2 Optimal temperature (A) and thermal stability (B) of protease produced by Neurospora sitophila
2.2.2 最适作用pH及pH稳定性
由图3A可知,蛋白酶活力随pH值的增大先升高后降低,当pH值为11.0时,酶活力达到最大值,分析原因可能是过酸或过碱条件都会导致酶活力降低,因此,确定该蛋白酶的最适作用pH为11.0。由图3B可知,蛋白酶在pH值为7.0~10.0范围内分别保温30 min、60 min、90 min时活性变化不显著(P>0.05),在pH值为11.0时分别保温30 min、60 min时活性变化不显著(P>0.05),此外,虽然随着保温时间的延长,酶活力显著下降(P<0.05),但相对酶活力均>80%,表明该酶是一种碱性蛋白酶,在碱性环境(pH值为7.0~11.0)中具有良好的稳定性。
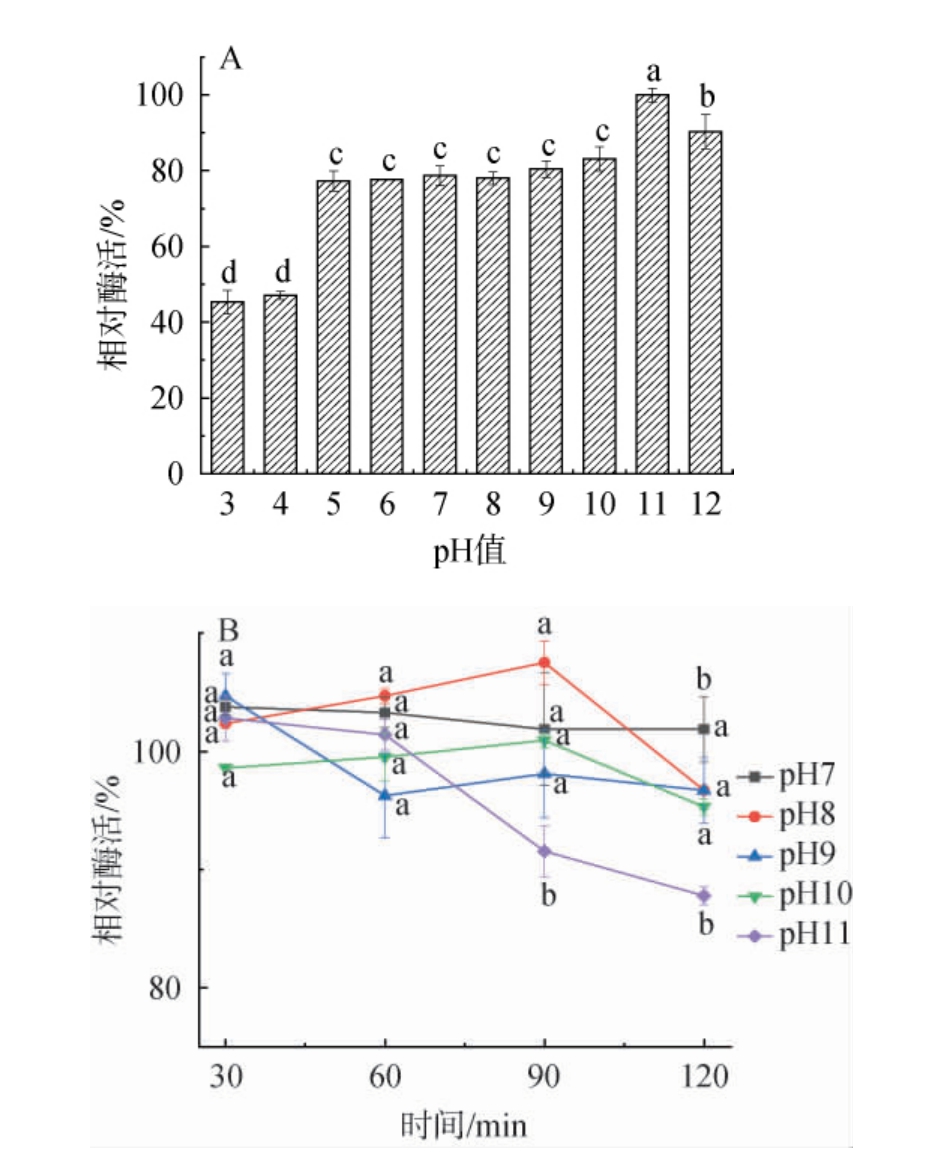
图3 好食脉孢菌产蛋白酶的最适pH(A)及pH稳定性(B)
Fig.3 Optimal pH (A) and pH stability (B) of protease produced by Neurospora sitophila
现有研究表明当前大多数微生物源的碱性蛋白酶来自于细菌[30],而且碱性蛋白酶的最适作用pH值为9.0~11.0,最适作用温度为45~55 ℃[31],这类蛋白酶被广泛应用于饲料和洗涤剂行业[32]。研究发现微生物源的碱性蛋白酶可用于乳制品生产、海产品加工、水解乳清蛋白、改善面筋蛋白等方面[4,33]。另外有些碱性蛋白酶还能够降解纤维蛋白,可用于溶栓药物开发方面[34]。全球人口持续增长与自然资源日益枯竭的双重压力,正推动工业生产领域迫切寻找兼具高效性、安全稳定性与可持续性的蛋白酶资源,本研究筛选的真菌性碱性蛋白酶可为蛋白酶资源的开发提供新的菌种来源,其来源安全性高,而且该蛋白酶的pH适应特性和热稳定性与工业需求相吻合[4,35],表明其具有在食品、医药、洗涤剂和饲料等工业方面的应用潜力。
2.2.3 金属离子对蛋白酶活力的影响
金属离子作为辅助因子与酶的生物活性有关,能提高或者降低酶的稳定性[36]。由图4可知,Mn2+对蛋白酶有显著的激活作用(P<0.05),酶活力提高了149.26%。研究报道,Mn2+使淀粉液化芽孢杆菌(Bacillus amyloliquefaciens)BS5582所产蛋白酶的活性提高了3倍[37],使嗜热假单胞菌(Pseudomonas thermaerum)GW1所产蛋白酶活性提升了5倍[38],表明Mn2+能使蛋白酶达到最佳活性,对维持酶的活性构象起着关键作用。Mg2+对酶活力的影响不显著(P>0.05),然而Ca2+、Na+、K+、Fe2+、Cu2+对酶活力具有显著的抑制作用(P<0.05),其中Fe2+对蛋白酶活力抑制作用最强,酶活力降低了31.78%。
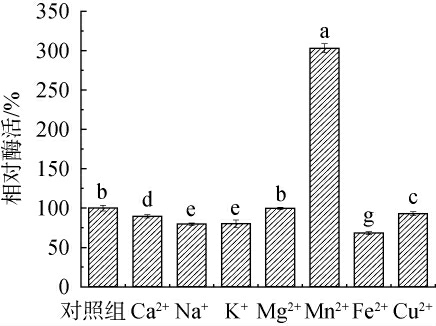
图4 金属离子对好食脉孢菌产蛋白酶活性的影响
Fig.4 Effect of metal ions on the activity of protease produced by Neurospora sitophila
3 结论
本研究采用单因素试验和响应面试验优化得到好食脉孢菌(Neurospora sitophila)固态发酵农业副产物(菜籽油粕、谷糠)产蛋白酶的最佳发酵条件为菜籽油粕10 g、料液比1∶1(g∶mL)、接种量7%、发酵温度28 ℃、发酵时间5 d。在此条件下,蛋白酶活力为129.98 U/mL,比优化前提高60.21%。好食脉孢菌所产蛋白酶的最适作用温度和pH值分别为55 ℃和11.0,且在低于50 ℃和碱性环境(pH 7.0~11.0)中具有良好的稳定性;Mn2+对蛋白酶活力有显著激活作用(P<0.05),Ca2+、Na+、K+、Fe2+和Cu2+对酶活力具有显著的抑制作用(P<0.05)。本研究结果对开发新型产蛋白酶菌株具有重要的应用意义。
[1]艾雨晴,陈松骏,秦娟,等.微生物产蛋白酶的研究进展[J].食品工业科技,2021,42(19):451-458.
[2]NAVEED M,NADEEM F,MEHMOOD T,et al.Protease-a versatile and ecofriendly biocatalyst with multi-industrial applications: An updated review[J].Catal Lett,2021,151:307-323.
[3]AKKAYA S N, ALMANSOUR A, ALTINTAS R, et al.Purification,characterization,optimization,and docking simulation of alkaline protease produced by Brevibacillus agri SAR25 using fish wastes as a substrate[J].Food Chem,2025,471:142816.
[4]张尧,王佳欣,温婵婵,等.微生物源蛋白酶和脂肪酶分类、特性及在食品工业中的应用进展[J].食品工业科技,2025,46(3):415-424.
[5]RAVEENDRAN S, PARAMESWARAN B, UMMALYMA S B, et al.Applications of microbial enzymes in food industry[J].Food Technol Biotech,2018,56:16-30.
[6]BARZKAR N.Marine microbial alkaline protease: An efficient and essential tool for various industrial applications[J].Int J Biol Macromol,2020,161:1216-1229.
[7]YILMAZ B, BALTACI M O, SISECIOGLU M, et al.Thermotolerant alkaline protease enzyme from Bacillus licheniformis A10: purification,characterization,effects of surfactants and organic solvents[J].J Enzyme Inhib Med Chem,2016,31(6):1241-1247.
[8]SODAGAR N,JALAL R,NAJAFI M F,et al.A novel alkali and thermotolerant protease from Aeromonas spp.retrieved from wastewater[J].Sci Rep,2024,14(1):26000.
[9]ELHAMDI M,BELHADJLETAIEF C,HMIDET N,et al.Proteases and keratinases from Bacillus zhangzhouensis MH1:Practical use in detergent,leather,and waste management processes[J].Int J Biol Macromol,2025,284:138036.
[10]PERKINS D D,DAVIS R H.Evidence for safety of Neurospora species for academic and commercial uses[J].Appl Environ Microb,2000,66(12):5107-5109.
[11]DENG Y, LIU X, KATROLIA P, et al.A dual-function chymotrypsinlike serine protease with plasminogen activation and fibrinolytic activities from the GRAS fungus,Neurospora sitophila[J].Int J Biol Macromol,2018,109:1338-1343.
[12]LIU X L,KOPPARAPU N K,ZHENG H C,et al.Purification and characterization of a fibrinolytic enzyme from the food-grade fungus, Neurospora sitophila[J].J Mol Catal B-Enzym,2016,134:98-104.
[13]EFFIONG T, ABDULSALAMI M, EGBE N, et al.Screening of fungi isolates from soil,pulp waste water and rotten wood for cellulase producing potentials[J].J Appl Sci Environ Manage,2019,23:1051.
[14]COUTO S R, SANROMÁN M.Application of solid-state fermentation to food industry-A review[J].J Food Eng,2006,76(3):291-302.
[15]王雨晴,辛嘉英,徐阳.好食脉孢菌发酵小麦麸皮回添对面团品质的影响[J].粮食与油脂,2023,36(8):31-36.
[16]许锡凯.好食脉孢菌固态发酵麦麸制备可溶性膳食纤维及其功能性质[D].哈尔滨:哈尔滨商业大学,2021.
[17]WANG K,YU Y,LIU S,et al.A review of the current state and future prospects in resource recovery of C hinese cereal vinegar residu e[J].Foods,2022,11(20):3256.
[18]RAMADHANI A N,RUWAIDAH L A,RAHMAN H M,et al.Utilization of waste banana peels and corn cobs as substrates in Neurospora sitophila fermentation for production of natural yellow dyes[J].J Rek Kim Lingk,2024,19:26-37.
[19]段睿,邓永平,刘晓兰,等.好食脉孢菌固态发酵醋糟产木聚糖酶的工艺优化[J].食品与机械,2019,35(10):214-217,222.
[20]WU S,ZHANG Y,CHEN B,et al.Combined treatment of rice bran by solid-state fermentation and extrusion:Effect of processing sequence and microbial strains[J].Food Chem X,2024,23:101549.
[21]焦健双,董晓丹,邱斌,等.油菜籽的加工现状与研究趋势[J].食品科技,2024,49(6):187-193.
[22]蔡颍锟.谷糠多酚的制备及其抗炎活性评价与分子机制研究[D].济南:齐鲁工业大学,2025.
[23]段雅洁.粗糙脉孢菌纤溶酶的固态发酵、分离纯化及其酶学性质研究[D].重庆:西南大学,2022.
[24]高飞,李雪,修琳,等.蜜环菌发酵玉米醇溶蛋白中蛋白酶学性质研究[J].中国食品学报,2024,24(8):62-71.
[25]陈济洋,魏登,李超,等.油菜籽饼粕风味豆酱生产工艺研发[J].中国调味品,2018,43(10):137-142.
[26]王殿友,任健.好食脉孢菌固态发酵脱脂葵花籽粕制备抗氧化活性肽的研究[J].中国油脂,2014,39(10):30-33.
[27]丁长河,尹萌,张梦涵.锁掷孢酵母固态发酵产β-胡萝卜素的工艺优化[J].粮食与油脂,2021,34(2):108-112.
[28]XU X,LIN M,ZANG Q,et al.Solid state bioconversion of lignocellulosic residues by Inonotus obliquus for production of cellulolytic enzymes and saccharification[J].Bioresource Technol,2018,247:88-95.
[29]AHMED U, PFANNSTIEL J, STRESSLER T, et al.Purification and characterization of a fungal aspartic peptidase from Trichoderma reesei and its application for food and animal feed protein hydrolyses[J].J Sci Food Agr,2022,102:5190-5199.
[30]程磊,王正祥.黑曲霉碱性蛋白酶CpyC的生化特征解析[J].食品与发酵工业,2024,50(23):1-6.
[31]PAN Y,HE W,GAO J,et al.Microencapsulated alkaline protease with enhanced stability and temperature resistance for silk degumming[J].Colloids Surface A,2025,707:135894.
[32]SONG P,ZHANG X,WANG S,et al.Microbial proteases and their applications[J].Front Microbiol,2023,14:1236368.
[33]彭思远,卫安琪,陈铖,等.酶解面筋蛋白对面条品质的影响[J].食品研究与开发,2025,46(15):1-6.
[34]JIANG Q,WANG L,LIU Q,et al.Purification and characterization of a novel fibrinolytic enzyme from Whitmania pigra Whitman[J].Protein Expr Purif,2020,174:105680.
[35]郝漫,邵岚莹,公为峰,等.耐热碱性蛋白酶AH-101的异源表达、酶学性质与洗涤应用研究[J].中国生物工程杂志,2024,44(4):23-32.
[36]余茜,张国丽,敖晓琳.金属离子对微生物蛋白酶活性的影响及机理[J].中国食品学报,2019,19(4):287-294.
[37]任涛,钮成拓,郑飞云,等.淀粉液化芽孢杆菌BS5582产蛋白酶的发酵条件优化、酶学性质分析及其在牛皮脱毛中的应用[J].食品与发酵工业,2024,50(22):106-114.
[38]SHARMA K M,KUMAR R,PANWAR S,et al.Microbial alkaline proteases:Optimization of production parameters and their properties[J].J Genet Eng Biotechnol,2017,15:115-126.