烟草(Nicotiana tabacum L.)隶属于茄科(Solanaceae)烟草属(Nicotiana sp.)植物,原产于南美洲,在我国各地均有种植[1]。我国作为烟草种植、卷烟生产和消费的大国,市场份额约占全世界的2/5[2],因此,提升卷烟原料质量和技术创新,是当前各卷烟工业研究的重点。复烤后烟叶醇化是改善烟叶品质、提升烟叶香气[3]的重要过程,在烟叶醇化过程中,微生物对烟叶进行了一种温和的生物和化学[4-6]作用,微生物在烟叶环境中可降解蛋白质、淀粉、纤维素和果胶等大分子物质,有效降低了尼古丁、苯并芘等有害物质[7],促进了烟叶产生糠醛、紫罗兰酮等香味物质[8],缩短了发酵时间[9]。因此,研究不同产区醇化烟叶微生物菌群结构多样性及功能,对于明确不同产区醇化烟叶的优势功能菌群、提升烟叶内在品质具有重要意义。
陈化烟叶表面的微生物主要分为细菌、霉菌、放线菌和酵母菌,其中优势菌群为细菌[10-11]。烟叶表面克雷伯菌属(Klebsiella)、不动杆菌属(Acinetobacter)、肠杆菌属(Enterobacter)和芽孢杆菌属(Bacillus)微生物可以有效降解蛋白质、淀粉、果胶、西柏烯、β-胡萝卜素、叶黄素,产生笨乙醛、芳樟醇等香味物质[12-13],有效缩短发酵时间,提升烟叶品质[14]。而在烟叶中添加微生物进行发酵,可有效降解烟叶中的总氮、淀粉含量,提升烟叶的化学协调性,增加烟叶的香味,降低杂质,提升烟叶内在品质[15]。不同醇化年份的烟叶表面微生物种类及代谢途径也不同,醇化4年的烟叶表面微生物多样性最丰富,主要为泛菌属(Pantoea)和假单胞菌属(Pseudomonas),其参与到氨基酸代谢和脂肪酸代谢等多条代谢途径[16]。而同一年份不同香型的烟叶表面微生物也不同,清香型表面微生物最丰富,3个香型主要的微生物菌群为鞘氨醇单胞菌属(Sphingomonas)、丁酸杆菌属(Buttiauxella)、假单胞菌属(Pseudomonas)等[17]。张碰元等[18]研究不同醇化方式对津巴布韦烟叶微生物和香味成分的影响发现,优势菌群为假单胞菌属(Pseudomonas)、泛菌属(Pantoea)、鞘氨醇单胞菌属(Sphingomonas)、节杆菌属(Arthrobacter)和甲基杆菌属(Methylobacterium),且随着醇化时间的延长,烟叶的香味成分总量不断升高。
烟草醇化作为关系卷烟质量的重要基础,但国内关于微生物发酵烟叶的研究较少,且烟叶表面约99%的微生物都是不可培养的,可培养微生物仅占其中的一小部分[19-21],因此,利用高通量测序技术对不同产区醇化烟叶表面微生物群落多样性及结构进行研究,已经成为当前研究的重点[22]。本研究以国内南北方不同产区醇化4年的烟叶为研究材料,利用宏基因组测序技术对烟叶表面的微生物菌群多样性及结构进行研究,探究其表面微生物菌群的差异,并通过京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库、同源基因组簇(Clusters of Orthologous Groups,COG)数据库、碳水化合物活性酶(Carbohydrate-Active enZymes,CAZy)数据库对微生物功能进行预测分析。挖掘改善烟叶质量菌种,为工业企业的卷烟配方及烟叶微生物提质增效提供研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
供试的5份烟叶样品均为2024年从内蒙古昆明卷烟有限责任公司仓库采集的经4年醇化的烟叶,具体信息见表1,烟叶经复烤后封箱统一存放于片烟仓库,仓库温度控制在(30±3)℃,相对湿度控制在(60±5)%。
表1 烟叶样品信息
Table 1 Information of tobacco leaves samples
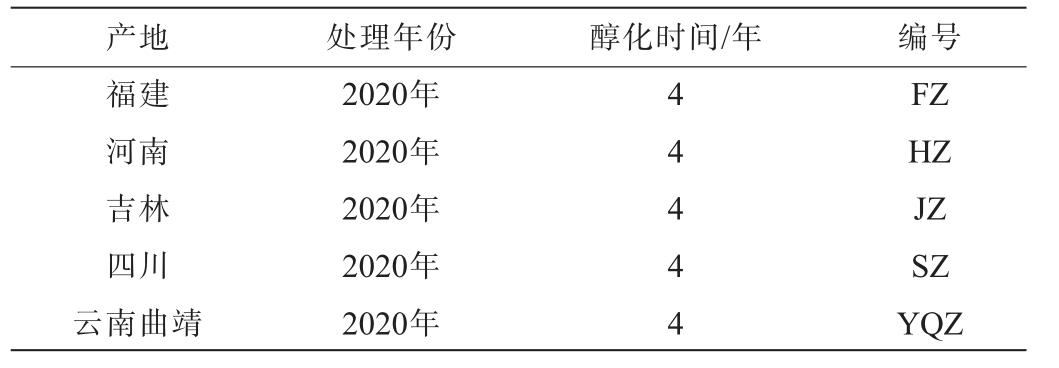
产地 处理年份 醇化时间/年 编号福建河南吉林四川云南曲靖2020年2020年2020年2020年2020年44444 FZH Z JZ SZ YQZ
1.1.2 试剂
磷酸盐缓冲液(phosphate buffer saline,PBS)、琼脂糖凝胶:国药集团化学试剂有限公司;聚合酶链式反应(polymerase chain reaction,PCR)Master Mix with GC Buffer、脱氧核糖核酸(deoxyribonucleic acid acid,DNA)聚合酶(5 U/μL)、E.Z.N.ATMMag-Bind Soil DNA试剂盒:美国Omega公司。
1.2 仪器与设备
S210-K台式pH计:瑞士梅特勒-托利多公司;DYY-5D型琼脂糖水平电泳仪:北京市六一仪器厂;5430R台式高速冷冻离心机、Mastercycler nexus gradient梯度PCR仪:德国Eppendorf公司;ChemiScope 6200 Touch荧光凝胶成像系统:上海勤翔科学仪器有限公司;Qubit3.0浓度检测仪:美国invitrogen公司;Covaris M220超声破碎仪:赛默飞世尔科技公司;Illumina Novassq 6000测序平台:美国Illuimina公司。
1.3 方法
1.3.1 醇化烟叶样品处理
称取50 g醇化烟叶样品剪碎后置于装有500 mL PBS(pH=7.0)的锥形瓶中,在28 ℃、200 r/min条件下振荡1 h,然后在超净工作台内用高温灭菌的双层纱布多次过滤,直至没有明显的烟叶碎片,收集滤液后于4 ℃、7 000 r/min条件下离心25 min,倒出上清液后,收集的沉淀即包含了醇化烟叶表面微生物。
1.3.2 醇化烟叶表面微生物宏基因组DNA提取及宏基因组测序
采用E.Z.N.ATM Mag-Bind Soil DNA Kit试剂盒参照其说明书提取醇化烟叶表面微生物的宏基因组DNA,采用Qubit 3.0检验提取的总DNA浓度,使用1%琼脂糖凝胶对提取的宏基因组DNA进行完成性检测,检测合格的宏基因组总DNA使用Covaris M220超声破碎仪打断成300 bp的小片段,然后对片段化的DNA进行末端修复、3'端加A、连接测序接头、对连接产物进行纯化片筛、文库扩增、产物纯化等步骤构建测序文库,构建好的测序文库经定量质检合格后委托北京百迈客生物科技有限公司基于Illumina Novassq 6000测序平台进行宏基因组测序[23]。
1.3.3 数据处理及分析
测序数据处理:测序得到的原始数据根据双端序列利用PE reads的overlap关系进行拼接,并用FLASH、bowtie 2软件通过对序列进行过滤,去除质量差的reads、拼接效果差的Tags[24],并对样品进行区分,最终得到有效数据。
物种组成分布、Alpha多样性和差异分析:使用UPARSE软件[25],以97%的相似度对有效数据进行聚类,获得操作分类单元(operational taxonomic unit,OTU),并基于NR数据库和已知的物种进行比对,将每个OTU中丰度最高的序列作为OTU代表,采用贝叶斯算法对以上序列进行注释、分类,在各分类学水平上统计各样本群落组成[26]。使用Mothur(version v.1.30)软件对样品Alpha多样性性(Chao1指数、Ace指数、Shannon指数、Simpson指数和Coverage指数)进行分析[27]。利用R语言进行主成分分析(principal component analysis,PCA)及物种间差异分析,并绘制韦恩图。
微生物功能预测分析:利用KEGG数据库、COG数据库及CAZy数据库等对醇化烟叶表面微生物功能进行分析,探究不同样品间功能的差异性。
2 结果与分析
2.1 不同产区醇化烟叶样品表面微生物高通量测序分析结果
基于OTU数绘制不同产区醇化烟叶样品表面微生物的稀疏曲线,结果见图1。由图1可知,随着测序深度的增加,5个醇化烟叶样品表面微生物的OTU数呈先升高后趋于平缓的趋势,当测序深度在2 230 000条时趋于平缓,说明OTU数目随着测序的进行增加极少,测序数据合理,能够满足后续分析。
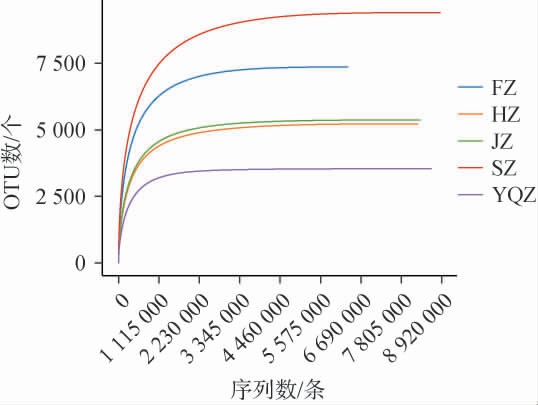
图1 基于操作分类单元数不同产区醇化烟叶样品表面微生物稀释曲线
Fig.1 Dilution curves of microorganisms on the surface of aged tobacco leaves samples from different production areas based on operational taxonomic units
不同产区醇化烟叶样品表面微生物的高通量测序及注释结果见表2及图2。由表2可知,从5个醇化烟叶样品表面微生物共获得有效序列11 771 049条,共注释到157个门、161个纲、337个目、789个科、2 699个属。由图2可知,5个醇化烟叶样品表面微生物含有1 362个共有菌属,四川产区醇化烟叶特有421个菌属,福建产区醇化烟叶特有167个菌属,河南、吉林、云南曲靖产区醇化烟叶分别特有59、51、8个菌属。
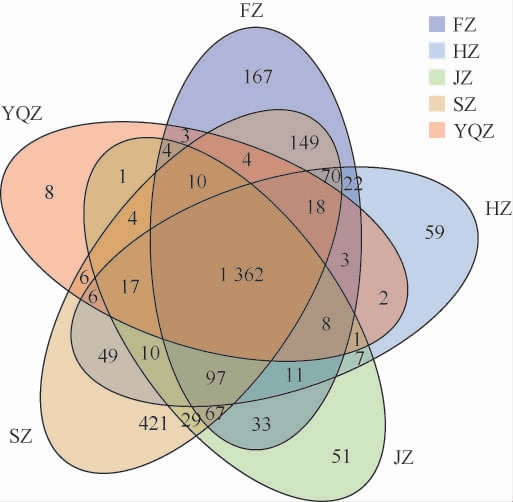
图2 不同产区醇化烟叶样品表面微生物属Venn图
Fig.2 Veen diagram of microbial genera on the surface of aged tobacco leaves samples from different production areas
表2 不同产区醇化烟叶样品表面微生物高通量测序及注释结果
Table 2 High-throughput sequencing and annotation results of microorganisms on the surface of aged tobacco leaves samples from different production areas
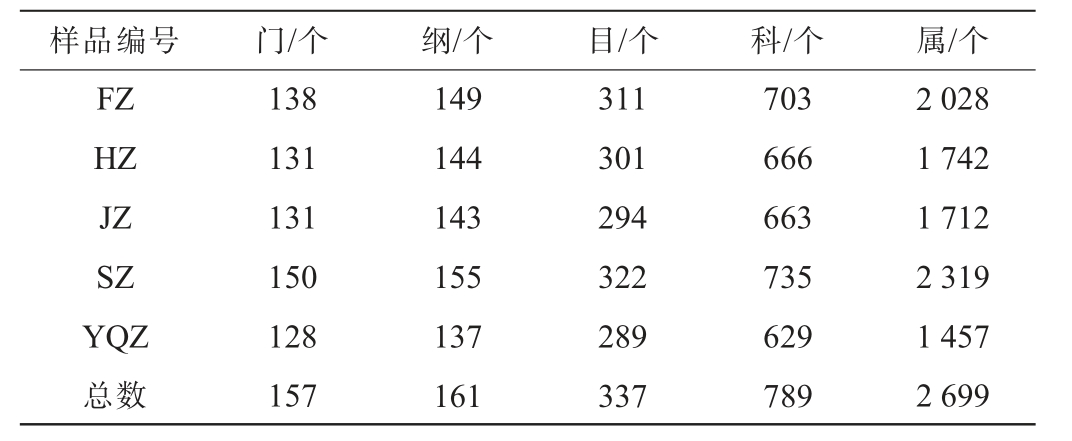
样品编号 门/个 纲/个 目/个 科/个 属/个FZ HZ JZ SZ YQZ总数138 131 131 150 128 157 149 144 143 155 137 161 311 301 294 322 289 337 703 666 663 735 629 789 2 028 1 742 1 712 2 319 1 457 2 699
2.2 不同产区醇化烟叶样品表面微生物Alpha多样性分析
Alpha多样性用于分析样本物种的丰富度及多样性,其中,ACE指数、Chao1指数表示物种丰富度,ACE指数、Chao1指数越大,物种丰富度越高;Shannon指数、Simpson指数表示物种多样性,Shannon指数越大,Simpson指数越小,说明物种多样性越高[28]。不同产区醇化烟叶样品表面微生物Alpha多样性分析结果见表3。由表3可知,5个产区醇化烟叶样品的Coverage值均为0.999 9,说明样品的文库覆盖率较高,所测数据具有代表性。SZ和FZ样品微生物的丰富度指数(ACE指数、Chao1指数)均显著高于其余3个样品(P<0.05),且SZ样品显著最高(P<0.05),YQZ样品微生物的丰富度指数显著低于其余4个样品(P<0.05),HZ和JZ样品微生物的丰富度指数差异不显著(P>0.05)。SZ样品微生物的Shannon指数显著高于其余4个样品(P<0.05),YQZ样品微生物的Shannon指数显著低于其余4个样品(P<0.05),YQZ样品微生物的Simpson指数低于其余4个样品,但不显著(P>0.05)。总体的醇化烟叶样品表面微生物的多样性和丰富度均为:四川>福建>吉林>河南>云南曲靖,相对而言,南方烟叶样品表面微生物更丰富。分析原因一方面可能是,南方产区气候多潮湿炎热,雨水相对于北方较多,烟叶在生长过程中可能携带部分来源于产地的微生物,在烟叶醇化过程中随着醇化时间的增加,烟叶表面的优势菌群也会随着发生变化[29];另一方面可能是,烟叶表面的微生物可能来源于储存环境,随着环境变化,烟叶微生物群落组成可能也会发生变化。
表3 不同产区醇化烟叶样品表面微生物Alpha多样性分析结果
Table 3 Alpha diversity analysis results of microorganisms on the surface of aged tobacco leaves samples from different production areas
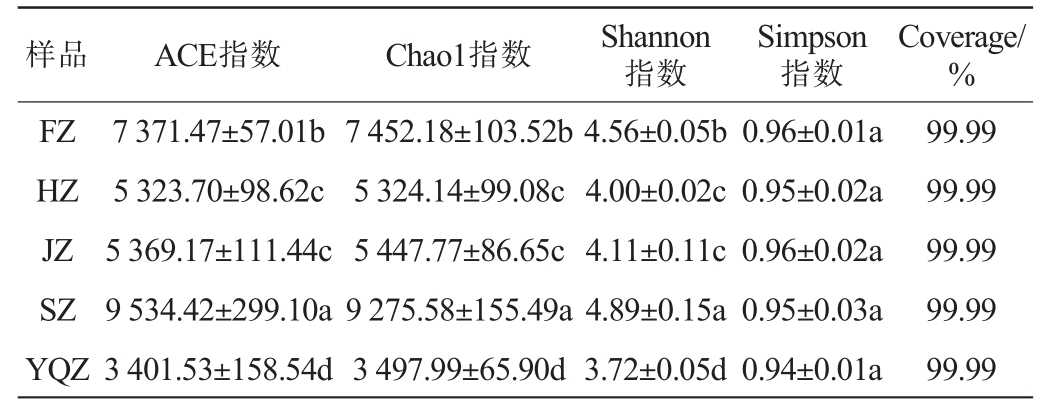
注:同列不同小写字母表示差异显著(P<0.05)。
样品 ACE指数 Chao1指数 Shannon指数Simpson指数Coverage/%FZ HZ JZ SZ YQZ 7 371.47±57.01b 5 323.70±98.62c 5 369.17±111.44c 9 534.42±299.10a 3 401.53±158.54d 7 452.18±103.52b 5 324.14±99.08c 5 447.77±86.65c 9 275.58±155.49a 3 497.99±65.90d 4.56±0.05b 4.00±0.02c 4.11±0.11c 4.89±0.15a 3.72±0.05d 0.96±0.01a 0.95±0.02a 0.96±0.02a 0.95±0.03a 0.94±0.01a 99.99 99.99 99.99 99.99 99.99
2.3 不同产区醇化烟叶样品表面的微生物菌群组成
不同产区烟叶样品表面微生物在门和属水平上的分布见图3。由图3a可知,除未知菌门外,5个产区醇化烟叶样品表面微生物的共有优势菌门(平均相对丰度>1%)为变形菌门(Proteobacteria)(57.27%~60.10%)、厚壁菌门(Firmicutes)(8.48%~12.64%)、拟杆菌门(Bacteroidetes)(8.41%~9.93%)、放线菌门(Actinobacteria)(1.34%~11.09%)、毛霉门(Mucoromycota)(1.66%~2.32%)、Artverviricota(1.17%~1.79%);此外,FZ、HZ、JZ样品共有的优势菌门还包括担子菌门(Basidiomycota)(1.01%~4.48%),FZ、HZ、JZ、YQZ样品共有的优势菌门还包括子囊菌门(Ascomycota)(1.04%~1.32%),这与田丽君等[17,30]的研究结果一致。烟叶表面的微生物代谢活动可以改善烟叶品质,缩短烟叶发酵时间,降解烟碱增加烟叶香气[9,11]。变形菌门、厚壁菌门、放线菌门、子囊菌门、毛霉门和担子菌门多存在于烟草土壤或其他植物土壤中,有助于改善烟草生长发育,烟叶中的微生物群落结构可能和烟草土壤微生物群落结构相关[31-34]。烟叶中的变形菌门、厚壁菌门和放线菌门微生物有助于烟叶中有机质的降解,提升烟叶品质[35]。
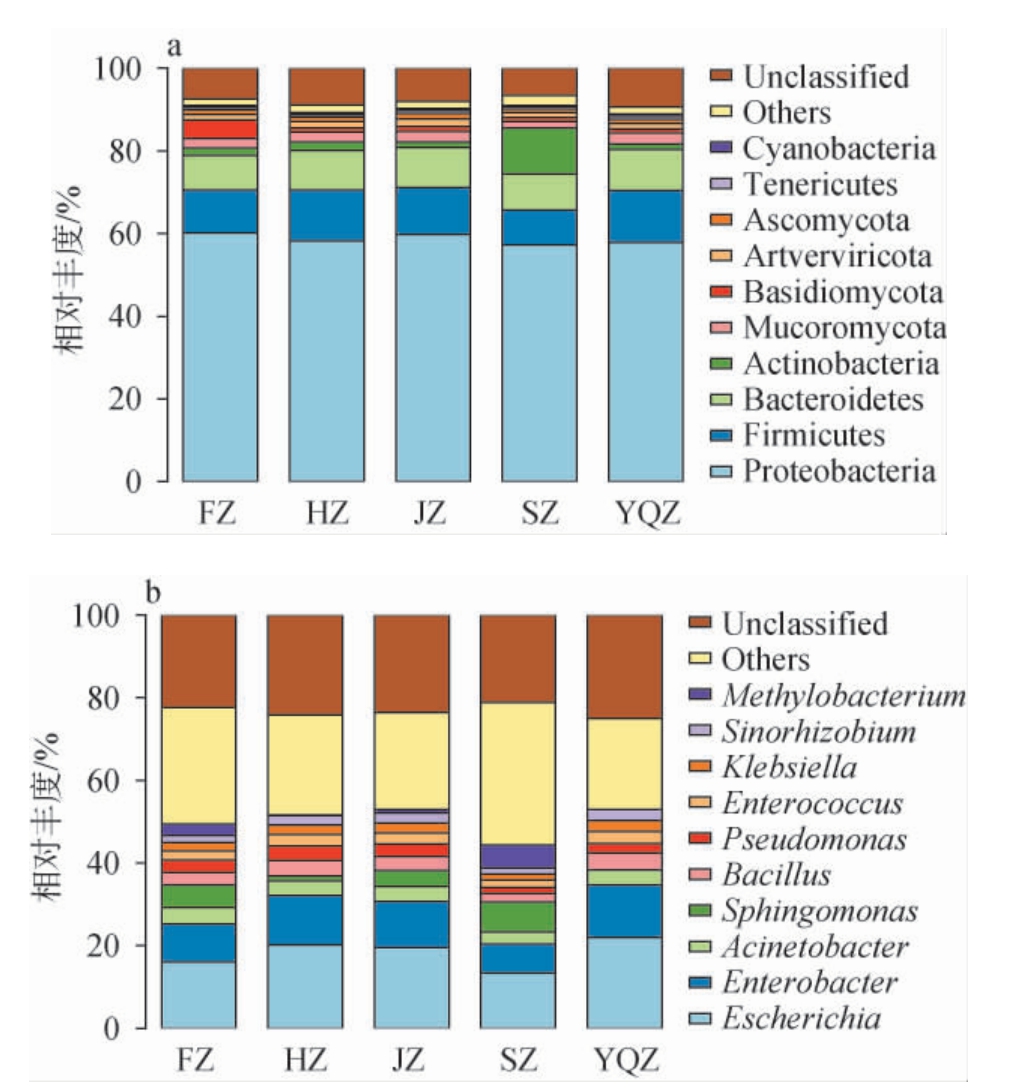
图3 基于门(a)和属(b)水平不同产区醇化烟叶样品表面微生物菌群结构
Fig.3 Microbial community structure on the surface of aged tobacco leaves samples from different production areas based on the phylum (a) and genus (b) levels
Others:平均相对丰度排名10之后的菌门或菌属。
由图3b可知,除未知菌属和其他菌属外,5个产区烟叶样品表面的共有优势菌属(平均相对丰度>1%)为埃希氏杆菌属(Escherichia)(13.38%~22.01%)、肠杆菌属(Enter obacter)(6.99%~12.69%)、不动杆菌属(Acinetobacter)(2.90%~4.06%)、芽孢杆菌属(Bacillus)(2.02%~4.03%)、假单胞菌属(Pseudomonas)(1.48%~3.51%)、肠球菌属(Enterococcus)(1.77%~2.88%)、克雷白杆菌属(Klebsiella)(1.55%~2.59%)、中华根瘤菌属(Sinorhizobium)(1.43%~2.66%)。此外,FZ、HZ、JZ、SZ样品中共有的优势菌属还包括鞘氨醇单胞菌属(Sphingomonas)(1.14%~7.33%);FZ和SZ样品中共有的优势菌属还包括甲基杆菌属(Methylobacterium),相对丰度分别2.70%和5.46%,这与浦绍占等[36-37]的研究结果相似,但也有区别,区别在于其他研究表明烟叶表面优势菌属还有类芽孢杆菌属(Paenibacillus)等,究其原因可能和烟叶产地的气候环境、发酵环境和烟叶发酵时间等息息相关[38]。肠杆菌属和鞘脂单胞菌属作为烟叶发酵过程中的重要菌属,参与烟叶大分子物质降解,加速了烟叶发酵时间,提升了烟叶品质[36]。研究表明,肠杆菌属作为雪茄烟叶发酵时期中的优势菌属,可能参与了氨基酸代谢、碳水化合物的运输等生物功能[39];在烟叶中添加肠杆菌属和不动杆菌属细菌后进行发酵,可以提升烟叶中还原糖、总糖的含量,增加烟叶香味物质,降低烟叶感官刺激性和杂气[40-41];烟叶优势菌群鞘脂单胞菌属微生物含有淀粉、蛋白质降解的相关基因,能够降解烟叶中的淀粉、蛋白质[42-44],产生醛、酮等香味物质[45];芽孢杆菌属细菌在烟叶发酵过程中,可以协调化学成分,增加烟叶香气物质含量,提升烟叶感官质量[46];然而,埃希氏杆菌属作为常见的基因工程菌属,目前尚未有关于其在烟叶中的相关报道。
2.4 不同产区醇化烟叶样品间表面微生物差异分析
基于属水平对不同产区醇化烟叶样品间表面微生物差异进行分析,结果见图4。由图4可知,第1主成分(principal component 1,PC1)的方差贡献率为95.63%,第2主成分(PC2)的方差贡献率为3.03%,前两个主成分的累计方差贡献率为98.66%,说明前两个主成分能够代表5个产区纯化烟叶的表面微生物群落。JZ、HZ样品距离更近,FZ样品和SZ样品相较于其他的3个样品较远,说明不同产区醇化烟叶表面微生物群落组成有明显差异。综上,北方产区吉林、河南产区醇化烟叶样品表明微生物组成相似,但与南方产区四川、福建产区醇化烟叶样品微生物组成结构不一致,推测可能与烟叶产地、醇化时间、醇化环境息息相关。
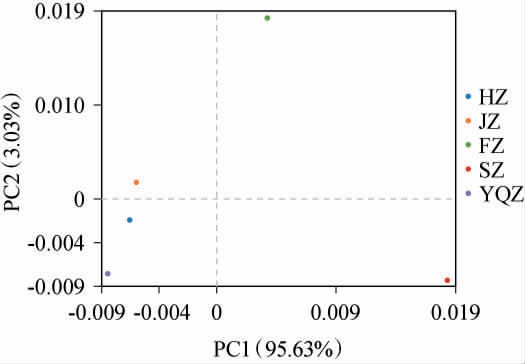
图4 不同产区醇化烟叶样品基于属水平表面微生物主成分分析结果
Fig.4 Principal component analysis results of microorganism on the surface of aged tobacco leaves samples from different production areas based on the genus level
2.5 不同产区醇化烟叶表面微生物基因功能注释
2.5.1 COG功能注释
通过COG数据库对不同产区醇化烟叶样品表面微生物基因的蛋白质功能进行注释,结果见图5。由图5可知,不同产区醇化烟叶样品表面微生物基因功能被划为24个类,5个醇化烟叶样品中相对丰度排名前10的基因功能均为:复制、重组和修复(Replication,recombination and repair)(53.72%~88.12%)、能源生产和转换(Energy production and conversion)(1.56%~5.41%)、翻译、核糖体结构和生物合成(Translation,ribosomal structure and biogenesis)(1.25%~4.04%)、氨基酸转运与代谢(Amino acid transport and metabolism)(0.64%~3.67%)、一般功能预测(General function prediction only)(0.87%~3.84%)、未知功能(Function unknown)(0.59%~0.40%)、蛋白质翻译后修饰(Posttranslational modification,protein turnover,chaperones)(0.93%~2.61%)、碳水化合物运输和代谢(Carbohydrate transport and metabolism)(0.72%~2.50%)、转录(Transcription)(0.94%~3.04%)、信号转导机制(Inorganic ion transport and metabolism)(0.37%~2.98%)。通过对5个样品间相对丰度排名前10的基因功能进行独立样本t检验,发现不同醇化烟叶样品微生物COG功能相对丰度差异较大,在5个样品间相对丰度均差异显著的基因功能有:复制、重组和修复,能源生产和转换,翻译、核糖体结构和生物合成,氨基酸转运与代谢,一般功能预测,未知功能,碳水化合物运输和代谢,碳水化合物运输和代谢,转录,信号转导机制(P<0.05)。此外,FZ、SZ和HZ、JZ、YZQ样品间蛋白质翻译后修饰差异显著(P<0.05)。
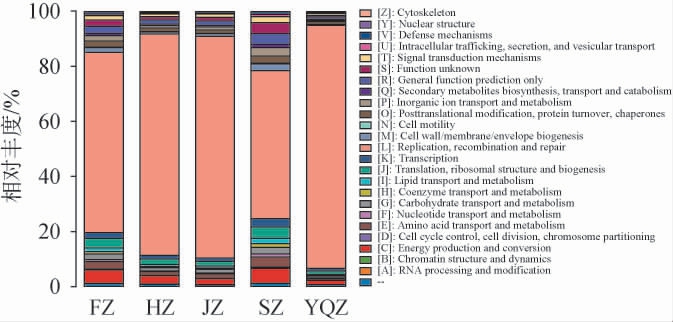
图5 不同产区醇化烟叶样品表面微生物基因同源基因组簇功能注释结果
Fig.5 Cluster of Orthologous Groups functional annotation results of gene from microorganisms on the surface of aged tobacco leaves samples from different production areas
2.5.2 KEGG功能注释
通过KEGG数据库对不同产区醇化烟叶样品表面微生物基因的代谢通路进行分析,结果见图6。由图6可知,不同产区醇化烟叶样品表面微生物显著富集的一级代谢通路为:新陈代谢(Metabolism)(41.89%~58.13%)、遗传信息处理(Genetic information processing)(24.89%~51.49%)、环境信息处理(Environmental information processing)(2.74%~10.97%)、细胞过程(Cellular processes)(3.87%~6.89%)(P<0.05),上述代谢通路在不同烟叶样品间差异均显著(P<0.05),说明烟叶表面的微生物代谢活动十分活跃。在二级代谢通路中,5个烟叶样品中相对丰度排名前10的代谢通路均为:全局和概览图谱(Global and overview maps)(26.11%~30.60%)、能量代谢(Energymetabolism)(10.58%~15.42%)、复制与修复(Replicationandrepair)(4.81%~19.40%)、碳水化合物代谢(Carbohydrate metabolism)(6.71%~8.32%)、翻译(Translation)(6.02%~8.69%)、氨基酸代谢(Amino acid metabolism)(4.26%~7.42%)、核苷酸代谢(Nucleotide metabolism)(3.09%~4.56%)、辅因子和维生素的代谢(Metabolism of cofactors and vitamins)(1.30%~4.18%)、膜转运(Membrane transport)(1.05%~3.70%)、信号转导(Signal transduction)(0.76%~2.84%)。通过对5个样品间相对丰度排名前10的二级代谢通路进行独立样本t检验,发现5个样品间均差异显著的二级代谢通路有:全局和概览、能量代谢、复制和修复、翻译、核苷酸代谢、辅因子和维生素的代谢、信号转导(P<0.05)。此外,FZ、SZ和HZ、YQZ、JZ样品间的碳水化合物代谢差异显著(P<0.05),SZ和YQZ、HZ样品间的氨基酸代谢差异显著(P<0.05),FZ、JZ和HZ、SZ、YQZ样品间的膜转运差异显著(P<0.05)。

图6 基于京都基因与基因组百科全书数据库不同产区醇化烟叶样品表面微生物功能基因一级(a)和二级(b)代谢通路注释结果
Fig.6 Annotation results of the primary (a) and secondary (b)metabolic pathways of microbial functional genes on the surface of aged tobacco leaves samples from different producing areas based on the Kyoto Encyclopedia of Genes and Genomes database
2.5.3 碳水化合物活性酶分析
采用CAZy数据库对不同产区醇化烟叶样品表面微生物的各类碳水化合物活性酶基因进行统计分析,结果见图7。
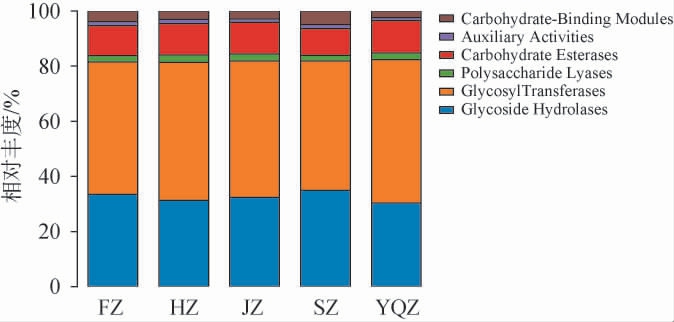
图7 不同产区醇化烟叶样品表面微生物碳水化合物活性酶基因注释结果
Fig.7 Annotation results of carbohydrate-active enzymes genes from microorganisms on the surface of aged tobacco leaves samples from different producing areas
由图7可知,5个产区醇化烟叶样品表面微生物含有的碳水化合物活性酶基因为:糖基转移酶(Glycosyl transferases)(46.95%~52.05%)、糖苷水解酶(Glycoside hydrolases)(30.30%~34.91%)、碳水化合物酯酶(Carbohydrate esterases)(9.76%~11.80%)、碳水化合物结合模块(Carbohydrate-binding modules)(2.37%~4.89%)、多糖裂解酶(Polysaccharide lyases)(2.02%~2.60%)、辅助氧化还原酶(Auxiliary activities)(1.10%~1.60%)。通过对5个样品间表面微生物的碳水化合物活性酶基因进行独立样本t检验,发现5个醇化烟叶样品间表面微生物的碳水化合物活性酶基因均差异显著(P<0.05)。
烟叶中的微生物活动是一个复杂的代谢过程,多个微生物群落相互交叉作用,共同组成了烟叶的醇化过程[47]。通过比对COG和KEGG数据库发现,烟叶表面的微生物主要参与复制、重组和修复、能源生产和转换、翻译、核糖体结构和生物合成、氨基酸转运与代谢、新陈代谢等代谢过程,这些代谢活动能促进大分子物质降解,产生香味物质[48],因此烟叶中微生物能够通过生物学活动分解烟叶中的有机物,促进烟叶的醇化。其中,部分产区烟叶微生物的代谢活动差异显著,这可能与产地烟叶的微生物群组成丰度不同有关。通过对烟叶表面微生物关键酶基因研究发现,相对丰度最高的是糖基转移酶和糖苷水解酶,二者均能有效降解纤维素,形成糖类物质[49-50],因此烟叶表面微生物代谢产生的酶能够有效参与烟叶醇化,提升烟叶品质。
3 结论
本研究采用宏基因组测序技术对5个不同产区醇化烟叶样品表面微生物多样性及群落组成进行差异分析,结果表明,不同产区醇化烟叶样品表面微生物涵盖了157个门、2 699个属,优势菌门(相对丰度>1%)主要为变形菌门(Proteobacteria)(57.27%~60.10%),优势菌属(相对丰度>1%)主要为埃希氏杆菌属(Escherichia)(13.38%~22.01%)、肠杆菌属(Enterobacter)(6.99%~12.69%);南、北方醇化烟叶表面微生物多样性差异显著(P<0.05),且四川产区醇化烟叶表面微生物多样性和物种组成最丰富。进一步通过COG数据库、KEGG数据库及CAZy数据库对微生物功能进行预测分析。结果表明,不同产区醇化烟叶表面微生物功能相对丰度存在差异,但均主要参与复制、重组和修复、能源生产和转换、新陈代谢及遗传信息处理代谢等;关键生物碳水化合物活性酶均为糖基转移酶和糖苷水解酶。本研究结果为不同产区的醇化烟叶研究提供了微生物菌群信息和功能作用参考。
[1]中国植物志编写委员会.中国植物志(六十七卷)[M].北京:中国科学出版社,1999:152.
[2]谢颖,韩雪燕,刘朝,等.2023年世界卫生组织全球控烟政策评估及对我国的启示[J].中华健康管理学杂志,2024,18(7):547-552.
[3]QIAO Y W, ZHENG P, YONG P, et al.Interaction analysis of tobacco leaf microbial community structure and volatiles flavor compounds during cigar stacking fermentation[J].Front Microbiol,2023,14:1168122.
[4]郑泽浩.烟叶微生物多样性及其对烟叶发酵品质的影响研究[D].杨凌:西北农林科技大学,2020.
[5]陈伦旺.陈化烟叶微生物的分离鉴定及其在烟叶发酵中的应用[D].杨凌:西北农林科技大学,2020.
[6]牟丹,周家喜,张鑫,等.烟叶陈化过程可培养微生物的生态功能[J].微生物学通报,2020,47(2):362-369.
[7]梅涌,姜兴涛,刘辉.烟叶陈化中的微生物多样性及其对烟叶品质改良的研究进展[J].湖北农业科学,2017,56(20):3801-3803.
[8]贾蓓蕾,魏涛,黄申,等.α-胡萝卜素降解产香菌株的分离、鉴定及发酵条件优化[J].食品与发酵工业,2015,41(1):34-39.
[9]郝捷,季嫱,李力群,等.生物酶和微生物技术改善烟叶香气的研究进展[J].生物技术进展,2022,12(6):817-824.
[10]舒明,樊虎,杨洋,等.废烟叶提取液源尼古丁降解菌分离鉴定和特性[J].微生物学通报,2017,44(5):1028-1037.
[11]赵铭钦,刘云,李芳芳,等.陈化烤烟叶面优势菌的筛选鉴定与其增香效应[J].微生物学报,2009,49(5):624-630.
[12]李石头,潘凡达,黄晓玉,等.基于宏基因组学的不同陈化时间烟草源功能微生物筛选[J].轻工学报,2023,38(1):101-109.
[13]WENG S,DENG M,CHEN S,et al.Application of pectin hydrolyzing bacteria in tobacco to improve flue-cured tobacco quality[J].Front Bioeng Biotech,2024,12:1340160.
[14]张玉姣,宋金鹏,郭学民,等.烟叶微生物菌群变化及微生物在烟叶中的应用现状[J].中国酿造,2022,41(6):31-36.
[15]QIAO L, LIU J, CHENG Y, et al.Microbial community change and quality improve via endophytic colonization of tobacco by Saccharomyces cerevisiae[J].Ind Crop Prod,2024,222(P2):119637.
[16]张文友,颜朗,赖先军,等.陈化烤烟叶片不同发酵时间微生物多样性及代谢组分析[J].中国烟草学报,2022,28(5):84-94.
[17]田丽君,荊永锋,郑卜凡,等.浏阳洞库陈化烟叶微生物多样性分析[J].中国烟草学报,2022,28(1):98-107.
[18]张碰元,黄家乐,刘远上,等.醇化方式对津巴布韦烟叶微生物和香味成分的影响[J].烟草科技,2023,56(3):6-16.
[19]孙政.降低烟草亚硝胺目的菌的筛选及应用研究[D].武汉:华中农业大学,2017.
[20]金永明.红大烟叶和K326烟叶陈化过程中微生物群落分析[D].兰州:兰州理工大学,2022.
[21]贺兆伟,奚家勤,邓宾玲,等.烟叶中高产果胶酶菌株的筛选及酶学性质[J].烟草科技,2013(5):72-76.
[22]贾云,胡婉蓉,吕晋雄,等.雪茄烟叶发酵过程中微生物群落及功能微生物分析[J].轻工学报,2023,38(1):71-78,89.
[23]李亚萍,乔海军,贾志龙,等.基于宏基因组学技术的天祝藏酒大曲微生物群落多样性及功能解析[J].轻工学报,2025,40(2):31-40.
[24]赵仁亮,胥伟,吴丹,等.基于Illumina MiSeq技术分析不同地域加工的茯砖茶中微生物群落多样性[J].生态学杂志,2017,36(7):1865-1876.
[25]EDGAR R C,UPARSE:highly accurate OTU sequences from microbial amplicon reads[J].Nat Method,2013(10):996-998.
[26]李选文,熊智,王金华,等.思茅松毛虫成虫肠道细菌多样性[J].新疆农业科学,2022,59(9):2276-2287.
[27]黄丽,庞庭才,祁岑,等.超高压处理对斜带石斑鱼冷藏期间细菌多样性的影响[J].食品与机械,2023,39(12):126-132.
[28]奉综涛,买地那·帕尔哈提,尹秀,等.西藏不同地区枸杞果实表皮和叶际微生物多样性研究[J].中国酿造,2025,44(2):150-157.
[29]陈善义,陈千思,刘金燕,等.不同醇化卷烟原料表面微生物的群落结构及对大分子物质的降解功能[J].烟草科技,2024,57(3):34-42.
[30]龚俊.烤后片烟储存过程中微生物多样性及变化动态[D].上海:华东师范大学,2015.
[31]杨帅,潘磊,陈连红,等.基于高通量测序的不同轮作方式下烟田土壤细菌群落组成分析[J].分子植物育种,2021,19(1):343-348.
[32]王志远,阮彦楠,王伟,等.不同梯度氮磷钾施用量对云南植烟土壤细菌群落结构与多样性的影响[J].西南农业学报,2022,35(4):764-771.
[33]钟艮平,杨学乐,艾季翔,等.不同海拔烤烟根际土壤真菌多样性及群落结构分析[J].作物研究,2025,39(2):143-153.
[34]冯满尧.五种分离源的真菌内生细菌多样性及其影响因素[D].昆明:云南大学,2023.
[35]崔钰杰,邹克兴,陈义昌,等.不同醇化时间对片烟原料附生细菌种群多样性及质量的影响[J].山东农业科学,2024,56(2):77-85.
[36]浦绍占,马永凯,刘敏,等.玉溪地区自然陈化烟叶表面可培养细菌多样性研究[J].中国微生态学杂志,2016,28(8):920-925.
[37]耿宗泽,吴泽,杨杰,等.基于高通量测序分析不同产地醇化烟叶细菌群落组成和多样性[J].食品与发酵科技,2023,59(5):17-22,37.
[38]LARSSON L,SZPONAR B,RIDHA B,et al.Identification of bacterial and fungal components in tobacco and tobacco smoke[J].Tob Induc Dis,2008,4(1):4.
[39]张鸽,李志豪,邓帅军,等.海南H382雪茄烟叶不同发酵周期细菌群落多样性表征及演替分析[J].中国烟草学报,2021,27(2):117-126.
[40]庹有朋,王刚,段旺军,等.利用生物技术对烤烟发酵的研究[J].食品与发酵科技,2020,56(2):69-75.
[41]黄申,刘丹阳,张增辉,等.肠杆菌和不动杆菌混菌发酵提升山东烟叶品质机制研究[J].轻工学报,2023,38(1):45-53.
[42]AKTER S, HUP M A. Sphingomonas chungangi sp.nov., a bacterium isolated from garden soil sample[J].Int J Syst Evol Microbiol,2020,70(7):4151-4157.
[43]GEUEKE B,BUSSE H J,FLEISCHMANN T,et al.Description of Sphingosinicella xenopeptidilytica sp.nov., a β-peptide-degrading species,and emended descriptions of the genus Sphingosinicella and the species Sphingosinicella microcystinivorans[J].Int J Syst Evol Microbiol,2007,57(1):107-113.
[44]PENG Y H,HE W C, LI Y J, et al.Degradation of CP4-EPSPS with a psychrophilic bacterium Stenotrophomonas maltophilia 780[J].Biomolecules,2022,12(2):318.
[45]郑天飞,张倩颖,李东亮,等.不同产地雪茄烟叶的风味特征和微生物群落分析[J].河南农业科学,2022,51(8):45-54.
[46]赵亮,琚绍煊,时向东,等.芽孢杆菌属在烟叶发酵和醇化中的应用研究进展[J].安徽农业科学,2024,52(21):1-4.
[47]刘雪,闫晓明,唐俊,等.基于宏基因组分析菌渣微生物群落组成和功能多样性[J].安徽农业大学学报,2024,51(3):488-494.
[48]张金萍,于佳俊,贾福晨,等.基于宏基因组学分析西藏青稞酒发酵过程中微生物多样性与风味形成的关系[J].食品与发酵工业,2025,51(5):310-321.
[49]颜俊杰.糖基转移酶GT1及内切葡聚糖酶An5晶体结构研究[D].无锡:江南大学,2016.
[50]赵鑫.Segatella bryantii中多功能糖苷水解酶酶学性质及催化机制研究[D].包头:内蒙古科技大学包头师范学院,2024.