酱香型白酒以独特的酱香、焦香和醇厚口感闻名于世,其本质是依赖于高温大曲中复杂微生物群落的协同代谢与动态平衡及后续酿造工艺[1-2]。小麦作为制曲原料,在茅台、五粮液制曲原粮中占100%,在剑南春制曲原粮占比80%,在全兴曲制曲原粮占比95%~96%,在沱牌曲酒的制曲原料占比为93%~95%[3-4]。其品种特性对大曲的质量具有重要影响,冯雨等[5-6]研究表明,软质小麦因蛋白质含量适宜、淀粉含量较高、易蒸煮糊化、微生物群落丰富的优点,成为制作大曲的最佳原料。陈泽军等[7-9]采用“宜麦”7号、绵麦902等酿酒专用小麦制作大曲和酿酒,发现“宜麦”7号小麦生产出的大曲优质率比普通小麦高8.1%,出酒率和原酒优品率也明显提高了6%和7%。
小麦也是大曲微生物主要来源[10-11]。DU H等[12]的研究表明,清香型大曲曲坯中82.67%的细菌均来自原料,主要包括Pantoea agglomerans、Enterobacter aerogenes、Pseudomonas koreensis。ZHANG Y等[13]的研究表明,原料小麦为酱香型大曲曲坯外部和内部分别提供了40.48%和96.61%的细菌。周天慈等[14]基于Source Tracker计算的结果同样发现,大曲发酵初期89.3%的细菌来自于原料。小麦微生物也与高温大曲风味物质组成有密切相关性,影响着白酒的品质和风味,黄瑜等[15]研究发现,小麦原料优势细菌属包括泛菌属(Pantoea)、假单胞菌属(Pseudomonas)和马赛菌(Massilia);优势真菌属为链格孢属(Alternaria)、附球霉属(Epicoccum)和枝孢属(Cladosporium)。模拟大曲以四甲基吡嗪和2,3-丁二醇为主要的风味物质,小麦样品微生物组成与大曲风味物质组成有密切的相关性。
本研究选取4种具有代表性的酿酒小麦品种,采用相同工艺生产高温大曲,并对其成曲的理化指标、微生物群落结构及挥发性风味物质进行检测与分析,旨在揭示小麦品种对高温大曲质量的具体影响,为优化大曲生产原料选择提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
种曲:贵州省某白酒企业;4种酿酒小麦(天民198(TM198)、天民184(TM184)、郑麦113(ZM113)、泛麦8号(FM8H)):国内某小麦供应商,理化性质见表1。
表1 不同品种酿酒小麦理化性质
Table 1 Physicochemical properties of different varieties of wheat for brewing
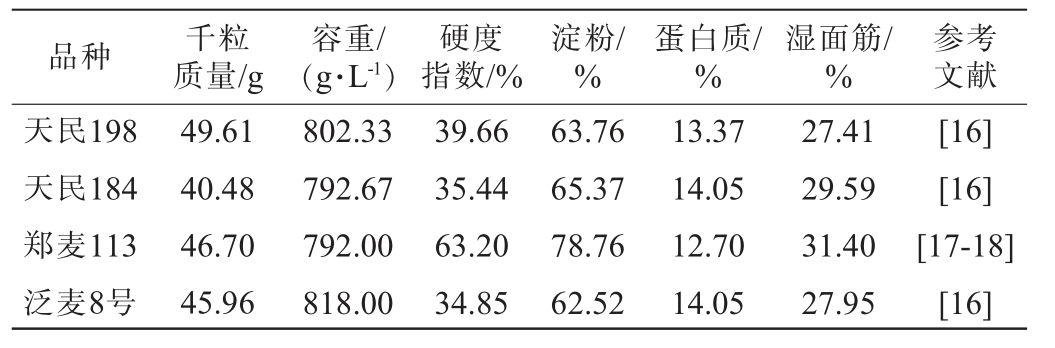
品种 千粒质量/g容重/(g·L-1)硬度指数/%淀粉/%蛋白质/%湿面筋/%参考文献天民198天民184郑麦113泛麦8号49.61 40.48 46.70 45.96 802.33 792.67 792.00 818.00 39.66 35.44 63.20 34.85 63.76 65.37 78.76 62.52 13.37 14.05 12.70 14.05 27.41 29.59 31.40 27.95[16][16][17-18][16]
1.1.2 试剂
可溶性淀粉(生化试剂)、糊精、无水乙醇、氯化钠、碘、酒石酸钾钠、醋酸钠、醋酸、无水葡萄糖(均为分析纯)、氢氧化钠(优级纯):国药集团化学试剂有限公司;碘化钾、硫酸铜、亚铁氰化钾、次甲基蓝(均为分析纯):天津市天力化学试剂有限公司;PowerSoil  脱氧核糖核酸(deoxyribonucleic acid,DNA)Isolation kit:深圳市安必胜科技有限公司;True Lib DNA Library Rapid Prep Kit for Illumina:依科赛生物科技有限公司。
脱氧核糖核酸(deoxyribonucleic acid,DNA)Isolation kit:深圳市安必胜科技有限公司;True Lib DNA Library Rapid Prep Kit for Illumina:依科赛生物科技有限公司。
1.2 仪器与设备
Legend Micro 21高速离心机:德国EPPENDORF公司;Synergy HTX酶标仪:Gene Company Limited基因有限公司;G560E振荡器:美国SI Vortex-Genie公司;MB35快速水分测定仪:美国Ohaus公司;HH-6数显恒温水浴锅:常州国华电器有限公司;ETC811X基因扩增仪:苏州东胜兴业科学仪器有限公司;S700-K多参数测试仪:梅特勒托利多科技(中国)有限公司;Agilent8890气相色谱(gas chromatography,GC)-Agilent7010D三重四级杆质谱联用仪(triple quadrupole massspectrometry,MS/MS)、DB-FFAP毛细管色谱柱(60 m×250 μm×0.25 μm):美国安捷伦科技有限公司。
1.3 方法
1.3.1 高温大曲生产工艺操作要点
将小麦除杂后加水润麦30 min左右,润麦结束后将小麦粉碎(麦皮“梅花瓣”,麦芯成细粉的粗麦粉,芯破皮不破的状态),将种曲(小麦质量的6%~9%)与粉碎后的小麦混合均匀,加总质量的37%~40%的水搅拌,接着踩制成型,自然阴干后入仓发酵室温40 d后出仓。
4种酿酒小麦品种对应的4种高温大曲分别编号为QTM198、QTM184、QZM113、QFM8H。
1.3.2 取样方式
分别取发酵室第三坎的第一、三、五层中间位置的曲块,从曲块4角与中间取出5份样本,在无菌研磨机粉碎混合均匀后采用四分法取样,取400 g用于理化分析,取适量的样本于-80 ℃保存,用于微生物检测。
1.3.3 高温大曲理化指标检测
水分含量、酸度、糖化力:参照QB/T 4257—2011《酿酒大曲通用分析方法》[19]进行测定。
1.3.4 小麦、高温大曲DNA提取、宏基因组建库和Illumina Miseq测序
利用脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒PowerSoil  DNA Isolation kit提取样品DNA,提取的DNA先随机打断为大小为300~350 bp的短片段,DNA片段经过双末端修复、接头连接、纯化、富集,检测PCR产物片段大小并进行文库定量后,将检测合格的文库送至北京擎科生物科技股份有限公司测序。
DNA Isolation kit提取样品DNA,提取的DNA先随机打断为大小为300~350 bp的短片段,DNA片段经过双末端修复、接头连接、纯化、富集,检测PCR产物片段大小并进行文库定量后,将检测合格的文库送至北京擎科生物科技股份有限公司测序。
1.3.5 高温大曲中挥发性风味物质检测
高温大曲中挥发性风味物质使用顶空固相微萃取-气质联用(headspace solid-phase microextraction-gas chromatography,HS-SPME-GC-MS)技术进行检测,具体方法如下:
样品前处理:称取1 g大曲样品至20 mL顶空瓶中,加入4 mL饱和氯化钠溶液后,涡旋混匀,最后加入10 μL的2-乙基丁酸溶液(46.565 μg/g)作为内标并密封。
顶空固相微萃取(HS-SPME)条件:SPME-ARROW三涂层萃取头,萃取及孵化温度50 ℃,孵化时间10 min,萃取时间30 min,解吸时间5 min,萃取前240 ℃老化5 min,萃取后240 ℃老化2 min。
气相色谱-质谱联用(GC-MS)条件:进样口温度220 ℃,不分流,开阀时间5.5 min,隔垫吹扫3 mL/min。色谱柱1为DB-FFAP色谱柱(60 m×0.25 mm×0.25 μm),流量:1.0 mL/min;色谱柱2为空心柱(2 m×0.15 mm),流量1.2 mL/min,吹扫流量1 mL/min。碰撞气(N2)流量1.5 mL/min,淬灭气(He)流量25 mL/min。升温程序为初始温度:40 ℃,以5 ℃/min升至80 ℃;以2 ℃/min升至230 ℃,保持20 min。总时间103 min。质谱参数:扫描范围30~550 amu。
定性定量方法:利用美国国家标准与技术研究院(national institute of standards and technology,NIST)23数据库对目标化合物进行初步定性,并在相同GC-MS条件下,以正构烷烃C7~C30标准品,计算各化合物的保留指数(retention index,RI),并与数据库(https://webbook.nist.gov/chemistry/name-ser/)中查询到的保留指数进行比对进行定性。采用内标法进行定量分析。
1.3.6 数据处理与统计分析
数据统计分析均使用SPSS 23.0软件进行,所有数据可视化均使用Origin 2023完成。
2 结果与分析
2.1 高温大曲理化指标检测结果分析
4种高温大曲理化指标检测结果见表2。
表2 4种高温大曲理化指标检测结果
Table 2 Detection results of physicochemical indicators of 4 high-temperature Daqu
注:同列标注的不同字母表示差异性显著(P<0.05),相同字母表示差异不显著(P>0.05)。
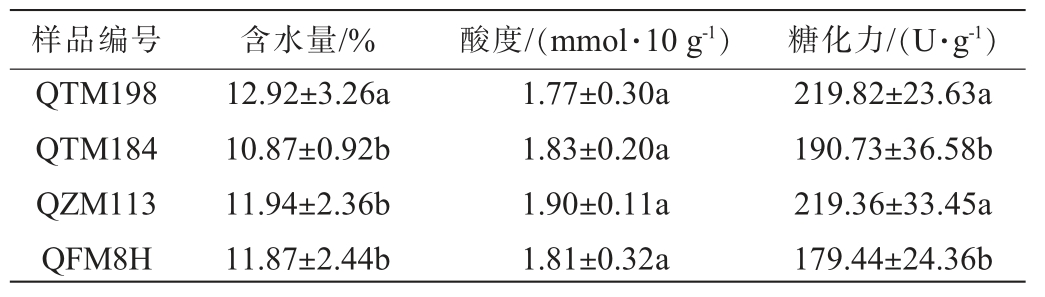
样品编号 含水量/% 酸度/(mmol·10 g-1)糖化力/(U·g-1)QTM198 QTM184 QZM113 QFM8H 12.92±3.26a 10.87±0.92b 11.94±2.36b 11.87±2.44b 1.77±0.30a 1.83±0.20a 1.90±0.11a 1.81±0.32a 219.82±23.63a 190.73±36.58b 219.36±33.45a 179.44±24.36b
由表2可知,4种高温大曲中含水量最高的是QTM198(12.92%),显著高于其他3种大曲(P<0.05)。乳酸菌、醋酸杆菌等微生物利用淀粉转化为乳酸、醋酸等有机酸,酸度可评价曲药对酿酒发酵体系pH的调节能力及酒体风味前体物质的储备水平[20-22];4种高温大曲中酸度最高的是QZM113,为1.90 mmol/10 g,最低的是QTM198,为1.77 mmol/10 g,但差异不显著(P>0.05)。糖化力是衡量淀粉在糖化酶作用下生成葡萄糖的能力,反映大曲中微生物对酿酒原料淀粉的利用效率[23-24],4种高温大曲中糖化力最高的是QTM198(219.82 U/g),最低的是QFM8H(179.44 U/g),QTM198与QZM113糖化力差异不显著(P>0.05),QTM184与QFM8H糖化力差异不显著(P>0.05)。
2.2 小麦与大曲微生物多样性分析
Goods_coverage用于反映测序深度和群落覆盖率,越接近于100%,说明测序深度越合理,测序深度已经基本覆盖到样品中所有的物种。Shannon指数反映群落的物种丰富度和均匀度。Simpson指数反映群落中优势物种的集中程度,指数越接近1,说明群落中优势物种的优势度越低、物种分布越均匀;指数越接近0,说明存在明显优势物种,群落均匀度越差。Chao1指数是基于操作分类单元(operational taxonomic units,OTU)数估算群落中实际存在的物种总数,指数值越大,代表群落中实际存在的物种越丰富。4种小麦及高温大曲微生物多样性分析见表3。由表3可知,4种小麦及高温大曲样品的微生物覆盖率均达到99.90%以上,表明此次测序深度已经基本覆盖到样品中所有的物种。高温大曲的Chao1指数远高于小麦,Shannon指数亦高于小麦,Simpson指数略低于小麦;表明高温大曲的微生物多样性及丰富度均高于小麦。
表3 4种小麦与高温大曲微生物多样性分析
Table 3 Analysis of microbial diversity in 4 wheat and high-temperature Daqu
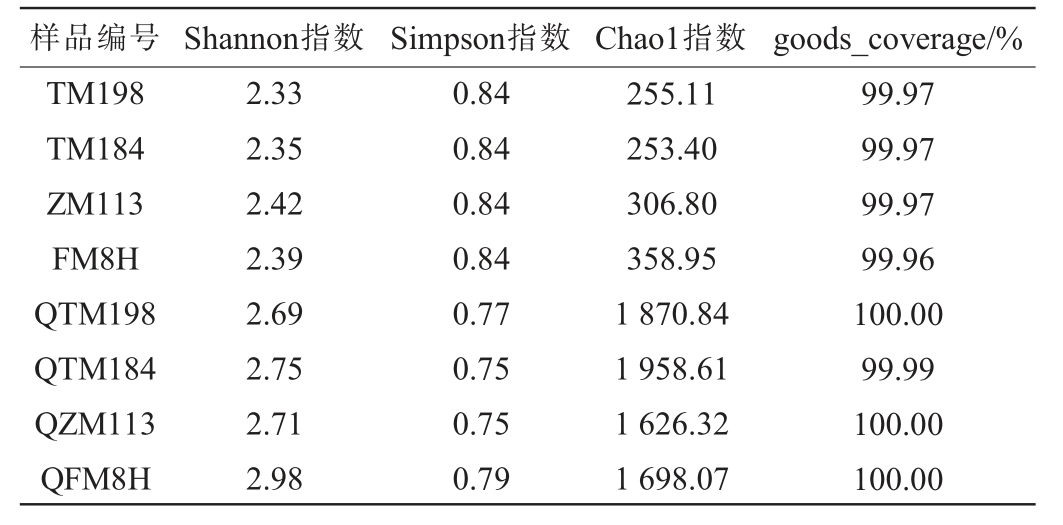
样品编号 Shannon指数 Simpson指数 Chao1指数 goods_coverage/%TM198 TM184 ZM113 FM8H QTM198 QTM184 QZM113 QFM8H 2.33 2.35 2.42 2.39 2.69 2.75 2.71 2.98 0.84 0.84 0.84 0.84 0.77 0.75 0.75 0.79 255.11 253.40 306.80 358.95 1 870.84 1 958.61 1 626.32 1 698.07 99.97 99.97 99.97 99.96 100.00 99.99 100.00 100.00
2.3 小麦及高温大曲属水平微生物群落分析
对4种小麦及高温大曲中的优势物种(此处取总体丰度前30位的物种)在属水平的组成绘制柱状图见图1。
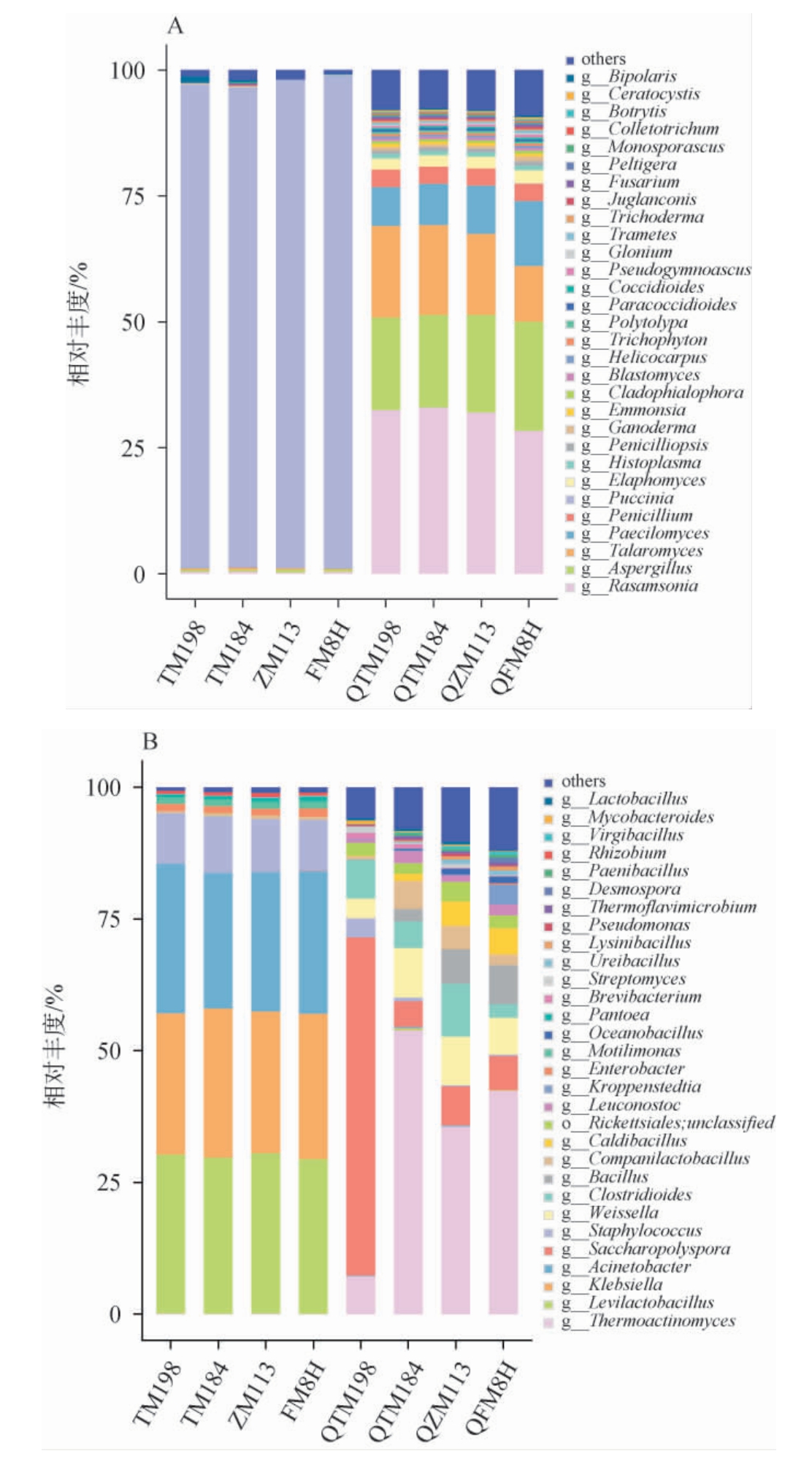
图1 基于属水平4种小麦及高温大曲的真菌(A)及细菌(B)群落结构分析
Fig.1 Analysis of fungi (A) and bacteria (B) community structure in 4 wheat and high-temperature Daqu at the genus level
由图1可知,4种小麦的优势真菌均为柄锈菌属(Puccinia),在TM198、TM184、ZM113、FM8H中相对丰度分别为96.01%、95.37%、96.93%、97.85%。Puccinia是一种专性活体营养寄生菌,是引起的小麦条锈病,威胁小麦产量最重要的真菌病害之一[25-26]。胡永芯等[27]研究表明,在大曲发酵前期,Puccinia在实验组及对照组都占绝对优势,这可能与小麦本身携带大量的Puccinia有关。4种高温大曲的优势真菌均为Rasamsonia、Aspergillus、Talaromyces、Paecilomyces。与杨阳等[28]关于高温大曲微生物组成的研究结果相印证。
4种小麦优势细菌属分别为促生乳杆菌属(Levilactobacillus)、克雷伯氏菌属(Klebsiella)、不动杆菌属(Acinetobacter)。高温大曲QTM198的优势细菌属为Saccharopolyspora、Clostridioides、Thermoactinomyces、Weissella;高温大曲QTM184 的优势细菌属为Thermoactinomyces、Weissella、Companilactobacillus、Clostridioides;高温大曲QZM113的优势细菌属为Thermoactinomyces、Clostridioides、Weissella、Saccharopolyspora;高温大曲QFM8H的优势细菌属为Thermoactinomyces、Bacillus、Weissella、Saccharopolyspora。小麦优势细菌在成曲中均有出现,可见小麦原料也可以为高温大曲提供微生物,这与周天慈等[14]的研究结论一致。4种高温大曲相同优势细菌属为Thermoactinomyces、Weissella,QTM184特有的优势细菌属是Companilactobacillus、QFM8H特有的优势细菌属是Bacillus。可见,不同小麦品种对微生物的群落结构还是存在一定的影响。
2.4 小麦及高温大曲属水平物种聚类分析
根据所有样品在属水平上的相对丰度信息(取总体丰度前30 位的物种),计算样品间的Bray距离,然后根据Bray距离进行分层聚类,这样可以判断样品在属分类水平上的相似性。物种分类堆叠图与Bray距离的聚类结果见图2。
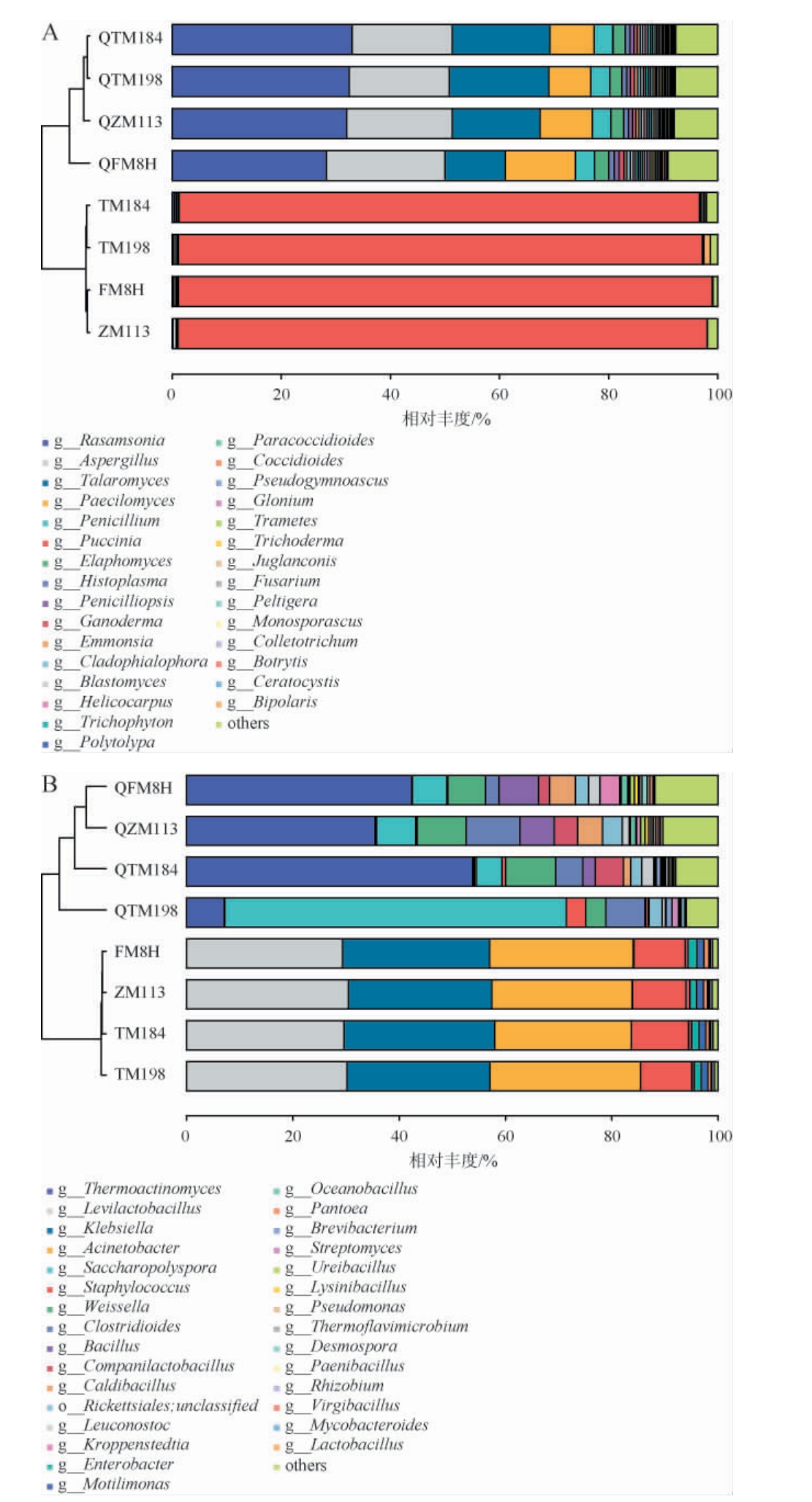
图2 基于属水平4种小麦及高温大曲真菌(A)及细菌(B)聚类分析
Fig.2 Cluster analysis of fungi (A) and bacteria (B) in 4 wheat and high-temperature Daqu at the genus level
从图2A可知,在真菌组成层面,FM8H与ZM113,TM184与TM198,QTM184与QTM198分别呈现出相似性。由图2B可知,在细菌组成方面,FM8H与ZM113,QFM8H与QZM113各自具有相似性。其中,FM8H和ZM113 在真菌与细菌组成上均较为相似,这很可能表明这两种小麦所处的生长环境或采用的种植管理措施存在相似性,进而导致它们内部或表面附着的微生物群落结构趋于一致。QTM184和QTM198真菌组成相似,说明发酵过程未对这2种高温大曲的真菌组成产生明显的差异化影响;QFM8H和QZM113细菌组成相似,说明发酵过程未对这2种高温大曲的细菌组成产生明显的差异化影响。
2.5 4种高温大曲挥发性风味物质分析
4种高温大曲挥发性风味物质检测结果见图3。由图3可知,4种高温大曲共检测出134种挥发性风味物质,其中吡嗪类14种、醇类13种、酚类4种、醛类16种、酸类7种、酮类14种、酯类22种、烷烃类10种、烯烃3种、其他类31种,高温大曲挥发性风味物质总量从高到低依次为QFM8H、QTM184、QZM113、QTM198。
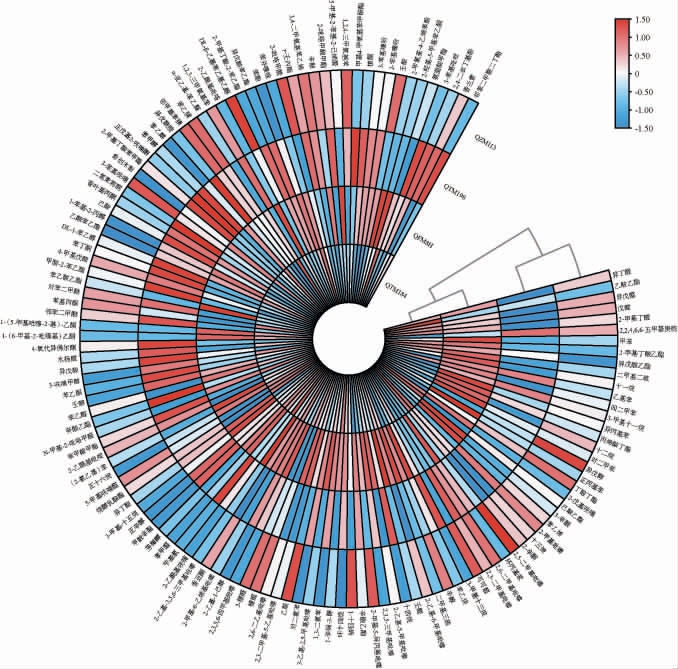
图3 高温大曲挥发性风味物质含量热图
Fig.3 Heatmap of volatile flavor compounds contents in high-temperature Daqu
吡嗪类风味物质是大曲中重要挥发性风味组成成分,能够赋予大曲烘焙、吐司和坚果等香气[29],其中的川芎嗪被白酒行业公认为“健康因子”[30-32]。QFM8H的川芎嗪含量最高(7.38 mg/kg),分别是QTM198、QTM184、QZM113的1.40倍、2.24倍、3.96倍。
有研究表明[33],苯乙醇是酱香大曲中的主要醇类物质之一,具有明显的甜香、玫瑰香和花香,是白酒中的重要风味化合物。醇类化合物含量最高的是QTM184(270.78 mg/kg),其中苯乙醇最为突出。酚类物质含量最高的是QTM184,含量为12.45 mg/kg,醛类物质含量QTM184和QZM113差异不明显且均比QFM8H、QTM198高,酸类、酯类物质含量最高的是QTM198,含量分别为34.12 mg/kg、54.83 mg/kg,酮类物质差异不明显。
苯乙烯是大曲风味成分重要物质之一,具有典型的汽油香与水果香。研究发现,4种高温大曲中苯乙烯含量均较高,大曲QFM8H的苯乙烯含量最高为293.88 mg/kg,在风味贡献度上表现尤为突出。
3 结论
本研究以4种酿酒小麦(TM198、TM184、ZM113、FM8H)为原料,经相同工艺制备高温大曲,通过分析理化指标、微生物群落及挥发性风味物质发现,4种小麦所制高温大曲中QTM198含水量显著高于其他3种(P<0.05);QZM113酸度最高,但与其他3种差异不显著(P>0.05);QTM198糖化力显著高于QTM184、QFM8H(P<0.05),稍高于QZM113但差异不显著(P>0.05)。高温大曲的微生物多样性及丰富度均高于小麦。微生物组成方面,4种小麦优势真菌均为Puccinia;4种高温大曲优势真菌为Rasamsonia、Aspergillus、Talaromyces、Paecilomyces。4种小麦优势细菌不同,且在成曲中均有出现,表明小麦可为高温大曲提供微生物,4种高温大曲有相同优势细菌属,也存在特有属,表明不同品种小麦对微生物生长有影响。从聚类分析看,部分小麦在真菌与细菌组成上相似,可能因生长环境或种植管理措施相似;部分高温大曲在真菌或细菌组成上相似,说明发酵过程未对相应曲药的微生物组成产生明显差异化影响。挥发性物质方面,4种高温大曲共检测出134种挥发性风味物质。QFM8H挥发性风味物质总量最高,且川芎嗪、苯乙烯含量最高;QTM184的醇类、酚类化合物含量最高,醛类物质含量也较高;QTM198的酸类、酯类物质含量最高。
综上,不同品种小麦可以通过影响微生物的生长与群落构建,改变大曲的理化指标特性,并调控挥发性物质的生成与积累,进而对制曲过程及大曲质量产生显著且多方面的影响。本研究为酱香型大曲生产原料选择提供理论依据。
[1]邵明凯,王海燕,徐岩,等.酱香型白酒发酵中酵母群落结构及其对风味组分的影响[J].微生物学通报,2014,41(12):2466-2473.
[2]蒋倩儿,陈文浩,孙金沅,等.酱香型白酒大曲微生物研究进展[J].中国酿造,2021,40(12):1-5.
[3]刘念.四川浓香型白酒“五朵金花”制曲比较[J].酿酒科技,2000(2):15-17.
[4]张立新.小议制酒大曲原料[J].中国酿造,2005,24(3):36-38.
[5]冯雨.小麦软硬度对高温大曲的影响[J].酿酒,2019,46(2):89.
[6]陈艳琦,刘琼,边巴拉姆,等.施氮量对稻茬弱筋小麦原粮品质及大曲品质的影响[J].华北农学报,2021,36(S1):303.
[7]陈泽军,周瑞平,尹礼国,等.酿酒专用小麦在多粮浓香型酒厂的应用[J].酿酒科技,2008(5):65.
[8]朱和琴,周瑞平,江东材,等.不同小麦生产偏高温大曲的研究[J].酿酒科技,2012(10):65.
[9]刘琼,陈艳琦,陈松鹤,等.施氮量对川西平原酿酒小麦原粮及其酿酒品质的影响[J].麦类作物学报,2022,42(3):325.
[10]ZHANG Y,SHEN Y,CHENG W,et al.Understanding the shifts of microbial community and metabolite profile from wheat to mature Daqu[J].Front Microbiol,2020,12:714726.
[11]唐慧芳,兰小辉,李硕,等.白酒大曲微生物溯源的研究进展[J/OL].酿酒科技,1-9[2025-09-26].https://link.cnki.net/urlid/52.1051.ts.20250604.1630.004.
[12]DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].Int J Food Microbiol,2019,297:32-40.
[13]ZHANG Y,SHEN Y,CHENG W,et al.Understanding the shifts of microbial community and metabolite profile from wheat to mature Daqu[J].Front Microbiol,2020,12:714726.
[14]周天慈,何宏魁,周庆伍,等.基于高通量扩增子测序技术解析中高温大曲微生物来源[J].食品与发酵工业,2021,47(16):66-71.
[15]黄瑜,杨帆,李江华,等.小麦原料微生物组成对高温大曲风味的影响[J].食品与发酵工业,2021,47(20):22-29.
[16]王海容,王永锋,朱国军,等.酿酒专用小麦籽粒品质特性研究[J].麦类作物学报,2024,44(3):352-359.
[17]黄松,黄岩,杨战峰,等.灌浆期高温胁迫对豫南稻茬麦区小麦灌浆速率及籽粒品质的影响[J].江苏农业科学,2023,51(18):88-93.
[18]王春霄.南阳地区小麦新品种(系)的鉴定与筛选[D].杨凌:西北农林科技大学,2022.
[19]中华人民共和国工业和信息化部.QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国标准出版社,2011.
[20]明红梅,陈晓旭,刘清斌,等.泸型大曲曲表与曲心理化生化特性的对比研究[J].湖北农业科学,2015,54(6):1445-1447,1451.
[21]UGLIANO M,MOIO L.Changes in the concentration of yeast-derived volatile compounds of red wine during malo lactic fermentation with four commercial starter cultures of Oenococus oeni[J].J Agr Food Chem,2005,53(26):10134-10139.
[22]常勇勇,林一心,尉军强,等.浓香型白酒糟醅质构及微生物菌群研究进展[J].中国酿造,2024,43(10):6-12.
[23]唐佳代,刘力萍,龙亚飞,等.不同感官特性酱香大曲真菌群落结构与理化特性[J].食品科学,2022,43(14):193-198.
[24]丁润月,李姝,魏阳,等.不同颜色高温大曲形成机理及特性差异研究进展[J].食品与发酵工业,2025,51(11):376-384.
[25]蒲蓉蓉.小麦条锈病调查报告[J].农业科技与信息,2010(21):33.
[26]张吉光.中国小麦条锈菌主要越夏区菌源与下游条锈病流行关系研究[D].杨凌:西北农林科技大学,2025.
[27]胡永芯,魏阳,杨阳,等.不同保温保湿材料对高温大曲发酵过程风味物质和微生物群落的影响[J/OL].食品与发酵工业,1-14[2025-09-26].https://doi.org/10.13995/j.cnki.11-1802/ts.042564.
[28]杨阳,张芮,于惠,等.不同粉碎度小麦发酵高温大曲的微生物群落结构及功能特征比较[J].现代食品科技,2024,40(7):72-80.
[29]胡金喆,韩业慧,谌琦月,等.基于多维度的大曲关键风味代谢菌群判定与调控应用研究[J/OL].食品与发酵工业,1-13[2025-09-26].https://doi.org/10.13995/j.cnki.11-1802/ts.042486.
[30]ZHU B F,XU Y.Production of tetramethylpyrazine by batch culture of Bacillus subtilis with optimal pH control strategy[J].J Ind Microbiol Biot,2010,37(8):815-821.
[31]LIN J G,WANG Q Q,ZHOU S M,et al.Tetramethylpyrazine:a review on its mechanisms and functions[J].Biomed Pharmacother,2022,150:11300.
[32]谢国权,梁昕彤,张文先,等.四甲基吡嗪衍生物的合成及抗肿瘤活性研究[J].化学研究与应用,2019,31(2):308-313.
[33]ZHANG H X,DU H,XU Y.Volatile organic compound-mediated antifungal activity of Pichia spp.and its effect on the metabolic profiles of fermentation communities[J].Appl Environ Microbiol, 2021, 87(9):e02992-20.