清香型白酒作为中国传统蒸馏酒的典型代表,其工艺特征以“清蒸清烧、地缸发酵”为核心,追求“酒体纯净、香气清雅”[1]。传统白酒酿造工艺中,大曲、小曲及麸曲的选择对产酒效率和风味形成具有决定性作用。相较于其他酒曲,麸曲凭借其发酵时间短、产酒量高且原料适用性广的优势,在规模化生产中广泛应用[2]。然而,传统麸曲白酒普遍存在香气单一、酯类物质含量不足的缺陷,制约了其品质提升[3]。
近年来,微生物强化技术为麸曲工艺的优化提供了新思路,黑曲霉通过分泌α-淀粉酶、糖化酶等高效分解淀粉,而酵母则主导酒精发酵及酯类合成,二者协同可平衡出酒率与风味品质[4-5]。潘菲等[6]通过从特香型白酒大曲中筛选高活性糖化酶的黑曲霉菌株,并与酿酒酵母复配制备麸曲,可显著提升出酒效率并优化酒体风味。李洪媛等[7]通过混合培养根霉与酵母菌株制备麸曲,发现其能够显著增加原酒中乙酸乙酯的含量,从而增强白酒的香气层次与口感协调性。余安玲等[8]优化混合麸曲的培养条件(如30 ℃、水料比1∶1、接种量10%)可使酵母活菌数达6.78×109 CFU/g,显著提升酒体酯类含量。黄亮等[9]在浓香型丢糟酒酿造中,黑曲霉麸曲(糖化酶活力1 507.91 U/g)与酵母酒母混合使用,可将酒醅残余淀粉率从7.23%降至5.20%。
然而,现有研究对于黑曲霉与酵母混合培养制备麸曲的研究较少,对混合菌种在清香型白酒固态发酵体系中的动态互作机制仍缺乏系统性探讨。黑曲霉通过高效分解淀粉为可发酵糖,为酵母提供充足底物;酵母则在乙醇发酵过程中生成酯类、高级醇等风味物质,并调控代谢路径以减少不良副产物,二者的协同效应可能突破单一菌种的功能局限。本研究基于筛选的黑曲霉与酵母菌株构建混合麸曲体系,并将其引入清香型白酒酿造工艺。通过对比不同菌种组合麸曲对原料产酒率及清香型白酒风味物质的影响,系统评估了混合麸曲的工业化应用价值,旨在为清香型白酒品质提升新的思路和方法。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
黑曲霉(Aspergillus niger)CBS 513.88、酿酒酵母(Saccharomyces cerevisiae)1#:由北京顺鑫农业股份有限公司牛栏山酒厂分离保存。
清香型大曲、稻壳、麸皮:由北京顺鑫农业股份有限公司牛栏山酒厂酿造车间提供。
1.1.2 试剂
葡萄糖(分析纯)、淀粉、酵母浸粉、琼脂(均为生化试剂):北京奥博星生物技术有限责任公司;乙酸正戊酯(色谱纯):上海安谱实验科技股份有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、无水硫酸钠、丙酮(均为分析纯):国药集团药业股份有限公司。
1.1.3 培养基
麸皮培养基:麸皮过20目筛,留大片麸皮。麸皮与蒸馏水按照10∶9比例搅拌均匀,置于500 mL锥形瓶内,30 g/瓶,瓶口用纱布和封口膜封口。
酵母浸出粉胨葡萄糖琼脂(yeast peptone dextrose agar,YPD)培养基:葡萄糖20 g/L,酵母浸粉10 g/L,蛋白胨20 g/L,琼脂20 g/L;YPD液体培养基不添加琼脂。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:去皮马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,pH值自然,氯霉素25 mg/mL。
上述培养基均于121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
DT-2002A型电子天平:常熟市佳衡天平仪器有限公司;精密酒精计(分度值0.1%vol):冀州市耀华器械仪表厂;Infinite 200 Pro多功能微孔板酶标仪:奥地利Tecan有限公司;BSC-1000A2生物安全柜:上海博讯医疗生物仪器股份有限公司;SPX-430型生化培养箱:宁波江南仪器厂;Agilent 7890B气相色谱(gas chromatography,GC)仪、DVB/CAR/PDMS萃取头(2 cm、50/30 μm)、HP-5MS石英毛细管色谱柱(30 m×0.25 mm×0.50 μm):美国安捷伦公司。
1.3 方法
1.3.1 酿酒酵母种子液制备
在无菌环境下,从斜面培养基中挑取1环酿酒酵母接入装有YPD液体培养基的试管中,30 ℃恒温培养24 h。培养完成后按照10%(V/V)的接种量转接入YPD液体培养基的锥形瓶中,30 ℃培养24 h,作为种子液备用。
1.3.2 种曲和麸曲制备
将保存的黑曲霉培养至孢子数>1×106 CFU/mL,酿酒酵母种子液培养至酵母活菌数>1×107 CFU/mL时,分别接入麸皮固体培养基中搅拌均匀,30 ℃恒温培养,16 h摇瓶以防结块,32 h后扣瓶培养,3~5 d后40 ℃低温烘干制成种曲;种曲以1%的接种量转接到麸皮固体培养基中,搅拌均匀,30 ℃培养3 d,40 ℃低温烘干制成黑曲霉麸曲、酿酒酵母麸曲和黑曲霉与酿酒酵母混合麸曲,置于阴凉、干燥、通风处贮存备用。
1.3.3 试验方案设计
按照糖化发酵剂的组成分为4组方案进行发酵实验,以只加清香大曲,不添加任何麸曲为对照组。根据酒厂的实际生产工艺,按总用曲量占原料的10%~16%设计实验组[10],即A组:清香大曲10%、黑曲霉2%、酿酒酵母4%;B组:清香大曲10%、黑曲霉2%;C组:清香大曲10%、酿酒酵母4%;D组(对照组):清香大曲10%。每组方案分别选择3个位置相近的地缸发酵,共计12个地缸。
1.3.4 清香型白酒生产工艺流程及操作要点
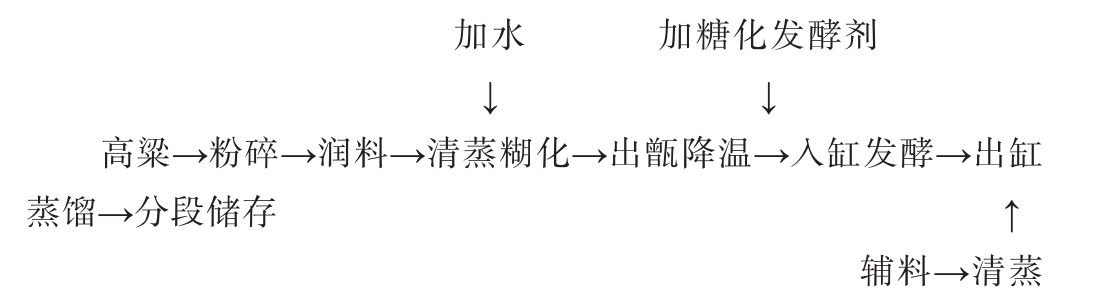
将破碎好的高粱(4~8瓣)用热水浸润24 h,粮醅装甑后当甑桶中的水蒸气均匀冒出并形成稳定蒸汽流时,加入总料量1%的凉水。清蒸糊化90 min,糊化完毕后取出摊晾,摊晾过程中添加适量凉水。待酒醅降温至25 ℃时,按照每缸高粱质量100 kg加入4组方案相应的麸曲或清香大曲粉,拌匀,入缸发酵。待酒醅发酵28 d取出,添加适量辅料(稻壳),拌匀,蒸酒,蒸馏得到的酒样进行后续挥发性风味成分分析和感官评价。
1.3.5 麸曲糖化力测定
将4组方案提及的黑曲霉麸曲、酿酒酵母麸曲、混合麸曲及清香型大曲均匀称取5 g,参考文献[11]的方法,采用3,5-二硝基水杨酸(DNS)试剂法测定糖化力。
1.3.6 酒样出酒率分析
酒精度参照国标GB 5009.225—2023《食品安全国家标准 酒和食用酒精中乙醇浓度的测定》测量[12]。原料出酒率按照公式(1)计算[13]:
式中:m为65%vol原酒产量,g;M为原料用量,g。
1.3.7 挥发性风味成分分析
挥发性风味成分的测定采用顶空固相微萃取-气相色谱质谱(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)联用法。
SPME条件:将实验酒样统一稀释至10%vol,称取1 mL待测酒样置于20 mL顶空瓶中,加入3 g无水硫酸钠、10 μL乙酸正戊酯标品(10 mg/L),60 ℃水浴平衡20 min,顶空萃取吸附30 min。
GC条件:选择不分流进样模式,载气为高纯度氦气(He)(纯度>99.999%),流速1.0 mL/min,进样温度250 ℃,热解吸5 min;升温程序:初始50 ℃保持2 min,以12 ℃/min的升温速度升至300 ℃,保持10 min。
MS条件:全扫描模式(SCAN),质量扫描范围45~450 amu;电子电离(electron ionization,EI)源,电子能量70 eV;传输线、离子源和四极杆的温度分别设置为250 ℃、230 ℃和150 ℃。
定性定量分析:使用Wiley数据库鉴定每种化合物,选择正负匹配度>800的化合物,根据保留时间定性;采用内标法定量,以内标物质(乙酸正戊酯)的质量浓度、峰面积计算各挥发性风味成分的含量,重复测量3次。
1.3.8 白酒感官评价
参考GB/T 10345—2022《白酒分析方法》[14]及牛栏山二锅头白酒风味轮绘制方法[15],由10名品酒师对4种酒样进行感官评价。将感官属性定义为花香、果香、草木香、甜香、原料香、发酵香、酸、苦、甜、纯净、协调、柔和。采用10分法非结构标度进行分析,并绘制风味雷达图,其中0分表示“无感觉”,10分表示“感觉最强”。
1.3.9 数据处理
统计分析均使用SPSS 23.0软件,并采用单因素方差分析比较均值,P<0.05水平上的数据具有显著性差异;利用Origin 2019软件绘制总离子流色谱图。所有样品重复测定3次,结果以“平均值±标准差”表示。
2 结果与分析
2.1 麸曲糖化力与酒样出酒率测定
将不同菌种组合麸曲的糖化力进行测定,并对发酵后的酒醅进行蒸馏,酒样酒精度折算成出酒率,结果见表1。
表1 不同菌种组合麸曲糖化力与酒样出酒率
Table 1 Liquor yield of Fuqu with different strain combinations

注:相同字母表示样品间差异不显著(P>0.05),不同字母表示样品间差异显著(P<0.05),下同。
组别 糖化力/(U·g-1)酒样出酒率/%A组B组C组D组2 407±45.33a 2 180±12.04b 985±51.29c 651±7.11d 31.93±0.91a 25.28±1.02b 14.45±0.87c 21.67±2.13b
由表1可知,各实验组的麸曲糖化力均显著高于对照组(P<0.05),其中A组的糖化力最高,比对照高了1 756 U/g,B、C组比对照分别高了1 529 U/g和334 U/g。从酒样出酒率来看,与对照组酒样比较,A组出酒率由21.67%提高到31.93%,出酒率增加了10.26个百分点,这可能是因为黑曲霉和酿酒酵母存在协同作用,黑曲霉分泌糖化酶和液化酶加速了对原料的糖化分解,被酿酒酵母利用转化为酒精。B组单独添加黑曲霉麸曲,出酒率比对照组提高了3.61个百分点,这可能是由于黑曲霉水解淀粉成小分子还原糖,在白酒酿造中,为酒醅中原有酿酒酵母乙醇发酵提供了还原糖[16],从而提高了出酒率。而C组单独添加酿酒酵母麸曲时,出酒率却下降了7.22个百分点,原因可能是酿酒酵母在酿造前期快速生成乙醇对霉菌的生长有抑制作用[17],从而降低了淀粉的水解。由此可见,黑曲霉与酿酒酵母的协同效应、功能互补是提升出酒率的关键,而单菌添加,黑曲霉糖化未充分转化、酿酒酵母代谢抑制的效果有限,需通过菌种组合优化实现高效酿造。
2.2 酒样挥发性风味成分测定
采用顶空固相微萃取气相色谱质谱联用(HS-SPMEGC-MS)法对4组酒样中的挥发性风味成分进行分析,挥发性风味成分总离子流色谱见图1,分析结果见表2。
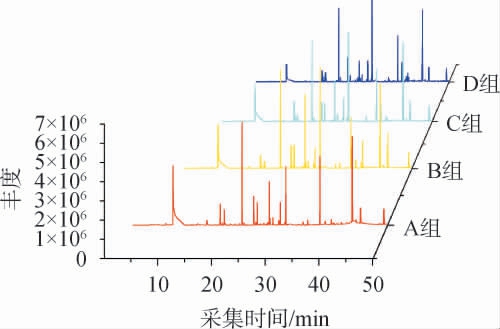
图1 4组酒样中挥发性风味成分气相色谱-质谱分析总离子流色谱图
Fig.1 Total ion chromatogram of volatile flavor components in 4 groups of liquor samples analysis by GC-MS
表2 4组酒样中挥发性风味成分气相色谱-质谱分析结果
Table 2 Results of GC-MS analysis of volatile flavor compounds in 4 groups of liquor samples

类别 化合物异丁醇异戊醇正丙醇正丁醇正己醇苯乙醇氢化安息香丙酮酸乙酯乳酸乙酯3-苯丙酸乙酯异丁酸苯乙酯2-(甲氨基)乙酸乙酯2-甲基丁酸乙酯2-羟基-3-甲基丁酸乙酯苯甲酸乙酯苯乙酸乙酯丁二酸二乙酯丁酸丙酯丁酸乙酯十四酸乙酯十五酸乙酯油酸乙酯月桂酸乙酯己酸乙酯棕榈酸乙酯DL-2-羟基-4-甲基戊酸乙酯戊酸乙酯辛酸乙酯亚油酸乙酯壬酸乙酯乳酸丁酯反油酸乙酯庚酸乙酯癸酸乙酯棕榈酸乙酯乙酸苯乙酯乙酸乙酯乙酸异丁酯乙酸异戊酯甲酸乙酯异丁酸乙酯三甲基乙酸乙酸异丁酸含量/(mg·L-1)A组 B组 C组 D组醇类酯类酸类32.16±5.49b 257.60±20.02b 17.11±2.88b 3.39±0.90ab 5.89±0.84a 49.52±2.88a 0.59±0.04b N.D 603.57±0.23d 4.19±1.75b 4.53±4.05a N.D 0.75±0.12c N.D 4.81±0.71a 1.78±0.07b N.D N.D 6.23±0.70a 3.58±0.17c 5.56±0.11a 6.05±2.41a 5.10±0.47a 9.90±0.29a 335.58±23.41a 60.44±7.24a 1.00±0.58a 6.32±0.81a 6.17±0.92b 6.51±1.94a 3.39±1.45a N.D 3.34±0.67a 3.03±0.14c 3.69±0.18b N.D 3 299.09±21.55a 4.25±0.16a 5.75±0.44b 3.51±0.33b 4.80±1.40a 107.43±13.03c 396.01±47.01b 3.14±0.34b 67.30±3.40a 112.38±8.53c 34.39±4.13a 3.97±0.85ab 3.64±0.20b 5.77±0.91d 3.54±0.85a N.D 878.03±5.08b 1.48±0.08c N.D 5.89±0.74a N.D 6.16±0.07a 4.28±0.48a 1.57±0.03b 3.94±0.16c 5.05±1.05a N.D 1.81±0.58d N.D N.D 1.37±0.76c 6.67±1.35b 5.29±0.78d 2.31±0.61d N.D 2.77±0.38d 5.49±0.36c N.D N.D 3.13±0.23b N.D 6.01±1.93a 4.52±0.15a 3.12±0.20b 1 005.06±0.95b 4.16±3.08a 3.29±3.24c 5.51±2.76a N.D 6.38±0.36d 4.55±0.77d 6.84±0.64a 27.20±2.06c 101.10±5.40c 33.12±3.07a 4.13±0.47b 3.58±0.57b 11.25±1.76c N.D N.D 716.15±12.89c 6.81±2.64a N.D N.D 3.10±0.74b 4.54±0.50b 4.55±0.11a 2.33±1.21a 22.50±3.59b N.D 3.04±0.73b 5.24±1.19a N.D N.D 3.52±0.57b 6.87±0.10b 20.57±8.16c 22.74±5.00c N.D 3.25±0.93c 4.03±0.17d N.D 2.89±0.26b 5.21±0.36a N.D 5.23±0.61b 3.10±3.94b 4.11±0.10a 997.72±20.27b 4.69±2.16a 7.82±6.27a 5.27±3.52a N.D 162.01±20.06b 228.22±34.50c 3.52±0.05b 68.81±0.42a 291.50±1.78a 32.78±1.16a 20.23±3.46a 2.35±1.05ab 29.29±0.95b N.D 4.97±0.98a 1 749.14±41.18a 6.86±1.32a N.D N.D 4.70±2.07a 2.34±1.85c 2.10±0.56b 2.47±0.45a 42.98±0.96a N.D N.D 4.87±0.37b 2.14±0.29b N.D 6.08±0.74a 4.86±0.05c 91.24±0.82b 50.55±0.47b N.D 4.99±0.30b 10.15±1.14a N.D N.D 5.25±1.87a N.D 6.04±2.61a 3.11±0.74b 2.09±0.93c 1 017.40±4.23b 1.44±0.24b 7.02±2.69a 3.85±0.71b 3.94±3.02b 536.62±3.81a 479.46±8.88a 3.20±0.07b
续表

注:“N.D”表示未检出。
类别 化合物含量/(mg·L-1)A组 B组 C组 D组醛酮类酚类异戊酸丁酸草酸5-甲基呋喃醛糠醛2-甲基丁醛异戊醛苯甲醛苯乙醛丁醛二乙缩醛丙酮3-羟基-2-丁酮2-乙基苯酚2,4-二叔丁基苯酚4-乙基愈创木酚2-甲氧基苯酚(2,2-二乙氧基乙基)-苯N.D 4.91±2.15a 6.96±1.04a N.D 6.16±0.86b 4.85±0.06b 3.68±0.46c N.D N.D 2.52±0.77c N.D 137.36±0.47a 4.39±0.75a N.D 6.56±0.05a 6.66±2.77a 4.69±0.41a 4.00±0.82a N.D N.D 3.77±0.19a 2.28±0.17d 5.62±0.10a 4.34±0.87b 4.25±0.79b N.D 7.22±1.94a 4.41±0.83c 4.32±0.32c 4.45±2.54a N.D 4.67±0.20b 3.75±1.69d 4.17±0.17a N.D N.D N.D 3.47±0.35a 4.35±0.76c 2.90±0.61c 3.69±0.58c 3.95±0.03c N.D 4.32±0.26b 5.90±0.45b 13.73±1.87b 4.44±0.33a 5.32±0.62a 6.90±0.15a 5.87±1.12b 2.97±1.18b 4.93±4.13a N.D N.D N.D 32.21±1.54a 5.27±0.92a 6.15±0.64a 5.18±1.00a 3.26±0.53a 4.85±0.05b 7.40±1.07a 4.08±0.31c 2.87±0.20b N.D N.D 4.96±0.58c 4.72±0.65a
由图1可知,不同菌种强化酒样的挥发性成分与对照组酒样总离子流色谱图基本相似,各酒样中挥发性成分的峰形、香气成分种类基本一致。由表2可知,经GC-MS从A、B、C和D组酒样中分别共鉴定出48种、46种、46种和46种挥发性风味成分。4种酒样中检出的挥发性成分包括醇类7种,酯类34种,酸类6种,醛酮类9种,酚类5种。
醇类物质在酒样中含量最高。A组(黑曲霉和酿酒酵母混合)酒样的高级醇(异丁醇、异戊醇、正丙醇等)总含量较对照组降低了17.69%,其中异丁醇含量降低53.26%,异戊醇含量降低11.63%,正丙醇含量降低47.79%。B组、C组酒样的醇类总含量较对照组分别降低了48.09%、59.46%。适量的高级醇能赋予酒体醇厚、甘甜的风味,但高级醇含量过高则会破坏酒体质量,其含量的降低可有效的减少白酒对人体的危害[18]。
清香型白酒的主要成分含有酯类及醛类物质,其香气特征具备清新、甜净的特点[19]。在酯类化合物中,A组的乙酸乙酯含量明显增加,是对照组的3.24倍。乙酸乙酯是清香型白酒的主体香,可以协调其他物质,赋予白酒的清香感,提升白酒品质[20]。另外,乳酸乙酯的含量也很高,但是A、B、C 三 组 中 的 乳 酸 乙 酯 含 量 均 显 著 低 于D 组(P<0.05)。乳酸乙酯具有柔和的果香,能缓冲和平衡酒香,但是其含量超过一定范围时,酒体会呈现香气不突出,主体香受抑制,从而降低白酒的品质[21-22]。有研究表明,在白酒酿造中,可通过提高酒曲本身糖化力和液化力等,使乳酸菌处于相对被抑制状态[23]。A组其他酯类如油酸乙酯、月桂酸乙酯、己酸乙酯、棕榈酸乙酯、DL-2-羟基-4-甲基戊酸乙酯等含量较D组也有显著提升,这些酯类为白酒带来更丰富的风味。
在酸类化合物中,A组的草酸含量较高,其他组别未检出草酸,可能是草酸能够参与调节Ca2+、pH及渗透压等生理学过程,参与了酒中酯类的合成[24]。醛酮类化合物作为其他风味物质的前体,是白酒中重要的微量呈香物质之一,对白酒的独特风味有着显著的贡献,尤其是A组的3-羟基-2-丁酮含量较对照组有显著增加(P<0.05),是对照组的33.67倍,这进一步丰富了白酒的香气和口感[25]。
酚类化合物中,A、B、C三组中2-乙基苯酚、4-乙基愈创木酚、2-甲氧基苯酚等含量与对照相比,显著增加(P<0.05)。4-乙基愈创木酚具有抗炎、抗氧化等生物活性功能[26],有助于减少白酒对人体的潜在危害,提高白酒的饮用安全性。
从酒样挥发性风味物质分析来看,实验组与对照组、以及各实验组内之间的风味成分存在差异,B、C组醇类含量较对照组显著降低(P<0.05),且酯类化合物含量不足,风味层次较弱。D组(对照组)乳酸乙酯过高抑制主体香,酚类及醛酮类含量低,综合品质较差。A组(黑曲霉和酿酒酵母混合)在优化风味、平衡成分及提升健康安全性方面表现最优。
2.3 酒样感官品评
对4种酒样依据香气、口味强度情况进行感官评价,并绘制4种酒样的风味雷达图,结果见图2。
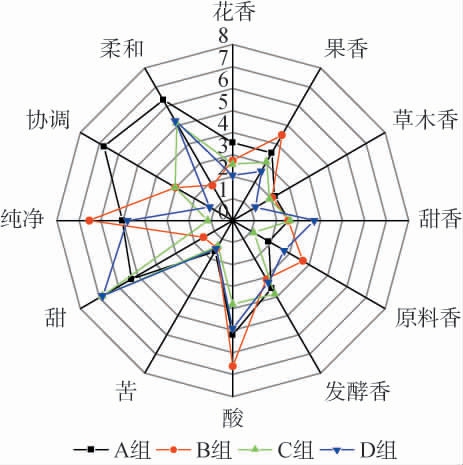
图2 4组酒样感官评价雷达图
Fig.2 Radar chart of sensory evaluation of 4 groups of liquor samples
由图2可知,4组实验酒样的香气、口感均有不同的差异,在香气方面,A组的花香较其他组得分较高,这与A组中酯类化合物具有花果香的特性有关。B组的原料香及果香较其他组得分较高,但口感显示酸度较高。C组发酵香更突出,D组甜香更胜一筹;在口味方面,A组更显协调、柔和,B组的纯净度更优一些。因此,从香气、口味强度等方面分析,A组酒样的综合感官评价最好。
3 结论
本研究探讨了不同菌种微生物方案组合制备的麸曲在清香型白酒中的应用效果。实验通过对比各组麸曲与对照组在糖化能力、出酒率、风味成分以及感官品质上的差异,评估了不同微生物组合对白酒发酵性能及酒体品质的影响。研究表明,黑曲霉与酿酒酵母混合制备的麸曲在清香型白酒发酵中表现出显著优势。该组合不仅提高了麸曲糖化能力和出酒率,还通过优化风味成分组成,显著降低了高级醇含量,减少了健康风险,同时提升了主体香乙酸乙酯的含量,强化了清香型白酒的特征。此外,该组合还调控了乳酸乙酯的平衡,增加了4-乙基愈创木酚等酚类物质的含量。感官品评结果显示,该组合赋予酒体协调柔和的口感与花果香特征,综合表现最优。相比之下,单独使用黑曲霉或酿酒酵母作为糖化发酵剂时,虽然在一定程度上提高了糖化力,但在出酒率、风味成分及感官品质方面存在不足。因此,黑曲霉与酿酒酵母混合制备的麸曲是提升清香型白酒发酵性能及酒体品质的有效策略。
[1]张英,鄢定波,胡景辉,等.清香型白酒发展概述[J].中国酿造,2024,43(9):1-8.
[2]王柏文,吴群,徐岩,等.中国白酒酒曲微生物组研究进展及趋势[J].微生物学通报,2021,48(5):1737-1746.
[3]丁娟,许勤虎,王祥河,等.多微麸曲清香型白酒酿造用糖化菌种筛选研究[J].天津科技,2023,50(7):19-22,26.
[4]张凯悦.酿醋用黑曲霉糖化力与产孢能力的相关性研究及麸曲淀粉酶组分分析[D].太原:山西师范大学,2021.
[5]谢再斌,常煦,何国庆,等.清香型白酒酿造过程中功能微生物及应用研究[J].中国酿造,2024,43(7):27-32.
[6]潘菲,董彪,刘婷,等.黑曲霉Aspergillus niger NCUF413.1对特香型白酒酿造出酒率和风味的影响[J].食品与发酵工业,2020,46(1):23-29.
[7]李洪媛,马美荣,周林艳,等.根霉酵母混合麸曲在清香型白酒生产中的应用[J].酿酒科技,2021(9):123-130.
[8]余安玲,张小娜,李红.酵母麸曲培养条件优化及其固态发酵应用研究[J].食品与发酵工业,2024,50(11):47-54.
[9]黄亮,任志强,邓杰,等.“麸曲+酒母”模式对丢糟发酵产酒的影响[J].现代食品科技,2022,38(11):73-79.
[10]高景炎.清香类型白酒生产工艺集锦[M].北京:中国质检出版社,2018:109-134.
[11]马歌丽,魏泉增,张志刚.分光光度法测定大曲糖化酶活力探讨[J].中国酿造,2008,17(9):69-71.
[12]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 5009.225—2023 酒和食用酒精中乙醇浓度的测定[S].北京:中国标准出版社,2023.
[13]马美荣,刘小改,李洪媛,等.两种扣囊复膜酵母在清香型麸曲白酒生产中的应用[J].食品工业科技,2021,42(21):133-139.
[14]国家标准化管理委员会,国家质量监督检验检疫总局.GB/T 1034—2022白酒分析方法[S].北京:中国标准出版社,2022
[15]柳旭,张倩,于晓涛,等.牛栏山二锅头白酒风味轮的构建及其感官特征分析[J].食品与发酵工业,2021,47(17):250-255.
[16]LIU H,SUN B.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[17]BRANCOLI P,FERREIRA J A,BOLTON K,et al.Changes in carbon footprint when integrating production of filamentous fungi in 1st generation ethanol plants[J].Bioresource Technol,2018,249:1069-1073.
[18]史百福.浅析白酒生产中产生高级醇的影响因素[J].中外食品工业,2024(8):27-29
[19]冒德寿,牛云蔚,姚征民,等.顶空固相微萃取-气相色谱质谱联用和气相色谱嗅闻技术鉴定清香型白酒特征香气物质[J].中国食品学报,2019,19(7):251-261.
[20]许银,杨强,张龙,等.高产乙酸乙酯酵母菌的筛选及其在清香型小曲白酒生产中的应用[J].中国酿造,2021,40(8):76-80.
[21]丁力杰,唐云,赵亚雄,等.白酒中的重要酯类物质及主要来源研究现状[J].酿酒科技,2024(3):91-100.
[22]XU Y,ZHAO J,LIU X,et al.Flavor mystery of Chinese traditional fermented Baijiu: The great contribution of ester compounds[J].Food Chem,2022,369(1):130920.1-130920.13.
[23]王进明,刘忠军.清香型白酒乳酸乙酯偏高的原因及解决措施[J].酿酒,2012,39(4):81-84.
[24]冷桃花,万丽佳,吴新,等.蔬菜中草酸检测技术的研究进展[J].食品安全质量检测学报,2020,11(13):4165-4170.
[25]王磊,王春光,刘雅冉,等.HS-SPME-GC-Orbitrap-MS法测定果酒中的醛酮类和呋喃类化合物[J].食品科学,2023,44(16):353-361.
[26]李祥弟,徐婷,刘占,等.高产四乙基愈创木酚耐盐乳酸菌的筛选及其发酵特性研究[J].食品与发酵工业,2023,49(22):33-40.