山西老陈醋是以高粱、麸皮为主要原料,以稻壳和谷壳为辅料,以大麦、豌豆为原料制作的大曲为糖化发酵剂,经酒精发酵后采用固态醋酸发酵、再经熏醅、陈酿等工艺酿制而成的[1]。山西老陈醋的发酵工艺属于传统固态自然发酵,原料、大曲及环境中的微生物通过自然富集繁殖,逐渐形成稳定的微生物群落。复杂的微生物群落产生了丰富的有机酸、氨基酸、多糖、醇、酯、酚等代谢产物,因此复杂但有规律的微生物群落组成是赋予传统酿造调味食品独特风味品质的根本。
山西老陈醋醋酸发酵阶段的优势菌群主要由醋酸菌(以醋酸杆菌属(Acetobacter)为主)、乳酸菌(乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)等)及芽孢杆菌(Bacillus)构成,其中乳杆菌属和醋酸杆菌属占主导优势[2]。醋酸发酵阶段,醋酸菌通过酶催化将乙醇转化为乙酸,并生成乙偶姻等功能性物质[3];乳酸菌代谢产生乳酸等有机酸,缓冲刺激性酸味,同时与醇类酯化生成乳酸乙酯等风味物质[4-6];芽孢杆菌能够代谢产生各种蛋白酶、淀粉酶类,利用淀粉、麦芽糖、葡萄糖、甘油、蔗糖等产酸,此外还可以代谢产生乳酸、苹果酸、酒石酸、丙酮酸等有机酸,一方面能缓冲乙酸带来的强烈刺激性酸味,另一方面与醇类物质酯化生成酯类物质,如乳酸乙酯、柠檬酸乙酯等,丰富老陈醋味感与口感[7-8]。
在食醋酿造机理的解析基础上,筛选土著优势优良菌株,强化应用在食醋酿造过程中,进行菌群优化和发酵定向代谢调控,进而提升食醋发酵效率、生产稳定性和产品风味营养品质,是近年来食醋酿造的关键核心攻关方向。余永建[9]将镇江香醋醋醋醅中分离得到的一株高产乳酸、甘氨酸、谷氨酸、脯氨酸的优良菌株瑞士乳杆菌(Lactobacillus helveticus)M3 1强化应用到醋酸发酵阶段,结果表明,该菌株能在保留原有氨基酸风味物质的前提下,将发酵周期缩短并提升乳酸含量。符传学[10]将筛选鉴定的乳酸片球菌(Pediococcus acidilactici)AFF1-5(耐温度45 ℃,耐pH 4.0)应用于独流老醋中试发酵体系发现,相较于空白对照组,菌剂组的醋酸发酵周期缩短4 d,总有机酸含量提高8.9%,使发酵周期减少4 d,总有机酸含量提高8.9%。王超宁[11]则针对山西老陈醋特色菌种开展功能挖掘,筛选出一株耐酒精(10%vol)、耐高温(50 ℃)及耐酸(pH 3.5)的巴氏醋酸杆菌(Acetobacter pasteurianus)CP2416;进一步 将该菌株应用于山楂苦荞醋酿造发现,相较于Acetobacter pasteurianus CICC 20011,菌株CP2416使成品总酸含量提升8.6%,有机酸总量增加4.7%,并显著提高酯类、醛类等挥发性风味物质含量。
本研究主要是将实验室前期从山西老陈醋醋醅中筛选出的两株优良菌株巴氏醋杆菌2416和植物乳植杆菌(Lactiplantibacillus plantarum)L7,经过高密度培养、活性保护技术开发成老陈醋酿造专用直投式醋酸菌剂和乳酸菌剂,并将其应用于山西老陈醋醋酸发酵阶段。在实验室小试的基础上,在企业进行一次上料量为300 kg高粱的中试试验,采用稀释平板菌落计数法结合高效液相色谱(high performance liquid chromatography,HPLC)、顶空固相微萃取-气相色谱-质谱联用(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GCMS)法,探讨强化菌剂对山西老陈醋酿造过程中微生物菌群、理化指标、风味成分的影响,为进一步进行生产性扩大试验应用及在企业、行业中推广提供数据支持。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
大曲:山西老陈醋集团有限公司;高粱:山西汾阳市永信蔚高粱专业合作社;麸皮:山西丰联农业有限公司;谷糠:文水县农盛贸易有限公司。
1.1.2 菌株
巴氏醋杆菌2416:分离自山西老陈醋醋醅中,保藏于中国普通微生物菌种保藏管理中心(China General Microbiological Culture Collection Center,CGMCC),保藏编号为CGMCC 15730,其产酸量为17.2 g/L(30 ℃发酵24 h),产酸性能良好,具有耐酒精(10%vol)、耐高温(50 ℃)、耐酸(pH=3.5)的特性[11]。
植物乳植杆菌L7:分离自山西老陈醋酒醪中,保藏于CGMCC,保藏编号为CGMCC 15731,其产酸量达24.3 g/L(37 ℃发酵24 h),同时,该菌在高温(50 ℃)、高酒精度(12%vol)、高糖度(250 g/L)、低酸度(pH=3)的条件下均可以生长良好,表现出较强的耐受性[12]。
酵母菌:安琪酵母股份有限公司。
1.1.3 试剂
草酸、丙酮酸、酒石酸、苹果酸、乳酸、乙酸、柠檬酸、琥珀酸(均为色谱纯):天津市光复精细化工研究所。其他试剂均为国产分析纯或生化试剂。
1.1.4 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、MRS培养基、孟加拉红培养基、平板计数琼脂(plate count agar,PCA)培养基:北京奥博星生物技术有限责任公司;醋酸菌液体培养基[11]:葡萄糖20 g、酵母膏10 g,碳酸钙10 g,蒸馏水1 000 mL,121 ℃条件下高压蒸汽灭菌20 min;醋酸菌固体培养基:在醋酸菌液体培养基中加入20 g琼脂。
1.2 仪器与设备
PB-21酸度计:赛多利斯科学仪器(北京)有限公司;戴安U3000液相色谱仪、Trace1300 气相色谱仪、TraceISQ质谱分析仪:赛默飞世尔科技(中国)有限公司;5425R离心机:艾本德(中国)有限公司。
1.3 方法
1.3.1 强化菌剂的制备
参考文献[13]的方法制备植物乳植杆菌L7直投式发酵剂(活菌数为1.01×1011 CFU/g)和巴氏醋杆菌2416直投式发酵剂(活菌数为7.8×1010 CFU/g),其中冻干保护剂配方为脱脂奶粉10%,海藻糖3%,甘油5%,蔗糖8%。
1.3.2 强化菌剂在山西老陈醋醋酸发酵阶段的应用
对照组:取300 kg高粱粉碎后,按60%(添加量均以高粱质量为基准)加水润料12 h,蒸煮1.5 h,加入220%水(80 ℃)焖料,冷却至25~33 ℃后拌入40%大曲和0.1%酵母,酒精发酵10 d(敞口发酵3 d,封口发酵7 d)。酒精发酵结束后加入120%麸皮、70%谷糠,接入10%火醅醋酸发酵9 d,最后加10%食盐,经熏醅、淋醋工序制得新淋醋[14]。
植物乳植杆菌L7强化组:在醋酸发酵阶段,拌料时,同步添加混合干料质量0.3%的乳酸菌剂,搅拌均匀,其余工艺操作同对照组。
巴氏醋杆菌2416强化组:在醋酸发酵阶段,拌料时,同步添加混合干料质量1.0%的醋酸菌剂,搅拌均匀,其余工艺操作同对照组。
植物乳植杆菌L7+巴氏醋杆菌2416复合强化组:在醋酸发酵阶段,拌料时,同步添加混合干料质量1%的醋酸菌剂和0.3%的乳酸菌剂,搅拌均匀,其余工艺操作同对照组。
1.3.3 样品的采集
对山西老陈醋醋酸发酵阶段进行动态采样,分别在醋酸发酵第0、1、3、5、7、9天从发酵缸中距醋醅表面30 cm处选取4个点共取100 g刚完成翻醅的醋醅样品,混匀,分别编号为C0、C1、C5、C7、C9;上述样品及新淋醋样品存放于-80 ℃保存。
1.3.4 分析检测
微生物活菌数的测定:采用稀释平板菌落计数法结合菌落和细胞形态对醋酸发酵过程中细菌总数(PCA培养基)、真菌总数(孟加拉红培养基)及主要优势菌群―霉菌(孟加拉红培养基)、酵母菌(PDA培养基)、乳酸菌(MRS培养基)、芽孢杆菌(MRS培养基)和醋酸菌(醋酸菌固体培养基)活菌数进行计数。
理化指标的测定:参考国标GB/T 19777—2013《地理标志产品山西老陈醋》[15]的方法对酒精度、还原糖、水分、总酸、不挥发性酸、pH进行测定;参照GB/T 5009.39—2003《酱油卫生标准的分析方法》[16]中的甲醛滴定法对氨基酸态氮含量进行测定。
有机酸的测定:采用高效液相色谱法对有机酸含量进行测定[17]。
挥发性风味物质的测定:采用HS-SPME-GC-MS法测定挥发性风味物质[18]。
1.3.5 数据处理与统计分析
所有样品均重复测定3次,采用SPSS_29.0.2.0软件处理数据,结果以“平均值±标准差”表示。采用Excel 2023和Origin 2018软件绘图。
2 结果与分析
2.1 强化菌剂对山西老陈醋醋酸发酵阶段微生物活菌数的影响
在醋酸发酵过程中,醋酸菌、乳酸菌和芽孢杆菌是主要的优势菌群,能够产生大量的有机酸、氨基酸和酯类物质,具有增强食醋风味和调节食醋口感等作用[19]。因此,考察强化菌剂对山西老陈醋醋酸发酵过程中细菌总数、醋酸菌、乳酸菌和芽孢杆菌活菌数的影响,结果见图1A~图1D。由图1A~图1D可知,在醋酸发酵过程中,醋醅中的细菌总数、醋酸菌、乳酸菌及芽孢杆菌活菌数均呈现先上升后下降的趋势。在醋酸发酵初期(0~5 d),营养物质丰富促使细菌总数快速增加,对照组细菌总数从6.29 lg(CFU/g)升至峰值9.04 lg(CFU/g),而添加菌剂的试验组增长幅度较大,醋酸菌剂、乳酸菌剂和复合菌剂强化试验组的细菌总数峰值分别达到9.63 lg(CFU/g)、9.51 lg(CFU/g)和9.70 lg(CFU/g)。随着醋酸含量升高和pH下降,细菌生长受到抑制,至发酵第9天,对照组细菌总数降至4.45lg(CFU/g),强化组细菌总数相对较高,维持在4.68~4.83 lg(CFU/g)。醋酸菌和乳酸菌活菌数变化趋势类似,在醋酸发酵第5天,对照组醋酸菌和乳酸菌活菌数达到峰值,分别为7.30 lg(CFU/g)、8.03 lg(CFU/g),添加高活性醋酸菌剂和乳酸菌可直接提高发酵体系中对应菌群的初始浓度,使菌群更快进入对数生长期,添加醋酸菌剂和复合菌剂强化组醋酸菌活菌数在醋酸发酵第3天达到峰值,分别为7.68 lg(CFU/g)、7.86 lg(CFU/g),而乳酸菌剂和复合菌剂强化组乳酸菌活菌数在醋酸发酵第3天达到峰值,分别为8.45 lg(CFU/g)、8.78 lg(CFU/g)。强化组醋醅芽孢杆菌活菌数与对照组无明显差异。此外,产酸积累和pH下降仍是后期菌群衰减的关键制约因素。

图1 强化菌剂对山西老陈醋醋酸发酵过程中醋醅微生物活菌数的影响
Fig.1 Effect of enhancing bacterial agent on the microbial viable count in Cupei during acetic acid fermentation process of Shanxi aged vinegar
在山西老陈醋酿造过程中,主要参与的真菌种类为酵母菌和霉菌。其中,霉菌可以分泌多种复杂的酶,将淀粉与蛋白质等大分子物质降解成较小的营养成分,如氨基酸、麦芽糖及葡萄糖,这些小分子有助于细菌、酵母菌和其他微生物的生长繁殖,而酵母菌则通过糖酵解作用,将葡萄糖转化为酒精和二氧化碳[20-21]。因此,考察强化菌剂对山西老陈醋醋酸发酵过程中酵母菌和霉菌的影响,结果见图1E~图1F。由图1E和图1F可知,在醋酸发酵过程中,酵母菌和霉菌的活菌数呈下降趋势并逐渐消亡,这是因为随着醋酸发酵的进行,醋醅环境逐渐变得适合产酸菌而抑制霉菌和酵母菌的生长。发酵结束时对照组醋醅中未分离到酵母菌,而强化组则在醋酸发酵第7天活菌数降至0;对照组和强化组的霉菌活菌数均从第0天的5.60 lg(CFU/g)下降到第5天的0,在产酸菌群竞争优势的建立对真菌生存空间的压缩作用下,强化组霉菌活菌数下降速度明显高于对照组。
2.2 强化菌剂对山西老陈醋醋酸发酵阶段理化指标的影响
强化菌剂对醋醅理化指标的影响见图2。水分对于醋醅发酵时微生物的生长代谢至关重要,适宜的水分含量能够为微生物提供良好的生存环境。由图2A可知,醋酸发酵阶段强化组与对照组醋醅中的水分含量无明显差异,均在60%~65%之间。这是由于醋醅中的麸皮和谷糠均具备良好的吸水性,能够有效保持醋醅的水分,满足微生物生长代谢需求[17]。还原糖作为微生物发酵的核心碳源,其动态变化直接表征碳源代谢效率。由图2B可知,醋酸发酵过程中,各组醋醅中的还原糖含量均呈先升高后下降的趋势,分析原因可能是发酵初期,高淀粉辅料麸皮、谷糠的引入导致还原糖含量升高,但随着微生物增殖进入对数生长期,碳源需求激增,消耗速率远超生成速率,还原糖含量下降。外源菌剂(醋酸菌/乳酸菌)通过强化菌群代谢,进一步加速还原糖消耗[22],醋酸发酵9 d时,与对照组还原糖含量相比(0.85 g/100 g),醋酸菌剂、乳酸菌剂和复合菌剂强化组的还原糖含量分别降低10.59%、9.41%、23.53%。由图2C可知,对照组的酒精度由初始的4.5%vol经5 d发酵被完全代谢,而强化组代谢周期缩短至3 d,代谢速率提升40%。分析原因可能是,添加醋酸菌剂与乳酸菌剂通过激活菌群β-氧化通路,显著提升乙醇脱氢酶活性,加速乙醇定向转化为乙酸,同步降低底物抑制效应[23]。

图2 强化菌剂对山西老陈醋醋酸发酵过程中醋醅理化指标的影响
Fig.2 Effect of enhancing bacterial agent on physicochemical indexes of Cupei during acetic acid fermentation process of Shanxi aged vinegar
总酸积累直接驱动pH下降,而乳酸生成通过缓冲体系缓解pH剧烈波动,二者共同反映代谢产物调控机制[24]。由图2D~图2F可知,对照组总酸和不挥发性酸含量分别从1.35 g/100 g、1.08 g/100 g持续上升至醋酸发酵第5天的4.88 g/100 g、1.35 g/100 g,之后趋于稳定,pH同步下降至稳定阈值3.63。而复合菌剂强化组在醋酸发酵第3天总酸含量达5.49 g/100 g,且不挥发性酸含量升至1.44 g/100 g,随后保持稳定。与对照组相比,复合菌剂强化组的醋酸发酵时间缩短了2 d。
氨基酸态氮是食醋重要的组成部分,反映食醋中氨基酸及小肽总体水平,其含量的高低影响着食醋的质量等级和整体风味[24]。由图2G可知,醋酸发酵过程中醋醅的氨基酸态氮含量均呈上升趋势,发酵前期增长速度快,发酵后期氨基酸态氮的增长幅度变缓。分析原因可能是发酵前期微生物代谢产生大量酶类,原料中的蛋白质在蛋白酶的作用下分解成多肽,多肽又经肽酶作用形成氨基酸,也可能与酒精发酵结束酒醪中酵母菌的自溶及酒醪中酸性蛋白酶的水解有关[25];发酵后期总酸含量的增加影响了蛋白酶的活性。醋酸发酵9 d时,对照组、醋酸菌剂、乳酸菌剂和复合菌剂强化组醋醅的氨基酸态氮含量分别为0.18 g/100 g、0.22 g/100 g、0.20 g/100 g和0.24 g/100 g,其中添加复合菌剂对氨基酸态氮含量提升幅度最大,相较于对照组提高了33.33%。
由图2H可知,醋酸发酵阶段总酯含量整体呈现上升的趋势,这是因为发酵前期醋酸菌、乳酸菌产酸,与乙醇结合生成酯。与对照组相比,强化组醋酸发酵过程中醋醅中的总酯含量有一定提高,这是因为醋酸发酵阶段加入醋酸菌剂和乳酸菌剂,产总酸含量和产不挥发性酸速率较快,在酒精发酵阶段产生乙醇未消耗完情况下,进行酯化反应。醋酸发酵9 d时,对照组总酯含量为3.78 g/100 g,复合菌剂组醋醅的总酯含量为3.98 g/100 g,相较于对照组提高了5.29%。
2.3 强化菌剂对新淋醋理化指标的影响
将植物乳植杆菌L7、巴氏醋杆菌2416及其复合菌剂应用于山西老陈醋醋酸发酵阶段,对比分析新淋醋的关键品质指标,结果见图3。由图3可知,相较于对照组,强化组新淋醋的总酸、不挥发性酸、氨基酸态氮和总酯含量均显著升高(P<0.05),其中复合菌剂强化组的提升最为显著,其含量分别为5.58 g/100 mL、2.23 g/100 mL、0.20 g/100 mL和4.29 g/100 mL,相较于对照组分别提高了22.10%、116.50%、53.85%和48.44%。这是由于植物乳植杆菌L7和巴氏醋杆菌2416的协同代谢机制,加速了乙酸、乳酸等有机酸的积累;微生物产酸形成的胁迫环境与生物酶活性协同促进了氨基酸态氮的生物转化;同时,菌群的协同效应通过底物利用优化、酶促反应强化及微生态调控等多维度作用,有效提升了酯类物质合成效率[26-27]。此外,菌剂应用对其他指标也产生了一定影响。与对照组相比,所有强化组还原糖含量均呈现下降趋势,但差异不显著(P>0.05),表明菌剂主要作用于后期代谢而非糖类初级分解;而氯化钠含量仅在复合菌剂组显著提升至0.66 g/100 mL(P<0.05)。

图3 强化菌剂对新淋醋理化指标的影响
Fig.3 Effect of enhancing bacterial agent on physicochemical indexes of new leaching vinegar
不同小写字母表示差异显著(P<0.05)。
2.3 强化菌剂对新淋醋风味物质的影响
2.3.1 强化菌剂对新淋醋有机酸含量的影响
有机酸不仅赋予了食醋独特的口感,同时也是食醋主要的风味物质组成,其组成和含量与食醋的质量密切相关。山西老陈醋中共检测出7种常见有机酸,包括草酸、柠檬酸、酒石酸、苹果酸、琥珀酸、乳酸和乙酸[25]。其中,乙酸是食醋的主体酸味物质,其爽口的酸味与微甜感赋予醋体鲜明特征,但同时伴随较强的刺激性;乳酸则赋予食醋微酸与甜味,同时略带涩感,这种涩感能够增强食醋的浓厚感,有效缓解乙酸带来的刺激性酸味;酒石酸稍有涩感,但其酸味强烈且呈味迅速,能够增加食醋酸味;丙酮酸和琥珀酸兼具酸、咸两种味道;柠檬酸的酸味清爽,能赋予食醋新鲜感;苹果酸的酸度较为柔和,在口腔中的滞留时间长,可以缓冲食醋的刺激性酸味[28]。强化菌剂对山西老陈醋醋酸发酵成醅及新淋醋有机酸含量的影响见表1。
表1 强化菌剂对新淋醋有机酸含量的影响
Table 1 Effect of enhancing bacterial agent on organic acid contents of new leaching vinegar
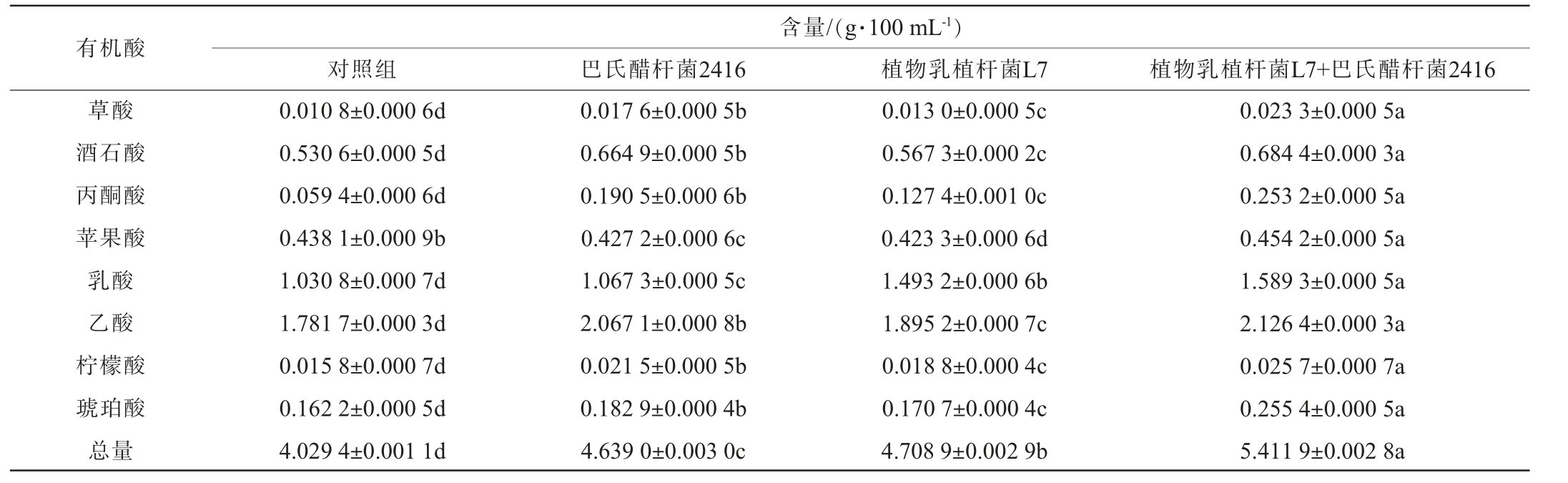
注:同行不同小写字母表示差异显著(P<0.05)。
含量/(g·100 mL-1)对照组 巴氏醋杆菌2416 植物乳植杆菌L7 植物乳植杆菌L7+巴氏醋杆菌2416草酸酒石酸丙酮酸苹果酸乳酸乙酸柠檬酸琥珀酸总量0.010 8±0.000 6d 0.530 6±0.000 5d 0.059 4±0.000 6d 0.438 1±0.000 9b 1.030 8±0.000 7d 1.781 7±0.000 3d 0.015 8±0.000 7d 0.162 2±0.000 5d 4.029 4±0.001 1d 0.017 6±0.000 5b 0.664 9±0.000 5b 0.190 5±0.000 6b 0.427 2±0.000 6c 1.067 3±0.000 5c 2.067 1±0.000 8b 0.021 5±0.000 5b 0.182 9±0.000 4b 4.639 0±0.003 0c 0.013 0±0.000 5c 0.567 3±0.000 2c 0.127 4±0.001 0c 0.423 3±0.000 6d 1.493 2±0.000 6b 1.895 2±0.000 7c 0.018 8±0.000 4c 0.170 7±0.000 4c 4.708 9±0.002 9b 0.023 3±0.000 5a 0.684 4±0.000 3a 0.253 2±0.000 5a 0.454 2±0.000 5a 1.589 3±0.000 5a 2.126 4±0.000 3a 0.025 7±0.000 7a 0.255 4±0.000 5a 5.411 9±0.002 8a
由表1可知,在淋醋后,除苹果酸外,强化组的有机酸总量及各有机酸含量均显著高于对照组(P<0.05),且复合菌剂强化组最高,有机酸总量达5.41 g/100 mL,较对照组提高34.31%。有研究表明[29-30],巴氏醋杆菌通过氧化途径主导乙酸合成,其关键酶乙醛脱氢酶(EC:1.2.1.3)、乙酸辅酶A转移酶(EC:2.8.3.18)和乙酰辅酶A合成酶(EC:6.2.1.1)驱动乙醇向乙酸的转化;而植物乳植杆菌则通过无氧发酵生成乳酸,并催化乙酰磷酸及L-乳酸向乙酸的二次转化,形成代谢互补。此外,乳杆菌代谢丙酮酸和乳醛生成的乳酸进一步参与乙醛酸循环,与醋酸菌协同通过丙酮酸-富马酸途径和三羧酸循环逆向还原,进而促进苹果酸和琥珀酸的积累,其中乳杆菌在琥珀酸代谢中的核心地位尤为突出。综上,山西老陈醋中有机酸的生成本质上是醋酸菌与乳酸菌代谢网络互作的结果,这种菌群互作不仅提升有机酸总量,更通过乙酸-乳酸动态平衡优化酸味层次,赋予山西老陈醋特有的醇厚风味。
2.3.2 强化菌剂对新淋醋挥发性风味成分的影响
强化菌剂对新淋醋挥发性风味成分的影响见图4。由图4A可知,从种类上看,从新淋醋样品中共检测出40种挥发性风味化合物,包括酯类14种、醇类7种、酸类7种、醛类5种、酮类3种、吡嗪类2种和其他类2种,对照组、乳酸菌剂、醋酸菌剂和复合菌剂强化组分别检测出32种、33种、34种、40种挥发性风味成分,表明微生物强化可增加挥发性风味物质种类。由图4B可知,从含量上看,乳酸菌剂、醋酸菌剂及复合菌剂强化组成醅挥发性风味成分总含量分别为8.12 mg/100 mL、8.48 mg/100 mL、9.09 mg/100 mL,较对照组分别增加了15.44%、20.60%和29.27%。综上所述,复合菌剂强化组新淋醋的挥发性风味物质种类及总含量均高于单一菌剂强化组和对照组(P<0.05)。
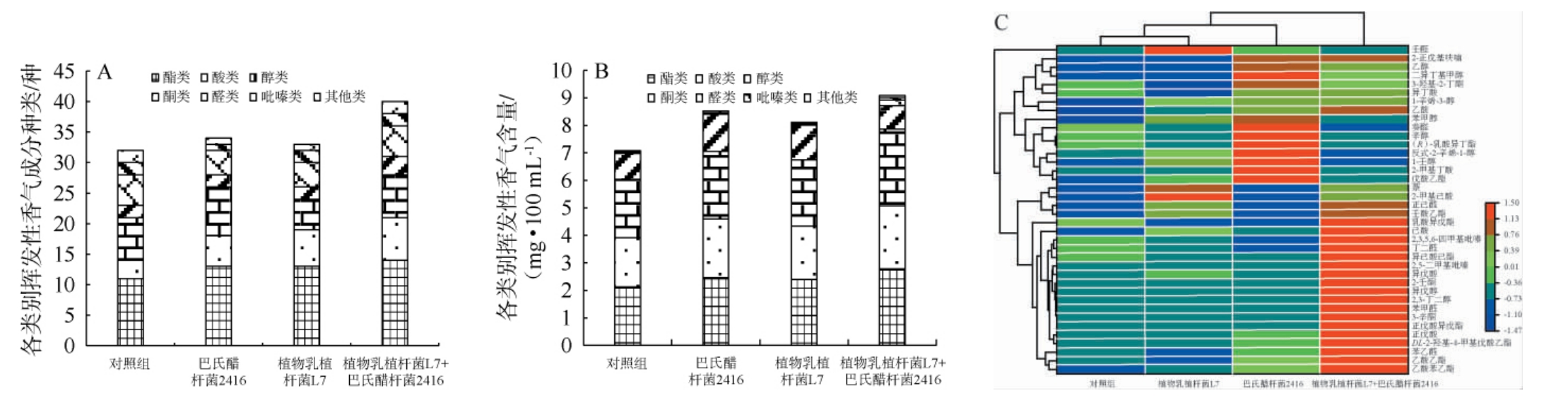
图4 强化菌剂对新淋醋挥发性风味物质的影响
Fig.4 Effect of enhancing bacterial agent on volatile flavor compounds in new leaching vinegar
由图4C可知,复合菌剂组较对照组明显提高了乙酸乙酯、乙酸苯乙酯、苯乙醛、DL-2羟基-4甲基戊酸乙酯、正戊酸、正戊酸异戊酯、3-辛酮、苯甲醛、2,3-丁二醇、异戊醇、2-壬酮、异戊酸、2,5-二甲基吡嗪、异己酸己酯、丁二醛、2,3,5,6-四甲基吡嗪、己酸、乳酸异戊酯及乙酸等挥发性风味物质的含量,其中典型的挥发性风味物质乙酸乙酯、乙酸苯乙酯、2,5-二甲基吡嗪、3-羟基-2-丁酮及乙酸赋予了新淋醋果香、蜜香、巧克力香、奶油香及典型酸香等多层次风味特征[31]。分析原因可能是植物乳植杆菌L7和巴氏醋杆菌2416在代谢过程中产生的协同效应所致,乳酸菌通过底物转化促进醋酸菌活性,而醋酸菌代谢产生的酸性环境则有利于酯类合成。该发现与CHAI L J等[32]的研究相印证,其采用醋醅来源的L.plantarum M1-6和A.pasteurianus G3-2进行原位生物强化时,同样观察到乙酸乙酯、乳酸乙酯等特征风味物质的显著增加。有研究表明[33],巴氏醋杆菌与植物乳植杆菌共培养可协同促进山西老陈醋特征风味物质的生成,在共培养体系中,苯甲醇、乙酸乙酯、乙酸苯乙酯和2,5-二甲基吡嗪含量较纯培养体系分别提升42.16%、64.23%、56.89%和31.26%,与本研究结果一致。在醋酸发酵阶段引入醋酸菌-乳酸菌复合强化体系,可通过菌群代谢互作显著优化新淋醋的挥发性香气成分,为提升山西老陈醋风味品质提供了科学的调控策略。
3 结论
本研究通过向山西老陈醋醋酸发酵阶段引入植物乳植杆菌L7、巴氏醋杆菌2416及其复合菌剂,系统探讨了强化菌剂对山西老陈醋酿造过程中微生物菌群、理化指标及风味物质的影响。结果表明,巴氏醋杆菌2416与植物乳植杆菌L7复合菌剂的强化可显著调控发酵体系中微生物菌群的动态演替,促进乳酸菌和醋酸菌的协同生长,加速底物代谢进程,从而缩短醋酸发酵周期。菌剂添加不仅提升了新淋醋中总酸、不挥发性酸、氨基酸态氮及总酯的含量,同时丰富了有机酸与挥发性风味物质,其中以乙酸乙酯、乙酸苯乙酯等为代表的特征风味物质含量增幅明显,赋予食醋更突出的果香、蜜香。综上所述,添加菌剂在缩短酿造周期的同时,可提高相关成分产量进而改善风味。本研究结果为传统酿造工艺优化提供了新思路,未来需结合多组学技术进一步解析菌群互作机制及其代谢调控网络,以推动微生物精准调控技术在食醋生产中的应用。
[1]LU Z M, WANG Z M, ZHANG X J, et al.Microbial ecology of cereal vinegar fermentation:insights for driving the ecosystem function[J].Curr Opin Biotechnol,2018,49:88-93.
[2]邢晓莹,孟卫凯,张慧妍,等.基于高通量测序分析山西老陈醋醋酸发酵过程中细菌群落的演替规律[J].食品工业科技,2024,45(17):147-154.
[3]孙晓琪,朱丹,张慧如,等.不同地区山西老陈醋酿造过程中细菌菌群多样性分析[J].中国酿造,2023,42(6):116-121.
[4]王超敏.山西老陈醋传统发酵工艺过程中菌群变化及优良菌株间的互作研究[D].晋中:山西农业大学,2021.
[5]刘静.食醋发酵条件下乳酸菌对醋酸菌生长代谢的影响[D].天津:天津科技大学,2020.
[6]杨昀松,姜明超,韩冬,等.醋酸菌在食醋发酵中产乙酸的影响因素研究进展[J].食品科学,2025,46(9):351-363.
[7]张天震.山西老陈醋微生物酿造机理及四大名醋指纹图谱差异性研究[D].晋中:山西农业大学,2019.
[8]乔羽.山西老陈醋发酵阶段芽孢杆菌的筛选及复合麸曲制作和应用研究[D].晋中:山西农业大学,2018.
[9]余永建.镇江香醋有机酸组成及乳酸合成的生物强化[D].无锡:江南大学,2014.
[10]符传学.传统食醋促发酵乳酸菌菌剂的制备和应用[D].天津:天津科技大学,2017.
[11]王超宇.山西老陈醋源优良醋酸菌的分离筛选及在山楂苦荞醋中的应用[D].晋中:山西农业大学,2019.
[12]李雅茹.山西老陈醋源优良酵母菌和乳酸菌的筛选、互作及应用研究[D].晋中:山西农业大学,2019.
[13]付蝶.山西老陈醋源巴氏醋杆菌2416发酵产酸优化及菌剂制备研究[D].晋中:山西农业大学,2022.
[14]郭宏萍.优良菌株组合发酵对食醋大曲和酿造过程中的代谢调控[D].晋中:山西农业大学,2021.
[15]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 19777—2013 地理标志产品山西老陈醋[S].北京:中国标准出版社,2013.
[16]中华人民共和国卫生部,中国国家标准化管理委员会.GB/T 5009.39—2003 酱油卫生标准的分析方法[S].北京:中国标准出版社,2003.
[17]陈旭峰,朱丹,郭宏萍,等.山西老陈醋酿造过程中理化指标动态变化及新淋醋品质分析[J].中国酿造,2021,40(12):52-57.
[18]孙晓琪,王宏霞,张慧如,等.山西老陈醋陈酿过程中挥发性香气物质和功能物质的变化规律[J].中国酿造,2023,42(3):34-40.
[19]胡航伟,刘凌霄,张文萌,等.谷物醋酿造过程中微生物多样性及挥发性风味物质变化研究进展[J].中国调味品,2023,48(7):42-48.
[20]刘稼鑫,叶晓婷,余永建,等.传统食醋发酵区系中微生物群落及相互作用关系研究进展[J].食品科学,2023,44(17):225-234.
[21]程荷芳.传统食醋酿造中微生物的研究进展[J].食品工业,2022,43(8):245-248.
[22]刘静.食醋发酵条件下乳酸菌对醋酸菌生长代谢的影响[D].天津:天津科技大学,2020.
[23]赵天行.产苯乳酸乳酸菌的生物学特性分析及其在食醋生产中的应用[D].武汉:华中农业大学,2022.
[24]李婷婷,周丽,任兴权,等.食醋中有机酸组成及其检测技术研究进展[J].食品安全质量检测学报,2024,15(24):86-95.
[25]邢晓莹,李美艳,孟卫凯,等.山西老陈醋酿造过程中理化指标及微生物群落的变化[J].中国酿造,2024,43(10):74-81.
[26]CHAI L J,SHEN M N,SUN J,et al.Deciphering the D-/L-lactate-producing microbiota and manipulating their accumulation during solidstate fermentation of cereal vinegar[J].Food Microbiol,2020,92:103559.
[27]XIE S K,ZHAO C M,FAN B Q,et al.Metabolic network of ammonium in cereal vinegar solid-state fermentation and its response to acid stress[J].Food Microbiol,2021,95:103684.
[28]王宏霞,闫裕峰,郎繁繁,等.山西老陈醋不同熏醅工艺对风味物质的影响[J].中国酿造,2021,40(7):38-42.
[29]吴艳芳.山西老陈醋发酵过程微生物相互作用及有机酸代谢调控机制解析[D].天津:天津科技大学,2021.
[30]孙红,柴丽娟,陆震鸣,等.镇江香醋核心酿造微生物醋酸杆菌和乳酸杆菌共培养对生长代谢的影响[J].微生物学报,2021,61(7):2065-2076.
[31]万苏艳,聂雯,李朝春,等.4种市售食醋的理化指标及风味品质分析[J].中国酿造,2025,44(3):186-194.
[32]CHAI L J,QIU T,LU Z M,et al.Modulating microbiota metabolism via bioaugmentation with Lactobacillus casei and Acetobacter pasteurianus to enhance acetoin accumulation during cereal vinegar fermentation[J].Food Res Int,2020,138:109737.
[33]石媛媛,胡萍,张珺,等.乳酸菌强化发酵对刺梨果醋风味品质的影响[J].食品与发酵科技,2022,58(2):22-30.