氨基甲酸乙酯(ethylcarbamate,EC)又称脲烷(urethane),是一种对人类有潜在致癌风险的有机化合物,其2007年被国际癌症研究机构归为2A类致癌物[1-3]。酒精饮料(白酒、黄酒)、乳制品(奶酪、酸奶)和调味品(食醋、酱油)等发酵食品中普遍含有EC[4-5],使发酵食品存在安全隐患。研究表明,酒精可促进EC的致癌作用[6-8],摄入酒精度高的饮料会显著增加人们罹患癌症的风险。白酒是一种深受消费者喜爱的酒精饮料,其同时含有EC和高浓度酒精,对消费者的健康构成潜在危害。为切实保障消费者健康同时促进白酒行业可持续健康发展,降低白酒中EC含量越来越受到研究者们关注。
众多国内外研究者致力于解析酒精饮料中EC的形成机制,旨在探索降低或消除其含量的方法。先前研究发现,酒精饮料中的EC主要是氨甲酰化合物和乙醇的自发反应形成[9-10],其中白酒中EC主要是尿素[11]、瓜氨酸[12]和氰化物[11]这三种EC前体物质与乙醇反应生成。酒精饮料酿造过程中,EC前体物质主要来源于两方面:一是酿酒原料(如高粱、小麦)自身带入[13-14];二是微生物(如酵母菌、乳酸菌)代谢产生[15]。因此,酿酒原料预处理[11,16]以及微生物菌株代谢工程改造[17-18]以降低EC前体物质含量,是当前阻止EC形成的研究热点。然而,这两种方法只能一定程度地降低酒精饮料中EC含量,并不能消除已经形成的EC,并且可能造成酒精饮料风味改变[19]。相比这两种降低EC策略,EC水解酶可直接分解已形成EC,将其分解为CO2、乙醇和氨[20],可能达到完全消除酒精饮料中EC的目的。然而,目前获得的EC水解酶在酸性环境下酶活力显著降低[21-23],限制了其在白酒产品及白酒发酵后期酸性环境中的应用。此外,在白酒产品或发酵体系中直接外源添加EC水解酶,存在引入其他物质、改变酒体原有风味的潜在风险。针对EC水解酶现存问题,研究热点集中于从酿酒发酵体系中筛选具备EC水解酶生产能力的土著微生物,并围绕菌株产酶工艺优化、酶分子的异源表达及分子改造等方向开展系统研究,以期提升EC水解酶的产量及其在酸性条件下的催化效率。目前,已从酿酒体系内成功分离得到多种产EC水解酶的土著微生物,细菌包括解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、腐 生 葡 萄 球 菌(Staphylococcus saprophyticus)等[24-25]、酵母菌包括假丝酵母(Candida ethanolica)、大仁红酵母(Rhodotorula dairenensis)等[20]。刘晓慧[25]通过异源表达技术并结合融合双亲短肽策略,显著提升了EC水解酶在酸性环境下的催化效率,使其比酶活提高了93%。王伟高等[26]采用培养基成分及培养条件单因素优化策略,将赖氨酸芽孢杆菌EC水解酶活力提高了350%。喜琴琴[27]通过响应面法对产EC水解酶酿酒酵母菌株进行发酵条件优化,使其酶活提高了1.17倍。康婷婷[28]同样基于异源表达体系,运用定点饱和突变技术对EC水解酶进行改造,成功将酶活性提升至原酶活的5.18倍。
为解决EC水解酶的酸性环境不耐受及其外源添加对白酒风味潜在影响的问题,本研究采用EC为唯一氮源培养基结合溴甲酚紫显色法,筛选具有EC降解能力的菌株。结合菌落与细胞形态特征和ITS基因序列分析,对目的菌株进行种属鉴定。对目的菌株进行耐酸性驯化,研究耐酸性驯化对菌株的生长情况、产EC水解酶情况以及其所产EC水解酶的酶学性质的影响,旨在从酱香型白酒酒醅中的土著微生物中筛选具有EC降解能力的微生物菌株,并通过定向驯化提升其耐酸性。以期将其应用于白酒酿造过程,降低EC含量,提升白酒产品的食用安全性。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酱香型白酒酒醅样品:贵州省仁怀市茅台镇某白酒厂。
1.1.2 试剂
蛋白胨、牛肉膏(均为生化试剂):北京奥博星生物技术有限责任公司;琼脂粉(生化试剂):北京索莱宝科技有限公司;葡萄糖(分析纯):南京化学试剂股份有限公司;氯化钠、溴甲酚紫指示剂、亚硝基铁氰化钠二水合物、磷酸二氢钾、三氯乙酸、柠檬酸(均为分析纯):上海阿拉丁生化科技股份有限公司;次氯酸钠溶液、磷酸氢二钠、苯酚、氨基甲酸乙酯、乙酸钠三水合物(均为分析纯):上海麦克林生化科技股份有限公司;氢氧化钠(分析纯):天津市科密欧化学试剂有限公司;蜗牛酶(酶活≥100 U/mg):上海源叶生物科技有限公司。
1.1.3 培养基
富集培养基[28]:牛肉膏1 g/100 mL,蛋白胨1 g/100 mL,NaCl 1.5 g/100 mL,EC 0.5 g/100 mL。
EC驯化液体培养基:EC 0.2~1.2 g/100 mL,葡萄糖(C6H12O6)0.2 g/100 mL,磷酸二氢钾(KH2PO4)0.2 g/100 mL,醋酸钠(CH3COONa)0.2 g/100 mL,氯化钠0.5 g/100 mL。
氮源筛选液体培养基:EC 0.6 g/100 mL,1%溴甲酚紫50 μL/100 mL,其余成分与EC驯化液体培养基相同。
复筛液体培养基:EC 0.6 g/100 mL,其余成分与EC驯化液体培养基相同;复筛固体培养基:复筛液体培养基中添加琼脂粉5 g/100 mL。
以上培养基均在121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
PWN224ZH电子分析天平:奥豪斯仪器(上海)有限公司;CLG-40L高压灭菌锅:日本ALP公司;SHP-250生化培养箱:贵州润峰泉科技有限公司;TGL16M高速冷冻离心机:盐城市凯特实验仪器有限公司;HH-4A 4孔单独控温水浴锅:国华(常州)仪器制造有限公司;Epoch全波长酶标仪:美国Biotek公司。
1.3 方法
1.3.1 产EC水解酶菌株的筛选
通过微生物富集培养、高浓度EC耐受性驯化、96孔深孔板高通量初筛及摇瓶培养复筛等实验方法,从酱香型白酒酒醅中筛选具有高效降解EC能力的菌株,具体筛选流程见图1。
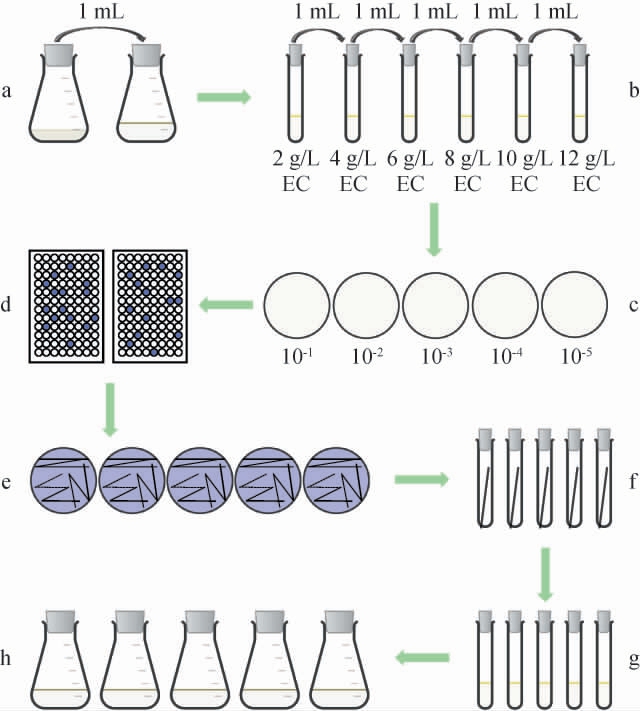
图1 产氨基甲酸乙酯水解酶菌株筛选流程
Fig.1 Screening process for ethyl carbamate hydrolase-producing strain
a:微生物富集培养;b:高浓度EC耐受性驯化;c:稀释涂布分离单菌落;d:96孔深孔板初筛;e:平板划线纯化;f:菌株斜面培养;g+h:菌株摇瓶复筛。
微生物富集培养:称取5 g酱香型白酒酒醅样品置于装液量为20 mL/250 mL 0.9%生理盐水中,将其于30 ℃、200 r/min条件下振荡培养30 min;取1 mL菌悬液于装液量为50 mL/250 mL富集培养基中,相同条件培养1 d。
产EC水解酶菌株的高浓度EC耐受性驯化:采用阶梯式递增EC浓度驯化法,即以2 g/L EC驯化液体培养基为第一级驯化培养基,按4→6→8→10→12 g/L EC逐步提高浓度对菌株进行培养。具体操作:取1 mL富集培养菌悬液置于装液量为10 mL/250 mL EC质量浓度为2 g/L EC驯化液体培养基中,于30 ℃、200 r/min 条件下振荡培养2 d,重复以上操作,最后将在12 g/L EC驯化液体培养基中培养2 d的菌株进行稀释涂布,于30 ℃静置培养4 d。
96孔深孔板初筛:挑取单菌落于装有2 mL氮源筛选液体培养基的96深孔板中,30 ℃、200 r/min条件下振荡培养2 d,选取菌株培养液转变为紫色的菌株进行摇瓶复筛。
摇瓶复筛:将初筛菌株进行平板划线纯化,于30 ℃静置培养4 d;接种环挑取单菌落接种于复筛固体培养基中进行斜面培养;挑取斜面培养物接入装液量为10 mL/250 mL复筛液体培养基中,30 ℃、200 r/min相同条件下振荡培养1 d;以2%(V/V)的接种量接种于装液量为50 mL/250 mL复筛液体培养基中,相同条件培养2 d。培养结束后立即取样,分别测定菌株胞内外的EC水解酶酶活力,确定EC水解酶是胞内酶还是胞外酶。采用上述同样的培养方式,将前5株酶活力高的菌株进行培养。培养3 h起,每隔3 h取样一次,测定其菌株生物量(OD600 nm值)以及EC水解酶酶活力,选择酶活最高的菌株作为目的菌株。
1.3.2 EC水解酶酶活力的测定
粗酶液的制备:取1 mL菌悬液于离心管中,在4 ℃、9 500 r/min条件下离心10 min,收集上清液,即为胞外粗酶液;收集菌体沉淀,向其加入1 mL磷酸氢二钠-柠檬酸缓冲液重悬菌体3次(每次均于相同条件下离心收集菌体),然后用1 mL磷酸氢二钠-柠檬酸缓冲液重悬菌体后,加入1%的蜗牛酶,在30 ℃条件下作用30 min,相同条件离心,收集上清液,即为胞内粗酶液。
酶活力的测定:采用Berthelot reaction比色法测定EC水解酶酶活力,参照杨攀平等[3]报道的方法并略作修改。取100 μL酶液与100 μL 1%EC溶液混合,37 ℃反应15 min;加入100 μL 10%的三氯乙酸终止液,混匀后各加入100 μL显色剂Ⅰ和Ⅱ,振荡混匀后37 ℃保温20 min,在波长625 nm处测定OD625nm值。
1.3.3 高产EC水解酶菌株的鉴定
形态学观察:将目的菌株划线于复筛固体培养基上,30 ℃条件下倒置培养,观察其菌落形态;将单菌落用超纯水稀释后,采用美蓝染液染色后在显微镜下观察其细胞形态。
分子生物学鉴定:将菌悬液送至生工生物工程(上海)股份有限公司,委托其进行ITS基因序列测序,将测序结果与美国国家生物技术信息中心(national center for biotechnology information,NCBI)数据库中模式菌株的ITS基因序列采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,获取高相似度及高同源性的序列。采用MEGA 7.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树[29],确定目的菌株种属。
1.3.4 高产EC水解酶菌株的耐酸性驯化
pH 驯化范围确定:将目的菌株接种于装液量为20 mL/250 mL复筛液体培养基中,于30 ℃、200 r/min 条件下振荡培养1 d;取上述菌悬液,以2%(V/V)的接种量分别转接至初始pH为6、5、4和3的装液量为50 mL/250 mL复筛液体培养基中,相同条件(30 ℃、200 r/min)下进行振荡培养。从接种后3 h起,每隔3 h取样一次,测定菌株生物量(OD600 nm值)以及EC水解酶酶活力,以确定目的菌株的pH驯化范围。
耐酸性驯化:采用梯度降低复筛液体培养基初始pH的方法进行菌株的耐酸性驯化[30]。具体步骤为:将目的菌株接种于pH驯化范围上限pH的装液量为50 mL/250 mL复筛液体培养基中,于30 ℃、200 r/min 条件下振荡培养1 d;取上述菌悬液,以2%(V/V)的接种量转接于较上限pH低0.5个单位的装液量为50 mL/250 mL复筛液体培养基中,相同培养条件下培养1 d;重复此培养过程,直至复筛液体培养基初始pH达到pH驯化范围的下限pH值。在此下限pH值条件下培养,从接种后3 h起,每隔3 h取样,测定菌株生物量(OD600nm值)以及EC水解酶酶活力。
1.3.5 EC水解酶的酶学性质研究
酶最适作用温度确定:将驯化后与未驯化菌株的EC水解酶粗酶液与EC底物混合,分别在30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃下进行反应,按照1.3.4节方法测定各温度下的酶活性。相对酶活的计算公式如下:
酶最适作用pH确定:于上述确定的最适作用温度下,调整反应体系pH值分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0,按照1.3.4节方法测定不同pH下的酶活性。相对酶活的计算公式如下:
1.3.6 数据处理与分析
数据结果均为3次实验数据的平均值。采用Origin 8.5软件将数据结果进行可视化呈现。
2 结果与分析
2.1 产EC水解酶菌株的筛选
2.1.1 96孔深孔板初筛
EC水解酶降解EC可产生氨,氨可以作为微生物生长繁殖所需的氮源[31],基于此,本研究采用EC为唯一氮源的筛选培养基,在此培养基中能存活的菌株,即为产EC水解酶菌株。同时,EC水解酶水解EC的产物氨会引起培养基pH升高,使溴甲酚紫由黄色变为紫色[8],因此,在筛选培养基中添加溴甲酚紫作为指示剂,通过培养基颜色变化直观呈现初筛结果见图2。
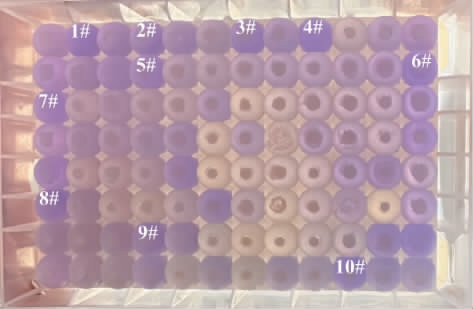
图2 菌株初筛显色结果
Fig.2 Color development results of the initial screened strains
白色文字代表选择的进入复筛的菌株编号。
由图2可知,初筛中部分菌株培养基颜色由黄色转变为紫色,初步确定这些菌株能够合成EC水解酶。选取显色快且紫色深的10株菌株(编号为1#~10#)进行下一步复筛试验。
2.1.2 摇瓶复筛
为了进一步确定初筛菌株的产EC水解酶能力,并明确其胞内、胞外的定位,将上述10株菌株进行摇瓶培养,测定菌株胞内、胞外EC水解酶酶活力,测定结果见图3。
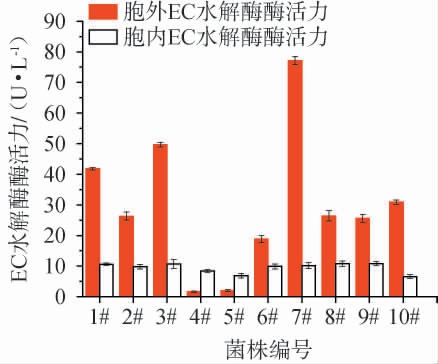
图3 菌株1#~10#培养2 d胞内外酶活性测定结果
Fig.3 Determination results of intracellular and extracellular enzyme activities of strains 1#-10# after culture for 2 d
由图3可知,菌株4#和5#的的胞外酶活力低于胞内酶活力外,其余菌株(1#~3#、6#~10#)的胞外酶活力均显著高于其胞内酶活力。这一现象表明,菌株1#~3#、6#~10#合成的EC水解酶为胞外酶,其胞内检测到的酶活力主要来源于新合成但没来得及分泌至胞外的酶。菌株1#~3#、6#~10#的胞外酶活力不仅远高于自身胞内酶活力,也高于菌株4#和5#的胞内、外酶活力。产胞外EC水解酶菌株酶活力由高至低排序为:菌株7#>3#>1#>10#>8#>2#>9#>6#。
不同菌株在相同的培养条件下生长,其代谢产酶趋势存在差异,各菌株达到酶活峰值的培养时间也可能会不同[32]。菌株1#~3#及6#~10#酶活测定时间均选择为48 h,此8株菌株胞外酶活力高低差异可能受此相同取样时间的影响。为消除取样时间对菌株间产酶差异的干扰,本研究将酶活高的前5株菌株(1#、3#、7#、8#、10#)生长曲线及产酶曲线进行了对比分析,结果见图4。
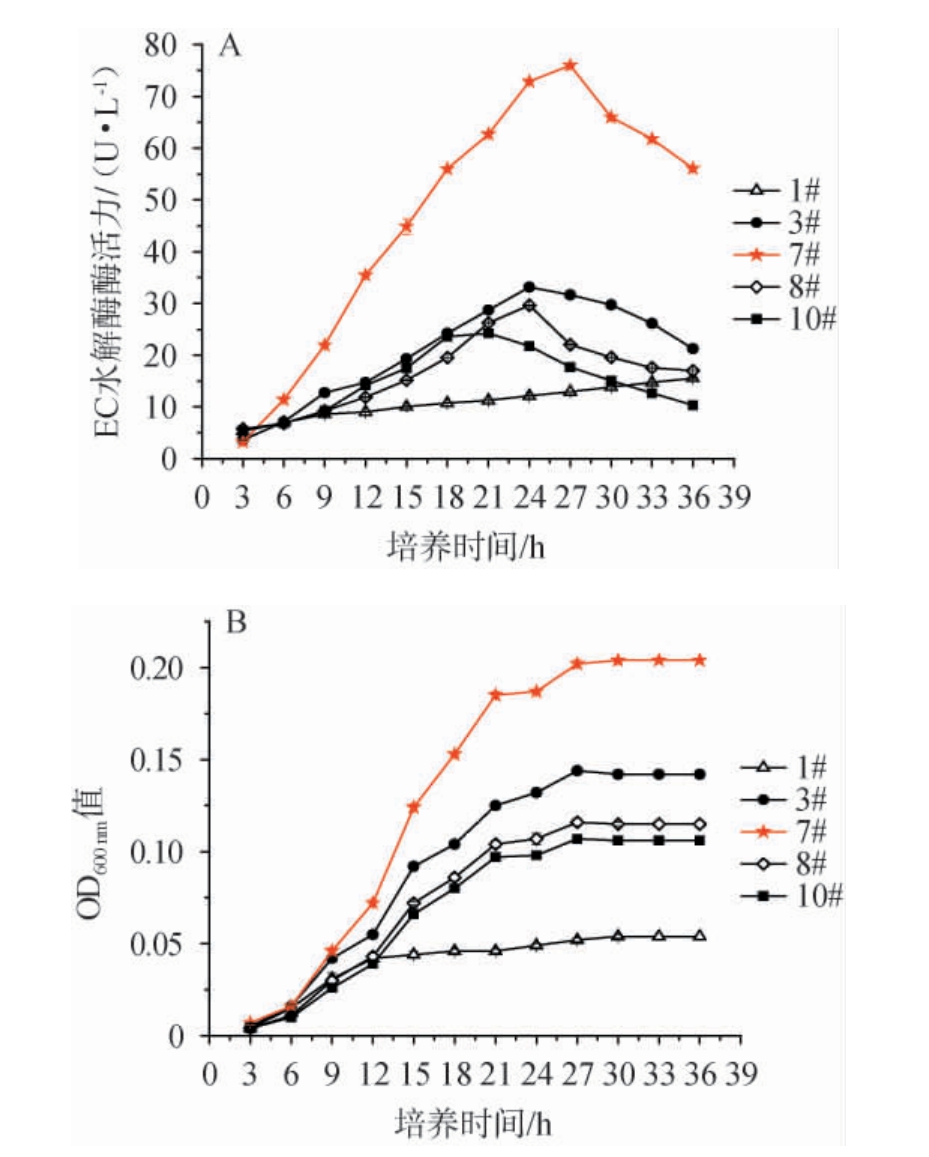
图4 菌株1#、3#、7#、8#、10#的氨基甲酸乙酯水解酶酶活力(A)和生物量(B)变化
Fig.4 Changes of ethyl carbamate hydrolase activities (A) and biomass (B) of strains 1#, 3#, 7#, 8# and 10#
由图4A可知,随着培养时间在3~36 h范围内的延长,菌株3#、7#、8#、10#EC水解酶活力呈现先增加后降低的趋势。菌株1#EC水解酶活力呈现一直增加的趋势,但未达到酶活峰值,且酶活力一直很低。菌株7#在培养时间27 h达到EC水解酶活力最大(76.0 U/L),菌株3#、8#、10#分别在培养时间24 h、24 h、18 h时达到EC水解酶活力最大,分别是33.2 U/L、29.6 U/L、23.6 U/L;菌株7#最高EC水解酶活力是菌株3#、8#、10#的2.3倍、2.6倍、3.2倍。在培养时间6~36 h时,菌株7#EC水解酶活力均远高于其余4株菌株。由图4B可知,5株菌株均呈现迟缓期、对数期、稳定期、衰亡期生长变化规律,均在27 h进入生长稳定期,此时菌株7#的OD600 nm值分别是菌株1#、3#、8#、10#的3.9倍、1.4倍、1.7倍、1.9倍。在9~36时,菌株7#的生物量均高于其余4株菌株。因此,选择生长性能和产酶能力均优的菌株7#作为目的菌株,并将其命名为ECH-7。
2.2 菌株ECH-7的种属鉴定
2.2.1 形态学观察
对菌株ECH-7进行平板划线培养,观察其菌落形态及显微镜下细胞形态,结果见图5。由图5A可知,菌株ECH-7的单菌落呈白色圆形、表面质地光滑、边缘整齐;由图5B可知,镜检结果显示菌株ECH-7为椭圆形的单细胞状态。
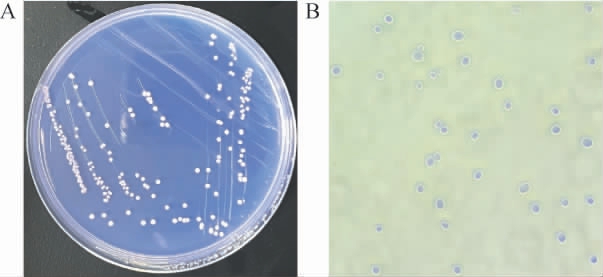
图5 菌株ECH-7的菌落形态(A)和细胞形态(B)
Fig.5 Colony morphology(A)and cell morphology(B)of strain ECH-7
2.2.2 分子生物学鉴定
基于ITS序列菌株ECH-7系统发育树见图6。
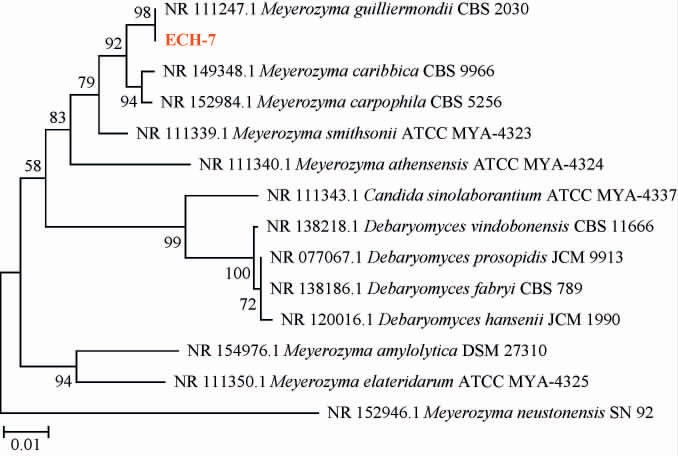
图6 基于ITS基因序列菌株ECH-7的系统发育树
Fig.6 Phylogenetic tree of strain ECH-7 based on ITS gene sequences
由图6可知,菌株ECH-7与季也蒙迈耶氏酵母(Meyerozyma guilliermondii)处在同一系统发育枝上,与季也蒙迈耶氏酵母NR 111247.1序列同源性最高,为100%,亲缘关系最近,结合菌株ECH-7的菌落形态及细胞形态特征,菌株ECH-7被鉴定为季也蒙迈耶氏酵母(Meyerozyma guilliermondii)。
2.3 季也蒙迈耶氏酵母ECH-7的耐酸性驯化
2.3.1 菌株ECH-7在不同pH培养条件下的生长情况和产酶情况
pH对菌株的生长以及产EC水解酶活性有较大影响[26]。考察不同pH对菌株ECH-7的生长及产EC水解酶活力的影响,结果见图7。
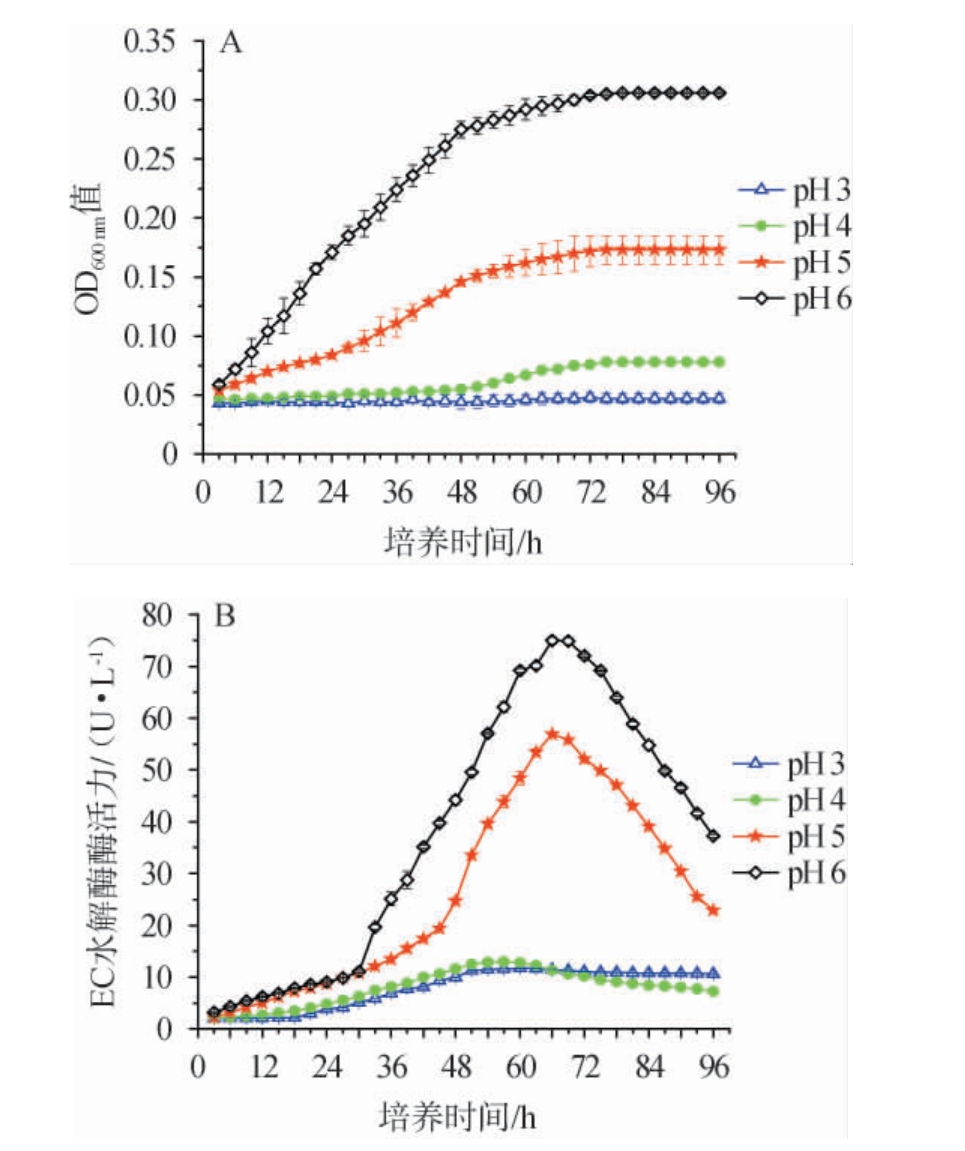
图7 不同pH条件下菌株ECH-7的生长曲线(A)及产酶曲线(B)
Fig.7 Growth curves (A) and enzyme production curves (B) of strain ECH-7 under different pH conditions
由图7A可知,在pH 5和6的培养条件下,菌株ECH-7呈现先快速生长、后缓慢生长直至稳定不变的典型微生物生长趋势;达到稳定期时,pH 5下培养的菌株ECH-7的生物量远低于pH 6下培养的生物量。与pH 5和6培养条件下菌株相比,pH 4下培养的菌株ECH-7生长困难,表现出延滞期较长(45 h),生物量涨幅很小的特征。在0~96 h的培养过程中,pH 3下培养的菌株ECH-7生物量几乎没有增长。这些现象表明,随着环境pH的不断降低,菌株ECH-7的生长繁殖能力越来越弱(pH 3<pH 4<pH 5<pH 6),特别是在酸性的环境(pH 3和4)中,菌株的生长繁殖能力受到严重地抑制。由图7B可知,在pH 3、4、5和6培养条件下,菌株产酶活力呈现先增加到达酶活峰值后下降的趋势。在pH 5和6培养条件下,菌株ECH-7的EC水解酶活力达到峰值的培养时间均为66 h,峰值酶活对比初始酶活(3 h)增加了54.7 U/L、71.8 U/L,菌株酶活产量高。在pH 3和pH 4培养条件下,菌株ECH-7的EC水解酶活性达到峰值的时间分别为60 h、57 h,对比初始酶活力(3 h)增加了9.7 U/L、10.9 U/L,菌株酶活产量低。显然,随着环境pH的不断降低,菌株ECH-7的产酶能力越来越弱(pH 3≈pH 4<pH 5<pH 6),特别是在酸性的环境(pH 3和4)中,菌株的产酶能力受到严重地抑制。结果表明,pH 5下菌株的生长和产酶能力低于pH 6,但显著强于pH 3和4。考虑到后续耐酸性驯化试验提高菌株产酶量的可行性,选择pH 6到5作为耐酸驯化范围。
2.3.2 菌株ECH-7的耐酸驯化结果
本研究采用梯度降低环境pH方法(pH下降梯度为pH 6.0→pH 5.5→pH 5.0)对菌株ECH-7进行耐酸性驯化(将驯化后菌株命名为ECH-7-驯),并对比菌株ECH-7和驯化后菌株ECH-7-驯的生长情况和产EC水解酶情况,结果见图8。
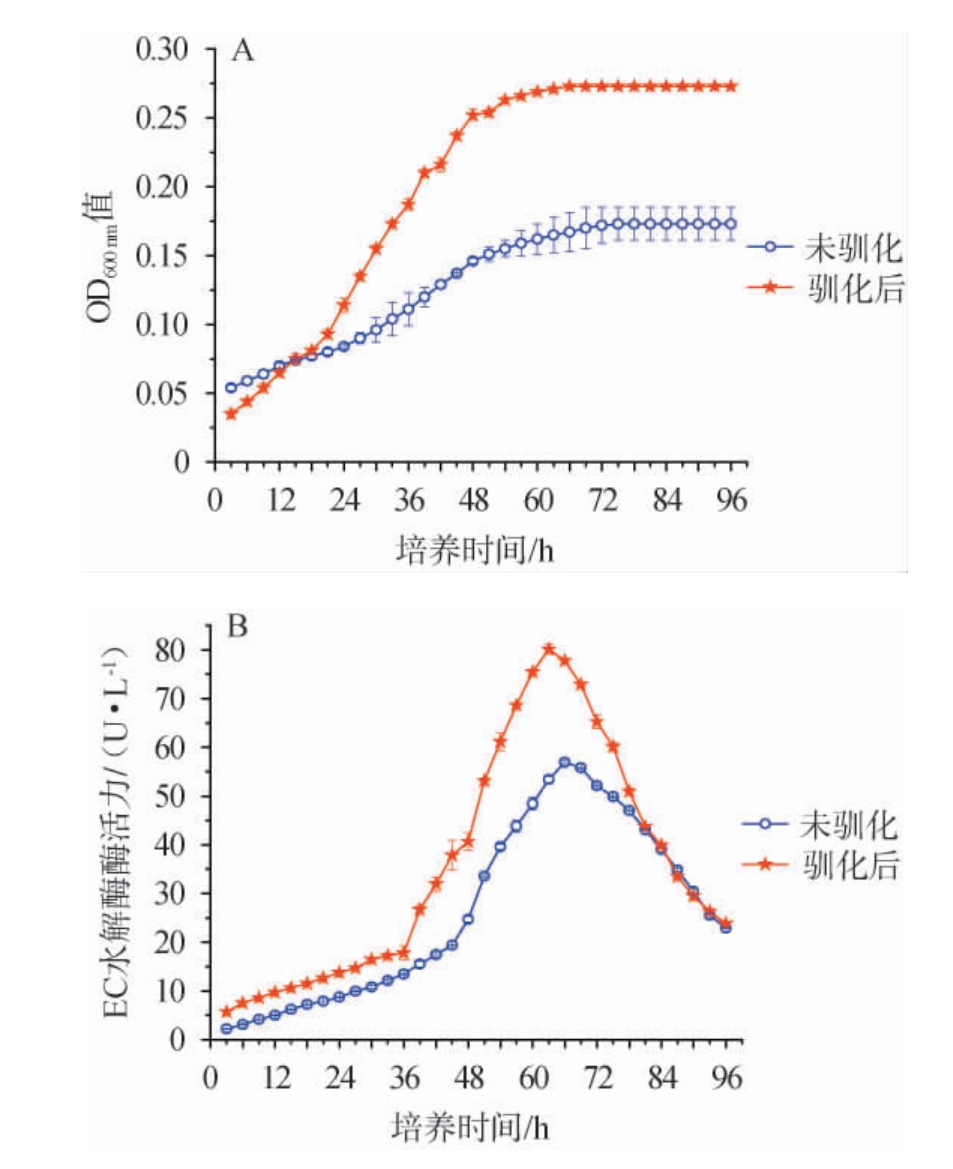
图8 菌株ECH-7和菌株ECH-7-驯的生长曲线(A)及产酶曲线(B)对比
Fig.8 Comparison of growth curves (A) and enzyme production curves(B) of strain ECH-7 and strain ECH-7-domestication
由图8A可知,菌株ECH-7-驯的生长性能显著提高。在pH 5培养条件下,培养时间15~96 h内,菌株ECH-7-驯生物量高于菌株ECH-7。相比菌株ECH-7,菌株ECH-7-驯进入稳定期时间(66 h)提前了9 h,菌株ECH-7-驯培养体系中生物量是菌株ECH-7的1.6倍。由图8B可知,菌株ECH-7-驯产酶能力显著提高。在培养时间3~81 h内,菌株ECH-7-驯酶活力高于菌株ECH-7。菌株ECH-7-驯产酶量达到峰值时间(63 h)比菌株ECH-7提前了3 h;菌株ECH-7和菌株ECH-7-驯的峰值酶活分别为56.9 U/L、80.2 U/L,菌株ECH-7-驯的峰值酶活比菌株ECH-7提高了40.9%。结果表明,缓和梯度降低环境pH的方法菌株ECH-7-驯,可以提升其在较酸环境中生长性能和产酶性能。相比菌株ECH-7,菌株ECH-7-驯能更好的适应白酒发酵过程的酸性环境并大量分泌EC水解酶到发酵环境中,直接降解发酵环境中EC,对于提升白酒的质量安全和保证消费者的健康具有重要意义。
2.4 EC水解酶粗酶液酶学性质分析
菌株ECH-7和菌株ECH-7-驯产氨基甲酸乙酯水解酶最适温度及最适pH值比较见图9。
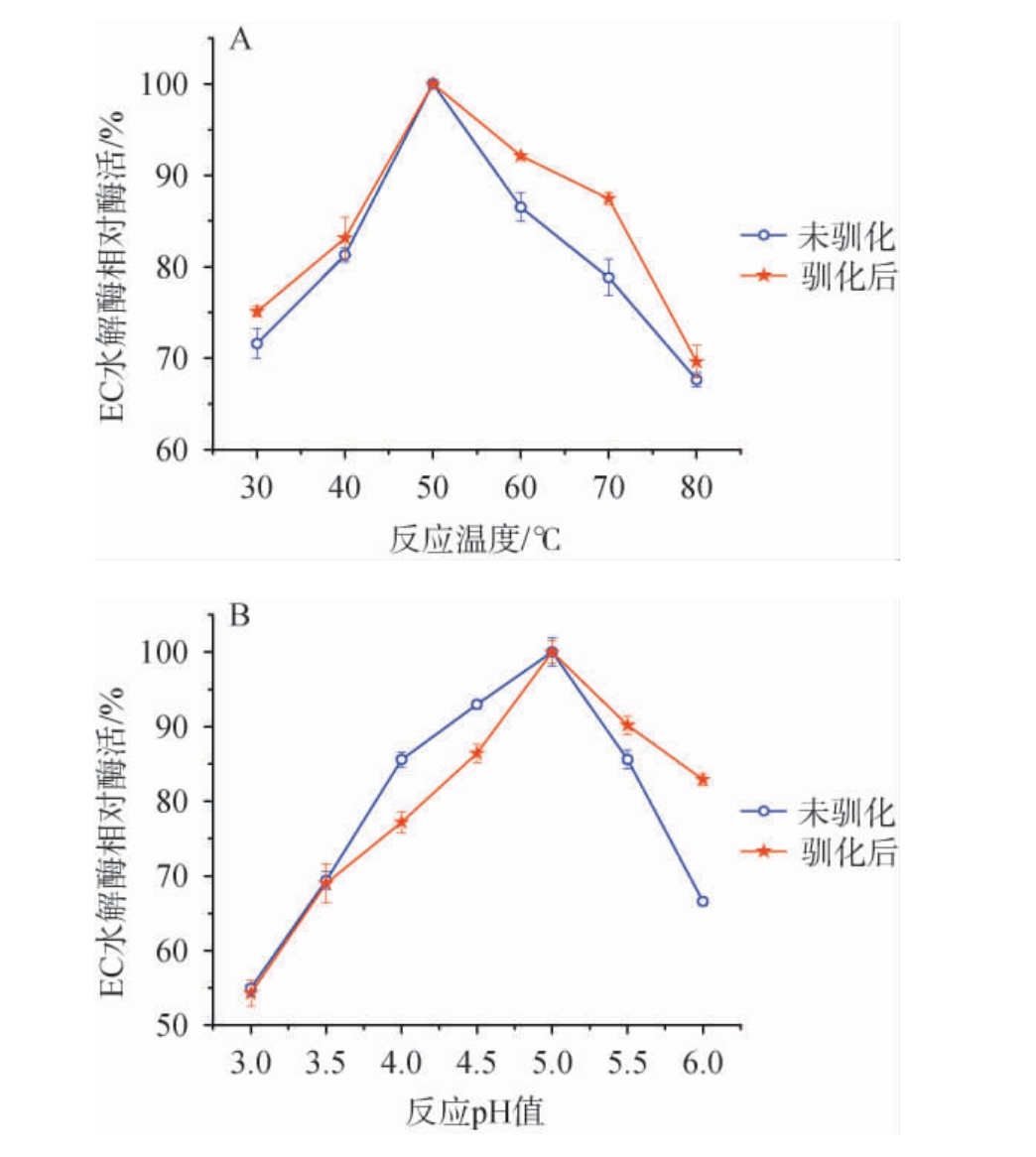
图9 菌株ECH-7和菌株ECH-7-驯产氨基甲酸乙酯水解酶最适温度(A)及最适pH值(B)
Fig.9 Optimal temperature (A) and optimal pH (B) of ethyl carbamate hydrolase produced by strain ECH-7 and strain ECH-7-domestication
由图9A可知,随着酶促反应温度从30 ℃升至80 ℃,菌株ECH-7和菌株ECH-7-驯的EC水解酶的相对酶活均呈现出先增加后下降的趋势,并在50 ℃反应条件下相对酶活达到最大值,由此确定菌株ECH-7和菌株ECH-7-驯所产EC水解酶的最适作用温度均为50℃。从总体来看,酶促反应温度为30~80℃,菌株ECH-7和ECH-7-驯的EC水解酶相对酶活性都较高,高于67.0%,菌株ECH-7-驯的EC水解酶相对酶活性高于菌株ECH-7的EC水解酶酶活。菌株ECH-7和菌株ECH-7-驯的EC水解酶的催化作用温度范围广泛,能更有效的持续在白酒酿造过程中发挥EC水解作用;菌株ECH-7-驯的EC水解酶酶活力进一步提高,显著加强了EC的水解效果。
由图9B可知,在pH值在3.0~5.0的反应条件下,菌株ECH-7和菌株ECH-7-驯的EC水解酶酶活力逐步上升,且均在pH 5时达到最大值;在pH 值在5~6的反应条件下,其EC水解酶酶活力逐步下降。因此,菌株ECH-7和菌株ECH-7-驯的EC水解酶最适作用pH值为5。菌株ECH-7和ECH-7-驯在pH 3~6的范围内,相对酶活都在50%以上,说明菌株产生的EC水解酶在酸性环境适应范围广泛,在白酒酿造过程的酸性环境中具有很大的应用潜力。
3 结论
本研究采用EC为唯一氮源的筛选培养基,从酱香型白酒酒醅中分离到一株高产EC水解酶的菌株ECH-7。结合形态学观察和分子生物学鉴定结果确定该菌株为季也蒙迈耶氏酵母(Meyerozyma guilliermondii)。菌株ECH-7经过耐酸性驯化后,菌株的生长和产EC水解酶性能均显著提升。相比未驯化菌株,驯化后菌株不仅提前9 h进入稳定期、生物量提高了1.6倍,而且提前3 h达到产酶峰值、峰值酶活提高了40.9%。未驯化和驯化后菌株所产EC水解酶酶学性质对比分析,发现两者所产EC水解酶的最适作用温度、pH值均分别为50 ℃、5。本研究为挖掘具有EC水解功能菌株,以及缓和驯化提高菌株酸性环境的生长和产酶性能奠定了一定的理论基础。本研究获得的耐酸、高产EC水解酶菌株以及对作用环境适应性宽的EC水解酶,在白酒行业及其他发酵产品行业具有很大的应用潜力。
[1]QIN Y, DUAN B B, SHIN J A, et al.Effect of fermentation on cyanide and ethyl carbamate contents in cassava flour and evaluation of their mass balance during lab-scale continuous distillation[J].Foods, 2021, 10(5):1089.
[2]JIAO Z H,DONG Y C,CHEN Q H.Ethyl carbamate in fermented beverages: presence, analytical chemistry, formation mechanism, and mitigation proposals[J].Compr Rev Food Sci Food Saf,2014,13(4):611-626.
[3]杨攀平,丁炎,仲梦园,等.氨基甲酸乙酯降解菌株的筛选鉴定与发酵产酶优化[J].中国调味品,2022,47(4):82-87.
[4]GUAN T W,TIAN X Q,WU J,et al.Investigation and risk assessment of ethyl carbamate in Chinese Baijiu[J].LWT-Food Sci Technol,2021,152:112340.
[5]尤小龙,程平言,胡峰,等.白酒中氨基甲酸乙酯形成机制,检测技术及控制研究进展[J].酿酒科技,2022(12):103-109.
[6]RIACHI L G,SANTOS Â,MOREIRA R F A,et al.A review of ethyl carbamate and polycyclic aromatic hydrocarbon contamination risk in cachaça and other Brazilian sugarcane spirits[J].Food Chem,2014,149:159-169.
[7]BELAND F A, BENSON R W, MELLICK P W, et al.Effect of ethanol on the tumoriginity of urethane (ethyl carbamate) in B6C3F1 mice[J].Food Chem Toxicol,2005,43(1):1-19.
[8]李超伟,侯晓艳,张宿义,等.白酒大曲中氨基甲酸乙酯降解菌株的筛选及共发酵培养条件的优化[J].食品科学,2025,46(5):151-160.
[9]TAVILLI E,ESTI M,FIDALEO M.Effective ethyl carbamate prevention in red wines by treatment with immobilized acid urease[J].Foods,2024,13(16):2476.
[10]ABT E,INCORVATI V,ROBIN L P,et al.Occurrence of ethyl carbamate in foods and beverages: review of the formation mechanisms, advances in analytical methods,and mitigation strategies[J].J Food Prot,2021,84(12):2195-2212.
[11]狄宇航.白酒发酵和蒸馏过程中氨基甲酸乙酯形成的机制解析和控制策略[D].无锡:江南大学,2023.
[12]郝丽刚,胡建祥,胡景辉,等.白酒中氨基甲酸乙酯研究进展概述[J].中国酿造,2024,43(9):14-20.
[13]尹子瑞,赵鑫锐,堵国成.酱香型白酒酿造过程中氨基甲酸乙酯前体来源解析[J].食品与发酵工业,2025,51(4):170-176.
[14]仇钰莹.浓香型白酒中氨基甲酸乙酯形成途径解析[D].无锡:江南大学,2016.
[15]田夏琼,江华明,关统伟,等.浓香型白酒发酵过程中氨基甲酸乙酯形成的关联因子探究[J].中国酿造,2022,41(1):59-63.
[16]YOSHIZAWA K, TAKAHASHI K, SATO K.Changes of urea content in rice and sake moromi during sake making process[J].J Brew Soc Japan,1988,83(2):136-141.
[17]COULON J,HUSNIK J I,INGLIS D L,et al.Metabolic engineering of saccharomyces cerevisiae to minimize the production of ethyl carbamate in wine[J].Am J Enol Vitic,2006,57(2):113-124.
[18]DAHABIEH M S,HUSNIK J I,VUUREN H.Functional expression of the DUR3 gene in a wine yeast strain to minimize ethyl carbamate in chardonnay wine[J].Am J Enol Vitic,2009,60(4):537-41.
[19]WEI T Y,JIAO Z H,HU J J,et al.Chinese yellow rice wine processing with reduced ethyl carbamate formation by deleting transcriptional regulator dal80p in Saccharomyces cerevisiae[J].Molecules,2020,25(16):3580.
[20]董乃慧.氨基甲酸乙酯降解菌株和降解酶应用基础研究[D].大连:大连工业大学,2022.
[21]DONG N H,XUE S Y,GUO H,et al.Genetic engineering production of ethyl carbamate hydrolase and its application in degrading ethyl carbamate in Chinese liquor[J].Foods,2022,11(7):937.
[22]LIU Q T,WANG H,ZHANG W Q,et al.High salt-resistant urethanase degrades ethyl carbamate in soy sauce[J].J Agr Food Chem,2024,72(38):21266-21275.
[23]LIU Q T,WANG H,LI X,et al.A highly thermostable ethyl carbamatedegrading urethanase from Thermoflavimicrobium dichotomicum[J].Int J Biol Macromol,2025,307:142245.
[24]丁霞,李巧玉,刘凡,等.降解浓香型白酒中氨基甲酸乙酯菌株的筛选及产酶特性研究[J].食品与发酵工业,2018,44(7):29-36.
[25]刘晓慧.氨基甲酸乙酯水解酶的筛选及分子改造[D].无锡:江南大学,2016.
[26]王伟高,陈坚,周景文.赖氨酸芽孢杆菌产氨基甲酸乙酯水解酶的发酵条件优化[J].食品与生物技术学报,2017,36(3):259-265.
[27]喜琴琴.酿酒酵母NXU12-2在葡萄酒生产中的应用及其氨基甲酸乙酯水解酶酶学特性分析[D].银川:宁夏大学,2024.
[28]康婷婷.氨基甲酸乙酯水解酶的筛选、表达及活力改造[D].杭州:浙江大学,2021.
[29]区晓阳,杨豫,陈菲,等.一株降解木聚糖菌株的筛选、鉴定、发酵条件优化及其酶学性质研究[J].食品与发酵工业,2025,51(13):38-44,74.
[30]张璋,赵腾飞,李红霞,等.产淀粉酶芽孢杆菌的筛选、耐酸性驯化及淀粉酶酶学性质分析[J].中国酿造,2024,43(8):74-79.
[31]申鹏森,田争福,田晓菊,等.一株降解氨基甲酸乙酯酿酒酵母菌的筛选及鉴定[J].食品与发酵工业,2022,48(9):20-25.
[32]张璋,赵腾飞,李红霞,等.产蛋白酶芽孢杆菌的筛选、耐酸性驯化及蛋白酶酶学性质分析[J].中国酿造,2024,43(1):84-90.