发酵肉制品在加工、发酵和成熟过程中会产生一些游离氨基酸(free amino acids,FAA)、脂肪酸等化合物,其对发酵肉制品的品质特性具有直接或间接的影响[1]。微生物是影响发酵肉制品风味及品质的重要因素[2-3]。与天然发酵肉制品相比,微生物发酵剂可以减少其他环境因素的干扰,保证风味物质的稳定性[4]。目前常用的发酵剂菌种中,乳酸菌(lactic acid bacteria,LAB)的应用最为广泛[5]。
LAB具有较为完善的蛋白水解系统,其酶系赋予了其独特的生理功能,LAB分泌的蛋白酶可以分解大量的蛋白质和其他营养因子[6]。在利用LAB发酵肉制品方面,它的酶系可以代谢肉制品中的脂质和蛋白质,影响脂肪的分解并促进多肽的产生等,能改善提高肉制品的品质,赋予它们特殊的风味[7-9]。潘晓倩等[10]利用一株植物乳植杆菌(Lactiplantibacillus plantarum)发酵风干肠,检出风干肠产品中醇类、酮类和酸类物质相对含量提高,且腌腊肉制品呈香特征物质种类较多,证明植物乳植杆菌可以利用自身的水解酶(脂肪酶、蛋白酶)促进肉类中蛋白质和脂肪的分解,改善产品风味。LAB的蛋白水解酶系可以促进其特有风味物质和功能组分-游离氨基酸的合成,是筛选出品质好、稳定性好的工业菌种的重要标准[11]。在肉制品发酵过程中,肌肉内源酶将大分子蛋白质分解成多肽等低分子化合物,而微生物酶可将多肽降解为小肽和游离氨基酸。许多氨基酸是风味物质或风味物质的前体,它们通过脱羧和脱氨作用产生胺类和有机酸,通过一系列变化在产品中形成挥发性风味物质[12-13],同时通过释放和降解游离氨基酸,LAB可以调节非挥发性等特征代谢物的组成。陈俊宏等[14]采用乳酸菌发酵猪肉肉糜,产品中氨基酸含量增加,营养价值提高,同时产生很多挥发性风味物质。
目前发酵肉制品发酵剂的基本标准包括具备良好的耐盐性、耐胆盐性和耐亚硝酸盐性,能在6%食盐、0.3%胆盐和150 mg/kg亚硝酸盐中生长良好,且能有效地抑制发酵食品中致病菌生长,以及发酵葡萄糖不产气,不产粘液,不产生硫化氢及生物胺等[15]。本研究通过测定菌株肌肉蛋白水解圈直径及菌株蛋白酶活力的方法从内蒙古特色发酵食品中初步分离的52株菌中筛选出蛋白分解特性较好且符合肉品发酵剂要求的乳酸菌,通过测定菌株的耐盐性、耐亚硝酸盐性、耐胆盐性、pH耐受性、温度耐受性及抑菌性等探究其发酵特性,并构建体外发酵模拟体系探究该菌株的肌肉蛋白水解能力,以期为后续自主知识产权肉制品发酵剂的开发及发酵肉制品风味、品质的提升奠定研究基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
分离自内蒙古地区特色发酵食品的52株疑似乳酸菌的菌株:兴安盟扎赉特旗酸奶样品,锡林郭勒盟阿巴嘎旗酸马奶样品,包头市达尔罕茂明安联合旗风干肉样品;植物乳植杆菌(Lactiplantibacillus plantarum)XAR-10:中国典型培养物保藏中心(China Center for Type Culture Collection,CCTCC)(保藏号:CCTCC M 2024143);大肠杆菌(Escherichia coli)ATCC 25922、金黄色葡萄球菌(Staphylococcus aureus)ATCC 6538:青岛海博生物技术有限公司。
1.1.2 化学试剂
二喹啉甲酸(bicinchoninic acid,BCA)法蛋白测定试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)凝胶制备试剂盒、F8060福林酚(分析纯)、5×蛋白上样缓冲液:北京索莱宝科技有限公司;PageRuler 预染蛋白Marker:赛默飞世尔科技(中国)有限公司;葡萄糖、氯化钠、氯化钙、亚硝酸钠、猪胆盐(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
MRS肉汤、MRS培养基:广东环凯微生物科技有限公司。
1.2 仪器与设备
SW-CJ-IFD型超净工作台:苏州净化设备有限公司;SYNERGY H1 酶标仪:北京雷康恒泰商贸有限公司;T6新悦可见分光光度计:北京普析通用仪器有限责任公司;Centrifuge 5810R型台式冷冻离心机:德国Eppendorf公司;PowerBacTM Basic电泳仪:美国Bio-Rad 公司。
1.3 方法
1.3.1 具有蛋白水解能力乳酸菌的初筛
参考刘保等[16]的方法提取羊肉中的肌原纤维蛋白,肌原纤维蛋白培养基配方参考杨乐[17]方法。将MAURIELLO G等[18]方法稍作改动,使用打孔器在肌原纤维蛋白培养基中打孔(直径6 mm),将活化的菌液吸取60 μL打入孔中,孔径为(6.0±0.1)mm,培养48 h。将琼脂层从培养皿中取出,进行染色及脱色,观察并测量透明圈直径,依据透明圈直径大小初步筛选菌株。
1.3.2 具有蛋白水解能力菌株的复筛
参考李丹阳等[19]方法进行筛选菌株粗蛋白酶的提取及蛋白酶活力测定,对初步筛选的菌株进行进一步复筛。
1.3.3 筛选菌株的形态学观察及生理生化试验
将分离纯化获得的菌株接种在MRS平板上培养1~2 d,观察单个菌落的形状、颜色、透明度及边缘整齐度。革兰染色后在显微镜下观察菌体细胞形态。
将活化3代菌株进行葡萄糖产气、葡萄糖发酵、产硫化氢和产生物胺试验[20]。
1.3.4 菌株的分子生物学鉴定
16S rDNA序列分析:参考段艳[21]的方法鉴定菌株,后续由呼和浩特斯凯瑞医学检验所有限公司完成测序。
1.3.5 耐受性试验
耐盐性:以植物乳植杆菌XAR-10为对照(下同),向NaCl质量分数分别为3.0%、6.0%、7.5%、9.0%、12.0%的20 mL MRS液体培养基中接种活化3代的菌液0.2 mL,置于37 ℃培养24 h,于波长600 nm处测定吸光度值(OD600nm值)。
耐亚硝酸盐性:向NaNO2质量浓度分别为30 mg/L、60 mg/L、90 mg/L、120 mg/L、150 mg/L的20 mL MRS液体培养基中接种活化3代的菌液0.2 mL,培养24 h,于波长600 nm处测定吸光度值(OD600nm值)。
耐胆盐性:将0.2 mL活化三代的菌液接种于胆盐含量分别为0.03%、0.30%及0.50%的20 mL MRS液体培养基,37 ℃培养24 h后,于波长600 nm处测定培养液的吸光度值(OD600nm值)。胆盐的耐受能力计算公式如下:
pH耐受性:按4.0%的接种量接于MRS液体培养基中,分别置于不同的pH (3.5、4.5、5.5、6.5、7.5)下培养24 h,于波长600 nm 处测定各个pH值条件下菌株生长的吸光度值(OD600nm值)。
温度耐受性:按4.0%的接种量接于MRS液体培养基中,分别置于不同的温度(4 ℃、20 ℃、30 ℃、37 ℃、42 ℃)下培养24 h,于波长600 nm处测定各个温度条件下菌株生长的吸光度值(OD600nm值)。
1.3.6 抑菌性试验
以植物乳植杆菌XAR-10为对照,采用牛津杯扩散法测定抑菌能力[22]:将活化三代的指示菌大肠杆菌(Escherichia coli)ATCC 25922及金黄色葡萄球菌(Staphylococcus aureus)ATCC 6538均匀涂布在营养琼脂培养基上,在培养皿中放置无菌牛津杯[外径为(7.8±0.1)mm],向其中加入200 μL菌株上清液,将平板于4 ℃放置6 h后于37 ℃培养48 h,采用游标卡尺测量抑菌圈直径,参考罗璠等[23]报道,抑菌活性的判定标准为:抑菌圈直径≤8 mm,没有抑菌活性;抑菌圈直径在8~15 mm,具有抑菌活性;抑菌圈直径>15 mm,抑菌效果显著。
1.3.7 菌株蛋白水解特性试验
游离氨基酸态氮含量的测定:将活化3代的菌株YR3-1和SMN-2接种于肌原纤维蛋白液体培养基中在37 ℃下培养,即为肌原纤维蛋白发酵体系,以未接种菌株为空白对照组。采用邻苯二甲醛衍生比色法确定不同发酵时间(0、1 d、2 d、3 d、4 d)肌原纤维蛋白发酵液中游离氨基酸态氮含量。参照刘保等[16]的方法,在波长340 nm处测定吸光度值,同时以苯丙氨酸质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制标准曲线,得到标准曲线线性回归方程y=0.491 0x-0.001 1,相关系数R2=0.999 3。按照回归方程计算样品中游离氨基酸态氮含量。
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)蛋白电泳:参照王德宝[24]的方法稍作改动。将活化3代的菌株YR3-1和SMN-2接种于肌原纤维蛋白液体培养基中,37 ℃培养48 h,即为肌原纤维蛋白发酵体系,以未接种菌株为空白对照组。取培养48 h肌原纤维蛋白发酵液,按照体积比4∶1加入5×蛋白上样缓冲液,将样品煮沸10 min,Marker及样品上样量均为10 μL,进行SDS-PAGE蛋白电泳分析。
1.3.8 数据处理与统计分析
采用Microsoft Office Excel 2021对试验数据进行计算和分析,每个试验重复三次,用SPSS 26.0软件分析数据之间的差异显著性,数据以“平均值±标准差”表示,采用邓肯法进行差异显著性分析,P<0.05为具有显著差异,并采用Origin 2021软件进行绘图。
2 结果与分析
2.1 降解肌肉蛋白乳酸菌的筛选
2.1.1 菌株的初筛
将自内蒙古地区特色发酵食品中分离的52株菌经平板划线纯化培养,筛除生长性差和遗传性能不稳定的菌株,并测量菌株对肌原纤维蛋白的水解圈直径,结果见表1。由表1可知,6株蛋白水解能力较强的菌株水解圈直径均>10 mm。因此,选取这6株菌株进一步进行复筛。
表1 筛选菌株的肌原纤维蛋白水解直径
Table 1 Myofibrillar proteolytic diameter of screened strains

注:不同小写字母表示差异显著(P<0.05)。下同。
菌株编号 水解圈直径/mm ALS-2 R1-2-4 YR3-1 YR2-3-2 SMN-2 BP-4 12.23±0.31c 11.38±0.31d 16.62±0.27a 10.22±0.25e 16.44±0.19a 15.82±0.59b
2.1.2 菌株的复筛
将初筛得到的6株菌进行蛋白酶酶活测定,结果见表2。由表2可知,菌株YR3-1 和SMN-2蛋白酶活力分别为(23.13±0.40)U/mL和(22.06±0.34)U/mL,显著高于其他4株菌(P<0.05)。胡玲萍等[25]筛选出1株高产蛋白酶的植物乳植杆菌L4,其酶活力为25.12 U/mL,与本试验结果相似。因此,选择菌株YR3-1和SMN-2进行下一步试验。
表2 筛选菌株蛋白酶酶活测定结果
Table 2 Determination results of protease activities of screened strains
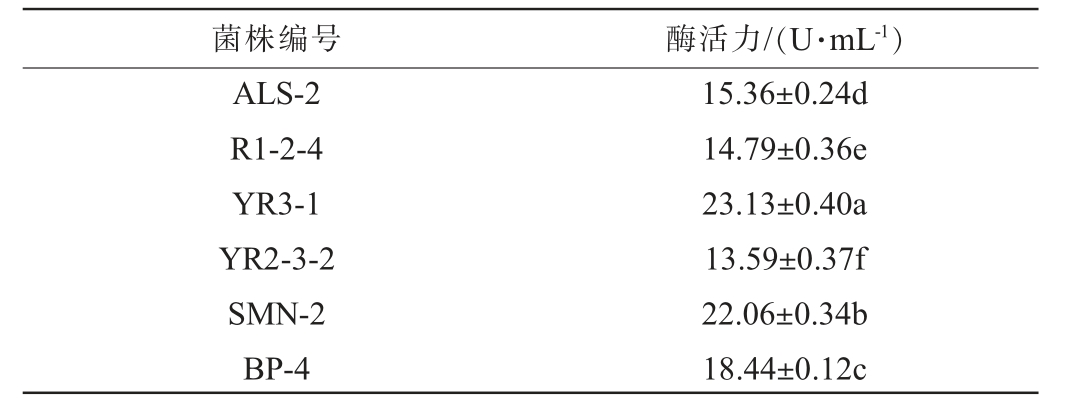
菌株编号 酶活力/(U·mL-1)ALS-2 R1-2-4 YR3-1 YR2-3-2 SMN-2 BP-4 15.36±0.24d 14.79±0.36e 23.13±0.40a 13.59±0.37f 22.06±0.34b 18.44±0.12c
2.2 筛选菌株的鉴定
2.2.1 筛选菌株形态学观察
所筛选菌株YR3-1和SMN-2的菌落及细胞形态见图1。菌株在培养基上的菌落如图1A、1B所示,菌落形状为圆形,大部分菌落中心凸起,直径普遍为1~2 mm,边缘整齐,颜色为白色,菌落不透明,均不产黏液。

图1 菌株YR3-1和SMN-2的菌落(A、B)及细胞(a、b)形态
Fig.1 Colony (A, B) and cell (a, b) morphology of strains YR3-1 and SMN-2
分离纯化后的菌株在光学显微镜(1 000倍)的形态如图1a、1b所示,菌株YR3-1和SMN-2形态呈球状,其革兰氏染色呈阳性,无芽孢。
2.2.2 生理生化试验
用于肉品发酵剂的乳酸菌应符合发酵葡萄糖不产气、H2S、生物胺和粘液等要求[26]。生理生化试验结果表明,菌株YR3-1和SMN-2均可发酵葡萄糖不产气,不产H2S、生物胺和粘液,满足肉制品发酵剂菌株要求。
2.2.3 筛选菌株鉴定结果
由表3可知,将蛋白水解能力较强的菌株YR3-1及菌株SMN-2进行分子生物学鉴定,其16S rDNA 基因序列在美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)上比对分析的结果表明,与戊糖片球菌(Pediococcus pentosaceus)的序列相似度为99%。因此,菌株YR3-1和SMN-2均被鉴定为戊糖片球菌(Pediococcus pentosaceus)。
表3 菌株YR3-1和SMN-2 16S rDNA基因序列鉴定结果
Table 3 Results of 16S rDNA gene sequence identification of strains YR3-1 and SMN-2

菌株 16S rDNA 同源性分析鉴定结果 同源性/%YR3-1 SMN-2 Pediococcus pentosaceus Pediococcus pentosaceus 99 99
2.3 筛选菌株耐受性分析
2.3.1 盐耐受性
耐盐能力较强的菌株,在肉制品的发酵、加工中都表现出很大的竞争优势,并且有较好的持久性[27]。以菌株XAR-10为阳性对照,菌株YR3-1和SMN-2盐耐受性试验结果见图2。由图2可知,当NaCl质量分数为6%时,3株菌均生长良好,菌株YR3-1的耐受能力最强,OD600nm值为1.37±0.01,其次为阳性对照菌株XAR-10,均显著高于菌株SMN-2(P<0.05)。当NaCl质量分数为12%时,3株菌几乎不再生长。李丹阳等[19]研究发现,乳酸菌菌株在较高盐浓度下不能生长。因此,菌株YR3-1的盐耐受性优于菌株SMN-2。
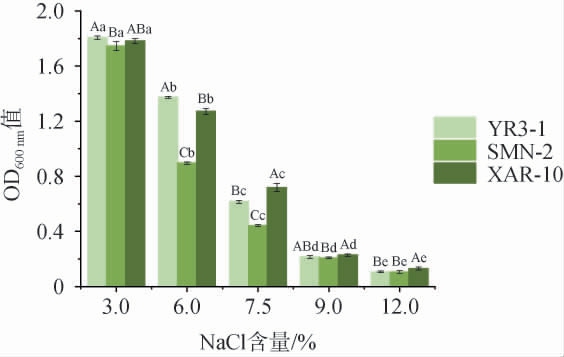
图2 菌株YR3-1及SMN-2的耐盐性试验结果
Fig.2 Results of salt tolerance experiments of strains YR3-1 and SMN-2
不同小写字母表示同一菌株不同浓度之间差异显著(P<0.05),
不同大写字母表示相同浓度不同菌株之间差异显著(P<0.05)。下同。
2.3.2 亚硝酸盐耐受性
亚硝酸盐通常作为护色剂、防腐剂等添加到发酵制品中来改善其色泽及风味[28]。以菌株XAR-10为阳性对照,菌株YR3-1和SMN-2亚硝酸盐耐受性试验结果见图3。由图3可知,随着NaNO2质量浓度的增加,菌株的生长能力呈显著下降趋势(P<0.05)。当NaNO2质量浓度为150 mg/L时,3株菌的OD600 nm值均>1,仍然可以生长,且菌株YR3-1和对照菌株XAR-10的亚硝酸盐耐受性显著高于菌株SMN-2(P<0.05)。
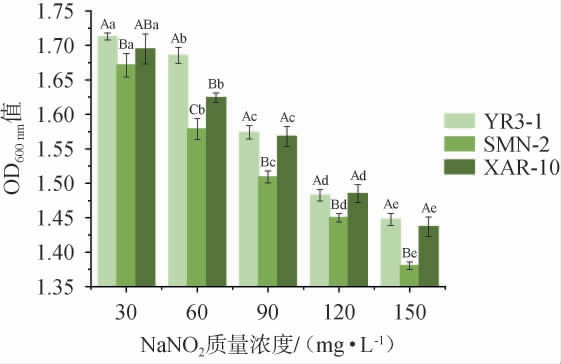
图3 菌株YR3-1及SMN-2耐亚硝酸盐性试验结果
Fig.3 Results of nitrite tolerance experiments of strains YR3-1 and SMN-2
2.3.3 耐胆盐性
胆盐耐受性是乳酸菌在肠道内生存的基本特性之一,肠道环境中胆盐浓度较高,因此菌株的耐胆盐性至关重要[29]。以菌株XAR-10为阳性对照,菌株YR3-1和SMN-2胆盐耐受性试验结果见表4。由表4可知,当胆盐含量为0.03%时,菌株胆盐耐受性均比较高(74.87%~82.05%);当胆盐含量为0.30%时,菌株YR3-1的胆盐耐受显著高于菌株SMN-2(P<0.05),胆盐耐受性分别为14.37%和11.19%,人小肠中的胆盐含量通常为0.03%~0.30%[30],菌株YR3-1表现出较强的胆盐耐受能力。当胆盐含量增加到0.50%时,随着胆盐含量的增加,3株菌的胆盐耐受性均有所下降。菌株YR3-1对胆盐耐受性优于菌株SMN-2。
表4 菌株YR3-1和菌株SMN-2胆盐耐受性试验结果
Table 4 Results of bile tolerance experiments of strains YR3-1 and SMN-2
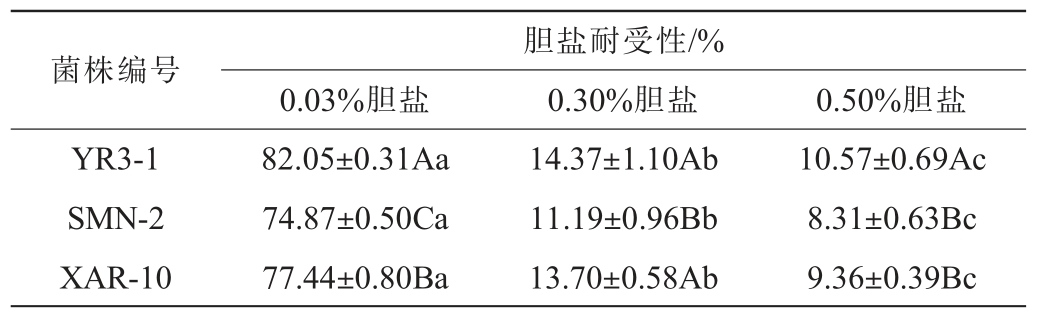
菌株编号0.03%胆盐胆盐耐受性/%0.30%胆盐 0.50%胆盐YR3-1 SMN-2 XAR-10 82.05±0.31Aa 74.87±0.50Ca 77.44±0.80Ba 14.37±1.10Ab 11.19±0.96Bb 13.70±0.58Ab 10.57±0.69Ac 8.31±0.63Bc 9.36±0.39Bc
2.3.4 pH值耐受性
肉制品在发酵过程中,其pH值会逐渐降低,因此菌株对低pH的耐受性也是筛选优良菌株的一个重要标准[31]。以菌株XAR-10为阳性对照,菌株YR3-1和SMN-2 pH值耐受性试验结果见图4。由图4可知,3株菌在pH值为6.5时,生长能力均最好,菌株YR3-1在pH值4.5~6.5条件下的生长能力明显高于菌株SMN-2。与其他pH值相比,3菌株在pH值为3.5时的生长能力显著下降(P<0.05),菌株YR3-1和SMN-2的OD600nm值较高。因此,菌株YR3-1和SMN-2在微酸性条件下生长最好,均能耐受pH值为3.5环境条件。
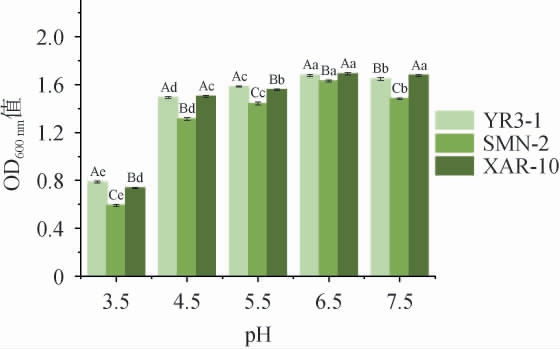
图4 菌株YR3-1和菌株SMN-2 pH值耐受性试验结果
Fig.4 Results of pH tolerance experiments of strains YR3-1 and SMN-2
2.3.5 温度耐受性
以菌株XAR-10为阳性对照,菌株YR3-1和SMN-2温度耐受性试验结果见图5。由图5可知,当温度在4~37 ℃范围内,3株菌的生长呈现上升趋势,温度4 ℃条件下,3株菌的生长能力显著低于其他温度(P<0.05),且生长能力随着温度的升高呈现先上升后下降的趋势,这可能是由于乳酸菌的较适宜生长温度为30~40 ℃,在4 ℃时,代谢速度减慢,影响了菌株的生长繁殖。在温度37 ℃时,菌株YR3-1的OD600 nm值为1.68±0.01,仅次于对照菌株XAR-10,且显著高于菌株SMN-2(P<0.05),可耐温度42 ℃。因此,菌株YR3-1温度耐受性优于菌株SMN-2。
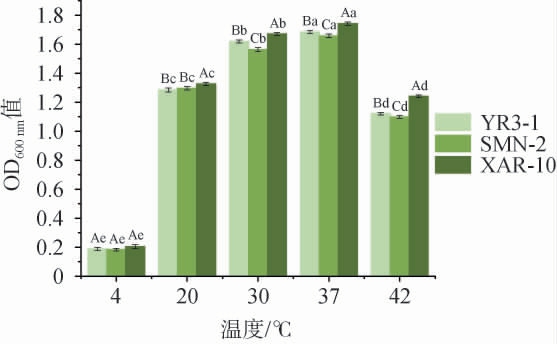
图5 菌株YR3-1和菌株SMN-2温度耐受性试验结果
Fig.5 Results of temperature tolerance experiments of strains YR3-1 and SMN-2
2.4 筛选菌株抑菌性分析
乳酸菌在发酵过程中可产生多种抑菌物质,其能有效地抑制发酵食品中致病菌生长并延长食品保质期[32]。以菌株XAR-10为阳性对照,菌株YR3-1和SMN-2 抑菌活性试验结果见表5。由表5可知,3株菌的代谢产物均对金黄色葡萄球菌和大肠埃希氏菌有不同程度的抑制作用,均能产生抑菌圈,说明试验菌株对两种常见致病菌均具有一定的抑制作用。其中菌株YR3-1对两株指示菌的抑制圈直径均明显大于其他两株菌,对金黄色葡萄球菌和大肠埃希氏菌的抑菌圈直径分别为(14.44±0.33)mm和(19.52±0.42)mm,说明菌株YR3-1对致病菌的抑制效果最强。熊玉帛等[33]研究表明植物乳植杆菌SYS-2和SYS-4对常见致病菌也具有一定的抑制能力,均能产生抑菌圈,与本实验结果相似。
表5 菌株YR3-1和SMN-2抑菌活性试验结果
Table 5 Results of antibacterial activity tests of strains YR3-1 and SMN-2

菌株编号抑菌圈直径/mm金黄色葡萄球菌 大肠埃希氏菌YR3-1 SMN-2 XAR-10 14.44±0.33a 13.56±0.25b 14.07±0.71ab 19.52±0.42a 18.40±0.21b 15.66±0.23c
2.5 筛选菌株蛋白水解能力分析
2.5.1 游离氨基酸态氮
肉制品中的蛋白质在蛋白酶的作用下水解为小肽和氨基酸等含氮物质,即为游离氨基酸态氮,它是反映发酵过程中的蛋白水解程度的一个重要指标,同时它也影响着肉制品的品质及风味[34]。
菌株YR3-1和SMN-2对肌原纤维蛋白发酵模拟体系中游离氨基酸态氮含量测定结果见图6。由图6可知,随着发酵时间的增加,3株菌对肌原纤维蛋白发酵模拟体系中游离氨基酸态氮含量整体呈上升趋势。在不同发酵时间的发酵模拟体系中,YR3-1组和SMN-2 组中游离氨基酸态氮含量均显著高于空白对照组(P<0.05),证明两株菌均具有较好的蛋白水解能力。两个试验组在第2、3、4天游离氨基酸态氮含量上升趋势较缓慢,但仍然显著高于对照组(P<0.05)。菌株YR3-1对肌原纤维蛋白发酵模拟体系中游离氨基酸态氮含量在不同发酵时间均高于菌株SMN-2,说明菌株YR3-1对于肌原纤维蛋白分解能力较强。
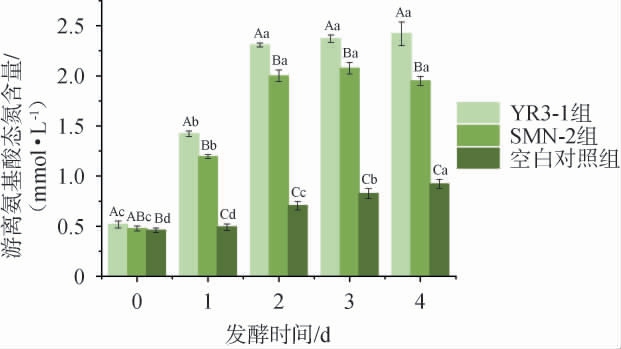
图6 肌原纤维蛋白发酵模拟体系中游离氨基酸态氮含量的变化
Fig.6 Changes of free amino acid nitrogen contents in myofibrillar protein fermentation simulation system
2.5.2 肌原纤维蛋白SDS-PAGE电泳分析
蛋白电泳条带的强度变化能直观地反映不同分子质量蛋白的变化情况[35]。菌株YR3-1及SMN-2的肌原纤维蛋白发酵模拟体系电泳分析结果见图7。
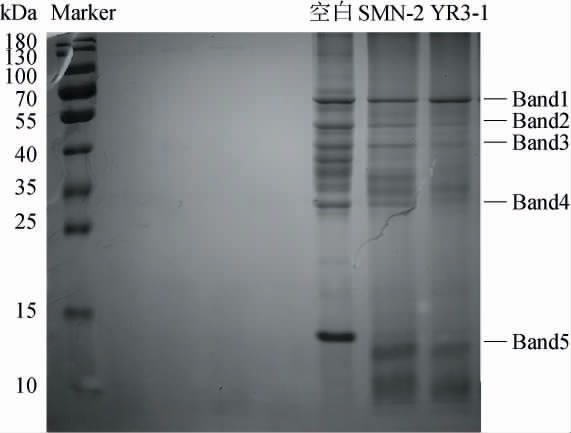
图7 菌株YR3-1和SMN-2降解肌原纤维蛋白十二烷基硫酸钠-聚丙烯酰胺凝胶电泳结果
Fig.7 Results of sodium dodecyl sulfate-polyacrylamide gel electrophoresis of myofibrillar protein degraded by strains YR3-1 and SMN-2
Band1:肌动蛋白(45 kDa);Band2:原肌球蛋白(40 kDa);Band3:肌钙蛋白(37 kDa);Band4,5:肌球蛋白轻链(10~25 kDa)。
由图7可知,与空白对照组相比,两个试验组的各蛋白条带亮度明显减弱,表明菌株促进了肌原纤维蛋白的降解,ZHAO W T等[36]研究发现,乳酸菌可以水解肌肉蛋白质。添加菌株YR3-1和SMN-2的肌动蛋白(Band1,45 kDa)条带相比空白组条带浅,说明2株菌具有较好地降解肌肉蛋白的能力。原肌球蛋白(Band2,40 kDa)和肌钙蛋白(Band3,37 kDa)条带亮度明显减弱,其中YR3-1组的条带几乎消失。这可能是由于接种2株戊糖片球菌发酵剂,微生物产生了蛋白酶使大分子质量的蛋白质降解。结果表明,菌株YR3-1对肌原纤维蛋白的降解能力最强。其次,与空白对照组相比,两试验组肌球蛋白轻链(Band5,12 kDa)条带较为明显,可见菌株将蛋白中的大分子片段水解为了小分子片段。因此,菌株YR3-1和SMN-2均可有效降解肌肉蛋白。王俊钢等[37]研究也有相似结论,加菌组与对照组(不加菌)电泳条带有明显差别,证明了戊糖片球菌可以促进肌原纤维蛋白的降解。
3 结论
本研究从内蒙古特色发酵食品中筛选出降解肌肉蛋白能力较强菌株YR3-1和SMN-2,其均鉴定为戊糖片球菌(Pediococcus pentosaceus)。两株菌均具有良好的耐盐、耐胆盐、耐亚硝酸盐、耐温和耐酸能力,菌株YR3-1耐受性优于菌株SMN-2,符合肉制品发酵剂菌株的要求,且具有良好的抑菌性。两株乳酸菌可促使大分子的肌肉蛋白水解为小分子物质,其中菌株YR3-1对肌原纤维蛋白降解效果最优。综上,菌株YR3-1具有较强降解肌肉蛋白的能力及良好的发酵特性,具有作为肉制品发酵剂开发潜力,将其用于肉制品发酵,有望改善发酵肉制品的品质及风味,为后续乳酸菌肉制品发酵剂的开发奠定基础。
[1]CHENG Y L,YIN X N,XU L, et al.Correlation analysis on the quality indicators of intensified dry-aged beef and microbial succession during fermentation[J].Food Biosci,2023,56:103439.
[2]ZHANG Y L,HU P,LOU L J,et al.Antioxidant activities of lactic acid bacteria for quality improvement of fermented sausage[J].J Food Sci,2017,82(12):2960-2967.
[3]LUAN X X, FENG M Q, SUN J.Effect of Lactobacillus plantarum on antioxidant activity in fermented sausage[J].Food Res Int, 2021, 144:110351.
[4]HUANG Z C,SHEN Y,HUANG X Q,et al.Microbial diversity of representative traditional fermented sausages in different regions of China[J].J Appl Microbiol,2021,130(1):133-141.
[5]ZHANG Q H,SHEN J L,MENG G G,et al.Selection of yeast strains in naturally fermented cured meat as promising starter cultures for fermented cured beef, a traditional fermented meat product of northern China[J].J Sci Food Agr,2024,104(2):883-891.
[6]MANUS J,MILLETTE M,USCANGA B R A,et al. In vitro protein digestibility and physico-chemical properties of lactic acid bacteria fermented beverages enriched with plant proteins[J].J Food Sci,2021,86(9):4172-4182.
[7]WANG Y,HAN J,WANG D X,et al.Research update on the impact of lactic acid bacteria on the substance metabolism,flavor,and quality characteristics of fermented meat products[J].Foods,2022,11(14):2090.
[8]CHESSA L,PABA A,DUPRÉ I,et al.A strategy for the recovery of raw ewe's milk microbiodiversity to develop natural starter cultures for traditional foods[J].Microorganisms,2023,11(4):823.
[9]LIU Y C,GAO S,CUI Y,et al.Characteristics of lactic acid bacteria as potential probiotic starters and their effects on the quality of fermented sausages[J].Foods,2024,13(2):198.
[10]潘晓倩,成晓瑜,张顺亮,等.乳酸菌发酵剂对风干肠风味品质的影响[J].肉类研究,2017,31(12):50-55.
[11]LÓPEZ C M,SENTANDREU M A,VIGNOLO G M,et al.Low molecular weight peptides derived from sarcoplasmic proteins produced by an autochthonous starter culture in a beaker sausage model[J].EuPA Open Proteomics,2015,7(2):54-63.
[12]LATORRE-MORATALLA M L,BOVER-CID S,BOSCH-FUSTÉ J,et al.Amino acid availability as an influential factor on the biogenic amine formation in dry fermented sausages[J].Food Control,2014,36(1):76-81.
[13]ZAGOREC M,CHAMPOMIER-VERGÈS M C.Lactobacillus sakei:A starter for sausage fermentation, a protective culture for meat products[J].Microorganisms,2017,5(3):56.
[14]陈俊宏,王洋,李芹,等.乳酸菌发酵工艺对肉糜理化性质及品质的影响[J].中国调味品,2021,46(6):5-10.
[15]彭健斌,苏平,林雨,等.应用于羊肉脱膻的三种发酵剂筛选及发酵特性研究[J].中国酿造,2020,39(12):130-135.
[16]刘保,丁捷,白婷,等.植物乳杆菌对牦牛肌肉蛋白提取物的降解能力研究[J].中国测试,2019,45(10):71-77.
[17]杨乐.乳酸菌对发酵香肠中蛋白水解的作用机制研究[D].呼和浩特:内蒙古农业大学,2023.
[18]MAURIELLO G, CASABURI A, VILLANI F.Proteolytic activity of Staphylococcus xylosus strains on pork myofibrillar and sarcoplasmic proteins and use of selected strains in the production of'Naples type'salami[J].J Appl Microbiol,2002,92(3):482-490.
[19]李丹阳,李宇辉,高云云,等.新疆哈萨克族风干肉中产蛋白酶乳酸菌的筛选及酶学特性研究[J].食品与发酵工业,2020,46(9):57-63.
[20]路福平,李玉.微生物学实验技术[M].第二版,北京:中国轻工业出版社,2020:42-47.
[21]段艳.乳酸菌的筛选及其对羊肉干发酵香肠品质特性的影响[D].呼和浩特:内蒙古农业大学,2013.
[22]杨智源,金日天,梁铎,等.源自蜡样芽孢杆菌抗菌肽DB16的筛选及其对金黄色葡萄球菌的抑菌机制[J].食品科学,2024,45(10):126-134.
[23]罗璠,李明雄,向文良,等.产类细菌素的乳酸菌的筛选及其抑菌特性研究[J].四川大学学报(自然科学版),2010,47(3):655-660.
[24]王德宝.发酵剂对发酵羊肉香肠蛋白质、脂质分解代谢及风味物质生成机制影响的研究[D].呼和浩特:内蒙古农业大学,2020.
[25]胡玲萍,裘迪红,王鑫钰.泡菜中高产蛋白酶乳酸菌的筛选鉴定及其酶学特性初步研究[J].食品与发酵工业,2015,41(6):35-40.
[26]李洪英.Staphylococcus simulans QB7胞外蛋白酶鉴定及产肽机制研究[D].贵阳:贵州大学,2023.
[27]杨扬.乳酸菌蛋白分解能力对羊肉干发酵香肠品质的影响[D].呼和浩特:内蒙古农业大学,2018.
[28]王蜀.香肠中具有降亚硝酸盐效果微生物的筛选及其机理研究[D].成都:成都大学,2024.
[29]张华丽,王悦,王伟亮,等.鲜马奶细菌多样性分析及乳酸菌的益生研究[J].内蒙古农业大学学报(自然科学版),2025,46(3):37-46.
[30]史梅莓,伍亚龙,杨恺,等.四川泡菜中潜在益生性植物乳杆菌的筛选及安全性评价[J].食品工业科技,2022,43(22):165-172.
[31]LV J,YANG Z X,XU W H,et al.Relationships between bacterial community and metabolites of sour meat at different temperature during the fermentation[J].Int J Food Microbiol,2019,307:108286.
[32]顾娜泥,武文玉,刘水琳,等.东北传统酱腌菜中耐盐乳酸菌的筛选、鉴定及其发酵特性研究[J].中国酿造,2024,43(8):31-37.
[33]熊玉帛,赵野,曾瑶英,等.华容芥菜降亚硝酸盐乳酸菌的筛选鉴定及发酵特性研究[J].中国酿造,2024,43(8):122-127.
[34]DLAMINI B C, BUYS E M, TAYLOR J R N.Effect of sorghum type and malting on production of free amino nitrogen in conjunction with exogenous protease enzymes[J].J Sci Food Agr,2015,95(2):417-422.
[35]杨雪倩.植物乳杆菌对发酵香肠蛋白质分解的影响[D].呼和浩特:内蒙古农业大学,2023.
[36]ZHAO W T,FAN X K,SHI Z H,et al.Effect of ultrasonic pretreatment with synergistic microbial fermentation on tenderness and flavor of airdried duck under low nitrite process[J].Food Chem X,2024,24:101946.
[37]王俊钢,李宇辉,岳建平,等.不同产蛋白酶乳酸菌对风干牛肉蛋白质降解的影响[J].食品工业科技,2022,43(8):117-123.