表1 筛选菌株耐受性试验测定条件及梯度
Table 1 Determination conditions and gradients of tolerance tests for screened strains

梯度 乙醇体积分数/% 葡萄糖质量浓度/(g·L-1) SO2/(mg·L-1) pH值1 2 3 4 5 12 14 16 18 20 200 250 300 350 400 150 200 250 300 350 4.0 3.5 3.0 2.5 2.0
Screening and fermentation characteristics of superior indigenous Saccharomyces cerevisiae from table grapes in the eastern foothills of Helan Mountain
宁夏贺兰山东麓葡萄酒产区酒庄众多,葡萄酒年产量大,但葡萄酒酿造仍主要依赖于国外进口商业酿酒酵母(Saccharomyces cerevisiae)菌种,导致葡萄酒品质同质化严重以及产区风格特色不突出等一系列问题。为了改善葡萄酒日益严重的同质化问题,酿造有产区特色的葡萄酒,选育优良本土酿酒酵母成为热点[1]。产区特色葡萄酒独特的风味,一般是在发酵过程中优良本土酵母菌产生与特定葡萄酒类型相关的典型香气有关[2]。优良酿酒酵母首先应具备发酵速度较快、较强综合耐受性,其次要能适应产区当地的微环境和酒精发酵,并且发酵出的葡萄酒酒体协调、口感丰富,能提升产区典型发酵酒类的品质[3-4]。目前,我国筛选和选育的本土酿酒酵母菌株在葡萄酒酿造中仍较匮乏,因此优良本土酵母菌种资源的筛选具有重要的现实意义[5-6]。近年来,ZHANG Z等[7]研究探明了贺兰山东麓葡萄酒产区葡萄酒发酵中的核心细菌菌群菌属,明确了细菌群落对葡萄酒香气形成的影响。周桂珍等[8]从宁夏贺兰山东麓葡萄酒产区的土壤、葡萄果实及叶片中分离的106株酵母菌中,筛选出可耐受乙醇体积分数15%、葡萄糖500 g/L、SO2 350 mg/L和pH 3.0环境的10株酿酒酵母。巩丽莉等[9]从168株宁夏本土酿酒酵母中筛选出能适应乙醇体积分数13%、葡萄糖350 g/L、SO2 250 mg/L、pH 1.0环境且低产H2S的4株本土酿酒酵母。张家晨[10]筛选出了3株可耐受乙醇体积分数16%、SO2 100 mg/L和pH 3.0环境的酵母菌。然而从该产区鲜食葡萄中筛选优良酿酒酵母的报道并不多见。
本研究从宁夏贺兰山东麓葡萄种植区的鲜食葡萄表皮及自然发酵醪液中筛选优良酵母菌株,通过杜氏管试验及产乙醇能力进行初筛,再经发酵力和耐受性测定复筛出具有良好发酵特性且综合耐受性较强的本土酵母菌株,采用分子生物学技术对筛选菌株进行鉴定。以赤霞珠葡萄为原料制备干红葡萄酒,通过常规分析方法及气质联用(gas chromatography-mass spectrography,GC-MS)法对赤霞珠干红葡萄酒理化指标和挥发性香气成分进行,并对结果进行聚类分析(cluster analysis,CA)。以期能够筛选到发酵性能优良、耐受性强并具有一定产区特色风味葡萄酒酿造特性的本土酿酒酵母菌株,为挖掘本土优良的酿酒酵母资源提供依据。优良的本土酿酒酵母菌株资源的挖掘,对解决葡萄酒同质化问题具有重要意义。
1.1.1 原料和菌株
鲜食葡萄(玫瑰香、红地球、扎娜和无核白葡萄):宁夏银川市贺兰山东麓鲜食葡萄种植园;赤霞珠葡萄(还原糖260.5 g/L,总酸5.8 g/L,pH为3.75):宁夏贺兰山东麓宁夏原歌葡萄酒庄。
商业酿酒酵母(Saccharomyces cerevisiae)XR:法国拉氟德公司。
1.1.2 化学试剂
葡萄糖(分析纯)、蛋白胨、酵母浸粉、琼脂(均为生化试剂):北京奥博星生物技术有限责任公司;无水乙醇、MgSO4、KH2PO4、2,3,5-氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)(均为分析纯):天津市大茂化学试剂厂;果胶酶(酶活104 U/g):江苏源盛通生物工程有限公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)液体培养基[11]:蛋白胨20 g,葡萄糖20 g,酵母膏10 g,蒸馏水定容至1 L,自然pH值。115 ℃高压蒸汽灭菌20 min。
YEPD固体培养基[11]:蛋白胨20 g,葡萄糖20 g,酵母膏10 g,琼脂15 g,蒸馏水定容至1L,自然pH值。115 ℃高压蒸汽灭菌20 min。
TTC上层培养基[11]:TTC 0.5 g,葡萄糖5 g,琼脂15 g,蒸馏水定容至1L,自然pH值。115 ℃高压蒸汽灭菌20 min。
TTC下层培养基[11]:MgSO4 0.4 g,KH2PO4 1.0 g,酵母浸粉1.5 g,蛋白胨2 g,葡萄糖10 g,琼脂15 g,蒸馏水定容至1 L,调节pH值至5.5。115 ℃高压蒸汽灭菌20 min。
7820A-5975C气相色谱-质谱联用仪:美国安捷伦科技(中国)有限公司;TS2009光学显微镜:上海一恒科学仪器有限公司;ST3100 pH计:上海仪电科学仪器股份有限公司;UV1000紫外分光光度计:美国赛默飞世尔科技(中国)有限公司;SHP-150B生化培养箱:上海精宏实验设备有限公司;LDZX-50FBS压力蒸汽灭菌器:山东博科生物产业有限公司;Tone90G聚合酶链式反应(polymerase chain reaction,PCR)仪:耶拿分析仪器(北京)有限公司;DYY-7B电泳仪:北京六一生物科技有限公司;iBright CL750全自动凝胶成像系统:北京赛智创业科技有限公司。
1.3.1 鲜食葡萄表皮及自然发酵醪液中酵母菌的分离
分别称取无霉变、腐烂的鲜食葡萄果皮10 g或鲜食葡萄发酵醪液(将不同鲜食葡萄捏碎装入无菌三角瓶中,自然发酵14 d)10 mL,加入90 mL无菌水,振荡10 min,制备成菌悬液。吸取菌悬液1 mL,接种于25 mL YEPD液体培养基中,于28 ℃、150 r/min培养24 h后梯度稀释,分别取10-4、10-5、10-6浓度的菌悬液100 μL涂布于YEPD固体培养基,28 ℃培养2 d。挑取菌落表面光滑、湿润、黏稠,质地柔软,易挑起,多为乳白或奶油色,具有愉悦香气等特征的疑似酵母菌的单个菌落[12],重复在YEPD固体培养基上划线分离2~3次,待菌种纯化后接种于YEPD斜面培养基,28 ℃培养24 h后,4 ℃保存。
1.3.2 酵母菌菌株的复筛
将分离纯化到的酵母菌菌株接种于含乙醇体积分数为10%,60 mg/L SO2的YEPD液体培养基中,再放入倒置的杜氏管,确保杜氏管内无空气,28 ℃恒温静置培养。每隔12 h观察并记录产气情况。然后采用TTC培养基根据显色反应进行产乙醇性能测定,综合筛选出起酵速度快、产乙醇能力强的酵母菌株。
1.3.3 发酵性能测定
(1)发酵力
发酵力的测定采用CO2失重法。
(2)耐受性
耐受性测定条件按表1调节YEPD培养基的浓度梯度后,将5 mL培养基分装到试管中再放入倒置的杜氏管,确保杜氏管内无空气。115 ℃灭菌20 min,冷却至室温后,2%接种量接入各待测酵母菌株,28 ℃静置培养48 h,观察其产气状况,判断其耐受性。
表1 筛选菌株耐受性试验测定条件及梯度
Table 1 Determination conditions and gradients of tolerance tests for screened strains

梯度 乙醇体积分数/% 葡萄糖质量浓度/(g·L-1) SO2/(mg·L-1) pH值1 2 3 4 5 12 14 16 18 20 200 250 300 350 400 150 200 250 300 350 4.0 3.5 3.0 2.5 2.0
1.3.4 筛选菌株的分子生物学鉴定
采用真菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒提取酵母菌的基因组DNA,以其为模板,参考赵雪平等[11]的方法PCR扩增26S rDNA D1/D2区基因序列,引物为NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')。PCR 扩增体系(25μL):10×EasyTaqBuffer2.5μL,NL1和NL4(10μmol/L)各0.5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)(2.5mmol/L)2μL,10×EasyTaq聚合酶0.25μL,酵母菌DNA 模板1 μL,双蒸水(ddH2O)18.25 μL。PCR扩增条件:95 ℃预变性5 min;94 ℃变性1 min,52 ℃退火1 min,72 ℃延伸80 s,36次循环;72 ℃再延伸8 min。PCR产物经2%琼脂糖凝胶电泳进行验证后,送上海生工生物公司测序。将测序序列提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对分析,根据MEGA7.0软件中邻接(neighbor joining,NJ)法构建系统进化树。
1.3.5 赤霞珠干红葡萄酒的制备
挑取无破损、成熟的赤霞珠酿酒葡萄果粒进行手工破碎,将破碎后的葡萄醪液装入5 L的发酵玻璃瓶中,装量约为70%,分别加入偏重亚硫酸钾60 mg/L和果胶酶20 mg/L,室温浸渍24 h后,不同试验组分别按接种量约106 CFU/mL接入酿酒酵母,于20 ℃恒温进行酒精发酵,每组重复3次。所有发酵处理每天压帽2~3次,并定时测定发酵葡萄醪液的相对密度变化,当葡萄醪液的相对密度接近0.997连续2 d保持不变视为发酵结束。分离皮渣,将酒液进行澄清,过滤后得到赤霞珠干红葡萄酒原酒,于低温环境贮存。
1.3.6 分析检测
(1)理化指标
赤霞珠干红葡萄酒的酒精度、总酸、总SO2、游离SO2和pH等理化指标参照国标GB/T 15038—2006《葡萄酒、果酒通用分析法》[13]测定。
(2)挥发性香气物质
挥发性香气物质含量测定采用顶空固相微萃取-气相色谱-质谱联用(head space-solidphase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)法[14-15]。香气活度值(odor activity value,OAV)=挥发性香气物质的含量/挥发性香气物质的感官阈值[16]。依据OAV评价各挥发性香气物质对酒整体香气的贡献,OAV>0.1的挥发性香气物质可视为葡萄酒的潜在挥发性香气影响化合物,OAV>1的挥发性香气物质对酒整体香气有重要贡献,是关键香气物质。
1.3.7 数据处理
利用Microsoft Excel 2019整理数据;采用SPSS Statistics 26.0软件进行数据统计分析;利用MEGA 7.0软件构建酿酒酵母菌株系统发育树;利用GraphPad Prism10软件作图和聚类分析。
2.1.1 鲜食葡萄表皮及其自然发酵醪液中酵母菌的分离
从不同鲜食葡萄及其发酵醪液中分离纯化得到46株酵母菌,编号为Y1~Y46,其中筛选自玫瑰香葡萄12株、红地球葡萄14株、扎娜葡萄13株和水晶白葡萄7株。菌落特征均呈白色、奶油色或乳白色,表面光滑湿润,圆形,边缘整齐,菌落直径在2~5 mm,有酒香味,镜检细胞形态为球形、椭圆形或卵圆形。
2.1.2 酵母菌菌株的复筛
依据酵母菌发酵过程产生CO2气体充满杜氏小管的时间可直接反映菌株的发酵能力[11],将初筛分离得到的46株酵母菌进行杜氏小管发酵复筛试验,复筛得到11株酵母菌,其产气情况及TTC培养基显色结果见表2。由表2可知,28 ℃培养24 h时,11株酵母菌产气量约等于杜氏小管体积,说明这11株酵母菌起酵能力较强,有较高的发酵速率。其中菌株Y7在12 h内产气量达到杜氏小管满体积,在筛选出的11株酵母菌中起酵速率最快。
表2 筛选菌株产气情况及TTC培养基显色结果
Table 2 Gas production and color developing results on TTC medium of screened strains
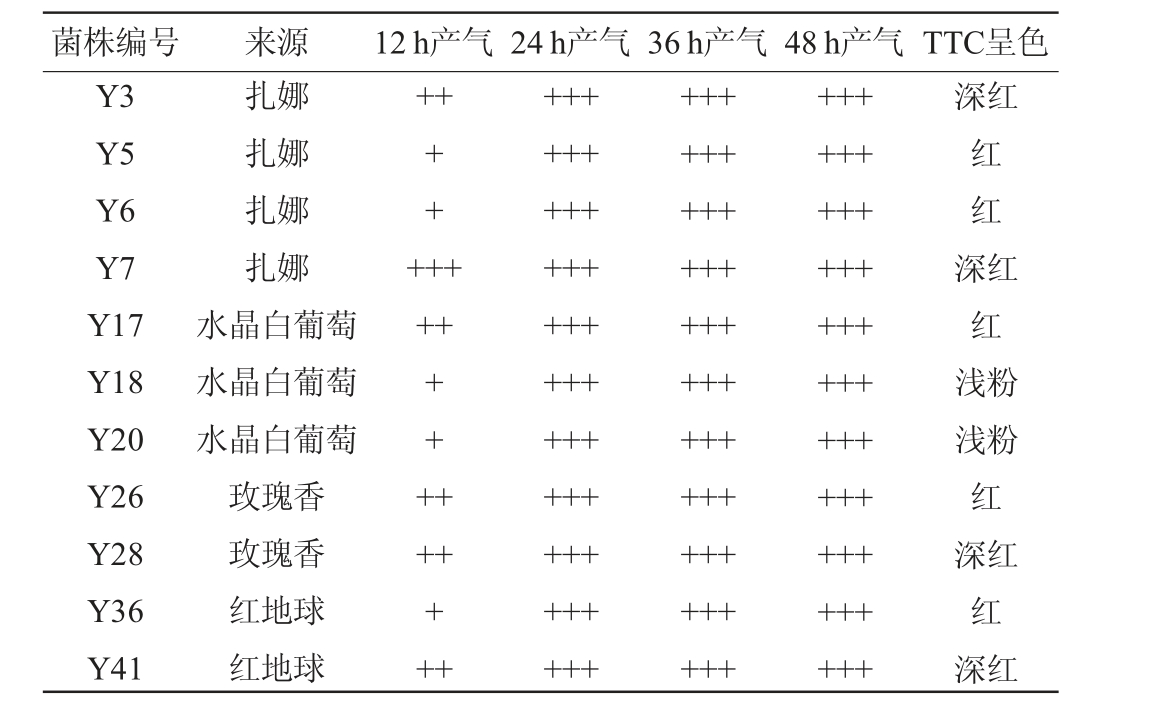
注:“+”:产气量约为1/3杜氏小管体积;“++”:产气量约为2/3杜氏小管体积;“+++”:产气量约为杜氏小管满体积;“-”:菌株在该培养时间段内不产气。下同。
菌株编号 来源 12 h产气24 h产气36 h产气48 h产气TTC呈色Y3 Y5 Y6 Y7 Y17 Y18 Y20 Y26 Y28 Y36 Y41扎娜扎娜扎娜扎娜水晶白葡萄水晶白葡萄水晶白葡萄玫瑰香玫瑰香红地球红地球++深红+++++++红红深++++红红浅粉++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++浅粉红深红红深红
TTC显色剂遇乙醇显红色,乙醇含量越高菌落呈深红色,乙醇含量低菌落呈浅粉色。由表2亦可知,4株酵母菌菌落TTC显色反应结果呈深红色,5株菌菌落TTC显色反应结果呈红色,2株菌菌落TTC显色反应结果呈浅红色。通过TTC显色反应复筛得到4株菌(菌株Y3、Y7、Y28和Y41)产乙醇性能较强、生长旺盛,有利于发酵作用。
发酵力是判断酵母菌株性能最重要的一个指标,酵母菌在发酵过程中细胞代谢产生CO2,这部分气体可以从发酵液中逸出使整个发酵体系质量减轻,因而可根据减少的质量来衡量菌株发酵力的强弱[8]。本试验以商业酿酒酵母XR为对照,将复筛得到的4株酵母菌株Y3、Y7、Y28和Y41,以2%接种量接种至200 mL灭菌的赤霞珠葡萄汁中28 ℃静置培养,每隔24 h测定其发酵液中CO2质量损失,结果见表3。由表3可知,与商业酿酒酵母XR相比,菌株Y41的发酵力最弱,明显低于XR;菌株Y3、Y7和Y28发酵力与XR相当,发酵过程平稳,3 d后发酵速度下降,且下降幅度变化不大。因此,选择菌株Y3、Y7和Y28进行下一步试验。
表3 筛选菌株发酵过程中CO2质量损失
Table 3 CO2 mass loss of screened strains
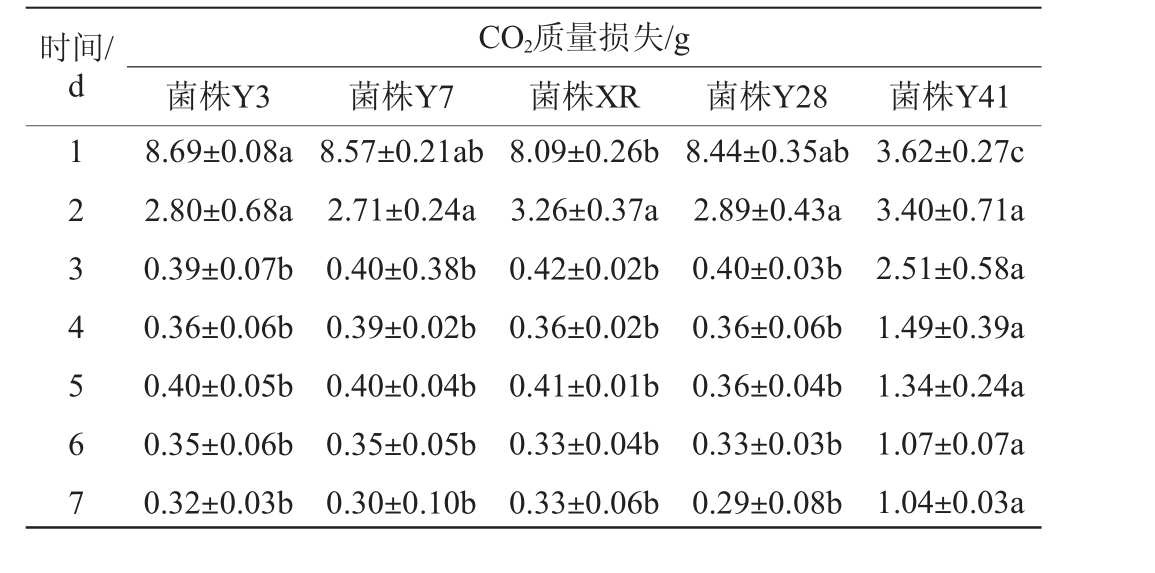
时间/d 12 34 56 7 CO2质量损失/g菌株Y3 菌株Y7 菌株XR 菌株Y28 菌株Y41 8.69±0.08a 2.80±0.68a 0.39±0.07b 0.36±0.06b 0.40±0.05b 0.35±0.06b 0.32±0.03b 8.57±0.21ab 2.71±0.24a 0.40±0.38b 0.39±0.02b 0.40±0.04b 0.35±0.05b 0.30±0.10b 8.09±0.26b 3.26±0.37a 0.42±0.02b 0.36±0.02b 0.41±0.01b 0.33±0.04b 0.33±0.06b 8.44±0.35ab 2.89±0.43a 0.40±0.03b 0.36±0.06b 0.36±0.04b 0.33±0.03b 0.29±0.08b 3.62±0.27c 3.40±0.71a 2.51±0.58a 1.49±0.39a 1.34±0.24a 1.07±0.07a 1.04±0.03a
酵母菌在适宜的条件下生长的更佳,能提高生产效率。酒精度、pH、糖浓度、SO2等因素均能影响酵母菌的生长。依据28 ℃静置培养48 h杜氏小管中产气量更多说明耐受能力更强的标准,筛选具有优良耐受性能的酵母菌株。本试验以商业酿酒酵母XR为对照,测定筛选菌株在不同梯度酒精度、糖浓度、SO2添加量以及pH条件下耐受性,结果见表4。
表4 筛选菌株的耐受性试验结果
Table 4 Tolerance tests results of screenned strains
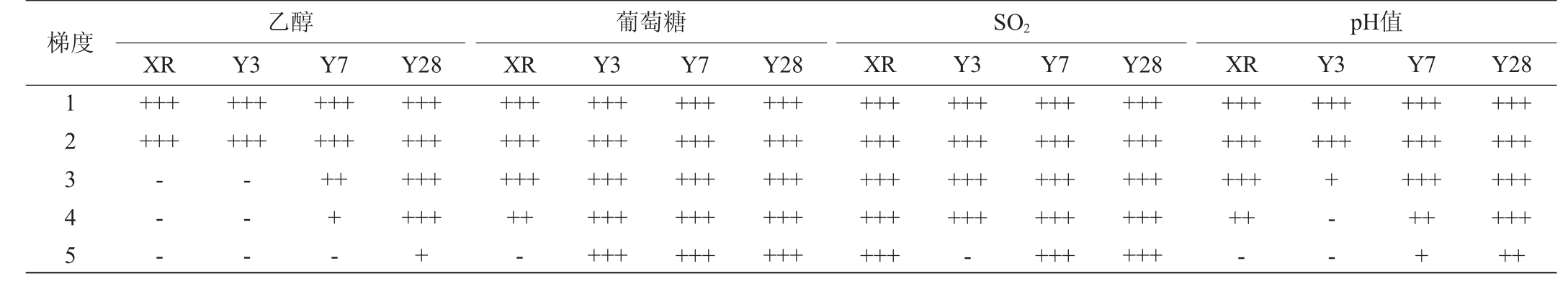
梯度12345乙醇XR Y3 Y7++++++++++++-- --- -+++++++++-葡萄糖XR Y3 Y7 Y28 Y28 Y28 SO2 XR Y3 Y7++++++++++++++++++++++++-++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++-++++++++++++++++++++++++++++++pH值XR Y3 Y7 Y28+++++++++++-+++++++- -++++++++++++++++++++++++++
由表4可知,3株筛选菌株在400 g/L葡萄糖浓度时杜氏小管中产气满体积,具有一样的耐受性,均优于菌株XR。与菌株Y3相比,菌株Y7和Y28在体积分数为18%乙醇、350mg/L SO2、pH 2.0条件下具有更强的耐受性。本研究筛选的2株酿酒酵母能耐受400 g/L葡萄糖、350 mg/L SO2、pH 2.0环境,与前人研究结果[17-18]相似。
在NCBI网站上将菌株Y7和Y28的26S rDNA基因测序结果进行序列相似性比对,用MEGA7.0软件构建系统发育树,结果见图1。由图1可知,菌株Y7的26S rDNA基因片段与酿酒酵母(Saccharomyces cerevisiae)相似性为100.00%,菌株Y28的26S rDNA基因片段与酿酒酵母(Saccharomyces cerevisiae)相似性达到99.83%。因此,菌株Y7和Y28均被鉴定为酿酒酵母(Saccharomyces cerevisiae)。

图1 基于26S rDNA基因序列菌株Y7和Y28的系统发育树
Fig.1 Phylogenetic tree of strains Y7 and Y28 based on 26S rDNA gene sequences
以商业酿酒酵母XR为对照,对菌株Y7和Y28酿造赤霞珠干红葡萄酒酒样进行理化指标测定,结果见表5。由表5可知,本土酿酒酵母Y7和Y28发酵酒样理化指标均在正常范围,符合国标GB/T 19504—2008《地理标志产品贺兰山东麓葡萄酒》要求。与商业酿酒酵母XR相比,菌株Y7和Y28发酵酒样的酒精度、总酸、总SO2、游离SO2含量和pH无显著差异(P>0.05)。菌株Y7发酵酒样的挥发酸含量最高,为0.36g/L,显著高于商业菌株XR和菌株Y28(P<0.05)。挥发酸一定程度上能为葡萄酒提供香气,但其含量过高时因出现醋味、酸味而影响葡萄酒整体香气,一般葡萄酒中挥发酸含量应≤1.2 g/L[19]。
表5 不同酿酒酵母菌株发酵赤霞珠葡萄酒的基础理化指标分析结果
Table 5 Analysis results of basic physicochemical indexes of Cabernet Sauvignon wines fermented by different Saccharomyces cerevisiae strains
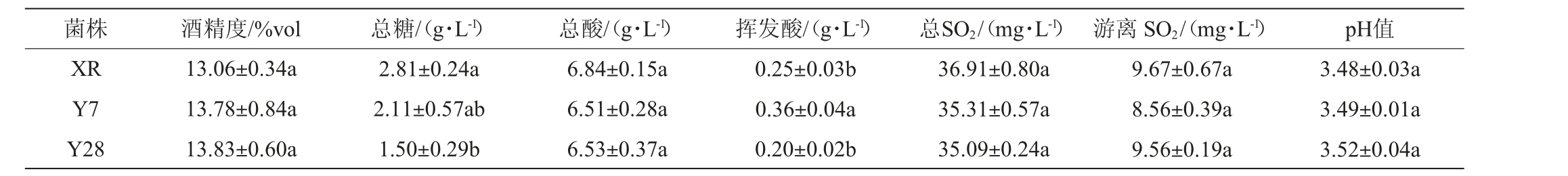
注:同列不同小写字母不同表示差异显著(P<0.05)。下同。
菌株 酒精度/%vol 总糖/(g·L-1) 总酸/(g·L-1) 挥发酸/(g·L-1) 总SO2/(mg·L-1) 游离SO2/(mg·L-1) pH值XR Y7 Y28 13.06±0.34a 13.78±0.84a 13.83±0.60a 2.81±0.24a 2.11±0.57ab 1.50±0.29b 6.84±0.15a 6.51±0.28a 6.53±0.37a 0.25±0.03b 0.36±0.04a 0.20±0.02b 36.91±0.80a 35.31±0.57a 35.09±0.24a 9.67±0.67a 8.56±0.39a 9.56±0.19a 3.48±0.03a 3.49±0.01a 3.52±0.04a
挥发性香气物质的种类和含量是衡量葡萄酒品质的重要指标之一,差异化的香气特征是不同葡萄酒品质判断的重要表征[20]。以商业酿酒酵母XR为对照,本土酿酒酵母菌株Y7和Y28发酵赤霞珠干红葡萄酒酒样挥发性香气成分见表6。由表6可知,在3种赤霞珠干红葡萄酒样品中共检测出48种挥发性香气化合物,其中酯类18 种、醇类15 种、酸类5种及其他类10种。商业酿酒酵母XR酿造酒样中共检出挥发性香气成分52种,其中酯类18种、醇类15种、酸类5种、酮醛类4种及其他类10种。菌株Y7酿造的酒样中共检出50种挥发性香气化合物,其中酯类18种、醇类15种、酸类5种、酮醛类4种及其他类8种。菌株Y28酿造的酒样中共检出49种挥发性香气成分,其中酯类18种、醇类14种、酸类5种、酮醛类4种及其他类8种。
表6 不同酿酒酵母菌株发酵赤霞珠葡萄酒中挥发性香气物质的含量和气味活性值分析
Table 6 Analysis of contents and odor activity values of volatile aroma substances in Cabernet Sauvignon wines fermented by different Saccharomyces cerevisiae strains
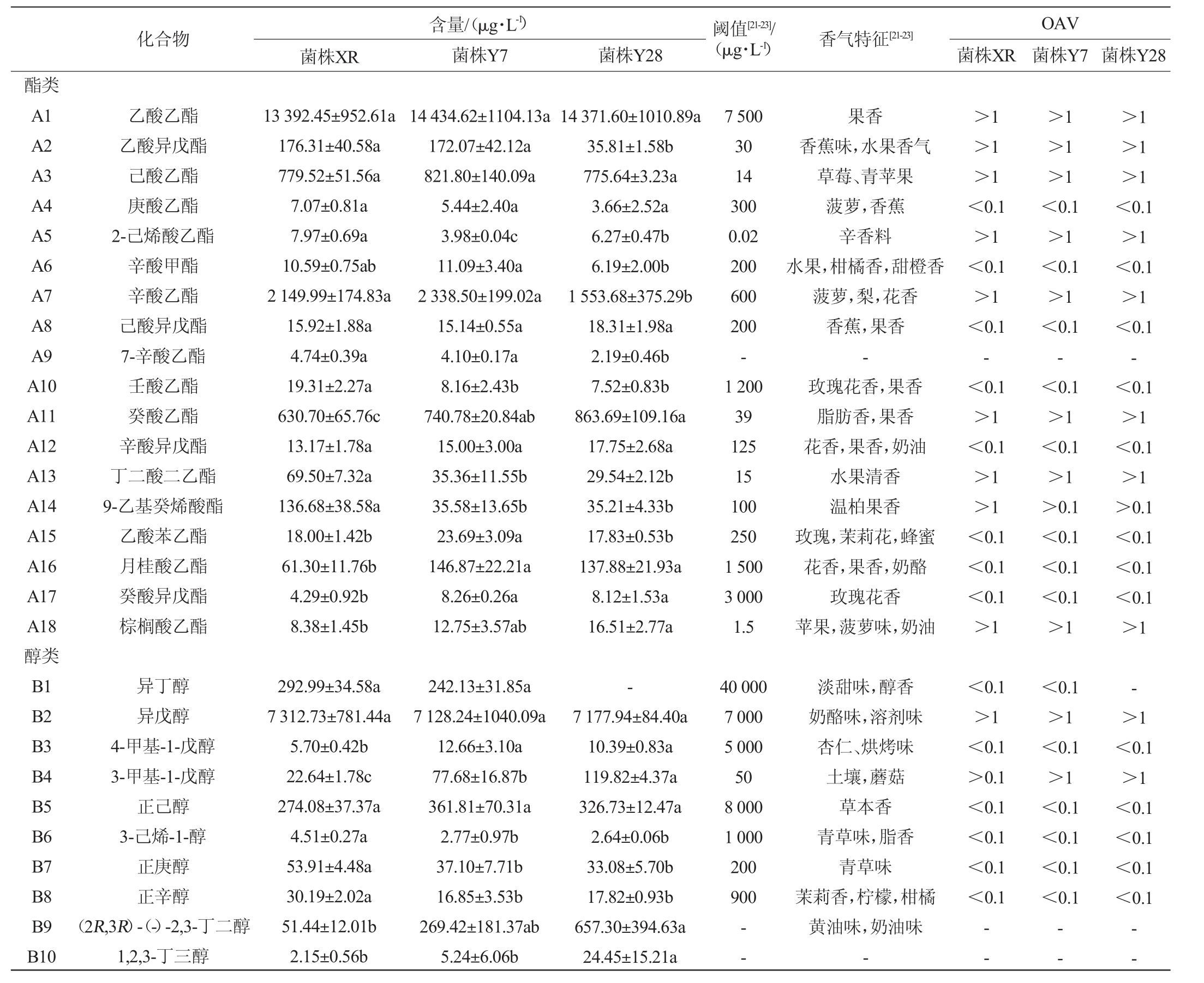
化合物 阈值[21-23]/(μg·L-1) 香气特征[21-23]菌株XR含量/(μg·L-1)菌株Y7 菌株Y28 菌株XR酯类A1 A2 A3 A4 A5 A6 A7 A8 A9 A10 A11 A12 A13 A14 A15 A16 A17 A18醇类B1 B2 B3 B4 B5 B6 B7 B8 B9 B10乙酸乙酯乙酸异戊酯己酸乙酯庚酸乙酯2-己烯酸乙酯辛酸甲酯辛酸乙酯己酸异戊酯7-辛酸乙酯壬酸乙酯癸酸乙酯辛酸异戊酯丁二酸二乙酯9-乙基癸烯酸酯乙酸苯乙酯月桂酸乙酯癸酸异戊酯棕榈酸乙酯13 392.45±952.61a 176.31±40.58a 779.52±51.56a 7.07±0.81a 7.97±0.69a 10.59±0.75ab 2 149.99±174.83a 15.92±1.88a 4.74±0.39a 19.31±2.27a 630.70±65.76c 13.17±1.78a 69.50±7.32a 136.68±38.58a 18.00±1.42b 61.30±11.76b 4.29±0.92b 8.38±1.45b 14 434.62±1104.13a 172.07±42.12a 821.80±140.09a 5.44±2.40a 3.98±0.04c 11.09±3.40a 2 338.50±199.02a 15.14±0.55a 4.10±0.17a 8.16±2.43b 740.78±20.84ab 15.00±3.00a 35.36±11.55b 35.58±13.65b 23.69±3.09a 146.87±22.21a 8.26±0.26a 12.75±3.57ab 14 371.60±1010.89a 35.81±1.58b 775.64±3.23a 3.66±2.52a 6.27±0.47b 6.19±2.00b 1 553.68±375.29b 18.31±1.98a 2.19±0.46b 7.52±0.83b 863.69±109.16a 17.75±2.68a 29.54±2.12b 35.21±4.33b 17.83±0.53b 137.88±21.93a 8.12±1.53a 16.51±2.77a 7 500 30 14 300 0.02 200 600 200-1 200 39 125 15 100 250 1 500 3 000 1.5果香香蕉味,水果香气草莓、青苹果菠萝,香蕉辛香料水果,柑橘香,甜橙香菠萝,梨,花香香蕉,果香-玫瑰花香,果香脂肪香,果香花香,果香,奶油水果清香温柏果香玫瑰,茉莉花,蜂蜜花香,果香,奶酪玫瑰花香苹果,菠萝味,奶油>1>1>1<0.1>1<0.1>1<0.1-<0.1>1<0.1>1>1<0.1<0.1<0.1>1异丁醇异戊醇4-甲基-1-戊醇3-甲基-1-戊醇正己醇3-己烯-1-醇正庚醇正辛醇(2R,3R)-(-)-2,3-丁二醇1,2,3-丁三醇292.99±34.58a 7 312.73±781.44a 5.70±0.42b 22.64±1.78c 274.08±37.37a 4.51±0.27a 53.91±4.48a 30.19±2.02a 51.44±12.01b 2.15±0.56b 242.13±31.85a 7 128.24±1040.09a 12.66±3.10a 77.68±16.87b 361.81±70.31a 2.77±0.97b 37.10±7.71b 16.85±3.53b 269.42±181.37ab 5.24±6.06b-7 177.94±84.40a 10.39±0.83a 119.82±4.37a 326.73±12.47a 2.64±0.06b 33.08±5.70b 17.82±0.93b 657.30±394.63a 24.45±15.21a 40 000 7 000 5 000 50 8 000 1 000 200 900<0.1>1<0.1>0.1<0.1<0.1<0.1<0.1--淡甜味,醇香奶酪味,溶剂味杏仁、烘烤味土壤,蘑菇草本香青草味,脂香青草味茉莉香,柠檬,柑橘黄油味,奶油味---OAV菌株Y7 菌株Y28>1>1>1<0.1>1<0.1>1<0.1-<0.1>1<0.1>1>0.1<0.1<0.1<0.1>1>1>1>1<0.1>1<0.1>1<0.1-<0.1>1<0.1>1>0.1<0.1<0.1<0.1>1<0.1>1<0.1>1<0.1<0.1<0.1<0.1->1<0.1>1<0.1<0.1<0.1<0.1——
续表

注:同行不同小写字母表示差异显著(P<0.05);-:未检测到该物质或未查到相关资料。
化合物 阈值[21-23]/(μg·L-1) 香气特征[21-23]菌株XR含量/(μg·L-1)菌株Y7 菌株Y28 菌株XR OAV菌株Y7 菌株Y28 B11 B12 B13 B14 B15酸类C1 C2 C3 C4 C5酮醛类D1 D2 D3 D4其他类E1 E2 E3 E4 E5 E6 1-癸醇正壬醇3-甲硫基丙醇苯甲醇苯乙醇乙酸2-甲基己酸己酸辛酸正癸酸乙醛庚醛3-羟基丁醛仲辛酮壬醛β-大马士酮香茅醇正十二烷十三烷γ-丁内酯11.22±0.86a 18.36±0.75a 17.35±1.65ab 8.73±0.75b 1 904.63±255.11b 56.71±3.64b 32.57±1.41a 66.09±9.34a 85.20±17.95c 7.57±3.62b 33.56±20.48a 4.18±0.29b 1.73±0.37b 13.67±0.22a 3.95±0.37b 6.64±0.93a 9.60±0.98a 6.77±0.25 6.22±1.57 10.78±1.42b 6.53±1.38b 15.57±3.31a 11.18±3.79b 7.72±2.83b 3 507.24±859.76a 238.20±56.97a 43.05±11.85a 117.38±41.59a 190.43±10.89a 17.59±7.27a 18.64±4.39a 5.51±0.46a 3.84±1.45a 17.35±2.02a 7.30±1.43a 7.67±2.58a 5.51±0.95b--14.13±2.02ab 6.39±0.40b 15.39±0.78a 19.74±5.79a 14.45±2.95a 3 343.27±586.01a 181.81±13.62a 37.33±2.06a 101.96±17.69a 133.18±22.68b 10.60±1.78ab 17.16±6.81a 5.47±0.16a 3.09±0.54ab 16.39±3.71a 7.60±1.05a 5.62±0.24a 5.57±0.33b--22.95±8.01a 400--200 000 1 400 200 000-420 500 1 000-- - - - 4 0- -玫瑰、橙花脂肪味,生青味-果香、烘烤、甜味玫瑰、花香醋酸味、辛辣味-奶酪味,腐臭奶酪味,涩味酸腐味,脂肪味醇味,乙醛味脂肪味,柑橘,酸败-果香,花香玫瑰,柑橘,油脂味花香味,甜味,蜂蜜味青草,柠檬,丁香花烷烃味-焦糖味,甜味<0.1--<0.1>1<0.1->0.1>0.1<0.1-- - - - ->0.1-- -<0.1--<0.1>1<0.1->1>0.1<0.1-- - - - ->0.1-- -<0.1--<0.1>1<0.1->1>0.1<0.1-- - - - ->0.1-- -
酯类物质能赋予葡萄酒愉悦的果香和花香,是葡萄酒香气中的重要贡献者[9],主要是在微生物酶催化作用和葡萄酒陈酿过程中产生。本试验中3株酿酒酵母发酵的酒样中酯类物质总含量有所差异,其中菌株Y7发酵酒样中的酯类总含量最高,为18833.19μg/L,菌株Y28次之,为17 907.42 μg/L,菌株XR的酯类总含量最低,为17 505.89 μg/L,说明筛选的本土酿酒酵母Y7和Y28具有与菌株XR相当的对葡萄酒香气贡献作用。3种赤霞珠葡萄酒酒样中,乙酸乙酯、乙酸异戊酯、己酸乙酯、2-己烯酸乙酯、辛酸乙酯、癸酸乙酯、丁二酸二乙酯、棕榈酸乙酯等化合物的OAV>1,是葡萄酒中花香及果香的关键香气物质。其中,菌株Y28发酵酒样中癸酸乙酯、棕榈酸乙酯等化合物的含量显著高于菌株XR和Y7(P<0.05)。
醇类物质是酵母细胞氨基酸代谢的副产物,在挥发性香气成分中的比重仅次于酯类物质,其对葡萄酒香气具有重要影响。当高级醇的含量<300 mg/L时,可增加葡萄酒香气的复杂性,但当其含量>400 mg/L时,却赋予葡萄酒刺激性的不良气味[24]。3种发酵酒样中,菌株Y28发酵酒样中醇类总含量最高,为12 014.76 μg/L,菌株Y7发酵酒样次之,为11 702.14 μg/L,菌株XR发酵酒样中醇类总含量最低,为10 010.64 μg/L。由表5可知,醇类物质中异戊醇、苯乙醇等化合物的OAV>1,是影响葡萄酒香气的主要高级醇,对葡萄酒香气贡献较明显,赋予葡萄酒奶酪香味、甜味和玫瑰花香等令人愉悦的气味。这与李婷[25]研究结果一致。具有玫瑰花味和甜味的苯乙醇在菌株Y7和Y28发酵酒样中显著高于菌株XR发酵酒样(P<0.05)。具有典型草本香的正己醇的含量在菌株Y7和Y28发酵酒样中高于XR发酵酒样,此外赋予葡萄酒黄油味和奶油味的(2R,3R)-(-)-2,3-丁二醇,其含量在菌株Y7和Y28发酵酒样中也高于菌株XR发酵酒样,并在菌株Y28发酵酒样中显著高于菌株XR发酵酒样(P<0.05),这也更好的说明本土酿酒酵母更具有典型的风味特征,菌株Y28可能具有地域性特征潜质。
酸类物质能够增加葡萄酒中黄油、奶酪等风味特征[8],本研究中本土酿酒酵母Y7和Y28发酵酒样中酸类含量均高于菌株XR的含量,但无显著差异(P>0.05)。由于酸类阈值较高,0.1<OAV<1.0,对葡萄酒香气贡献不突出,属于潜在香气的贡献者。酮醛类物质和其他类物质均会影响葡萄酒复杂的风味和香气。本试验中,本土酿酒酵母发酵的酒样中,带有玫瑰、柑橘、油脂味的壬醛和具有焦糖味、甜味的γ-丁内酯的含量均显著高于商业酵母XR的含量(P<0.05)。但在相关研究中未见本土酿酒酵母发酵产品中γ-丁内酯的相关报道。
选择OAV>0.1的15种挥发性香气物质进行聚类分析,结果见图2。由图2可知,与菌株XR相比,2株本土酿酒酵母Y7和Y28发酵酒样中癸酸乙酯、棕榈酸乙酯、3-甲基-1戊醇、苯乙醇、己酸、辛酸等挥发性香气物质含量较高,本土酿酒酵母Y7和Y28发酵酒样与商业酵母XR发酵酒样香气特征存在差异,但菌株Y7和Y28发酵酒样间香气特征无明显差异。这说明2株本土酿酒酵母与商业酵母XR在香气特征上具有明显差异性,而本土酵母间无香气特征差异。
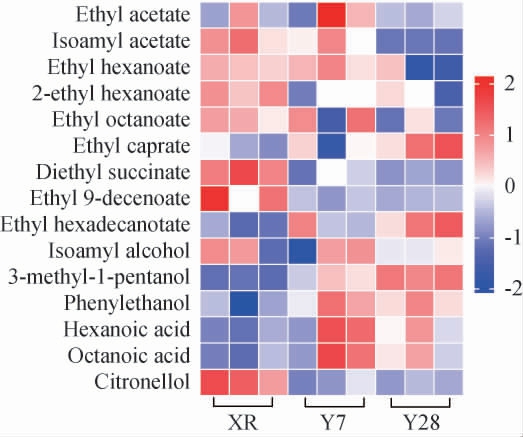
图2 不同酿酒酵母发酵赤霞珠葡萄酒中挥发性香气成分聚类分析
Fig.2 Cluster analysis of volatile aroma components in Cabernet Sauvignon wines fermented by different Saccharomyces cerevisiae
本研究从宁夏贺兰山东麓葡萄种植区的鲜食葡萄表皮及自然发酵醪液中分离得到46株酵母菌,复筛获得2株发酵速度快、高产乙醇以及能耐受体积分数18%乙醇、400 g/L葡萄糖、350 mg/L SO2、pH 2.0环境的菌株Y7和Y28。利用26S rDNA D1/D2基因序列分析进行分类鉴定,菌株Y7和Y28均被鉴定为酿酒酵母(Saccharomyces cerevisiae)。菌株Y7发酵酒样的挥发酸含量最高,显著高于商业菌株XR和菌株Y28(P<0.05)。菌株Y7和Y28发酵酒样中挥发性香气化合物总含量均高于XR发酵的酒样。聚类分析结果表明,本土酿酒酵母Y7和Y28发酵酒样与商业酵母XR发酵酒样香气特征存在差异。本试验筛选的2株优良本土酿酒酵母Y7和Y28,具有一定的潜力酿造产区特色葡萄酒,丰富了宁夏贺兰山东麓葡萄酒产区本土酿酒酵母微生物资源,同时为进一步挖掘产区优良本土酿酒酵母提供理论指导。
[1]CAPECE A, PIETRAFESA R, SIESTO G, et al.Selected indig enous Saccharomyces cerevisiae strains as profitable strategy to preserve typical traits of Primitivo wine[J].Fermentation,2019,5(4):87.
[2]LYONS S M,MORGAN S C,MCCANN S,et al.Unique volatile chemical profiles produced by indigenous and commercial strains of Saccharomyces uvarum and Saccharomyces cerevisiae during laboratory-scale Chardonnay fermentations[J].OENO One,2021,55(3):101-122.
[3]李婧.冰葡萄酒发酵过程中酵母菌群落演潜规律及优良菌株的筛选[D].大连:大连理工大学,2020.
[4]CHEN Y,JIANG J,SONG Y Y,et al.Yeast diversity during spontaneous fermentations and oenological characterization of indigenous Saccharomyces cerevisiae for potential as wine starter cultures[J].Microorganisms,2022,10(7):1455.
[5]叶冬青,孙悦,李莹,等.本土酿酒酵母与商业酵母混菌发酵特性研究[J].中国食品学报,2021,21(4):90-98.
[6]刘宁.本土酿酒酵母对葡萄酒质量的影响及优良菌株的筛选[D].杨凌:西北农林科技大学,2015.
[7]ZHANG Z,ZHANG Q C,YANG H,et al.Bacterial communities related to aroma formation during spontaneous fermentation of 'cabernet sauvignon'wine in Ningxia,China[J].Foods,2022,11(18):2775.
[8]周桂珍,杨伟明,杨建兴,等.宁夏贺兰山东麓葡萄酒酵母菌的筛选及应用[J].微生物学通报,2023,50(2):553-572.
[9]巩丽莉,周迪,卢玲,等.贺兰山东麓优良本土酿酒酵母筛选及发酵特性分析[J].微生物学通报,2023,50(9):4021-4044.
[10]张家晨.宁夏贺兰山东麓葡萄酒产区微生物多样性研究及菌库的建立[D].林芝:西藏农牧学院,2021.
[11]赵雪平,温雅娇,李正英,等.内蒙古乌海地区果园及发酵醪液中酿酒酵母菌的筛选[J].食品与发酵工业,2020,46(11):178-183.
[12]王志恒,刘亚琴,冯翠娥,等.宁夏贺兰山东麓酿酒酵母筛选及菌株鉴定[J].食品研究与开发,2017,38(11):176-180.
[13]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 15038—2006 葡萄酒、果酒通用分析方法[S].北京:中国标准出版社,2006.
[14]郭静娴,谢涵,华玉波,等.不同酵母对赤霞珠桃红葡萄酒香气的影响[J].中国酿造,2021,40(4):50-55.
[15]LAN Y B,XIANG X F,QIAN X,et al.Characterization and differentiation of key odor-active compounds of 'Beibinghong' icewine and dry wine by gas chromatography-olfactometry and aroma reconstitution[J].Food Chem,2019,287:186-196.
[16]ZHU J C,NIU Y W,XIAO Z B.Characterization of the key aroma compounds in laoshan green teas by application of odour activity value(OAV), gas chromatography-mass spectrometry-olfactometry(GC-MS-O)and comprehensive two-dimensional gas chromatography mass spectrometry(GC×GC-qMS)[J].Food Chem,2021,339:128136.
[17]乔喜玲.干红葡萄酒酿酒酵母的优选及其酿酒特性研究[D].呼和浩特:内蒙古农业大学,2020.
[18]何曼.昌黎产区野生酵母多样性及其发酵特性分析[D].秦皇岛:河北科技师范学院,2019.
[19]姚圣圣.果香型酿酒酵母在不同产区红葡萄酒中的应用研究[D].烟台:烟台大学,2022.
[20]冯丹萍,何荣荣,程思琦,等.本土酵母NX11424对赤霞珠葡萄酒发酵中酵母菌多样性及香气成分的影响[J].微生物学通报,2022,49(9):3722-3739.
[21]夏鸿川,张众,孙丽君,等.混菌发酵对贺兰山东麓‘赤霞珠’干红葡萄酒香气的影响[J].食品科学,2022,43(14):165-175.
[22]李伟,张众,王礼,等.贺兰山东麓‘美乐’自然发酵干红葡萄酒品质特性[J].食品科学,2022,43(8):204-212.
[23]LIANG L H,MA Y W,JIANG Z Z,et al.Dynamic analysis of microbial communities and flavor properties in Merlot wines produced from inoculation and spontaneous fermentation[J].Food Res Int,2023,164:112379.
[24]LIU P T,LU L,DUAN C H,et al.The contribution of indigenous non-Saccharomyces wine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J].LWT-Food Sci Technol,2016,71:356-363.
[25]李婷.本土酿酒酵母的优选及其干红葡萄酒品质分析[D].呼和浩特:内蒙古农业大学,2019.