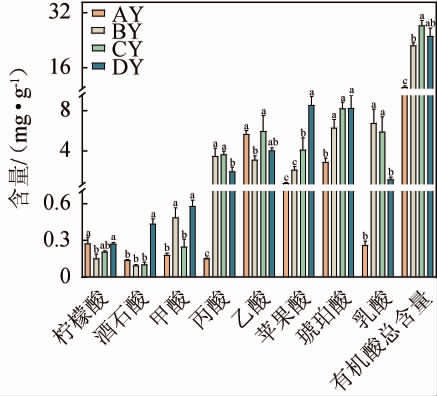
图1 高温大曲发酵过程中有机酸含量变化及差异分析
Fig.1 Change and differential analysis of organic acid contents of high-temperature Daqu during fermentation process
AY、BY、CY、DY分别代表“入仓曲阶段”、“一翻曲阶段”、“二翻曲阶段”、“出仓曲阶段”;不同小写字母表示显著差异(P<0.05)。下同。
Analysis of flavor compounds of sauce-flavor high-temperature Daqu during fermentation process
高温大曲作为酱香型白酒的糖化发酵剂,其品质直接决定了酱香型白酒的质量和风味[1-2]。高温制曲是酱香型白酒独特的工艺之一,相较于其他酒曲,在发酵过程中品温可达60~70 ℃[3-4]。高温大曲以纯小麦为主要原料,其制曲过程主要包括将母曲与小麦混合,曲坯压制成型、入室发酵培养(约40 d)和贮曲保存(3~6个月)[5]。入室发酵培养包括四个关键工艺节点,分别是入仓曲阶段、一翻曲阶段、二翻曲阶段、出仓曲阶段[6]。
高温高湿的发酵条件促进了大曲独特微生物菌系和各种酿酒酶系的形成,最终赋予了高温大曲独特的风味特征[7]。在大曲发酵过程中,原料的分解产物、微生物的代谢产物和生物化学反应的产物,如氨基酸、还原糖、有机酸、挥发性成分等,直接或者间接地构成了酱香型白酒的风味成分[8-9]。大曲中的有机酸可以调控微生物的生长代谢,影响酵母和其他微生物的活性,进而影响大曲的发酵过程和最终的风味呈现[10]。氨基酸作为评价高温大曲质量的重要指标之一,其含量与曲香密切相关,含量越高曲香越纯正,含量较低可能导致曲味平淡[11],并为微生物的生长和代谢提供必要的氮源,也是大曲香气成分的重要前体物质[12]。挥发性成分是高温大曲的主要香气来源,赋予了大曲浓郁的曲香,而曲香是高温大曲质量的重要指标[13],其在酱香型白酒香气中起着重要作用,决定了酱香型白酒的质量和风味[14]。
目前,关于酱香型高温大曲风味物质的研究主要集中在不同类型、不同生产地域、不同等级和不同贮存时间等方面的分析[15-18],而对高温大曲发酵过程不同阶段的风味物质变化研究较少。YANG L等[15]通过采用全二维气相色谱飞行时间质谱(comprehensive two-dimensional gas chromatograpuy-time of flight-mass spectrometry,GC×GC-TOFMS)和超高效液相色谱-四级杆-飞行时间-质谱(ultra high performance liquid chromatography-qudropole-time of flightmass spectrometry,UPLC-Q-TOF-MS)技术结合理化性质揭示了不同颜色高温大曲的特性,共鉴定出647种化合物,其中芳香族和吡嗪类为主要挥发性物质,有机酸和氨基酸为主要非挥发性物质,基于变量重要性投影(variable importance in the projection,VIP)值(VIP>1)共筛选出48个差异标志物,用于区分不同颜色的大曲。JIN Y等[16]采用顶空固相微萃取结合气质联用技术(headspace solid phase microextraction and gas chromatography mass spectrometry,HS-SPME-GC-MS)对14个不同产区的酱香型成品曲进行分析,发现不同产区大曲的酯类、含氮类和芳香类物质含量具有显著差异。
本研究以不同发酵阶段的酱香型高温大曲为研究对象,采用高效液相色谱法(high performance liquid chromatography,HPLC)、超高效液相色谱串联质谱法(ultra performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)和顶空固相微萃取结合气相色谱质谱法(HS-SPME-GC-MS)分别测定高温大曲发酵过程中的有机酸、氨基酸和挥发性风味成分,探究酱香型高温大曲发酵过程不同阶段风味物质的变化规律及差异,为高温大曲生产的质量控制提供理论基础。
1.1.1 材料
大曲样品:贵州省仁怀市茅台镇酱香型白酒酒厂。选择3个大曲发酵培养车间进行样品采集。高温大曲样品分别在大曲培养过程的第0、7、14、40天采集,从曲房的上、中、下层随机抽取9个平行样品进行彻底混合,样品研磨成粉末进行彻底混合,转移到无菌袋作为每个时间点的代表性样品,共12个样品。大曲样品命名为AY(入仓曲阶段)、BY(一翻曲阶段)、CY(二翻曲阶段)和DY(出仓曲阶段)。
1.1.2 化学试剂
硫酸(色谱纯):天津科密欧有限公司;正构烷烃(C7~C30)混合对照品溶液、2-辛醇、柠檬酸、乳酸、酒石酸、甲酸、乙酸、丙酸、苹果酸、琥珀酸(均为色谱纯):上海麦克林生化科技股份公司;天冬氨酸(aspartic acid,Asp)、脯氨酸(proline,Pro)、甲硫氨酸(methionine,Met)、异亮氨酸(isoleucine,Ile)、苯丙氨酸(phenylalanine,Phe)、缬氨酸(valine,Val)、半胱氨酸(cysteine,Cys)、谷氨酸(glutamic acid,Glu)、组氨酸(histidine,His)、甘氨酸(glycine,Gly)、色氨酸(tryptophan,Try)、丙氨酸(alanine,Ala)、亮氨酸(leucine,Leu)、苏氨酸(threonine,Thr)、精氨酸(arginine,Arg)、丝氨酸(serine,Ser)、酪氨酸(tyrosine,Tyr)、谷氨酰胺(glutamine,Gln)、赖氨酸(lysine,Lys)、天冬酰胺(asparaginate,Asn)(均为色谱纯):上海阿拉丁生化科技股份公司;乙腈(色谱纯):德国Merck公司。所有标准品纯度>98.00%。
Agilent 1100高效液相色谱仪、HP-INNOWAX色谱柱(60 m×0.25 mm,0.25 μm):美国Agilent公司;Qtrap 5500型超高效液相色谱质谱仪:美国AB SCIEX公司;Trace 1300-ISQ气相色谱-质谱联用仪、自动进样器、Legend Micro 17型高速离心机:美国Thermo fisher公司;50/30 μm DVB/CAR/PDMS萃取头:美国Supelco公司;KQ-500DE型超声波清洗仪:昆山超声仪器有限公司;Vortex Genie2型涡旋振荡器:美国Scientific Industries公司;Aminex HPX-87H色谱柱(300 mm×7.8 mm,9 μm):美国伯乐公司;BEH Amide色谱柱(2.1 mm×100 mm,1.7 μm):美国沃特世公司。
1.3.1 有机酸的测定
有机酸的测定采用HPLC法[19],稍有修改。准确称取2 g曲粉置于50 mL 离心管中,加入40 mL稀硫酸(浓度为0.008 mol/L),静置1 h(30 ℃水浴),涡旋振荡10 min后,以12 000 r/min离心10 min后取上清液,稀释合适的倍数,最后经0.22 μm微孔滤膜过滤,利用HPLC进行测定,大曲样品重复测定3次。
HPLC条件:Aminex HPX-87H色谱柱(300 mm×7.8 mm,9 μm),流动相为稀硫酸(浓度为0.008 mol/L),柱温60 ℃,流速0.6 mL/min,检测波长为210 nm,进样量20 μL,每个样本的运行程序为30 min。
定性定量方法:根据有机酸单一标准品的保留时间来确定各有机酸的出峰时间与顺序从而进行有机酸定性分析。以标准品质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,采用峰面积外标法对大曲样品有机酸进行定量分析。
1.3.2 游离氨基酸的测定
游离氨基酸的测定采用UPLC-MS/MS法[20],稍有修改。准确称取0.1 g曲粉置于50 mL离心管中,加入20 mL体积分数为0.2%甲酸水溶液,振荡10 min,超声30 min,取2 mL上清液至2 mL离心管内,12 000 r/min离心10 min,经0.2%甲酸水溶液稀释到合适的倍数,吸取上清液1 mL至液相小瓶,利用UPLC-MS/MS进行测定,大曲样品重复测定3次。
UPLC条件:为BEH Amide色谱柱(2.1 mm×100 mm,1.7 μm),0.2%甲酸水溶液为水相、乙腈溶液为有机相。洗脱梯度条件:0.01~4.00 min:20%A,80%B;4.00~4.01 min:80%A,20%B;4.01~5.00min:20%A,80%B。流速0.30mL/min,柱温为40 ℃,进样体积为2 μL。MS条件:电子电离(electronic ionization,EI)源,正离子扫描,多反应监测(multiple reaction monitoring,MRM)模式;雾化气压力3.79 bar,辅助气压力3.79 bar,气帘气压力2.41 bar,离子源温度550 ℃。
定性定量方法:根据游离氨基酸单一标准品的保留时间来确定各游离氨基酸的出峰时间与顺序从而进行定性分析。以标准物质的质量浓度为横坐标、峰面积为纵坐标,绘制标准曲线。通过对比待测样品中游离氨基酸的峰面积与标准曲线,即可实现对大曲样品中游离氨基酸的定量分析。
1.3.3 挥发性风味成分的测定
挥发性风味成分的测定采用HS-SPME-GC-MS法[7],稍有修改。准确称取1.00 g曲粉置于20 mL顶空瓶中,加入质量浓度为0.8321 mg/mL 内标(2-辛醇)溶液5 μL,将顶空瓶密封拧紧。顶空瓶于60 ℃恒温条件下平衡5 min,萃取55 min后插入进样口,并在250 ℃下解吸5 min,进行GC-MS检测,大曲样品重复测定3次。
GC条件:HP-INNOWAX色谱柱(60 m×0.25 mm,0.25 μm),进样口温度250 ℃;升温程序:起始温度40 ℃,保持3 min;以3 ℃/min升至150 ℃,保持2 min;再以5 ℃/min速度升至230 ℃,保持10 min。载气为高纯氦气(He),流速1 mL/min,恒流模式。
MS条件:电子电离(electronic ionization,EI)源;电子能量70 eV,全扫描模式;传输线温度230 ℃,离子源温度250 ℃,质量扫描范围35~550 m/z。
定性定量方法:通过Xcalibur软件处理GC-MS实验数据,大曲挥发性风味化合物质谱图与美国国家标准技术研究所(National Institute of Standards and Technology,NIST)谱库和Wiley谱库比对,正反匹配度>800作为初步定性结果,进一步利用化合物的保留指数进行定性。采用内标法进行定量分析。
1.3.4 数据统计分析方法
利用Excel 2019软件对试验数据进行统计分析;利用GraphPad Prism 8.0.2和Origin 2022软件对试验数据进行绘图。使用SIMCA 14.1软件进行主成分分析(principal component analysis,PCA)、偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)及变量重要性投影(variable importance in projection,VIP),并利用GraphPad Prism 8.0.2对所测化合物进行显著性分析,以P<0.05且VIP>1为条件筛选潜在差异风味物质;利用TBtools 2.147绘制热图,表征差异物质在发酵过程中的变化规律。
由图1可知,有机酸总含量呈先升高后降低的趋势,在二翻曲阶段达到最大值。在不同发酵阶段,高温大曲有机酸总含量大小顺序依次为二翻曲阶段(CY:(28.29±1.43)mg/g)>出仓曲阶段(DY:(25.15±2.34)mg/g)>一翻曲阶段(BY:(22.43±0.82)mg/g)>入仓曲阶段(AY:(10.32±0.38)mg/g),其中BY、CY和DY样品中的有机酸总含量均显著高于AY样品(P<0.05)。

图1 高温大曲发酵过程中有机酸含量变化及差异分析
Fig.1 Change and differential analysis of organic acid contents of high-temperature Daqu during fermentation process
AY、BY、CY、DY分别代表“入仓曲阶段”、“一翻曲阶段”、“二翻曲阶段”、“出仓曲阶段”;不同小写字母表示显著差异(P<0.05)。下同。
不同发酵阶段均检出8种有机酸,各种有机酸具有不同的变化趋势,其含量在不同阶段之间具有显著差异(P<0.05)。如图1所示,柠檬酸和酒石酸含量在发酵过程中均呈先下降后上升的趋势,出仓时柠檬酸和酒石酸含量分别为(0.269±0.014)mg/g、(0.434±0.041)mg/g;甲酸含量在DY样品中达到最大值,为(0.576±0.052)mg/g;乙酸和丙酸是主要挥发性有机酸,均在CY样品中达到峰值,乙酸和丙酸分别为(5.94±1.55)mg/g、(3.62±0.36)mg/g;苹果酸、琥珀酸、乳酸是主要非挥发性有机酸。苹果酸和琥珀酸含量均在DY样品中达到最大值,分别为(8.52±0.86)mg/g、(8.21±1.27)mg/g;而乳酸含量呈先升高后降低,在BY样品中的含量最高,为(6.72±1.43)mg/g。研究表明,高温会提高乳酸菌的活性,这可能是BY和CY样品中乳酸含量显著高于AY样品的原因[21]。乙酸、丙酸、苹果酸、琥珀酸和乳酸是高温大曲发酵过程中的主要有机酸,它们的含量之和占各阶段有机酸总含量的90%以上,说明在发酵过程中具有显著的影响和重要性。乙酸和乳酸是酱香大曲中的重要风味物质[22]。乙酸和乳酸是白酒中的主要有机酸,乙酸主要起呈味作用,适量可使口感清爽,乳酸起呈味和助香作用,可使酒体更柔和且醇厚[23]。也有研究表明,非挥发性有机酸可以被用来区分不同香型的白酒,其中乳酸和琥珀酸是酱香型白酒的特征物质,柠檬酸和苹果酸是浓香型白酒的特征物质[24]。
由图2可知,高温大曲游离氨基酸总含量呈先增加后减少的趋势,在一翻曲阶段达到最大值。不同发酵阶段的高温大曲氨基酸总含量大小顺序为一翻曲阶段(BY:(27.61±1.69)mg/g>二翻曲阶段(CY:(27.23±3.90)mg/g)>出仓曲阶段(DY:(27.21±2.36)mg/g)>入仓曲阶段(AY:(3.78±0.12)mg/g),结果表明,一翻曲、二翻曲和出仓曲阶段中的氨基酸总含量均显著高于入仓曲(P<0.05)。
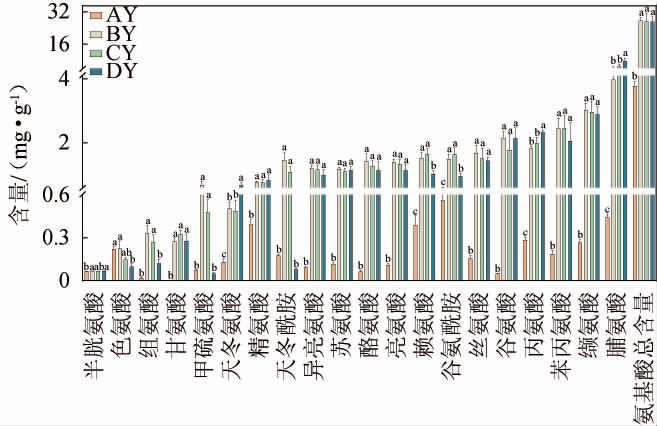
图2 高温大曲发酵过程中氨基酸含量变化
Fig.2 Changes of amino acid contents high-temperature Daqu during fermentation process
如图2所示,在不同发酵阶段高温大曲中检测到的氨基酸种类相似,共检测到20种游离氨基酸,其中,有19种是所有大曲样品中的共有氨基酸,在AY样品中未检测到甘氨酸。在整个发酵过程中,大多数氨基酸化合物含量均呈先上升后下降的趋势,并在BY或CY样品中达到最大值,各种游离氨基酸含量在不同发酵阶段之间存在显著差异(P<0.05)。脯氨酸、缬氨酸、苯丙氨酸、丙氨酸、赖氨酸、谷氨酰胺在整个发酵过程中的含量相对较高,其含量之和分别占各阶段游离氨基酸总量的56.15%(AY)、51.77%(BY)、57.04%(CY)和62.62%(DY);而半胱氨酸、色氨酸、组氨酸、甘氨酸含量则相对较低。其中谷氨酸、丝氨酸、谷氨酰胺、缬氨酸、丙氨酸和脯氨酸也是酱香型高温大曲中的主要氨基酸[20]。苯丙氨酸可代谢合成芳香族化合物(如苯乙酸和苯乙醛),这些化合物为酱香大曲提供花香和水果香[25]。
由图3可知,12个高温大曲样品中共检出116种挥发性风味成分,包括酯类55种、醇类10种、酸类10种、酮类8种、醛类12种、含氮类10种、芳香烃类3种、酚类2种及其他类化合物6种。由图3a可知,酱香型高温大曲在一翻曲和二翻曲阶段挥发性风味成分种类更多(BY:74种;CY:75种),入仓曲和出仓曲相对较少(AY:59种;DY:61种)。四个不同发酵阶段共有23种挥发性风味成分,AY、BY、CY、DY样品中的独有成分分别有16种、12种、7种和3种。
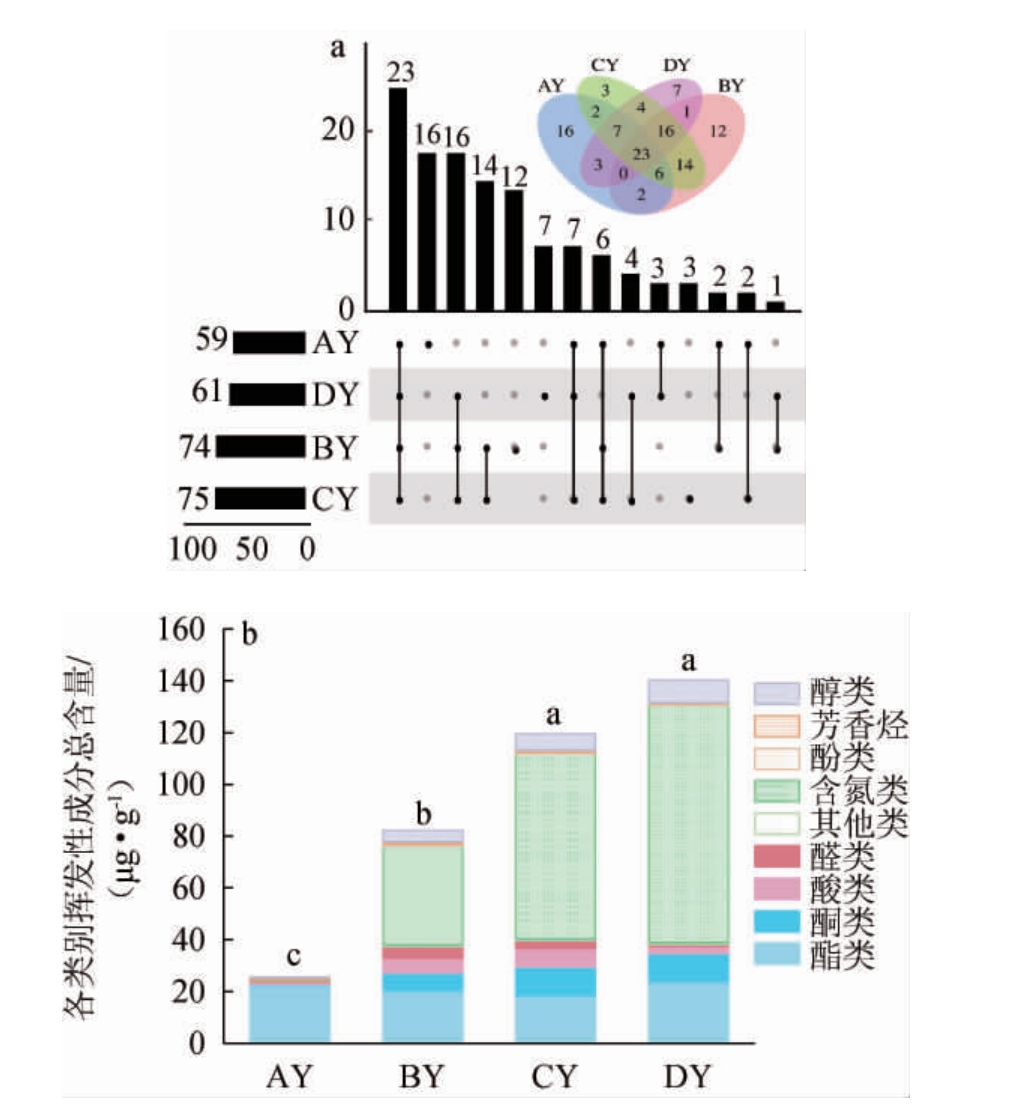
图3 高温大曲发酵过程中各类别挥发性风味物质数量(a)及含量(b)
Fig.3 Quantity (a) and contents (b) of various volatile flavor substances during high temperature Daqu fermentation process
由图3b可知,酱香型高温大曲挥发性风味成分总含量范围为25.65~140.21 μg/g。随着发酵进行,挥发性化合物总含量持续增加,在DY样品中含量最高,(140.21±17.38)μg/g。CY和DY样品中的挥发性成分总含量显著高于AY和BY样品(P<0.05)。在挥发性成分的具体组成上,主要以酯类、含氮类、醇类、酸类、醛类和酮类为主,但同一类别化合物的含量在不同发酵阶段大曲样品中的差异较大。酯类物质总含量呈先下降后上升的趋势,在DY样品中达到最大值(23.76±2.78)μg/g。与浓香型大曲和清香型大曲相似,酯类物质也是酱香型高温大曲中的主要挥发性成分[26];在BY、CY和DY样品中的醇类和酸类物质总含量均远高于AY样品;醛类和酮类物质总含量均呈先增加后减少的趋势;含氮类物质总含量呈持续上升,是BY、CY和DY样品中的主要组成部分,其含量在DY样品中达到最大值,为(91.71±13.40)μg/g。
对各类挥发性物质含量进行标准化处理并绘制热图,结果见图4。酯类物质是白酒香气的主要来源,对白酒的整体风味影响较大[27]。由图4a可知,整个发酵过程中,主要酯类为甲酯类,棕榈酸甲酯和亚油酸甲酯在高沸点酯类中相对含量较高,亚油酸乙酯和棕榈酸乙酯对白酒风味具有一定的贡献[28]。高沸点的酯类(长链脂肪酸酯)也是酱香型成品曲中的主要酯类物质[29]。己酸乙酯、乳酸乙酯等是主要中短链脂肪酸酯,其中乳酸乙酯仅存在于CY样品,己酸乙酯仅存在于BY和CY样品。己酸乙酯具有甜味和水果的香气特征,也是浓香型白酒主体香气成分,对浓香型白酒典型风格的塑造有重要作用[30]。
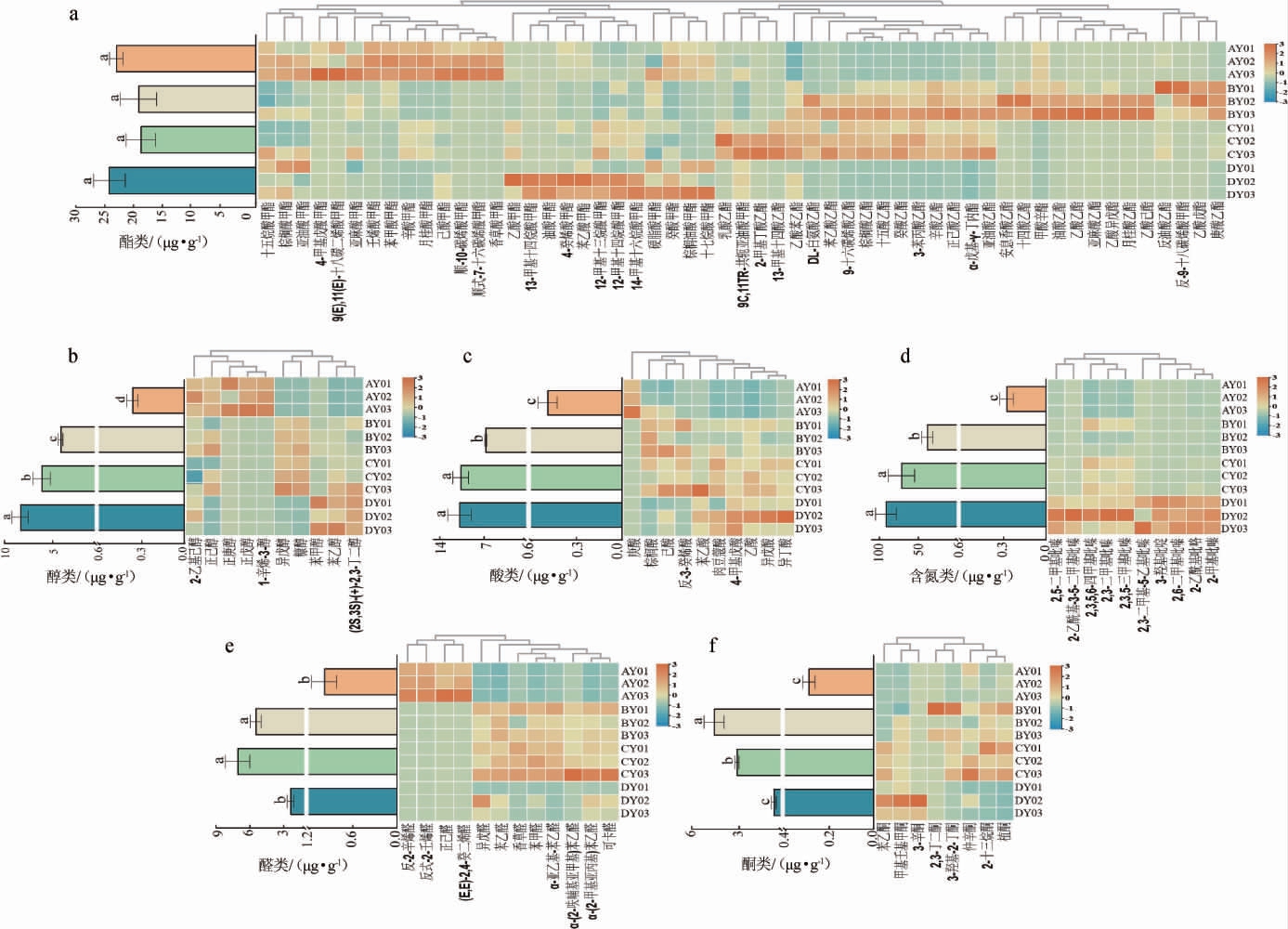
图4 高温大曲发酵过程中主要类别挥发性风味化合物含量变化
Fig.4 Changes of main categories volatile flavor compounds contents of high-temperature Daqu during fermentation process
(a)、(b)、(c)、(d)、(e)、(f)分别代表酯类、醇类、酸类、含氮类、醛类、酮类物质含量变化。
醇类化合物可增加酒体的甜度和醇厚感,同时也是形成酯类物质的前体物质之一,是香气连接的重要纽带[31]。由图4b可知,醇类物质总含量呈持续增加的趋势,在DY中达到最大值,为(8.71±0.72)μg/g,其在不同发酵阶段之间均存在显著差异(P<0.05)。1-辛烯-3-醇仅在AY样品中检出,具有强烈的蘑菇味和土腥味[32],也是青稞酒中的重要香气活性物质[33]。异戊醇和糠醇在BY和CY样品中较高,苯乙醇和(2S,3S)-(+)-2,3-丁二醇在DY样品中含量较高。苯乙醇是酱香大曲中的主要醇类物质之一,具有较强烈的甜香、玫瑰香和花香,是白酒中的重要风味化合物[34]。醇类中的高级醇(花香、水果香、甜香)是白酒中的重要风味成分,其含量过低时酒味寡淡,含量过高时有异杂味,容易导致饮后上头[35]。
酸类化合物是白酒中重要的风味物质,其含量过少会使酒味淡且余味短,含量过多则会使酸味过浓及酒味粗糙[36]。由图4c可知,酸类物质总量呈上升的趋势,在DY样品中达到峰值,为(11.18±1.85)μg/g,其在不同发酵阶段存在显著差异(P<0.05)。庚酸仅存在于AY样品;己酸、棕榈酸等在BY和CY样品中的含量较高;异戊酸在DY样品中的含量相对较高,是已报道的高温大曲中的重要挥发性化合物[38]。
含氮类化合物是白酒中重要的风味化合物,主要为吡嗪类化合物,对白酒的风味有重要贡献,同时具有健康功能活性[38]。由图4d可知,含氮类物质总量在不同发酵阶段存在明显差异(P<0.05)。10种含氮类化合物的含量均在DY样品中达到最大值,其中,2,3,5-三甲基吡嗪、2,3,5,6-四甲基吡嗪为主要含氮类物质,这两种物质被认为是“酱香”的主要贡献者[39]。2,3,5,6-四甲基吡嗪又称川芎嗪,其香味阈值低,是酱香型大曲和白酒中的重要风味物质,也是重要的健康因子[40]。2,3,5-三甲基吡嗪是酱香型白酒中的香气活性物质,具有焙烤、焦香、咖啡等香气特征,也是黑曲中含量较高的吡嗪类物质之一[41]。
醛酮类物质对白酒的香气具有提升作用,醛类是缩醛类的前体物质,使白酒更加飘逸,缩醛类赋予白酒清香柔和,而酮类赋予酒体绵柔细腻[42]。由图4e和4f可知,在整个发酵过程中,醛酮类总含量均呈先增加后减少的趋势,在BY和CY样品中的含量较高。反式-2-壬烯醛、正己醛和反-2-辛烯醛仅在AY样品中检出;3-羟基-2-丁酮在BY样品中的含量相对较高,具有令人愉悦的杏仁、奶油、椰子等香气,同时也是2,3,5,6-四甲基吡嗪的前体物质[43];苯乙醛在CY样品中的含量最高,具有玫瑰香和花香,是中高温大曲中的关键香气成分[44];3-辛酮仅在DY样品中检出。
为了直观体现高温大曲不同发酵阶段挥发性风味物质的差异以及筛选关键差异物质,建立PLS-DA模型,结果见图5。所有样本都在95%置信区间内,自变量拟合指数(R2X)为0.846,因变量拟合指数(R2Y)为0.979,预测能力(Q2)为0.965,表示模型拟合结果优秀,并且模型结果显示出样品组间的高区分度。由图5a可知,不同发酵阶段大曲样品被很好地分开,聚类趋势明显,AY和DY样品相离较远,表明样品间差异显著;BY和CY样品相离较近,表明样品间组成较相似。由图5b可知,通过置换检验(n=200)检测模型是否过拟合,图中左侧点均低于右侧点,R2截距为0.214(R2<0.45),Q2截距为-0.609(Q2<-0.05),验证建立的PLSDA模型有效,不存在过拟合[45]。为了进一步分析高温大曲发酵过程中的风味物质对区分不同发酵阶段的贡献率,进行VIP分析,VIP>1可认为该变量为判别模型的潜在差异物质[46],且VIP值越大说明该物质对判别的贡献越大[47]。由图5c可知,根据VIP>1和P<0.05的标准,共筛选出52种物质作为不同发酵阶段高温大曲样品潜在差异标志物,包括酯类21种、含氮类5种、醇类5种、酸类5种、醛类4种、酮类5种、氨基酸3种、酚类1种、芳香烃1种和其他类2种。
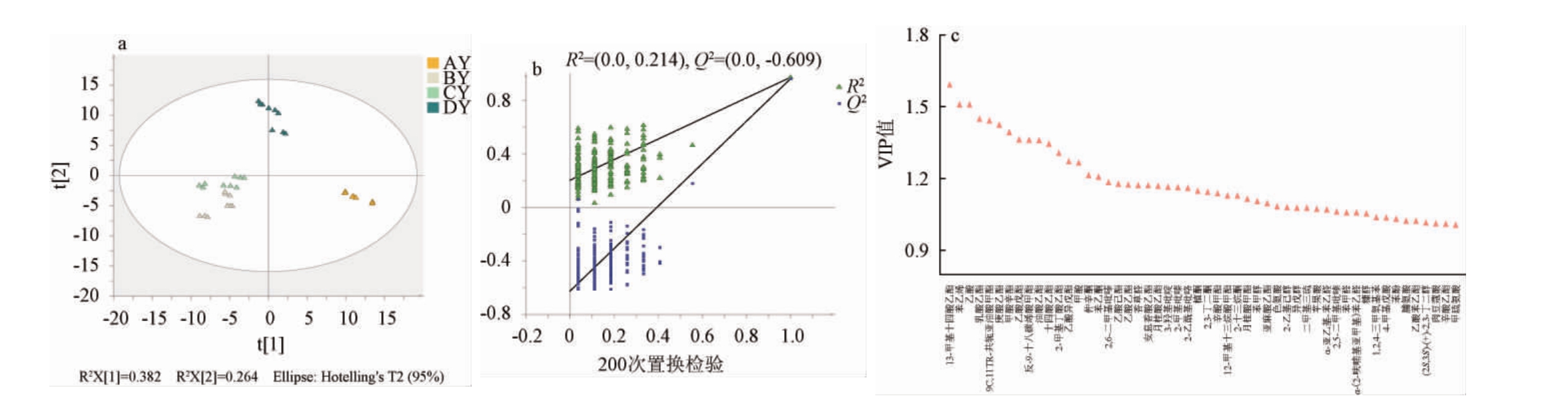
图5 不同发酵阶段高温大曲挥发性风味物质偏最小二乘判别分析
Fig.5 Partial least squares discriminant analysis of volatile flavor compounds of high-temperature Daqu during fermentation process
(a)、(b)、(c)分别代表PLS-DA得分图、置换检验、VIP值>1的化合物。
为了直观地看出不同发酵阶段大曲样品之间的差异,将这52种潜在差异标志物的定量数据用于聚类分析和主成分分析,结果见图6。

图6 潜在差异标志物聚类分析热图(a)和主成分分析得分图(b)
Fig.6 Cluster analysis heatmap (a) and principal component analysis score plot (b) of potential difference markers
由图6a可知,与其他阶段相比,AY样品中的辛酸甲酯、月桂酸甲酯和2-乙基己醇的含量较突出;大多数酯类物质,包括庚酸乙酯、乙酸戊酯、辛酸乙酯等,在BY样品中的含量较高。此外2,3-丁二酮、苯乙烯、色氨酸等多种物质也在BY样品中的含量较高。苯乙烯(汽油香、水果香)和乙酸戊酯(水果香、苹果香)是BY样品中的关键风味物质,VIP值分别为1.51和1.36,中高温成品大曲中的重要风味物质[48]。酯类和酮类物质,包括13-甲基十四酸乙酯、乳酸乙酯、仲辛酮、乙酸等多种物质的含量在CY样品中相对较高。13-甲基十四酸乙酯的VIP值最高(1.59),表明对判别的贡献最大。乳酸乙酯也具有较高的VIP值(1.44),具有浓郁的水果香、甜香,是清香型白酒的主要香气成分[49]。含氮类、酸类和醇类物质,包括2,6-二甲基吡嗪、2-甲基吡嗪、甲酸、苹果酸、苯甲醇和(2S,3S)-(+)-2,3-丁二醇等在DY样品中含量更高,此外脯氨酸、苯酚和二甲基三硫等物质在DY样品中的含量也相对较高。在这些差异物中,已有研究表明苯甲醛、乙酸、乙酸乙酯、异戊醇、2,6-二甲基吡嗪、乙酸异戊酯可作为酱香型高温大曲发酵过程中的差异标志物[7],此外脯氨酸也是区分不同颜色高温大曲的关键差异氨基酸[11]。乙酸是白酒中的关键风味物质,也是普通大曲的特征标志物。2,3-丁二酮、糠醇、2-甲基吡嗪、2-乙基己醇、2-乙酰基吡咯、苯酚、2-甲基丁酸乙酯等物质也是区分不同颜色高温大曲的关键标志物[15]。乙酸乙酯、戊酸乙酯、2-甲基丁酸乙酯、辛酸乙酯、乙酸是不同质量等级酱香型白酒中的关键标志物[50]。
由图6b可知,前两个主成分(PC1、PC2)解释了60.90%的总方差贡献率,不同发酵阶段大曲样品明确分为4组,表明VIP值和P值较高的风味物质是造成不同发酵阶段大曲样品风味物质组成差异的原因。其中,13-甲基十四酸乙酯、苯乙烯、乙酸、乳酸乙酯、9C,11TR-共轭亚油酸甲酯、庚酸乙酯、甲酸辛酯、乙酸戊酯、反-9-十八碳烯酸甲酯、油酸乙酯、十四酸乙酯、2-甲基丁酸乙酯在酱香型高温大曲发酵过程中的含量差异显著(P<0.05)且VIP值相对较高(VIP>1.30),因此,这12种化合物可作为区分酱香型高温大曲不同发酵阶段的关键差异物质。
本研究分析了酱香型高温大曲发酵过程不同发酵阶段有机酸、氨基酸和挥发性成分的动态变化和差异。结果表明,在整个发酵过程中,有机酸和氨基酸总含量呈先增加后减少的趋势,分别在二翻曲阶段和一翻曲阶段达到最大值,分别为(28.29±1.43)mg/g、(27.61±1.69)mg/g;而挥发性成分总含量持续增加,出仓时达到峰值[(140.21±17.38)μg/g]。乙酸、丙酸、琥珀酸、苹果酸和乳酸是大曲发酵过程中的主要有机酸,其含量之和占各阶段有机酸总量的90%以上。脯氨酸、缬氨酸、苯丙氨酸、丙氨酸、赖氨酸、谷氨酰胺是大曲样品中的主要氨基酸,其含量之和占不同发酵阶段氨基酸总量的50%以上。酯类物质是入仓曲阶段的主要挥发性成分;含氮类物质是一翻曲、二翻曲和出仓曲阶段的主要挥发性成分。各种风味物质在发酵过程中具有不同的变化趋势,其含量在不同发酵阶段之间存在显著差异(P<0.05)。通过差异分析筛选出52种潜在差异标志物用于区分不同发酵阶段高温大曲样品(VIP>1,P<0.05),聚类分析(CA)和主成分分析(PCA)结果表明,其中12种化合物是关键差异物质(VIP>1.30,P<0.05)。入仓曲阶段中的辛酸甲酯、月桂酸甲酯、2-乙基己醇含量较高;一翻曲阶段中的苯乙烯、乙酸戊酯、2,3-丁二酮等含量较高;二翻曲阶段中的13-甲基十四酸乙酯、乙酸、仲辛酮等含量较高;出仓曲阶段中的2,6-二甲基吡嗪、二甲基三硫、脯氨酸等含量较高。本研究为解析酱香型高温大曲发酵过程中的风味物质变化规律和各发酵阶段的差异分析提供参考依据,为解析大曲发酵机制提供了物系支持,并为高温大曲生产的质量控制提供理论依据。
[1]SHI W,CHAI L J,FANG G Y,et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Res Int,2022,156(7):111298.
[2]王琳,胡小霞,黄永光.茅台镇酱香型白酒不同生产轮次酿造环境的细菌菌群结构特征[J].食品科学,2021,42(22):185-192.
[3]YI Z L,JIN Y L,XIAO Y,et al.Unraveling the contribution of high temperature stage to Jiang-flavor Daqu,a liquor starter for production of Chinese Jiang-flavor Baijiu,with special reference to metatranscriptomics[J].Front Microbiol,2019,10:472.
[4]HUANG Y H,YI Z L,JIN Y L,et al.New microbial resource:microbial diversity,function and dynamics in Chinese liquor starter[J].Sci Rep,2017,7(1):14577.
[5]GAN S H,YANG F,SAHU S K,et al.Deciphering the composition and functional profile of the microbial communities in Chinese Moutai liquor starters[J].Front Microbiol,2019,10:1540.
[6]郭敏.基于高通量测序对酱香大曲制曲微生态多样性的研究[D].贵阳:贵州大学,2018.
[7]ZHU Q, CHEN L L, PENG Z, et al.Analysis of environmental driving factors on core functional community during Daqu fermentation[J].Food Res Int,2022,157(7):111286.
[8]WANG W Y,LIU R L,SHEN Y,et al.The potential correlation between bacterial sporulation and the characteristic flavor of Chinese Maotai liquor[J].Front Microbiol,2018,9:1435.
[9]WANG Y R,CAI W C,WANG W P,et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Sci Nutr,2021,9(2):1003-1016.
[10]云敏,周洪楷.有机酸在酱香型白酒酿造过程的调控作用[J].酿酒科技,2011(7):44-46.
[11]张巧玲,吕锡斌,秦兴,等.酱香型白酒高温大曲游离氨基酸比较分析[J].中国酿造,2019,38(4):53-57.
[12]吴钱弟,周榆林,王久明,等.酱香型白酒第四、五轮次基酒中游离氨基酸分析[J].中国酿造,2020,39(5):54-59.
[13]岳腾飞,李娜,梁伟伟,等.基于UPLC-MS和HS-SPME-GC-MS的浓香型大曲组分分析[J].酿酒,2023,50(2):82-88.
[14]MU Y,HUANG J,ZHOU R Q,et al.Exploring the response patterns of strong-flavor Baijiu brewing microecosystem to fortified Daqu under different pit ages[J].Food Res Int,2022,155(5):111062.
[15]YANG L, FAN W L, XU Y.GC×GC-TOF/MS and UPLC-Q-TOF/MS based untargeted metabolomics coupled with physicochemical properties to reveal the characteristics of different type daqus for making soy sauce aroma and flavor type Baijiu[J].LWT-Food Sci Technol,2021,146(12):111416.
[16]JIN Y, LI D Y, AI M, et al.Correlation between volatile profiles and microbial communities:A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Res Int,2019,121(7):422-432.
[17]沈世明,何猛超,刘桂珍,等.酱香型大曲贮存初期微生物及风味物质变化的分析研究[J].酿酒科技,2023(2):128-135.
[18]ZHANG Y D,DING F,CHENG W,et al.Characteristics of the microbiota and metabolic profile of high temperature Daqu with different grades[J].World J Microb Biot,2022,38(8):137.
[19]吴艳芳.山西老陈醋发酵过程微生物相互作用及有机酸代谢调控机制解析[D].天津:天津科技大学,2021.
[20]乔敏莎,王凡,山其木格,等.超高效液相色谱质谱法测定酱香型酒曲原料中氨基酸含量[J].食品与发酵工业,2023,49(12):278-284.
[21]ZHANG H X,WANG L,WANG H Y,et al.Effects of initial temperature on microbial community succession rate and volatile flavors during Baijiu fermentation process[J].Food Res Int,2021,141(3):109887.
[22]戴奕杰.酱香型白酒酿造过程中微生物群落组成及其与酒品质的关系[D].长沙:湖南农业大学,2021.
[23]张杰,程伟,潘天全,等.浓香型白酒风味成分研究现状及展望[J].酿酒,2019,46(1):29-32.
[24]王广南.白酒中不挥发性有机酸的分析及其对白酒风味影响的研究[D].北京:北京工商大学,2022.
[25]WANG Y P,WEI X Q,GUO X W,et al.Effect of the deletion of genes related to amino acid metabolism on the production of higher alcohols by Saccharomyces cerevisiae[J].Biomed Res Int,2020,2020:6802512.
[26]周晨曦,郑福平,李贺贺,等.白酒大曲风味物质研究进展[J].中国酿造,2019,38(5):6-12.
[27]黄魏,程平言,张健,等.酱香型白酒风味形成的影响因素及主体风味成分研究进展[J].酿酒科技,2020(4):85-93.
[28]丁力杰,唐云,赵亚雄,等.白酒中的重要酯类物质及主要来源研究现状[J].酿酒科技,2024(3):91-100,107.
[29]张小龙,邱树毅,王晓丹,等.酱香型大曲中挥发性成分与微生物代谢关系[J].中国酿造,2020,39(12):51-57.
[30]ZHANG G, XIE M X, KANG X Y, et al.Optimization of ethyl hexanoate production in Saccharomyces cerevisiae by metabolic engineering[J].LWT-Food Sci Technol,2022,170(18):114061.
[31]孙细珍,杜佳炜,黄盼,等.现代工艺和传统工艺酿造小曲清香型白酒感官表征及风味成分分析[J].食品科学,2021,42(6):282-290.
[32]郑佳,彭智辅,赵东.中国传统酿酒大曲的风味化学研究进展[J].酿酒科技,2017(3):89-94.
[33]QIAN Y P,AN Y Q,CHEN S,et al.Characterization of Qingke liquor aroma from tibet[J].J Agr Food Chem,2019,67(50):13870-13881.
[34]冯方剑,唐维川,杨官荣,等.不同产区酱香型大曲理化指标及风味成分的研究[J].酿酒,2023,50(5):29-36.
[35]STUPAK M, GOODALL I, TOMANIOVA M, et al.A novel approach to assess the quality and authenticity of Scotch Whisky based on gas chromatography coupled to high resolution mass spectrometry[J].Anal Chimica Acta,2018,1042(26):60-70.
[36]孙金沅,宫俐莉,刘国英,等.古井贡酒酒醅挥发性香气成分的GC-MS与GC-O分析[J].食品科学,2016,37(24):87-93.
[37]魏阳,张芮,张立强,等.小麦粉碎度与成品高温大曲理化和风味组分的相关性研究[J].食品与发酵工业,2024,50(20):181-189.
[38]丁海龙,沈小娟,宋川,等.中国白酒健康功能成分吡嗪类化合物研究进展[J].中国酿造,2022,41(9):8-12.
[39]王奕芳,周容,张明春,等.白酒中重要的功能化合物吡嗪的研究进展[J].酿酒,2018,45(6):20-24.
[40]卢延想.高温大曲中产香微生物的筛选及应用研究[D].天津:天津科技大学,2023.
[41]陈心雨,刘念,王超凯,等.高温大曲中美拉德反应的研究进展[J].食品与发酵科技,2023,59(6):109-112.
[42]黄琴,陈茂彬,丁安子,等.兼香型白酒贮存期挥发性成分变化规律[J].食品科学,2014,35(24):115-118.
[43]刘家欢,孙细珍,熊亚青,等.基于感官和化学分析技术解析不同产区酱酒风味特征[J].食品与发酵工业,2024,50(9):268-283.
[44]崔新莹.中高温大曲香气成分分析及评价模型的研究[D].济南:齐鲁工业大学,2023.
[45]YUN J,CUI C J,ZHANG S H,et al.Use of headspace GC/MS combined with chemometric analysis to identify the geographic origins of black tea[J].Food Chem,2021,360(27):130033.
[46]张晨霞,王国成,王超,等.普洱市不同产茶区普洱生茶香气成分差异性分析[J].食品研究与开发,2020,41(1):177-184.
[47]唐平,卢君,毕荣宇,等.赤水河流域不同地区酱香型白酒风味化合物分析[J].食品科学,2021,42(6):274-281.
[48]陶敏,明红梅,马世源,等.贮存时间对中高温大曲质量的影响[J].食品与发酵工业,2022,48(2):205-211.
[49]LI H H, ZHANG X, GAO X J, et al.Comparison of the aroma-active compounds and sensory characteristics of different grades of light-flavor Baijiu[J].Foods,2023,12(6):1238.
[50]王金龙,尹延顺,田栋伟,等.不同质量等级酱香白酒中风味物质及差异性分析[J].中国酿造,2024,43(1):41-49.