Determination of 6 flavonol glycosides in epimedium health wine by ultra-high performance liquid chromatography
淫羊藿(Epimedium brevicornu Maxim.)又称仙灵脾,是一种用药历史悠久的中药[1],可用于治疗肾阳虚衰、阳痿遗精、筋骨痿软、风湿痹痛、麻木拘挛等疾病[2]。现代研究表明,淫羊藿中含有黄酮[3-5]、多糖[6-7]、酚酸[8]、木脂素[9]、生物碱[10]等多种活性成分,具有免疫调节[11-12]、缓解体力疲劳[13-14]、改善心脑血管系统[15]、增强骨质[16-17]、抗肿瘤[18]、抗衰老[19]等药理作用。淫羊藿发挥药效作用的主要成分为黄酮醇苷类化合物,包括淫羊藿苷、朝藿定C、朝藿定B、朝藿定A、朝藿定A1、淫羊藿次苷Ⅱ等[20-21]。2020版《中国药典》已将淫羊藿药材的质量控制指标调整为总黄酮醇苷,并规定了朝藿定A、朝藿定B、朝藿定C、淫羊藿苷这四个指标的检测方法[2,22]。
保健酒是以单味或多味中药材为主要原料,使用白酒浸泡或者数字提取等方式对药材中的有效成分进行提取,制成具有特定功能的酒[23]。保健酒的原料除原酒及中药材外,还包含一些其他辅料,基质较为复杂[24]。同时保健酒的制作过程中按照一定的比例添加中药材,相较于药材本身而言,转移至酒体中的有效成分含量不高,因此需要使用灵敏度较高的仪器进行精准定性和定量。目前,保健酒中有效成分的检测方法主要有紫外可见分光光度法(ultraviolet-visible spectrophotometry,UV-VIS)、高效液相色谱法(high performance liquid chromatography,HPLC)、超高效液相色谱-串联质谱法(ultra high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)等。其中,UV-VIS法方法简单,但灵敏度相对较低;HPLC法的分离效率高、灵敏度高;UPLC-MS/MS法分析速度快、灵敏度高,但仪器价格昂贵、操作复杂;相较于高效液相色谱法,超高效液相色谱法(UPLC)的分离效率、分辨率、灵敏度更高。刘正才等[25]利用超高效液相色谱-串联质谱法,建立了保健酒中14黄酮类化合物含量同时测定的方法。由于淫羊藿特殊的药理作用,很多保健酒中添加有此味药材[26]。本研究的淫羊藿保健酒是以淫羊藿、枸杞子、肉桂等药材为主要原料,经数字化提取制备的具备缓解体力疲劳等保健功能的酒。检测淫羊藿苷、朝藿定C、朝藿定B、朝藿定A、朝藿定A1、淫羊藿次苷Ⅱ这6种黄酮醇苷对保证保健酒质量稳定具有重要意义。
本研究建立了超高效液相色谱法(UPLC)同时测定淫羊藿保健酒中淫羊藿苷、朝藿定C、朝藿定B、朝藿定A、朝藿定A1、淫羊藿次苷Ⅱ6种黄酮醇苷检测方法,以期为保健酒中黄酮醇苷检测方法的建立提供参考,为产品生产质量控制提供保障。
5批次淫羊藿复方保健酒(编号1~5):劲牌有限公司;朝藿定A1、朝藿定A、朝藿定B(纯度≥98%):成都德思特生物技术有限公司;朝藿定C(纯度94.3%)、淫羊藿苷(纯度98.1%)、淫羊藿次苷Ⅱ(纯度99.2%):中国食品药品检定研究院;甲酸、乙腈(均为色谱纯):美国赛默飞世尔科技有限公司;甲醇(分析纯):国药集团化学试剂有限公司。
MPE型高通量真空平行浓缩仪:睿科集团股份有限公司;AB135-S型十万分之一电子天平:瑞士梅特勒-托利多公司;Votex-3可调式涡旋混合器:上海嘉鹏科技有限公司;HLB固相萃取小柱(200 mg/6 mL):深圳逗点生物技术有限公司;Agilent ZORBAX Eclipse XDB-C18色谱柱(2.1 mm×150 mm,1.8 μm)、Agilent 1290型超高效液相色谱仪:美国安捷伦科技有限公司。
1.3.1 6种黄酮醇苷混合标准溶液的制备
精密量取适量淫羊藿苷、朝藿定C、朝藿定B、朝藿定A、朝藿定A1、淫羊藿次苷Ⅱ6种黄酮醇苷标准品于10 mL容量瓶中,加入一定体积的甲醇溶解并定容,使用涡旋混合器混合均匀,得到各标准品储备液质量浓度分别为190.903mg/L、154.973 mg/L、106.400 mg/L、45.864 mg/L、19.522 mg/L、4.474 mg/L。分别适量量取各标准储备液至25 mL容量瓶中,加甲醇定容,混合均匀,作为6种黄酮醇苷混合标准工作溶液,各成分的质量浓度分别为114.542 mg/L、92.984 mg/L、63.840 mg/L、27.518 mg/L、11.713 mg/L、2.684 mg/L。
1.3.2 黄酮醇苷的UPLC分析
样品预处理:使用移液管精密移取待测酒样10 mL于玻璃管中,利用高通量真空平行浓缩仪于50 ℃条件下水浴蒸发至近干(除去其中的乙醇),加入5 mL水溶解残渣,再用10 mL水洗涤,样品及洗涤液上样于经活化的HLB固相萃取小柱,依次使用30 mL水及5 mL体积分数5%甲醇洗柱(去除样品中的水溶性杂质),再用10 mL甲醇洗脱,收集洗脱液于玻璃管中,利用高通量真空平行浓缩仪于50 ℃条件下蒸干,精密加入2 mL体积分数50%甲醇充分溶解并混合均匀,过0.22 μm滤膜,装入液相小瓶,待测。
色谱条件:Agilent ZORBAX Eclipse XDB-C18色谱柱(2.1 mm×150 mm,1.8 μm);使用乙腈(A)-0.1%甲酸(B)作为流动相,梯度洗脱程序(0~10 min,20%~30%A;10~15 min,30%~50%A;15~20 min,50%A);柱温25 ℃;流速0.3 mL/min;进样量2 μL;检测波长270 nm。
定性定量分析:根据保留时间对待测酒样中的6种黄酮醇苷进行定性,采用外标法定量,通过建立峰面积与标准品溶液质量浓度的线性关系,计算酒样中目标化合物的含量。计算公式如下:
式中:cx为样品中各成分的含量,mg/L;cr为标准品质量浓度,mg/L;Ax为样品峰面积;Ar为标准品峰面积;5为样品浓缩倍数的换算系数。
1.3.3 方法学考察
线性范围、检出限、定量限考察:分别取适量淫羊藿苷、朝藿定C、朝藿定B、朝藿定A、朝藿定A1、淫羊藿次苷Ⅱ标准工作液,采用UPLC进行分析,得到各成分色谱图及峰面积,以标准品溶液质量浓度(X)为横坐标,峰面积(Y)为纵坐标,制作标准曲线,得到6种黄酮醇苷的标准曲线回归方程、相关系数(R2)及线性范围。将6种黄酮醇苷标准品溶液稀释适当的倍数制得不同浓度溶液,以3信噪比(S/N)作为检出限(limit of detection,LOD),10信噪比作为定量限(limit of quantification,LOQ),得到该方法的检出限与定量限。
精密度试验:取同一酒样,按照1.3.2中的色谱条件测定6次,记录6种黄酮醇苷的含量,并计算各成分的精密度试验结果的相对标准偏差(relative standard deviation,RSD)值。
稳定性试验:参照实验室质量控制技术规范中的要求,取同一酒样,在不同时间(0、2 h、4 h、8 h、12 h、24 h)按照1.3.2中的色谱条件进样测定6次,根据检测结果计算各成分的稳定性试验结果的RSD值。
重复性试验:取同一酒样6份,按照1.3.2中的色谱条件进样测定,根据检测结果计算重复性试验结果的RSD值。
加标回收率试验:精密量取9份已测得6种黄酮醇苷含量的同一酒样5 mL,根据酒样中各成分含量,分别加入低、中、高3个水平的加标样品溶液,按照1.3.2中的色谱条件进样测定,根据检测结果计算各成分的加标回收率及RSD值。
1.3.4 数据处理
利用安捷伦超高效液相色谱仪工作站中的OpenLAB软件查看色谱图、建立标准曲线,使用Origin 2021绘图,使用Excel 2016处理数据。
将6种黄酮醇苷混合标准品溶液及样品分别进样分析,得到混合标准品及样品黄酮醇苷分析超高液相色谱图,结果见图1。由图1可知,样品与标准品在相同保留时间出峰,淫羊藿苷、朝藿定C、朝藿定B、朝藿定A、朝藿定A1、淫羊藿次苷Ⅱ的出峰时间分别为10.891 min、10.254 min、9.798 min、9.397 min、8.952 min、16.774 min,6种黄酮醇苷可在20 min内检出,各目标峰的峰形及分离度较好。
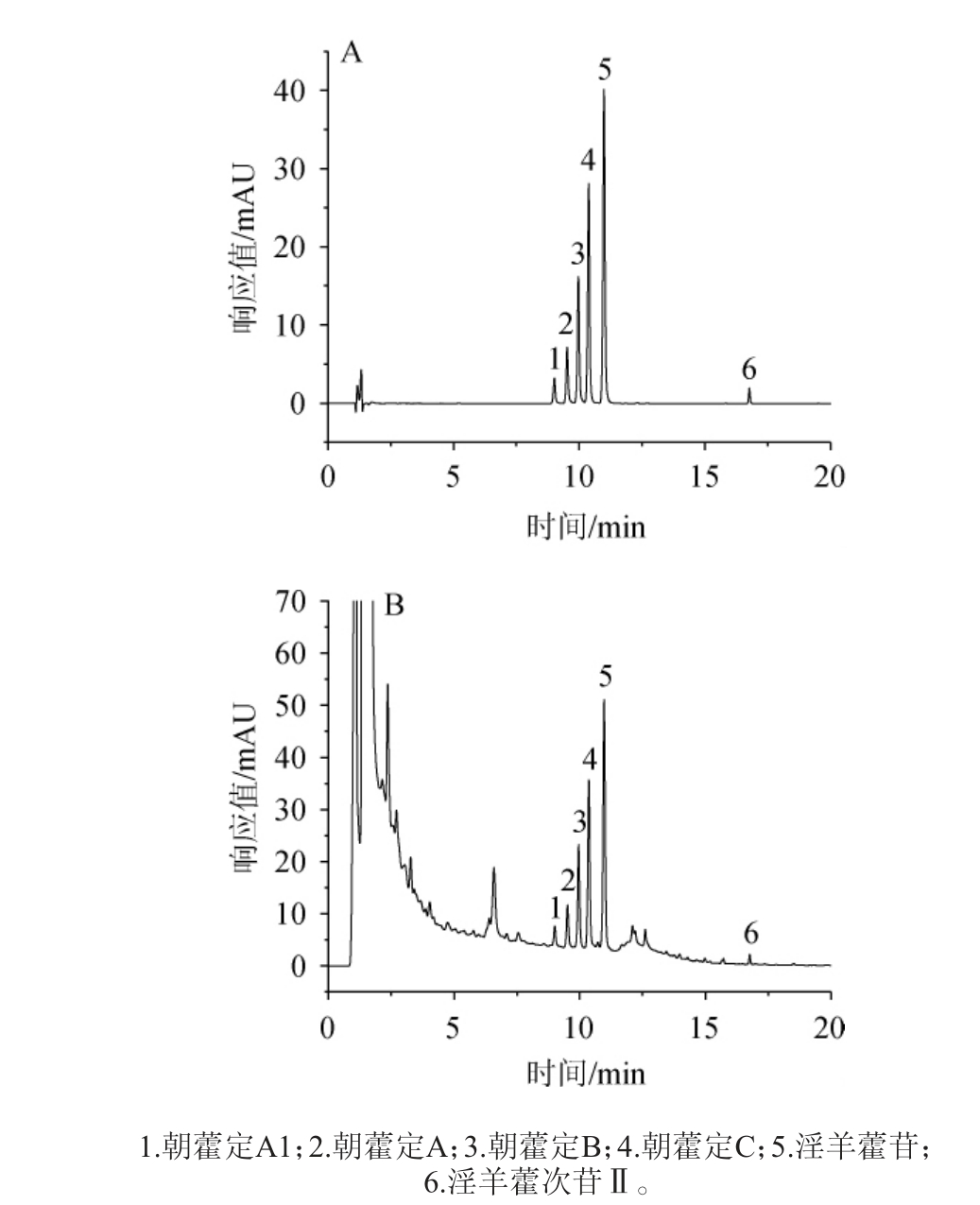
图1 混合标准品(A)及样品(B)中黄酮醇苷分析超高液相色谱图
Fig.1 Ultra-high performance liquid chromatogram of flavonol glycosides in mixed standards (A) and samples (B)
2.2.1 线性关系、检出限及定量限
6种黄酮醇苷的标准曲线回归方程、相关系数、线性范围、检出限与定量限结果见表1。由表1可知,淫羊藿苷、朝藿定C、朝藿定B、朝藿定A、朝藿定A1、淫羊藿次苷Ⅱ分别在5.727~114.542 mg/L、4.649~92.984 mg/L、3.192~63.840 mg/L、1.376 ~27.518 mg/L、0.586 ~11.713 mg/L、0.134~2.684 mg/L质量浓度范围内,显示良好线性关系,相关系数R2均≥0.999 6,检出限范围为0.004~0.011 mg/L,定量限范围为0.013~0.034 mg/L。表明6种黄酮醇苷在对应的质量浓度范围内与色谱峰面积的线性关系良好,此方法的检出限、定量限低,检测灵敏度高。
表1 6种黄酮醇苷的标准曲线回归方程、相关系数、线性范围、检出限与定量限
Table 1 Standard curve regression equation, correlation coefficient,linear range, limit of detection and limit of quantitation of 6 flavonol glycosides
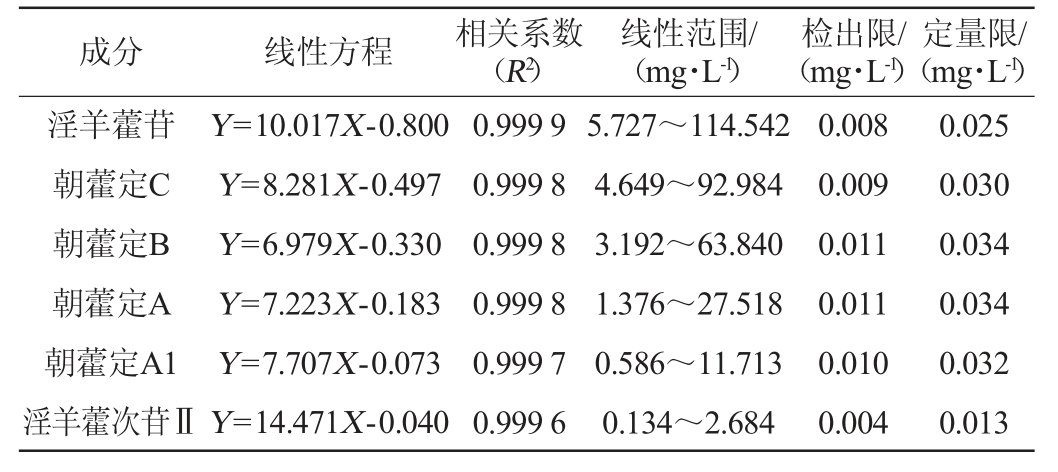
成分 线性方程 相关系数(R2)线性范围/(mg·L-1)检出限/(mg·L-1)定量限/(mg·L-1)淫羊藿苷朝藿定C朝藿定B朝藿定A朝藿定A1淫羊藿次苷ⅡY=10.017X-0.800 Y=8.281X-0.497 Y=6.979X-0.330 Y=7.223X-0.183 Y=7.707X-0.073 Y=14.471X-0.040 0.999 9 0.999 8 0.999 8 0.999 8 0.999 7 0.999 6 5.727~114.542 4.649~92.984 3.192~63.840 1.376~27.518 0.586~11.713 0.134~2.684 0.008 0.009 0.011 0.011 0.010 0.004 0.025 0.030 0.034 0.034 0.032 0.013
2.2.2 精密度试验
6种黄酮醇苷的精密度试验结果见表2。由表2可知,淫羊藿苷、朝藿定C、朝藿定B、朝藿定A、朝藿定A1、淫羊藿次苷Ⅱ精密度试验结果的RSD值分别为0.250%、0.484%、0.402%、0.534%、0.917%、0.376%,RSD值均<1%,表明仪器性能较为稳定,方法的精密度良好。
表2 6种黄酮醇苷的精密度试验结果
Table 2 Results of precision tests of 6 flavonol glycosides
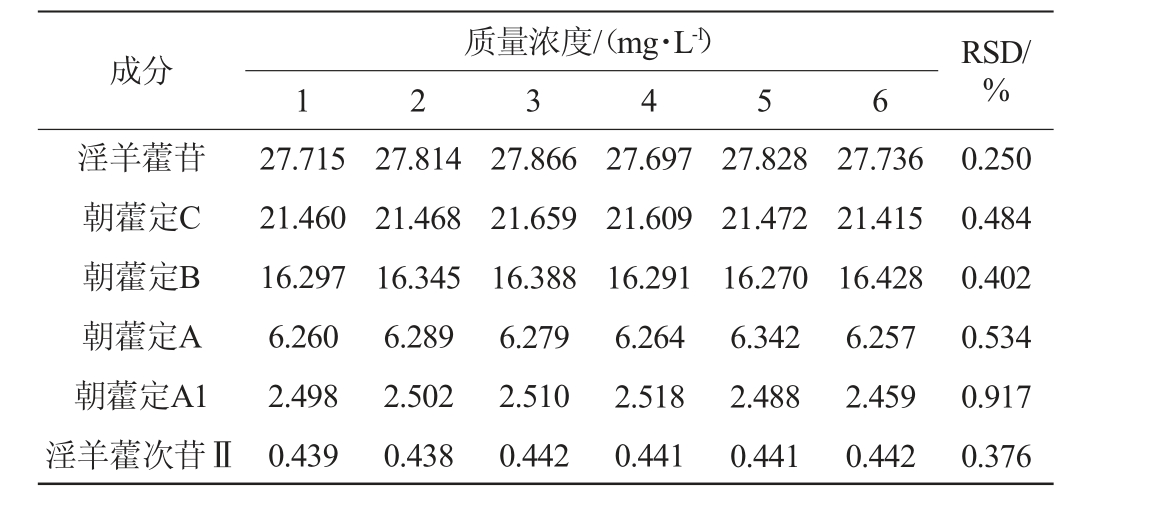
质量浓度/(mg·L-1)1 2 3 4 5 6成分 RSD/%淫羊藿苷朝藿定C朝藿定B朝藿定A朝藿定A1淫羊藿次苷Ⅱ27.715 21.460 16.297 6.260 2.498 0.439 27.814 21.468 16.345 6.289 2.502 0.438 27.866 21.659 16.388 6.279 2.510 0.442 27.697 21.609 16.291 6.264 2.518 0.441 27.828 21.472 16.270 6.342 2.488 0.441 27.736 21.415 16.428 6.257 2.459 0.442 0.250 0.484 0.402 0.534 0.917 0.376
2.2.3 稳定性试验
6种黄酮醇苷的稳定性试验结果见表3。
表3 6种黄酮醇苷的稳定性试验结果
Table 3 Results of stability tests of 6 flavonol glycosides
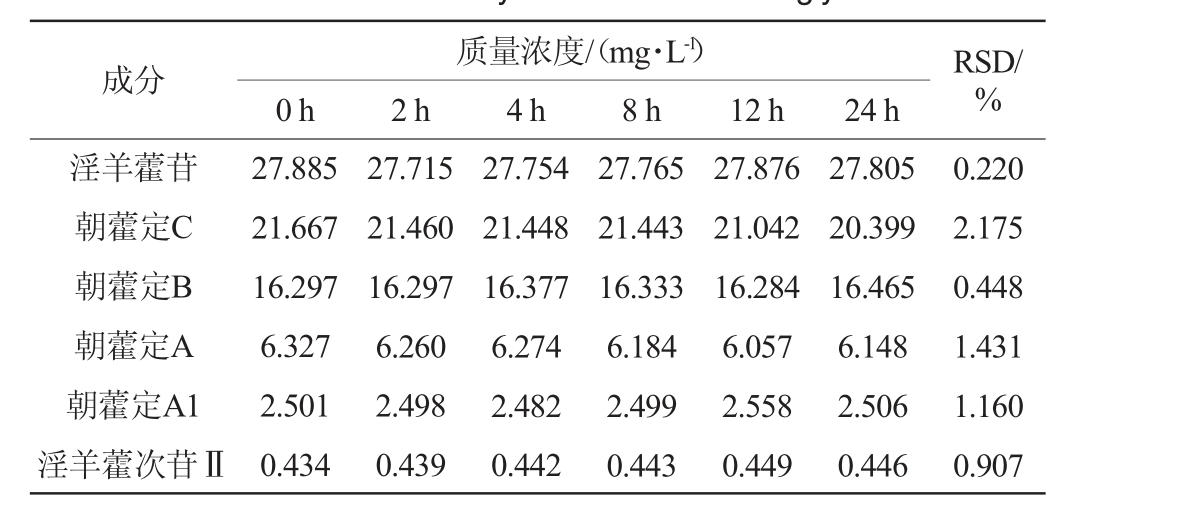
质量浓度/(mg·L-1)0 h 2 h 4 h 8 h 12 h 24 h成分 RSD/%淫羊藿苷朝藿定C朝藿定B朝藿定A朝藿定A1淫羊藿次苷Ⅱ27.885 21.667 16.297 6.327 2.501 0.434 27.715 21.460 16.297 6.260 2.498 0.439 27.754 21.448 16.377 6.274 2.482 0.442 27.765 21.443 16.333 6.184 2.499 0.443 27.876 21.042 16.284 6.057 2.558 0.449 27.805 20.399 16.465 6.148 2.506 0.446 0.220 2.175 0.448 1.431 1.160 0.907
由表3可知,淫羊藿苷、朝藿定C、朝藿定B、朝藿定A、朝藿定A1、淫羊藿次苷Ⅱ稳定性试验结果的RSD值分别为0.220%、2.175%、0.448%、1.431%、1.160%、0.907%,RSD值均<3%,表明样品溶液在24 h内稳定性良好。
2.2.4 重复性试验
6种黄酮醇苷的重复性试验结果见表4。由表4可知,淫羊藿苷、朝藿定C、朝藿定B、朝藿定A、朝藿定A1、淫羊藿次苷Ⅱ重复性试验结果的RSD值分别为0.375%、0.294%、0.713%、0.465%、1.012%、1.119%,RSD值均<2%,表明该方法重复性良好。
表4 6种黄酮醇苷的重复性试验结果
Table 4 Results of repeatability tests of 6 flavonol glycosides
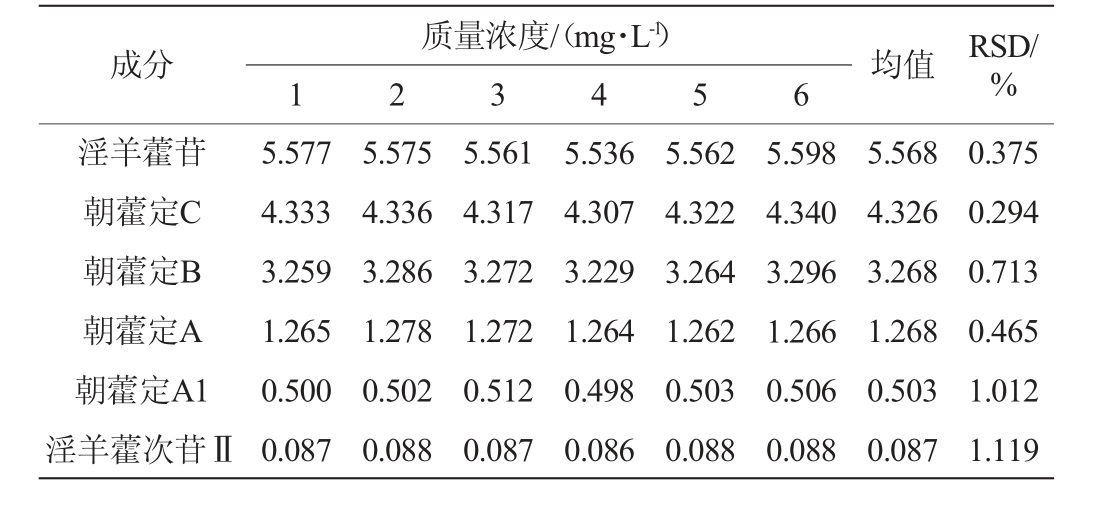
成分淫羊藿苷朝藿定C朝藿定B朝藿定A朝藿定A1淫羊藿次苷Ⅱ质量浓度/(mg·L-1)1 2 3 4 5 6 均值 RSD/%5.577 4.333 3.259 1.265 0.500 0.087 5.575 4.336 3.286 1.278 0.502 0.088 5.561 4.317 3.272 1.272 0.512 0.087 5.536 4.307 3.229 1.264 0.498 0.086 5.562 4.322 3.264 1.262 0.503 0.088 5.598 4.340 3.296 1.266 0.506 0.088 5.568 4.326 3.268 1.268 0.503 0.087 0.375 0.294 0.713 0.465 1.012 1.119
2.2.5 加标回收率试验
6种黄酮醇苷的加标回收试验结果见表5。由表5可知,淫羊藿苷、朝藿定C、朝藿定B、朝藿定A、朝藿定A1、淫羊藿次苷Ⅱ的平均加标回收率分别99.218%、99.229%、99.713%、97.891%、94.741%、95.599%,各成分平均回收率试验结果的RSD值分别为1.519%、1.583%、1.324%、1.843%、1.167%、0.945%,RSD值均<2%,表明该方法具有较高的准确性。
表5 6种黄酮醇苷的加标回收率试验结果
Table 5 Results of spiked recovery rates tests of 6 flavonol glycosides
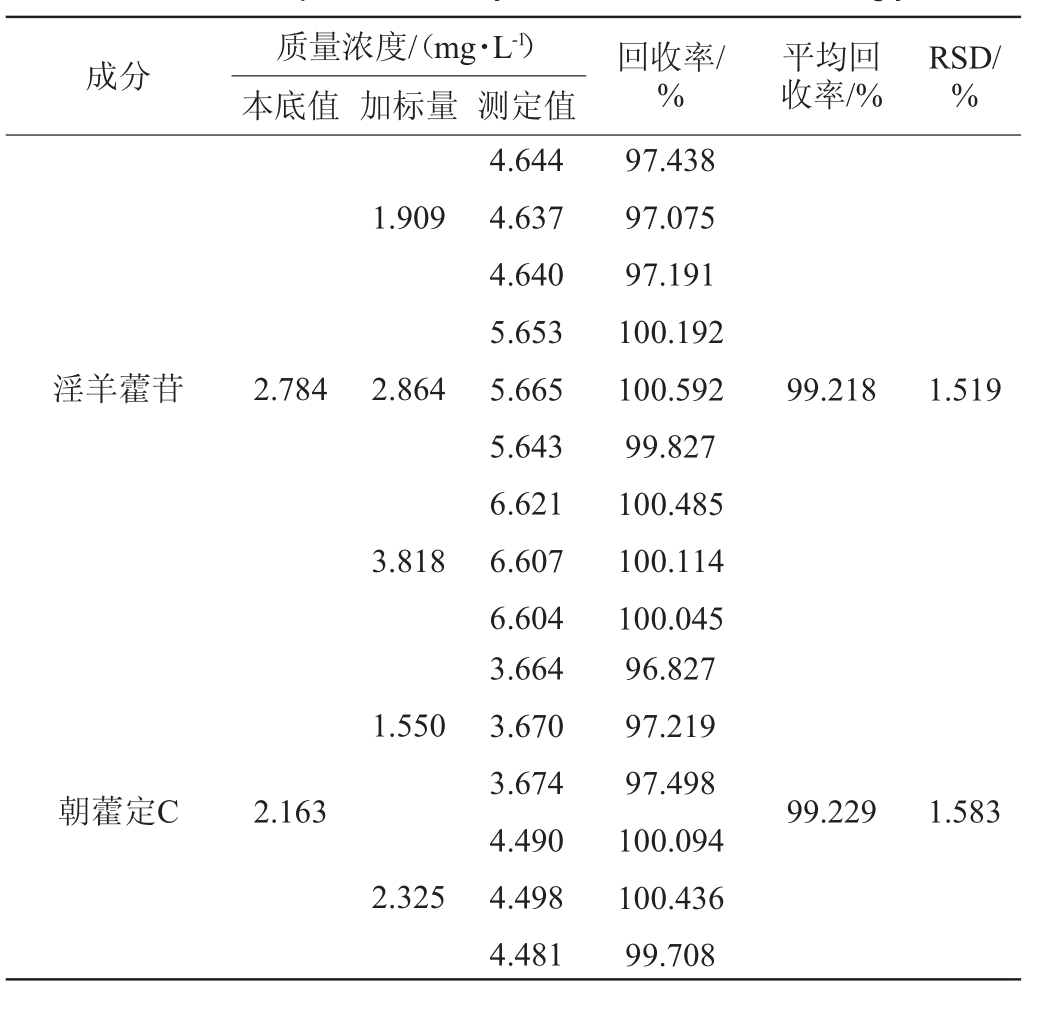
质量浓度/(mg·L-1)本底值 加标量 测定值成分 回收率/%平均回收率/%RSD/%1.909淫羊藿苷2.784 2.864 99.218 1.519 3.818 1.550朝藿定C 2.163 99.229 1.583 2.325 4.644 4.637 4.640 5.653 5.665 5.643 6.621 6.607 6.604 3.664 3.670 3.674 4.490 4.498 4.481 97.438 97.075 97.191 100.192 100.592 99.827 100.485 100.114 100.045 96.827 97.219 97.498 100.094 100.436 99.708
续表
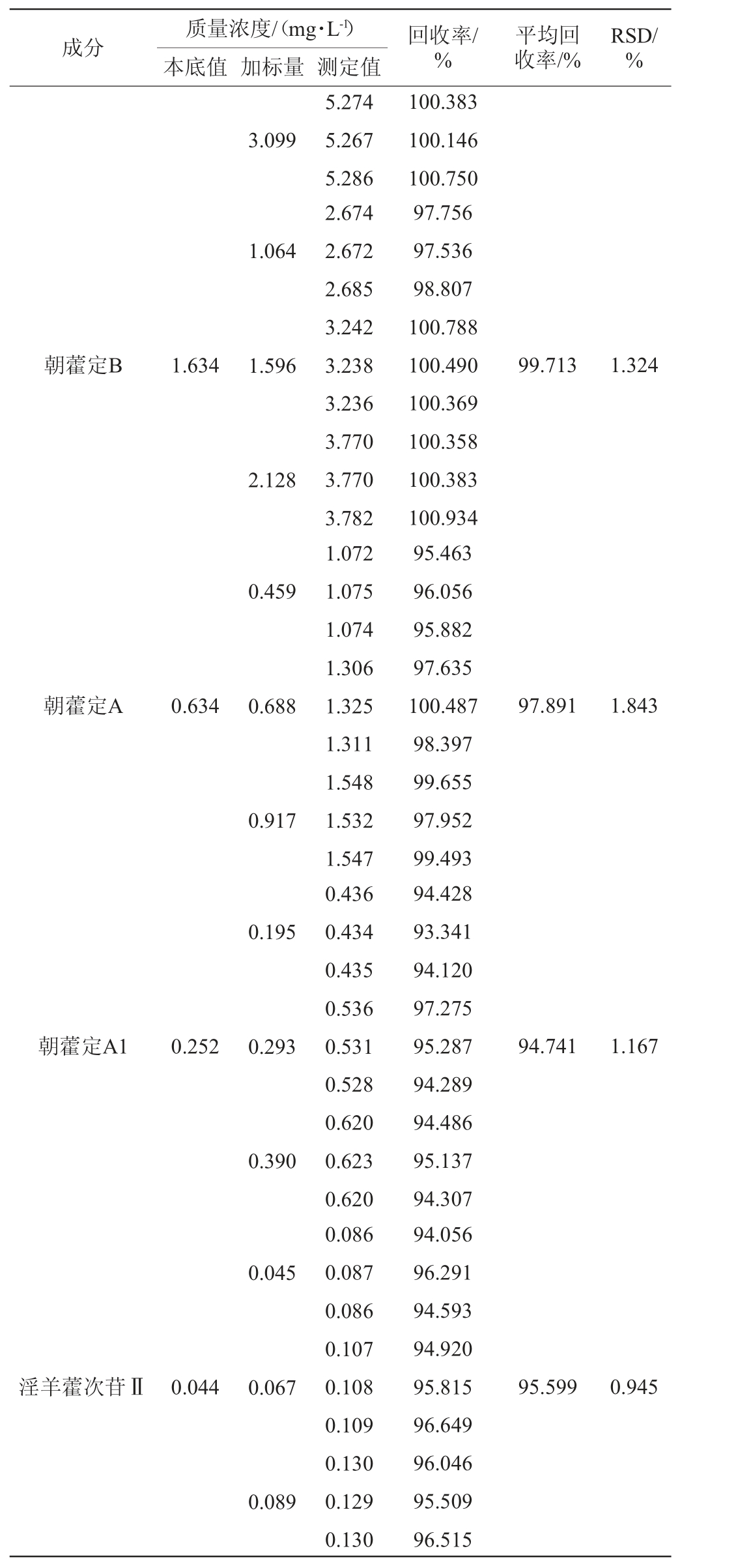
成分 回收率/%质量浓度/(mg·L-1)本底值 加标量 测定值平均回收率/%RSD/%3.099 1.064朝藿定B 1.634 1.596 99.713 1.324 2.128 0.459朝藿定A 0.634 0.688 97.891 1.843 0.917 0.195朝藿定A1 0.252 0.293 94.741 1.167 0.390 0.045淫羊藿次苷Ⅱ0.044 0.067 95.599 0.945 0.089 5.274 5.267 5.286 2.674 2.672 2.685 3.242 3.238 3.236 3.770 3.770 3.782 1.072 1.075 1.074 1.306 1.325 1.311 1.548 1.532 1.547 0.436 0.434 0.435 0.536 0.531 0.528 0.620 0.623 0.620 0.086 0.087 0.086 0.107 0.108 0.109 0.130 0.129 0.130 100.383 100.146 100.750 97.756 97.536 98.807 100.788 100.490 100.369 100.358 100.383 100.934 95.463 96.056 95.882 97.635 100.487 98.397 99.655 97.952 99.493 94.428 93.341 94.120 97.275 95.287 94.289 94.486 95.137 94.307 94.056 96.291 94.593 94.920 95.815 96.649 96.046 95.509 96.515
抽取5批次淫羊藿复方保健酒,按照1.3.2中色谱条件下进样测定,结果见表6。由表6可知,5批次复方淫羊藿保健酒中淫羊藿苷、朝藿定C、朝藿定B、朝藿定A、朝藿定A1、淫羊藿次苷Ⅱ含量的RSD值均<10%,表明生产工艺较为稳定。
表6 各批次样品中各成分含量
Table 6 Contents of each component in each batch of samples
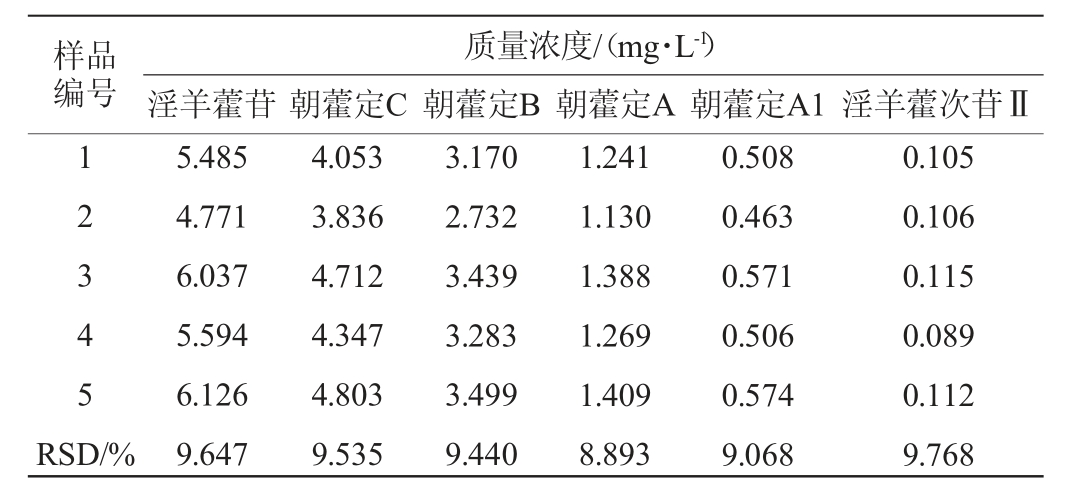
样品编号质量浓度/(mg·L-1)淫羊藿苷 朝藿定C 朝藿定B 朝藿定A 朝藿定A1 淫羊藿次苷Ⅱ1 2 3 4 5 RSD/%5.485 4.771 6.037 5.594 6.126 9.647 4.053 3.836 4.712 4.347 4.803 9.535 3.170 2.732 3.439 3.283 3.499 9.440 1.241 1.130 1.388 1.269 1.409 8.893 0.508 0.463 0.571 0.506 0.574 9.068 0.105 0.106 0.115 0.089 0.112 9.768
本研究建立了超高效液相色谱法同时测定淫羊藿保健酒中淫羊藿苷、朝藿定C、朝藿定B、朝藿定A、朝藿定A1、淫羊藿次苷Ⅱ6种黄酮醇苷含量的方法,各目标成分能够在20 min内完成有效分离。在此条件下,6种黄酮醇苷在各自质量浓度范围内线性关系良好(R2≥0.999 6),检出限为0.004~0.011 mg/L,定量限为0.013~0.034 mg/L,平均加标回收率为94.741%~99.713%,精密度、稳定性、重复性、加标回收率试验结果的RSD值均<3.0%,说明该方法灵敏、稳定、准确,适用于淫羊藿保健酒中6种黄酮醇苷的准确测定,可为淫羊藿保健酒的质量评价和生产过程控制提供参考依据。
[1]郭俊霞,王晓宇,吴萍,等.基于药材质量研究的淫羊藿本草源流考[J].亚太传统医药,2022,18(5):189-194.
[2]国家药典委员会.中华人民共和国药典一部[M].北京:中国医药出版社,2020:340-341.
[3]ZHANG X L,TANG B L,WEN S J,et al.Advancements in the biotransformation and biosynthesis of the primary active flavonoids derived from Epimedium[J].Molecules,2023,28(20):7173.
[4]YANG X H,LI L,XUE Y B,et al.Flavonoids from Epimedium pubescens:extraction and mechanism, antioxidant capacity and effects on CAT and GSH-Px of Drosophila melanogaster[J].Peer J,2020,8:e8361.
[5]王瑜婷,曹嵌,何荣荣,等.淫羊藿总黄酮提取工艺优化与抗氧化活性研究[J].现代中药研究与实践,2023,37(3):71-76.
[6]邢中夫,于慧,万新焕.淫羊藿多糖提取、分离纯化、结构特征和生物活性研究进展[J].药学研究,2023,42(10):830-836.
[7]KE L T, DUAN X Q, CUI J, et al.Research progress on the extraction technology and activity study of Epimedium polysaccharides[J].Carbohydr Polym,2023,306:120602.
[8]龚华乾,高敏,柴艺汇,等.淫羊藿化学成分与药理作用研究进展[J].湖北民族大学学报(医学版),2021,38(4):75-78.
[9]李莉,王嘉瑞,王晶,等.淫羊藿的主要化学成分、药理作用研究进展及质量标志物的预测分析[J].中华中医药学刊,2023,41(11):143-151.
[10]丁越.淫羊藿生物碱的提取纯化及其生理活性研究[D].长春:吉林农业大学,2022.
[11]BI Z Y,ZHANG W,YAN X Y.Anti-inflammatory and immunoregulatory effects of icariin and icaritin[J].Biomed Pharmacother,2022,151:113180.
[12]卢芳,冯镇凯,杨晓旭,等.基于免疫调节作用的淫羊藿各拆分组分筛选研究[J].中华中医药学刊,2018,36(6):1331-1335.
[13]司秋霞.淫羊藿对缓解小鼠体力疲劳的实验研究[J].临床医药文献电子杂志,2020,7(23):160-163.
[14]罗则华,杜倩,奚鑫,等.基于网络药理学的淫羊藿抗疲劳作用机制研究[J].中草药,2020,51(11):2997-3004.
[15]龚华乾,高敏,柴艺汇,等.淫羊藿化学成分与药理作用研究进展[J].湖北民族大学学报(医学版),2021,38(4):75-78.
[16]JIANG J,HE J J,XIAO S C,et al.Screening of superior anti-osteoporotic flavonoids from Epimedii Folium with dual effects of reversing iron overload and promoting osteogenesis[J].Biomed Chromatogr, 2023,37(9):e5686.
[17]XU B, ZHOU Y, WANG Q, et al.Use of network pharmacology and molecular docking methods to elucidate the curative effect of Epimediumanemarrhen on osteoporosis[J].Nat Prod Commun,2022,17(3):1-12.
[18]杨家军,原明月,牛野,等.基于网络药理学和分子对接探讨淫羊藿抗肿瘤作用机制[J].药学研究,2022,41(5):292-298,306.
[19]李丹婷,姜宇,栾雅格,等.生炙淫羊藿抗衰老活性比较及作用机制研究[J].中国现代中药,2022,24(9):1727-1735.
[20]李莉,王嘉瑞,王晶,等.淫羊藿的主要化学成分、药理作用研究进展及质量标志物的预测分析[J].中华中医药学刊,2023,41(11):143-151.
[21]张秀秀,杨洁,何洁,等.淫羊藿药材中黄酮类成分提取工艺优选[J].中国药业,2023,32(14):67-72.
[22]薛佳,陈海杰,周永逸,等.淫羊藿不同部位多元活性成分的分析与评价[J].中国中药杂志,2023,48(13):3448-3461.
[23]秦月,严沁,张玲,等.中国保健酒的历史发展及研究进展[J].中国酿造,2021,40(9):7-11.
[24]李雅新,梁慧珍,张文生,等.保健酒制作工艺的研究进展[J].中国酿造,2022,41(5):23-27.
[25]刘正才,陈章捷,郭菁,等.超高效液相色谱-串联质谱法同时测定保健酒中14种黄酮类成分的含量[J].食品安全质量检测学报,2020,11(7):2178-2184.
[26]刘永铭,刘树森,熊轶喆,等.基于数据挖掘和网络药理学的淫羊藿保健品组方规律及主要保健功能研究[J].中草药,2024,55(6):2027-2039.