Bioflocculant production from molasses by Photorhabdus luminescens,flocculation condition optimization and its application in heavy metal removal
随着工业和科学技术的发展,絮凝剂被广泛应用于市政污水和工业领域,如自来水生产、废水处理、发酵过程和食品工业[1-3]。通常,絮凝剂分为三大类:包括无机絮凝剂(如聚合氯化铝、硫酸铝)、有机絮凝剂(如聚丙烯酰胺、聚乙烯亚胺)和天然絮凝剂(如明胶、壳聚糖、瓜尔胶和生物絮凝剂)[4-5]。尽管无机絮凝剂成本低,有机絮凝剂性能有效,但铝盐引起的健康问题(包括阿尔茨海默病以及对人类和环境有害的神经毒性和致癌性的聚丙烯酰胺)正在限制它们的使用[6-7]。
生物絮凝剂是一类由微生物分泌到细胞外的代谢产物,由多糖、蛋白质及糖蛋白等组成的有机高分子聚合物。与传统物理化学方法去除重金属相比,生物絮凝剂具有高活性、低成本、安全、无毒、环保和可自然降解的特点,这些优势使其成为无机和有机合成絮凝剂的理想替代品。它们在工业和生物技术领域展现出具有巨大的应用潜力,尤其在重金属去除方面受到越来越多的关注[8-9]。一些研究表明,pH值可以影响絮凝活性,pH值的增加在一定程度上影响絮凝剂和高岭土胶体粒子的表面电荷,导致絮凝率下降[10-11]。在阳离子诱导剂方面,一些分泌的生物絮凝剂活性受到一些金属离子的影响,Ca2+、Zn2+、Mg2+等金属离子在低浓度下提高生物絮凝剂的活性,但在较高浓度下会抑制活性。例如,低浓度的CaCl2、ZnCl2和MgSO4在高岭土絮凝过程中促进絮凝活性,但当质量浓度高于0.1 g/L时,絮凝活性下降[12]。
广西壮族自治区作为中国的主要甘蔗种植区,其糖蜜资源的开发与利用对当地乃至全国的糖业发展具有重要意义。以糖蜜作为碳源,探究其在发酵过程中的关键作用,以期优化糖蜜的资源综合利用,提升其经济价值,并减少对环境的影响,以实现糖业的可持续发展[13]。
本研究以糖蜜为碳源,采用单因素及响应面试验优化发光杆菌(Photorhabdus luminescens)利用糖蜜生产生物絮凝剂培养条件,既降低了生物絮凝剂的生产成本,也有效的降低了废水中的重金属浓度,达到以废治废,为生产生物絮凝剂的廉价培养基选取提供了科学依据,也探索了糖蜜资源化利用途径。
1.1.1 菌种发光杆菌(Photorhabdus luminescens):保存于贺州学院广西康养食品科学与技术重点实验室。
1.1.2 试剂
高岭土、葡萄糖、糖蜜、HCl、NaOH、CdSO4·2.5H2O、K2CrO4、NiCl2·6H2O、CuSO4·5H2O、(CH3COO)2Pb(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
分离培养基:牛肉膏5 g/L、蛋白胨10 g/L、琼脂15 g/L、NaCl 5 g/L、溴百里酚蓝0.04 g/L、红四氮唑0.02 g/L,pH 7.0~7.4,121 ℃灭菌20 min。
发酵培养基(采用牛肉膏蛋白胨培养基):牛肉膏5 g/L、蛋白胨10 g/L、NaCl 5 g/L,pH 7.0,121 ℃灭菌20 min。
PRACTUM224-1CN电子天平:赛多利斯科学仪器有限公司;PHS-2C笔式pH计:上海康仪仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌器:上海博讯实业有限公司;HWS-150立式恒温培养摇床:上海世平实验设备有限公司;SW-CJ-1D超净工作台:江苏通净净化设备有限公司;101-1电热恒温鼓风箱:北京中兴伟业仪器公司;UV-2450紫外可见分光光度计:日本岛津公司;DM 2000光学显微镜:德国莱卡公司;Lynx6000离心机:美国thermo公司;Malvern Mastersizer 3000E Zeta分析仪:英国Malvern公司;85-2数显恒温磁力搅拌器使用说明书:苏州学森仪器设备有限公司;SN-QX-20D 超声仪:上海尚仪器设备有限公司;FDM-1000冷冻干燥机:东京理化器械株式会社;Agilent 8900电感耦合等离子体-质谱(inductivelycoupled plasma mass spectrometry,ICP-MS):安捷伦科技(中国)有限公司。
1.3.1 生物絮凝剂的制备
将发光杆菌以5%的接种量接种于装有100 mL发酵培养基的500 mL锥形瓶中,在26 ℃恒温摇床中160 r/min培养120 h。将发酵液加入2倍体积预冷的无水乙醇中,并在4 ℃冰箱中放置24 h[14-15]。然后将提取液6 000 r/min离心15 min,去上清液收集沉淀物,用体积分数95%的乙醇洗涤沉淀物3次,最终将沉淀物在-80 ℃真空冷冻干燥机进行冻干,得到生物絮凝剂粉末,电子天平称质量。
1.3.2 高岭土悬液絮凝
按照参考文献[16]的方法,在250 mL烧杯中加入0.8 g高岭土、160 mL蒸馏水、10 mL 50 mg/L CaCl2(阳离子诱导剂)和50 mg生物絮凝剂粉末,加入蒸馏水至总体积200 mL,并将pH调节至7.0,240 r/min搅拌后静置5 min。使用紫外分光光度计在波长600 nm处测定吸光度值。使用蒸馏水代替CaCl2和生物絮凝剂样品作为对照组,在相同条件下测定吸光度值,计算絮凝率,其计算公式如下:
式中:F为絮凝率,%;ODc为样品处理后的高岭土悬液的吸光度值;ODi为对照组的吸光度值。
1.3.3 发酵培养基碳源、氮源对生物絮凝剂产量的影响
分别考察5 g/L碳源(葡萄糖、糖蜜、蔗糖、甘露糖、半乳糖、果糖),10 g/L氮源(蛋白胨、牛肉膏、酵母浸粉、胰蛋白胨、NH4Cl、尿素)对生物絮凝剂产量的影响。
1.3.4 高岭土悬液絮凝条件优化单因素试验
分别考察初始pH值(5、6、7、8、9),生物絮凝剂添加量(150 mg/L、200 mg/L、250 mg/L、300 mg/L、350 mg/L);阳离子诱导剂种类(NaCl、KCl、MgSO4、ZnCl2、CaCl2、FeCl3)及质量浓度(10 mg/L、30 mg/L、50 mg/L、70 mg/L、90 mg/L),搅拌速率(160 r/min、200 r/min、240 r/min、280 r/min、320 r/min)对高岭土悬浊液絮凝率的影响。
1.3.5 高岭土悬液絮凝条件优化响应面试验
基于单因素试验结果,确立中心点,依据Box-Behnken中心组合试验原理[17],以絮凝率(Y)作为响应值,使用Design-Expert 10软件分别考察初始pH(X1)、生物絮凝剂质量浓度(X2)、阳离子诱导剂质量浓度(X3)和搅拌速率(X4)对高岭土悬液絮凝的影响。响应面试验因素与水平见表1。
表1 高岭土悬液絮凝条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface experiments for kaolin suspension flocculation condition optimization
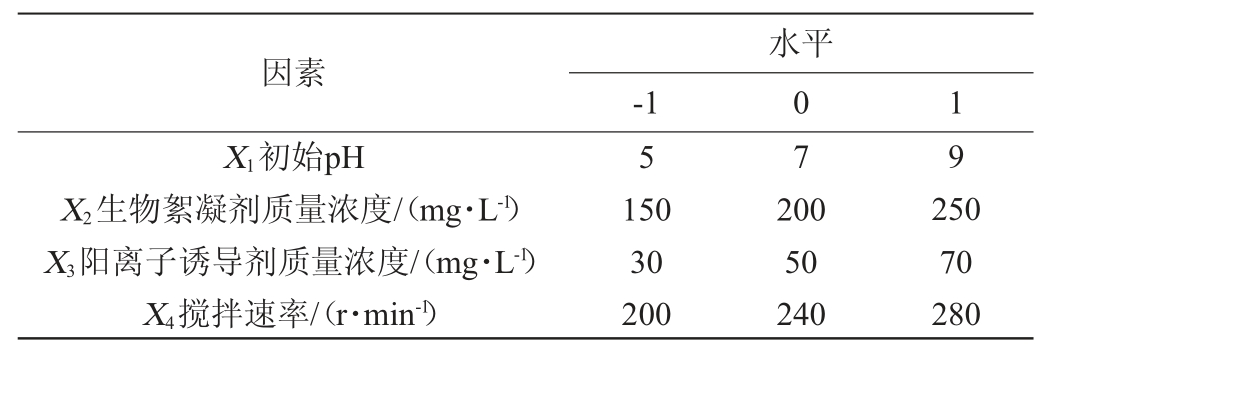
因素X1初始pH X2生物絮凝剂质量浓度/(mg·L-1)X3阳离子诱导剂质量浓度/(mg·L-1)X4搅拌速率/(r·min-1)-1水平0 1 5 7 9 150 30 200 200 50 240 250 70 280
1.3.6 生物絮凝剂对重金属的吸附效果
利用生物絮凝剂对重金属(Cd、Cr、Ni、Cu和Pb)进行吸附。将100 mg的冷冻干燥的生物絮凝剂加入100 mL的金属盐溶液(CdSO4·2.5H2O、K2CrO4、NiCl2·6H2O、CuSO4·5H2O和(CH3COO)2Pb)中,将混合物以240 r/min搅拌均匀,使用ICP-MS测量上清液中的金属浓度[18-20]。使用以下公式计算重金属去除效率:
式中:E为絮凝率,%;Ci和Ce分别为金属的初始浓度和最终浓度。
由图1可知,发光杆菌可以利用多种碳氮源生产生物絮凝剂。当碳源为糖蜜、氮源为蛋白胨时,生物絮凝剂产量达到最大,为4.53 g/L。这可能是因为糖蜜和蛋白胨含有较多的有利于絮凝作用的氨基、羟基和羧基等官能团,从而提高了絮凝剂的产量和活性[21-22]。因此,选择发酵培养基最佳碳源、氮源组合为5 g/L糖蜜、10 g/L蛋白胨。
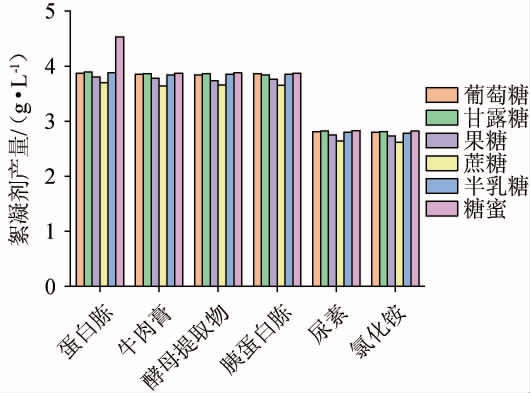
图1 不同发酵培养基碳源、氮源对絮凝剂产量的影响
Fig.1 Effect of different carbon and nitrogen sources in fermentation medium on flocculant yield
2.2.1 初始pH对絮凝效果的影响
由图2可知,絮凝率随初始pH变化呈先升高后降低的趋势;当初始pH为5~7时,絮凝率随初始pH的升高而升高;当初始pH为7时,絮凝率最高为92.6%;当初始pH>7时,絮凝率随pH升高而降低;可能是pH的升高在一定程度上影响了絮凝剂和高岭土胶体粒子的表面电荷,导致絮凝率下降[23]。因此,选择絮凝初始pH为7。
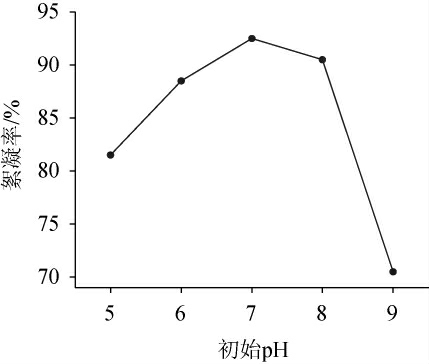
图2 不同初始pH值对絮凝效果的影响
Fig.2 Effect of different initial pH on flocculation efficiency
2.2.2 生物絮凝剂质量浓度对絮凝效果的影响
由图3可知,絮凝率随生物絮凝剂质量浓度变化呈先升高后降低的趋势;当生物絮凝剂质量浓度较低时,絮凝活性较差,可能是絮凝剂质量浓度太低导致形成的絮体太小。随着絮凝剂质量浓度的升高,絮凝率升高,可能是絮凝剂的强大网捕和桥接效应,进一步促进了絮凝效率;当絮凝剂质量浓度为200 mg/L时,絮凝率最高为92.9%;当絮凝剂质量浓度>200 mg/L时,絮凝率随絮凝剂质量浓度增加反而下降;可能是过量的絮凝剂导致粒子与分子之间的结合达到饱和状态,分子开始相互排斥,阻碍了粒子的凝聚和沉降。因此选择絮凝剂质量浓度为200 mg/L。
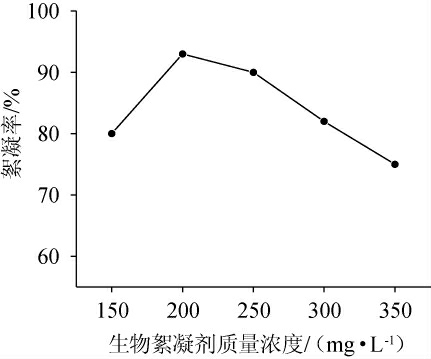
图3 不同生物絮凝剂质量浓度对絮凝效果的影响
Fig.3 Effect of different mass concentrations of bioflocculant on flocculation efficiency
2.2.3 阳离子诱导剂对絮凝效果的影响
在高岭土悬液中添加无机金属盐,其金属离子能够中和生物絮凝剂表面官能团的负电荷,从而稳定电荷并有效提升絮凝剂的絮凝效果。由图4a可知,阳离子诱导剂为FeCl3时絮凝效果最佳,其次是CaCl2。在废水处理中,MgSO4、ZnCl2和CaCl2等作为参与絮凝反应的阳离子诱导剂,这种技术被称为二价阳离子桥接(DCB),SOBECK D C等[24]解释了为什么絮体性能得到了增强。作为链接,镁盐通过中和官能团的剩余负电荷来增强絮凝过程。
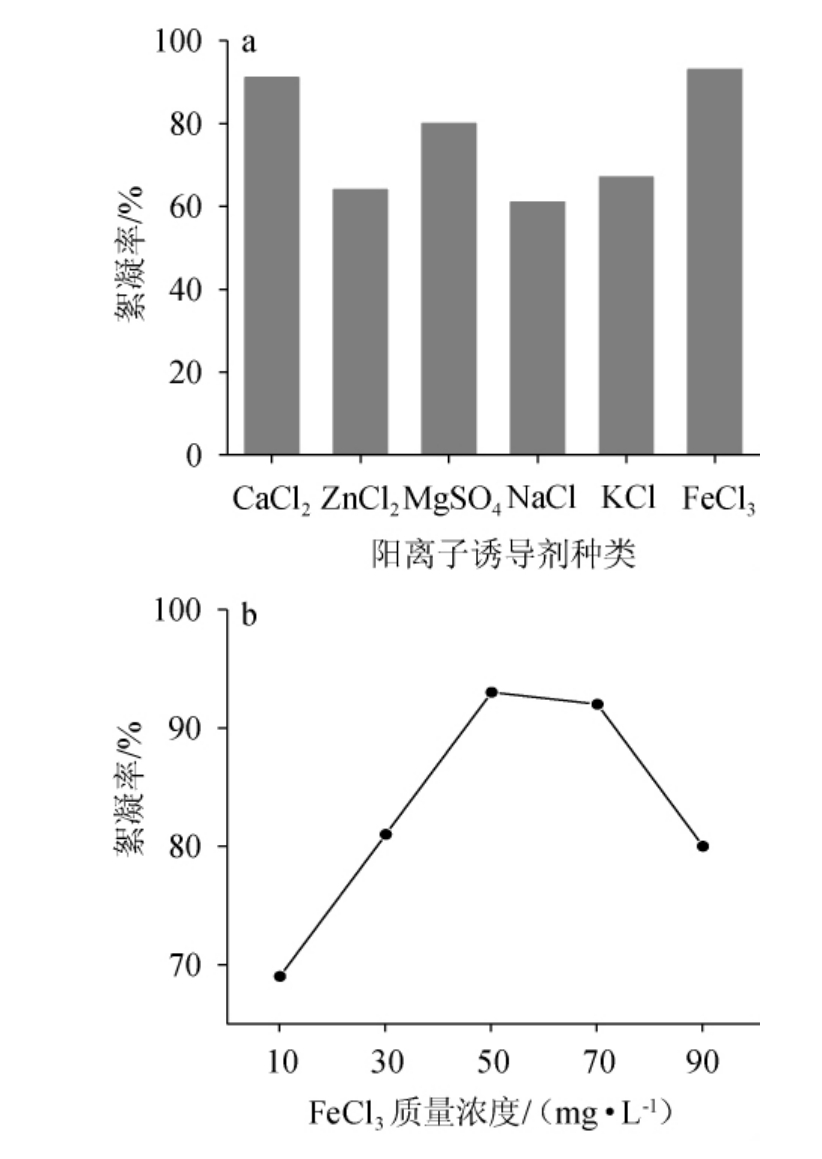
图4 不同阳离子诱导剂(a)及FeCl3质量浓度(b)对絮凝效果的影响
Fig.4 Effect of different cationic inducer (a) and FeCl3 mass concentrations (b) on flocculation efficiency
由图4b所示,絮凝率随FeCl3质量浓度的增加而增大,当FeCl3质量浓度为50 mg/L时,絮凝率最高为92.8%;当FeCl3质量浓度>50 mg/L时,絮凝率随阳离子诱导剂浓度的增加而下降;可能是过高的阳离子浓度导致过度中和,破坏了絮凝剂的结构,影响了其桥接和絮凝的能力。因此,选择阳离子诱导剂质量浓度为50 mg/L。
2.2.4 搅拌速率对絮凝效果的影响
搅拌速率影响絮凝过程的溶氧,从而影响絮凝剂与高岭土结合的稳定性。由图5可知,絮凝率随搅拌速率变化呈先升高后降低的趋势;当搅拌速率为160~240 r/min时,絮凝率随搅拌速率的增加而升高;当搅拌速率为240 r/min时,絮凝率最高为92.7%;当搅拌速率>240 r/min时,絮凝率随搅拌速率增加而降低;当320 r/min的搅拌速率时,絮凝率下降到80%;可能是高速搅拌下倾向于打散絮体、胶体,从而影响了絮凝体的稳定性。因此,选择搅拌速率为240 r/min。
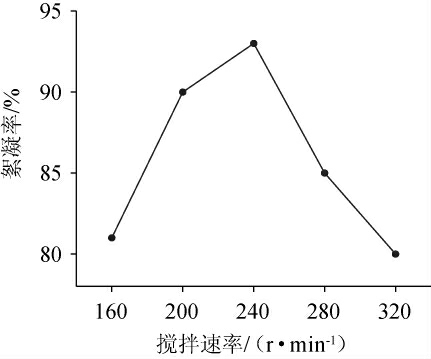
图5 不同搅拌速率对絮凝效果的影响
Fig.5 Effect of different stirring rate on flocculation efficiency
使用Design-Expert 10软件,以絮凝率(Y)作为响应值,对初始pH(X1)、生物絮凝剂质量浓度(X2)、阳离子诱导剂质量浓度(X3)及搅拌速率(X4)进行4因素3水平Box-Behnken试验[25-26],试验设计与结果见表2,方差分析见表3。
表2 Box-Behnken试验设计与结果
Table 2 Design and results of Box-Behnken experiments
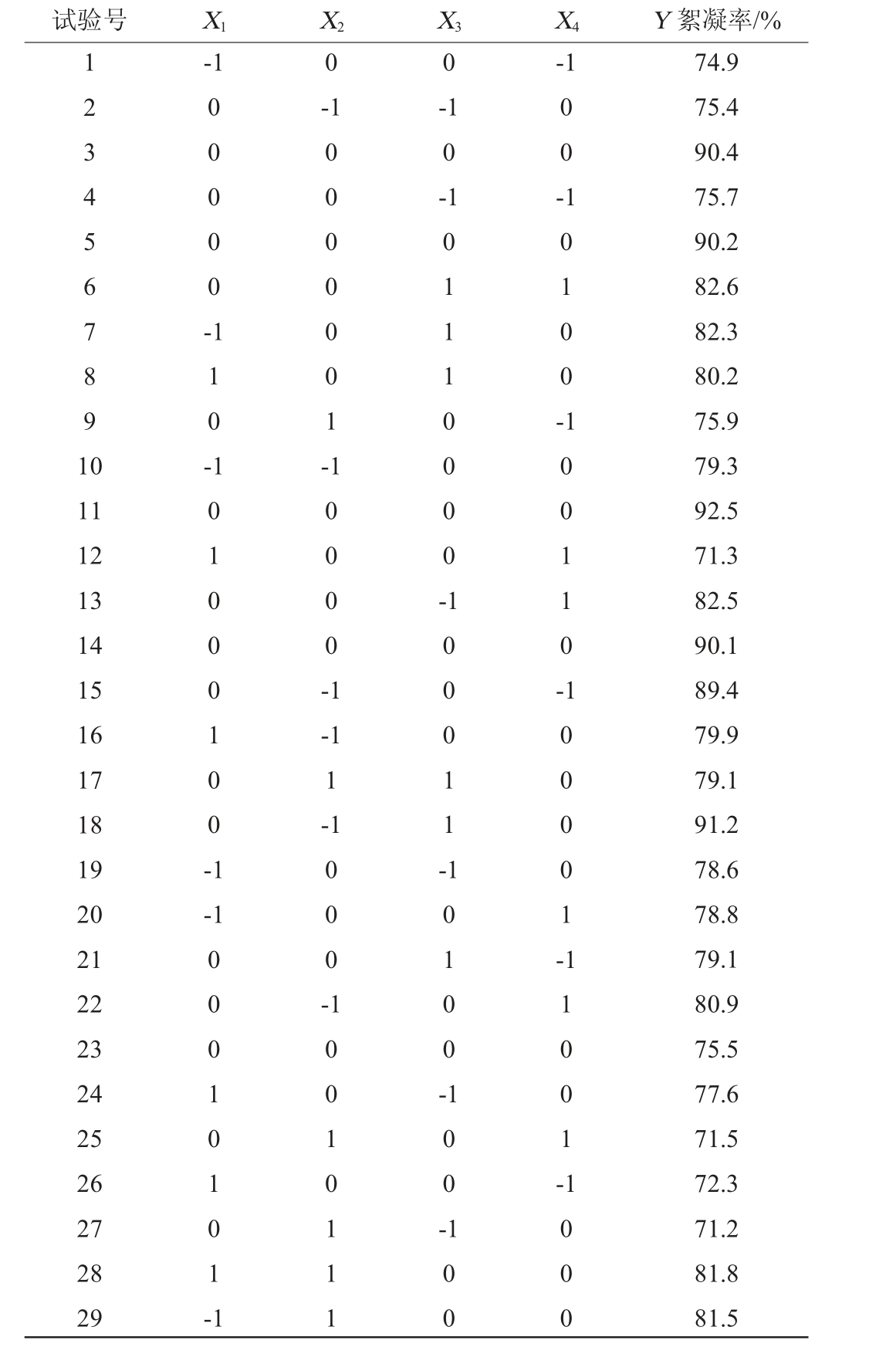
试验号 X1 X2 X3 X4 Y 絮凝率/%1234567891 0-1 0 0-1 0 0 0 0 0 --1-1 0-1 0 0 -1 1 0 -0 0 0 0 00 1 -1 0 1 0 0 -11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 1 0 1 0 0 0 1 00 -1 1 0 0 0 0 -1 0 1 11 0 0 0 0 -1 0 0 1 1 0 --1 1-1 1 0 0 0 11 --1 0 0 0 1 0 1 0 1 -1 0 0 0 -1 0 0 0 0 1 -10010 111 1 0 1 0 0 -1 0 0 -1 1 0 0 1 -1 0 0 1 0 00 74.9 75.4 90.4 75.7 90.2 82.6 82.3 80.2 75.9 79.3 92.5 71.3 82.5 90.1 89.4 79.9 79.1 91.2 78.6 78.8 79.1 80.9 75.5 77.6 71.5 72.3 71.2 81.8 81.5
表3 回归模型方差分析
Table 3 Variance analysis of regression equation
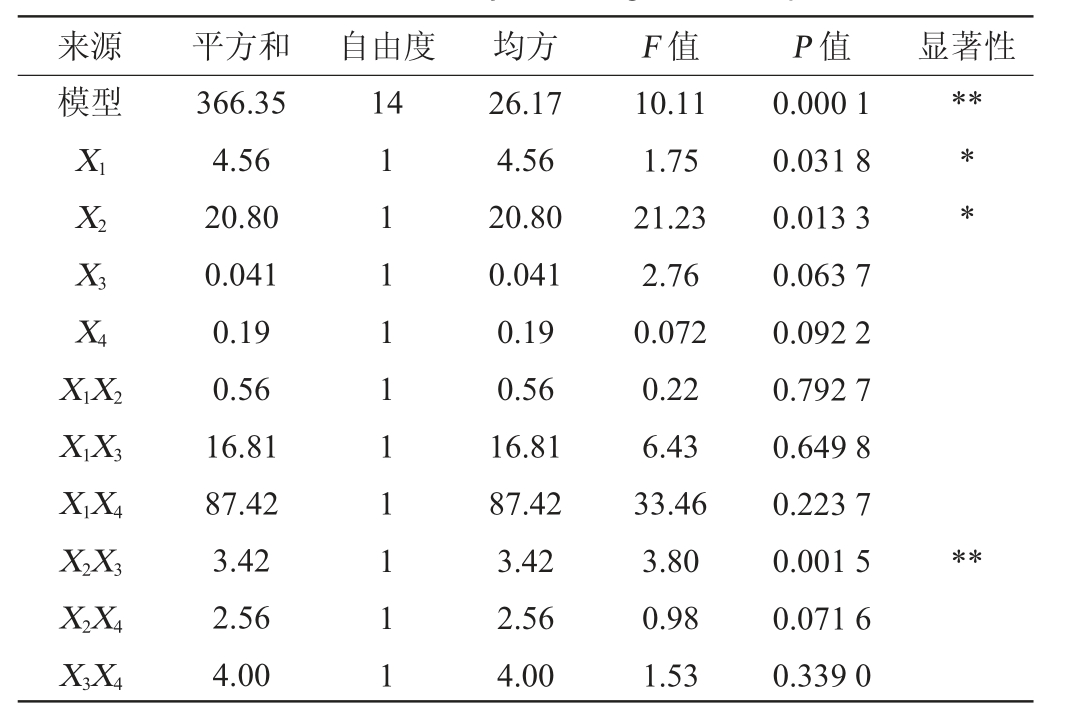
来源 平方和 自由度 均方 F 值 P 值 显著性模型14**X1 X2 X3 X4 X1X2 X1X3 X1X4 X2X3 X2X4 X3X4 366.35 4.56 20.80 0.041 0.19 0.56 16.81 87.42 3.42 2.56 4.00 11 111 11111 26.17 4.56 20.80 0.041 0.19 0.56 16.81 87.42 3.42 2.56 4.00 10.11 1.75 21.23 2.76 0.072 0.22 6.43 33.46 3.80 0.98 1.53 0.000 1 0.031 8 0.013 3 0.063 7 0.092 2 0.792 7 0.649 8 0.223 7 0.001 5 0.071 6 0.339 0****
续表
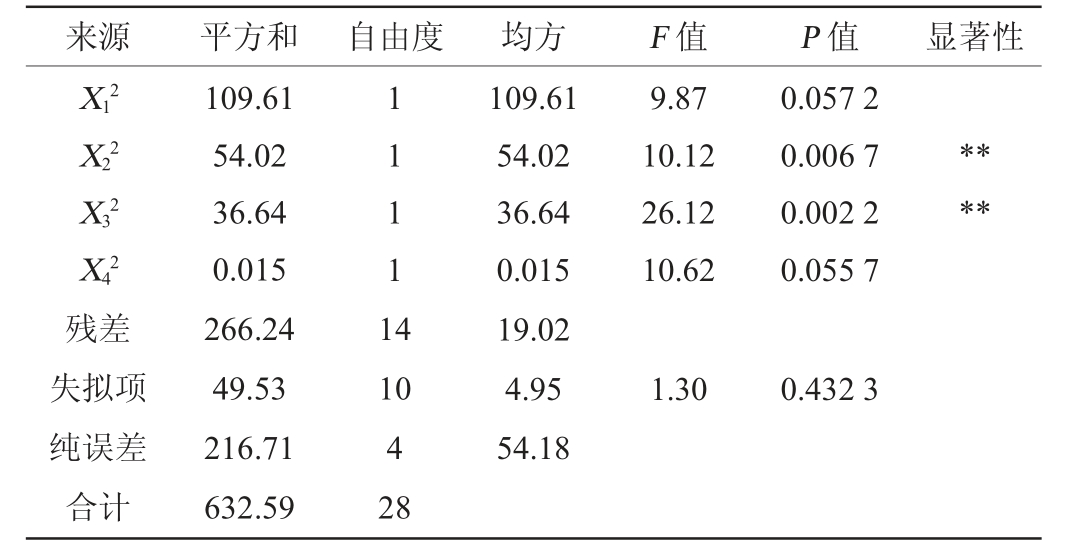
注:“*”表示差异显著(P<0.05);“**”表示差异极显著(P<0.01)。
来源 平方和 自由度 均方 F 值 P 值 显著性X12 X22 X32 X42残差失拟项纯误差合计109.61 54.02 36.64 0.015 266.24 49.53 216.71 632.59 1 111 1 4 9.87 10.12 26.12 10.62 0.057 2 0.006 7 0.002 2 0.055 7****10 4 28 109.61 54.02 36.64 0.015 19.02 4.95 54.18 1.30 0.432 3
采用Design-Expert 10软件对表2数据进行多元二次回归拟合分析,得到回归方程为:
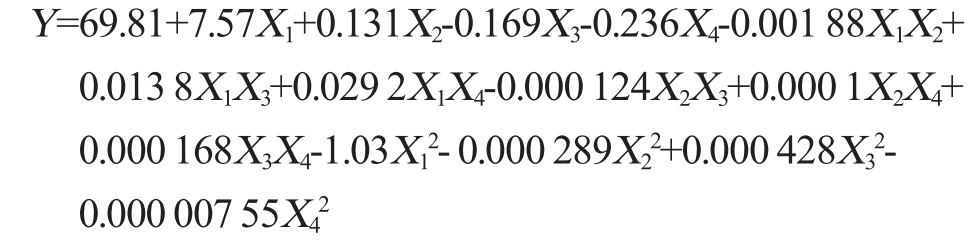
由表3可知,模型极显著(P<0.01),失拟项不显著(P>0.05),说明模型可靠。模型的决定系数R2为0.909 1,调整决定系数R2Adj为0.855 9,表明模型和实际试验拟合良好,试验误差小,证明采用响应面法对絮凝效果条件进行优化是可行的。根据F值可知,各因素对絮凝率的影响次序依次为:生物絮凝剂质量浓度>阳离子诱导剂质量浓度>初始pH>搅拌速率;根据P值可知,一次项X1和X2对结果影响显著(P<0.05);二次项X22、X32,交互项X2X3对结果影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。
生物絮凝剂质量浓度与阳离子诱导剂质量浓度间交互作用对絮凝率影响的响应面及等高线见图6。
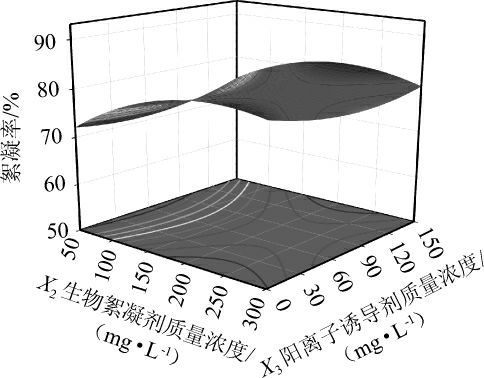
图6 生物絮凝剂质量浓度与阳离子诱导剂质量浓度间交互作用对絮凝率影响的响应面及等高线
Fig.6 Response surface plots and contour lines of effects of interaction between bioflocculant mass concentration and cationic inducer mass concentration on flocculation efficiency
由图6可知,生物絮凝剂质量浓度与阳离子诱导剂质量浓度间交互作用对絮凝率影响的响应面呈凸面,等高线呈椭圆,说明两者间交互作用对絮凝率影响较大。通过Design-Expert 10软件分析得到最佳絮凝条件为初始pH 6.967,生物絮凝剂质量浓度198.749 mg/L、阳离子诱导剂质量浓度48.827 mg/L、搅拌242.279 r/min,在此条件下,预测絮凝率理论值为92.5%。为方便实际操作,将上述最佳絮凝条件修正为初始pH 7.0,搅拌速率240 r/min,生物絮凝剂质量浓度200 mg/L,阳离子诱导剂FeCl3质量浓度50 mg/L,重复3次试验,测得实际絮凝率平均值为93.2%,与理论预测值基本吻合。
生物絮凝剂之所以能有效吸附水溶液中的金属离子,主要归功于其分子结构中的阴离子性质和多价位点。生物絮凝剂表面电荷及其丰富的羧基、羟基和氨基等官能团能吸附重金属离子形成稳定絮体[27-28]。絮凝剂对重金属的去除率见表4。
表4 发光杆菌产生物絮凝剂絮凝前后对重金属的去除效率
Table 4 Removal efficiency of bioflocculant produced by Photorhabdus luminescens before and after flocculantion on heavy metal

测试项目 Cd Cr Cu Pb Ni重金属去除率/% 80.71±0.49 61.32±0.61 78.18±0.85 58.22±0.96 85.90±0.73images/BZ_270_1374_1586_1404_1635.png
由表4可知,该絮凝剂对Cr、Pb、Ni、Cu、Cd的去除率分别为61.32%、58.22%、85.90%、78.18%、80.71%。不同生物絮凝剂去除重金属效率的差异取决于它们的结合特异性、吸引相互作用、生物絮凝剂与吸附的金属离子的构像类型、电荷密度和生物絮凝剂质量浓度,这些因素共同决定了絮凝剂的吸附性能和效率[29-30]。
以糖蜜为碳源,利用发光杆菌生产生物絮凝剂,并对其发酵条件和絮凝条件进行优化。结果表明,最佳培养基组成为5 g/L糖蜜、10 g/L蛋白胨、5 g/L NaCl,在此条件下,絮凝剂产量达到4.53 g/L。通过单因素试验和响应面试验,得到最佳絮凝条件为pH 7.0、生物絮凝剂0.2 g/L、阳离子诱导剂(FeCl3)0.05 g/L和搅拌速率240 r/min,在此条件下絮凝剂对高岭土的絮凝效率达到93.2%。该絮凝剂对Cr、Pb、Ni、Cu和Cd去除率分别为61.32%、58.22%、85.90%、78.18%和80.71%。本研究为发光杆菌利用糖蜜开发生物絮凝剂的研究及应用奠定了基础。
[1]吴毅刚,王涵.微生物絮凝剂的研究及应用现状[J].煤炭加工与综合利用,2023(8):20-25.
[2]林杨,刘淼,林锋.微生物絮凝剂研究进展及其在食品工业中的应用[J].中国酿造,2018,37(1):1-6.
[3]叶永丽,扈晓鹏,高旭东.微生物絮凝剂在食品工业中的应用进展[J].中国酿造,2014,33(4):1-4.
[4]赵诗琪,李康辉,陈猷鹏.微生物絮凝剂及其在工业水处理中的应用探索[J].工业水处理,2023,43(2):1-13.
[5]于涛.复合生物絮凝剂的分离纯化及对亚甲基蓝脱色效果研究[D].哈尔滨:黑龙江大学,2011.
[6]李政伟,张金良,蔡明.微生物絮凝剂在生活污水处理中的应用进展[J].水处理技术,2023,49(2):25-29,34.
[7]覃思绮,冯惠芳,刘一凤.产微生物絮凝剂菌株的分离及絮凝特性研究[J].环境污染与防治,2024,46(5):684-688.
[8]文遥,刘小燕,冯兴浪.微生物絮凝剂在净化水产养殖尾水研究中的应用[J].当代水产,2022,47(12):63-64,67.
[9]梁雨.低温Pseudomonas sp.HD8产絮凝剂的分离提取及絮凝机制的研究[D].哈尔滨:黑龙江大学,2014.
[10]尹乐斌,杨爱莲,刘丹.豆制品废水制备微生物絮凝剂培养条件优化及产物成分分析[J].中国酿造,2021,40(6):176-181.
[11]彭翠珍,宗绪岩,徐勇.酿酒废水产微生物絮凝剂菌株的筛选及发酵条件优化[J].中国酿造,2017,36(9):92-97.
[12]HADIYANTO H, WIDAYAT W, PRATIWI M E, et al.Effect of pH,cationic inducer, and clam shells as bio-flocculant in the optimization of the flocculation process for enhanced microalgae harvesting using response surface methodology[J].Environ Poll Bioavailab,2022,34(1):338-351.
[13]毛艳丽,王远红,刘瑞群.利用糖蜜废水生产微生物絮凝剂及其絮凝条件优化[J].中国给排水,2008,24(23):20-28.
[14]吴鹏,张锐,范欣竹.微生物絮凝剂提取方法的优化及其对废水中木质纤维类污染物的絮凝机理[J].环境工程学报,2022,16(1):343-354.
[15]渠兆曦.猪场污泥中生物絮凝剂的提取及应用研究[D].武汉:华中农业大学,2023.
[16]ZHONG C Y,XU A H,CHEN L,et al.Production of a bioflocculant from chromotropic acid waste water and its application in steroid estrogen removal[J].Colloid Surface B,2014,122:729-737.
[17]DAUD M N, ABDULLAH S R S, HASAN A H.Response surface methodological analysis for the optimization of acid-catalyzed transesterification biodiesel wastewater pre-treatment using coagulation flocculation process[J].Process Saf Environ,2018,113184-192.
[18]裴润全.多种微生物絮凝剂的去除水中铅锌离子的效能与机制[D].桂林:桂林理工大学,2021.
[19]华景秋.利用芽孢杆菌在高盐浓度下生产微生物絮凝剂的机理及应用研究[D].南京:南京林业大学,2021.
[20]陈婷.多糖型微生物絮凝剂去除水中重金属离子的效能及机制[D].哈尔滨:哈尔滨工业大学,2017.
[21]SIVASANKAR P,POONGODI S,LOBO A O,et al.Characterization of a novel polymeric bioflocculant from marine actinobacterium Streptomyces sp.and its application in recovery of microalgae[J].Int Biodeter Biodegr,2020,148:104883.
[22]XIA M C,ZHOU H,AMANZE C,et al.A novel polysaccharides-based bioflocculant produced by Bacillus subtilis ZHX3 and its application in the treatment of multiple pollutants[J].Chemosphere,2021,289:133185-133185.
[23]RAJIVGANDHI G, VIMALA R T V, MARUTHUPANDY M, et al.Enlightening the characteristics of bioflocculant of endophytic actinomycetes from marine algae and its biosorption of heavy metal removal[J].Environ Res,2021,200:111708-111708.
[24]SOBECK D C, HIGGINS M J.Examination of three theories for mechanisms of cation-induced bioflocculation[J].Water Res,2002,36(3):527-538.
[25]杨慧敏,曾礼兰,贺富强.响应面法优化超压肠杆菌利用黄水生产微生物絮凝剂[J].中国酿造,2020,39(2):78-83.
[26]李琪,张慧,安超.响应面法优化苦瓜甙的提取工艺及其HPLC测定[J].安徽农业大学学报,2022,49(1):175-180.
[27]LIANG R H, LI Y, HUANG L, et al.Pb2+ adsorption by ethylenediamine-modified pectins and their adsorption mechanisms[J].Carbohyd Polym,2020,234:115911.
[28]HUANG J, HUANG Z, ZHOU J, et al.Enhancement of heavy metals removal by microbial flocculant produced by Paenibacillus polymyxa combined with an insufficient hydroxide precipitation[J].Chem Eng J,2019,374:880-894.
[29]AYANGBENRO S A, BABALOLA O O, AREMU S O.Bioflocculant production and heavy metal sorption by metal resistant bacterial isolates from gold mining soil[J].Chemosphere,2019,231:113-120.
[30]张莎.微生物絮凝剂产生菌的筛选和絮凝剂的分离纯化及特性研究[D].秦皇岛:燕山大学,2014.