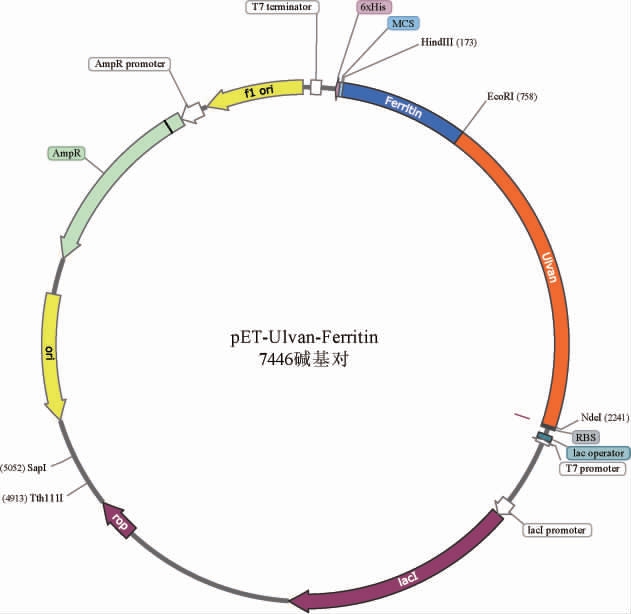
图1 表达载体pET-Ulvan-Ferritin质粒图
Fig.1 Diagram of the expression vector pET-Ulvan-Ferritin plasmid
Preparation process of ulva oligosaccharides by self-immobilized enzyme method
石莼(Ulva)是一类广泛分布于全球海洋中的绿色大型海藻,其细胞壁中富含石莼多糖(ulvan)。石莼多糖是一种复杂的杂多糖,由3-硫酸鼠李糖、艾杜糖醛酸、葡萄糖醛酸和木糖等组成,具有抗肿瘤、抗凝血、降血脂、抗病毒、防辐射、抗氧化等多种生物活性[1-2],在食品、医药、化妆品等领域具有广阔的应用前景[3]。然而,天然石莼多糖分子质量大、溶解性差,限制了其直接应用。将石莼多糖降解为石莼寡糖更容易被机体吸收利用,且生物活性更高[4-7],具有广阔的应用前景[8]。
目前,制备石莼寡糖的方法主要包括酸水解法和酶解法。相比于酸水解法,酶解法温和,产物结构可控且对环境友好,因此受到广泛关注[9-10]。研究者从海洋微生物中筛选出多种石莼多糖裂解酶,包括溶菌酶和糖苷酶,并应用于石莼多糖的酶解制备石莼寡糖[11]。XU F等[12]从海洋细菌中克隆出PL24 ulvan裂解酶,该酶可有效降解石莼多糖,主要产物为低聚糖。石莼多糖裂解酶是石莼寡糖绿色生产工艺中关键的一类工具酶,但目前报道的大多数石莼多糖裂解酶由于活性低和稳定性差,很少应用于工业生产[13]。因此挖掘并开发活性高且性质稳定的石莼多糖裂解酶,在未来石莼多糖的高值化利用中具有重要意义。近年来,酶的固定化技术为提高酶的稳定性和可重复使用性提供了新思路。LI N等[14]将β-木糖苷酶和木聚糖酶固定在金属有机框架UiO-66-NH2上,固定化酶在生产低聚木糖的同时,还提高了酶的稳定性。然而,传统的酶固定化方法仍存在载体成本高等不足。因此,迫切需要开发一种低成本固定化石莼多糖裂解酶的方法。
Ferritin作为主要的铁储存蛋白,广泛存在于大多数活细胞中,具有良好的生物相容性。它由24个亚基组成,形成高度对称的纳米笼结构,且可自发组装[15-16]。其独特的纳米笼结构和生化特性,能够很好地满足石莼多糖裂解酶的宏量制备。鉴于此,本研究通过基因工程技术构建带有铁蛋白(Ferritin)标签的石莼多糖裂解酶(Ulvan-Ferritin,Ulvan-F)质粒载体,通过其独特的自组装特性,制备自固定化酶并应用于酶解石莼多糖。采用单因素试验和响应面试验优化其发酵工艺条件,并对其制备石莼寡糖的重复使用率、得率及分子质量进行测定。以期为石莼寡糖的工业化生产提供一种高效、环保的新方法,为石莼寡糖的开发应用提供重要技术支撑,促进石莼多糖资源的高值化开发利用。
1.1.1 材料
石莼:采自福建省漳州市东山县;游离石莼多糖裂解酶酶液:本实验室制备保存。
1.1.2 试剂
氨苄青霉素钠、甘油、异丙基硫代-β-D-半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):北京索莱宝科技有限公司;蛋白胨、酵母粉:英国OXIOD公司;十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶试剂盒:上海碧云天生物技术有限公司;4×Laemmli Sample Buffer、10×Tris-Glycine-SDS电泳缓冲液:美国BIO-RAD公司;Fast Blue蛋白快速染色液:美国Biosharp公司;Britton-Robinson缓冲液:上海酶联生物科技有限公司;盐酸、氢氧化钠:国药集团化学试剂有限公司。所用试剂均为分析纯或生化试剂。
1.1.3 培养基
LB液体培养基:胰蛋白胨10 g,酵母粉5 g,NaCl 10 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
TB液体培养基:胰蛋白胨12 g,酵母粉24 g,甘油4 mL,磷酸二氢钾2.2 g,磷酸氢二钾9.4 g,蒸馏水1 000 mL,121 ℃高压蒸汽灭菌20 min。
UH5300紫外分光光度计、CR22N高速冷冻离心机:日立科学仪器(北京)有限公司;Muitiskan SkyHigh酶标仪:赛默飞世尔科技(中国)有限公司;HH-2恒温水浴锅:赛多利斯科学仪器(北京)有限公司;Waters 2695 HPLC仪:美国Waters公司;RXH-8热风循环烘箱:南京銮豪机械设备有限公司;DF-101S集热式恒温加热磁力搅拌器:巩义市予华仪器有限责任公司;ZD-9950转移摇床:其林贝尔仪器制造有限公司;JY92-IIN超声波细胞粉碎机:宁波新芝生物科技股份有限公司;ZQTY-90S振荡培养箱:上海知楚仪器有限公司;SW-CJ-1FD洁净工作台:苏净基团苏州安泰空气技术有限公司;GIS-2008成像系统:上海天能科技有限公司。
1.3.1 自固定化酶质粒构建及表达
目的基因Ulvan-Ferritin由苏州金唯智生物科技有限公司合成并测序,然后通过NdeⅠ和HindⅢ限制性酶切位点将目的基因克隆到质粒pET-22b(+),成功构建了表达载体pET-Ulvan-Ferritin(图1)。

图1 表达载体pET-Ulvan-Ferritin质粒图
Fig.1 Diagram of the expression vector pET-Ulvan-Ferritin plasmid
重组大肠杆菌在含氨苄青霉素钠(100 mg/mL)的LB肉汤培养基中,37 ℃、200 r/min条件下活化过夜。然后按菌液∶培养基的体积比为1∶100接种至TB肉汤培养基中,37 ℃、200 r/min条件下培养。培养至OD600值达到0.6~0.8时加入IPTG(100 mmol/L),在18 ℃、180 r/min下诱导18 h[17]。收集菌体,置于Tris-HCl缓冲液(50 mmol/L,pH 9.0)中,冰浴超声破碎。破碎条件为:功率420 W,工作2 s,停顿4 s,总超声时间20 min。随后,4 000×g离心10 min,重复2次,收集沉淀物。通过SDS-PAGE鉴定蛋白纯度。纯化后的蛋白加少量Tris-HCl缓冲液,冷冻保存。
1.3.2 石莼多糖的制备
石莼60 ℃烘干,粉碎过50目筛,以料液比1∶40(g∶mL)加水,超声提取(60 ℃,45 kHz、300 W)。将提取溶液以5 000 r/min离心10 min,最终体积浓缩500 mL。通过添加4倍体积的体积分析95%乙醇,醇沉石莼多糖,冻干保存。
1.3.3 石莼寡糖制备工艺条件优化单因素试验
固定化酶酶解工艺条件为0.1 g石莼多糖溶于Tris-HCl缓冲液(50 mmol/L、pH 7.0)配制成1%石莼多糖溶液。取350 μL溶液向其加入50 μL的Ulvan-F酶溶液,于35 ℃的水浴锅中酶解1 h。考察不同酶解体系(Tris-HCl缓冲液、磷酸盐(phosphate buffer solution,PBS)缓冲液、伯瑞坦-罗宾森(Britton-Robinson,B-R)缓冲液、超纯水)、不同酶解pH值(7、8、9、10)、不同酶解温度(15 ℃、25 ℃、35 ℃、45 ℃)、不同底物浓度(1%、3%、5%、7%)对石莼寡糖得率的影响。
1.3.4 石莼寡糖得率测定
采用DNS法测定石莼寡糖得率[18]。以鼠李糖质量浓度(x)为横坐标,以OD540 nm值(y)为纵坐标绘制标准曲线,得到标准曲线回归方程为y=1.494 5x-0.053,相关系数R2为0.990 9。取400 μL在不同酶解条件下得到的石莼寡糖溶液,加入400 μL DNS试剂,沸水浴5 min,冷却后加入1.6 mL蒸馏水,测定OD540nm值,根据回归方程计算石莼寡糖浓度。石莼寡糖得率计算公式如下:
式中:Ca为石莼寡糖质量浓度,mg/mL;V为样品体积,mL;Mb为石莼多糖质量,g。
1.3.5 石莼寡糖制备工艺条件优化响应面试验
在单因素试验结果的基础上,以酶解pH(A)、酶解温度(B)及底物浓度(C)为自变量,以石莼寡糖得率(Y)为响应值,根据Box-Behnken设计原理,选取了3因素和3水平响应面试验,进行酶解工艺优化[19],Box-Behnken试验设计因素与水平见表1。
表1 酶解工艺优化Box-Behnken试验设计因素与水平
Table 1 Factors and levels of Box-Behnken tests for enzymatic hydrolysis process optimization

水平 A 酶解pH B 酶解温度/℃ C 底物浓度/%-1 0 1 8 9 1 0 15 25 35 1 3 5
1.3.6 自固定化酶重复使用率测定
在最适酶解条件下,将Ulvan-F酶解液与石莼多糖进行1 h的酶解。酶解结束后,将酶解液立即以4 ℃、12 000 r/min的条件离心2 min分离上清液和沉淀,测定分离上清液的吸光度值(OD540 nm值)。接着将沉淀物(Ulvan-F)回收,用Tris-HCl缓冲液清洗,然后加入相同体积的Tris-HCl缓冲液来悬浮沉淀物,再加入新的石莼多糖溶液进行下一轮酶解。第一轮酶解的寡糖得率被定义为100%,计算每轮酶解寡糖相对得率。
1.3.7 自固定化酶及游离酶制备石莼寡糖得率对比
自固定化酶制备石莼寡糖:在最适酶解条件下,将Ulvan-F与石莼多糖进行1 h的酶解。酶解结束后,将酶解液在4 ℃、12 000 r/min的条件离心2 min,以分离上清液和沉淀。上清液即为石莼寡糖溶液,通过DNS显色法测定石莼寡糖得率。沉淀物(Ulvan-F)被回收,并用Tris-HCl缓冲液清洗,然后加入等体积的Tris-HCl缓冲液悬浮沉淀物,再加入新的石莼多糖溶液进行下一轮酶解。重复进行10轮酶解,计算石莼寡糖总得率。
游离酶制备石莼寡糖:在最适酶解条件下,将游离石莼多糖裂解酶与石莼多糖进行10 h的酶解,于100 ℃煮沸5 min使酶灭活,离心收集上清即为石莼寡糖溶液,计算石莼寡糖得率。
1.3.8 自固定化酶法制备石莼寡糖分子质量测定
采用高效液相色谱法,根据样品的保留时间对石莼寡糖的分子质量进行测定。
样品制备:精密称取0.1 g石莼多糖,溶于Tris-HCl缓冲液(50 mmol/L、pH 9.0)配制成1%石莼多糖溶液。取2 mL溶液向其加入250 μL Ulvan-F酶溶液于25 ℃的水浴锅中酶解1 h,离心收集上清即为石莼寡糖溶液。上述样品在进柱前使用0.22 μm滤膜过滤杂质,防止堵塞色谱柱。
色谱条件:采用配备有示差折光检测器(refractive index detector,RID)的高效液相色谱系统;UltrahydrogelTM Guard Column(6 mm×40 mm)色谱柱和UltrahydrogelTM 120(7.8 mm×300 mm)凝胶柱串联使用;Waters 2414 RID检测器;流动相为超纯水;柱温(30±0.1)℃;检测器温度(30±0.1)℃;流速0.5 mL/min;进样量10 μL。
定性分析:根据Waters PEG系列分子质量(Mw)标准品(106 Da、202 Da、430 Da、1 030 Da、1 400 Da),以出峰时间(x)为横坐标,以分子质量的对数lnMw(y)为纵坐标,绘制标准曲线,得到石莼寡糖标准曲线回归方程y=-0.470 1x+14.393,相关系数R2=0.993 7,将样品保留时间带入回归方程计算其分子质量。
1.3.9 数据处理
采用Microsoft Excel 2021初步处理试验数据,Origin 2018软件处理及生成图像,以Design Expert 13.0软件进行响应面试验设计。
蛋白Ulvan-F的SDS-PAGE分析结果见图2。由图2可知,在75 kDa有一条很明显的粗条带,其分子质量与Ulvan-F的理论分子质量(77 kDa)接近,这说明添加了Ferritin标签后,重组蛋白可以自发形成难溶活性Ulvan-F聚集体。对于传统海藻多糖裂解酶的纯化分离而言,传统方法制备酶的纯化成本约占其总成本的70%[20],在生产过程中成本较高。而Ulvan-F在宿主细胞中高效表达并超声破碎后仅需低速离心便可实现目标蛋白的纯化,与传统色谱、镍柱纯化蛋白相比,可降低酶的生产成本。
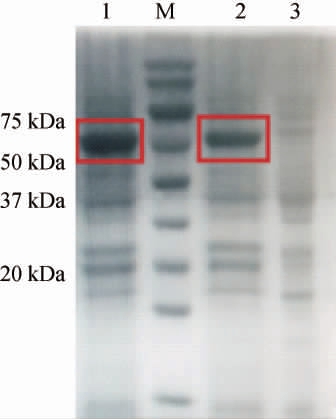
图2 蛋白Ulvan-F的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
Fig.2 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis analysis of Ulvan-F protein
M:Marker(10~180 kDa);1、2:Ulvan-F沉淀;3:Ulvan-F上清液。
2.2.1 酶解体系的测定
不同酶解体系对石莼寡糖得率的影响见图3。由图3可知,在PBS缓冲液、B-R缓冲液、超纯水中,Ulvan-F的寡糖得率分别为9.97 mg/g、6.33 mg/g、5.66 mg/g。而在Tris-HCl缓冲液中,Ulvan-F表现出最高的酶解活性,寡糖得率达到12.03 mg/g。这是由于Tris-HCl缓冲液提供了一个相对稳定的pH环境,保护了酶的活性中心,使其能够最大程度地发挥催化作用。因此,选择Tris-HCl缓冲液作为酶解体系,可最大程度地保持Ulvan-F的活性。
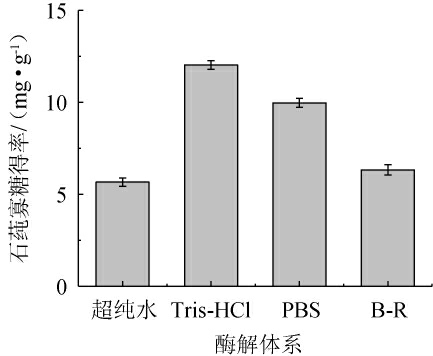
图3 不同酶解体系对石莼寡糖得率的影响
Fig.3 Effect of different enzymatic hydrolysis systems on the yield of ulva oligosaccharides
2.2.2 酶解pH值的确定
不同酶解pH值对石莼寡糖得率的影响见图4。由图4可知,当酶解pH值分别为7、8、10时,石莼寡糖得率分别为12.63 mg/g、14.12 mg/g、14.75 mg/g。而当酶解pH值为9时,Ulvan-F的酶活性最高,石莼寡糖得率为17.70 mg/g。酶的活性中心在特定的pH条件下能够保持最佳构象,从而提高酶解效率。较低的pH值(如pH=7.0)可能导致酶的活性中心质子化,影响底物的结合和催化反应。而较高的pH值(如pH=10.0)可能导致酶的构象发生变化或活性中心去质子化[21],从而降低酶的活性。因此,在实际应用中,应将酶解体系的pH值控制在9.0,以确保Ulvan-F的最高活性和稳定性。
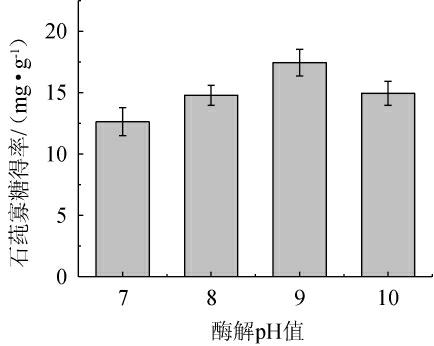
图4 不同酶解pH值对石莼寡糖得率的影响
Fig.4 Effect of different enzymatic hydrolysis pH on the yield of ulva oligosaccharides
2.2.3 酶解温度的确定
不同酶解温度对石莼寡糖得率的影响见图5。由图5可知,当酶解温度在15~25 ℃范围内增加时,石莼寡糖得率逐渐增加;当酶解温度为25 ℃时,Ulvan-F活性最高,其酶解产生的石莼寡糖得率最高可达18.01 mg/g;当酶解温度>25 ℃时,石莼寡糖得率开始下降,当酶解温度为45 ℃时石莼寡糖得率仅为13.95 mg/g。温度是影响酶活性的关键因素之一,较低的温度会降低酶分子的运动速率,从而减慢酶催化反应的速率。但温度过高则会导致酶蛋白变性,失去催化活性[22]。Ulvan-F在25 ℃时表现出最佳活性,说明在这个温度下,酶的结构最为稳定,催化效率最高。超过35 ℃时,酶活性显著下降,这是由于高温导致酶蛋白的结构破坏,从而影响其活性中心的功能。因此,选择在25 ℃条件下进行石莼多糖的酶解,以确保最高的酶解效率。
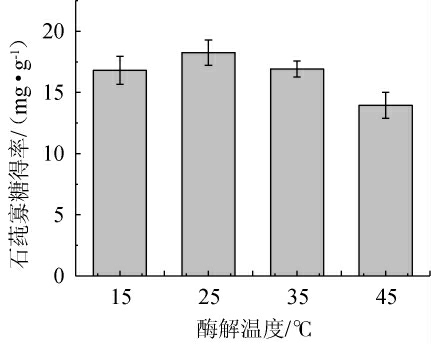
图5 不同酶解温度对石莼寡糖得率的影响
Fig.5 Effect of different enzymatic hydrolysis temperature on the yield of ulva oligosaccharides
2.2.4 底物浓度的确定
底物浓度对酶活性的影响主要体现在酶-底物复合物形成效率上。在适当的底物浓度下,酶与底物能够充分结合,形成稳定的酶-底物复合物,从而提高酶的催化效率[23]。不同底物浓度对石莼寡糖得率的影响见图6。由图6可知,当底物浓度在1%~3%范围内的增加时,石莼寡糖得率增加;当底物浓度为3%时,石莼寡糖得率达最大值,为23.55 mg/g。当底物浓度>3%时,石莼寡糖得率下降。结果表明,3%的石莼多糖浓度为Ulvan-F提供了最佳底物浓度,使其能够高效进行催化反应。低于3%的底物浓度可能导致底物不足,使酶的活性中心无法充分结合底物,从而降低酶解效率。而高于3%的底物浓度则可能导致底物过多,产生底物抑制效应,或由于溶液黏度增加,影响酶与底物的结合。因此,Ulvan-F酶解石莼多糖的最佳底物浓度为3%。
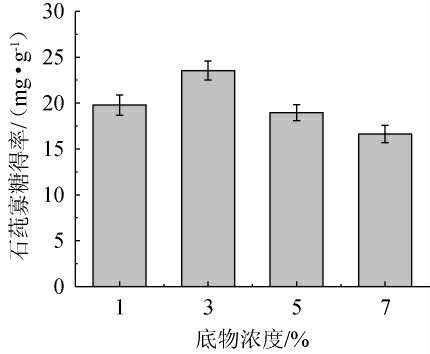
图6 不同底物浓度对石莼寡糖得率的影响
Fig.6 Effect of different substrate concentrations on the yield of ulva oligosaccharides
2.3.1 响应面试验结果及方差分析
在单因素试验结果的基础上,以酶解pH(A),酶解温度(B),底物浓度(C)为主要影响因素,以石莼寡糖得率(Y)为响应值,进行3因素3水平响应面试验,确定Ulvan-F酶解石莼多糖的最佳酶解工艺条件。Box-Behnken试验设计及结果见表2,方差分析结果见表3。
表2 酶解工艺优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken tests for enzymatic hydrolysis process optimization
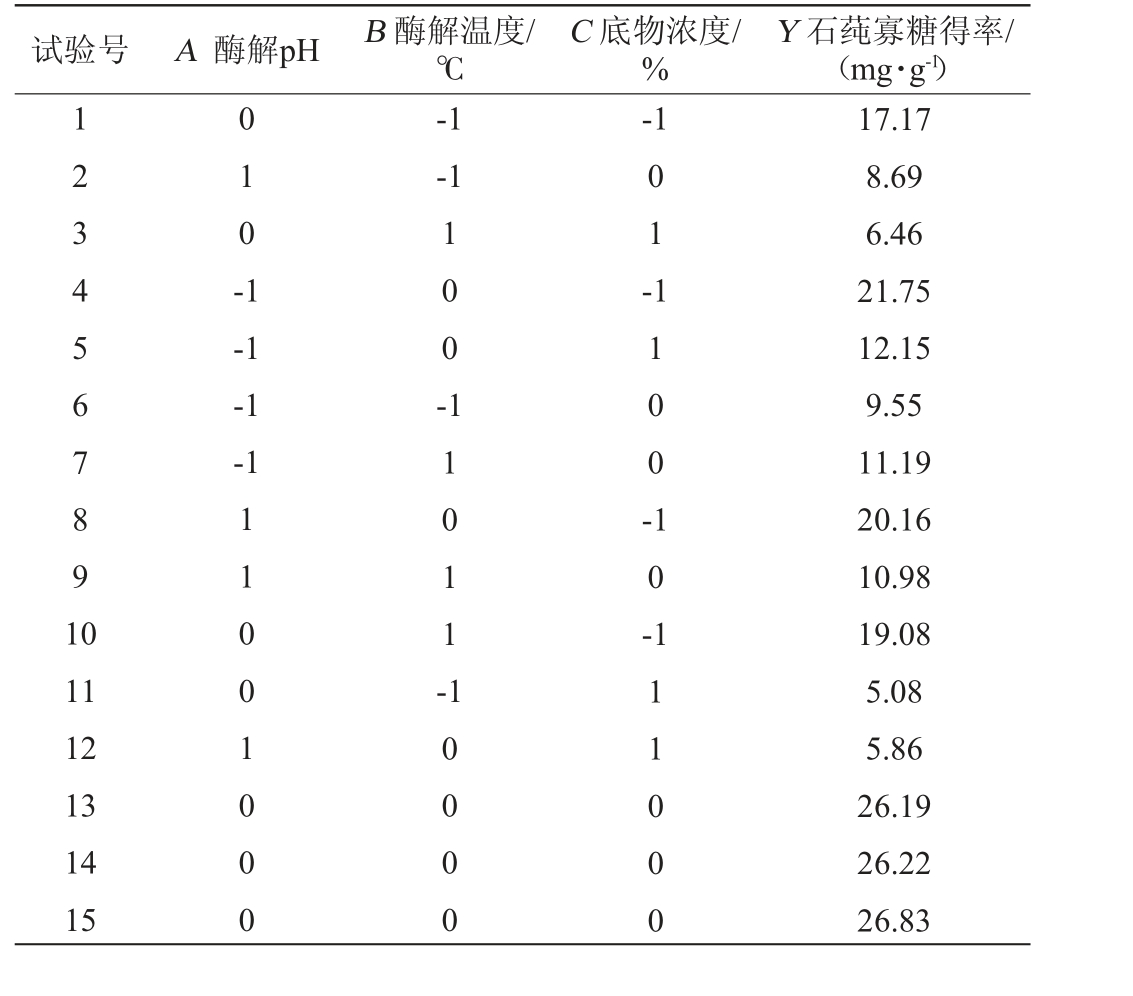
试验号 A 酶解pH B 酶解温度/℃C 底物浓度/%Y 石莼寡糖得率/(mg·g-1)1234567891 0 0 1 0 -1-1-1-1 0 1 --1-1-1 1 0 0 -1 1 0 0 -1 0 -11 12 13 14 15 11001 000 1 1 0 1 1 -10000 111000 17.17 8.69 6.46 21.75 12.15 9.55 11.19 20.16 10.98 19.08 5.08 5.86 26.19 26.22 26.83
表3 回归模型方差分析
Table 3 Variance analysis of regression model
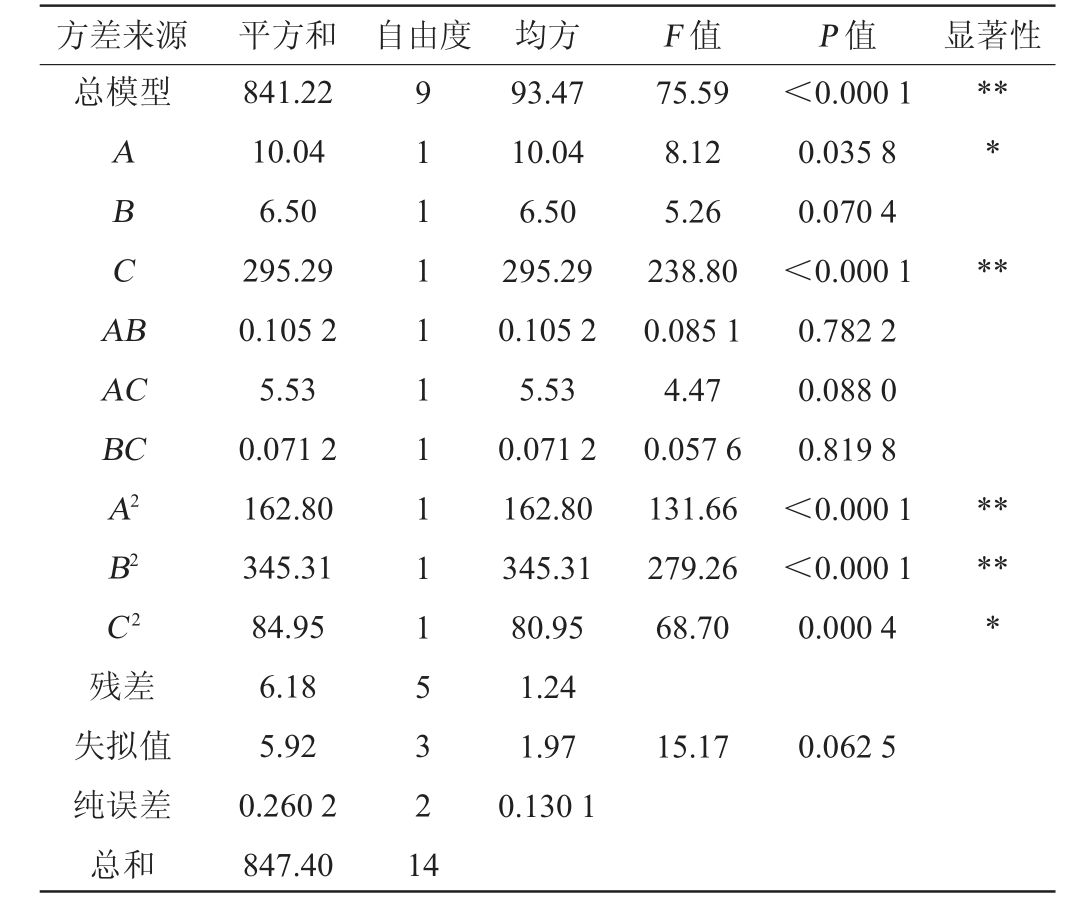
注:“**”表示对试验结果有极显著影响(P<0.01);“*”表示对试验结果有显著影响(P<0.05)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性总模型ABCA B*****AC BC A2 B2 C2残差失拟值纯误差总和841.22 10.04 6.50 295.29 0.105 2 5.53 0.071 2 162.80 345.31 84.95 6.18 5.92 0.260 2 847.40 9 1 1 1 1 1 1 1 1 1 5 3 2 1 4 93.47 10.04 6.50 295.29 0.105 2 5.53 0.071 2 162.80 345.31 80.95 1.24 1.97 0.130 1 75.59 8.12 5.26 238.80 0.085 1 4.47 0.057 6 131.66 279.26 68.70<0.000 1 0.035 8 0.070 4<0.000 1 0.782 2 0.088 0 0.819 8<0.000 1<0.000 1 0.000 4*****15.17 0.062 5
利用Design Expert 13.0软件对表2中的数据进行二次多元回归拟合,得到石莼寡糖得率(Y)对酶解pH(A)、酶解温度(B)及底物浓度(C)的多元二次回归方程:
由表3可知,该回归模型极其显著(P<0.01),而失拟项不显著(P>0.05),决定系数R2=0.997 2,校正决定系数R2Adj=0.979 6,说明该模型可以解释97.96%的石莼寡糖得率响应值的变化,说明石莼寡糖得率的实测值与预测值之间的拟合度较好。由此可见,该二次回归模型可以用来分析与预测该酶解工艺中石莼寡糖得率的实际情况。由P值可知,一次项C,二次项A2、B2对石莼寡糖得率的影响极显著(P<0.01);一次项A、二次项C2对石莼寡糖得率的影响显著(P<0.05)。其他项对结果影响不显著(P>0.05)。由F值可知,对于石莼寡糖得率的影响程度大小排序为:底物浓度(C)>酶解pH(A)>酶解温度(B)。
2.3.2 响应面交互作用分析
根据响应曲面的陡峭程度、等高线的形状和稀疏程度,可以推测出每个因素之间的交互作用对石莼寡糖得率的影响[24]。各因素间交互作用对石莼寡糖得率影响的响应曲面及等高线见图7。由图7可知,酶解pH(A)和底物浓度(C)交互作用的响应曲面陡峭,等高线接近椭圆形,说明AC交互作用对石莼寡糖得率影响较大,这与回归模型方差分析结果一致。
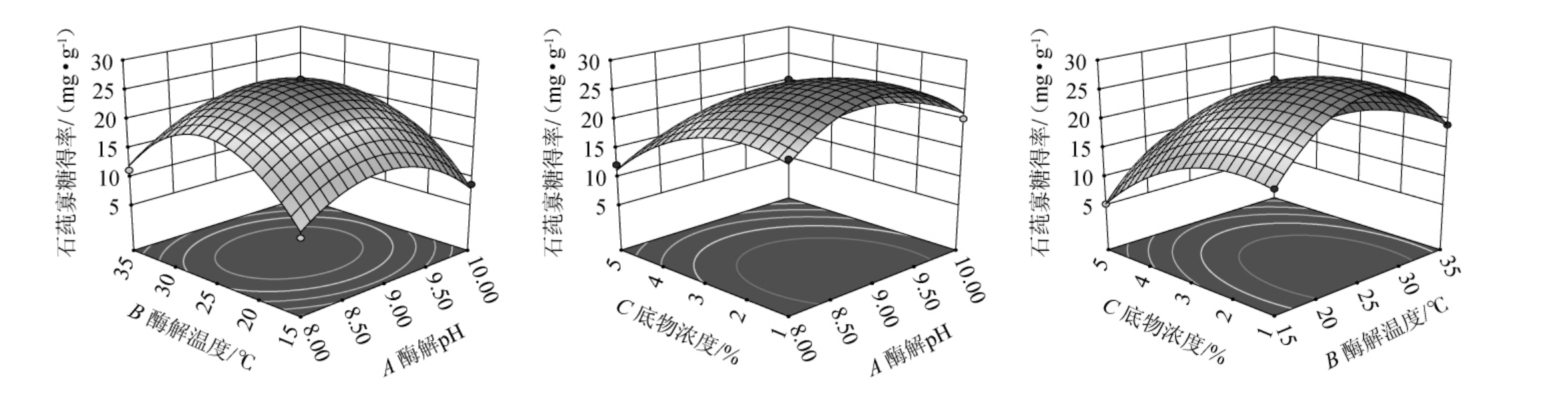
图7 酶解pH、酶解温度、底物浓度间交互作用对石莼寡糖得率影响的响应曲面及等高线
Fig.7 Response surface plots and contour lines of effects of interaction between enzymatic hydrolysis pH, enzymatic hydrolysis temperature and substrate concentration on the yield of ulva oligosaccharides
2.3.3 验证试验
通过Design Expert 13.0软件分析得出Ulvan-F最佳酶解条件为底物浓度2.48%、酶解pH 9.3、酶解温度25.43 ℃。在此优化条件下,石莼寡糖得率预测值为27.44 mg/g。为了方便操作,将最佳酶解条件修正为底物浓度2.50%、酶解pH 9.0、酶解温度25 ℃,在此条件下进行3次平行验证试验,石莼寡糖得率实际值为27.76 mg/g,与理论预测值27.44 mg/g接近,表明回归模型与试验结果符合良好,能够真实反映底物浓度、酶解pH、酶解温度对石莼寡糖得率的影响。
自固定化酶的重复使用性是评估其工业应用潜力的重要指标。Ulvan-F制备石莼寡糖的重复使用次数相对得率分析见图8。
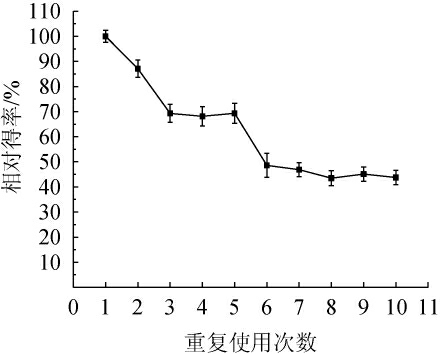
图8 重复使用Ulvan-F制备石莼寡糖的相对得率分析
Fig.8 Relative yield analysis of ulva oligosaccharides with Ulvan-F after reuse
由图8可知,在最佳酶解条件下,Ulvan-F经过5轮重复使用后,其相对酶活仍能保持69.33%,经过10轮重复使用后,其相对酶活仍能保持43.77%。随着重复使用次数的增加,由于频繁的离心和洗涤,Ulvan-F在转移过程中可能有所损失,导致在相同的酶解时间内没有足够的酶与底物酶解,石莼寡糖得率有所下降。与其他固定化海藻多糖裂解酶相比,Ulvan-F不仅保持了较高的酶活性,还简化了复杂的固定化过程,避免了昂贵的固定化载体费用。例如,AKSU A等[25]使用戊二醛作为交联剂将海藻酸裂解酶固定在磁性纳米颗粒上,该固定化酶仅在6次循环使用后,活性保留率下降至50%。这些结果显示,自固定化酶Ulvan-F在实际应用中的可行性和经济性,为石莼寡糖的工业化生产提供了有力支持。
Ulvan-F制备石莼寡糖重复使用次数得率分析见图9。由图9可知,Ulvan-F重复使用10轮次,每轮酶解1 h的石莼寡糖得率分别为26.61 mg/g、23.18 mg/g、18.43 mg/g、18.13 mg/g、18.45 mg/g、12.92 mg/g、12.48 mg/g、11.57 mg/g、12.01 mg/g、11.65 mg/g。石莼寡糖总得率为165.43 mg/g,并且Ulvan-F仍保留43.77%的初始酶活。
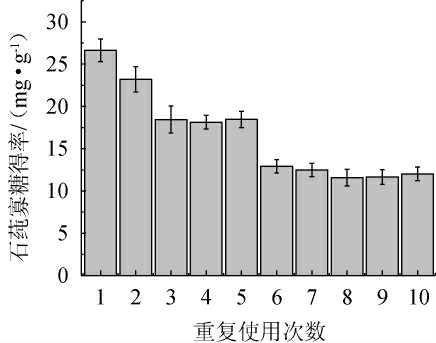
图9 重复使用Ulvan-F制备石莼寡糖得率分析
Fig.9 Yield analysis of ulva oligosaccharides with Ulvan-F after reuse
游离酶酶解10 h后石莼寡糖的得率为117.82 mg/g,相比传统的游离酶,Ulvan-F不仅能实现大分子蛋白(酶)与产物的有效分离,便于进一步纯化酶解产物,同时其可重复使用特性有效降低了酶的使用成本。
Ulvan-F酶解后产物的HPLC检测结果见图10。由图10可知,HPLC图谱中出现了2个峰,其在11.63 min和17.60 min处的响应值分别为100 mV、300 mV。根据回归方程计算,这2个峰对应的平均分子质量分别为55 488 6 Da和492.36 Da,推测11.63 min处的峰对应物质为石莼聚糖,而17.60 min处的峰对应物质为石莼寡糖。
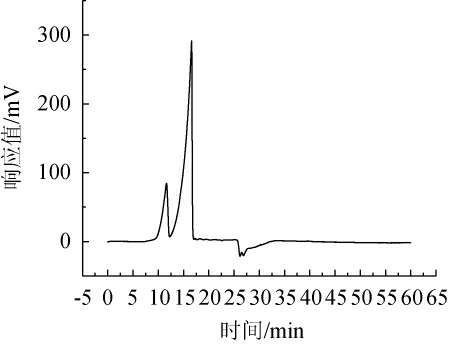
图10 Ulvan-F酶解产物的高效液相色谱分析
Fig.10 HPLC analysis of the enzymatic hydrolysis products by Ulvan-F
本研究通过基因工程技术构建带有铁蛋白(Ferritin)标签的石莼多糖裂解酶(Ulvan-Ferritin,Ulvan-F)质粒载体,通过其独特的自组装特性,制备自固定化酶并应用于酶解石莼多糖。其最佳酶解工艺条件为:酶解温度25 ℃,酶解pH 9.0,底物浓度2.50%。在该优化条件下,石莼寡糖得率为27.76 mg/g,Ulvan-F重复使用10次后依旧保持较高活性,石莼寡糖总得率可达165.43 mg/g,优于游离酶。Ulvan-F酶解产物平均分子质量为492.36 Da。Ulvan-F仅需低速离心便可实现目标蛋白的纯化,极大简化了酶的纯化过程,以及其可重复性在实现酶与产物分离以及减少大分子蛋白对产物活性、降低生产成本影响方面显示出显著优势。综上所述,本研究优化了自固定化酶法制备石莼寡糖的工艺,对石莼寡糖的宏量制备和进一步深入研究具有指导意义。
[1]CHI Y,LI H,WANG P,et al.Structural characterization of ulvan extracted from ulva clathrata assisted by an ulvan lyase[J].Carbohydr Polym,2020,229:115497.
[2]胡富,李谦,朱本伟,等.石莼多糖裂解酶的研究进展[J].中国生物工程杂志,2019,39(8):104-113.
[3]董方.PL36家族褐藻酸裂解酶和PL24家庭石莼多糖裂解酶的酶学性质、结构和催化机制[D].济南:山东大学,2020.
[4]LIU X,LIU D,LIN G,et al.Anti-ageing and antioxidant effects of sulfate oligosaccharides from green algae ulva lactuca and Enteromorpha prolifera in SAMP8 mice[J].Int J Biol Macromol,2019,139:342-351.
[5]CHI Y,ZHANG M,WANG X,et al.Ulvan lyase assisted structural characterization of ulvan from ulva pertusa and its antiviral activity against vesicular stomatitis virus[J].Int J Biol Macromol,2020,157:75-82.
[6]CHEN Y,WU W,NI X,et al.Regulatory mechanisms of the green alga Ulva lactuca oligosaccharide via the metabolomics and gut microbiome in diabetic mice[J].Curr Res Food Sci,2022,5:1127-1139.
[7]FLÓREZ-FERNÁNDEZ N,RODRÍGUEZ-COELLO A,LATIRE T,et al.Anti-inflammatory potential of ulvan[J].Int J Biol Macromol,2023,253:126936.
[8]ZHENG L,LIU Y,TANG S,et al.Preparation methods,biological activities,and potential applications of marine algae oligosaccharides:a review[J].Food Science and Human Wellness,2023,12:359-370.
[9]刘倩,晋文慧,矫浩田,等.长茎葡萄蕨藻中β-1,3-木聚糖的提取工艺优化及单糖组成分析[J].食品工业科技,2023,44(16):210-217.
[10]LUAN T,HU S,NIE W,et al.Recent advances in marine oligosaccharides:a review of bioactivities and application[J].J Funct Foods,2023,108:105754.
[11]COSTA M M, PIO L B, BULE P, et al.Recalcitrant cell wall of ulva lactuca seaweed is degraded by a single ulvan lyase from family 25 of polysaccharide lyases[J].Anim Nutr,2022,9:184-192.
[12]XU F, DONG F, SUN X H, et al.Mechanistic insights into substrate recognition and catalysis of a new ulvan lyase of polysaccharide lyase family 24[J].Appl Environ,2021,87(12):e0041221.
[13]TANG T,CAO S,ZHU B,et al.Ulvan polysaccharide-degrading enzymes:an updated and comprehensive review of sources category, property,structure,and applications of ulvan lyases[J].Algal Res,2021,60:102477.
[14]LI N,XIA H,JIANG Y,et al.Co-immobilization of β-xylosidase and endoxylanase on zirconium based metal-organic frameworks for improving xylosidase activity at high temperature and in acetone[J].Bioresource Technol,2023,383:129240.
[15]UCHIDA M,KANG S,REICHHARDT C,et al.The ferritin superfamily:supramolecular templates for materials synthesis[J].Biochim Biophys Acta,2010,1800:834-845.
[16]SUDAREV V, GETTE M, BAZHENOV S, et al.Ferritin-based fusion protein shows octameric deadlock state of self-assembly[J].Biochem Biophys Res Commun,2024,690:149276.
[17]毛磊,刘冠章,袁航,等.可捕集CO2的纳米碳酸酐酶粒子的高效制备及性能研究[J].化工学报,2023,74(6):2589-2598.
[18]葛钟琪.基于Ferritin的自固定化及寡聚化酶的理性构建及催化性能[D].厦门:华侨大学,2021.
[19]汪梓旭,郑志国,鲍时翔,等.褐藻胶裂解酶酶学性质及酶解马尾藻工艺的响应面优化[J].中国酿造,2020,39(2):103-108.
[20]陈雅鑫,袁航,刘冠章,等.蛋白质纳米笼介导的酶自固定化研究进展[J].化工学报,2023,74(7):2773-2782.
[21]BARAZORDA H L, NEDYALKOVA M, MAS F, et al.Unveiling the effect of low pH onthe SARS-CoV-2 main protease by molecular dynamics simulations[J].Polymer,2021,13:3823.
[22]ADJOUT R,MOUGET J L,PRUVOST J,et al.Effects of temperature,irradiance,and pH on the growth and biochemical composition of Haslea ostrearia batch-cultured in an airlift plan-photobioreactor[J].Appl Microbiol Biotechnol,2022,106:5233-5247.
[23]DAVLETGILDEEVA A T,ISHCHENKO A A,SAPARBAGEV M,et al.The enigma of substrate recognitionand catalytic efficiency of APE1-like enzymes[J].Front Cell Dev Biol,2021,9:617161.
[24]廖静如,杜冰,刘志伟,等.超声辅助优化制备壳寡糖-果胶稳定的Pickering乳液工艺及稳定性分析[J].食品工业科技,2023,44(13):9-20.
[25]AKSU A,ÇETINKAYA S,YENIDÜNYA A F,et al.Immobilization of pectinase on chitosan-alginate-clay composite beads: Experimental,DFT and molecular docking studies[J].J Mol Liq,2023,390:122947.