海洋来源成团泛菌Y-03产低温甾醇酯酶发酵条件优化
魏振勇1,于 爽1,2,迟雪梅1,2,郭信志1,王 聪1,孙 溪1,迟乃玉1,2,张庆芳1,2*
(1.大连大学 生命健康学院,辽宁 大连 116622;2.辽宁省海洋微生物工程技术研究中心,辽宁 大连 116622)
摘 要:为提高海洋来源成团泛菌(Pantoea agglomerans)Y-03产低温甾醇酯酶的酶活力,该研究首先通过单因素试验及Plackett-Burman(PB)试验确定成团泛菌Y-03产低温甾醇酯酶酶活的显著影响因素,然后运用Box-Behnken(BB)响应面试验对其发酵工艺进行优化。结果表明,成团泛菌Y-03产低温甾醇酯酶的最适发酵工艺为葡萄糖添加量3.7%、胰蛋白胨添加量1.3%、K2HPO4添加量0.4%、初始pH值8、转速180 r/min、接种量4%、装液量44 mL/250 mL、发酵温度27 ℃。在此优化条件下,甾醇酯酶活力为484.24 U/L,相比于优化前酶活力提高143.89%。该研究为提高成团泛菌的甾醇酯酶产量及酶活力和未来放大生产研究奠定了基础。
关键词:甾醇酯酶;成团泛菌;发酵工艺优化;响应面法
中图分类号:TS201.3
文章编号:0254-5071(2025)01-0219-07
doi: 10.11882/j.issn.0254-5071.2025.01.032
引文格式:魏振勇,于爽,迟雪梅,等.海洋来源成团泛菌Y-03产低温甾醇酯酶发酵条件优化[J].中国酿造,2025,44(1):219-225.
收稿日期:2024-04-24
修回日期:2024-07-14
基金项目:国家重点研发计划项目(2022YFC2805105)
作者简介:魏振勇(1994-),男,硕士,研究方向为微生物学。
*通讯作者:张庆芳(1965-),女,教授,博士,研究方向为食品微生物与应用。
Optimization of fermentation conditions for low-temperature sterol esterase production by Pantoea agglomerans from marine
WEI Zhenyong1,YU Shuang1,2,CHI Xuemei1,2,GUO Xinzhi1,WANG Cong1,SUN Xi1,CHI Naiyu1,2,ZHANG Qingfang1,2*
(1.College of Life and Health,Dalian University,Dalian 116622,China,2.Marine Microbiology Engineering Research Center of Liaoning Province,Dalian 116622,China)
Abstract:In order to improve the enzymatic activity of low-temperature sterol esterase produced by Pantoea agglomerans Y-03 from marine,the significant factors affecting enzymatic activity of low temperature sterol esterase produced by P. agglomerans Y-03 were determined by single factor tests and Plackett-Burman(PB) tests, and the fermentation process was optimized by Box-Behnken (BB) response surface tests.The results showed that the optimal fermentation process for producing low-temperature sterol esterase by P. agglomerans Y-03 were glucose 3.7%, tryptone 1.4%,K2HPO4 0.4%, initial pH 8, rotational speed 180 r/min, inoculum 4%, liquid loading volume 45 ml/250 ml, fermentation temperature 27 ℃.Under these optimal conditions,the sterol esterase activity was 484.24 U/L,which was 143.89%higher than that before optimization.This study laid a foundation for improving the yield and activity of sterol esterase produced by P.agglomerans and for future research on scale-up production.
Key words:sterol esterase;Pantoea agglomerans;fermentation process optimization;response surface method
甾醇酯酶(EC 3.1.1.13)属于酯酶的一种,又被称为胆固醇酯酶,其在体内主要负责将胆固醇和脂肪酸衍生物结合在一起形成脂质颗粒,并将其储存在细胞内或输送到其他部位,在胆固醇代谢中具有重要作用,其缺乏可能导致高胆固醇症等疾病[1]。甾醇酯酶可以在水溶液中产生聚集体并催化胆固醇酯水解为胆固醇和脂肪酸,而在有机溶剂中通过催化酯化反应或酯交换反应合成胆固醇酯[2]。甾醇酯酶通过基因表达后,在动物、植物及微生物胞内合成,大多数微生物可以将甾醇酯酶分泌到胞外发挥其作用[1-2]。
截止目前,已发现的可产生甾醇酯酶的微生物有莓实假单胞菌(Pseudomonas fragi)[3]、Melanocarpus albomyces[4]、红球菌属(Rhodococcus sp.)[5]、沙眼衣原体(Chlamydia trachomatis)[6]、伯克霍尔德氏菌(Burkholderia stabilis)[7]、薰衣草链霉菌(Streptomyces lavendulae)、阿维链霉菌(Strepto myces avermitilis)[8]、不动杆菌属(Acinetobacter sp.)[9]、金黄杆菌属(Chryseobacterium sp.)[10]、柱状假丝酵母(Candida cylindracea)[11]、从线嘴壳菌(Ophiostoma piceae)[12]、金黄色葡萄球菌(Staphylococcus aureus)[13]等,但产量普遍偏低。为提高甾醇酯酶的产量及活性,目前主要通过优化菌株的发酵培养基及发酵条件,优化方法主要包括正交法、响应面法等[14]。权浩严等[15]采用正交法对毕赤酵母(Pichia pastoris)产胆固醇酯酶的发酵条件及发酵培养基成分进行优化,结果胆固醇酯酶活力提高3.65倍;韩廷玉等[16]采用响应面法对莓实假单胞菌产胆固醇酯酶的发酵条件进行优化,结果酶活力提高1.33倍。
甾醇酯酶因其具有广泛的底物作用范围,在食品、医疗和化工产业都发挥重要的作用,但如今对甾醇酯酶的研究主要集中在陆地上的中、高温酶,对海洋来源的低温甾醇酯酶研究较少[17-18]。因此,本研究以海洋来源的成团泛菌(Pantoea agglomerans)Y-03作为出发菌株,以甾醇酯酶活力为响应值,采用单因素、Plackett-Burman(PB)及Box-Behnken(BB)响应面试验对其发酵工艺进行优化,为提高甾醇酯酶产量及活力和放大生产研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
成团泛菌(Pantoea agglomerans)Y-03(GenBank:CP144368.1):分离自中国渤海海域(121°78'85.73''E,39°01'79.07''N)50~90 m深度处海底泥,保藏于辽宁省海洋微生物工程技术研究中心。
1.1.2 试剂
亚油酸胆固醇酯(分析纯):上海泰坦科技股份有限公司;辣根过氧化物酶(peroxidase,POD)(200 U/mg):北京索莱宝科技有限公司;胆固醇氧化酶(cholesterol oxidase,COD)(1 000 U/mL)、4-氨基安替比林(分析纯):上海麦克林生化科技股份有限公司;玫瑰红B(分析纯)、聚乙烯醇(分析纯):国药集团化学试剂有限公司;植物甾醇酯(分析纯):湖南禾益元生物科技有限公司;其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
LB固体培养基[10]:酵母浸粉0.5%,胰蛋白胨1%,琼脂2%,NaCl 1%,pH 7。
种子培养基[10]:牛肉膏0.5%,胰蛋白胨1%,NaCl 1%,pH 7。
发酵培养基[10]:植物甾醇酯0.5%,K2HPO4 0.3%,胰蛋白胨1%,MgSO4·7H2O 0.3%,(NH4)2SO4 0.5%,葡萄糖3%,pH 7。
以上培养基均在121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
PHS-3E pH检测计:东莞万创电子制品有限公司;CRY-2112恒温摇床:上海茸研仪器有限公司;DK-S26恒温水浴锅:上海精宏实验设备有限公司;Multiskan1510酶标仪:芬兰Labsystems公司;YXQ-LS-100SII压力蒸汽灭菌锅:上海博迅实业有限公司;CR21N冷冻离心机:日本日立公司;LTI-700低温恒温培养箱:上海爱朗仪器有限公司。
1.3 方法
1.3.1 成团泛菌Y-03产甾醇酯酶的发酵条件
将成团泛菌Y-03划线接种于LB固体培养基上,在28 ℃条件下培养24 h,重复2次使其活化。挑取单一菌落的菌株接种于种子培养基中,在28 ℃、200 r/min条件下振荡培养24 h,作为种子液。将种子液按1%(V/V)的接种量接种于发酵培养基,装液量为50 mL/250 mL,在28 ℃、180 r/min条件下培养36 h。
1.3.2 甾醇酯酶活力的测定
将发酵液在4 ℃、8 000 r/min条件下离心10 min,取上清液为粗酶液,参照任楠楠等[19]的方法测定甾醇酯酶活力,具体方法:在3 mL 0.15 mol/L磷酸钾缓冲液(pH=7.0)中加入0.2 mmol亚油酸胆固醇酯、0.6 mg 4-氨基安替比林、2 mg苯酚、1 U COD、6 U POD、10 mg曲拉通X-100和80 μL异丙醇,加入0.2 mL酶液,在37 ℃条件下孵育6 min,以灭活酶液作为对照组,在波长500 nm处测定吸光度值,重复3次,取平均值。甾醇酯酶酶活定义:在pH 7、20 ℃条件下,每分钟催化产生1 μmol醌亚胺染料所需的酶量为一个酶活单位(U)。
1.3.3 成团泛菌Y-03产甾醇酯酶发酵培养基优化单因素试验
在发酵培养基的基础上,分别考察碳源种类(葡萄糖、蔗糖、可溶性淀粉、麦芽糖、甘油、乳糖)及添加量(2.0%、2.5%、3.0%、3.5%、4.0%、4.5%)、氮源种类(酵母粉、牛肉膏、胰蛋白胨、硫酸铵、硝酸铵、尿素)及添加量(0.5%、0.7%、0.9%、1.1%、1.3%、1.5%)、无机盐种类(K2HPO4、CaCl2、MgSO4、CuSO4)及添加量(0.1%、0.2%、0.3%、0.4%、0.5%、0.6%)对成团泛菌Y-03产甾醇酯酶活力的影响。
1.3.4 成团泛菌Y-03产甾醇酯酶发酵条件优化单因素试验
在确定发酵培养基成分及添加量后,进一步考察初始pH值(6.5、7.0、7.5、8.0、8.5、9.0)、发酵温度(23 ℃、25 ℃、27 ℃、29 ℃、31 ℃、33 ℃)、转速(165 r/min、170 r/min、175 r/min、180 r/min、185 r/min、190 r/min)、装液量(30 mL/250 mL、40mL/250mL、50mL/250mL、60mL/250mL、70mL/250mL、80 mL/250 mL)、接种量(1%、2%、3%、4%、5%、6%)对成团泛菌Y-03产甾醇酯酶活力的影响。
1.3.5 成团泛菌Y-03产甾醇酯酶发酵工艺优化Plackett-Burman试验
在单因素试验结果的基础上,以胰蛋白胨添加量(A)、葡萄糖添加量(B)、K2HPO4添加量(C)、接种量(D)、转速(E)、初始pH值(F)、装液量(G)、发酵温度(H)为考察因素,以甾醇酯酶活力为评价指标,运用Design-Expert 13分析软件设计N=11的8因素PB试验,最终确定显著影响因素,PB试验设计及结果见表1。
表1 成团泛菌Y-03产甾醇酯酶发酵工艺优化Plackett-Burman试验因素与水平
Table 1 Factors and levels of Plackett-Burman tests for fermentation process optimization of sterol esterase produced by Pantoea agglomerans Y-03
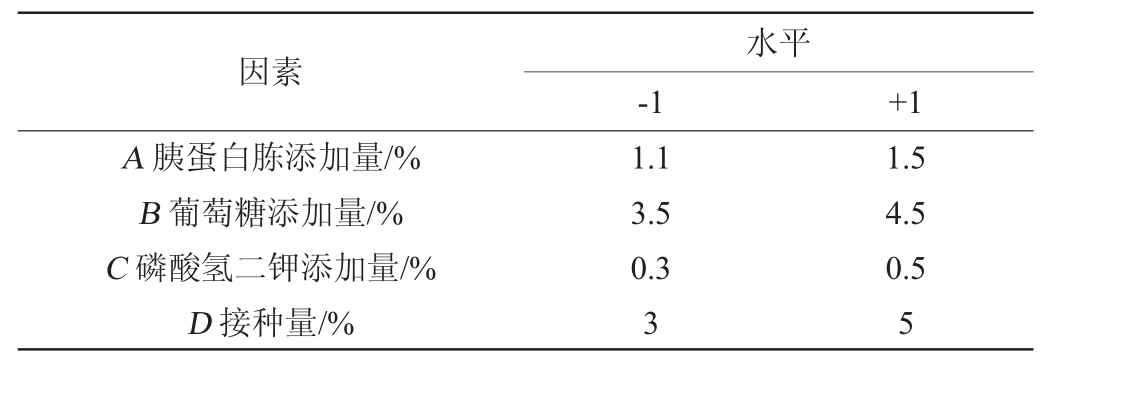
因素A 胰蛋白胨添加量/%B 葡萄糖添加量/%C 磷酸氢二钾添加量/%D 接种量/%水平-1 +1 1.1 3.5 0.3 3 1.5 4.5 0.5 5
续表
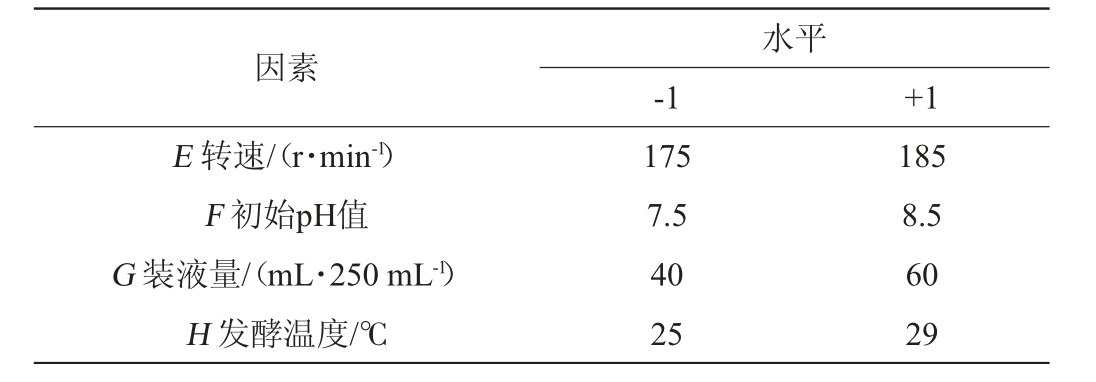
因素E 转速/(r·min-1)F 初始pH值G 装液量/(mL·250 mL-1)H 发酵温度/℃水平-1 +1 175 7.5 40 25 185 8.5 60 29
1.3.6 成团泛菌Y-03产甾醇酯酶发酵工艺优化BB响应面试验
根据PB试验结果,以甾醇酯酶活力(Y)为响应值,以葡糖糖添加量(X1)、装液量(X2)、发酵温度(X3)为考察因素,固定其他因素分别为单因素最优试验结果,采用Design-Expert 13软件设计三因素三水平的BB响应面试验,试验因素与水平见表2。
表2 成团泛菌Y-03产甾醇酯酶发酵工艺优化Box-Behnken响应面试验因素与水平
Table 2 Factors and levels of Box-Behnken tests for fermentation process optimization of sterol esterase produced by Pantoea agglomerans Y-03
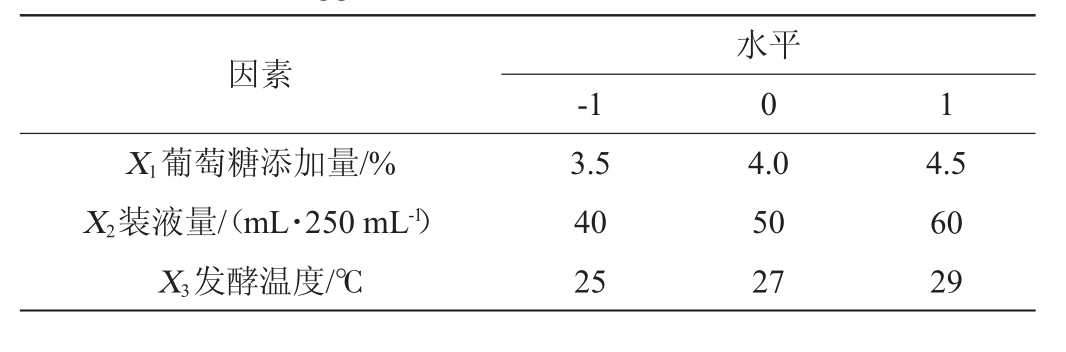
因素X1葡萄糖添加量/%X2装液量/(mL·250 mL-1)X3发酵温度/℃-1水平0 1 3.5 40 25 4.0 50 27 4.5 60 29
1.3.7 数据处理
每个试验进行3组平行,使用Origin2020软件进行数据处理与分析,结果以“平均值±标准差”表示,将各组中最大酶活力设定为100%,计算其他各组的相对酶活。
2 结果与分析
2.1 成团泛菌Y-03产甾醇酯酶发酵培养基优化单因素试验
2.1.1 不同碳源及添加量对菌株Y-03产甾醇酯酶的影响
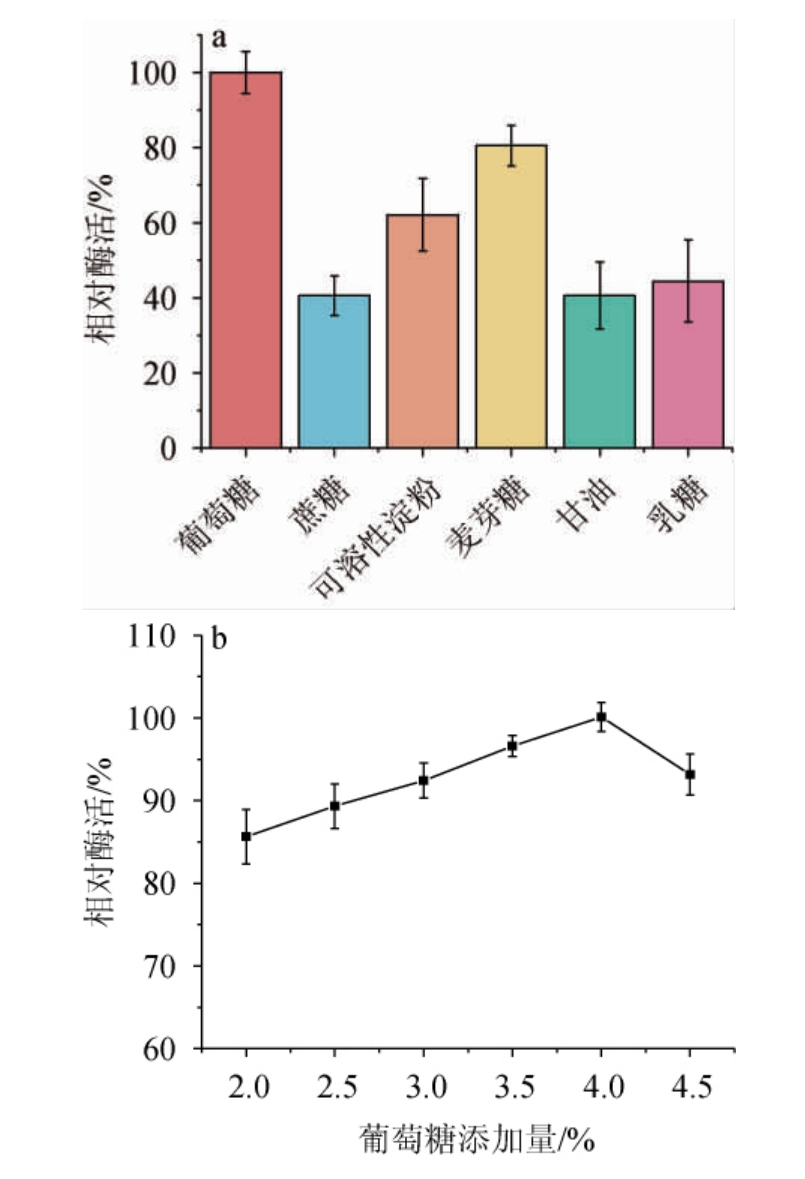
碳源是一种营养物质,其构成了微生物细胞和代谢产物中的碳素来源,不同菌株的碳源代谢酶系不同[20]。为确定发酵培养基最适碳源种类及添加量,考察不同碳源及添加量对菌株Y-03产甾醇酯酶的影响,结果见图1。由图1a可知,当以葡萄糖作为碳源时,酶活最高,其次是麦芽糖和可溶性淀粉。然而,以蔗糖、乳糖和甘油分别作为碳源时,酶活较低。分析原因可能是该菌株在发酵前期主要以速效碳源为主,使菌株能够快速生长繁殖,在底物诱导下产酶[21]。因此,确定葡萄糖为最适碳源。由图1b可知,随着葡萄糖添加量的增加,酶活呈先升高后下降的趋势,当葡萄糖添加量为4%时,酶活最高。分析原因可能是葡萄糖浓度过高引起较高的渗透压,从而对菌体生长有一定的影响[22]。因此,确定葡萄糖最适添加量为4%。
2.1.2 不同氮源及添加量对菌株Y-03产甾醇酯酶的影响
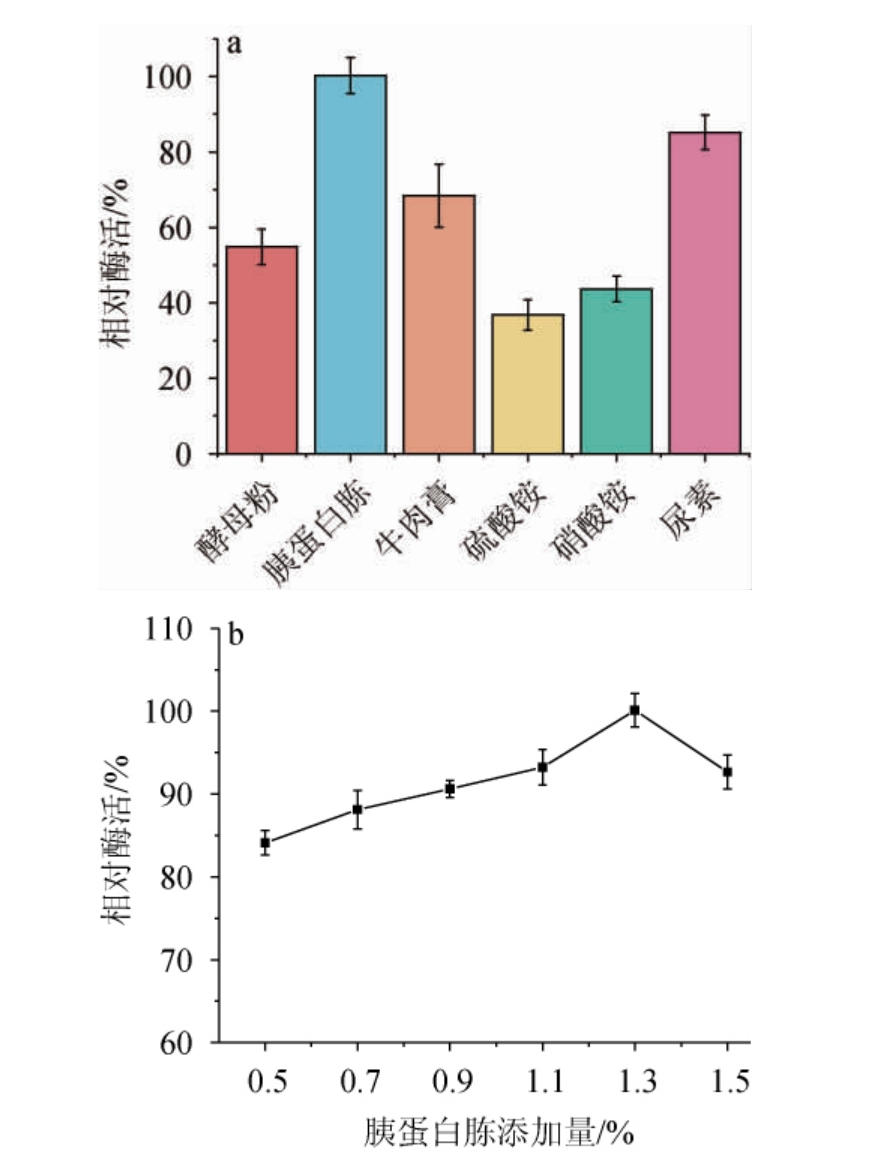
氮源是生物体营养物质之一,其主要是用于菌体生长和含氮代谢物合成[23]。不同氮源及添加量对菌株Y-03产甾醇酯酶的影响见图2。由图2a可知,当胰蛋白胨作为氮源时,酶活力最高,其次是无机氮源尿素,但是以无机氮源硫酸铵和硝酸铵作为氮源时,酶活较低。结果表明,有机氮源比无机氮源更适合作为发酵培养基氮源来促进酶活的提高。因此,确定胰蛋白胨为最优氮源。由图2b可知,随着胰蛋白胨添加量的增加,酶活呈先升高后下降的趋势,当胰蛋白胨添加量为1.3%时,酶活最高。分析原因可能是当发酵培养基中氮源浓度过高时,菌株生长过快,出现自溶现象,从而使培养基中甾醇酯酶活力降低[24]。因此,确定胰蛋白胨最适添加量为1.3%。
2.1.3 不同无机盐及添加量对菌株Y-03产甾醇酯酶的影响
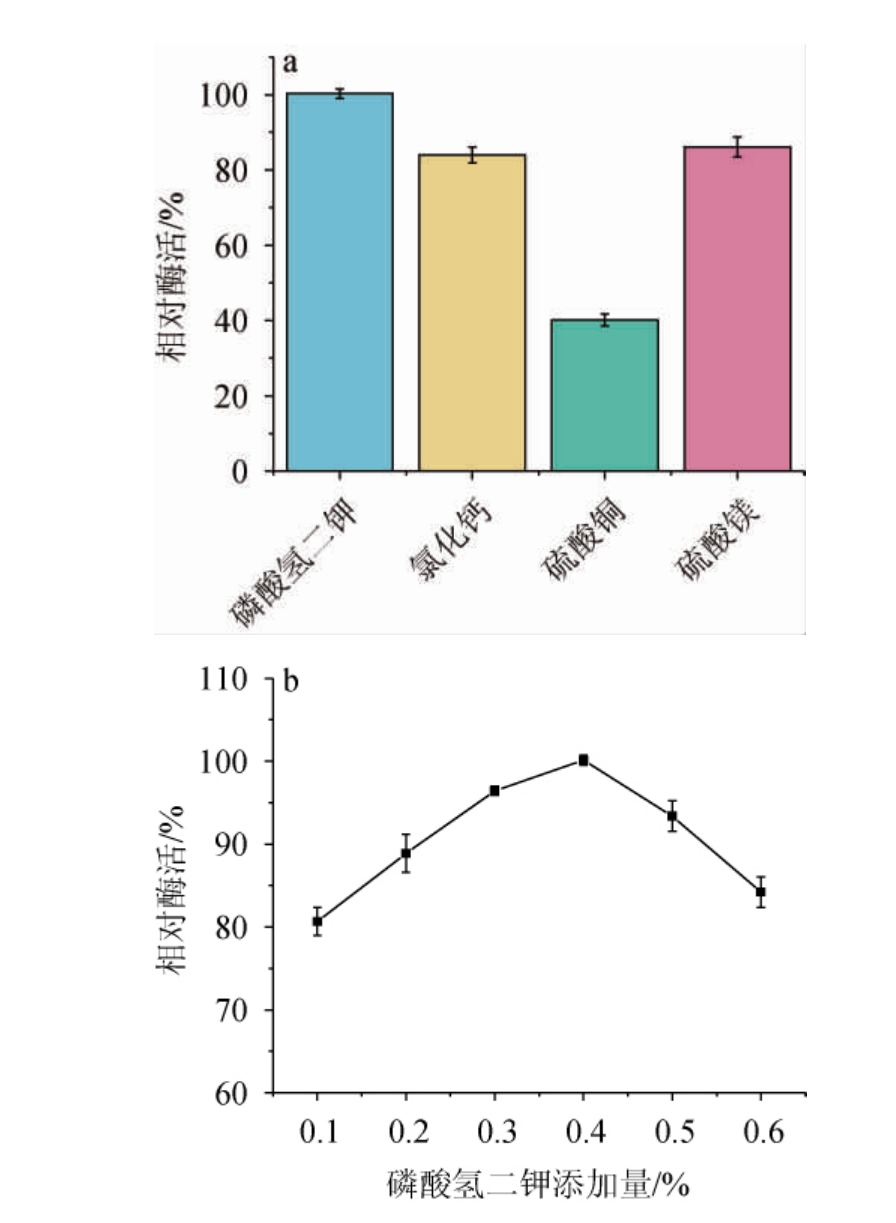
无机盐是生物体生命活动所必需的,微生物的生长离不开各种元素的参与[25]。不同无机盐及添加量对菌株Y-03产甾醇酯酶的影响见图3。由图3a可知,当无机盐为K2HPO4时,酶活最高,其原因可能是海洋中含有丰富的钾离子,该菌株来源于海洋[19]。由图3b可知,随着K2HPO4添加量的升高,酶活呈先升高后下降的趋势,当K2HPO4添加量为0.4%时,酶活最高。分析其原因可能是当K2HPO4含量过高时,会引起渗透压过高并影响细胞膜的完整性,从而使物质无法正常进入和排出细胞,导致微生物生命活动受阻;当K2HPO4含量过低时,无法维持菌体正常生命活动[16]。因此,确定K2HPO4的最适添加量为0.4%。
2.2 成团泛菌Y-03产甾醇酯酶发酵条件优化单因素试验
2.2.1 初始pH值对菌株Y-03产甾醇酯酶的影响
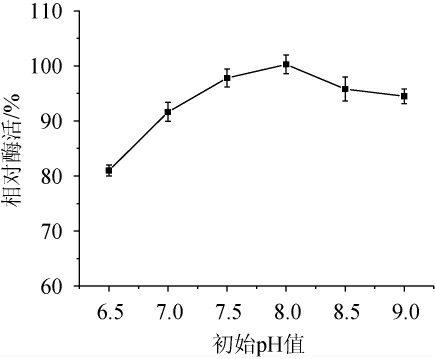
培养不同微生物所需要的初始pH值是不同的,pH可以通过对细菌的新陈代谢产生影响,从而对细菌的生长速率及酶活性产生一定的影响,细菌最适pH值通常在7~8[26]。因此,考察不同初始pH值对菌株Y-03产甾醇酯酶的影响,结果见图4。由图4可知,随着初始pH值的升高,酶活呈先升高后下降的趋势,当初始pH值为8.0时,酶活最高。因此,确定最适初始pH值为8.0。
2.2.2 发酵温度对菌株Y-03产甾醇酯酶的影响
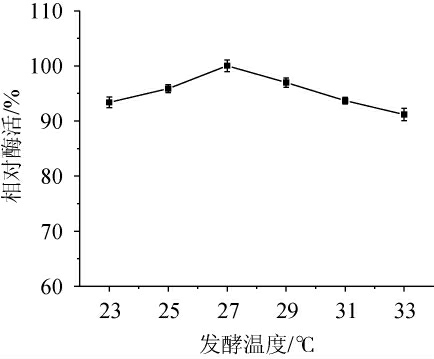
不同的发酵温度对菌株的生长及代谢产物的积累均有不同程度影响,从酶促反应动力学角度分析,温度的升高将加速反应的进行,促进生长代谢,加速产物的形成,然而,随着温度上升,酶失活速度增加,菌体易衰老,从而影响酶的生成[27]。因此,考察不同发酵温度对菌株Y-03产甾醇酯酶的影响,结果见图5。由图5可知,随着发酵温度的升高,酶活呈先升高后下降的趋势。当发酵温度为27 ℃时,酶活最高。结果发现,该菌株更适合在低温环境下进行发酵产酶,分析其原因可能是该菌株来源于海洋低温极端环境,在较高温度环境下影响菌株代谢产酶途径,进而使酶活力下降。因此,确定最适发酵温度为27 ℃。
2.2.3 转速对菌株Y-03产甾醇酯酶的影响
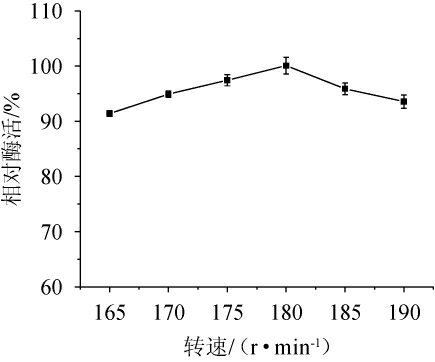
摇床转速会影响培养基中的氧气传递效率,由于不同菌株代谢类型不同,对好氧或需氧菌株影响十分明显,转速过低,培养基溶氧量不足,会导致活菌数减少,进而影响菌株对酶合成和分泌的能力[28]。因此,考察不同转速对菌株Y-03产甾醇酯酶的影响,结果见图6。由图6可知,随着转速的升高,甾醇酯酶活力呈先升高后下降的趋势,当转速为180 r/min时,酶活最高。因此,确定最适转速为180 r/min。
2.2.4 装液量对菌株Y-03产甾醇酯酶的影响
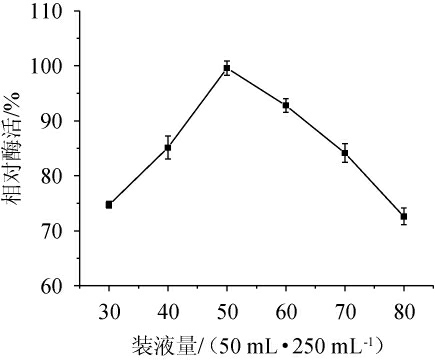
发酵液溶氧量不仅由转速决定,装液量也可以影响传氧系数,装液量越少,溶氧系数越大[29]。不同装液量对菌株Y-03产甾醇酯酶的影响见图7。由图7可知,随着装液量的升高,酶活呈升高后下降的趋势,当装液量为50 mL/250 mL时,酶活最高。分析其原因,可能是在装液量较低时,发酵液存在蒸发或菌体营养物质不充足,导致菌体死亡;装液量较高时,发酵液的溶氧量减小,不利于菌株生长及发酵产酶[30]。因此,确定最佳装液量为50 mL/250 mL。
2.2.5 接种量对菌株Y-03产甾醇酯酶的影响
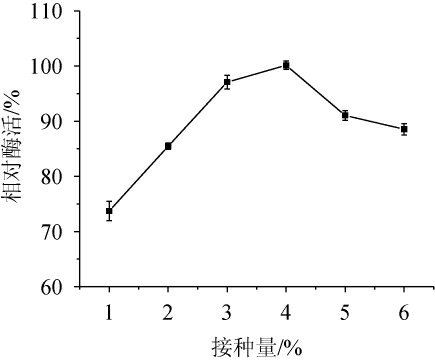
接种量的多少直接影响到菌体的生长速率和增殖能力,适当的接种量能有效地缩短菌体到达峰值的时间,促进菌体的快速生成,降低杂菌的滋生几率;然而,接种量过大会对发酵过程产生一定影响,造成溶解氧的缺乏,进而影响酶的合成[31]。不同接种量对菌株Y-03产甾醇酯酶的影响见图8。由图8可知,随着接种量的升高,酶活呈先升高后下降的趋势,当接种量为4%时,酶活力最高。因此,确定最适接种量为4%。
2.3 成团泛菌Y-03产甾醇酯酶发酵工艺优化PB试验设计及结果
成团泛菌Y-03产甾醇酯酶发酵工艺优化PB试验设计及结果见表3,方差分析见表4。由表3及表4可知,葡萄糖添加量对菌株Y-03产甾醇酯酶活力的影响显著(P<0.05)、装液量、发酵温度对菌株Y-03产甾醇酯酶活力的影响极显著(P<0.01),其他因素对菌株Y-03产甾醇酯酶活力无显著影响(P>0.05)。因此,选择这3个因素进行BB响应面试验。
表3 Plackett-Burman试验设计及结果
Table 3 Design and results of Plackett-Burman tests
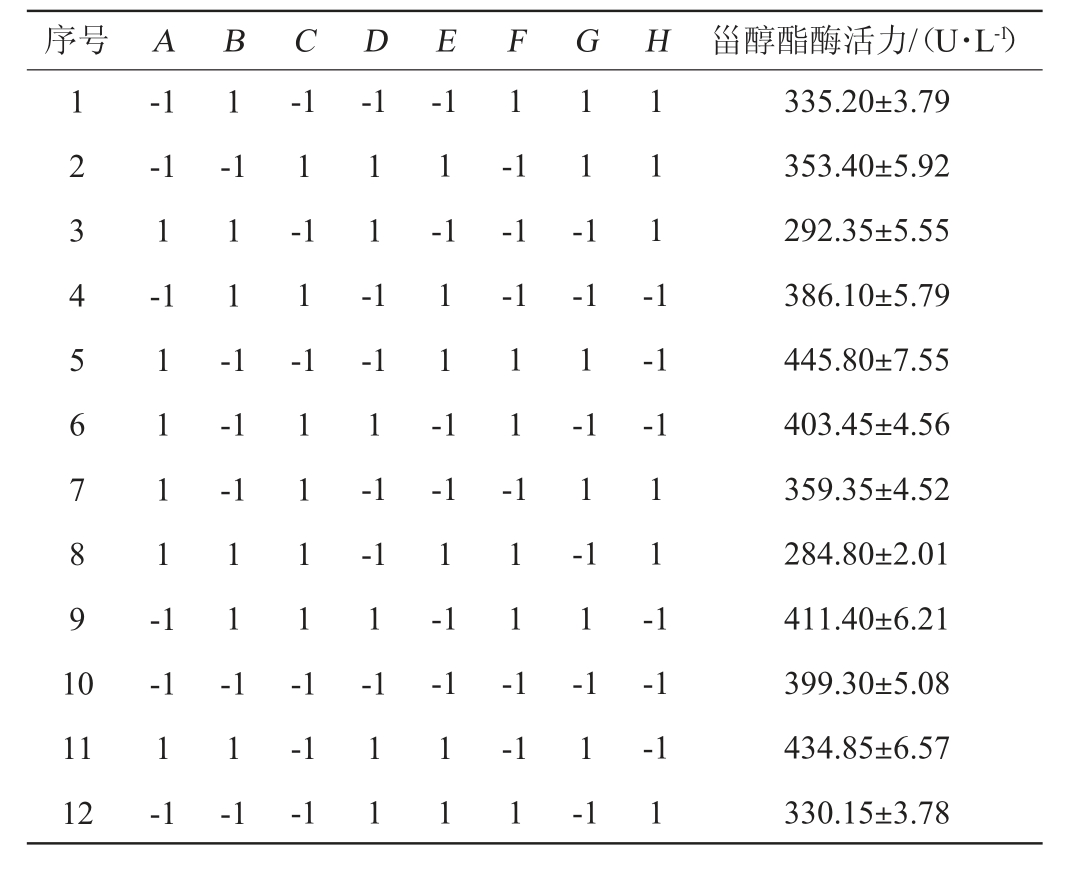
序号 A B C D E F G H 甾醇酯酶活力/(U·L-1)1 2 3 4 5 6 7 8 9 1 0-1-1 1-1 1-1 1-1 1 1 -1-1 1-1-1-1-1 1 1 -1 1 1 1 -1 1 1 1 1 -1 1 1 -1-1 1-1 1-1-1-1 1 1 -1 1 1 -1 1 1 1 -1-1-1 1 1 -1-1 1-1-1 1-1 1 1 --1 1-1-1 1 1 1 -1 11 12-1 1-1 1 1 -1-1-1 1 1 1 1-1 1-1 1-1 1-1 1-1 1-1-1-1 1 335.20±3.79 353.40±5.92 292.35±5.55 386.10±5.79 445.80±7.55 403.45±4.56 359.35±4.52 284.80±2.01 411.40±6.21 399.30±5.08 434.85±6.57 330.15±3.78
表4 Plackett-Burman试验结果方差分析
Table 4 Variance analysis of Plackett-Burman tests results
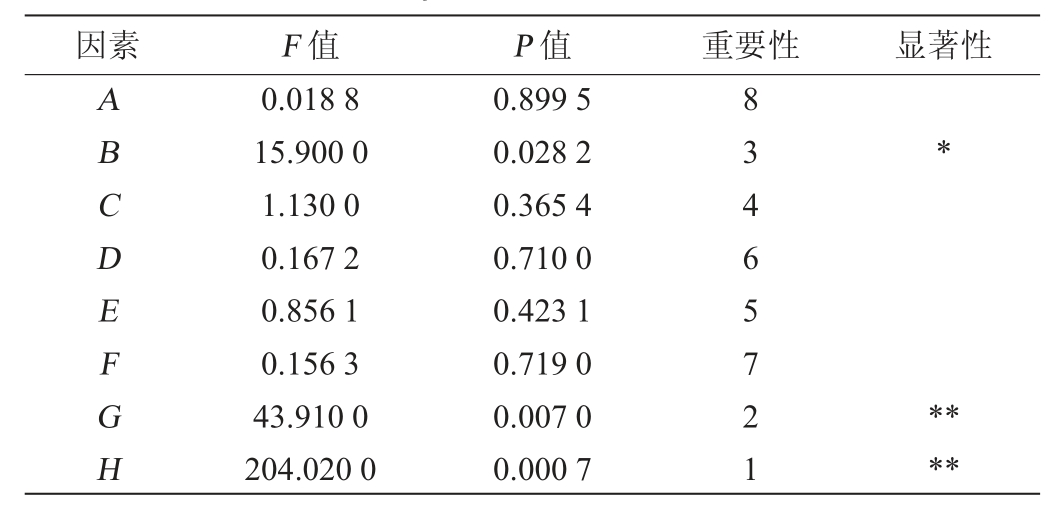
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。下同。
因素 F 值 P 值 重要性 显著性ABCDEFGH 0.018 8 15.900 0 1.130 0 0.167 2 0.856 1 0.156 3 43.910 0 204.020 0 0.899 5 0.028 2 0.365 4 0.710 0 0.423 1 0.719 0 0.007 0 0.000 7 83465721*****
2.4 成团泛菌Y-03产甾醇酯酶发酵工艺优化BB响应面试验设计及结果
成团泛菌Y-03产甾醇酯酶发酵工艺优化BB响应面试验设计及结果见表5,方差分析见表6。
表5 Box-Behnken试验设计及结果
Table 5 Design and results of Box-Behnken tests
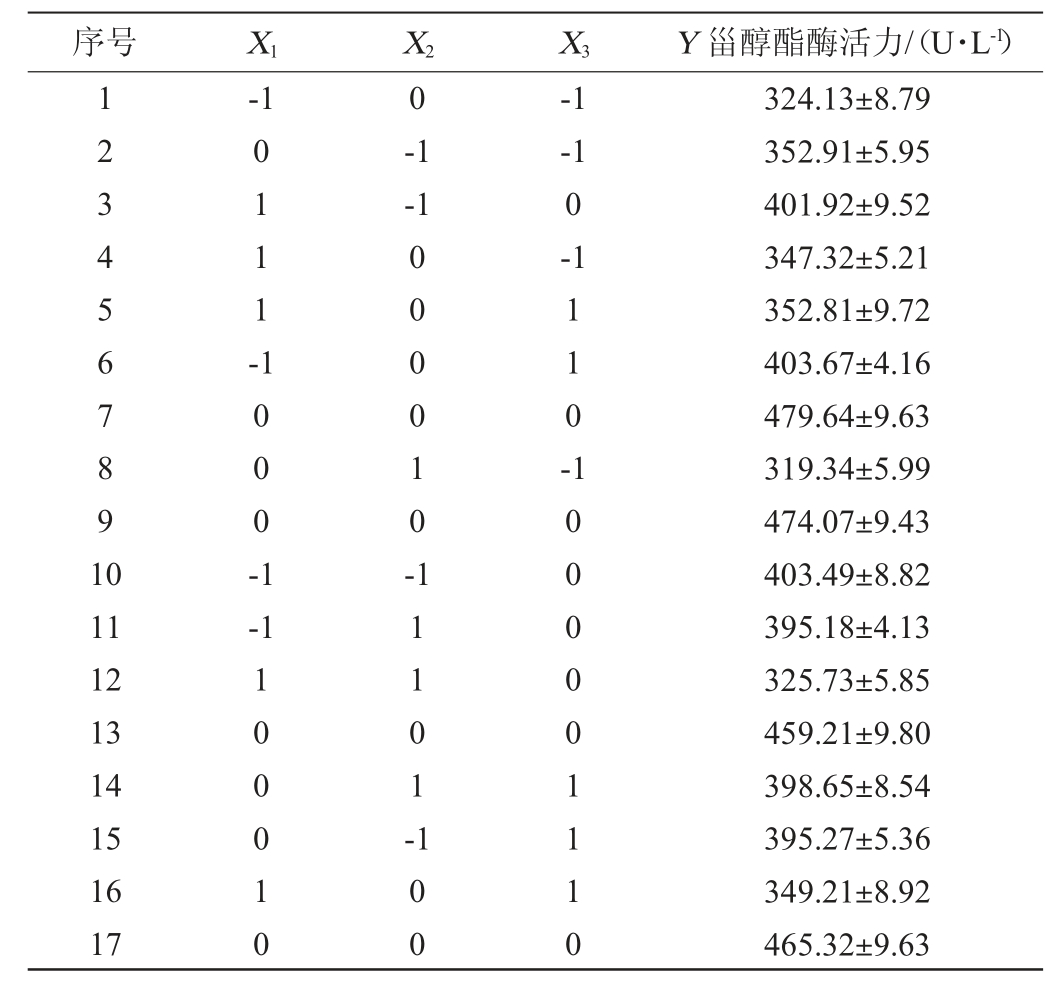
序号 X1 X2 X3 Y 甾醇酯酶活力/(U·L-1)1234567891 0-1 0 0111--1-1-1-1 0-1 1000-1 000010-110-11 12 13 14 15 16 17-1 100010 11101-100 1000001110 324.13±8.79 352.91±5.95 401.92±9.52 347.32±5.21 352.81±9.72 403.67±4.16 479.64±9.63 319.34±5.99 474.07±9.43 403.49±8.82 395.18±4.13 325.73±5.85 459.21±9.80 398.65±8.54 395.27±5.36 349.21±8.92 465.32±9.63
表6 回归模型方差分析
Table 6 Variance analysis of regression model
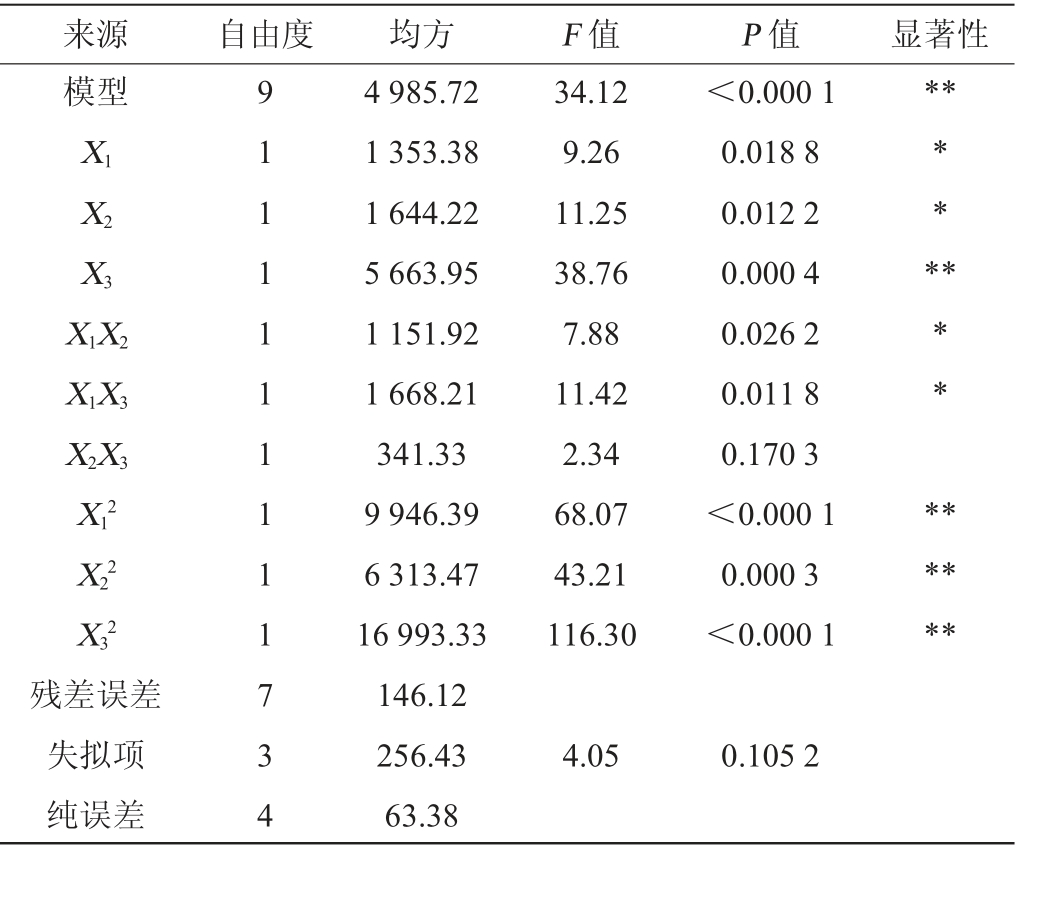
来源 自由度 均方 F 值 P 值 显著性模型**X1 X2 X3 X1X2 X1X3 X2X3 X12 X22 X32 34.12 9.26 11.25 38.76 7.88 11.42 2.34 68.07 43.21 116.30<0.000 1 0.018 8 0.012 2 0.000 4 0.026 2 0.011 8 0.170 3<0.000 1 0.000 3<0.000 1** *** * ******残差误差失拟项纯误差9 1 1 1 1 1 1 1 1 1 7 3 4 4 985.72 1 353.38 1 644.22 5 663.95 1 151.92 1 668.21 341.33 9 946.39 6 313.47 16 993.33 146.12 256.43 63.38 4.05 0.105 2
运用Design-Expert 13软件对表5试验结果进行多元二次回归拟合,得到菌株Y-03产甾醇酯酶的二次回归方程:Y=469.56-12.53X1-14.34X2+25.64X3-16.97X1X2-18.91X1X3+9.24X2X3-48.97X12-39.01X22-64.00X32。由表6可知,模型极显著(P<0.01),失拟项不显著(P>0.05),不存在失拟因素,表明回归方程模型建立成功。在回归模型中,决定系数R2=0.9777、调整决定系数R2Adj=0.9491,均大于0.9,表明模型相关性良好。变异系数(coefficient of variation,CV)为=3.09%<10%,表明该模型可靠。因此,该回归方程能较好地替代试验真实值,对菌株Y-03实际发酵产甾醇酯酶进行分析与预测。由表6亦可知,一次项X1、X2及交互项X1X2、X1X3对结果影响显著(P<0.05),一次项X3及二次项X12、X22、X32对结果影响极显著(P<0.01)。各因素间交互作用对甾醇酯酶活力影响的响应面及等高线图见图9。由图9可知,因素X1与X2、X1与X3间交互作用的等高线图为椭圆形,表明两因素间交互作用显著;X2与X3间交互作用的等高线图接近圆形,表示两因素间交互作用不显著,这与方差分析结果一致。
采用Design-Expert 13软件对回归方程进行最优求解,得到最适发酵工艺为葡萄糖添加量3.71%、装液量44.37 mL/250 mL、发酵温度27.43 ℃,甾醇酯酶预测值为480.11 U/L。为便于实际操作,将最佳发酵工艺调整为葡萄糖添加量3.70%、装液量44 mL/250 mL、发酵温度27 ℃,胰蛋白胨添加量1.3%、K2HPO4添加量0.4%、初始pH值8、转速180 r/min、接种量4%,在此条件下进行3次验证试验,甾醇酯酶活力为(484.24±9.16)U/L,与理论值接近,表明优化模型可信度较高,与优化前甾醇酯酶活力(336.53 U/L)相比提高143.89%。
3 结论
为提高海洋来源成团泛菌(Pantoea agglomerans)Y-03产低温甾醇酯酶活力,采用单因素试验对其发酵培养基组分及发酵条件进行优化,在此基础上,通过PB试验,筛选出对酶活有显著影响的3个因素,分别为葡萄糖添加量、发酵温度、装液量;进一步通过BB响应面试验优化确定其最适发酵工艺为葡萄糖添加量3.7%、胰蛋白胨添加量1.3%、K2HPO4添加量0.4%、初始pH值8、转速180 r/min、接种量4%、装液量44 mL/250 mL、发酵温度27 ℃,在此条件下,甾醇酯酶活力为484.24 U/L,相比于优化前酶活力提高143.89%。本研究结果对未来进一步小试及中试生产研究奠定了基础。
参考文献:
[1]YASUTAKE Y,KONISHI K,MURAMATSU S,et al.Bacterial triacylglycerol lipase is a potential cholesterol esterase: Identification of a key determinant for sterol-binding specificity[J].Int J Biol Macromol,2021,167:578-586.
[2]LIU X Y, ZHOU M Y, XING S, et al.Identification and biochemical characterization of a novel hormone-sensitive lipase family esterase Est19 from the antarctic bacterium Pseudomonas sp.E2-15[J].Biomolecules,2021,11(11):1552.
[3]梁宽,毛文刚,贾文敬,等.微生物胆固醇酯酶的研究进展[J].化学与生物工程,2023,40(3):1-5,12.
[4]LIU Y H,ZHANG N,MA J,et al.Advances in cold-adapted enzymes derived from microorganisms[J].Front Microbiol,2023,14:1152847.
[5]武翠玲,谭晓晶,姚明明,等.胆固醇酯酶高产菌株的筛选及动力学性质研究[J].中国酿造,2006,25(12):36-39.
[6]PETERS J,ONGURI V,NISHIMOTO S K,et al.The Chlamydia trachomatis CT149 protein exhibits esterase activity in vitro and catalyzes cholesteryl ester hydrolysis when expressed in HeLa cells[J].Microbes Infect,2012,14(13):1196-1204.
[7]YOSHIDA K, KONISHI K, MAGANA-MORA A, et al.Production of recombinant extracellular cholesterol esterase using consistently active promoters in Burkholderia stabilis[J].Biosci Biotech Biochem,2019,83(10):1974-1984.
[8]KUMARI M,PADHI S,SHARMA S,et al.Biotechnological potential of psychrophilic microorganisms as the source of cold-active enzymes in food processing applications[J].3 Biotech,2021,11:479.
[9]DU L J,HUO Y,GE F L,et al.Purification and characterization of a novel extracellular cholesterol esterase from Acinetobacter sp.[J].J Basic Microb,2010,50(S1):S30-S36.
[10]曾诚.甾醇酯酶产生菌的筛选、鉴定及酶学性质研究[D].南京:南京林业大学,2012.
[11]MHETRAS N, MAPARE V, GOKHALE D.Cold active lipases: Biocatalytic tools for greener technology[J].Appl Biochem Biotech,2021,193:2245-2266.
[12]GUTIÉRREZ-FERNÁNDEZ J,VAQUERO M E,PRIETO A,et al.Crystal structures of Ophiostoma piceae sterol esterase:structural insights into activation mechanism and product release[J].J Struct Biol,2014,187(3):215-222.
[13]MATINJA A I,KAMARUDIN N H A,LEOW A T C,et al.Cold-active lipases and esterases:a review on recombinant overexpression and other essential issues[J].Int J Mol Sci,2022,23(23):15394.
[14]梁佳园,张艳敏,徐淑科,等.产低酰基结冷胶重组菌株的构建及发酵培养基优化[J].中国酿造,2023,42(8):203-209.
[15]权浩严,王鹏,位正鹏,等.产胆固醇酯酶毕赤酵母发酵条件优化及酶学性质研究[J].食品工业科技,2021,42(17):94-99.
[16]韩廷玉,李盼盼,刘春莹,等.莓实假单胞菌产低温胆固醇酯酶发酵条件优化[J].中国酿造,2020,39(8):47-53.
[17]KONISHI K,YASUTAKE Y,MURAMATSU S,et al.Disruption of SMCrelated genes promotes recombinant cholesterol esterase production in Burkholderia stabilis[J].Appl Microbiol Biot, 2022, 106(24): 8093-8110.
[18]ICHIKAWA K,YOSHIDA A,SHIONO Y,et al.Biochemical characterization of a lipolytic enzyme from Aspergillus oryzae that hydrolyzes triacylglycerol and sterol esters[J].Appl Biochem Biotech,2020,192:910-922.
[19]任楠楠,王晓辉,迟乃玉,等.海洋低温甾醇酯酶菌株的筛选鉴定及其酶学特性研究[J].中国酿造,2019,38(1):37-41.
[20]SA R B,SUN Y,CAO Y,et al.Medium optimization and fermentation kinetics for antifungal compounds production by an endophytic Paenibacillus polymyxa DS-R5 isolated from Salvia miltiorrhiza[J].Curr Microbiol,2024,81:54.
[21]蒲桂洪.奥利万星中间体A82846B的菌株选育与发酵工艺研究[D].重庆:西南大学,2020.
[22]李舒婷,袁凯,李华,等.基于非粮糖蜜的聚羟基脂肪酸酯发酵培养基优化与中试放大[J].中国酿造,2024,43(4):216-223.
[23]DELBARRE-LADRAT C,SINQUIN C,MARCHAND L,et al.Influence of the carbon and nitrogen sources on diabolican production by the marine Vibrio diabolicus strain CNCM I-1629[J].Polymers,2022,14(10):1994.
[24]唐文竹,何玉宁,张璐,等.响应面法优化褐藻胶降解菌Cobetia sp.20发酵培养基[J].微生物学杂志,2024,44(2):79-86.
[25]赵子琪,刘烨瑀,于爽,等.海洋来源低温果胶酶产生菌筛选、鉴定与酶学性质研究[J].食品工业科技,2024,45(10):133-140.
[26]徐海洋,赵紫琰,陈倩倩,等.微杆菌XL1左聚糖酶的发酵条件优化及酶学性质研究[J].中国调味品,2023,48(6):7-14.
[27]刘佳慧,吕红,林娟.一株产低温碱性淀粉酶蕈状芽孢杆菌的分离筛选和发酵优化[J].四川大学学报(自然科学版),2023,60(2):149-155.
[28]陈秋旭,卫春会,吴玲,等.浓香型酒醅中一株高产蛋白酶菌株的鉴定及产酶条件的优化[J].食品科技,2023,48(2):7-13.
[29]徐勤茜,张泽宇,陶雪婷,等.酸橙内生菌Bacillus thuringiensis Bt028产几丁质酶的发酵条件优化[J].食品工业科技,2022,43(11):151-158.
[30]李秋晓,庞泽敏,张茹,等.高产乙酸乙酯酵母的筛选鉴定及发酵条件优化[J].中国酿造,2024,43(6):80-87.
[31]王进军,韦慧仙,鲍飞,等.土壤中木质素降解菌株的筛选及产酶条件优化[J].江苏农业科学,2023,51(16):210-222.