
Effect of fermentation methods on physicochemical components and antioxidant activities of apple-strawberry wine
富士苹果与草莓富含维生素、矿物质和其他生物活性物质[1]。富士苹果酸甜适口且果汁丰富,草莓则以鲜艳的红色和独特的香气受到喜爱[2]。在健康意识增强的背景下,消费者对食品的品质要求越来越高,尤其是既能提供独特风味又有健康益处的产品。复合果酒是结合多种水果优势的酒类产品,正逐渐成为市场新宠。将富士苹果与草莓混合用于酿造果酒,不仅融合了富士苹果的清甜与草莓的色泽和香气,还提供丰富的营养价值和独特的味觉享受,满足了市场对健康饮品的需求。
酵母的选择是影响果酒品质的因素之一。尤其是富士草莓果酒酿造中,适宜的酵母菌株对产品风味、香气以及理化成分有决定性的影响。除了传统酿酒酵母被广泛应用于果酒外,非酿酒酵母的应用对果酒品质也起到了积极地影响并有助于提升产品的感官特性[3-4]。研究表明,非酿酒酵母具有酿酒酵母所缺乏的一些酿酒特性,如提高果酒的香气复杂性和感官品质[5-9]。然而,由于非酿酒酵母的酒精发酵力弱,国内外学者通常将其与酿酒酵母混合使用,以改善果酒质量[10-12]。王燕荣等[13]使用葡萄汁有孢汉逊酵母与卡利比克迈耶氏酵母进行混合发酵,显著提升了苹果酒的香气和感官品质。王俊钢等[14]通过混合使用非酿酒酵母德尔布有孢圆酵母(Torulaspora delbrueckii)NS-D与安琪酵母发酵红枣果酒,提高了红枣果酒的感官评分和抗氧化性能。胡陆军等[5]研究发现,采用酿酒酵母、库德里阿兹威毕赤酵母、植物乳杆菌混菌发酵制备香梨百香果复合果酒可提高总酸含量与抗氧化性,降低还原糖含量,显著提升香气成分和感官评分。李甜等[15]通过异常威克汉姆酵母、葡萄汁有孢汉逊酵母、克鲁维毕赤酵母与商业酿酒酵母FX10混合发酵茵红李果酒,增加了甘油产量,降低了乳酸和乙醇含量。王香君等[16]从桑果中筛选非酿酒酵母,在混菌发酵中使用能显著提升桑果酒的香气和风味,特别是酯类和醇类物质的增加,使得桑果酒更加浓郁饱满。
尽管混菌发酵技术在提升果酒品质方面已取得一定成果,但任存在最佳菌种组合、发酵条件优化等问题。另外,国内外研究主要集中在单一果酒的酿造上,对复合果酒酿造中酵母菌种的选择和组合研究相对较少。因此,本研究着重探讨了利用非酿酒酵母和酿酒酵母发酵富士苹果与草莓复合果酒的过程。通过对比分析两种酵母在富士苹果与草莓复合果酒酿造中的表现,揭示不同发酵方式对果酒理化成分及风味品质的影响,旨在发现最适宜的酵母种类和发酵工艺,以期生产出口感良好、营养全面、保健效果显著的高品质复合果酒。
富士苹果、草莓:兰州市华联超市;酿酒酵母(Saccharomyces cerevisiae)32169、德尔布有孢圆酵母(Torulaspora delbrueckii)1004和异常毕赤酵母(Pichia anomala)31838:中国工业微生物菌种保藏管理中心(China center of Industrial Culture Collection,CICC)提供;果胶酶(300 000 U/g):宁夏和氏璧生物技术有限公司。偏重亚硫酸钾(分析纯):国药集团化学试剂有限公司;苹果酸、乳酸、柠檬酸、琥珀酸、3-辛醇(均为色谱纯):美国Sigma公司;葡萄糖、果糖和蔗糖(色谱纯):上海源叶生物科技有限公司;氢氧化钠等(分析纯):国药集团化学试剂有限公司。
总酚、总黄酮测定试剂盒、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力测定试剂盒、2,2'-联氮-二(3-乙基-苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid)ammonium salt,ABTS)阳离子自由基清除能力测定试剂盒、铁离子还原抗氧化能力(ferric ion reducing antioxidant power,FRAP)测定试剂盒:苏州梦犀生物医药科技有限公司。
TRACE ISQ型三重四级杆气质联用仪:美国赛默飞世尔科技公司;Waters 2695型高效液相色谱仪:美国沃特斯公司;SpectraMax 190型酶标仪:Molecular Devices公司;YXQ-70A型立式压力蒸汽灭菌器:上海博迅医疗器械厂;LRH-70型恒温培养箱:上海一恒科学仪器有限公司。
1.3.1 富士苹果草莓复合果酒发酵工艺流程及操作要点

操作要点:
富士苹果、草莓复合果浆制备:挑选大小均匀、无腐烂、无损坏的富士苹果和草莓,用清水彻底清洗后,将富士苹果去皮去核切块,草莓去除果蒂。将处理好的富士苹果块和草莓按6∶4的质量比混合放入榨汁机中,进行破碎打浆,直至得到均匀的复合果浆。为使果浆更加细腻,可使用细筛网过滤果渣。混合果汁的可溶性固形物为11.90%,葡萄糖含量为5.02 g/L,果糖含量为79.89 g/L,蔗糖含量为5.02 g/L,可滴定酸含量为3.19 g/L,pH为3.47。
护色、酶解:加入偏重亚硫酸钾使其终浓度为100 mg/L(游离SO2浓度相当于75 mg/L)杀菌护色,加入果胶酶为复合果浆的0.6%,常温静置4 h进行酶解。
酵母接种:将德尔布有孢圆酵母(CICC 1004)、异常毕赤酵母(CICC 31838)与酿酒酵母(CICC 32169)按照1.3.2 酵母接种方式接种到富士苹果和草莓复合果浆中。
酒精发酵:在20 ℃下厌氧静置发酵,发酵周期为6 d,每24 h测定可溶性固形物的变化,当可溶性固形物不再发生变化时,即为发酵结束。
过滤:采用虹吸法将上层清液吸入酒瓶中,然后用纱布过滤下层含有酒渣的果酒,得到富士苹果草莓复合果酒。
1.3.2 酵母接种方式
酿酒酵母(CICC32169)、德尔布有孢圆酵母(CICC1004)与异常毕赤酵母(CICC 31838)发酵试验组合及编号如表1所示。所有实验组的总接种量统一为6%,混合接种比例为1∶1,接种浓度为105 CFU/mL的酿酒酵母和106 CFU/mL的非酿酒酵母。
表1 苹果草莓酒发酵方式
Table 1 Fermentation methods of apple-strawberry wine

编号 发酵方式FNY-1 FNY-2 FNY-3 FNY-4 FNY-5酿酒酵母酿酒酵母+德尔布有孢圆酵母先接种酿酒酵母,24 h后接种德尔布有孢圆酵母酿酒酵母+异常毕赤酵母先接种酿酒酵母,24 h后接种异常毕赤酵母
1.3.3 分析检测
酵母发酵力测定:参照曾朝珍等[17]的方法进测定。通过定期监测发酵过程中由于二氧化碳排放造成的质量变化,来评价酵母的发酵活性,直到发酵活动结束为止。
还原糖的测定:参照并优化先前报道的高效液相色谱方法进行[5],使用Agilent 1200高效液相色谱系统,配备ShodexAsahipak NH2P-50 4E色谱柱(4.6 mm×250 mm,5 μm)和G1362A折光率检测器,采用以下参数:流动相为25%(体积比)乙腈溶于水,流速为0.6 mL/min,注射体积为10 μL,柱温维持在30 ℃,并进行了20 min的等度洗脱。通过比较标准品(葡萄糖、果糖和蔗糖)的相对保留时间和峰面积来进行糖类化合物的鉴定和定量。
可滴定酸测定:参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》[18]测定;
有机酸测定:参照曾朝珍等[17]的方法进行测定。
总酚、总黄酮含量测定:采用总酚试剂盒和总黄酮试剂盒进行检测。
抗氧化能力的测定:DPPH自由基清除能力、ABTS阳离子自由基清除能力、铁离子还原抗氧化能力(FRAP)分别采用相应的试剂盒进行检测。
1.3.4 数据处理与统计分析
为了确保实验结果的可靠性和可重复性,每种发酵方式均进行了3次重复实验。实验数据处理利用Excel 2010和采用IBM SPSS Statistics 24.0软件,利用邓肯多重比较法(Duncan)对数据间进行差异显著性分析,P<0.05表示差异显著。使用Origin 2021软件对数据进行绘图处理。
五种不同发酵方式对富士苹果草莓复合果酒酵母发酵力的影响见图1。由图1可知,酿酒酵母单独发酵(FNY-1)在第3天二氧化碳质量损失达到最高为6.48 g,表明单一发酵在早期酵母活性较高,表现出较强的发酵力。混合接种的FNY-2(酿酒酵母+德尔布有孢圆酵母)和FNY-4(酿酒酵母+异常毕赤酵母)在第3天的二氧化碳质量损失分别达到了4.78 g和4.75 g,表明发酵效果较好。顺序接种的FNY-3(先接种酿酒酵母,24 h后接种德尔布有孢圆酵母)和FNY-5(先接种德尔布有孢圆酵母,24 h后接种异常毕赤酵母)发酵效率相对较低,二氧化碳质量损失最高分别为3.53 g和3.06 g。此外,发酵过程中,FNY-1在第2天至第4天的发酵活跃期最为明显,而FNY-2和FNY-4在相同阶段也表现出显著的发酵活性,表明混合接种可以促进发酵。但顺序接种的FNY-3和FNY-5在发酵初期的二氧化碳产生量较低,且发酵高峰出现延迟,表明顺序接种可能导致发酵效率的降低和延迟。总体来看,单一高浓度接种的发酵效率最高,混合接种次之,顺序接种则相对较低。此结果表明不同酵母和发酵方式对果酒的发酵效率会产生影响。
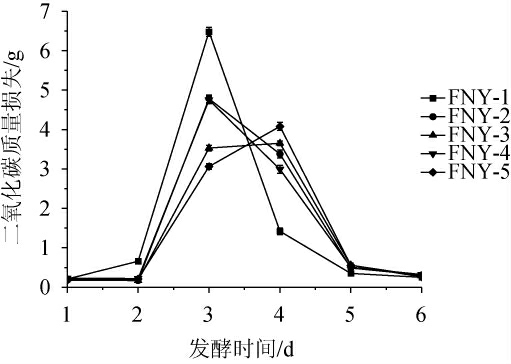
图1 不同发酵方式对苹果草莓酒酵母发酵力的影响
Fig.1 Effect of different fermentation methods on yeast fermentation power of apple-strawberry wine
通过对五种不同发酵方式发酵的富士苹果草莓复合果酒可滴定酸含量的分析,研究了不同酵母组合及其发酵顺序对其可滴定酸含量的影响,结果见图2。由图2可知,酿酒酵母单独发酵(FNY-1)虽然发酵力最高,但可滴定酸含量较低为3.52 g/L,显示其可滴定酸生成效率不高。相较之下,混合接种方式FNY-2(酿酒酵母+德尔布有孢圆酵母)和FNY-4(酿酒酵母+异常毕赤酵母)的可滴定酸含量较高,尤其是FNY-2组达到5.20 g/L,表明混合接种提高了可滴定酸的生成,可能是由于两种菌株的协同作用优化了酸代谢路径。顺序接种发酵的可滴定酸含量因菌株组合而异,FNY-5(先接种酿酒酵母,24 h后接种异常毕赤酵母)也达到5.20 g/L,显示出顺序接种发酵在某些条件下也能显著提高可滴定酸生成,而FNY-3(先接种酿酒酵母,24 h后接种德尔布有孢圆酵母)则未能显著改善(P>0.05)。这一结果强调了发酵方式的选择对调节果酒酸度的重要性,尤其是在顺序发酵过程中,酿酒酵母+异常毕赤酵母显示出其提高酸度的潜能,而在混合发酵中,酿酒酵母+德尔布有孢圆酵母的效果更为显著。
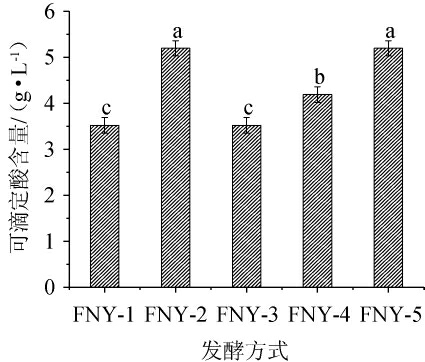
图2 不同发酵方式对苹果草莓酒可滴定酸含量的影响
Fig.2 Effect of different fermentation methods on titratable acid contents in apple-strawberry wine
五种不同发酵方式发酵富士苹果草莓复合果酒过程中还原糖含量的影响结果见图3。由图3可知,不同发酵方式对葡萄糖、果糖和蔗糖的消耗表现出显著差异(P<0.05)。在发酵第3天,FNY-3(先接种酿酒酵母,24 h后接种德尔布有孢圆酵母)和FNY-5(先接种酿酒酵母,24 h后接种异常毕赤酵母)的葡萄糖、果糖和蔗糖含量均显著低于其他处理组(P<0.05),表明顺序发酵在这些特定酵母组合中显著提高了糖分消耗效率。这可能是因为顺序发酵允许酵母有更多时间适应环境,从而优化代谢途径。一些研究表明,非酿酒酵母有助于将葡萄糖转化为乙醇、二氧化碳和其他次级代谢物[19-20],从而提升果酒风味和质量。发酵第6天的数据进一步确认了顺序发酵的FNY-3(酿酒酵母与德尔布有孢圆酵母)和FNY-5(酿酒酵母与异常毕赤酵母)在糖分消耗上的显著优势,葡萄糖、果糖和蔗糖的含量在顺序发酵组中持续下降,表明顺序发酵能够更有效地利用糖分,优化整体糖代谢活性,提升发酵效果。
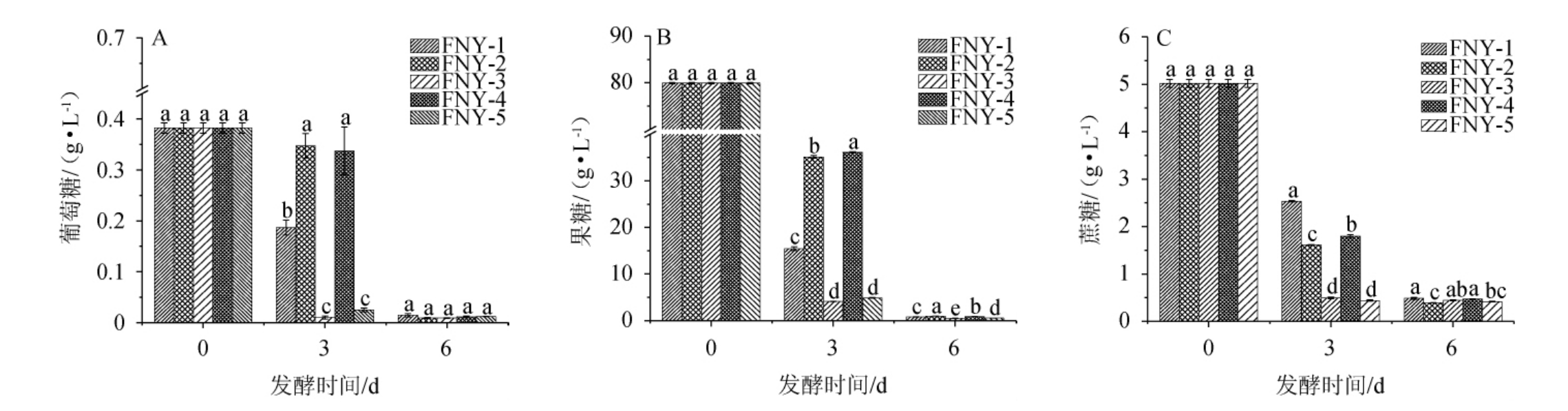
图3 不同发酵方式对苹果草莓酒葡萄糖(A)、果糖(B)和蔗糖(C)含量的影响
Fig.3 Effect of different fermentation methods on glucose (A), fructose (B) and sucrose (C) contents in apple-strawberry wine
混合发酵和顺序发酵方式下对富士苹果草莓复合果酒有机酸含量变化的影响结果见图4。

图4 不同发酵方式对苹果草莓酒苹果酸(A)、乳酸(B)、柠檬酸(C)和琥珀酸(D)含量的影响
Fig.4 Effect of different fermentation methods on malic acid (A), lactic acid (B), citric acid (C) and succinic acid (D) contents in apple-strawberry wine
由图4可知,不同发酵方式对有机酸含量的影响显著(P<0.05)。由图4A可知,对于苹果酸而言,所有发酵方式在第6天的苹果酸含量都进一步降低,但酿酒酵母与德尔布有孢圆酵母的混合发酵(FNY-2)下降趋势最显著(P<0.05)。由图4B可知,酿酒酵母与异常毕赤酵母的顺序发酵(FNY-5)使乳酸含量在第3天增长至804.87 mg/L。而酿酒酵母与德尔布有孢圆酵母顺序发酵(FNY-3)的乳酸含量也显著增加至760.81mg/L(P<0.05)。这表明在顺序发酵均能显著促进乳酸的产生(P<0.05)。到第6天,乳酸含量相较于第3天有所下降,但酿酒酵母与异常毕赤酵母的顺序发酵(FNY-5)乳酸含量相对最高。由图4C可知,在柠檬酸含量方面,酿酒酵母与德尔布有孢圆酵母的顺序发酵(FNY-3)在第3天显著增加至2 747.96 mg/L(P<0.05),与异常毕赤酵母的顺序发酵(FNY-5)增加至2720.45mg/L,说明顺序发酵有助于柠檬酸的积累。到第6天,两种发酵方式柠檬酸含量继续上升。由图4D可知,从发酵开始至第3天,所有处理组的琥珀酸含量都有增加,FNY-3和FNY-5发酵显著,分别达531.29 mg/L和519.71 mg/L(P<0.05)。第6天,琥珀酸含量继续增加至559.55 mg/L和560.25 mg/L,表明顺序发酵促进琥珀酸积累。有机酸是果酒中的重要成分,它会影响产品的感官特性。在发酵过程中,苹果酸含量降低,因为酵母菌能够降解苹果酸并转化为其他有机酸[21-22]。乳酸是由苹果酸在糖酵解转化过程中丙酮酸还原而成[23],对果酒的柔软感有积极的影响,琥珀酸的重要性不仅仅在于它只存在于果酒中,它很容易与其他分子反应生成酯。柠檬酸在柠檬酸循环中起着重要的中间作用。它可以在发酵过程中由酿酒酵母首先合成,然后进入细胞进行分解代谢[24]。以上结果表明,不同发酵方式对有机酸含量的变化有显著影响,选择合适的发酵方式可以根据所需的有机酸特性来优化果酒的品质。顺序发酵在促进乳酸、柠檬酸和琥珀酸的积累方面表现出积极的代谢作用。混合发酵(FNY-2)在苹果酸的降解上效果最为显著。
不同发酵方式发酵富士苹果草莓复合果酒过程中总酚及总黄酮含量的影响见图5。
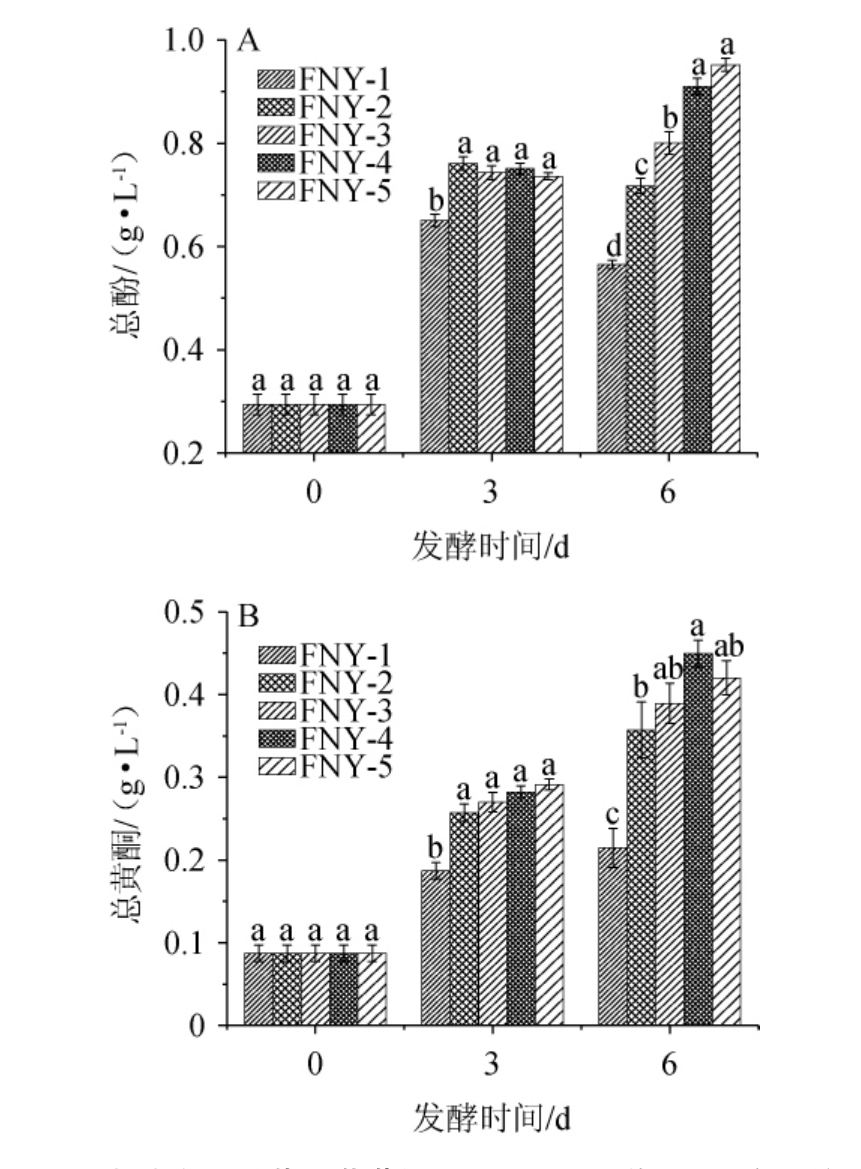
图5 不同发酵方式对苹果草莓酒总酚(A)和总黄酮(B)含量的影响
Fig.5 Effect of different fermentation methods on total phenols (A)and total flavonoids (B) contents in apple-strawberry wines
由图5A可知,所有发酵样品在发酵的前3天内总酚含量普遍上升,其中由酿酒酵母和德尔布有孢圆酵母进行的混合发酵(FNY-2)总酚含量增加最大至0.76 g/L。而酿酒酵母与两种非酿酒酵母的顺序发酵(FNY-3和FNY-5)总酚含量也显著提升至0.74 g/L(P<0.05),表明顺序发酵下总酚含量增加显著(P<0.05)。随着发酵至第6天,酿酒酵母与异常毕赤酵母的混合(FNY-4)和顺序发酵(FNY-5)组的总酚含量进一步增至0.91 g/L和0.95 g/L,表明异常毕赤酵母在整个发酵期内对总酚积累的促进作用显著(P<0.05)。由图5B可知,总黄酮含量在发酵起始均为0.09 g/L,在发酵至第3天,所有不同发酵方式下的总黄酮含量均有所增加,但除了酿酒酵母单独发酵(FNY-1)以外,其它发酵方式下总黄酮含量差异不显著(P>0.05)。到第6天,混合发酵FNY-4中的总黄酮含量最高,为0.45 g/L,但与顺序发酵FNY-5和FNY-3的总黄酮含量(0.42 g/L和0.39 g/L)差异不显著(P>0.05)。FNY-2的总黄酮含量为0.36 g/L,FNY-1的总黄酮含量最低,为0.21 g/L,显著低于其他所有处理(P<0.05)。造成以上结果的原因可能是微生物可以将共价结合的大分子酚酸分解成小分子,就像微生物可以将膳食中结合的酚酸转化为游离的酚酸一样,增加总酚的含量[25-26]。而总黄酮含量的增加是因为随着发酵的进行,浸泡时间延长,总黄酮的溶解量增加。同时,发酵液中酒精含量也在发酵过程中不断增加,也有利于总黄酮的提取[27-28]。以上结果可知,单独使用酿酒酵母发酵的效果较差,异常毕赤酵母在混合和顺序发酵中显著提高了总酚和总黄酮含量。
本研究采用FRAP、DPPH和ABTS自由基清除能力来量化分析不同发酵方式处理后的富士苹果草莓复合果酒的抗氧化能力,结果见图6。

图6 不同发酵方式对苹果草莓酒铁离子还原/抗氧化能力(A)、DPPH(B)和ABTS(C)自由基清除能力的影响
Fig.6 Effect of different fermentation methods on ferric ion reducing/antioxidant power (A), DPPH (B) and ABTS (C) free radical scavenging capacity of apple-strawberry wine
由图6可知,FRAP测定结果表明,经过6 d发酵,酿酒酵母与异常毕赤酵母的顺序发酵(FNY-5)显示出最高的抗氧化能力(4.34 μmol Trolox/mL),显著优于其他处理组(P<0.05)。DPPH自由基清除率测试中,虽然FNY-2在第3天自由基清除活性较高(2.79 μmol Trolox/mL),但FNY-5在发酵第6天以3.38 μmol Trolox/mL超过了FNY-2且差异显著(P<0.05)。ABTS自由基清除率测定结果表明,FNY-2在第6天达到最高清除活性(7.63μmolTrolox/mL),而FNY-5在第3天达到峰值(6.85 μmol Trolox/mL)后在第6天略有下降(6.60 μmol Trolox/mL)。有研究表明,发酵过程可以增强果实中活性成分的溶出[28]。这一过程中,微生物的水解作用产生的酚类化合物和类黄酮,能够提高体系的抗氧化性能。同时,发酵还促使细胞壁结构的解构,从而促进了抗氧化化合物的释放或新合成[29]。这些结果表明,虽然FNY-2在ABTS测试中表现较好,但FNY-5在FRAP和DPPH测试中显示出更强的抗氧化能力,尤其是在发酵6 d后表现最为显著(P<0.05),其在促进抗氧化成分积累和提升果酒长期抗氧化稳定性方面是一个更优的选择。
在本研究中,通过对葡萄糖、果糖、蔗糖、可滴定酸、苹果酸、乳酸、柠檬酸、琥珀酸、总酚、总黄酮、FRAP、DPPH和ABTS等指标的综合分析,利用热图对不同发酵方式发酵的富士苹果草莓复合果酒指标进行了综合分析,结果见图7。
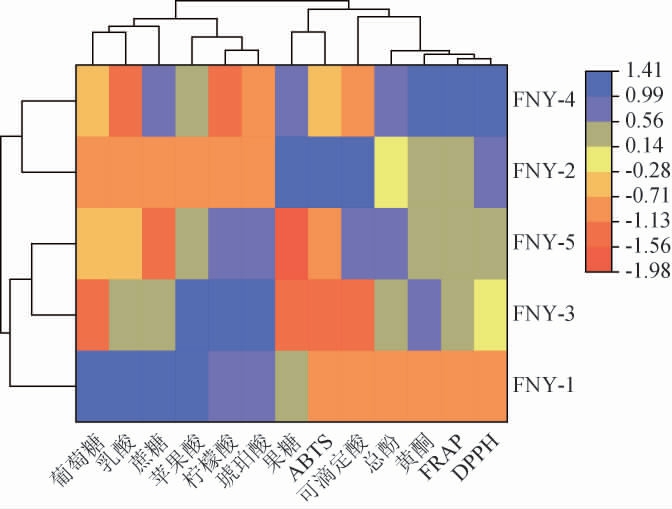
图7 不同发酵方式下苹果草莓酒理化成分和抗氧化活性聚类分析热图
Fig.7 Heat map of cluster analysis of physicochemical components and antioxidant activity of apple-strawberry wine under different fermentation methods
由图7可知,不同发酵方式发酵富士苹果草莓复合果酒可分成三大类:酿酒酵母菌与德尔布有孢圆酵母(FNY-2)和异常毕赤酵母(FNY-4)同时接种混合发酵的富士苹果草莓复合果酒样品归为一类,表明同时接种混合发酵在多个指标上具有一致性,其对于这些指标的影响具有共同的特征。酿酒酵母与德尔布有孢圆酵母(FNY-3)和异常毕赤酵母(FNY-5)顺序发酵的样品归为另一类,表明顺序发酵在化学成分和抗氧化能力上与混合发酵存在显著差异(P<0.05)。酿酒酵母菌单独发酵(FNY-1)的复合果酒样品单独聚为一类,表明单一发酵在各项测试指标上与混合发酵和顺序发酵均有显著不同的效果。聚类结果反映了不同发酵方式可导致复合果酒在化学成分及其抗氧化能力上的差异。混合发酵和顺序发酵之间的差异可能与不同类型的酵母菌在发酵过程中相互作用、相互影响有关,而单一酵母发酵则表现出一组完全不同的特征。
本研究揭示了发酵方式对富士苹果草莓复合果酒理化成分和抗氧化活性的显著影响。混合发酵显著提升了可滴定酸含量和苹果酸降解效果,而顺序发酵在糖分消耗和有机酸积累方面表现突出,并在多项抗氧化能力测试中显示出较好的效果。综合分析表明,酿酒酵母与异常毕赤酵母的顺序发酵在提升富士苹果草莓酒的品质方面表现最佳,不仅在糖代谢效率上显著提升,还在有机酸、总酚黄酮含量的增加以及抗氧化能力测试中均表现出较强的活性,显著提升了果酒的整体品质。聚类分析进一步证明,不同发酵方式导致的化学成分及抗氧化能力存在显著差异,这表明优化发酵工艺对于提升果酒品质至关重要。本研究不仅为高品质富士苹果草莓复合果酒的生产提供了科学依据,还为酿酒工业中发酵技术的优化提供了新思路。
[1]匡立学,聂继云,李银萍,等.中国不同地区‘富士’苹果品质评价[J].中国农业科学,2020,53(11):2253-2263.
[2]唐歆玥,曹叶婷,邓明益,等.柠檬醛对草莓贮藏期间品质和抗氧化能力的影响[J].食品安全质量检测学报,2024,15(2):131-140.
[3]LORENZINI M,SIMONATO B,SLAGHENAUFI D,et al.Assessment of yeasts for apple juice fermentation and production of cider volatile compounds[J].LWT-Food Sci Technol,2019,99:224-230.
[4]LIU S X,LAAKSONEN O,YANG B R.Volatile composition of bilberry wines fermented with non-Saccharomyces and Saccharomyces yeasts in pure,sequential and simultaneous inoculations[J].Food Microbiol,2019,80:25-39.
[5]胡陆军,胡晋伟,陈小蝶,等.混菌发酵对香梨百香果复合果酒品质影响的研究[J].中国酿造,2023,42(3):122-128.
[6]赵婕,袁倩,张序,等.混合发酵对早酥梨-美乐低醇桃红果酒品质的影响[J].食品与发酵工业,2022,48(22):119-127.
[7]MEDINA K,BOIDO E, FARIÑA L, et al.Increased flavour diversity of Chardonnay wines by spontaneous fermentation and co-fermentation with Hanseniaspora vineae[J].Food Chem,2013,141(3):2513-2521.
[8]GOBBI M, COMITINI F, DOMIZIO P, et al.Lachancea thermotolerans and Saccharomyces cerevisiae in simultaneous and sequential co-fermentation:a strategy to enhance acidity and improve the overall quality of wine[J].Food Microbiol,2013,33(2):271-281.
[9]SUN S Y, GONG H S, JIANG X M, et al.Selected non-Saccharomyces wine yeasts in controlled multistarter fermentations with Saccharomyces cerevisiae on alcoholic fermentation behaviour and wine aroma of cherry wines[J].Food Microbiol,2014,44:15-23.
[10]WU Y Z, LI Z G, ZOU S B, et al.Chemical composition and flavor characteristics of cider fermented with Saccharomyces cerevisiae and non-Saccharomyces cerevisiae[J].Foods,2023,12(19):3565.
[11]LIU J J,WAN Y,CHEN Y R,et al.Effects of Torulaspora delbrueckii on physicochemical properties and volatile flavor compounds of navel orange wine[J].J Food Compos Anal,2023,121(18):105328.
[12]GAO M M,HU J G,WANG X J,et al.Effects of Pichia kluyveri on the flavor characteristics of wine by co-fermentation with Saccharomyces cerevisiae[J].Eur Food Res Tech,2023,249:1449-1460.
[13]王燕荣,胡海霞,史晓霞,等.混菌发酵对‘123’苹果酒香气成分的影响[J].中国酿造,2023,42(9):96-102.
[14]王俊钢,李宇辉,史学伟,等.混菌发酵红枣果酒工艺条件优化及抗氧化性研究[J].中国酿造,2023,42(8):210-215.
[15]李甜,雷雨,李东,等.不同非酿酒酵母与酿酒酵母顺序发酵对茵红李果酒风味的影响[J].食品科学,2023,44(24):179-187.
[16]王香君,蒲军,夏文银,等.桑果中非酿酒酵母的分离鉴定及混菌发酵果酒研究[J].中国酿造,2024,43(1):91-98.
[17]曾朝珍,慕钰文,袁晶,等.不同发酵温度对苹果酒理化性质及香气成分的影响[J].中国酿造,2023,42(12):192-197.
[18]赵驰,朱永清,董玲,等.李子果酒主发酵过程中理化指标及挥发性成分变化分析[J].中国酿造,2019,38(9):65-68.
[19]ENGLEZOS V,JOLLY N,DI GIANVITO P,et al.Microbial interactions in winemaking:Ecological aspects and effect on wine quality[J].Trends Food Sci Tech,2022,127:99-113.
[20]DZIALO M C,PARK R,STEENSELS J,et al.Physiology,ecology and industrial applications of aroma formation in yeast[J].FEMS Microbiol Rev,2017,41:S95-S128.
[21]KANTER J P,BENITO S,BREZINA S,et al.The impact of hybrid yeasts on the aroma profile of cool climate Riesling wines[J].Food Chem,2019,5:100072.
[22]JANUSZEK M,SATORA P,WAJDA Ł,et al. Saccharomyces bayanus enhances volatile profile of apple brandies[J].Molecules,2020,25(14):3127.
[23]FEJZULLAHU F, KISS Z, KUN-FARKAS G, et al.Influence of Non-Saccharomyces strains on chemical characteristics and sensory quality of fruit spirit[J].Foods,2021,10(6):1336.
[24]YE M Q,YUE T L,YUAN Y H.Evolution of polyphenols and organic acids during the fermentation of apple cider[J].J Sci Food Agr,2014,94(14):2951-2957.
[25]HUANG J T, LI H C, WANG Y Q, et al.Evaluation of the quality of fermented kiwi wines made from different kiwifruit cultivars[J].Food Biosci,2021,42(11):101051.
[26]高振鹏,宋杨,张美娜,等.益生菌发酵苹果汁过程中总酚酸变化与动力学研究[J].农业机械学报,2019,50(11):350-356.
[27]许亮,师俊玲,任健,等.枸杞果酒发酵过程中黄酮含量的变化[J].食品科学,2011,32(5):100-103.
[28]何思莲,施灿璨,李琼,等.龙眼果酒发酵工艺优化、抗氧化活性研究及品质分析[J].中国酿造,2022,41(5):131-136.
[29]袁晶,康三江,曾朝珍,等.益生菌发酵对苹果浆理化性质、抗氧化活性及挥发性风味的影响[J].食品安全质量检测学报,2023,14(18):287-295.