Optimization of enzymatic extraction process of anthocyanins from blueberry wine residue by response surface method
蓝莓(Vaccinium spp.)是杜鹃花科(Ericaceae)、越橘亚属(Vaccinium)的落叶灌木,蓝莓果似球形或椭圆形,果皮颜色呈深紫色或蓝黑色。蓝莓果富含花青素、维生素、糖类、矿物质、多酚等营养物质,蓝莓鲜果中的花青素含量高达387~487 mg/100 g[1],是花青素含量较高的一种水果。花青素是一种天然的水溶性色素[2],属黄酮类酚类化合物[3],具有抗氧化[4]、保护视力[5]、防衰老、抗癌[6]、抑菌以及增强记忆力[7]等多种保健功能。蓝莓在酿造果酒的过程中,压榨后的酒渣中的主要组成成分是果皮、果肉,其中仍然含有大量的花青素。目前,蓝莓酒渣的主要用途是作为动物饲料或者有机肥料。为了提升蓝莓酒渣的高质化利用,从中提取花青素,应用于食品[8]、化妆品、药品等领域[3],从而获得良好的经济效益。
从植物中提取花青素的方法主要有生物酶(淀粉酶、纤维素酶、果胶酶)[9]、有机溶剂[10]、超声波[11]及微波提取法。化学、物理的提取方法虽然简便,但是化学残留物易污染环境,物理法易造成花青素被氧化。生物酶是一种高度特异的催化蛋白物质,溶解植物细胞壁中的纤维素、半纤维素等,溶出更多花青素,达到更好的提取效果。卢丞文等[12]综述了蓝莓花青素提取技术研究进展,并对各种方法进行对比总结其优缺点,以期为扩大蓝莓花青素工业化生产提供一定的参考依据。熊颖等[13]以蓝莓酒渣为原料,以柠檬酸酸化的乙醇为提取溶剂,采用单因素及响应面法优化蓝莓酒渣花青素的提取工艺。结果表明,蓝莓酒渣花青素提取的最佳工艺条件为乙醇体积分数70%、提取温度50 ℃、料液比1∶20(g∶mL)、溶剂pH=2、提取时长1 h,该条件下提取液中花青素的质量分数可达6.38 mg/g。高效液相色谱分析结果表明,蓝莓鲜果中主要含有飞燕草色素、矢车菊色素、锦葵色素和一种未知色素。蒋思峡等[14]采用乙醇浸提法提取蓝莓酒中原花青素,并利用单因素试验及响应面试验对蓝莓酒中原花青素的提取工艺进行优化。结果表明,最佳提取工艺条件为提取时间57 min,料液比1∶7(g∶mL),乙醇体积分数67.0%,提取温度55 ℃。在此最佳条件下,原花青素平均得率为4.86 mg/g。张秀娟[15]从笃斯越橘果渣这一加工副产物中提取花青素类化合物,并探究其稳定性及对体外体内的降糖作用。采用响应面法优化得到最佳提取工艺为含水量29%,提取温度63 ℃,液料比36∶1(mL∶g)。此优化条件下,总花青素得率为(11.40±0.14)mg/g。结果表明,笃斯越橘花青素可有效缓解T2DM小鼠体质量减轻、多饮多食等症状,降低空腹血糖和糖化血红蛋白的水平,缓解胰岛素抵抗,改善葡萄糖稳态,减少总胆固醇和甘油三酯累积,从而抑制由高血糖和胰岛素抵抗引发的高血脂并发症。
本研究以蓝莓酒渣为研究对象,采用酶法提取蓝莓酒渣花青素,通过单因素试验及响应面试验优化其提取工艺,旨在高效利用蓝莓酒渣,通过提取其中的花青素,并将其广泛应用于食品和医疗行业,以实现更高的经济价值。
蓝莓鲜果:贵州麻江种植基地;酿酒酵母(Saccharomyces cerevisiae)X16、酵母营养添加剂、果胶酶(40 000 U/g):法国LAFFORT公司;α-淀粉酶(20000U/g)、纤维素酶(10000U/g)、酸性蛋白酶(50 000 U/g)、中性蛋白酶(50 000 U/g)、焦亚硫酸钾(分析纯):河南万邦化工科技有限公司;氯化钾(分析纯):上海凌峰化学试剂有限公司;一水合柠檬酸、无水乙酸钠(均为分析纯):江苏强盛功能化学股份有限公司;盐酸(分析纯):国药集团化学试剂有限公司。
2000A多功能粉碎机:浙江省永康市金穗机械制造厂;SHA-H水浴振荡摇床:上海坤诚科学仪器有限公司;DZF-6055电热鼓风干燥箱:上海一恒科学仪器有限公司;WT6002电子天平:杭州万特衡器有限公司;PHS-3E雷磁pH计:上海仪电科学仪器股份有限公司;UV-2700紫外可见分光光度计:日本岛津制作所;CE0035气囊压榨机:德国Europress公司。
1.3.1 蓝莓酒的制备及酒渣处理
从贵州麻江蓝莓种植基地采购蓝莓鲜果,冷链运至常州大学果酒实验室,放入冷库存放24 h。挑选10 kg蓝莓鲜果清洗后切片机破碎,放入不锈钢桶中,加入果胶酶0.3 g、酿酒酵母X16 3 g、酵母营养添加剂3 g、冰糖1.8 kg以及焦亚硫酸钾0.5 g,低温发酵(9~12 ℃),每天搅拌。当酒精度至12%vol时,采用气囊压榨机进行压榨分离,将分离后的酒液进行低温陈酿(2~4 ℃),即得蓝莓酒。蓝莓酒渣在60 ℃烘箱干燥至恒质量,粉碎机粉碎,过80目筛,4 ℃保存备用。
1.3.2 花青素含量测定
取0.5 g蓝莓酒渣,加入少许经预冷的1%KCl-HCl溶液,在冰浴条件下研磨匀浆后,转入试管中,用1%KCl-HCl溶液定容至20 mL,混匀,于4 ℃避光提取20 min后过滤,收集提取液备用。
花青素含量的测定采用pH示差法[16]。取1 mL上述提取液于2个试管中,其中1支试管中加入9 mL 1%KCl-HCl缓冲液(pH=1.0),摇匀后避光静置60 min,分别测定待测液在波长510 nm处的吸光度值(A510 nm),在波长700 nm处的吸光度值(A700nm)。另1支试管中加入9 mL的NaAc-HCl缓冲液(pH=4.5),摇匀后避光静置60 min,分别测定待测液在波长510 nm处的吸光度值(A'510 nm),在波长700 nm处的吸光度值(A'700nm)。蓝莓酒渣中花青素提取量(以矢车菊-3-O-葡萄糖苷当量计)计算公式如下:
式中:ω为花青素提取量,mg/g;M为矢车菊-3-O-葡萄糖苷的相对分子质量,449.2 g/mol;D为稀释倍数;V为提取液体积,mL;ε为矢车菊-3-O-葡萄糖苷的消光系数26 900;L为光程1 cm;m为蓝莓酒渣质量,g。A510nm、A700nm缓冲液为pH值为1.0的吸光度值,A'510 nm、A'700 nm为缓冲液pH值为4.5的吸光度值。
1.3.3 不同种类酶对蓝莓渣花青素提取的影响
取0.1 g蓝莓酒渣,按照料液比1∶100(g∶mL)加入无水乙醇,分别在样品中加入0.7%的淀粉酶、纤维素酶、果胶酶、酸性蛋白酶、中性蛋白酶,于50 ℃水浴,摇床振荡30 min,4 000 r/min离心5 min后取出,过0.45 μm滤膜,得到滤液测定花青素含量,考察不同种类酶对蓝莓渣提取花青素的影响。
1.3.4 蓝莓渣花青素酶法提取工艺优化
(1)单因素试验
淀粉酶添加量的确定:蓝莓酒渣按照料液比1∶100(g∶mL)加入无水乙醇,淀粉酶添加量为0.3%、0.5%、0.7%、0.9%、1.1%,分别于50 ℃、200 r/min条件下提取30 min,4 000 r/min条件下离心5 min,取上清液过0.45 μm滤膜,测定滤液花青素含量。
提取时间的确定:蓝莓酒渣按照料液比1∶100(g∶mL)加入无水乙醇,淀粉酶添加量0.7%,分别于50 ℃、200 r/min条件下提取10 min、20 min、30 min、40 min、50 min,4 000 r/min条件下离心5 min,取上清液过0.45 μm滤膜,测定滤液花青素含量。
提取温度的确定:蓝莓酒渣按照料液比1∶100(g∶mL)加入无水乙醇,淀粉酶添加量0.7%,分别于30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、200 r/min条件下提取40 min,4 000 r/min条件下离心5 min,取上清液过0.45 μm滤膜,测定滤液花青素含量。
初始pH值的确定:蓝莓酒渣按照料液比1∶100(g∶mL)加入无水乙醇,淀粉酶添加量0.7%,初始pH值为1、2、3、4、5、6、7,于50 ℃、200 r/min条件下提取40 min,4 000 r/min条件下离心5 min,取上清液过0.45 μm滤膜,测定滤液花青素含量。
(2)响应面试验
在单因素试验基础上,以淀粉酶添加量(A),提取时间(B),提取温度(C),初始pH值(D)为自变量,以花青素提取量(Y)为响应值,采用4因素3水平响应面试验方法探究淀粉酶添加量、提取时间、提取温度、初始pH值4个因素对花青素提取量的影响,得出最佳提取工艺条件,响应面试验因素与水平见表1。
表1 酶法提取工艺优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for enzymatic extraction process optimization

水平 A 淀粉酶添加量/%B 提取时间/min C 提取温度/℃ D 初始pH值-1 0 1 0.5 0.7 0.9 30 40 50 50 60 70 4 5 6
1.3.5 数据处理
采用IBM SPSS Statistics 27.0.1软件对数据差异显著性分析,所有试验数据平行测定3次。使用Origin 2023软件制作图表,使用Design Expert 8.0.6.1软件进行响应面试验结果分析。
通过查阅大量参考文献,发现纤维素酶是提取水果花青素的常用酶。本试验以纤维素酶提取花青素作为对照,比较淀粉酶、果胶酶、酸性蛋白酶、中性蛋白酶提取蓝莓酒渣中的花青素提取量,结果见表2。
表2 不同酶种类对蓝莓酒渣花青素提取量的比较
Table 2 Comparison of anthocyanin extraction yield from blueberry wine residue by different enzymes

注:不同字母表示差异显著(P<0.05)。
处理 酶种类 花青素提取量/(mg·g-1)试验组对照组淀粉酶果胶酶酸性蛋白酶中性蛋白酶纤维素酶0.51±0.022e 0.17±0.005c 0.075±0.021a 0.089±0.013b 0.40±0.015d
由表2可知,淀粉酶提取蓝莓渣的花青素提取量最高为0.51 mg/g,其次为纤维素酶提取蓝莓渣的花青素提取量为0.40mg/g、果胶酶提取蓝莓渣的花青素提取量为0.17mg/g,两种蛋白酶的提取量最小。主要原因是蓝莓酒渣中的主要成分为膳食纤维和多酚类,细胞壁的主要成分是纤维素和半纤维素[17]。膳食纤维包括水溶性膳食纤维、不溶性膳食纤维以及木质素,淀粉酶会使蓝莓酒渣中的非水溶性膳食纤维转化为水溶性膳食纤维,进而溶解纤维素细胞壁,促使花青素溶出[18]。而纤维素酶只会使蓝莓细胞壁中的水溶性纤维素分解,花青素得到释放。果胶酶提取量相对低的原因是果胶水解,使部分细胞壁破裂,但不能溶解纤维素[19]。两种蛋白酶含量最小的原因是在提取过程中酒渣中的多酚与蛋白质发生络合反应[20],产生暗黄色絮状物,影响花青素的提取。因此,提取蓝莓渣花青素的最适酶为淀粉酶。
2.2.1 淀粉酶添加量对花青素提取量的影响
由图1可知,随着淀粉酶的添加,花青素提取量呈现先上升后平缓的趋势。当淀粉酶的添加量为0.3%~0.7%时,花青素提取量随之升高;当淀粉酶添加量为0.7%时,花青素提取量达到最高,为0.45 mg/g;当淀粉酶的添加量>0.7%之后,花青素提取量趋向平缓。主要原因是随着酶添加量的增加,花青素溶出速率加快,直至蓝莓渣中的花青素释放完全,花青素提取量趋向平缓[21]。因此,最适淀粉酶的添加量为0.7%。
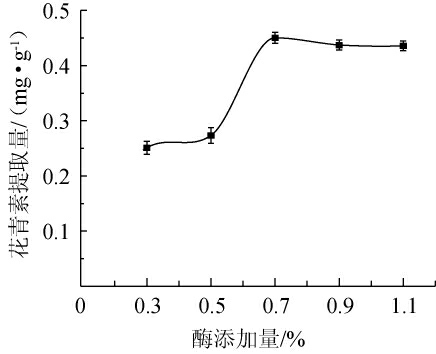
图1 淀粉酶添加量对花青素提取量的影响
Fig.1 Effect of amylase addition on anthocyanin extraction yield
2.2.2 提取时间对花青素提取量的影响
由图2可知,在淀粉酶的作用下,随着时间的增加,花青素提取量呈现先上升后平缓的趋势。当提取时间为10~40 min时,花青素提取量逐渐递增;当提取时间为40 min时,花青素提取量最高,为0.56 mg/g;当提取时间>40 min之后,花青素提取量趋向平缓。主要原因是随着时间增加,花青素溶出速率加快,提取时间过长,酶和酒渣反应完全,花青素提取量趋向平缓[22]。因此,最适提取时间为40 min。
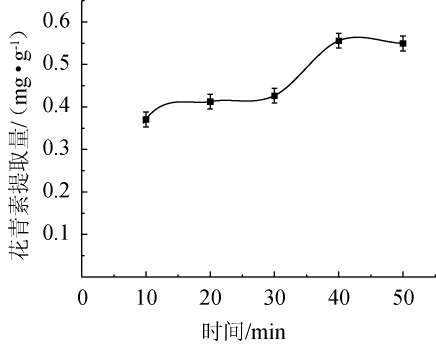
图2 提取时间对花青素提取量的影响
Fig.2 Effect of extraction time on anthocyanin extraction yield
2.2.3 提取温度对花青素提取量的影响
由图3可知,随着温度的增加,花青素提取量呈现先上升后下降的趋势。当提取温度为30~60 ℃时,花青素提取量逐渐递增;当提取温度为60 ℃时,花青素提取量最高,为0.61 mg/g;当提取温度>60 ℃之后,花青素提取量下降。主要原因是花青素的适宜温度在40~60 ℃,提取温度过高,淀粉酶的活性受到影响,化学键不稳定,从而导致酶的结构与功能发生变化,影响花青素的提取[16]。因此,最适提取温度为60 ℃。
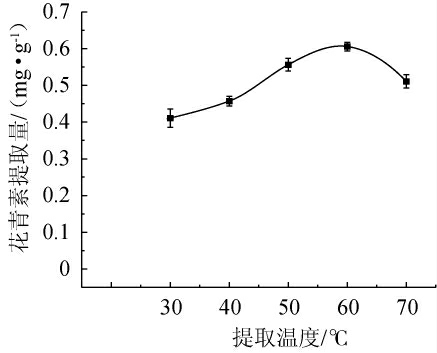
图3 提取温度对花青素提取量影响
Fig.3 Effect of extraction temperature on anthocyanin extraction yield
2.2.4 初始pH值对花青素提取量的影响
由图4可知,在淀粉酶的作用下,花青素提取量随着初始pH值的增加呈现先上升后下降的趋势,当初始pH值为1~5时,花青素提取量逐渐递增;当初始pH值为5时,花青素提取量最高,为0.66 mg/g;当初始pH值>5之后,花青素提取量下降。主要原因是在pH值≤5时,淀粉酶的活性逐渐增强。初始pH值过高,一方面是由于酶活性降低,另一方面是偏中性的环境影响花青素的稳定性,导致提取量下降[23]。因此,最适初始pH值为5。
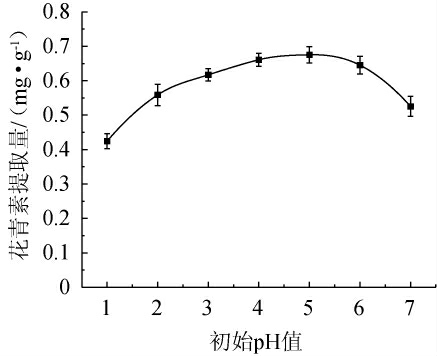
图4 初始pH对花青素提取量的影响
Fig.4 Effect of initial pH on anthocyanin extraction yield
2.3.1 响应面设计试验结果与分析
在单因素试验基础上,以淀粉酶添加量(A)、提取时间(B)、提取温度(C)、初始pH值(D)为自变量,以花青素提取量(Y)为响应值进行4因素3水平响应面试验,结果见表3,方差分析结果见表4。
表3 酶法提取工艺优化响应面试验设计与结果
Table 3 Design and results of response surface tests for enzymatic extraction process optimization
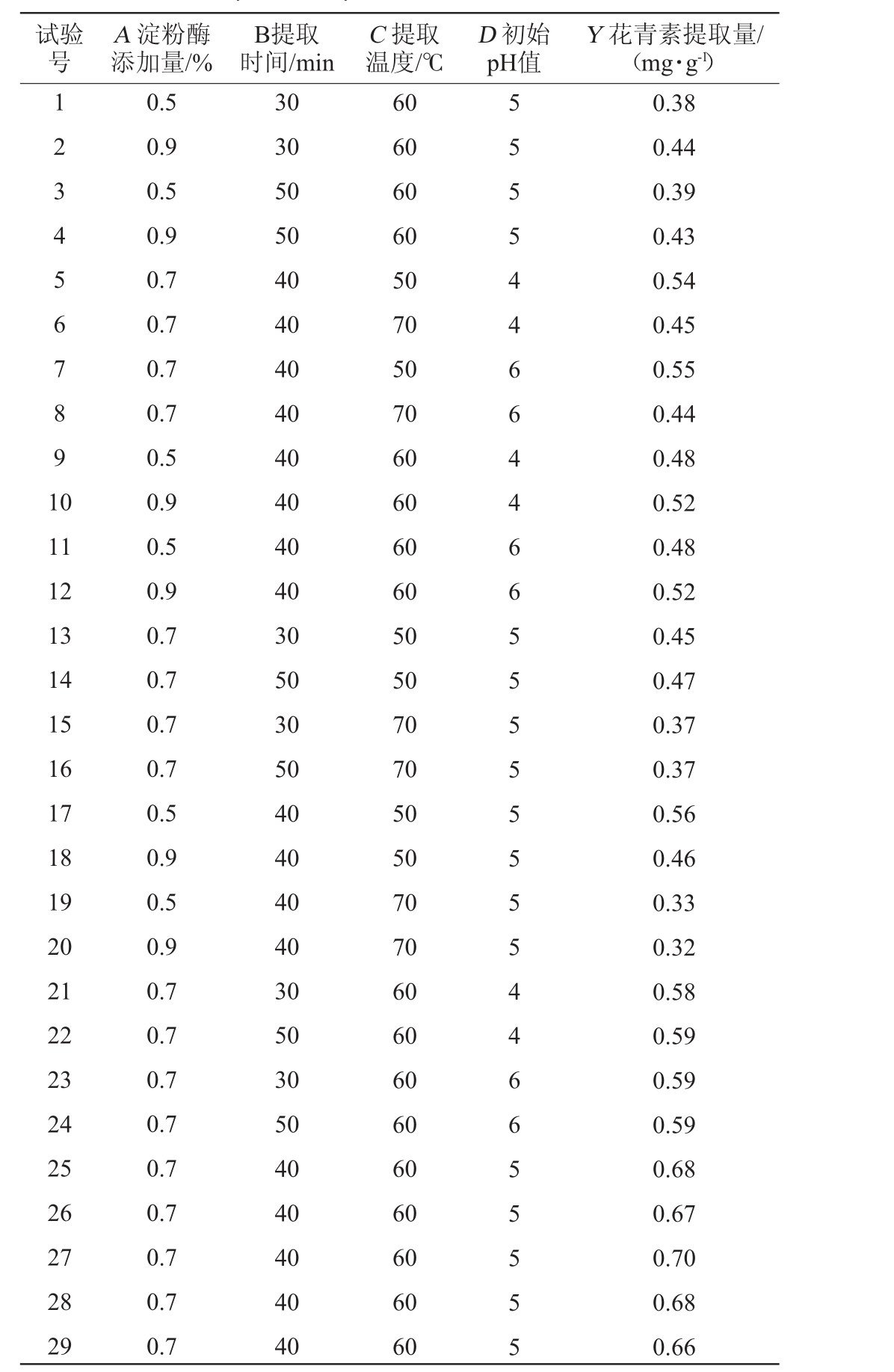
试验号A 淀粉酶添加量/%B提取时间/min C 提取温度/℃D 初始pH值Y 花青素提取量/(mg·g-1)1 2 3 4 5 6 7 8 9 1 0 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 0.5 0.9 0.5 0.9 0.7 0.7 0.7 0.7 0.5 0.9 0.5 0.9 0.7 0.7 0.7 0.7 0.5 0.9 0.5 0.9 0.7 0.7 0.7 0.7 0.7 0.7 0.7 0.7 0.7 30 30 50 50 40 40 40 40 40 40 40 40 30 50 30 50 40 40 40 40 30 50 30 50 40 40 40 40 40 60 60 60 60 50 70 50 70 60 60 60 60 50 50 70 70 50 50 70 70 60 60 60 60 60 60 60 60 60 5 5 5 5 4 4 6 6 4 4 6 6 5 5 5 5 5 5 5 5 4 4 6 6 5 5 5 5 5 0.38 0.44 0.39 0.43 0.54 0.45 0.55 0.44 0.48 0.52 0.48 0.52 0.45 0.47 0.37 0.37 0.56 0.46 0.33 0.32 0.58 0.59 0.59 0.59 0.68 0.67 0.70 0.68 0.66
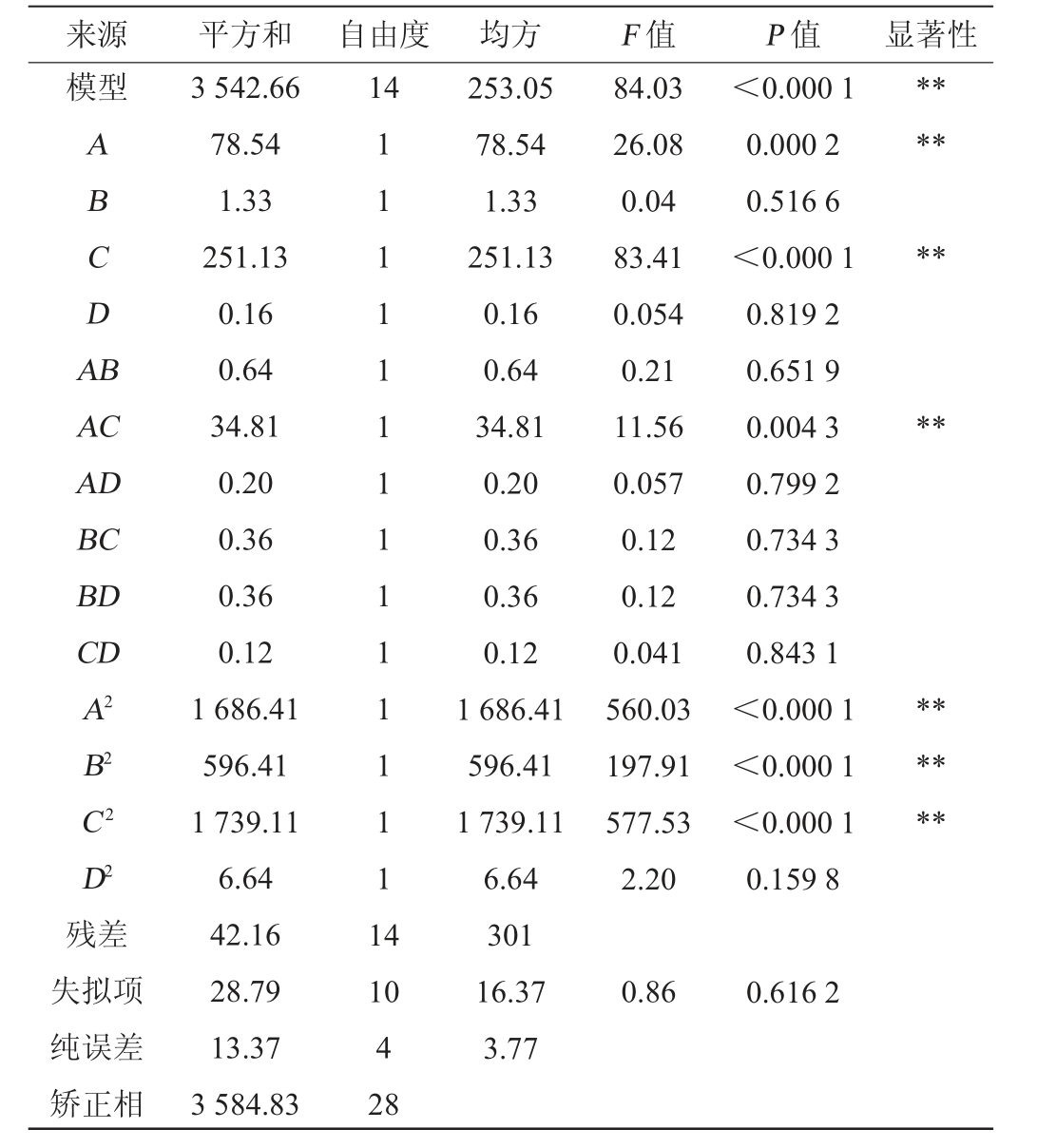
表4 回归模型方差分析
Table 4 Variance analysis of regression model
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著
(P<0.01)。
来源 平方和 自由度 均方 F 值 P 值 显著性模型14 ABCDA B******AC AD BC BD CD A2 B2 C2 D2残差失拟项纯误差矫正相3 542.66 78.54 1.33 251.13 0.16 0.64 34.81 0.20 0.36 0.36 0.12 1 686.41 596.41 1 739.11 6.64 42.16 28.79 13.37 3 584.83 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 4 84.03 26.08 0.04 83.41 0.054 0.21 11.56 0.057 0.12 0.12 0.041 560.03 197.91 577.53 2.20<0.000 1 0.000 2 0.516 6<0.000 1 0.819 2 0.651 9 0.004 3 0.799 2 0.734 3 0.734 3 0.843 1<0.000 1<0.000 1<0.000 1 0.159 8********10 4 28 253.05 78.54 1.33 251.13 0.16 0.64 34.81 0.20 0.36 0.36 0.12 1 686.41 596.41 1 739.11 6.64 301 16.37 3.77 0.86 0.616 2
采用Design Expert 8.0.6.1软件对表3数据进行二次多项回归拟合,得到蓝莓花青素提取量对淀粉酶添加量、提取时间、提取温度及初始pH值的多元二次多元回归方程如下:
由表4可知,回归模型P<0.01,极显著;失拟项P为0.616 2>0.05,不显著,说明此模型拟合极好。模型的决定系数R2=0.976 5,说明拟合回归方程可信度较高。由F值可知,对花青素提取量按影响效果大小排序为提取温度(C)>淀粉酶添加量(A)>提取时间(B)>初始pH值(D)。由P值可知,一次项A、C,交互项AC,二次项A2、B2、C2对花青素提取量影响极显著(P<0.01),其他项对结果影响不显著(P>0.05)。
2.3.2 响应面各因素间交互作用分析
各因素间交互作用对花青素提取量的影响的响应面及等高线见图5。

图5 各因素间交互作用对花青素提取量影响的响应曲面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between various factors on anthocyanin extraction yield
响应面直接反映各试验因素相互作用对蓝莓酒渣花青素提取量的影响[24-25],响应面越陡峭,等高线越趋于椭圆形,表明二者交互作用对结果影响越显著;反之,响应面越平缓,等高线越趋于圆形,表明二者交互作用对结果影响越不显著。由图5可知,淀粉酶添加量(A)和提取温度(C)之间的交互作用的响应面陡峭,等高线呈椭圆形,表明二者对花青素提取含量有极显著影响(P<0.05)。其余各因素交互作用响应面平缓,等高线呈圆形,表明对结果影响不显著。这与表4方差分析结果一致。
2.3.3 验证实验
通过Design-Expert 8.0.6.1软件分析得出的酶法提取花青素的最佳工艺条件为淀粉酶添加量0.720%,提取温度58.253 ℃,提取时间为41.444 min,初始pH值为5.047。在此条件下,花青素提取量预测值为0.72 mg/g。考虑到实际操作可行性,将优化酶法提取工艺条件修正为淀粉酶添加量0.7%,提取温度60 ℃,提取时间为40 min,初始pH值为5.0。并在此优化条件下进行3次平行验证试验,得到花青素提取量实际值为0.70 mg/g,与预测值差别不大,比优化前提高了20.8%,表明该模型可用于优化酶法提取花青素的工艺条件。
采用单因素试验及响应面试验优化蓝莓酒渣花青素最佳酶法提取工艺为:淀粉酶添加量0.7%,蓝莓酒渣与无水乙醇料液比1∶100(g∶mL),提取温度60 ℃,提取时间40 min,初始pH值为5。在此优化条件下,花青素提取量为0.68 mg/g,比对照提高了20.8%。因此,应用此工艺提取蓝莓酒渣花青素是可行的,具有较高的经济价值与环保意义。
[1]尤丽,党娅.蓝莓花青素的代谢及功能特性研究进展[J].食品研究与开发,2021,42(14):193-200.
[2]NOMI Y, IWASAKI-KURASHIGE K, MATSUMOTO H.Therapeutic effects of anthocyanins for vision and eye health[J].Molecules,2019,24(18):3311.
[3]SADOWSKA-BARTOSZ I,BARTOSZ G.Antioxidant activity of anthocyanins and anthocyanidins: a critical review[J].Int J Molecular Sci,2024,25(22):12001.
[4]BERG S,BRETZ M,HUBBERMANN E M,et al.Influence of different pectins on powder characteristics of microencapsulated anthocyanins and their impact on drug retention of shellac coated granulate[J].J Food Eng,2012,108(1):158-165.
[5]SUN L Q, DING X P, QI J, et al.Antioxidant anthocyanins screening through spectrum-effect relationships and DPPH-HPLC-DAD analysis on nine cultivars of introduced rabbiteye blueberry in China[J].Food Chem,2012,132(2):759-765.
[6]刘军波,邹礼根,翁丽萍,等.蓝莓保健食品的现状分析及展望[J].农产品加工,2020(18):88-91.
[7]ANDRES-LACUEVA C,SHUKITT-HALE B,GALLI R L,et al.Anthocyanins in aged blueberry-fed rats are found centrally and may enhance memory[J].Nutr Neurosci,2005,8(2):111-120.
[8]周杰,周洋,黄建刚.蓝莓酒渣果酱制作工艺的优化[J].中国酿造,2018,37(4):201-204.
[9]孙韵倩,赖锦晖,张欣,等.植物提取花青素工艺改进案例研究[J].粮食科技与经济,2019,44(11):118-120.
[10]刘晨,刘安军,马艳弘,等.蓝莓酒渣花色苷的超声波辅助提取工艺及抗氧化活性[J].江苏农业科学,2015,43(1):242-247.
[11]徐娟,王瑞芸,孙航,等.蓝莓酒渣中花青素超声波辅助提取研究[J].粮食与油脂,2017,30(5):80-83.
[12]卢丞文,沙蒙.蓝莓花青素提取技术的研究进展[J].农业与技术,2017,37(15):1-4.
[13]熊颖,禹霖,柏文富,等.蓝莓酒渣花青素提取工艺优化及花青素组成分析[J].经济林研究,2022,40(1):159-168.
[14]蒋思峡,王士超,胡鹏刚.蓝莓酒中原花青素提取工艺研究[J].中国酿造,2021,40(10):134-138.
[15]张秀娟.笃斯越橘果渣花青素的提取优化与活性评价[D].哈尔滨:东北林业大学,2023.
[16]练冬梅.冰菜主要营养成分及抗氧化活性分析[J].农业科学,2020,10(5):225-230.
[17]DIMAS-LOPEZ D, SOTO S, NORMA G V, et al.Optimization of anthocyanin extraction from Oxalis tuberosa peel by ultrasound,enzymatic treatment and their combination[J].J Food Meas Charact,2023,17(2):1775-1782.
[18]高鲲,梁文珍,贾金辉,等.酶法提取蓝莓果渣非水溶性膳食纤维工艺研究[J].辽宁农业职业技术学院学报,2021,23(5):10-13.
[19]NOGALES-BUENO J, BACA-BOCANEGRA B, HEREDIA F J, et al.Phenolic compounds extraction in enzymatic macerations of grape skins identified as low-level extractable total anthocyanin content[J].J Food Sci,2020,85(2):324-331.
[20]黄惠华,王志,陈建新.多酚-蛋白质络合反应的影响因素研究[J].食品科学,2003,24(2):22-25.
[21]王彦平,陈月英,孙瑞琳,等.超声波结合酶法提取葡萄皮渣原花青素工艺优化及其抗氧化活性[J].食品研究与开发,2021,42(24):74-79.
[22]田恒,张敏,李正杰.酶辅助提取金寨蓝莓花青素研究[J].园艺与种苗,2018,38(10):9-11.
[23]张盼盼,王丽,时志军,等.蓝莓果渣花青素的超声辅助提取工艺优化[J].食品与机械,2017,33(2):152-157.
[24]HE B,ZHANG L L,YUE X Y,et al.Optimization of ultrasound-assisted extraction of phenolic compounds and anthocyanins from blueberry(Vaccinium ashei)wine pomace[J].Food Chem,2016,204(10):70-76.
[25]KUMAR M,DAHUJA A,SACHDEV A,et al.Optimization of the use of cellulolytic enzyme preparation for the extraction of health promoting anthocyanins from black carrot using response surface methodology[J].LWT-Food Sci Technol,2022,163:113528.