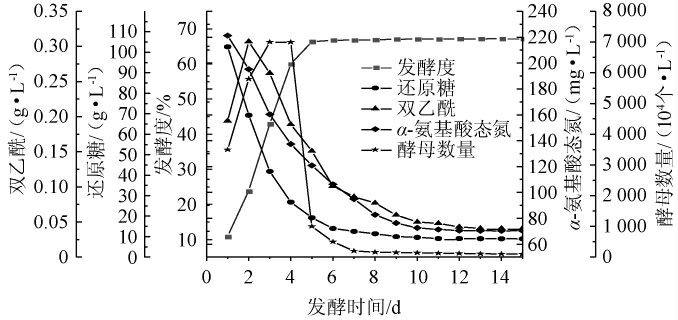
图1 啤酒发酵过程各指标的变化曲线
Fig.1 Change curves of each index during beer fermentation process
Establishment and validation of a kinetic model for the changes in microbial cells and substances during fermentation process of lager beer
啤酒是一种由麦芽为主要原料添加其他辅料酿造含二氧化碳的低浓度酒精饮料,深受世界人民喜爱。截至2022年年底,世界啤酒产量达到了1.89亿kL,其中中国的产量为3 604.05万kL,排名世界第一,年产量接近第二名美国的两倍[1]。
啤酒发酵过程,作为啤酒生产中的重要环节,其工艺的改变直接关系到发酵液中物质的变化,进而影响啤酒的口味和品质[2]。同时在啤酒的发酵过程中,发酵度的变化与基质的消耗及菌体的生长都有着明显的关系。通过建立啤酒发酵动力学模型,可以快速了解发酵进程中微生物代谢活动,从而对相关重要参数的动态变化有更加清楚地认识,降低成品啤酒中由于代谢产物变化而导致风味变差的风险[3-4]。研究人员对小麦啤酒[5]、蓝莓果酒[6]、嘉宝果果酒[7]、低度米酒[8]、葡萄酒[9-10]等发酵过程中的酿酒酵母数量、还原糖消耗量和双乙酰生成量变化分别建立了动力学模型,所得的结果表明,Logistic、Boltzmann、DoseResp和Farazdaghi-Harris模型的测定值和预测值之间具有较好的拟合度。这些模型可以用来描述啤酒发酵过程中菌株的生长、底物的消耗和产物的生成变化规律。在啤酒发酵中,酵母将糖通过代谢途径生成乙醇、二氧化碳和各种次生代谢产物,奠定了啤酒的风味和口感。Logistic和Boltzmann模型总体趋势呈现S型,适合描述底物消耗和产物形成的关系;DoseResp模型通常用于评估化学物质对生物体产生的剂量-反应关系的数学模型,确定给定剂量的化学物质与生物体中特定的生物效应之间的关系;Farazdaghi-Harris模型用于描述一个给定时期内,种群数量如何随时间变化而变化[11]。
由于酵母代谢过程的复杂性,目前对啤酒的研究报道多数集中在啤酒发酵过程中风味[12]、抗氧化物质[13]、酿造工艺[14]和香气成分[15]等方面,而关于发酵过程中基质消耗和产物生成的动力学变化规律研究报告较少。国内外有研究总结了几种啤酒发酵的动力学模型,但由于以往的研究多在实验室条件下模拟发酵,制作的动力学模型并不适用于工业化生产,这就导致研究结果的局限性[16-17]。该研究采用四种不同的模型对从酒厂发酵罐中直接取样的啤酒还原糖、α-氨基酸态氮、酵母菌数、双乙酰含量及发酵度进行测定,并对其变化进行非线性拟合,并建立了动力学模型,分析发酵过程中各组分动态变化规律,同时对所建立的模型通过同类型不同批次的啤酒进行验证,以期对啤酒的控制发酵提供理论基础,带动啤酒发酵工业的进一步发展。
麦芽:华润雪花啤酒(自贡)有限责任公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):上海展云化工有限公司;酒石酸钾钠、苯酚、亚硫酸钠、磷酸氢二钠、磷酸二氢钾、茚三酮、果糖、碘酸钾、甘氨酸、邻苯二胺(均为分析纯):国药集团化学试剂有限公司;盐酸(分析纯):贵州剑立消防工程有限责任公司。
Lambda 35紫外-可见双光束分光光度计:美国PE公司;ALC-210型电子分析天平:北京赛多利斯仪器有限公司;PHH-7011型pH仪表:美国Omega公司;Alcolyzer Plus Beer型全自动啤酒分析仪:奥地利安东帕公司;双乙酰发生装置、SHZ-82型水浴恒温振荡器:金坛天竟仪器厂。
1.3.1 啤酒发酵工艺流程及操作要点
麦芽→原料粉碎→糖化→过滤→麦汁煮沸→添加酒花→冷却→接种酵母→发酵→后熟→过滤灌装→成品
麦芽等原料需要经过粉碎处理后进行糖化;糖化分为4个阶段,50℃维持20 min,主糖化阶段温度65 ℃维持50 min,糊化阶段温度72 ℃维持15 min,终止糖化阶段温度78 ℃维持8 min,将麦芽中的淀粉转化成糖,形成麦汁;将麦汁过滤后煮沸,煮沸时间为90 min,以杀灭麦汁中的杂菌并稳定麦汁的成分;在煮沸过程结束前10 min加入啤酒花,以增加啤酒的苦味和香气;将煮沸后的麦汁冷却到25 ℃,将活化后的酵母按照10 g/L的接种量加入冷却后的麦汁中,在12 ℃条件下发酵14 d;在4 ℃条件下进行后发酵,后发酵时间为5周。
在麦汁进入主发酵阶段后24 h开始,每天固定在下午2点开始取样,连续取样15 d,每次重复测定3批,使用取样管从发酵容器中取样。
1.3.2 检测方法
酵母菌数量的测定:采用血球计数板测定酵母菌的浓度[18];还原糖含量测定:DNS比色法[19];α-氨基酸态氮含量测定:采用茚三酮比色法测定[20];双乙酰测定:采用邻苯二胺法测定[21];发酵度测定:利用全自动啤酒分析仪测定。
1.3.3 模型构建与数据分析
每组实验平行重复3次,取平均值,采用软件Origin9.0对实验所得数据绘制图形进行分析,在Logistic、Boltzmann、DoseResp和Farazdaghi-Harris模型间选取合适的动力学模型对酵母菌的生长、α-氨基酸态氮和还原糖基质的消耗、发酵度的变化进行非线性拟合。而双乙酰含量数据采用CurveExpert 1.4数学软件进行分析,自建了符合双乙酰含量变化的非线性函数,得出有理函数的分数形式并利用数学软件Origin9.0进行绘图。对相应的微分模型进行积分处理,并选择适宜的参数常量,利用数学软件进行回归分析、建模。将验证数据带入构建的模型方程中,验证模型的实际效果。
对啤酒发酵过程中组分的含量变化进行测定,3批样品数据取平均数,绘制发酵曲线,结果见图1。

图1 啤酒发酵过程各指标的变化曲线
Fig.1 Change curves of each index during beer fermentation process
由图1可知,麦汁发酵期间,还原糖作为酵母生长的主要碳源,其含量在发酵前4 d快速降低,6 d后还原糖含量趋于稳定。此外,α-氨基酸态氮是酵母发酵过程中主要氮源,其在啤酒发酵过程中含量变化趋势与还原糖类似。
酵母菌数量在发酵前3 d快速增加,新陈代谢旺盛,在此过程中酵母菌的主要生命活动是通过大量消耗还原糖等底物,繁殖酵母细胞,发酵6 d后酵母进入衰亡期,菌体数量由于营养物质和生存空间减少随之快速降低。
双乙酰是从α-乙酰乳酸(一种丙酮酸在缬氨酸生物合成中的中间代谢产物)的转化中获得的,是啤酒发酵中的必然产物,双乙酰在发酵过程中含量变化呈现先上升后下降到稳定的趋势。啤酒发酵度是指麦汁中浸出物被酵母消耗掉部分与麦汁中浸出物总量的比值,发酵度在发酵前5 d快速上升;发酵6d后上升速度明显减慢,最终基本保持不变。
2.2.1 还原糖消耗动力学模型
由图1看出麦汁中还原糖的变化总体呈下降趋势,在发酵的前3 d变化极其显著,4~6 d下降速度相对放缓,6~15 d缓慢下降,最后含量趋于稳定;出现这种趋势是由于在发酵前期,接种酵母后酵母大量生长繁殖,还原糖被酵母菌消耗,导致含量急剧下降至较低水平,不足以支撑酵母菌的稳定生长,此时还原糖含量趋于稳定[22]。结合测定数据利用数学软件Origin 9.0进行非线性拟合,还原糖底物消耗拟合曲线及拟合系数结果见表1。Logistic模型下还原糖含量实际值测定结果及消耗拟合曲线见图2。
表1 还原糖消耗拟合曲线及拟合系数
Table 1 Fitting curves and fitting coefficients of reducing sugars consumption

注:x代表发酵时间,d;y代表还原糖含量,g/L。
模型 拟合曲线 相关系数R2 Farazdaghi-Harris y= 1 0.006 6+0.003x1.5752 0.990 05 Logistic y=7.894+ 104.846 1+ x 2.278( )2.717 0.999 83 Boltzmann y=9.315+ 220.65 1+ex-0.567 0.999 47 1.41 Dose-response y=9.316+ 220.656 1+10-0.306(0.5677-x)0.999 47
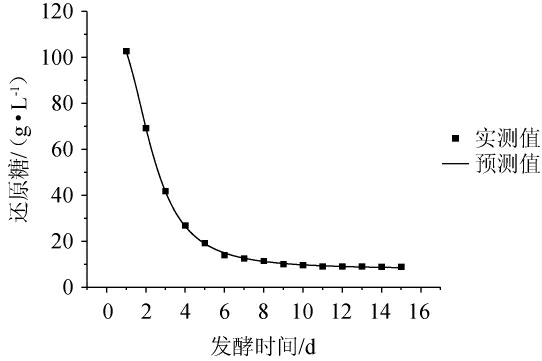
图2 还原糖消耗Logistic模型拟合曲线
Fig.2 Logistic model fitting curve for reducing sugars consumption
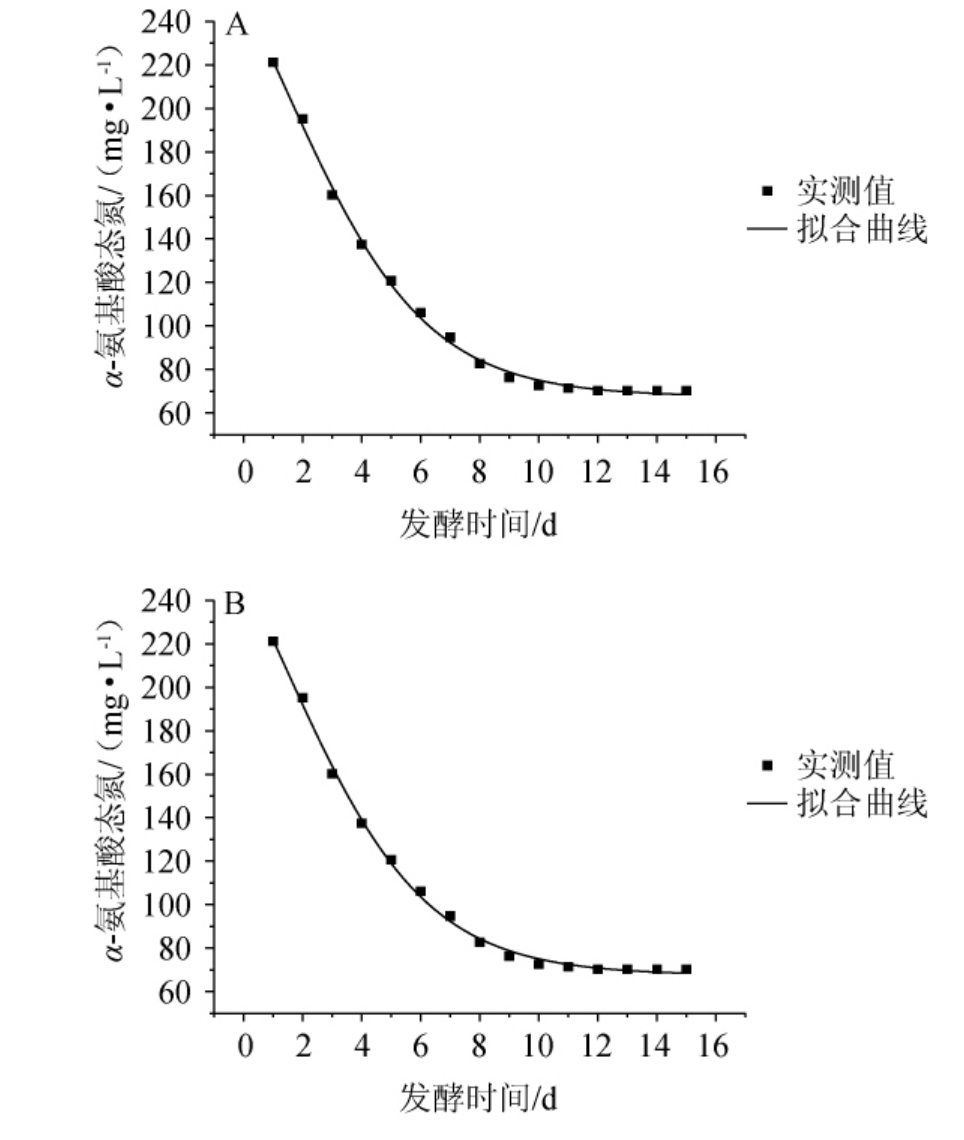
图3 α-氨基酸态氮消耗的Boltzmann模型(A)及DoseResp模型(B)拟合曲线
Fig.3 Boltzmann model (A) and DoseResp model (B) fitting curves for α-amino acid nitrogen consumption
由表1可知,4种模型的拟合系数(R2)均大于0.99,其中Logistic模型相关系数高于其他三种模型,为4种模型中最高,说明此模型能够较好地反映在啤酒发酵过程中还原糖含量变化的情况。由图2可知,发酵时间为1~4 d时,还原糖消耗较快,表示啤酒主发酵阶段即将结束,发酵时间超过4 d时,还原糖的消耗趋于稳定,Logistic模型下的还原糖含量实测值和预测值基本吻合,再次说明该模型能够较好地描述啤酒发酵过程中还原糖的消耗过程。
2.2.2 α-氨基酸态氮消耗动力学模型
在啤酒发酵过程中,由于酵母细胞分泌在胞外的酶活性较低,难以利用分解麦汁中的蛋白质,而更偏向于吸收并利用麦汁中的游离氨基酸来满足酵母细胞的繁殖,因此α-氨基酸态氮是酵母发酵过程中主要的氮源[22],同时也是影响酵母生长和发酵的另一重要因素,是评价麦汁质量的重要指标之一。麦汁中α-氨基酸态氮含量高,表明氮源丰富,则酵母的代谢就旺盛,发酵能力强,与此同时也会增强双乙酰的生成,建立动力学模型在一定程度上有利于控制啤酒的风味。α-氨基酸态氮消耗拟合方程及其相关系数见表2。
表2 α-氨基酸态氮消耗拟合曲线及拟合系数
Table 2 Fitting curves and fitting coefficients of α-amino acid nitrogen consumption

注:x代表发酵时间,d,y代表α-氨基酸态氮含量,mg/L。
模型 拟合曲线 相关系数R2 Farazdaghi-Harris y= 1 0.003 3+0.001 1x0.9278 0.992 0 Logistic y=58.97+ 201.15 1+ x 3.7( )2.18 0.996 9 Boltzman y=67.53+ 285.47 1+ex-1.39 2.38 0.998 1 Dose-response y=67.53+ 285.24 1+10-0.1821(1.395-x)0.998 1
由表2可知,4种模型相关系数(R2)均>0.99,Boltzmann和DoseResp模型相关系数一致,均高于Logistic模型和Farazdaghi-Harris模型,说明这两种模型均能较好反应啤酒发酵过程中α-氨基酸态氮的含量变化。α-氨基酸态氮含量实际值测定结果及消耗拟合曲线见图2。由图2可知,发酵时间为1~4 d时,α-氨基酸态氮消耗较快,表明酵母快速生长繁殖,α-氨基酸态氮消耗速率加快;当发酵时间超过4 d,酵母进入衰亡期,活力减弱,α-氨基酸态氮变化趋于稳定。Boltzmann和DoseResp模型下的α-氨基酸态氮含量实测值和预测值基本吻合,说明这两个模型能较好地模拟啤酒发酵过程中α-氨基酸态氮的消耗过程。
2.2.3 酵母菌生长动力模型
由图1可知,酵母菌生长曲线在啤酒发酵的第4天后数量急剧下降,一方面由于拉格啤酒是底层发酵,取样时取样器并未伸入发酵容器底部,另一方面酵母菌进入衰亡期[23-24],后续数据意义不大,所以只选取了前4 d的数据进行分析。由于Farazdaghi-Harris模型下拟合数据出现不收敛情况,模型变化趋势不适合酵母菌生长曲线,故只选取其他3种模型,酵母菌数量拟合方程及相关系数见表3。
表3 酵母菌生长拟合曲线及拟合系数
Table 3 Fitting curves and fitting coefficients of yeast growth

注:x代表发酵时间,d;y代表酵母菌数量,104/L。
模型 拟合曲线 相关系数R2 Logistic y=7 000- 3 500 1+ x 1.76( )3 0.906 4 Boltzman y=7 000- 3 500 1+ex-1.76 0.15 0.954 5 DoseResp y=3 500+ 3 500 1+10(1.76-x)1.67 0.991 0
由表3可知,对比3种模型的拟合效果,DoseResp模型拟合相关系数最高,相关系数(R2)为0.990 4。因此选择DoseResp模型来拟合啤酒发酵过程中的酵母菌数量变化过程。DoseResp模型酵母菌生长拟合曲线见图4。由图4可知,发酵时间为0~4 d,拟合曲线与实测值几乎重合,说明DoseResp模型可较好的反映出酵母菌数量变化的现象,发酵时间为3 d时,酵母菌数量达到最高值。
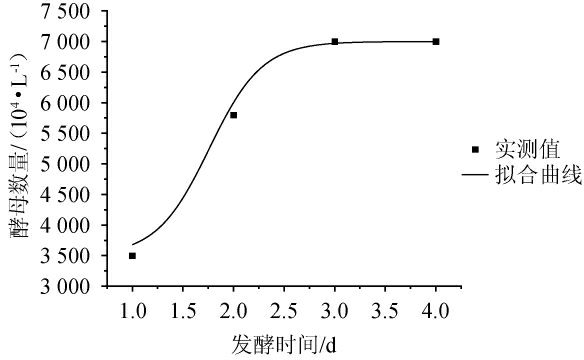
图4 酵母菌数量DoseResp模型拟合曲线
Fig.4 DoseResp model fitting curve for yeast count
2.2.4 双乙酰生成动力学模型构建
双乙酰作为啤酒发酵过程中必然的副产物,是酵母合成缬氨酸的中间产物α-乙酰乳酸分泌到酵母细胞外,通过氧化脱羧反应而生成的[25]。双乙酰属于啤酒发酵过程中的不良风味物质,同时也是啤酒成熟的限制性指标,啤酒中的双乙酰含量应尽可能控制到0.1 mg/L以下,高于阈值会导致啤酒在饮用时有一股米饭馊味。由于Farazdaghi-Harris模型拟合曲线不收敛,变化趋势不适合反映双乙酰含量变化趋势,故只选取另外3种模型进行拟合分析,双乙酰生成拟合方程及其相关系数见表4。
表4 双乙酰生成拟合曲线及拟合系数
Table 4 Fitting curves and fitting coefficients for diacetyl formation

注:y表示双乙酰的含量,mg/L;x表示发酵时间,d。
模型 拟合曲线 相关系数R2 Logistic y=0.043 48+ 0.212 49 1+ x 5.0396( )4.8794 57+ 0.210 6 1+ex-5.061 0.967+ 0.210 6 0.908 41 Boltzman y=0.048 0.895 42 DoseResp y=0.048 57 1+100.4491(x-5.061)0.895 42
由表4可知,3种模型相关系数(R2)均<0.90,不能较好地描述啤酒发酵过程中双乙酰含量的变化过程,需重新设立模型并验证。结合图1可以看出,双乙酰含量前5 d变化幅度较大,变化趋势具体表现为先升高至最大值然后快速下降,发酵5~10 d双乙酰含量下降趋缓,发酵10~15 d双乙酰含量保持稳定,并小于0.1 mg/L,发酵前10 d双乙酰含量差异显著,10 d后双乙酰含量差异不显著。由于双乙酰的这种变化趋势,大部分的经典动力学模型都不适合描述双乙酰的含量变化,故将每日所测得的双乙酰含量数据采用CurveExpert 1.4数学软件进行分析,得出一条符合双乙酰含量变化的非线性函数并进行了绘图,双乙酰含量变化的动力学模型为:
式中:H表示双乙酰的含量,mg/L;t表示发酵时间,d。
非线性函数模拟双乙酰含量实测值与拟合值的相关系数R2=0.997 04,可见此模型能够很好地描述啤酒在发酵过程中双乙酰含量的变化情况。双乙酰含量实测值和拟合曲线见图5。由图5可知,发酵时间为0~2 d时,酵母菌快速繁殖,双乙酰前体物质快速生成,双乙酰生成速率加快,当发酵时间>3 d时,酵母菌数量达到顶点,双乙酰被还原,逐渐趋于稳定。拟合曲线与实测值几乎重合,说明该非线性函数可较好的反映出双乙酰含量的变化。
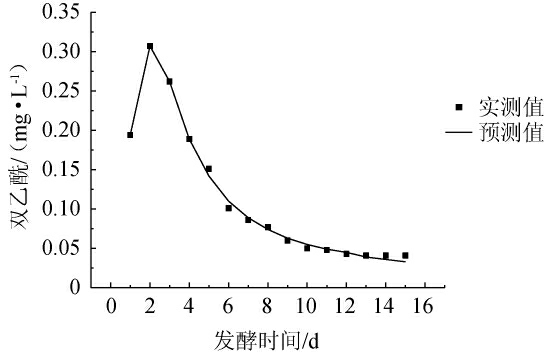
图5 双乙酰含量模型拟合曲线
Fig.5 Fitting curve of diacetyl content model
2.2.5 发酵度动力学模型构建
啤酒发酵度是指麦汁中浸出物被酵母消耗掉部分与麦汁中浸出物总量之比。啤酒发酵过程中必须要把发酵度控制在一个合适的范围之内,若发酵度过高,则酵母发酵生成的酒精和二氧化碳浓度高,对啤酒质量产生不利影响,而发酵度过低,则残糖量高,这时发酵液较容易滋生杂菌。由于Farazdaghi-Harris模型下,发酵度变化拟合曲线相关系数不足0.9,且拟合没有收敛,故将Farazdaghi-Harris模型排除。发酵度变化拟合曲线及拟合系数见表5。
表5 发酵度变化拟合曲线及拟合系数
Table 5 Fitting curves and fitting coefficients for changes in fermentation degree

注:x代表发酵时间,d;y代表发酵度,%。
模型 拟合曲线 相关系数R2 Boltzman y=67.200 9- 60.668 8 1+ex-2.6755 0.999 04 0.6847 Logistic y=67.553 4- 56.257 2 1+ x 2.7405( )4.569 60.668 8 0.996 53 DoseResp y=6.532 1+1+100.634(2.675-x)0.999 25
由表5可知,DoseResp模型拟合相关系数(R2)较高(0.999 25),可以较好地描述啤酒发酵过程中发酵度变化过程。DoseResp模型下酒精生成拟合曲线见图6。由图6可知,发酵时间为0~4 d时,发酵度逐渐增加;发酵时间>4 d时,发酵度变化趋于稳定;发酵时间为6 d时,发酵度达到最高值,为67.6%。啤酒发酵过程中发酵度变化动力学模型的预测值和实测值的相对误差较小,表明该模型能够较好地反映发酵度随发酵时间的变化。
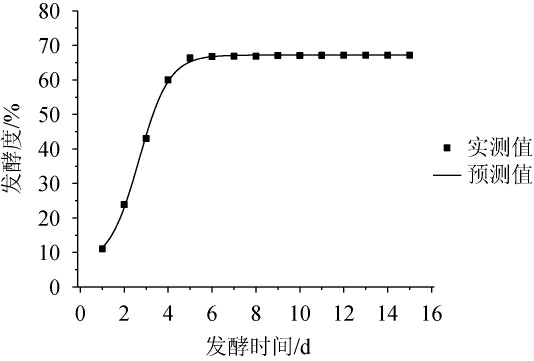
图6 发酵度变化的DoseResp模型拟合曲线
Fig.6 DoseResp model fitting curve for changes in fermentation degree
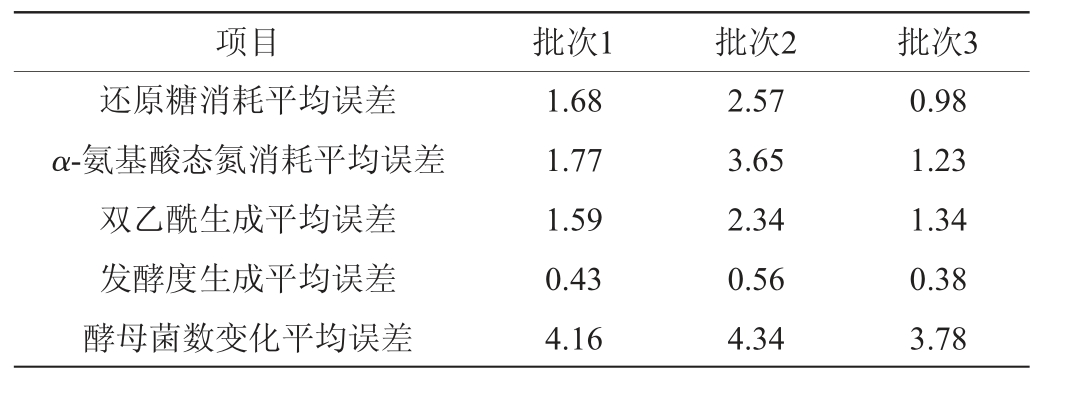
为了验证模型的普遍适用性,选取3个不同批次同类型的啤酒进行测定,绘制发酵曲线,将实测值与模型预测值进行误差分析,结果见表6。
表6 同类型不同批次啤酒对模型适用性
Table 6 Applicability of different batches of the same type of beer to model%
?
由表6可知,批次3啤酒各方面指标实测值与模型预测值误差均最小,批次2啤酒误差实测值与模型预测值比其余两种要大;其中三个批次的啤酒测得发酵度生成的平均误差最小,说明发酵度模型构建最优。总体来看,这三个批次啤酒实测值与预测值误差均小于5%,说明此模型的普适性较好,可以用此模型基本描述多种类型啤酒的底物消耗、双乙酰生成及发酵度变化的情况。
从啤酒发酵的15 d期间还原糖消耗,α-氨基酸态氮含量,双乙酰含量和发酵度的变化趋势来看,四者相互关联,在发酵初期,酵母菌数量急剧增加,还原糖和α-氨基酸态氮含量快速下降,在发酵第1~6 d发酵度随着还原糖和α-氨基酸态氮含量的急剧减少而增加,双乙酰含量随酵母菌数量先增加,后由于酵母菌使用代谢产物来还原双乙酰,将其转化为2,3-丁二醇,因此双乙酰含量会开始减少。
对啤酒发酵过程中的基质(还原糖、α-氨基酸态氮)消耗,产物(双乙酰、酵母菌)和发酵度变化的动力学曲线进行拟合得到了动力学模型曲线,其中符合还原糖消耗的经典模型是Logistic模型;符合α-氨基酸态氮消耗的经典模型是Boltzmann和DoseResp,二者相关系数均一致;符合酵母菌数变化的模型是DoseResp;双乙酰变化并无经典模型适合,采用CurveExpert 1.4数学软件进行模拟分析得到相关非线性函数;发酵度动力模型采用DoseResp经典模型。经分析相关系数均大于0.99,说明拟合效果较好,可以用该模型描述啤酒发酵过程中还原糖、α-氨基酸态氮的消耗,双乙酰、酵母的生成,发酵度的变化情况。
[1]Statisa.2022年全球各国啤酒产量[R/OL].(2023-07)[2023-11-26].https://www.statista.com/statistics/270269/leading-10-countries-in-worldwidebeer-production/.
[2]ARCHANA G, GAURAV S, SHRUTI M, et al.Beer production by fermentation process:A review[J].J Microbiol Biotechn Food Sci,2024,13(4):1-6.
[3]张增浩.中式桂花小麦啤酒酿造工艺及其特色风味成分[D].济南:齐鲁工业大学,2024.
[4]GARGALO C L,SALVADÓ A M,KRÜHNE U,et al.Modelling and dynamic optimization of beer fermentation towards optimal flavor and operation[J].Comput Aid Chem Eng,2021,50:599-604.
[5]赵庭,姜琳,贾晶,等.小麦啤酒上面啤酒酵母生成4-乙烯基愈创木酚的条件优化及其发酵动力学模型构建[J].轻工学报,2022,37(2):15-22.
[6]张阳阳,靳羽慧,王荣荣,等.蓝莓猕猴桃酒发酵动力学模型的研究[J].食品科技,2023,48(7):79-84.
[7]李敏杰,熊亚.嘉宝果果酒发酵动力学模型的建立[J].食品科技,2022,47(9):83-87.
[8]李静雯,张东亚,陆洋,等.低度米酒发酵工艺优化及发酵动力学模型建立[J].酿酒科技,2021(8):58-64.
[9]毛亚玲,李俊娥,于静,等.酒酒球菌和酿酒酵母共接种发酵动力学模型建立[J].食品科学,2023,44(2):156-164.
[10]MILLER K V, BLOCK D E.A review of wine fermentation process modeling[J].J Food Eng,2020,273:109783.
[11]CHIOLERIO A, ADAMATZKY A.Acetobacter biofilm: Electronic characterization and reactive transduction of pressure[J].ACS Biomater Sci Eng,2021,7(4):1651-1662.
[12]张海鹏,于佳俊,侍亚敏,等.不同种类麦芽对拉格啤酒挥发性硫化物形成的影响[J].中国酿造,2023,42(10):52-58.
[13]MARTINEZ-GOMEZ A,CABALLERO I,BLANCO C A.Phenols and melanoidins as natural antioxidants in beer.Structure,reactivity and antioxidant activity[J].Biomolecules,2020,10(3):400.
[14]张鸿宇,冯涛,崔云前.优化拉格啤酒中乙酸乙酯和乙酸异戊酯含量的研究[J].食品科技,2023,48(9):82-90.
[15]FECHIR M, REGLITZ K, MALL V, et al.Molecular insights into the contribution of specialty barley malts to the aroma of bottom-fermented lager beers[J].J Agr Food Chem,2021,69(29):8190-8199.
[16]ZAMUDIO LARA J M,DEWASME L,HERNÁNDEZ ESCOTO H,et al.Parameter estimation of dynamic beer fermentation models[J].Foods,2022,11(22):3602.
[17]VAN RIJSWIJCK I M H,VAN MASTRIGT O,PIJFFERS G,et al.Dynamic modelling of brewers'yeast and Cyberlindnera fabianii co-culture behaviour for steering fermentation performance[J].Food Microbiol,2019,83:113-121.
[18]任璐,王莹钰,杨沫,等.啤酒高浓酿造中氨基酸对酵母发酵性能和啤酒色值的影响[J].食品科学,2018,39(14):119-124.
[19]盛政,杜文凯,王崇崇,等.茶多酚对茶食品中还原糖检测方法的影响[J].茶叶科学,2023,43(4):567-575.
[20]高洋.小米精酿啤酒工艺研制及品质分析[D].沈阳:沈阳农业大学,2023.
[21]孙尧.不同酶制剂的应用对麦芽糖化工艺及啤酒发酵过程影响的研究[D].哈尔滨:东北农业大学,2023.
[22]杨梦霞,严晶晶,杨东升.特色大米啤酒糖化工艺优化及其理化指标分析[J].食品科技,2022,47(8):47-53.
[23]刘丽艳,赵金安,王大忠.啤酒主发酵过程控制参数变化趋势分析[J].食品研究与开发,2015,36(20):85-87.
[24]崔云前,袭祥雨,吉春晖,等.啤酒酵母絮凝影响因素及改善途径的研究概况[J].食品工业,2020,41(3):246-250.
[25]郭胜,闫俊锋,杨莹,等.基于测量不确定度评定啤酒中双乙酰合格率的研究[J].酿酒科技,2022(11):115-118.