Effect of non-Saccharomyces cerevisiae on the quality of navel orange fruit wine
我国脐橙种植范围广泛、产量丰富,以其为原料酿造的脐橙果酒口感香甜、余味悠长,富含多种营养物质(如类黄酮、胡萝卜素、维生素等),具有抗氧化、抗炎、降低胆固醇等功能[1],深受消费者的喜爱。果酒发酵过程是复杂且多层次的生化反应过程,涉及到多种微生物特别是酿酒酵母与非酿酒酵母的代谢活动,酿酒酵母在果酒发酵过程中能够将糖转化为二氧化碳和酒精,大大提升了发酵速率;非酿酒酵母通常在发酵初期发挥主要作用,其生产的次生代谢产物(如酯类、萜烯类、醇类物质)能够丰富果酒香气的复杂性,对果酒品质有着积极贡献[2]。已有研究表明,在果酒发酵过程中使用非酿酒酵母与酿酒酵母共同发酵能够丰富葡萄酒中的香气组成,使葡萄酒的香气更加富有层次[3]。
在果酒发酵过程中,由于不同酵母菌株的环境耐受性、酒精产生能力、抗氧化活性等方面存在较大差异,在发酵过程中香气物质的产量也相差较大,因此,筛选抗逆性优良、抗氧化能力较强、香气化合物较高的酵母菌种越来越重要[4]。毕静莹等[5]从脐橙土壤、枝叶、果皮中分离出90株野生酵母菌,通过菌株发酵力、耐受性、酿酒性能等分析,筛选出的本土酿酒酵母F25、T11具有较好的应用前景;贾瑞楠等[6]从橙汁发酵液中筛选出了1株发酵能力旺盛、香气浓郁的橙酒专用酵母,为果酒的研究生产奠定基础;朱娟娟等[7]探讨了3株商业酵母对脐橙果酒品质的影响,筛选出菌株FC9更适宜酿造脐橙果酒,为提升脐橙果酒口感及品质提供参考依据;胡小琴等[4]通过分析果酒基本理化指标和挥发性香气物质,从6种商品酵母中筛选出菌株DV10最适合脐橙果酒的酿造。以上酵母筛选多从发酵性能及耐受性方面进行评价研究,然而对于抗氧化活性、香气化合物及感官分析评价脐橙果酒品质的研究较少。
本研究以奉节脐橙自然发酵液为分离源,通过耐受性评价、脐橙果酒基本理化指标、抗氧化活性、香气化合物分析及感官综合评价等实验筛选出更适宜酿造脐橙果酒的菌株,以期为利用发酵微生物菌株改善脐橙果酒口感及品质提供参考依据。
1.1.1 原料与菌种
商业酿酒酵母(Saccharomyces cerevisiae)BV818:安琪酵母股份有限公司;脐橙(纽荷尔脐橙):重庆。
1.1.2 试剂
偏重亚硫酸钾(分析纯):上海麦克林生化科技有限公司;果胶酶(酶活100 U/mg):法国Laffort公司;4-甲基-2-戊醇(色谱纯):美国Sigma Aldrich公司。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)琼脂培养基、WL营养琼脂(wallerstein laboratory nutrient agar,WL)固体基础培养基:青岛海博生物科技有限公司。
L12-Energr61破碎机:山东九阳股份有限公司;BX-1手持折光计:德国SCHMIDT+HAENSCH公司;TU5200酒精计:江苏金怡仪器科技有限公司;SpectraMax Mini多功能酶标仪:美谷分子仪器(上海)有限公司;57329-U萃取头:美国Supelco公司;PALRSI85自动进样器:瑞士CTC公司;Aglient GC 7890B/MS 5977A气相色谱-质谱联用仪(gas chromatography mass spectrometry,GC-MS)、DB-WAX色谱柱(60 m×2.5 mm,0.25 μm):美国Agilent公司。
1.3.1 酵母菌株的分离纯化与鉴定
将新鲜脐橙进行带皮破碎处理,称取200 g于500 mL三角瓶中,透气封口膜封住瓶口,置于28 ℃生化培养箱中富集3 d,待有气泡产生后,取出发酵液,用无菌水稀释至10-4,吸取100 μL稀释液均匀涂布于WL固体培养基,28 ℃恒温培养48 h后,观察菌落特征,挑选不同表现特征的单菌落进行2~3次平板划线纯化,得到单菌落,接种到YEPD培养基培养,菌株保藏于-80 ℃,备用。
采用试剂盒提取法提取纯菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以引物NL1(5'-GCATAT CAATAAGCGGAGGAAAAG-3')、NL4(5'GGTCCGTGTTTCAAGACGG-3')扩增26S核糖体核糖核酸(ribosomal ribonucleic acid,rRNA)基因的D1/D2区域,采用50 μL反应体系进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,将含有目标片段的PCR产物送至华大基因检测公司测序,测序结果在美国国立生物技术信息中心(national center for biotechnology information,NCBI)进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,选取同源性较高的模式菌株26S rDNA序列,采用MEGA10.0软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
将鉴定为非酿酒酵母的菌株分别接入1 μL(接种环刮取1环)于放有倒置杜氏管的YEPD液体培养基中,20 ℃恒温发酵3 d,每隔24 h观察其产气情况,记录杜氏管内气体体积。随后继续恒温培养至7 d,进行感官评价,记录香气情况。
1.3.2 酵母菌株的耐受性
参考胡江南等[8]的方法,以带有杜氏小管的YEPD液体培养基为基础,分别将葡萄糖质量浓度梯度设为400 g/L、500 g/L、600 g/L;果糖质量浓度梯度设为400 g/L、500 g/L、600g/L;KCl质量浓度梯度设为1.0mol/L、1.2mol/L、1.4mol/L;乙醇体积分数梯度设为12%、14%、16%;SO2质量浓度为400 mg/L、500 mg/L、600 mg/L;低温耐受性梯度设为10 ℃、12 ℃、14 ℃,高温耐受性梯度设为36 ℃、38 ℃、40 ℃;pH值梯度设为2、3;均以接种量为1 μL(接种环刮取1环)接种于YEPD液体培养基中,28 ℃恒温培养7 d,观察其生长状况。
1.3.3 脐橙果酒发酵工艺流程
参考钟轲等[9]的方法,进行脐橙果酒发酵,每组样品做3个重复。
1.3.4 测定方法
①基本理化指标的测定
可溶性固形物:采用BX-1手持糖度计测定;乙醇、总酸、还原糖等指标测定:参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》。
②活性成分及抗氧化活性的测定
总酚含量:按照福林-消卡法测定[10];总黄酮含量:采用亚硝酸钠氯化铝法测定[11];抗坏血酸、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):参照试剂盒法测定。
③香气化合物分析
香气化合物的检测采用气相色谱-质谱(gas chromatography mass spectrometry,GC-MS)联用技术,具体操作条件参照原苗苗等[12]的方法。
定性分析:将质谱检测图运用计算机谱库美国国家标准与技术研究院(nationalinstitute ofstandards and technology,NIST)14进行初步检索和分析,再结合相关文献资料对人工谱图进行解析,确定每种香气化合物。
定量分析:采用内标法半定量分析,计算样品中各香气组分的含量。内标为4-甲基-2-戊醇(2 g/L)。
香气活度值(odor activity value,OAV)为待测化合物的质量浓度与该物质嗅觉阈值的比值,一般认为OAV>1是关键香气化合物。OAV计算公式如下:
1.3.5 感官评定
花香、果香、橙香、酒香、香气纯净度、香气浓郁度、香气协调性、口感共八种感官属性评定特征对脐橙果酒感官评价中,具有一定代表性[13-14]。由10位受专业培训的人员组成感官评定小组,各香气特征强度采用1~10分制,对脐橙果酒进行测评,取平均值作为评分结果。
1.3.6 数据处理与统计分析
采用SPSS 27.0软件进行数据统计分析,并采用Origin 2018、MEGA5.1进行数据作图和分析。
通过稀释平板分离法挑选不同菌落特征的单菌落进行平板划线纯化,从奉节脐橙中分离出28株菌株,通过26S rDNA基因序列比对共检测出15株非酿酒酵母菌株,将其编号为A1~A15,进行杜氏小管发酵初筛及感官评价分析。观察杜氏小管产气情况,结果显示气体全部充满杜氏小管的有8株(A1、A2、A7、A8、A9、A10、A11、A12);继续恒温培养7 d后进行感官品评,香气良好的菌株有4株(A1、A2、A3、A4),其中菌株A1具有浅浅的绿茶香气,菌株A2具有哈密瓜、香蕉等热带水果香气。因此,发酵能力且香气良好的菌株2株(A1、A2),采用MEGA5.1软件构建系统发育树,结果见图1。
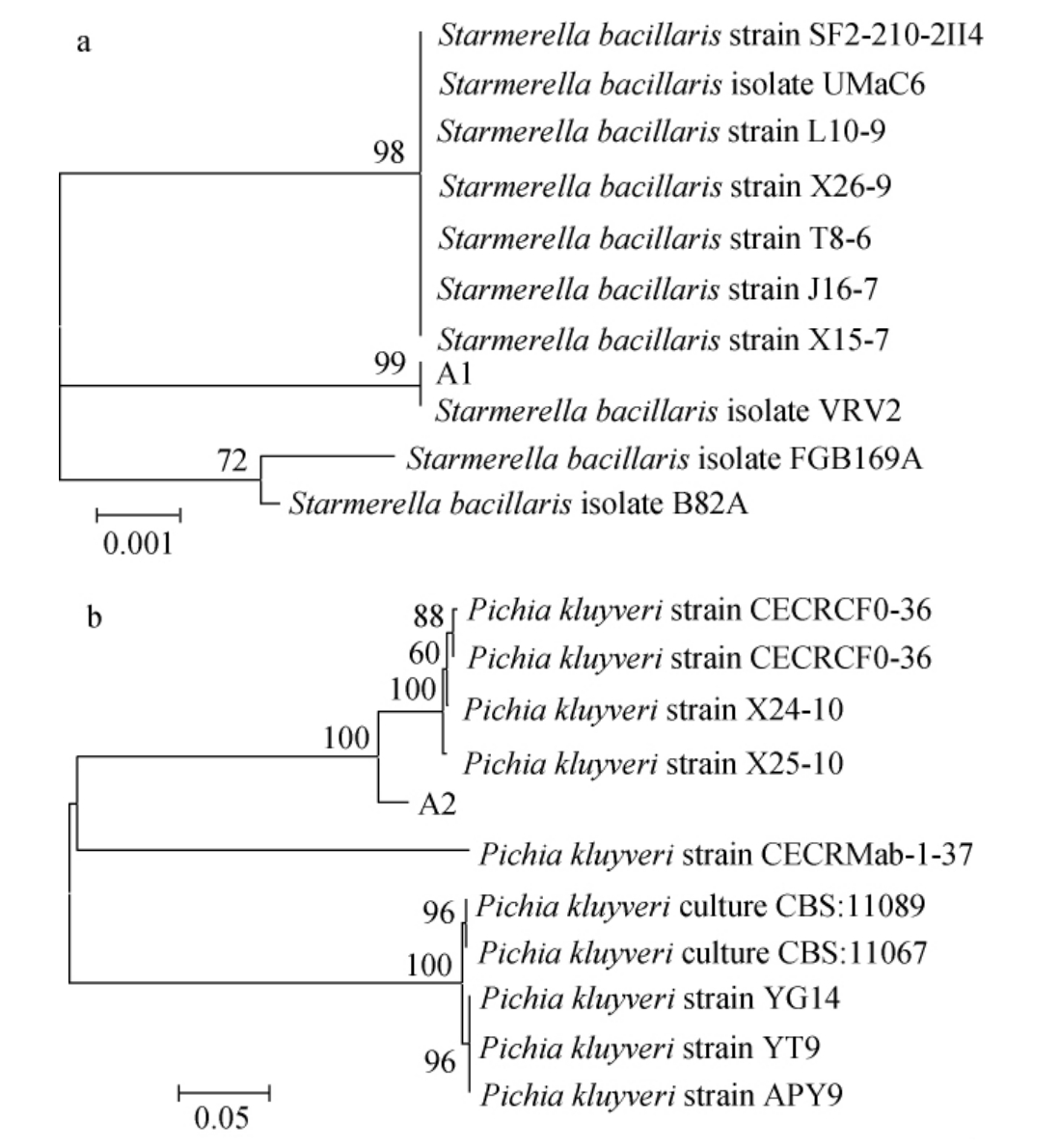
图1 基于26S rDNA基因序列的非酿酒酵母A1(a)和A2(b)系统发育树
Fig.1 Phylogenetic tree of non-Saccharomyces cerevisiae A1(a)and A2(b) based on 26S rDNA gene sequence
由图1可知,菌株A1与Starmerella bacillaris isolate VRV2具有较高的同源性,相似度为99%;菌株A2与Pichia kluyveri strain X25-10具有较高的同源性,相似度为100%。通过以上比对结果,鉴定菌株A1为泽普林假丝酵母(Starmerella bacillaris),鉴定菌株A2为克鲁维毕赤酵母(Pichiakluyveri)。
菌株A1、A2的耐受性见表1。由表1可知,菌株A1对葡萄糖和果糖的耐受性均为100~500 g/L,菌株A2对葡萄糖和果糖的耐受性均为100~400 g/L,A1对葡萄糖和果糖的耐受性比A2要高;较高的渗透压会影响酵母的代谢,A1、A2对渗透压耐受性均为0.8~1.2 mol/L,但是A2对渗透压的耐受性在1.2 mol/L更强;A1对乙醇的耐受性为6%~14%(V/V),A2对乙醇耐受性为6%~12%(V/V),A1对乙醇的耐受性比A2更强;在果酒中添加SO2能起到杀菌作用,但过量的SO2会抑制酵母生长,A1、A2对SO2耐受性均为100~500 mg/L,对SO2耐受性较强;A1、A2对温度耐受性均为12~38 ℃;对pH耐受性均为3~5,两株酵母对酸的耐受性较好,能有效适应果酒发酵的环境。
表1 非酿酒酵母A1和A2耐受性实验结果
Table 1 Tolerance experiments results of non-Saccharomyces cerevisiae A1 and A2
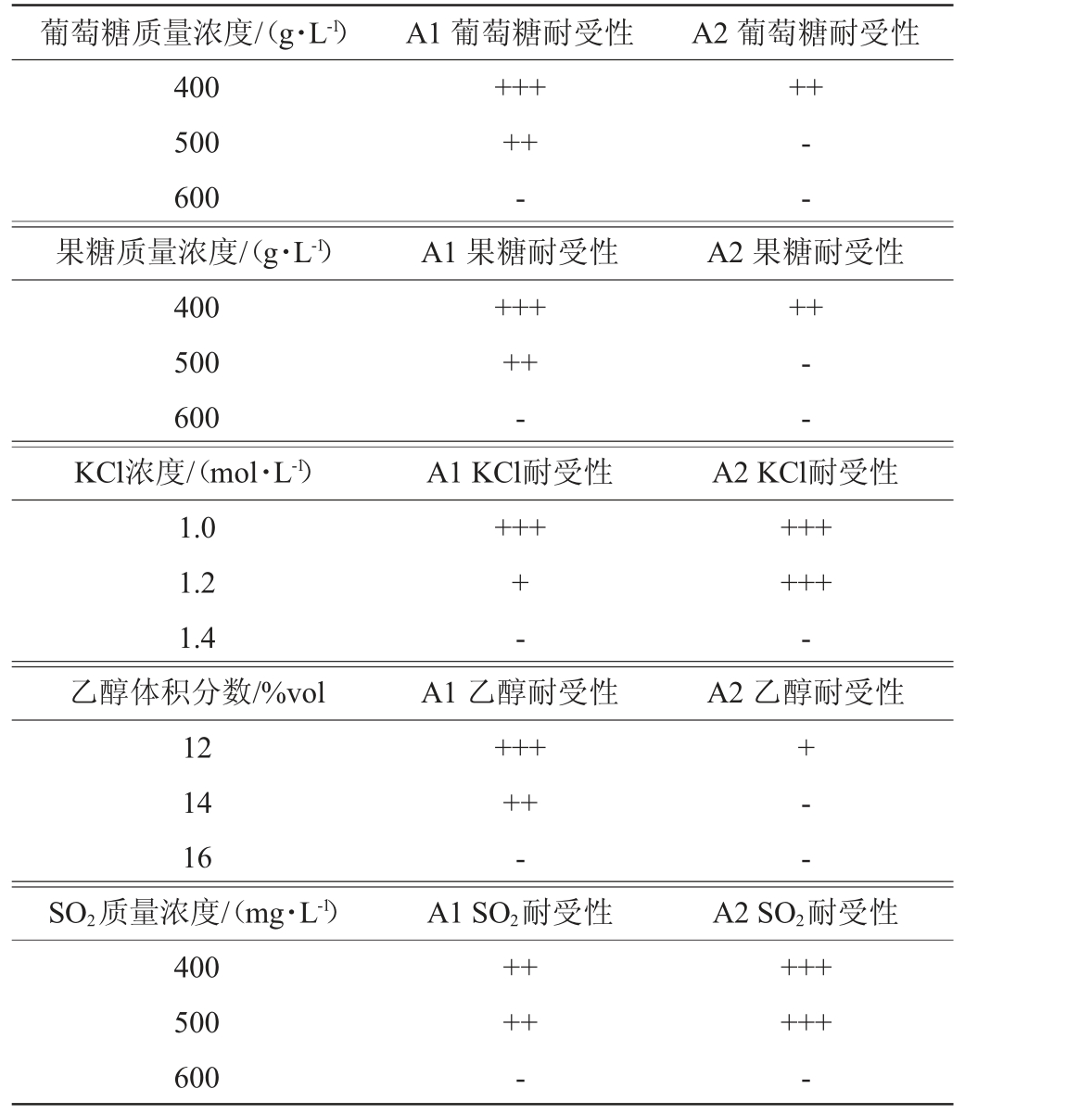
葡萄糖质量浓度/(g·L-1) A1 葡萄糖耐受性 A2 葡萄糖耐受性400 500 600果糖质量浓度/(g·L-1)400 500 600 KCl浓度/(mol·L-1)1.0 1.2 1.4乙醇体积分数/%vol 12 14 16 SO2质量浓度/(mg·L-1)400 500 600+++++-A1 果糖耐受性+++++-A1 KCl耐受性+++++--A2 果糖耐受性++--+-A1 乙醇耐受性+++++-A1 SO2耐受性++++-A2 KCl耐受性++++++-A2 乙醇耐受性+- -A2 SO2耐受性++++++-
续表
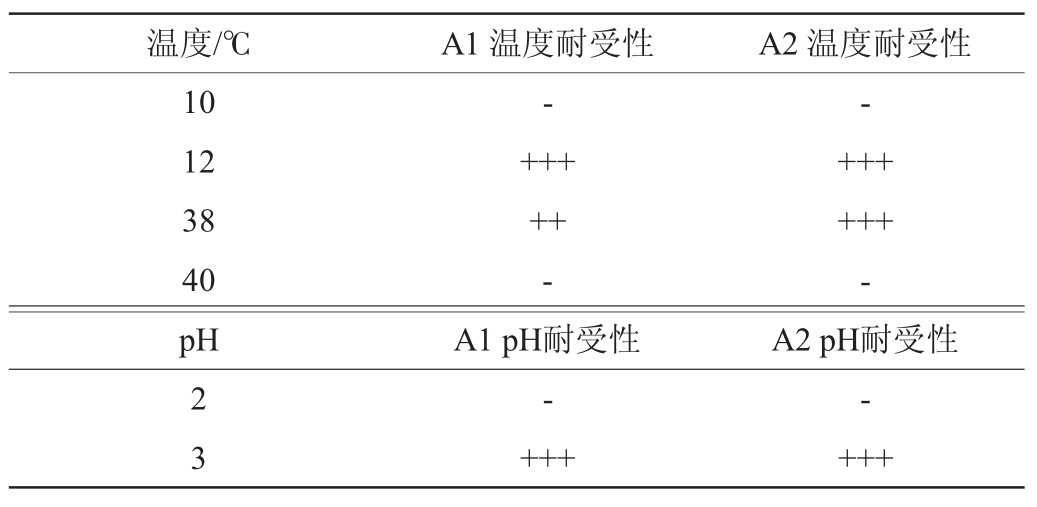
注:“+++”表示气体充满杜氏小管;“++”表示气体充满杜氏小管的2/3;
“+”表示气体充满杜氏小管的1/3;“-”表示气体不足杜氏小管1/3。
温度/℃10 12 38 40 pH A1 温度耐受性-+++++-A1 pH耐受性A2 温度耐受性-++++++-A2 pH耐受性2 3--++++++
综上,菌株A1对葡萄糖、果糖和乙醇的耐受性强于菌株A2,两者对温度SO2、KCl和pH耐受性相同,菌株A1耐受性整体比A2强。
由表2可知,发酵后的脐橙果酒总酸均降低,为4.95~7.33 g/L。相比对照组BV818,菌株A1与BV818混菌发酵、A2与BV818混菌发酵总酸含量分别提升了48.08%和27.27%,具有显著性差异(P<0.05),可能是因为在非酿酒酵母在酒精发酵过程中产生了有机酸。发酵后脐橙果酒pH值均升高,为4.02~4.10,差异不显著(P>0.05)。发酵结束时,酒精度为10.18~11.37%vol,符合GB/T 15038—2006《葡萄酒、果酒通用分析方法》的标准。对照组BV818总糖含量最低仅为4.39 g/L,菌株A1与BV818混菌发酵、菌株A2与BV818混菌发酵总糖分别为8.82 g/L和6.65 g/L,具有显著性差异(P<0.05)。甘油含量与果酒的感官品质相关,高水平的甘油通常为果酒增加更饱满的酒体和更柔和的口感,其中,菌株A1与BV818混菌发酵制备果酒中甘油含量最高,达到7.39 g/L,较对照组BV818提升了138.39%,具有显著性差异(P<0.05)。
表2 脐橙汁和脐橙果酒基本理化指标
Table 2 Basic physicochemical indicators of navel orange juice and navel orange wine
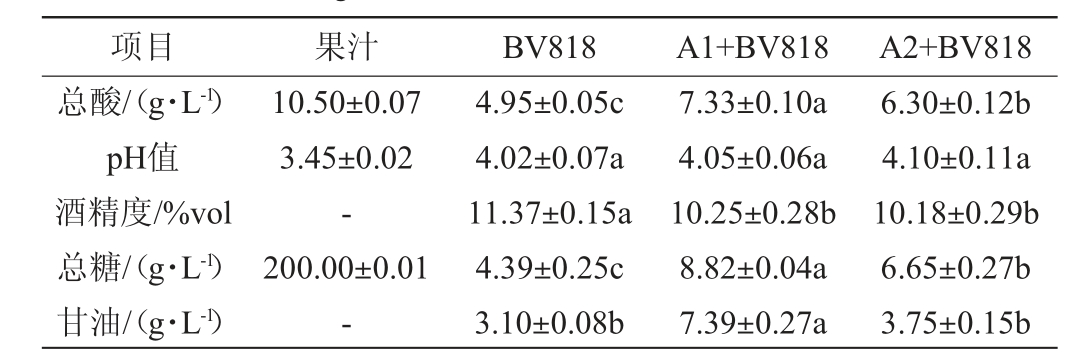
注:不同字母代表差异显著(P<0.05);“-”表示未检出,下同。
项目 果汁 BV818 A1+BV818 A2+BV818总酸/(g·L-1)pH值酒精度/%vol总糖/(g·L-1)甘油/(g·L-1)10.50±0.07 3.45±0.02-200.00±0.01-4.95±0.05c 4.02±0.07a 11.37±0.15a 4.39±0.25c 3.10±0.08b 7.33±0.10a 4.05±0.06a 10.25±0.28b 8.82±0.04a 7.39±0.27a 6.30±0.12b 4.10±0.11a 10.18±0.29b 6.65±0.27b 3.75±0.15b
综上所述,这些基本理化指标均符合GB/T15038—2006《葡萄酒、果酒通用分析方法》的标准,菌株A1与BV818混菌发酵能够高产甘油,使果酒口感更加圆润柔顺,提升果酒品质。
总酚、总黄酮和抗坏血酸是脐橙果酒中的主要抗氧化成分,可以反映果酒的抗氧化能力[15],抗氧化物质具有抗动脉粥样硬化[16]、抗炎和抗肿瘤活性[17]、抑制血液凝块等功效[18]。
脐橙果酒活性成分及抗氧化活性分析见表3。由表3可知,发酵结束后脐橙果酒总酚含量为304.03~487.92 mg/L,与对照组BV818相比,其余2组脐橙果酒均有显著性差异(P<0.05)。其中,菌株A1与BV818混菌发酵总酚含量显著提升了60.48%,菌株A2与BV818混菌发酵也显著提升了13.81%。一方面,总酚含量的差异与不同菌种间的发酵速率有关[19],另一方面,可能是不同菌株产生的次级代谢产物含量有所差异,与酚类物质发生氧化、聚合等反应程度不同[20]。郭晨晨等[20]研究发现,不同酵母在发酵槜李果酒前期,总酚含量呈现下降趋势,而钟平娟等[21]研究发现,山楂果酒发酵过程中总酚含量相对平稳;胡冀太[22]研究发现,不同酵母发酵山楂果酒过程中,总酚含量的上升速率有所差异。因此,果酒发酵中对总酚含量变化的研究结果并不一致,这可能与水果自身特性、菌种代谢速率、发酵工艺条件等因素有关[22]。
表3 不同脐橙果酒活性成分及抗氧化活性分析
Table 3 Analysis of active components and antioxidant activities of different navel orange wines
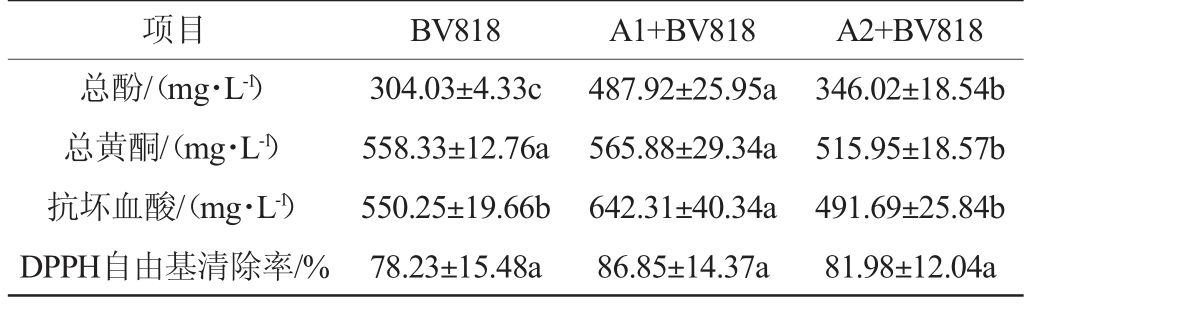
项目 BV818 A1+BV818 A2+BV818总酚/(mg·L-1)总黄酮/(mg·L-1)抗坏血酸/(mg·L-1)DPPH自由基清除率/%304.03±4.33c 558.33±12.76a 550.25±19.66b 78.23±15.48a 487.92±25.95a 565.88±29.34a 642.31±40.34a 86.85±14.37a 346.02±18.54b 515.95±18.57b 491.69±25.84b 81.98±12.04a
黄酮是一类不稳定的化合物,受多种因素影响,由表3可知,发酵结束后脐橙果酒总黄酮含量为515.95~565.88 mg/L。对照组BV818总黄酮含量最高,达到558.33 mg/L。这主要是因为黄酮不溶于水,易溶于酒精,酒精度较高的脐橙果酒能够析出更多含量的黄酮[22]。脐橙果酒样品中的抗坏血酸含量为491.69~642.31 mg/L,相比于对照组BV818,菌株A1与BV818混菌发酵抗坏血酸显著提升了16.73%;脐橙果酒因其酵母的发酵特性不同导致清除DPPH自由基能力差异较大,其中,菌株A1与BV818混菌发酵的DPPH自由基清除率最高为86.85%,3种脐橙果酒DPPH自由基清除率无显著差异(P>0.05)。
综上,菌株A1与BV818混菌发酵制备果酒具有较高的总黄酮、抗坏血酸、总酚含量和DPPH自由基清除能力,因此,菌株A1与BV818混菌发酵能产生更多的抗氧化物质,具有较高的营养价值,更适合酿造脐橙果酒。
果酒在经过发酵后,不仅能够保留新鲜水果中的微量元素和生物活性物质,而且能够产生丰富的香气化合物,如醇类、酯类、萜烯类等,达到提升口感、改善风味的目的[29-30]。由表4及图2可知,列出的5种脐橙果酒中共检测出35种主要挥发性香气化合物,包括9种醇类、14种酯类、7种萜烯类、4种酸类、1种醛类。3种脐橙果酒的香气化合物数量差异不大,其中,BV818香气化合物数量最少,仅为29种。
表4 不同脐橙果酒中香气化合物的含量
Table 4 Contents of aroma compounds in different navel orange wines
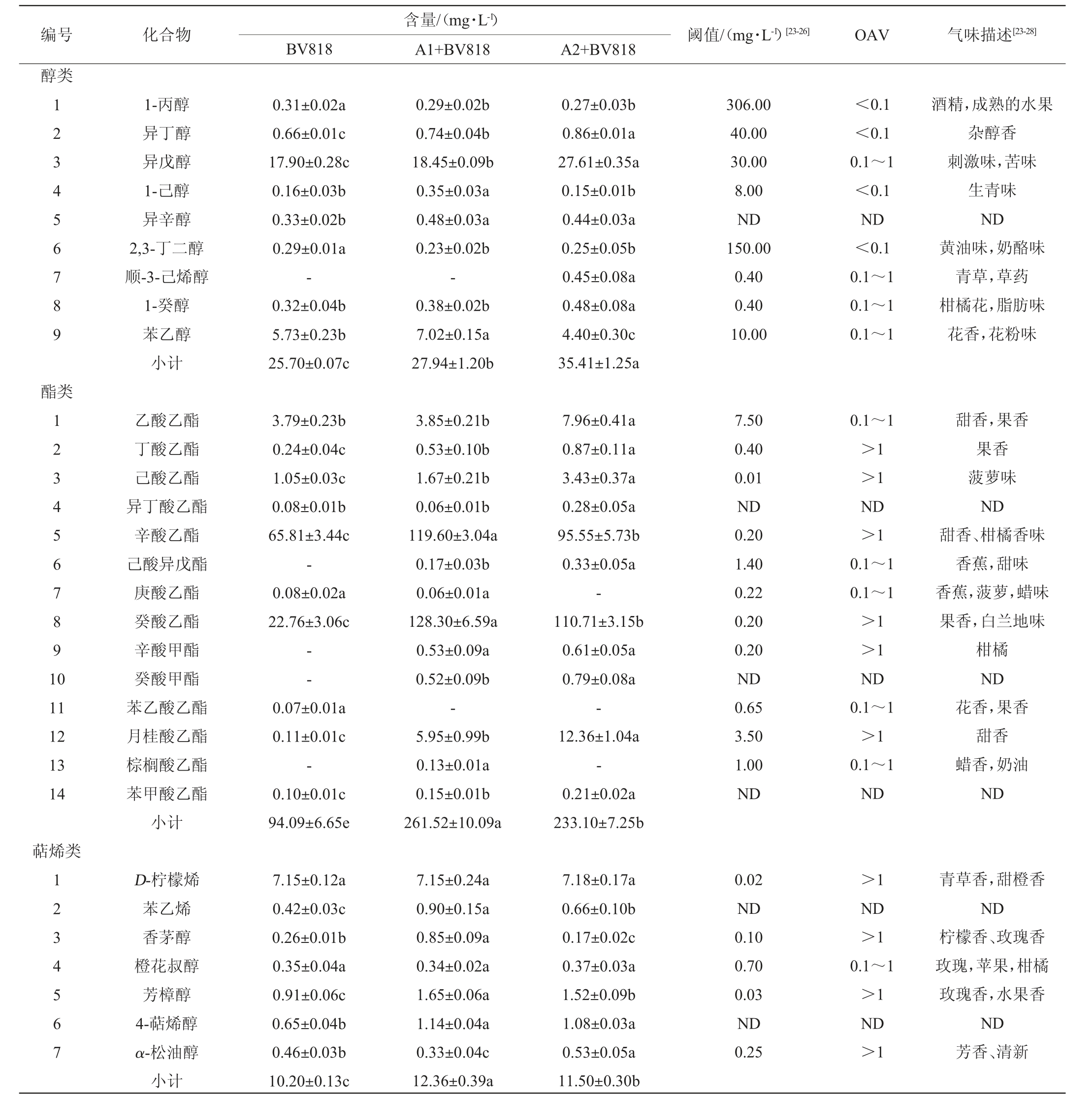
编号 化合物 阈值/(mg·L-1)[23-26] OAV 气味描述[23-28]BV818含量/(mg·L-1)A1+BV818 A2+BV818醇类123456789 酯类1 234567891 0 11 12 13 14萜烯类1 234567 1-丙醇异丁醇异戊醇1-己醇异辛醇2,3-丁二醇顺-3-己烯醇1-癸醇苯乙醇小计乙酸乙酯丁酸乙酯己酸乙酯异丁酸乙酯辛酸乙酯己酸异戊酯庚酸乙酯癸酸乙酯辛酸甲酯癸酸甲酯苯乙酸乙酯月桂酸乙酯棕榈酸乙酯苯甲酸乙酯小计D-柠檬烯苯乙烯香茅醇橙花叔醇芳樟醇4-萜烯醇α-松油醇小计0.31±0.02a 0.66±0.01c 17.90±0.28c 0.16±0.03b 0.33±0.02b 0.29±0.01a-0.32±0.04b 5.73±0.23b 25.70±0.07c 3.79±0.23b 0.24±0.04c 1.05±0.03c 0.08±0.01b 65.81±3.44c-0.08±0.02a 22.76±3.06c--0.07±0.01a 0.11±0.01c-0.10±0.01c 94.09±6.65e 7.15±0.12a 0.42±0.03c 0.26±0.01b 0.35±0.04a 0.91±0.06c 0.65±0.04b 0.46±0.03b 10.20±0.13c 0.29±0.02b 0.74±0.04b 18.45±0.09b 0.35±0.03a 0.48±0.03a 0.23±0.02b-0.38±0.02b 7.02±0.15a 27.94±1.20b 3.85±0.21b 0.53±0.10b 1.67±0.21b 0.06±0.01b 119.60±3.04a 0.17±0.03b 0.06±0.01a 128.30±6.59a 0.53±0.09a 0.52±0.09b-5.95±0.99b 0.13±0.01a 0.15±0.01b 261.52±10.09a 7.15±0.24a 0.90±0.15a 0.85±0.09a 0.34±0.02a 1.65±0.06a 1.14±0.04a 0.33±0.04c 12.36±0.39a 0.27±0.03b 0.86±0.01a 27.61±0.35a 0.15±0.01b 0.44±0.03a 0.25±0.05b 0.45±0.08a 0.48±0.08a 4.40±0.30c 35.41±1.25a 7.96±0.41a 0.87±0.11a 3.43±0.37a 0.28±0.05a 95.55±5.73b 0.33±0.05a-110.71±3.15b 0.61±0.05a 0.79±0.08a-12.36±1.04a-0.21±0.02a 233.10±7.25b 7.18±0.17a 0.66±0.10b 0.17±0.02c 0.37±0.03a 1.52±0.09b 1.08±0.03a 0.53±0.05a 11.50±0.30b 306.00 40.00 30.00 8.00 ND 150.00 0.40 0.40 10.00 7.50 0.40 0.01 ND 0.20 1.40 0.22 0.20 0.20 ND 0.65 3.50 1.00 ND 0.02 ND 0.10 0.70 0.03 ND 0.25<0.1<0.1 0.1~1<0.1 ND<0.1 0.1~1 0.1~1 0.1~1 0.1~1>1>1 ND>1 0.1~1 0.1~1>1>1 ND 0.1~1>1 0.1~1 ND>1 ND>1 0.1~1>1 ND>1酒精,成熟的水果杂醇香刺激味,苦味生青味ND黄油味,奶酪味青草,草药柑橘花,脂肪味花香,花粉味甜香,果香果香菠萝味ND甜香、柑橘香味香蕉,甜味香蕉,菠萝,蜡味果香,白兰地味柑橘ND花香,果香甜香蜡香,奶油ND青草香,甜橙香ND柠檬香、玫瑰香玫瑰,苹果,柑橘玫瑰香,水果香ND芳香、清新
续表
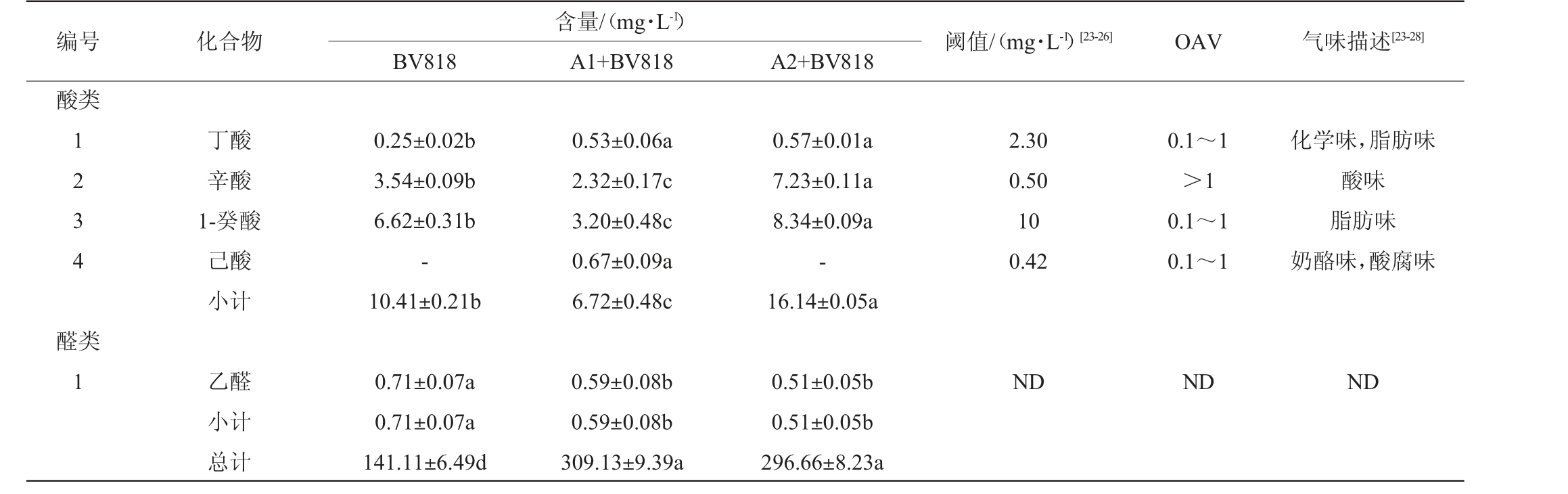
注:不同字母代表差异显著(P<0.05);“-”表示未检出;“ND”表示未确定。
BV818含量/(mg·L-1)A1+BV818 A2+BV818编号 化合物 阈值/(mg·L-1)[23-26] OAV 气味描述[23-28]酸类1 2 3 4 醛类1丁酸辛酸1-癸酸己酸小计乙醛小计总计0.25±0.02b 3.54±0.09b 6.62±0.31b-10.41±0.21b 0.71±0.07a 0.71±0.07a 141.11±6.49d 0.53±0.06a 2.32±0.17c 3.20±0.48c 0.67±0.09a 6.72±0.48c 0.59±0.08b 0.59±0.08b 309.13±9.39a 0.57±0.01a 7.23±0.11a 8.34±0.09a-16.14±0.05a 0.51±0.05b 0.51±0.05b 296.66±8.23a 2.30 0.50 10 0.42 ND 0.1~1>1 0.1~1 0.1~1 ND化学味,脂肪味酸味脂肪味奶酪味,酸腐味ND
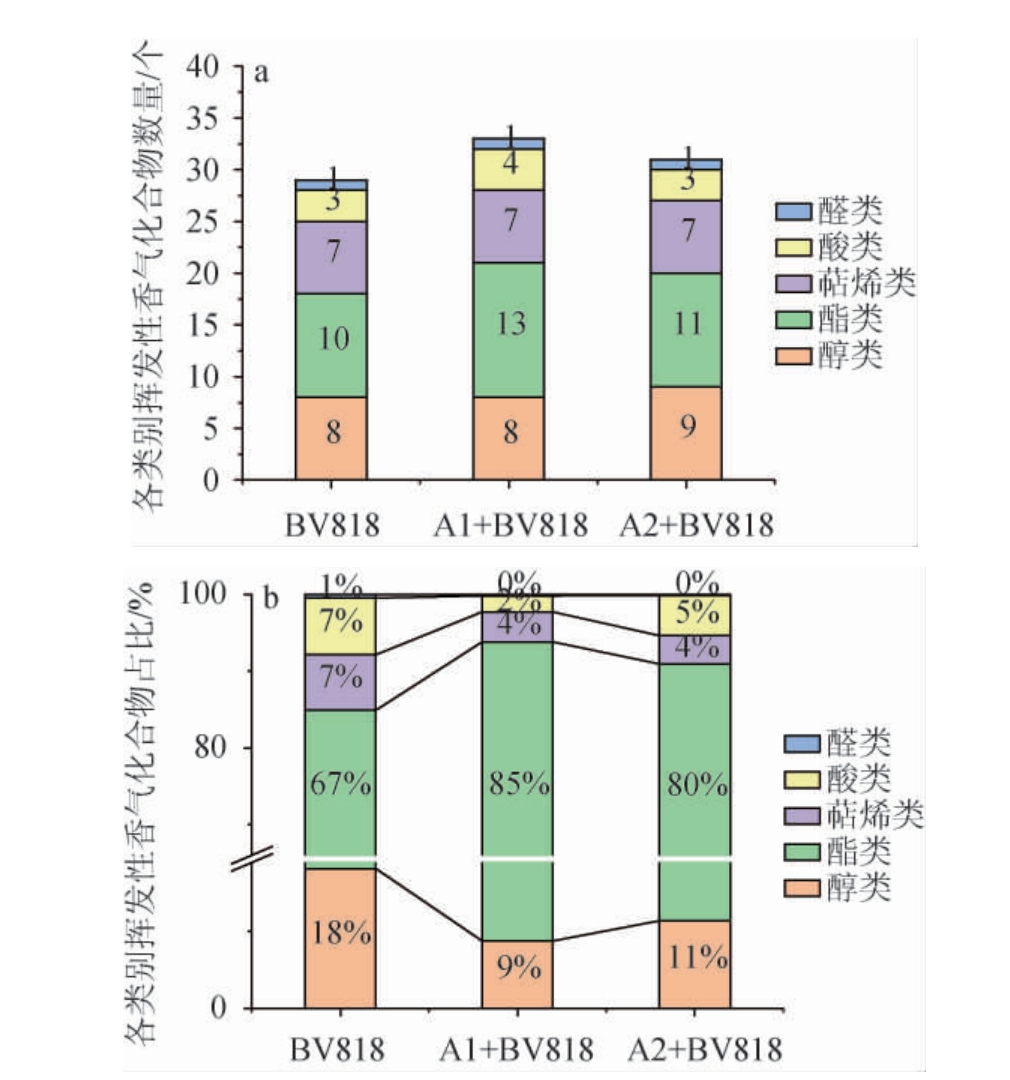
图2 不同脐橙果酒中各类别香气化合物的数量(a)和占比(b)
Fig.2 Quantity (a) and proportion (b) of various categories aroma compounds in different navel orange wines
酯类化合物是一种由酸水解和氧化产生的物质,是果酒产生甜香的主要挥发物,对于脐橙果酒的组成至关重要[31]。如表4及图2所示,在所有脐橙果酒中,酯类总量占总香气化合物比例最高,为67%~85%。菌株A1与BV818混菌发酵酯类总量占总香气化合物比例最高,达到85%,与对照组BV818相比,其余2组脐橙果酒均增加了总体酯类含量,其中,菌株A1与BV818混菌发酵最为显著,总体酯类化合物增加了177.95%,为脐橙果酒赋予了丰富的甜香。相比于对照组BV818,菌株A1与BV818混菌发酵的辛酸乙酯和癸酸乙酯含量提升显著,分别增加了81.74%和463.71%,此外,菌株A2与BV818混菌发酵中辛酸乙酯和癸酸乙酯含量也提升显著,分别增加了45.19%和386.42%。由此可见,菌株A1、A2分别与BV818混菌发酵可以一定程度增添脐橙果酒中的柑橘香和果香。菌株A2与BV818混菌发酵中,己酸乙酯、月桂酸乙酯含量显著提升,分别达到3.43 mg/L和12.36 mg/L,为脐橙果酒的风味带来菠萝香和甜香。相比于对照组BV818,另外2种脐橙果酒丁酸乙酯、辛酸甲酯的气味活性值均>1,可为脐橙果酒贡献一定的果香和柑橘香。
醇类化合物也是脐橙果酒中较为丰富的一类香气化合物,多来源于酵母代谢途径,为香气具有重要贡献的化合物主要包括丙醇、异丁醇、异戊醇、苯乙醇等醇类化合物[4,23]。如表4及图2所示,醇类总量占总香气化合物的9%~18%,相比对照组BV818,菌株A2与BV818混菌发酵显著增加了37.78%;在菌株A1与BV818混菌发酵中,苯乙醇含量占醇类总量最高,达到25.13%,而菌株A2与BV818混菌发酵中,异戊醇含量显著提升了54.25%,均与对照组存在显著性差异(P<0.05)。相比对照组BV818,2种脐橙果酒的1-丙醇、2,3-丁二醇含量有一定程度下降,但是其OAV较低,对果酒香气影响较少。
如表4及图2所示,萜烯类化合物作为脐橙果酒果香和花香的重要来源之一[32],本研究共检测出7种萜烯类化合物,占总香气化合物的4%~7%。相比对照组,其余2种脐橙果酒均增加了萜烯类化合物含量。D-柠檬烯作为脐橙果酒的特征性成分,在3种脐橙果酒中无显著性差异,均占萜烯类化合物总量的57.85%~70.10%,为脐橙果酒贡献了令人愉悦的甜橙香。除BV818外,2种脐橙果酒的芳樟醇含量为13.21%~13.35%,与对照组存在显著性差异(P<0.05),为脐橙果酒贡献了玫瑰香。除D-柠檬烯、芳樟醇外,3种脐橙果酒香茅醇、α-松油醇的OAV均>1,其中,菌株A1与BV818混菌发酵的香茅醇含量较高,可为脐橙果酒贡献一定的清新的柠檬香和玫瑰香。
酸类影响着脐橙果酒的口感和颜色,适量的酸能够为果酒带来积极影响,而酸度过量时,则会带来负面气味[14,33]。如表4及图2所示,酸类占香气化合物总量的2%~7%,3种脐橙果酒辛酸含量均高于阈值,但是菌株A1与BV818混菌发酵的辛酸含量显著低于对照组,在一定程度上改善了果酒的口感。
醛酮类化合物在果酒中常呈现植物性清香,虽然含量较少,对脐橙果酒的香气也起到了重要作用[34]。如表4及图2所示,本研究仅检测出了乙醛,含量为0.51~0.71 mg/L,相比BV818,其余2种脐橙果酒均降低了醛酮类含量。
综上所述,相比于对照组,2种脐橙果酒均能增加总酯、总萜烯类含量,降低总醛酮类含量。在3种脐橙果酒中,菌株A1与BV818混菌发酵酯类总量占总香气化合物比例最高,辛酸乙酯和癸酸乙酯含量相比对照组提升显著,一定程度上为脐橙果酒增添了柑橘香。菌株A2与BV818混菌发酵中,己酸乙酯、月桂酸乙酯含量显著提升,为脐橙果酒的风味带来菠萝香和甜香。醇类化合物中,菌株A1与BV818混菌发酵中苯乙醇含量较高,而菌株A2与BV818混菌发酵异戊醇含量提高。萜烯类化合物中,D-柠檬烯是脐橙果酒的特征性成分,为脐橙果酒贡献了令人愉悦的甜橙香;酸类化合物中,菌株A1与BV818混菌发酵辛酸含量显著低于照组,在一定程度上降低了负面影响;相比对照组,2种脐橙果酒均降低了醛酮类化合物含量,对脐橙果酒香气起到了积极作用。
香气化合物贡献率与其阈值有关,通常采用OAV来准确表征香气化合物对主体香气成分的贡献,OAV是由香气化合物含量除以其阈值得到,OAV>1的关键香气化合物对果酒香气具有突出贡献[35],将OAV>1的关键香气化合物进一步整理,使数值相似的化合物整理到雷达图上,结果见图3。

图3 不同脐橙果酒中关键香气化合物气味活度值雷达图
Fig.3 Radar chart of odor activity values of key aroma compounds in different navel orange wines
由图3(a)可知,辛酸乙酯、癸酸乙酯、D-柠檬烯、己酸乙酯的OAV分别为329.05~598.00、113.80~641.50、357.50~359.00、105.00~343.00,这几种物质构成了脐橙果酒的主体香气物质。与对照组BV818相比,其余2种脐橙果酒均提升了辛酸乙酯、癸酸乙酯、己酸乙酯的OAV,尤其是菌株A1与BV818混菌发酵显著提升。由图3(b)可知,与对照组BV818相比,其余2种脐橙果酒提高了丁酸乙酯、辛酸甲酯和月桂酸乙酯OAV,可增加果酒中的果香、柑橘香和甜香。由图3(c)可知,与对照组相比,菌株A1与BV818混菌发酵显著提升了香茅醇含量,可大幅提升果酒中柠檬香和玫瑰香。由图3(d)可知,与对照组相比,2种脐橙果酒均提升了芳樟醇的OAV。
综上,辛酸乙酯、癸酸乙酯、D-柠檬烯、己酸乙酯构成了脐橙果酒的主体香气物质,不同菌株发酵脐橙果酒香气成分略有差异,菌株A1、A2分别与BV818混菌发酵的OAV较高且香气更明显。其中,菌株A1与BV818混菌发酵中癸酸乙酯、辛酸乙酯和香茅醇较高,果酒中含有更多的白兰地香、柑橘香和柠檬香;菌株A2与BV818混菌发酵中月桂酸乙酯、己酸乙酯OAV较高,使果酒中富含更多的甜香和菠萝香。
由专业的10人感官评价小组品评,对不同酵母发酵的脐橙果酒进行了打分,并绘制雷达图,结果见图4。
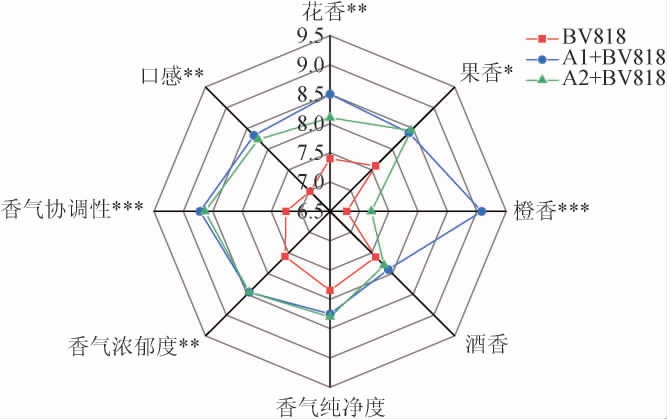
图4 不同脐橙果酒感官评分雷达图
Fig.4 Radar chart of sensory score of different navel orange wines
“***”表示差异高度显著(P<0.001),“**”表示差异极显著(P<0.01),
“*”表示差异显著(P<0.05)。
由图4可知,菌株A1与BV818混菌发酵的脐橙果酒总分最高,增强了脐橙果酒的橙香气味,同时提高了脐橙果酒的香气协调性,能显著突出脐橙果酒的风格。此外,菌株A1与BV818混菌发酵甘油含量较高,使口感更加细腻圆润;菌株A2与BV818混菌发酵的果香及香气浓郁度较高,可能与其较高的己酸乙酯含量有关,能更好的突出热带水果的香气。综上,菌株A1与BV818混菌发酵评分最高,能更好的突出橙香,具有良好的典型性风格,其酿造的脐橙果酒口感柔和,具有潜在的利用价值。
本研究从奉节脐橙自然发酵液中分离筛选出2株发酵能力、产香优良且耐受性较高的非酿酒酵母菌株A1和A2。菌株A1、A2分别鉴定为泽普林假丝酵母(Starmerella bacillaris)及克鲁维毕赤酵母(Pichia kluyveri)。菌株A1能耐受葡萄糖500 g/L、果糖500 g/L、乙醇体积分数14%;菌株A2能耐受葡萄糖400 g/L、果糖400 g/L、乙醇体积分数12%;菌株A1和A2均能耐受KCl 1.2 mol/L、SO2 500 mg/L、温度12~38 ℃、pH 3。菌株A1和A2分别与菌株BV818混菌(10∶1,V/V)发酵制备脐橙果酒中共检测出35种香气化合物,基于香气活度值(OAV)筛选出11种关键香气化合物(OAV>1)。菌株A1与菌株BV818混菌发酵制备的脐橙果酒总酯含量提高177.95%;总酚、总黄酮、甘油含量、感官评分、抗坏血酸、1,1-二苯基-2-三硝基苯肼(DPPH)自由基清除率最高,分别为487.92 mg/L、565.88 mg/L、7.39 g/L、84.54分、642.31 mg/L及86.85%。因此,菌株A1具有应用于脐橙果酒工业生产的潜力。本研究为脐橙果酒发酵菌株的筛选提供参考依据,为脐橙果酒品质提升及工业化生产奠定基础。
[1]陈瑶,赖崇德,刘玄,等.橙汁酿酒酵母菌株的分离筛选和发酵性能的测定[J].江西农业大学学报,2007(4):665-669.
[2]原苗苗,赵新节,孙玉霞.低温对葡萄酒香气成分和酵母代谢的影响[J].食品与发酵工业,2017,43(12):268-276.
[3]LIN M M H,BOSS P K,WALKER M E,et al.Evaluation of indigenous non-Saccharomyces yeasts isolated from a South Australian vineyard for their potential as wine starter cultures[J].Int J Food Microbiol, 2020,312:108373.
[4]胡小琴,刘伟,许弯,等.不同酵母对脐橙果酒品质的影响[J].食品工业科技,2021,42(5):1-11.
[5]毕静莹,卢丽娟.本土酿酒酵母的筛选及其在脐橙果酒酿造中的应用[J].中国酿造,2023,42(11):140-146.
[6]贾瑞楠,单万祥,李永仙,等.橙酒酵母的分离、筛选及鉴定[J].食品与发酵工业,2018,44(7):122-127.
[7]朱娟娟,郑少阳,李炎杰,等.不同酿酒酵母对脐橙果酒发酵特性的影响[J].南方农业学报,2017,48(5):870-875.
[8]胡江南,高熳熳,马立娟,等.葡萄酒发酵优良酵母的筛选、鉴定及应用[J].中国酿造,2023,42(7):43-50.
[9]钟轲,丁燕,汤晓宏,等.不同海拔高度和品种对脐橙果酒香气组成及感官品质的影响[J].中国酿造,2023,42(10):100-107.
[10]孙海燕.贺兰山东麓干红葡萄酒多酚组分与其抗氧化、抗癌活性的关联性研究[D].杨凌:西北农林科技大学,2019.
[11]张宏丽.贺兰山东麓葡萄籽功能性成分研究与利用[D].银川:宁夏大学,2013.
[12]原苗苗,姜凯凯,孙玉霞,等.戴尔有孢圆酵母对葡萄酒香气的影响[J].食品科学,2018,39(4):99-105.
[13]邓山鸿,陈钢.氮源对低温发酵脐橙果酒挥发性成分的影响[J].食品工业科技,2020,41(20):92-103.
[14]FAN G, XU X Y, QIAO Y, et al.Volatiles of orange juice and orange wines using spontaneous and inoculated fermentations[J].Eur Food Res Technol,2009,228(6):849-856.
[15]ZHOU Y, FEI G, FARIDUL HASAN K M, et al.Cultivar difference characterization of kiwifruit wines on phenolic profiles, volatiles and antioxidant activity[J].Food Chem,2023,18:100691.
[16]KUROWAKA E M,MANTHEY.Hypolipidemic effects and absorption of citrus polymethoxylated flavones in hamsters with diet-induced hypercholesterolemia[J].J Agr Food Chem,2004,52(10):2879-2886.
[17]LI S,SANG S,PAN M H,et al.Anti-inflammatory property of the urinary metabolites of nobiletin in mouse[J].Bioorg Med Chem Lett, 2007,17(18):5177-5181.
[18]RAMFUL D,TARNUS E,ARUOMA O I,et al.Polyphenol composition,vitamin C content and antioxidant capacity of Mauritian citrus fruit pulps[J].Food Res Int,2011,44(7):2088-2099.
[19]李国薇,樊明涛,王胜利,等.酵母菌种对苹果酒主发酵过程中的多酚组成及抗氧化活性的影响[J].中国酿造,2012,31(10):33-37.
[20]郭晨晨,王鑫涛,劳凤仙,等.不同酿酒酵母对槜李果酒发酵及挥发性香气成分的影响[J].中国酿造,2023,42(10):114-121.
[21]钟平娟,叶丽芳,门戈阳,等.大果山楂酒发酵过程中抗氧化活性和香气成分分析[J].食品研究与开发,2021,42(8):24-29.
[22]胡冀太.不同工艺及酵母对山楂酒发酵过程及成品酒品质的影响[D].泰安:山东农业大学,2012.
[23]李慧颖,郑福静,张煜,等.外源多酚对赤霞珠干红葡萄酒发酵挥发性物质稳定与呈香的基质效应[J].中国食品学报,2024,24(4):370-380.
[24]孟令君,张煜,吴璐璐,等.有机酸对赤霞珠干红葡萄酒的提酯增香效应研究[J].食品安全质量检测学报,2024,15(1):155-162.
[25]郑淑丹,陈钢,阙发秀,等.脐橙全果酒发酵工艺优化及其与脐橙果汁酒风味物质的对比分析[J].食品科学,2019,40(10):171-177.
[26]NJPRPGE S M,UKEDA H,KUSUNOSE H,et al.Volatile components of the essential oils from Kabosu,Daidai,and Yuko,Japanese sour citrus fruits[J].Flavor Frag J,1994,9(6):289-297.
[27]FARINA L,VILLAR V,ARES G,et al.Volatile composition and aroma profile of Uruguayan Tannat wines[J].Food Res Int,2015,69(3):244-255.
[28]WANG X F,MAO X J,YAN A P,et al.Simultaneous determination of nine plant growth regulators in navel oranges by liquid chromatographytriple quadrupole tandem mass spectrometry[J].Food Anal Meth,2016,9(12):1-10.
[29]卜坚珍,于立梅,曾晓房,等.榴莲果酒发酵工艺优化及其香气成分分析[J].食品与机械,2017,33(9):182-185.
[30]郑淑丹,陈钢,阙发秀,等.脐橙全果酒发酵工艺优化及其与脐橙果汁酒风味物质的对比分析[J].食品科学,2019,40(10):171-177.
[31]IGNACIO B,JAVIER R,ADELAIDA E F,et al.Microbial contribution to wine aroma and its intended use for wine quality improvement[J]Molecules,2017,22(2):189.
[32]于慧娟,郭夏丽.秸秆降解菌的筛选及其纤维素降解性能的研究[J].生物技术通报,2019,35(2):58-63.
[33]ENGLEZOS V,RANTSIOU K,CRAVERO F,et al.Volatile profile of white wines fermented with sequential inoculation of Starmerella bacillaris and Saccharomyces cerevisiae[J].Food Chem,2018,3:350-360.
[34]赵芳琴,王诗,赵丹丹,等.混菌发酵接种比例对美乐低醇葡萄酒香气品质的影响[J].甘肃农业大学学报,2020,55(1):186-195.
[35]FONTANA A R,BOTTINI R.QuEChERS method for the determination of 3-alkyl-2-methoxypyrazines in wines by gas chromatography-mass spectrometry[J].Food Anal Meth,2016,9(12):3352-3359.