Research progress on the copigmentation of anthocyanins in fermented fruit wine
颜色是水果类发酵酒最重要的质量参数之一,是人们的第一个感知特征,在消费过程中起着至关重要的作用。通常,参与水果类发酵酒颜色的酚类化合物大多数是从果皮和种子中提取,并在酿酒过程中扩散到水果类发酵酒中。花色苷是影响水果类发酵酒颜色的重要物质,其稳定性受温度、光、pH、溶剂、氧气、辅色反应以及与酒中存在的其他化合物的共价反应等因素的影响[1]。其中,辅色效应被认为是稳定花色苷颜色的重要举措,在花色苷提供的各种颜色表达中起着重要作用。辅色效应是指有色形式的花色苷(黄烊盐阳离子)的平面极化核与有机分子(辅色素)之间形成分子结合或配合物的非共价相互作用,从而限制水分子的攻击和花色苷无色形式的形成,这种结合是由弱的分子力促进的,包括氢键和疏水作用[2]。有研究表明,辅色效应负责葡萄酒中30%~50%的着色,是稳定葡萄酒陈酿过程中颜色的重要原因[3]。
在酚类化合物中,黄酮醇和酚酸化合物被认为是花色苷最重要的辅色素。有研究表明,黄酮醇是类黄酮化合物中最有效的辅色素,黄酮醇与花色苷的缔合常数显著高于黄烷醇与花色苷的缔合常数[4]。由于在水果类发酵酒中黄烷醇的含量远高于黄酮醇的含量,仍是水果类发酵酒中重要的一类酚类辅色素[5]。关于其他种类的酚类化合物,如羟基肉桂酸,特别是其中的咖啡酸,也显示出很强的辅色作用[6]。此外占据总色素含量很大部分的吡喃型花色苷在稳定水果类发酵酒色泽方面也被广泛研究[7]。近年来,随着辅色素与花色苷的辅色效应理论研究的发展,辅色素尤其是酚类化合物与花色苷的辅色效应在红酒酿造或贮存过程中用于稳定酒体颜色逐渐成为热点。本文通过介绍花色苷的基本结构及其在水溶液中的多态平衡以及4种花色苷辅色效应的类型,并对水果类发酵酒中充当辅色素的多酚物质进行总结,以期为水果类发酵酒的生产和消费提供一定的理论依据。
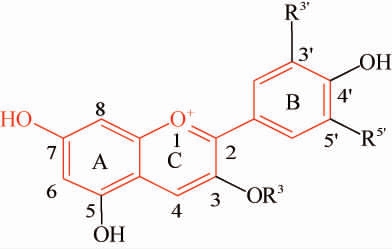
花青素属于酚类化合物中的类黄酮类(flavonoids),花青素由一个芳香环A和一个含氧杂环C组成,含氧杂环C通过碳-碳键连接到第三个芳香环B上(7-羟基黄烊盐阳离子发色团以红色表示),而花色苷是由花青素和糖以糖苷键结合而成的一类化合物。花青素和花色苷的基本结构如下:

自然界有超过300种不同的花青素,其来源于不同种水果和蔬菜,如紫甘薯、越橘、酸果蔓、蓝莓、黑枸杞、葡萄、接骨木红、黑加仑、紫胡罗卜和红甘蓝,颜色从红到蓝。这些花青素主要包含飞燕草素(delchindin)、矢车菊素(cyanidin)、牵牛花色素(petunidin)、芍药花色素(peonidin)、锦葵素(malvidin)、天竺葵素(pelargonidin)。几乎所有已知的几千种花色苷都是由上述六种非配醣体(aglycone)衍生的,它们的区别仅仅在于B环上的羟基和甲氧基取代基的数量(见表1)。
表1 花青素和花色苷相应的取代基
Table 1 Corresponding substituents of anthocyanidins and anthocyanins
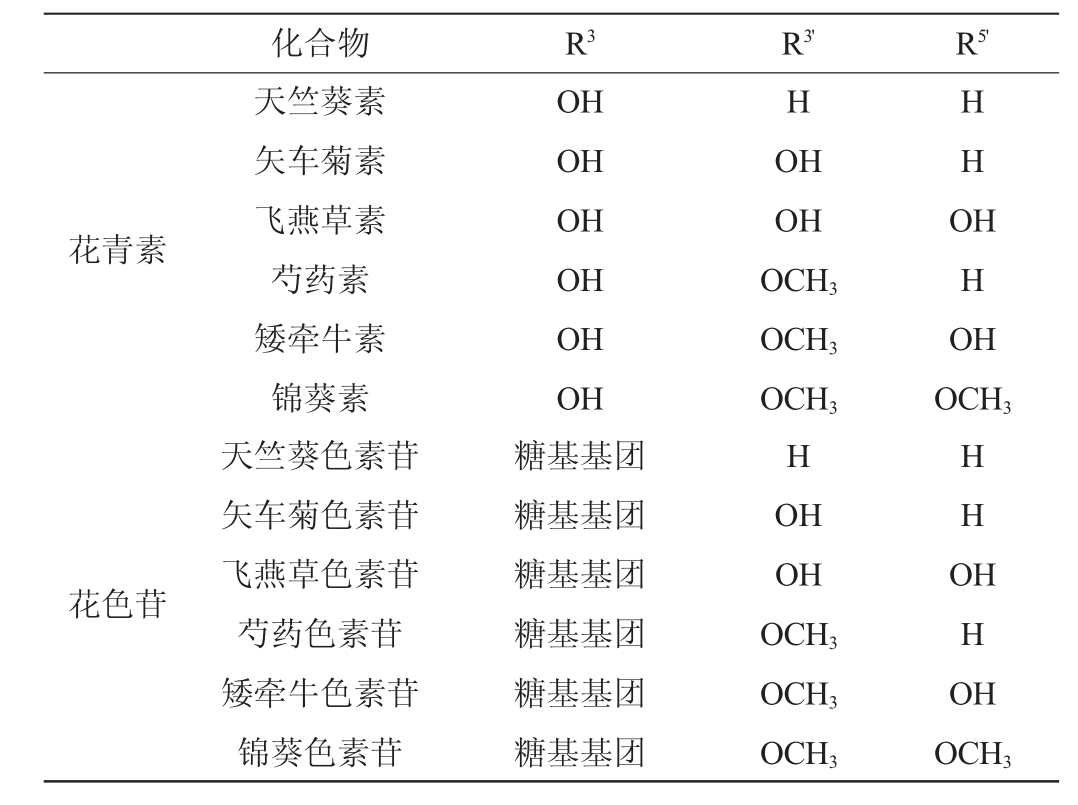
花青素花色苷化合物 R3 R3' R5'天竺葵素矢车菊素飞燕草素芍药素矮牵牛素锦葵素天竺葵色素苷矢车菊色素苷飞燕草色素苷芍药色素苷矮牵牛色素苷锦葵色素苷OH OH OH OH OH OH糖基基团糖基基团糖基基团糖基基团糖基基团糖基基团H OH OH OCH3 OCH3 OCH3 H OH OH OCH3 OCH3 OCH3 HHO HHO H OCH3 HHO HHO H OCH3
花色苷烊盐核上带有正电荷的8个共轭双键组成的发色团是花色苷在不同pH条件下产生强烈的红橙色到蓝紫色的原因[8]。有研究表明,这些花色苷本身不能赋予在自然界中观察到的颜色,而是在复杂的自然基质中与其他分子或离子相互作用来调节和稳定颜色[9]。花色苷中羟基和甲氧基的含量会影响颜色强度和类型,若存在更多的羟基,颜色会变成蓝色,而存在更多的甲氧基,颜色会变红[10]。因此,对于给定的花色苷,相应花色苷结构的差异取决于糖基化的性质和程度,以及附加在糖上的酰基,这些结构决定了它们的分子电子分布、反应性和颜色多样性[11]。
花色苷具有弱二酸的功能,是因为它们的发色团含有一个强吸电子的吡啶环,使C4′、C5和C7的酚羟基具有一定的酸性,其中,C7位点上的羟基酸性最高,其次是C4′位点上的羟基[12]。花色苷的降解与其色素的褪色有关,由于其分子结构的离子特性,花色苷的颜色受pH值的影响[13]。花色苷在水溶液中通常以离子化醌式碱、中性醌式碱、黄烊盐离子、半缩酮、顺式查尔酮以及反式查尔酮等六种基本形式存在,其存在形式依赖溶液的pH值。花色苷在水溶液中的多态平衡如图1所示[12],红色的黄烊盐离子在pH<3时占主导地位,而在pH>3时,黄烊盐离子发生水合反应,或失去质子,形成无色半缩酮形式。无色的半缩醛通过开环互变后形成淡黄色的顺式-查尔酮,顺式-查尔酮则通过热反应或光化学反应异构化为淡黄色的反式-查耳酮。因此,当pH值升高至3时,天然花色苷水溶液的红色通常会褪色,但在再酸化至pH<3时再生,表明这些耦合的基态平衡的可逆性[11]。而当pH在6~7范围时,质子转移将红色黄烊盐离子变成紫色的中性醌式碱;当pH>7时,紫色的中性醌式碱通过去除第二个质子形成蓝色的离子化醌式碱。导致这些变换的原因是由于黄烊盐离子的共振结构,当pH值变化时,它们会受到电子跃迁的影响,并负责其氧化还原特性[14]。有研究表明,某些花色苷,特别是那些在B环上只有一个羟基的花色苷,在碱性pH值下比先前预期的颜色更强烈[15]。
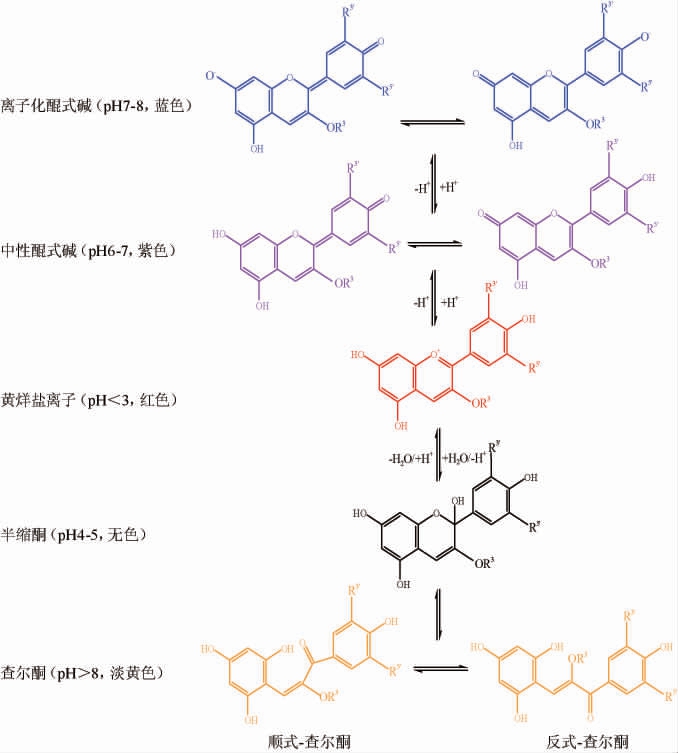
图1 花色苷在水溶液中的多态平衡
Fig.1 Polymorphic balance of anthocyanins in aqueous solution
R3为糖基基团,R3′、R5′分别为H、OH、OCH3。
辅色效应有助于保护花色苷的黄烊盐阳离子免受亲核攻击,从而通过花色苷的发色团与无色辅色素之间的非共价相互作用来增强和稳定颜色[13]。花色苷辅色效应的类型如图2所示,主要的辅色效应类型包括自缔合辅色、分子内辅色、分子间辅色和金属缔合辅色。
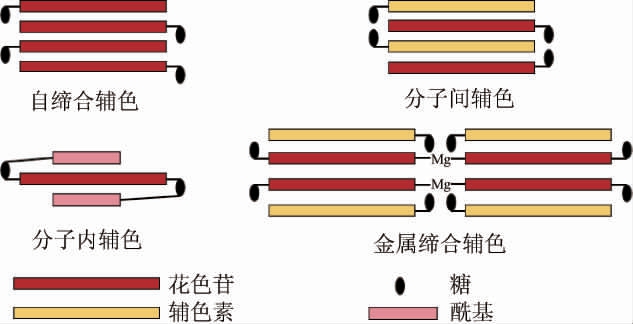
图2 花色苷辅色效应的类型
Fig.2 Types of anthocyanins copigmentation
由两个或多个花色苷分子通过芳香环的垂直堆叠形成疏水相互作用,从而防止水的亲核攻击以及半缩酮和查耳酮形式的形成,这种作用机制称为自缔合辅色效应[16]。花色苷的浓度、B环上的取代基以及糖的位置对花色苷的自缔合和稳定性的大小有较大的影响。花色苷的自缔合通常不如分子间的辅色作用强,需要相对高浓度的花色苷(约1 mmol/L)才能观察到[17]。基于B环上的取代基(羟基和甲氧基),羟基在C5′位置的自缔合较强,而在C3′位置的自缔合较弱[18],原因是在C3′位置上的羟基会使B环和C环的键发生轻微的扭转,降低了平面度,从而降低了花色苷分子的自缔合[12]。花色苷自缔合相互作用的有效性与B环的甲氧基化程度呈正相关,C3′和C5′位的甲氧基取代可以显著增加花色苷的自缔合,由于B环上甲氧基的空间位阻决定了复合物的朝向,因此利于更好的结合[17]。此外,花色苷的糖基化也会影响自缔合的堆叠排列,原因是糖基化存在额外的氢键会增强花色苷的自缔合,因此,糖的位置和大小决定了复合物的整体排列[13]。
如图2所示,分子内辅色多发生在酰化花色苷上,花色苷上的酰基充当辅色素,与花色苷的发色团共价连接在相同的糖残基上,这种方式称为分子内辅色。由于不同基团的折叠、旋转和堆叠形成三级结构相关的疏水力导致花色苷和酰基芳香族残基形成层状“夹心”结构,从而保护花色苷免受水的亲核攻击[18]。对于那些具有实现这种层状“夹心”结构复合物所需的两个或更多芳香酰基部分的花色苷,更有效的实现花色苷的稳定[13]。因此,酰基的数量以及花色苷的结构特征是影响花色苷分子内辅色的重要因素。此外,酚酸酰化可提高花色苷的稳定性,当花色苷与咖啡酸、香豆酸或阿魏酸酰化时,引入的羟基肉桂酸可以发生异构化反应(从E到Z),所得的Z结构可以实现更致密的共面复合物,从而抑制吡啶环的水合作用[19]。一般来说,对于通过单糖或双糖与花色苷的B环或C环相连的羟基肉桂酸部分,分子内辅色比自缔合辅色更重要[12]。通常,酰化花色苷比非酰化花色苷更稳定,富含酰化花色苷的物质由于分子内辅色而表现出很高的稳定性,但在水果类发酵酒中,酰化花色苷、非酰化花色苷与多酚辅色素同时存在,分子内辅色与分子间辅色对水果类发酵酒的相互辅色机制还需进一步研究。
分子间辅色是指有色花色苷分子与非花色苷分子之间的非共价相互作用。分子间相互作用与花色苷的存在形式有关,黄烊盐离子和醌式碱形式的花色苷因具有有效的离域π-电子和平面的结构,更容易与具有相似结构特征的辅色素发生相互作用[20]。由于分子间辅色效应形成π-π复合物,导致黄烊盐离子中分子的光谱特性发生变化,增加吸收强度及其波长,而花色苷的存在形式与pH有关,故分子间辅色效应的大小取决于pH值。分子间辅色不仅受pH值的影响,还受温度、溶剂、花色苷的种类、辅色素的浓度及其结构的影响。研究表明,不同结构的花色苷其分子间辅色相互作用不同,各种花色苷与阿魏酸的相互作用遵循锦葵素-3-O-葡萄糖苷>矢车菊素-3-O-葡萄糖苷>飞燕草素-3-O-葡萄糖苷的顺序[21]。除了多酚类物质与花色苷发生分子间辅色外,氨基酸、蛋白质、生物碱以及多糖等物质也可作为辅色素与花色苷发生分子间辅色[18,20]。此外,辅色素浓度越高,分子间辅色的效果更好,而较高的温度和甲醇、甲酰胺或盐的存在则会降低花色和与辅色素之间的分子间辅色[17]。
起初,金属缔合辅色反应被证明是保持花卉系统中蓝色的重要作用[12],近年来,已被证明可以稳定不同浆果及其衍生产品的颜色。花色苷B环上的基团(邻苯二酚、连苯三酚)以分子间辅色的方式通过配位键与金属离子形成络合物的这种方式称为花色苷的金属缔合辅色[22]。高浓度的金属离子促使花色苷逐渐去除两个氢离子,从其红色黄烊盐离子形成蓝色醌式碱阴离子,然后通过与外部辅色素的典型分子间辅色或与其他花色苷的自缔合来稳定复合物,从而形成更复杂的超分子结构[12,17]。如图3所示,花色苷、黄酮和金属离子以6∶6∶2的化学计量比组织成两个平行的平面,每个平面包含3个花色苷、3个黄酮和1个组织空间的金属离子[23]。一般情况下,花色苷、辅色素和金属离子的化学计量比为6∶6∶2,而在特殊情况下,6个花色苷、6个辅色素和4个金属离子也会以化学计量比为6∶6∶4的比例共同缔合形成四核金属配合物[24]。有研究表明,儿茶酰基-吡喃麦芽素-3-O-葡萄糖苷由于其邻苯二酚基团与金属离子缔合形成的金属缔合物不容易发生自缔合作用[25]。此外,金属离子的质量浓度和价态均会影响金属离子与花色苷的缔合辅色作用,高质量浓度的金属离子通过其他反应可能会引起颜色的衰败,而高价态的金属离子与花色苷则具有较好的缔合辅色作用[26]。
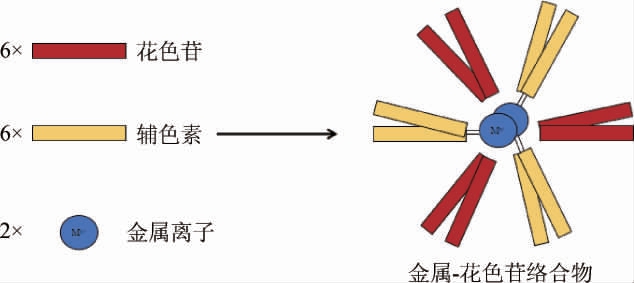
图3 金属-花色苷络合物的超分子结构
Fig.3 Supramolecular structure of metal-anthocyanin complex
酚类化合物是指芳香烃中苯环上的氢原子被羟基取代所生成的化合物,根据其分子所含的羟基数目可分为一元酚和多元酚。根据其结构特点,可将其分为类黄酮酚类化合物和非类黄酮酚类化合物。多酚辅色素是能够与花色苷发生辅色效应,或在低酸环境下增加花色苷稳定性从而稳定颜色的一类无色或淡色物质。一般情况下,辅色效果随辅色素含量的增加而增加,非类黄酮酚类辅色素的辅色作用低于类黄酮酚类辅色素。主要的类黄酮酚类化合物和非类黄酮酚类化合物的结构如下[27-28,51]:
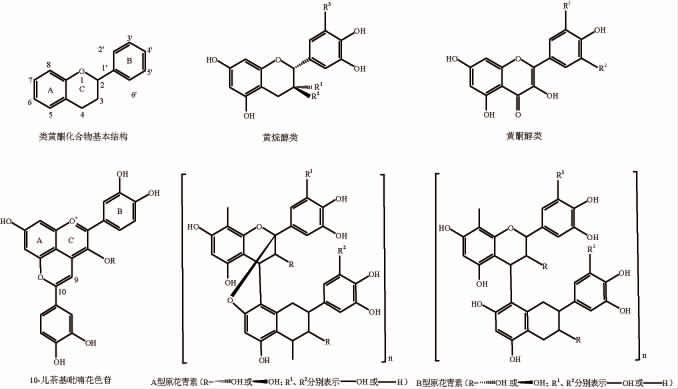
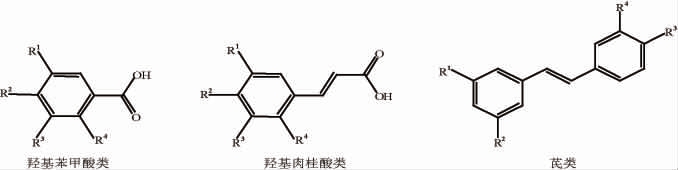
类黄酮酚类化合物相应的取代基见表2,非类黄酮酚类化合物相应的取代基见表3。
表2 类黄酮酚类化合物相应的取代基
Table 2 Corresponding substituents of flavonoid phenolic compounds
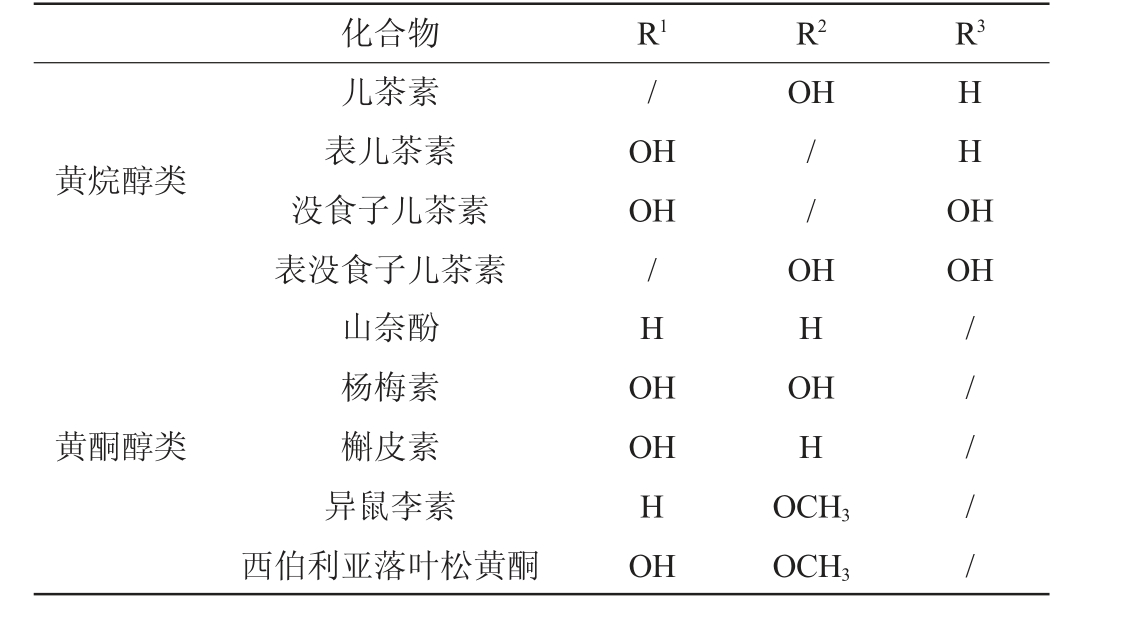
化合物 R1 R2 R3/OH黄烷醇类OH OH HHO H儿茶素表儿茶素没食子儿茶素表没食子儿茶素山奈酚杨梅素槲皮素异鼠李素西伯利亚落叶松黄酮/HO H// O HHO OH黄酮醇类OH H OH HH OCH3 OCH3// / / /
表3 非类黄酮酚类化合物相应的取代基
Table 3 Corresponding substituents of non-flavonoid phenolic compounds
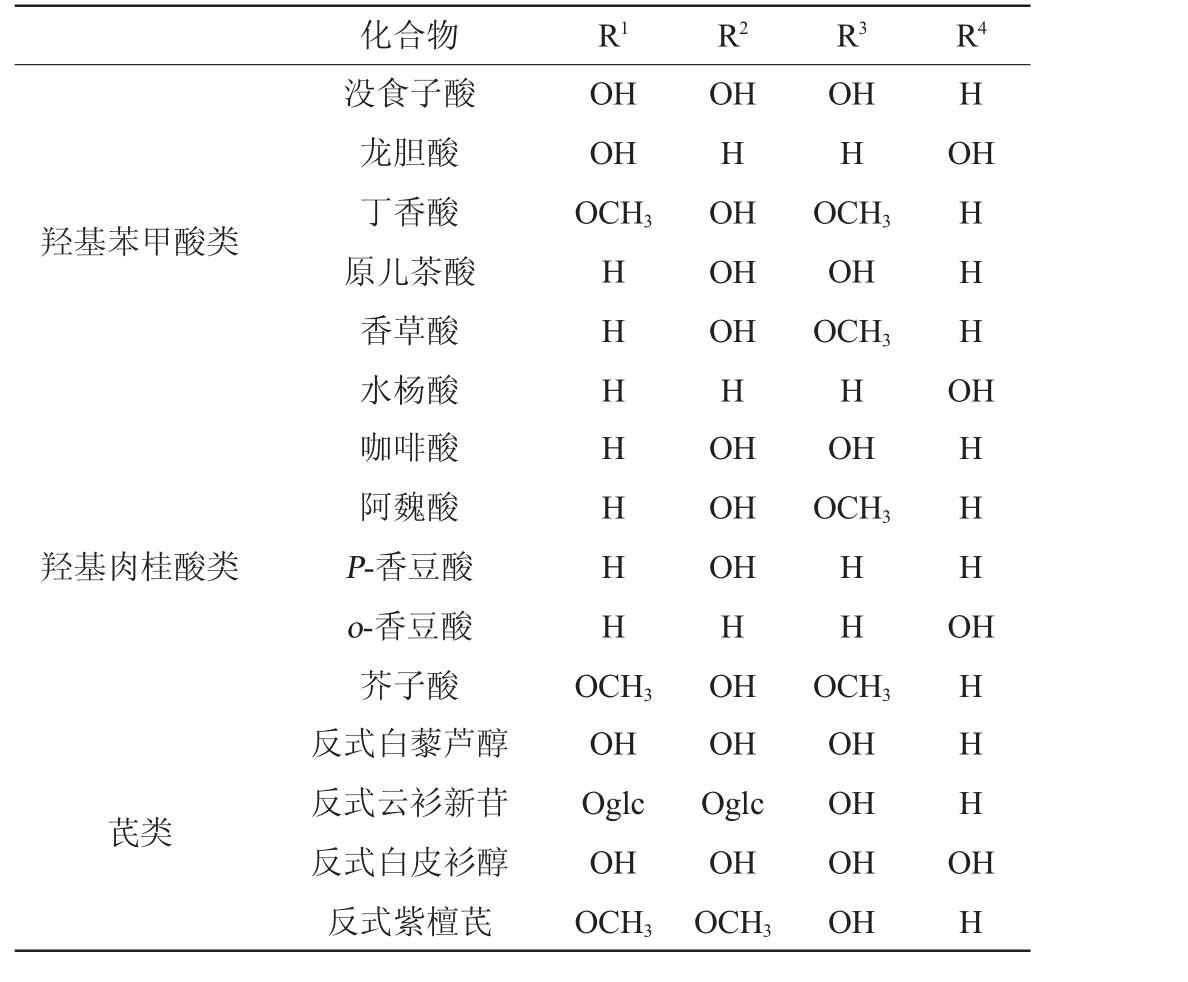
化合物 R1 R2 H OH羟基苯甲酸类没食子酸龙胆酸丁香酸原儿茶酸香草酸水杨酸OH OH OCH3 HHH OH H OH OH OH H R3 R4 OH H OCH3 OH OCH3 H HHHO H羟基肉桂酸类HHHH OH OH OH H OH OH Oglc OH OCH3咖啡酸阿魏酸P-香豆酸o-香豆酸芥子酸反式白藜芦醇反式云衫新苷反式白皮衫醇反式紫檀芪OH OCH3 HH HHHO芪类OCH3 OH Oglc OH OCH3 OCH3 OH OH OH OH HHHHO HH
4.1.1 黄烷醇
黄烷醇是葡萄酒中的一类类黄酮物质,在口腔中与唾液蛋白结合从而影响葡萄酒的感官属性(收敛性),还通过辅色效应或形成具有不同光谱属性的新色素化合物参与颜色的稳定性[29]。黄烷醇是类黄酮中结构最复杂的种类,在水果类发酵酒中通常以单体及其相应聚合物的形式存在,儿茶素、表儿茶素和表儿茶素没食子酸酯等是水果类发酵酒中的主要单体黄烷醇。对于单体黄烷醇而言,分子结构是影响辅色效应的重要因素,比如具有平面化结构的表儿茶素的辅色能力显著高于非平面化的儿茶素,是由于儿茶素C环中的C-2和C-4位置上具有反式取代基构型,使其非平面化,从而导致空间位阻受到约束[30]。有研究表明,黄烷醇类辅色素的辅色能力随着聚合度的增加而降低,由于黄烷醇聚合物的分子体积增大,从而阻碍花色苷分子的靠近[22]。而乙烯基儿茶素二聚体由于特殊的“三环”结构提供了更广的极性平面,与花色苷发色团建立多个范德华相互作用,被认为是比儿茶素二聚体辅色反应更强的辅色素[31]。
4.1.2 黄酮醇
果酒中的酚类化合物,除了黄酮醇和花色苷外,大多数化合物都是无色的,其中,黄酮醇在C3位点上存在一个羟基,以糖苷元形式存在或与糖(即糖苷)结合,是葡萄皮和红葡萄酒中发现的黄色色素[32]。槲皮素、山奈酚、异槲皮素和芦丁等黄酮醇似乎是最有效的辅色素,可提供最强的深色位移和增色效应,因为它们在整个三环核心结构(环A、B和C)上具有π共轭体系可以紧密地堆积在花色苷上,因此被认为是红葡萄酒中最好的辅色素[17]。其中槲皮素和芦丁是黄酮醇类中报导较多的辅色素,槲皮素在C2~C3之间的双键降低了B环的自由度,从而在空间上更有利于π-π的叠加[33]。BÁRBARA T等[4]在研究锦葵素-3-O-葡萄糖苷与葡萄酒酚类化合物相互作用时,锦葵素-3-O-葡萄糖苷对酚类化合物的亲和力为槲皮素>咖啡酸>表儿茶素>没食子酸>儿茶素,槲皮素是对锦葵素-3-O-葡萄糖苷具有最高亲和力的辅色素。研究表明,芦丁与其他辅色分子络合时对花色苷的辅色作用比单纯芦丁对花色苷的辅色作用更强,芦丁在低质量浓度(0.08 mg/mL)下对桑葚花色苷提取物(mulberry anthocyanin extract,MAE)具有更好的增色效应和深色位移,而乳清分离蛋白(whey protein isolate,WPI)与芦丁的结合则提高了MAE的颜色稳定性[34]。
4.1.3 花色苷
锦葵素-3-葡萄糖苷是果酒花色苷中最重要的一种色素,研究表明,锦葵素-3-葡萄糖苷的自缔合在热力学上优于其他被测辅色素分子的分子间相互作用,在年轻红葡萄酒中,锦葵素-3-葡萄糖苷的自我结合比其他辅色效应更重要[30]。此外,XU Z等[33]研究表明,花色苷B环取代基的种类及数量对颜色的表达具有重要的影响,B环上具有两个取代基的花色苷具有更多的红色色调,而三个取代基具有更多的蓝色色调,与羟基相比,甲氧基能增加更多的蓝色色调。花色苷与其他物质反应形成的化合物称为花色苷衍生物,根据结构,它们可以分为吡喃花色苷和非吡喃花色苷,对果类发酵酒的长期颜色表达至关重要[32]。目前,吡喃花色苷被认为是最重要的一类花色苷衍生物,与具有C6-C3-C6骨架的花色苷相比,吡喃花色苷是在花色苷的C4位点上增加了吡喃环,从而具有更高的稳定性。辅色素与花色苷的种类可影响吡喃花色苷形成速率及产量,相比丙酮酸,在相同条件下,咖啡酸和花色苷之间的辅色作用通过保持反应物的近距离并增加碰撞频率来促进吡喃花色苷的形成[35]。黄烷醇(黄烷-3-醇)的聚合物(原花青素)与花色苷之间形成的缩合产物称为非吡喃花色苷,也称聚合色素[32]。聚合作用可防止花色苷发色团免受水的亲核攻击以及花色苷的氧化降解,从而增强花色苷稳定性,保留聚合色素中花色苷的红色[36]。在陈酿过程中聚合色素的形成与原花青素或单宁的初始浓度有关[37]。对于原花青素来说,高聚原花青素对花色苷的反应活性高于低聚原花青素,在红葡萄酒陈酿过程中的颜色稳定性中起主要作用[38]。
4.2.1 羟基苯甲酸类
羟基苯甲酸类物质具有由苯甲酸衍生的C6-C1结构,主要包括对羟基苯甲酸、原儿茶酸、没食子酸、香草酸和丁香酸等,通常以游离的形式存在于果酒中。羟基苯甲酸的辅色能力与甲基化程度及羟基数量有关,双甲基化的丁香酸的辅色能力高于单甲基化的香草酸[39]。具有更多羟基的原儿茶酸和没食子酸的辅色能力高于对羟基苯甲酸的辅色能力,由于甲氧基的空间尺寸大于羟基,香草酸和丁香酸与锦葵素-3-O-葡萄糖苷的辅色反应导致更大的增色效应和深色位移[40]。XU Z等[33]研究表明,没食子酸对花色苷的亲和力随着花色苷B环上甲氧基和羟基取代基的数量增加,甲氧基比羟基更有效,由于甲氧基比羟基具有更大的空间尺寸,因此促进了色素-共色素复合物中的π-π堆积相互作用。甲氧基和羟基是影响羟基苯甲酸的辅色能力的主要因素,是因为含有更多羟基或甲氧基的辅色素引起π共轭体系的延伸,从而可以与花色苷形成更多的氢键[17,39]。
4.2.2 羟基肉桂酸类
羟基肉桂酸类物质具有C6-C3结构,其中,咖啡酸、香豆酸、芥子酸和阿魏酸等与酒石酸酯或双酯结合存在于果肉或果酒中,是羟基肉桂酸类化合物研究较多的辅色素[27]。羟基肉桂酸及其衍生物通常被描述为相对有效的辅色素,与其他类黄酮化合物相比,其辅色能力比羟基苯甲酸类的辅色素强,与黄烷醇和二氢黄酮醇相媲美[17]。对于酚酸类化合物,研究证明,羟基肉桂酸比羟基苯甲酸表现出更有效的辅色作用,其原因是羟基肉桂酸由于侧链较长,可以更好的与花色苷中的糖侧链相互作用,导致更高的结合力[41]。此外,羟基肉桂酸衍生物也具有一定的辅色作用,当与花色苷共价连接时,直接影响花色苷以及花色苷与金属螯合物的颜色表达[42]。
4.2.3 芪类
芪类物质是通过乙基连接两个芳香环组成的具有生物活性的化合物,主要来源于葡萄、蓝莓、花生及其衍生物中。白藜芦醇在果酒中的浓度远低于其他多酚物质,但因其多种生物学作用而被广泛研究,是芪类化合物重要的辅色素[22]。研究表明,添加反式白藜芦醇可提高锦葵素-3-葡萄糖苷的稳定性,增加红葡萄酒的颜色强度[43]。HERASROGER J 等[44]研究表明,白藜芦醇也具有类似的效果,在红葡萄酒的辅色反应中可充当辅色素。在果酒中,反式异构体的藜芦醇很容易转化为顺式异构体的藜芦醇,但由于其在果酒中的含量极低,故对果酒的辅色作用常被忽略。
Oxovitisins是陈年红葡萄酒中的一类具有独特光谱特征的新型淡黄色色素,由于其完全失去黄素阳离子结构后,不再被视为花色苷衍生物[32]。Oxovitisins是vitisin A与水反应,然后经过脱羧、氧化和脱水步骤,从而产生新的中性吡喃酮结构的羧基吡喃花色苷衍生物[45]。研究表明,Oxovitisins比其前体物质(锦葵素-3-O-葡萄糖苷和vitisin A)具有更高的稳定性,在产品生产、运输和贮存过程中可以更好保持产品的色泽[46]。
除纤维素外,木质素是存在自然界中的第二丰富天然物质,其中,木质素磺酸盐是木质素的另一种存在形式,是造纸过程中用亚硫酸盐制浆法从软木中产生的水溶性化合物[47]。有研究表明[48],木质素磺酸盐与黄烊盐离子形式的花色苷之间形成了络合物,在pH 1.0条件下,附着在木质素的烷烃主链单元上的阴离子磺酸盐基团与锦葵素-3-O-葡萄糖苷上的烊盐离子发生相互作用,从而引起深色位移。
本文总结了水果类发酵酒中花色苷的基本结构、多态平衡及其与多酚物质的辅色效应。花色苷作为天然色素,其辅色效应的最新进展在稳定色泽方面引起了广泛的关注。目前,国内有关花色苷辅色效应的研究逐渐向辅色反应机制演变,而关于复杂体系中辅色素与花色苷的复合物以及多种辅色素之间的协同或抑制作用的研究较少。近年来,随着分子动力学研究的发展,理论与实验研究对辅色反应的分子理解有了更全面的认识,然而,尽管实验技术能提供对辅色效应更多方面的见解,但仍有许多重大挑战需要解决。比如,花色苷辅色效应的研究大多集中在以二甲花翠素-3-O-葡萄糖苷为主体的分子间辅色,而其他辅色反应缺乏更深入的研究,尤其是基于金属离子与花色苷和辅色素之间的金属缔合辅色在水果类发酵酒中的研究更少。虽然花色苷的颜色可以通过与金属离子或辅色素的辅色反应来调节,但色素复合物的稳定性(热稳定性、光稳定性和氧化稳定性等)范围以及辅色素与花色苷形成的吡喃花色苷还有待研究。辅色素与花色苷的辅色反应机制多在模拟体系中进行,缺乏基于水果类发酵酒中的应用,在真实水果类发酵酒中,辅色素之间可能存在多种反应机制,甚至呈现相反的现象,这些均需要进一步研究。此外,色素复合物的形成对水果类发酵酒感官、风味等品质的影响尚不完全清楚,不同辅色素对花色苷的结构亲和关系还有待建立等。
[1]FANZONE M, GONZÁLEZ-MANZANO S, PÉREZ-ALONSO J, et al.Evaluation of dihydroquercetin-3-O-glucoside from Malbec grapes as copigment of malvidin-3-O-glucoside[J].Food Chem,2015,175:166-173.
[2]FERNANDES A,BRÁS N F,OLIVEIRA J,et al.Impact of a pectic polysaccharide on oenin copigmentation mechanism[J].Food Chem,2016,209:17-26.
[3]TROUILLAS P,SANCHO-GARCÍA J C,DE FREITASS V,et al.Stabilizing and modulating color by copigmentation:Insights from theory and experiment[J].Chem Rev,2016,116(9):4937-4982.
[4]BÁRBARA T,ELVIRA M,F N B,et al.Supramolecular study of the interactions between malvidin-3-O-glucoside and wine phenolic compounds:Influence on color[J].J Agr Food Chem,2023,72(4):1894-1901.
[5]GARCÍA-MARINO M,ESCUDERO-GILETE M L,HEREDIA F J,et al.Color-copigmentation study by tristimulus colorimetry(CIELAB) in red wines obtained from Tempranillo and Graciano varieties[J].Food Res Int,2013,51(1):123-131.
[6]XUE Z D, ZHANG Q A, WANG T T.Co-pigmentation of caffeic acid and catechin on wine color and the effect of ultrasound in model wine solutions[J].J AOAC Int,2020,104(6):1703-1709.
[7]DIPALMO T,CRUPI P,PATI S,et al.Studying the evolution of anthocyanin-derived pigments in a typical red wine of Southern Italy to assess its resistance to aging[J].LWT-Food Sci Technol,2016,71:1-9.
[8]BUENO J M,SÁEZ-PLAZA P,RAMOS-ESCUDERO F, et al.Analysis and antioxidant capacity of anthocyanin pigments.Part II:Chemical structure,color,and intake of anthocyanins[J].Crit Rev Anal Chem, 2012,42(2):126-151.
[9]NUNO B,JOHAN M,ANDRÉ S,et al.Strategies used by nature to fix the red,purple and blue colours in plants:A physical chemistry approach[J].Phys Chem Chem Phys,2021,23(42):24080-24101.
[10]ANTONELLA S,DAVIDE B,ERSILIA B,et al.Chemistry,pharmacology and health benefits of anthocyanins[J].Phytother Res,2016,30(8):1265-1286.
[11]SILVA V O, FREITAS A A, MAÇANITA A L, et al.Chemistry and photochemistry of natural plant pigments:The anthocyanins[J].J Phys Org Chem,2016,29(11):594-599.
[12]ALAN H,INGO A,CATHIE M.Natural blues:Structure meets function in anthocyanins[J].Plants,2021,10(4):726.
[13]ENARU B,DRET,CANU G,DARIA POP T,et al.Anthocyanins:Factors affecting their stability and degradation[J].Antioxidants,2021,10(12):1967.
[14]AYVAZ H,CABAROGLU T,AKYILDIZ A,et al.Anthocyanins:Metabolic digestion,bioavailability,therapeutic effects,current pharmaceutical/industrial use,and innovation potential[J].Antioxidants,2022,12(1):48.
[15]TAN C,DADMOHAMMADI Y,LEE M C,et al.Combination of copigmentation and encapsulation strategies for the synergistic stabilization of anthocyanins[J].Compr Rev Food Sci Food Safety,2021,20(4):3164-3191.
[16]DE FREITAS V A P,FERNANDES A,OLIVEIRA J,et al.A review of the current knowledge of red wine colour[J].OENO One,2017,51(1):1001-1021.
[17]WANG J D,ZHAO Y Q,SUN B,et al.The structure of anthocyanins and the copigmentation by common micromolecular copigments: A review[J].Food Res Int,2024,176:113837.
[18]CAI D B,LI X S,CHEN J L,et al.A comprehensive review on innovative and advanced stabilization approaches of anthocyanin by modifying structure and controlling environmental factors[J].Food Chem, 2022,366:130611.
[19]ZHAO C L, CHEN Z J, BAI X S, et al.Structure-activity relationships of anthocyanidin glycosylation[J].Mol Divers,2014,18(3):687-700.
[20]ESRA G,EZGI E Ö,KARDELEN D,et al.Copigmentation and stabilization of anthocyanins using organic molecules and encapsulation techniques[J].Curr Plant Biol,2022,29:100238.
[21]LV X R,LI L L,LU X M,et al.Effects of organic acids on color intensification, thermodynamics, and copigmentation interactions with anthocyanins[J].Food Chem,2022,396:133691.
[22]赵旭,张欣珂,陈新军,等.葡萄酒中的酚类物质Ⅱ:辅色效应与生物活性研究进展[J].食品科学,2019,40(17):284-294.
[23]PINA F,ALEJO-ARMIJO A,CLEMENTE A,et al.Evolution of flavylium-based color systems in plants:What physical chemistry can tell us[J].Int J Mol Sci,2021,22(8):3833.
[24]PINA F, BASÍLIO N, PAROLA A J, et al.The triumph of the blue in nature and in anthropocene[J].Dyes Pigments,2023,210:110925.
[25]VALLVERDU′-QUERALT A,BILER M,MEUDEC E,et al.p-Hydroxyphenyl-pyranoanthocyanins: An experimental and theoretical investigation of their acid-base properties and molecular interactions[J].Int J Mol Sci,2016,17(11):1842.
[26]黄雨珊,范舒悦,勾叙衡,等.金属元素在葡萄酒中的作用[J].中国食品学报,2023,23(11):446-456.
[27]ROCÍO G,JOSÉ M A,EMMA C.Wine polyphenol content and its influence on wine quality and properties:A review[J].Molecules,2021,26(3):718.
[28]张欣珂,赵旭,成池芳,等.葡萄酒中的酚类物质Ⅰ:种类、结构及其检测方法研究进展[J].食品科学,2019,40(15):255-268.
[29]PÉREZ-NAVARRO J,CAZALS G,ENJALBAL C,et al.Flavanol glycoside content of grape seeds and skins of Vitis vinifera varieties grown in Castilla-La Mancha,Spain[J].Molecules,2019,24(21):4001.
[30]LAMBERT G S, ASENSTORFER E R, WILLIAMSON M N, et al.Copigmentation between malvidin-3-glucoside and some wine constituents and its importance to colour expression in red wine[J].Food Chem,2010,125(1):106-115.
[31]CRUZ L,BRÁS N F,TEIXEIRA N,et al.Vinylcatechin dimers are much better copigments for anthocyanins than catechin dimer procyanidin B3[J].J Agr Food Chem,2010,58(5):3159-3166.
[32]ZHANG X K,JEFFERY D W,LI D M,et al.Red wine coloration:A review of pigmented molecules,reactions,and applications[J].Compr Rev Food Sci Food Safety,2022,21(5):3834-3866.
[33]XU Z,WEN B D,WEI J Q,et al.Intermolecular copigmentation between five common 3-O-monoglucosidic anthocyanins and three phenolics in red wine model solutions:The influence of substituent pattern of anthocyanin B ring[J].Food Chem,2020,326:126960.
[34]CHEN X,GUAN Y M,ZENG M M,et al.Effect of whey protein isolate and phenolic copigments in the thermal stability of mulberry anthocyanin extract at an acidic pH[J].Food Chem,2022,377:132005.
[35]ZHU X Y,GIUSTI M M.Pyranoanthocyanin formation rates and yields as affected by cyanidin-3-substitutions and pyruvic or caffeic acids[J].Food Chem,2021,345:128776.
[36]HE F,LIANG N N,MU L,et al.Anthocyanins and their variation in red wines.II.anthocyanin derived pigments and their color evolution[J].Molecules,2012,17(2):1483-1519.
[37]KUMAR L,TIAN B,HARRISON R.Interactions of Vitis vinifera L.cv.Pinot Noir grape anthocyanins with seed proanthocyanidins and their effect on wine color and phenolic composition[J].LWT-Food Sci Technol,2022,162:113428.
[38]LI L X,SUN B S.Grape and wine polymeric polyphenols:Their importance in enology[J].Crit Rev Food Sci Nutr,2019,59(4):563-579.
[39]MALAJ N,DE SIMONE B C,QUARTAROLO A D,et al.Spectrophotometric study of the copigmentation of malvidin 3-O-glucoside with p-coumaric, vanillic and syringic acids[J].Food Chem, 2013, 141(4):3614-3620.
[40]ZHANG B,LIU R,HE F,et al.Copigmentation of malvidin-3-O-glucoside with five hydroxybenzoic acids in red wine model solutions:Experimental and theoretical investigations[J].Food Chem,2015,170: 226-233.
[41]CAO Y,ZHAO B F,LI Y G,et al.Investigation of the difference in color enhancement effect on cyanidin-3-O-glucoside by phenolic acids and the interaction mechanism[J].Food Chem,2023,411:135409.
[42]SIGURDSON G T,ROBBINS R J,COLLINS T M,et al.Effects of hydroxycinnamic acids on blue color expression of cyanidin derivatives and their metal chelates[J].Food Chem,2017,234:131-138.
[43]ULRIH N P,OPARA R,KOROŠEC M,et al.Part II.Influence of transresveratrol addition on the sensory properties of'Blaufränkisch'red wine[J].Food Chem Toxicol,2020,137:111124.
[44]HERAS-ROGER J,ALONSO-ALONSO O,GALLO-MONTESDEOCA A,et al.Influence of copigmentation and phenolic composition on wine color[J].J Food Sci Technol,2016,53(6):2540-2547.
[45]HE J R,OLIVEIRA J,SILVA A M S,et al.Oxovitisins:a new class of neutral pyranone-anthocyanin derivatives in red wines[J].J Agr Food Chem,2010,58(15):8814-8819.
[46]WU M C, MA Y, LI A, et al.Stability and antiproliferative activity of malvidin-based non-oxonium derivative (oxovitisin A) compared with precursor anthocyanins and pyranoanthocyanins[J].Molecules, 2022,27(15):5030.
[47]ARO T, FATEHI P.Production and application of lignosulfonates and sulfonated lignin[J].Chem Sus Chem,2017,10(9):1861-1877.
[48]ARAU′JO P,BASÍLIO N,FERNANDES A,et al.Impact of lignosulfonates on the thermodynamic and kinetic parameters of malvidin-3-O-glucoside in aqueous solutions[J].J Agr Food Chem,2018,66(25):6382-6387.