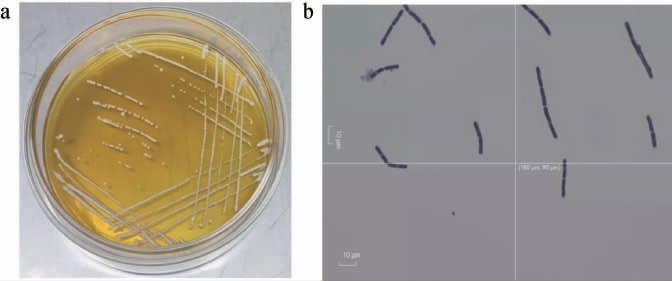
图1 菌株PETB0001的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain PETB0001
Bacterial community and quality characteristics of Pu-erh tea fermented by Weizmannia coagulans
凝结魏茨曼氏菌(Weizmannia coagulans)原名凝结芽孢杆菌(Bacillus coagulans)[1],最早由Hammer于1915年从变质的牛奶中分离出来[2]。凝结魏茨曼氏菌是一种嗜热兼性厌氧的革兰氏阳性细菌[3],兼具益生菌和乳酸菌的双重优势[4]。凝结魏茨曼氏菌能产生氨基酸、蛋白酶、抑菌素等[5],具有调节肠道菌群[6]、促进营养物质代谢和利用[7]、调节免疫力[8]等保健功效,广泛用作益生菌[9]。美国食品和药品监督管理局(Food and Drug Administration,FDA)批准凝结魏茨曼氏菌为安全可食用的益生菌[10],更重要的是凝结魏茨曼氏菌的芽孢具有非常强大的稳定性,具有耐高温、耐酸和耐胆盐等高抗逆性特点,作为新型微生态制剂,被广泛应用到畜牧业、水产养殖业、医药、保健和食品行业[11-13]。近年来凝结魏茨曼氏菌已应用于酸奶[14]、乳制品[15]、三七叶茶[16]和饲料发酵[17]等研究,成为发酵食品开发热点。
普洱熟茶(ripened pu-erh tea)是一种以云南大叶种晒青茶为原料的微生物发酵茶[18],具有汤色红浓(褐)、滋味醇厚(和)、陈香显著等独特风味[19-20]。除了风味独特外,国内外研究还发现普洱熟茶具有抗氧化、抗菌、降脂、调节肠道菌群等生物活性[18,21]。ZHU M等[22]研究发现,普洱熟茶具有独特风味与良好的健康功效,与其关键的后发酵(postfermentation)工艺息息相关。在普洱熟茶发酵中多种微生物共同作用,促进普洱熟茶特征品质形成[23]。李晨晨等[24]研究发现,普洱熟茶发酵中存在凝结魏茨曼氏菌(W.coagulans),ZHANG Y等[25]研究表明,在普洱熟茶中发现了耐热细菌凝结魏茨曼氏菌。本团队前期研究发现[26],凝结魏茨曼氏菌是普洱茶发酵后期的优势细菌,提示有可能应用该益生菌发酵制备普洱熟茶。
本研究从普洱熟茶中分离筛选菌株,并对筛选菌株进行形态学观察及分子生物学鉴定。接种分离菌株发酵制备益生菌普洱熟茶(样品编号为WF),以未接菌发酵样品为对照(CK),比较发酵样品细菌群落结构及品质特征差异。旨在为开发富含益生菌的普洱茶熟茶提供试验依据,拓展益生菌的应用范围。
1.1.1 材料
以云南大叶种一芽二叶晒青茶为原料,经过后发酵加工制成普洱熟茶:云南省普洱祖祥高山茶园有限公司。
1.1.2 化学试剂
儿茶素、没食子酸、表儿茶素、表没食子儿茶素、表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯、没食子儿茶素、儿茶素没食子酸酯、没食子儿茶素没食子酸酯、鞣花酸、咖啡碱、杨梅素、槲皮素、木犀草素、山奈酚标准品(纯度均≥98%):成都曼思特生物科技有限公司;γ-氨基丁酸、天冬氨酸、谷氨酸、丝氨酸、组氨酸、甘氨酸、苏氨酸、精氨酸、丙氨酸、酪氨酸、半胱氨酸、甲硫氨酸、苯丙氨酸、异亮氨酸、亮氨酸、赖氨酸、脯氨酸标准品(纯度均≥98%):美国安捷伦公司;茶氨酸标准品(纯度≥98%):中国食品药品检定研究院;甲醇、乙腈(均为色谱纯):美国Sigma公司;制霉菌素(效价5 390 U/mg):上海源叶生物科技有限公司;细菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:生工生物工程(上海)股份有限公司;DNA聚合酶(SU/μL):南京诺唯赞生物科技公司;DNA分子质量标准试剂、DNA染料:上海捷瑞生物工程公司;DNA引物:北京擎科生物科技有限公司。
1.1.3 培养基
牛肉膏蛋白胨培养基、MRS液(固)体培养基:青岛高科技工业园海博生物技术有限公司;营养琼脂:北京奥博星生物技术有限责任公司。
756CRT型紫外可见分光光度计:上海菁华科技仪器有限公司;CP214型电子分析天平:上海奥豪斯仪器有限公司;1200型高速液相色谱:美国安捷伦公司;K6600-A全波长酶标仪:北京凯奥科技发展有限公司;CT15RE型离心机:日本日立公司;M150型显微镜:麦克奥迪实业集团有限公司;Trident960型基因扩增仪:力康生物医疗科技控股有限公司;DYY-2C电泳仪:北京市六一仪器厂;RHS-250-Ⅱ型生化培养箱:上海跃进医疗器械有限公司;HH-S28S型数显恒温水浴锅:金坛市大地自动化仪器厂;HH-S28S型电热恒温水浴锅:北京市永光明医疗仪器有限公司;YS6060型色差仪:深圳市三恩时科技有限公司。
1.3.1 菌株的分离鉴定
称取10 g普洱茶发酵样品于90 mL无菌水中,制备菌悬液,将菌悬液进行10倍系列梯度稀释,取稀释液分别涂布于牛肉膏蛋白胨培养基、MRS固体培养基,37 ℃条件下培养48 h后,挑取单菌落在MRS固体培养基上多次分离纯化得到单菌落。通过形态学观察及分子生物学技术对筛选菌株进行鉴定。
形态学观察:菌落形态及革兰氏染色鉴定参照《微生物学实验手册》[27]、《伯杰细菌鉴定手册》[28]和《常见细菌系统鉴定手册》[29]进行。将筛选菌株接种于MRS培养基,37 ℃培养48 h后,观察菌株菌落形态;对菌株进行革兰氏染色[29],观察菌株细胞形态[30]。
分子生物学鉴定:使用细菌DNA提取试剂盒提取筛选菌株总基因组DNA,以其为模版,采用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')、1492R(5'-TACGGCTACCTTGTTACGACTT-3')对菌株16S rRNA基因序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增[31]。PCR扩增体系(25.0 μL):2×SanTaq PCR Mix(12.5 μL),引物27F(10 μmol/L,1.0 μL),引物1492R(10 μmol/L,1.0 μL),DNA模板(2.0μL),双蒸水(ddH2O)(8.5μL)。PCR扩增程序:95℃,5 min;(95 ℃,30 s;55 ℃,30 s;72 ℃,1.5 min)×35个循环:72 ℃,10 min;16 ℃反应结束。采用1%琼脂糖凝胶电泳对PCR扩增产物检测合格后,委托生工生物工程股份有限公司进行测序。将测序结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,利用基于局部比对搜索工具(basic local alignment search tool,BLAST)进行同源序列比对,使用MAGA7.0软件中的邻接(neighbor joining,NJ)法构建系统发育树[32]。
1.3.2 普洱熟茶的制备
将筛选菌株接种于MRS液体培养基中,培养条件为37 ℃、200 r/min摇床培养24 h。将筛选菌株培养液离心后收集菌体,经无菌水洗涤、稀释菌体;利用血球计数板计数法[33]结合稀释涂布平板菌落计数法[34]对筛选菌株菌进行计数,用无菌水将菌液调整至1×108 CFU/mL,制备得到筛选菌株发酵剂。
于9 L蒸馏水加入30 kg晒青茶,发酵制备普洱熟茶,在发酵13 d、24 d、30 d、36 d时进行翻堆,分别在发酵30 d和36 d按照106 CFU/g接种量依次接入筛选菌株发酵剂,混匀,发酵41 d后终止发酵,接菌发酵普洱熟茶样品命名为WF。以不接菌发酵普洱熟茶样品为对照(CK)。用五点取样法取样,混匀分为两份样品,一份用于稀释涂布平板菌落计数,并对计数菌落进行革兰氏染色和16S rDNA序列分析鉴定,然后干燥用于感官评价及理化指标测定,另一份-80 ℃贮藏用于细菌群落分析。
1.3.3 普洱熟茶样品中细菌DNA提取及高通量测序
采用细菌DNA提取试剂盒提取普洱熟茶样品的细菌基因组DNA,以稀释后的基因组DNA(1 ng/μL)为模板,应用515F和806R引物、PhusionR High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶扩增细菌16S rRNA基因的V3-V4区。委托北京诺禾致源科技股份有限公司,应用NovaSeq 6000测序平台对PCR产物进行高通量测序。对测序数据通过DADA2进行降噪,并过滤掉丰度<5的序列,从而获得最终的扩增子序列变异(amplicon sequence variants,ASVs)。对于得到的ASVs的代表序列利用Silva 138.1数据库进行物种注释,分析物种丰度与分布情况。
1.3.4 分析检测
采用稀释涂布平板计数法[34]测定凝结魏茨曼氏菌数量;参照国标GB/T 8305—2013《茶水浸出物》[35]测定水浸出物含量;参照国标GB/T 8314—2013《茶游离氨基酸总量的测定》[36]测定游离氨基酸含量;参照国标GB/T 8313—2018《茶叶中茶多酚和儿茶素类含量的检测方法》[37]测定茶多酚含量;采用茶叶蒽酮硫酸法[38]测定可溶性糖的含量;采用萃取比色法[39]检测茶色素含量;采用高效液相色谱法[40]测定氨基酸、儿茶素、咖啡碱含量[41];参照国标GB/T 23776—2018《茶叶感官审评方法》[42]进行感官评价;采用定量描述分析法[43]评价茶汤特征滋味,分数从0(无)到9(非常强烈);采用色差仪测定茶汤的颜色参数。
1.3.5 数据处理与统计分析
采用IBM SPSS statistics 22.0软件进行数据处理和统计分析,结果以“平均值±标准差”表示,统计分析采用最小显著差异(least significance difference,LSD)方差分析方法,显著性以P<0.05表示;利用GraphPad Prism 8.0进行柱形图的绘制,TBtools 1.108对归一化后的数据进行聚类热图的绘制,Origin 2022绘制茶汤滋味雷达图,差异生物标志物采用诺禾致源云平台(https://magic.novogene.com)进行线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)分析。
普洱熟茶样品WF中分离纯化出1株菌,命名为PETB0001。菌株PETB0001于MRS培养基,37 ℃静置培养48 h后,其菌落和细胞形态见图1。由图1a可知,菌株PETB0001的菌落呈圆形、乳白色、中心凸起,有光泽且不透明,边缘较规则;由图1b可知,菌株PETB0001革兰氏染色阳性、杆状、两端钝圆。

图1 菌株PETB0001的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain PETB0001
以菌株PETB0001的DNA为模板,扩增得到碱基长度为1 427 bp的16S rDNA序列,下载近缘模式物种16S rDNA序列,应用邻接法构建系统发育树,结果见图2。由图2可知,菌株PETB0001(GenBank序列号:PP159045)与凝结魏茨曼氏菌(Weizmannia coagulans)(NR115580.1、NR041523.1和NR115727.1)聚为一个分支,序列相似度为98.6%~99.2%。因此,菌株PETB0001被鉴定为凝结魏茨曼氏菌(Weizmannia coagulans)。

图2 基于16S rDNA基因序列菌株PETB0001的系统发育树
Fig.2 Phylogenetic tree of strain PETB0001 based on 16S rDNA gene sequences
按传统方法进行普洱熟茶发酵,在30 d和36 d接入凝结魏茨曼氏菌PETB0001发酵,制备凝结魏茨曼氏菌发酵样品(WF),以未接菌发酵样品为对照(CK)。两类普洱熟茶样品中凝结魏茨曼氏菌MRS平板菌落计数结果见图3。由图3a和3b可知,WF样品中凝结魏茨曼氏菌多于CK。进一步通过革兰氏染色和16S rDNA序列分析,表明计数菌落为凝结魏茨曼氏菌。由图3c可知,WF样品中凝结魏茨曼氏菌的菌落数为(5.98±1.08)×106 CFU/g,显著高于CK样品[(4.75±0.93)×105 CFU/g](P<0.05),是CK样品的11.59倍。应用16S rRNA基因扩增子测序检测发酵普洱熟茶归类为凝结魏茨曼氏菌的序列reads数(图3d)。由图3 d可知,WF样品的凝结魏茨曼氏菌reads数(162.00±26.85)显著高于CK样品(72.00±4.41)(P<0.05),是CK样品的19.31倍。

图3 普洱熟茶样品中凝结魏茨曼氏菌的生长及菌落数
Fig.3 Growth and colony number of Weizmannia coagulans in ripened Pu-erh tea samples
以未接菌发酵制备普洱熟茶为对照(CK),普洱熟茶样品中细菌丰富度与α多样性指数见表1。由表1可知,经过QIIME2软件检查并剔除嵌合体序列等序列后,得到559~716个细菌操作分类单元(operational taxonomic units,OTUs)。接菌发酵普洱熟茶(WF)细菌的丰富度和α多样性均低于对照(CK),发酵中凝结魏茨曼氏菌与其他微生物之间相互作用(如共生和拮抗作用),以及发酵茶化学成分的不断变化,改变了普洱熟茶发酵菌群结构。
表1 普洱熟茶样品中细菌群落的丰富度及α多样性指数
Table 1 Richness and alpha diversity indexes of bacterial communities in ripened Pu-erh tea samples

茶样 Observed_OTUs/个 Chao1指数 Shannon指数 Simpson指数CK WF 715±264 559±172 716.39±263.38 560.13±171.60 5.76±0.87 5.13±0.49 0.93±0.02 0.92±0.01
普洱熟茶样品中细菌门水平和属水平的细菌群落结构见图4。由图4a可知,WF样品在门水平中优势细菌为变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、厚壁菌门(Firmicutes),相对丰度分别为38.7%、33.7%和20.6%,CK样品的优势细菌为变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、厚壁菌门(Firmicutes),相对丰度分别为42.6%、31.8%、13.3%。由图4b可知,WF样品在属水平中优势细菌主要为假单胞菌(Pseudomonas)、短状杆菌(Brachybacterium),相对丰度分别为21.0%、20.9%,其次是短杆菌(Brevibacterium)、芽孢杆菌(Bacillus),相对丰度分别为8.1%、5.0%;而CK样品优势细菌属主要为假单胞菌(Pseudomonas)、短状杆菌(Brachybacterium),相对丰度分别为24.0%、20.8%,其次是葡萄球菌(Staphylococcus)、短杆菌(Brevibacterium),相对丰度分别为6.1%、5.3%。WF样品芽孢杆菌属的相对丰度(5.0%)显著高于CK样品(0.8%)(P<0.05)。
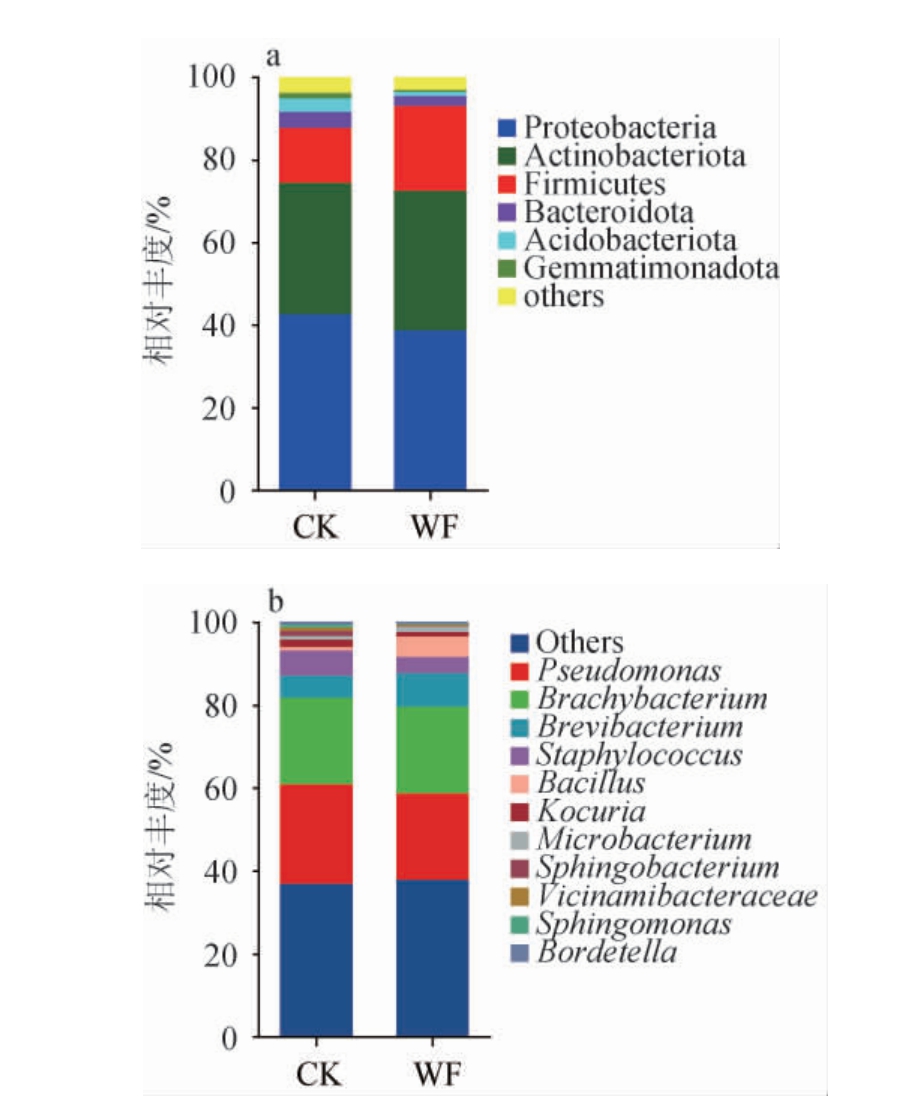
图4 基于门(a)及属(b)水平普洱熟茶样品中细菌群落结构
Fig.4 Bacterial community structure of ripened Pu-erh tea samples based on phyla (a) and genera (b) levels
进一步应用LEfSe比较2组发酵样品细菌群落结构,结果见图5。由图5可知,以线性判别分析(linear discriminant analysis,LDA)阈值>4的条件筛选得到WF样品中差异生物标志物,主要包括厚壁菌门(Firmicutes)、杆菌纲(Bacilli)、芽孢杆菌目(Bacillales)、伯克氏菌目(Burkholderiales)、芽孢杆菌科(Bacillaceae)、产碱菌科(Alcaligenaceae)、短杆菌科(Brevibacteriaceae)、短杆菌属(Brevibacterium)、芽孢杆菌属(Bacillus)、凝结芽孢杆菌(Bacillus coagulans);而CK样品中差异生物标志物为肠杆菌目(Enterobacterales)、葡萄球菌目(Staphylococcales)、葡萄球菌科(Staphylococcaceae)、葡萄球菌属(Staphylococcus)。LEfSe进一步证实,接入的凝结魏茨曼氏菌(原名凝结芽孢杆菌)成为WF样品的标志物,综合平板计数和reads数目结果,本研究开发了这一种普洱熟茶富含凝结魏茨曼氏菌。
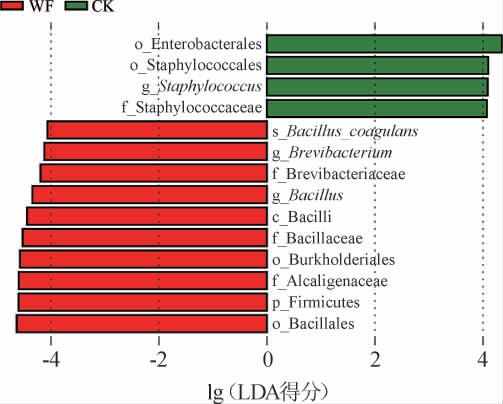
图5 普洱熟茶样品中差异生物标志物线性判别分析效应大小分析
Fig.5 Linear discriminant analysis effect size analysis of differential biomarker in ripened Pu-erh tea samples
发酵样品的干茶、茶汤、茶底的感官评价结果见表2和图6。由表2、图6a和图6b可知,经发酵后,茶样的茶汤均呈褐红色,滋味醇厚、回甘,香气陈香纯正;但WF样品较CK样品的干茶色泽更深,茶汤更明亮,香气果香更浓郁,滋味更浓醇。由图6c可知,WF样品的明亮度L*值(35.11±0.01)、红绿a*值(44.88±0.01)和黄蓝b*值(56.35±0.05)较CK样品均显著增加(P<0.05),这进一步说明了WF样品具有更深的褐红色。由图6d可知,WF样品的甜度、厚重感和香气较CK样品显著增加(P<0.05),而涩味较对照降低。综合来看,WF样品较CK样品感官风味得到提升,表现在干茶及茶汤的颜色更褐红和明亮,滋味和香气特征更突出。
表2 普洱熟茶样品的感官评价结果
Table 2 Sensory evaluation results of ripened Pu-erh tea samples

样品 外形 香气 汤色 滋味 叶底CK WF条索紧结,较红褐,较匀整条索紧结,红褐,匀整陈香纯正,较持久陈香,果香浓郁,持久褐红尚明亮褐红较明亮较醇厚,带回甘,带涩浓醇,甜,回甘红褐,柔软,较匀齐红褐,柔软,匀齐

图6 普洱熟茶样品的感官特征
Fig.6 Sensory characteristics of ripened Pu-erh tea samples
为了评估通过冲泡饮用,是否可以摄入活的益生菌,应用60~80 ℃冲泡发酵样5 min,平板计数结果发现,凝结魏茨曼氏菌的数目未降低。这与MAJEED M等[44]研究在含有凝结魏茨曼氏菌芽孢的红茶、绿茶和乌龙茶经70~80 ℃冲泡10 min后,凝结魏茨曼氏菌芽孢数目未显著降低结果一致。
普洱熟茶的特征成分测定结果见图7。由图7可知,WF茶样的可溶性糖[(5.68±0.67)%]、茶红素[(1.32±0.03)%]、咖啡碱[(49.32±0.73)mg/g]、甲硫氨酸[(0.53±0.19)mg/g]、儿茶素[(0.19±0.01)mg/g]、表儿茶素[(0.12±0.06)mg/g]、表没食子酸儿茶素[(0.09±0.01)mg/g]、表没食子儿茶素没食子酸酯[(0.05±0.00)mg/g]、花旗松素[(0.03±0.00)mg/g]的含量显著高于对照(P<0.05或P<0.01),这与感官审评接菌发酵茶样干茶及茶汤的颜色更褐红,甜味和厚重感更显著的结果相符。而WF茶样的茶多酚[(5.51±0.66)%]、鞣花酸[(1.20±0.35)mg/g]、儿茶素没食子酸酯[(0.06±0.01)mg/g]、水浸出物[(43.65±0.70)%]、天冬氨酸[(1.90±0.00)mg/g]、缬氨酸[(1.73±0.08)mg/g]、脯氨酸[(0.09±0.00)mg/g]、茶氨酸[(0.04±0.00)mg/g]、丝氨酸[(0.02±0.00)mg/g]、酪氨酸[(0.03±0.00)mg/g]、茶碱[(0.06±0.00)mg/g]、杨梅素含量显著或极显著低于对照(P<0.05或P<0.01),这些茶叶特征成分的变化也与传统普洱茶发酵过程中物质的变化相似[45],且与接菌发酵茶样茶汤涩味较低感官评价结果一致。
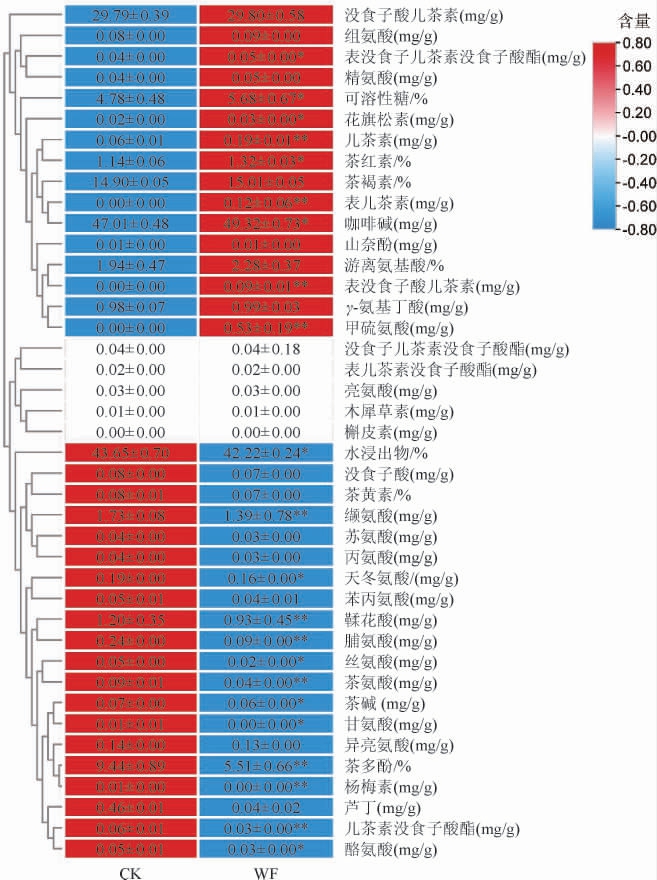
图7 普洱熟茶样品的特征成分含量测定结果
Fig.7 Determination results of characteristic components contents in ripened Pu-erh tea samples
“*”表示差异显著(P<0.05),“**”表示差异极显著(P<0.01)。
本研究从普洱熟茶中分离鉴定得到一株凝结魏茨曼氏菌(Weizmannia coagulans)PETB0001,将该菌接入发酵中,制备得到凝结魏茨曼氏菌的数量较对照显著增加的普洱熟茶。接菌发酵茶样的成分与不接菌的对照不同,且果香、滋味醇厚度和甜度较对照显著增加,而涩味较对照降低。作为一种富含益生菌并且风味较好的普洱熟茶,具有一定的市场潜力。
[1]GUPTA R S,PATEL S,SAINI N,et al.Robust demarcation of 17 distinct Bacillus species clades,proposed as novel Bacillaceae genera,by phylogenomics and comparative genomic analyses:description of Robertmurraya kyonggiensis sp.Nov.and proposal for an emended genus Bacillus limiting it only to the members of the subtilis and cereus clades of species[J].Int J Syst Evol Micrrobiol,2020,70(11):5753-5798.
[2]HAMMER B W.Bacteriological studies on the coagulation of evaporated milk[J].Iowa Agric Exp Stn Res Bull,1915,19:119-131.
[3]ÖZÜSAGˇLAM M A.Importance of Bacillus coagulans bacterium as probiotic in animal nutrition[J].SDU J Agr,2010,5:50-57.
[4]KONURAY G, ERGINKAYA Z.Potential use of Bacillus coagulans in the food industry[J].Foods,2018,7(6):92.
[5]金迅,刘冬梅,阮晖.凝结芽孢杆菌13002的益生特性[J].食品工业科技,2018,39(6):97-101.
[6]ZHANG S,LI P,LEE S,et al.Weizmannia coagulans:an ideal probiotic for gut health[J].Food Sci Hum Well,2024,13(1):16-26.
[7]LI L,LIU B,CAO J,et al.Different effects of Bacillus coagulans vegetative cells and spore isolates on constipation-induced gut microbiota dysbiosis in mice[J].Food Funct,2022,13(18):9645-9657.
[8]BARON M.A patented strain of Bacillus coagulans increased immune response to viral challenge[J].Postgrad Med,2009,121(2):114-118.
[9]MAJEED M,MAJEED S,NAGABHUSHANAM K,et al.Evaluation of probiotic Bacillus coagulans mtcc 5856 viability after tea and coffee brewing and its growth in git hostile environment[J].Food Res Int,2019,121:497-505.
[10]EFSA B P.Scientific opinion on the maintenance of the list of QPS biological agents intentionally added to food and feed[J].Efsa J,2013,11(11):3449-3556.
[11]ENDRES J R,CLEWELL A E,JADE K A,et al.Safety assessment of a proprietary preparation of a novel probiotic,Bacillus coagulans,as a food ingredient[J].Food Chem Toxicol,2009,47:1231-1238.
[12]KOPACZ K,PHADTARE S.Probiotics for the prevention of antibioticassociated diarrhea[J].Healthcare,2022,10(8):1450.
[13]董惠钧,姜俊云,郑立军,等.新型微生态益生菌凝结芽孢杆菌研究进展[J].食品科学,2010,31(1):292-294.
[14]CAO J,YU Z,ZHANG Q,et al.Effects of Bacillus coagulans GBI-30,6086 as an adjunct starter culture on the production of yogurt[J].Food Res Int,2022,160:111398.
[15]LAVRENTEV F V,ASHIKHMINA M S,ULASEVICH S A,et al.Perspectives of Bacillus coagulans MTCC 5856 in the production of fermented dairy products[J].LWT-Food Sci Technol,2021,148:111623.
[16]张媛媛,杨启良,陈绍民,等.凝结芽胞杆菌发酵三七叶茶抗氧化活性及其香气成分研究[J].食品与发酵工业,2023,49(10):9-16.
[17]张秀江,胡虹,向凌云,等.饲用凝结芽孢杆菌益生机理及发酵制备工艺研究进展[J].饲料工业,2022,43(23):55-60.
[18]LIU J,HE D,XING Y,et al.Effects of bioactive components of Pu-erh tea on gut microbiomes and health:a review[J].Food Chem,2021,353:129439.
[19]LV H,ZHANG Y,LIN Z,et al.Processing and chemical constituents of Pu-erh tea:a review[J].Food Res Int,2013,53(2):608-618.
[20]WANG C,LI J,WU X,et al.Pu-erh tea unique aroma:volatile components,evaluation methods and metabolic mechanism of key odor-active compounds[J].Trends Food Sci Tech,2022,124:25-37.
[21]WANG S, QIU Y, GAN R, et al.Chemical constituents and biological properties of Pu-erh tea[J].Food Res Int,2022,154:110899.
[22]ZHU M,LI N,ZHOU F,et al.Microbial bioconversion of the chemical components in dark tea[J].Food Chem,2020,312:126043.
[23]MA C,MA B,ZHOU B,et al.Pile-fermentation mechanism of ripened Pu-erh tea: omics approach,chemical variation and microbial effect[J].Trends Food Sci Tech,2024,146:104379.
[24]李晨晨,吕杰,杨瑞娟,等.普洱茶渥堆发酵过程中嗜热细菌的分离和鉴定[J].北京化工大学学报(自然科学版),2012,39(2):74-78.
[25]ZHANG Y,SKAAR I,SULYOK M,et al.The microbiome and metabolites in fermented Pu-erh tea as revealed by high-throughput sequencing and quantitative multiplex metabolite analysis[J].Plos One,2016,11(6):1-18.
[26]ZHAO M,XIAO W,MA Y,et al.Structure and dynamics of the bacterial communities in fermentation of the traditional Chinese post-fermented Pu-erh tea revealed by 16s rRNA gene clone library[J].World J Microb Biot,2013,29(10):1877-1884.
[27]周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986:263-266.
[28]BUCHANAN R E,GIBONS N E.(中国科学院微生物研究所翻译组译).伯杰细菌鉴定手册(第8版)[M].北京:科学出版社,1984:660-759.
[29]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:267-300.
[30]单春乔,刘秋晨,李娟,等.凝结芽孢杆菌检测方法的建立[J].饲料研究,2020,43(12):84-87.
[31]ZHAO J,JIANG Y,GONG L,et al.Mechanism of β-cypermethrin metabolism by Bacillus cereus GW-01[J].Chem Eng J,2022,430:132961.
[32]SAITO N,NEI M.The neighbor-joining method: a new method for reconstructing phylogenetic trees[J].Mol Biol Evol,1987,4:406-425.
[33]吕加平.酸奶中乳酸菌镜检涂片的特殊染色法[J].微生物学通报,1999(4):281-282.
[34]SUN T,MIAO H,ZHANG C,et al.Effect of dietary Bacillus coagulans on the performance and intestinal microbiota of weaned piglets[J].Animal,2022,16(7):100561.
[34]中国国家标准化管理委员会,中华人民共和国国家质量监督检验检疫总局.GB/T 8305—2013 茶水浸出物测定[S].北京:中国标准出版社,2013.
[35]中国国家标准化管理委员会,中华人民共和国国家质量监督检验检疫总局.GB/T 8314—2013 茶游离氨基酸总量的测定[S].北京:中国标准出版社,2013.
[36]中国国家标准化管理委员会,国家市场监督管理总局.GB/T 8313—2018 茶叶中茶多酚和儿茶素类含量的检测方法[S].北京:中国标准出版社,2018.
[37]ZHAO M, ZHANG D, SU X, et al.An integrated metagenomics/metaproteomics investigation of the microbial communities and enzymes in solid-state fermentation of Pu-erh tea[J].Sci Rep-Uk,2015,5(1):10117.
[38]张正竹.茶叶生物化学实验教程[M].北京:中国农业出版社,2009.
[39]刘琨毅,王利妍,安江珊,等.阿曲霉接菌发酵普洱茶的研究[J].轻工学报,2022,37(4):1-9.
[40]NIAN B,CHEN L,YI C,et al.A high performance liquid chromatography method for simultaneous detection of 20 bioactive components in tea extracts[J].Electrophoresis,2019,40(21):2837-2844.
[42]中国国家标准化管理委员会,中华人民共和国国家质量监督检验检疫总局.GB/T 23776—2018 茶叶感官审评方法[S].北京:中国标准出版社,2018.
[43]FAN F, HUANG C, TONG Y, et al.Widely targeted metabolomics analysis of white peony teas with different storage time and association with sensory attributes[J].Food Chem,2021,362:130257.
[44]MAJEED M,MAJEED S,NAGABHUSHANAM K,et al.Evaluation of probiotic Bacillus coagulans MTCC 5856 viability after tea and coffee brewing and its growth in git hostile environment[J].Food Res Int,2019,121:497-505.
[45]孟宪钰,付亚轩,李明超,等.普洱熟茶化学成分研究进展[J].食品与发酵工业,2019,45(12):285-290.