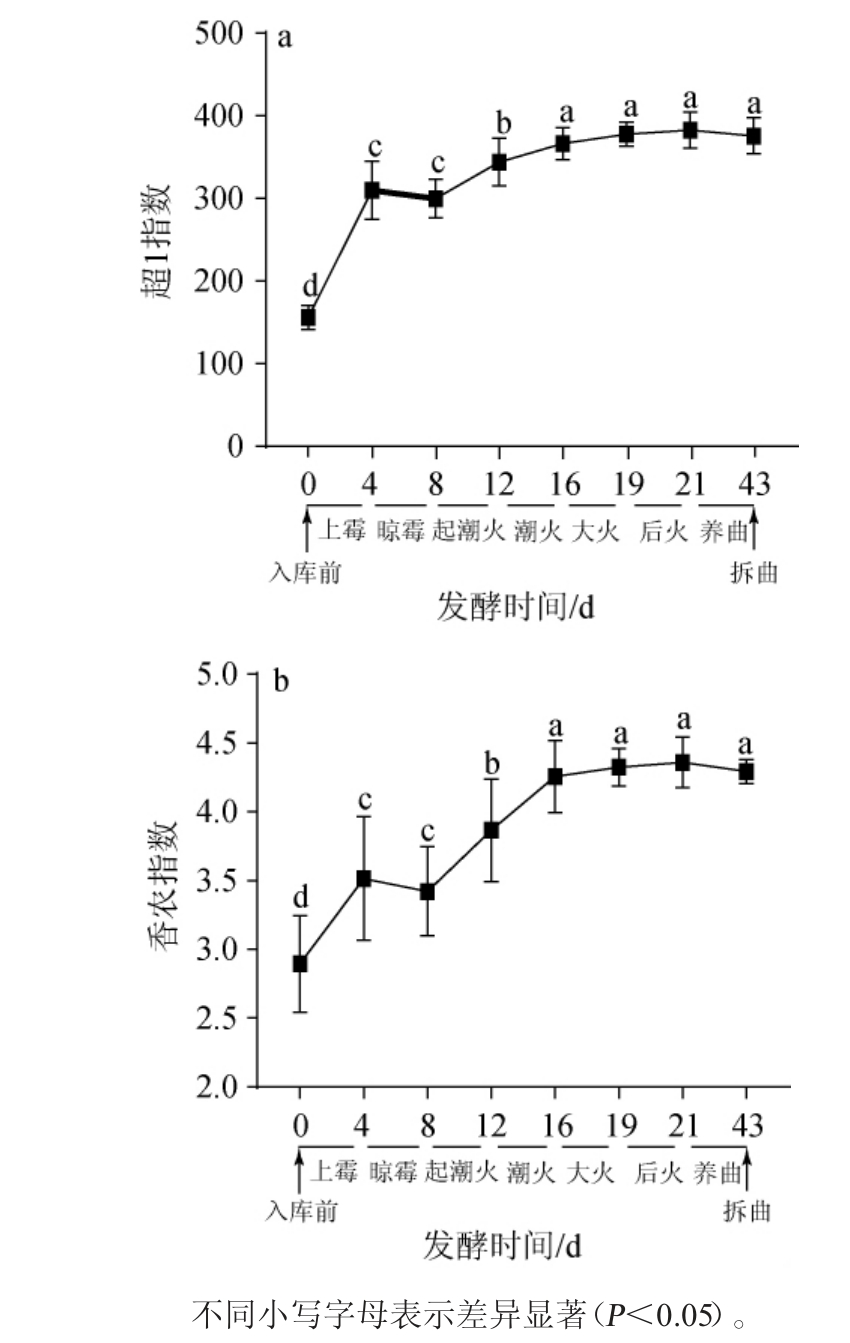
图1 不同发酵阶段低温大曲样品中真菌菌群的超1指数(a)及香农指数(b)曲线
Fig.1 Chao1 index (a) and Shannon index (b) curves of fungal flora of low-temperature Daqu with different fermentation stages
Analysis of fungal flora diversity in low-temperature Daqu with different fermentation stages
清香型白酒作为三大香型白酒之一,其酿造采用地缸固态发酵,经历两次加曲、两次发酵和两次蒸酒,俗称为“清蒸二次清”[1]。低温大曲作为酿造清香型白酒的糖化发酵剂,采用豌豆和大麦为主要原料,经过上霉、晾霉、起潮火、潮火、大火、后火和养曲7个阶段发酵而来,最终富集到丰富的酶和微生物,它们在酿酒过程中发挥了重要作用[2]。近年来,为了提升白酒的酿酒效率和品质,大曲越来越被重视[3-5]。已有的研究发现,低温大曲中的霉菌主要为根霉菌属(Rhizopus)、根毛霉菌属(Rhizomucor)和曲霉菌属(Aspergillus)[3,6],酵母菌主要为酵母菌属(Saccharomyces)、覆膜孢酵母菌属(Saccharomycopsis)和毕赤酵母菌属(Pichia)[6-7],细菌主要为芽孢杆菌属(Bacillus)和乳酸菌类群[6-8],这些菌群能够产生多种水解酶、风味化合物及其前体物质[9-10]。
目前,大曲在发酵过程中的微生物群落演替亦是科研工作者关注的重点。HU Y L等[11]研究了白云边酒业生产的高温大曲在140 d发酵周期中的微生物群落变化,结果发现,Bacillus和嗜热放线菌属(Thermomyces)等耐热微生物在大曲发酵的各个阶段均占优势,尤其是在第7~38天的高温期。在发酵的前110 d,细菌的丰富度和多样性高于真菌,但在发酵结束时结果相反。ZHU M等[12]研究发现,中温大曲的整个发酵过程根据温度可分为3个阶段,真菌在早期活跃,而细菌在中后期活跃,环境湿度和二氧化碳与大多数真菌呈正相关,但与高温放线菌(Thermoactinomyces)、糖多孢菌(Saccharopolyspora)和不动杆菌(Acinetobacter)呈负相关,且真菌编码的与糖化和乙醇发酵相关的酶可能与嗜热子囊菌(Thermoascus)和Thermomyces的高丰度一致。然而,目前低温大曲发酵过程中微生物类群如何演替尚不明确,对其展开研究对低温大曲的制曲工艺改良具有积极意义。
本研究采用Illumina MiSeq高通量测序技术对入库前、上霉、晾霉、起潮火、潮火、大火、后火和养曲阶段低温大曲中的真菌类群分别进行解析,同时分析低温大曲整个发酵过程中的核心真菌类群、入库前、后样本的特有真菌类群,以期揭示低温大曲发酵过程中的真菌群落结构演替规律,为低温大曲制曲工艺优化升级提供一定的科学理论参考。
不同发酵阶段大曲样品:湖北省某清香型白酒企业;TGuide S96磁珠法土壤/粪便基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司;10×Buffer、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)缓冲液、rTaq DNA聚合酶(5 U/μL):宝生物工程(大连)有限公司;引物ITS3F(5'-GCATCGATGAAGAACGCAGC-3')和ITS4R(5'-TCCTCCGCTTATTGATATGC-3'):上海桑尼生物科技有限公司;Illumina MiSeq测序试剂盒v3:美国Illumina公司。其他试剂均为国产分析纯或生化试剂。
JMR-2703型聚合酶链式反应(polymerase chainreaction,PCR)扩增仪:北京菁美瑞科技有限公司;PowerPac电泳仪:美国Bio-Red公司;MiSeq PE300高通量测序平台:美国Illumina公司;R930机架式服务器:美国DELL公司。
1.3.1 样本采集
于2023年11月21日至2024年1月3日从湖北省某清香型白酒企业的同一制曲车间连续采集发酵第0天、第4天、第8天、第12天、第16天、第19天、第21天和第43天的低温大曲样本,这些采集时间点分别对应低温大曲入库前(0 d)、上霉(1~4 d)、晾霉(5~8 d)、起潮火(9~12 d)、潮火(13~16 d)、大火(17~19)、后火(20~21 d)和养曲阶段(22~43 d)。采集的所有样本均由同一批次原料、同一生产车间和同一班组生产。发酵第0天(入库前)采集7份样本,其他发酵时间点均采集8份样本,每批样本均含有靠门、中间和靠窗位置的样本。采集到的每批样本均于当天运送回实验室进行粉碎并置于-40 ℃备用。
1.3.2 宏基因组DNA的提取和PCR扩增
参照宏基因组DNA提取试剂盒说明书完成低温大曲样本中的DNA提取,以其为模板,使用添加了核苷酸标签序列的正向引物ITS3F和反向引物ITS4R对真菌的内源转录间隔区(internally transcribed spacer,ITS)2区进行PCR特异性扩增。PCR扩增体系:DNA模板0.5 μL,10×Buffer 2.5 μL,dNTP mix 2 μL,rTaq DNA聚合酶0.5 μL,引物ITS3F和ITS4R各0.5 μL,双蒸水(ddH2O)18.5 μL。PCR扩增程序参照文献[13]。采用琼脂糖凝胶电泳对PCR扩增产物进行质量检测。
1.3.3 高通量测序和生物信息学分析
将质量合格的PCR扩增产物寄至上海美吉生物医药科技有限公司,使用该公司的Illumina MiSeq PE300平台完成测序,并基于QIIME(v1.9.0)平台完成生物信息学分析[14]。首先根据核苷酸标签信息将下机序列拆分和归并至各样本;然后使用FLASH(v1.2.7)软件对双端序列进行拼接,并参照CAPORASO J G等[15]提出的标准对序列进行质量控制。有效序列按照97%序列相似度构建操作分类单元(operational taxonomic units,OTU)[16],然后采用UCHIME软件(v4.1)对OTU序列进行嵌合体检查,剔除含有嵌合体的OTU[17]。最后基于Unite数据库(v7.2)完成样本中真菌的物种信息注释[18]。基于OTU水平统计所有样本中的核心真菌类群、入库前样本的特有真菌类群和入库后样本的特有真菌类群。
1.3.4 数据处理与统计分析
使用GraphPad Prism 8.3.0软件绘制低温大曲样本中真菌α多样性指数曲线;使用MATLAB 2015b软件进行马氏距离聚类分析并实现数据可视化;使用R(v4.3.2)软件绘制低温大曲中优势真菌类群的百分堆积柱状图。
采用Illumina MiSeq高通量测序从低温大曲样品中共得到3 280 145条有效序列,按照97%序列相似度划分到2 102个OTU。每份样本中平均含有52 065条有效序列和526个OTU。基于OTU数对不同发酵阶段低温大曲样品中真菌菌群的超1指数和香农指数进行计算,结果见图1。

图1 不同发酵阶段低温大曲样品中真菌菌群的超1指数(a)及香农指数(b)曲线
Fig.1 Chao1 index (a) and Shannon index (b) curves of fungal flora of low-temperature Daqu with different fermentation stages
由图1a可知,随着发酵时间的延长,低温大曲样品中真菌菌群的超1指数曲线呈逐渐上升趋势。从入库前至拆曲,低温大曲样品中真菌菌群的超1指数从156上升至376。经显著性检验发现,低温大曲样品中真菌菌群的超1指数依次在上霉、起潮火和潮火阶段出现显著上升趋势(P<0.05),说明低温大曲样品中的真菌菌群丰富度在上霉、起潮火和潮火阶段有明显增加。由图1b可知,真菌菌群香农指数曲线的变化趋势与超1指数曲线相一致,亦随着发酵时间的延长而出现逐渐上升的趋势。从入库前至拆曲,真菌菌群的香农指数从2.90上升至4.29。香农指数亦分别在上霉、起潮火和潮火阶段出现显著上升趋势(P<0.05),说明低温大曲样品中的真菌菌群多样性亦在上霉、起潮火和潮火阶段有明显增加。在上霉阶段,曲块中水分含量最高,空气湿度亦较高,曲堆温度在33 ℃左右,适宜的环境使大曲中真菌丰富度和多样性在经历该阶段后出现大幅度提升[19]。随着发酵的进行,大曲内部微生物生长繁殖产生的生物热不断积累,曲堆温度在起潮火最后时期达到整个发酵的最高点[20]。温度不断上升说明微生物生长繁殖速率较快,所以会观测到微生物丰富度和多样性的显著提升。在潮火阶段,曲块堆积层数会加高一层,目的是减少散热,使温度能够在43 ℃左右维持3~4 d。维持相对高的温度能够将微生物从曲块表层逼进曲块中心生长繁殖,提高原料的利用率,这可能是促进大曲中真菌丰富度和多样性提升的原因之一。
进一步基于非加权UniFrac距离的马氏距离聚类对不同发酵阶段低温大曲样品中的真菌菌群β多样性进行分析,结果见图2。
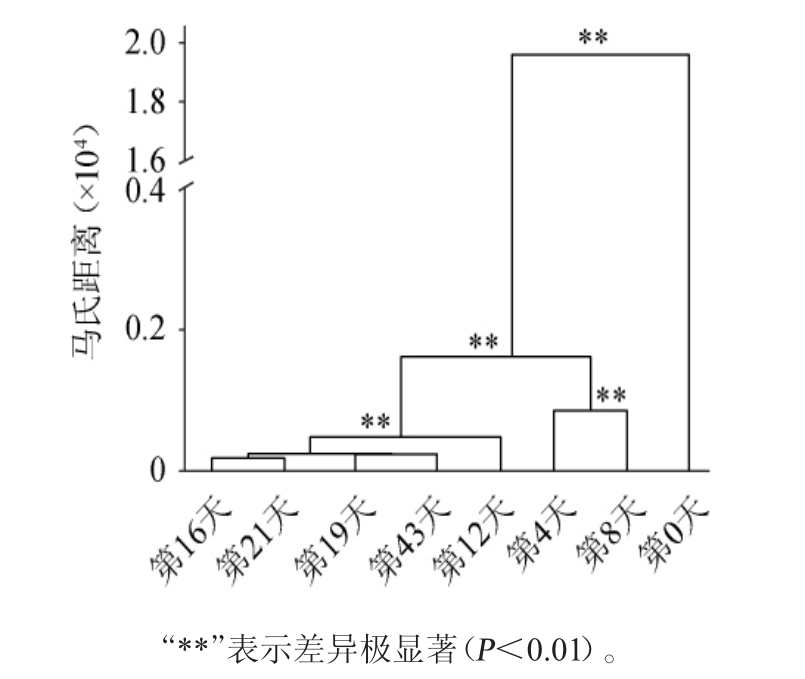
图2 基于非加权UniFrac距离不同发酵阶段低温大曲样品的马氏距离聚类分析
Fig.2 Mahalanobis distance clustering analysis of low-temperature Daqu samples with different fermentation stages based on unweighted UniFrac distance
由图2可知,第0天的样品单独聚为一支,第4天和第8天的样品聚为一支,第12天、第16天、第19天、第21天和第43天的样品聚为一大支。由图2亦可知,第0天、第4天、第8天和第12天的样本间存在极显著差异(P<0.01),而第16天、第19天、第21天和第43天的样本间差异不显著(P>0.05)。即入库前、上霉、晾霉和起潮火阶段的低温大曲样品群落结构各不相同,而潮火、大火、后火和养曲阶段的低温大曲样品群落结构相似。这说明在潮火阶段之前,低温大曲样品中的真菌群落结构会随着发酵的进行而不断发生变化,而经历潮火阶段后,低温大曲的真菌群落结构趋于稳定,不再发生显著变化。潮火阶段的发酵温度较高,说明相对较高的温度能促进大曲微生物群落结构的稳定。XIAOC等[20]研究发现,从入库至发酵温度达到最高点期间,中温大曲中微生物群落演替与温度升高显著相关,而在经历最高温发酵后,微生物群落演替则不再与温度变化存在显著相关性。这一研究亦表明相对高的发酵温度有利于微生物群落结构的稳定。
通过物种注释,从不同发酵阶段低温大曲样品中共注释到4个门、11个纲、21个目、46个科和83个属,分别有0.90%和1.51%的序列未鉴定到门和属水平。基于门和属水平对低温大曲样品中的真菌菌群结构进行分析,并将平均相对丰度>1.0%的门和属定义为优势门和优势属,结果见图3。

图3 基于门(a)和属(b)水平不同发酵阶段低温大曲样品中真菌菌群结构分析结果
Fig.3 Analysis results of fungal flora structure in low-temperature Daqu samples with different fermentation stages based on phylum (a) and genus (b) levels
由图3a可知,在整个发酵过程中低温大曲样品中共注释到3个优势真菌门,分别为子囊菌门(Ascomycota)(68.53%)、毛霉菌门(Mucoromycota)(27.76%)和担子菌门(Basidiomycota)(2.35%)。由图3a亦可知,在入库前和上霉期间,Ascomycota在低温大曲样品中的平均相对丰度为91.47%,而至潮火阶段,Ascomycota的平均相对丰度逐渐下降至54.23%。然而,Mucoromycota的相对丰度在入库前至潮火阶段从0.01%逐渐升高至43.28%。Basidiomycota的相对丰度在整个发酵过程中均较为稳定,未发生较大变化。
由图3b可知,在整个发酵过程中低温大曲中样品共注释到9个优势真菌属,分别为隶属于Ascomycota的Saccharomycopsis(39.55%)、威克汉姆酵母菌属(Wickerhamomyces)(9.23%)、Aspergillus(5.81%)、假丝酵母菌属(Candida)(5.33%)、Saccharomyces(2.81%)和汉逊酵母菌属(Hanseniaspora)(1.15%),隶属于Mucoromycota的Rhizopus(25.73%),隶属于接合菌门(Zygomycota)的梗霉菌属(Lichtheimia)(2.16%),隶属于Basidiomycota 的丝孢酵母菌属(Trichosporon)(2.09%)。值得注意的是,入库前低温大曲样品中以Wickerhamomyces和Saccharomyces为主,其相对丰度分别为50.03%和15.98%,而在入库经历晾霉阶段后,其相对丰度分别下降至5.96%和5.60%,它们可能来源于原料和制曲车间环境。在入库后,低温大曲样品中以Saccharomycopsis和Rhizopus为主,其相对丰度分别为44.45%和28.94%。Saccharomycopsis取代Wickerhamomyces成为相对丰度最高的真菌属,其可能来源于曲房环境和用于保温的稻草。随着发酵的进行,Saccharomycopsis的相对丰度逐渐降低,而Rhizopus的相对丰度逐渐升高,直至潮火期后两者的相对丰度不再发生明显变化,这再次表明较高的温度能够促进大曲中真菌群落结构的稳定。Saccharomycopsis和Saccharomyces等是大曲中显著富集的真菌类群,对大曲糖化力、酸性蛋白酶和乙醇合成具有积极贡献[21]。有研究表明,口囊覆膜酵母(Saccharomycopsis fibuligera)往往在大曲和酒醅中均含有较高比例,并且具有良好的产淀粉酶和产酯特性,在酿酒过程中具有重要的地位[22-23]。Rhizopus具有高产淀粉酶特性,能够代谢淀粉生成酵母菌可直接利用的还原糖,促进酵母菌的生长繁殖[24-25]。
进一步从OTU水平上解析低温大曲从入库前到拆曲出房这一过程中的核心类群,同时解析入库前和入库后的特有真菌类群,结果见表1。将所有样本中均出现的OTU定义为核心OTU,将仅在入库前样本中出现而入库后样本中未出现的OTU定义为入库前样本特有OTU,反之则定义为入库后样本特有OTU。
表1 不同发酵阶段低温大曲样品中的核心真菌类群和特有真菌类群
Table 1 Core and unique fungal flora in low-temperature Daqu with different fermentation stages
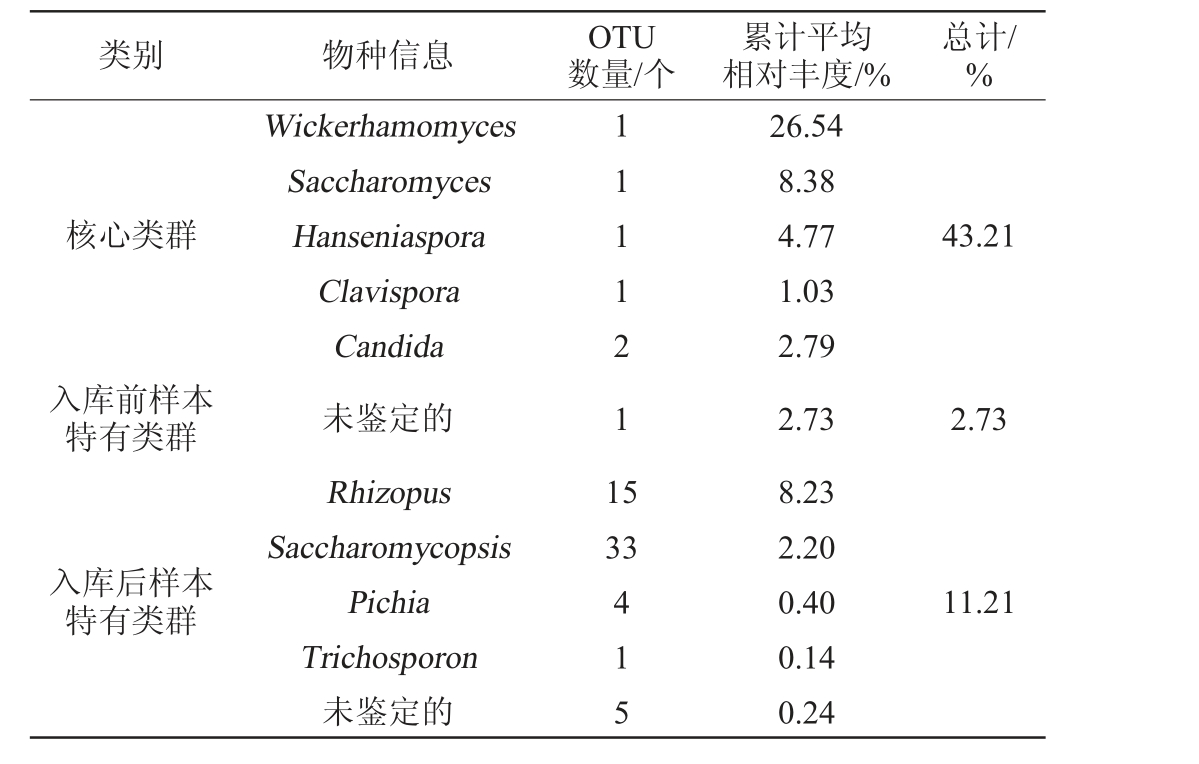
类别 物种信息 OTU数量/个累计平均相对丰度/%总计/%核心类群43.21入库前样本特有类群11112 1 1 5 2.73 Wickerhamomyces Saccharomyces Hanseniaspora Clavispora Candida未鉴定的Rhizopus Saccharomycopsis Pichia Trichosporon未鉴定的33入库后样本特有类群415 26.54 8.38 4.77 1.03 2.79 2.73 8.23 2.20 0.40 0.14 0.24 11.21
由表1可知,从入库前到拆曲出房,低温大曲样品中共含有6个核心OTU,经过序列比对它们隶属于Wickerhamomyces(26.54%)、Saccharomyces(8.38%)、Hanseniaspora(4.77%)、Clavispora(1.03%)和Candida(2.79%),累计平均相对丰度达43.21%。已有的研究表明,隶属于Wickerhamomyces的部分异常威克汉姆酵母菌(Wickerhamomyces anomalus)菌株具有高产乙酸乙酯的能力[26-27]。入库前样本含有1个特有OTU,其相对丰度为2.73%,但未鉴定到门或属水平。入库后样本有58个特有OTU,经过序列比对它们隶属于Rhizopus(8.23%)、Saccharomycopsis(2.20%)、Pichia(0.40%)和Trichosporon(0.14%),有5个OTU未鉴定到门或属水平,累计平均相对丰度为11.21%。由此可见,Wickerhamomyces、Saccharomyces和Hanseniaspora等为低温大曲发酵过程中的核心真菌类群,它们可能是由制曲原料和制曲车间等环境提供,而Rhizopus和Saccharomycopsis是入库后样本中的特有真菌类群,它们可能是由曲房环境提供。
低温大曲发酵过程中,真菌菌群的超1指数和香农指数分别从156和2.90上升至376和4.29,均依次在上霉、起潮火和潮火阶段出现显著提升(P<0.05)。在潮火阶段之前,低温大曲中的真菌群落结构会随着发酵的进行而不断变化,直至潮火阶段后趋于稳定。低温大曲发酵过程中共注释到9个优势真菌属(平均相对丰度>1.0%),包括Saccharomycopsis、Wickerhamomyces、Aspergillus等,在入库前,以Wickerhamomyces和Saccharomyces为主,而在经历上霉阶段后,以Saccharomycopsis和Rhizopus为主。发酵过程中的核心菌群为Wickerhamomyces、Saccharomyces和Hanseniaspora等,而入库后样本的特有类群为Rhizopus和Saccharomycopsis等,初步分析它们可能是由曲房环境提供。综上,上霉、起潮火和潮火阶段对低温大曲中真菌丰富度和多样性的提升具有促进作用,且潮火阶段对大曲中真菌群落结构的稳定亦有着积极影响。
[1]徐娟,刘忠军,钟吉安,等.基于仿生学和GC-IMS技术分析市售不同酒曲清香型白酒的风味特征[J].中国酿造,2023,42(12):244-248.
[2]ZHENG Y F, LIANG F, WU Y, et al.Unraveling multifunction of lowtemperature Daqu in simultaneous saccharification and fermentation of Chinese light aroma type liquor[J].Int J Food Microbiol,2023,397(7):110202.
[3]WU Q,ZHU Y,FANG C,et al.Can we control microbiota in spontaneous food fermentation?-Chinese liquor as a case example[J].Trends Food Sci Technol,2021,110(4):321-331.
[4]LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[5]WANG P,WU Q,JIANG X J,et al.Bacillus licheniformis affects the microbial community and metabolic profile in the spontaneous fermentation of Daqu starter for Chinese liquor making[J].Int J Food Microbiol,2017,250:59-67.
[6]XIANG F S,CAI W C,HOU Q C,et al.Comparative analysis of the microbial community structure in light-flavor Daqu in Taiyuan and Suizhou regions,China[J].LWT-Food Sci Technol,2023,177(3):114599.
[7]CAI W C, WANG Y R, NI H, et al.Diversity of microbiota, microbial functions,and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150(12):110734.
[8]ZONG E,BO T,DANG L,et al.Different functions can be provided by low temperature Daqu with different appearance features due to variations in the microbial community structure during fermentation[J].LWT-Food Sci Technol,2024,193(2):115763.
[9]LE V D, ZHENG X W, CHEN J Y, et al.Characterization of volatile compounds in Fen-Daqu-a traditional Chinese liquor fermentation starter[J].J I Brewing,2012,118(1):107-113.
[10]ZHENG X W, TABRIZI M R, NOUT M J R, et al.Daqu-a traditional Chinese liquor fermentation starter[J].J I Brewing,2011,117(1):82-90.
[11]HU Y L,DUN Y H,LI S,et al.Changes in microbial community during fermentation of high-temperature Daqu used in the production of Chinese'Baiyunbian'liquor[J].J I Brewing,2017,123(4):594-599.
[12]ZHU M,ZHENG J,XIE J,et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Res Int,2022,153(3):110955.
[13]朱祎一,文安燕,王琴,等.贵州望谟板栗冷藏期致腐真菌鉴定及其生物学特性研究[J].食品与发酵工业,2023,49(8):113-120.
[14]KUCZYNSKI J,STOMBAUGH J,WALTERS W A,et al.Using QIIME to analyze 16S rRNA gene sequences from microbial communities[J].Curr Protoc Microbiol,2012,27(1):1E.5.1-1E.5.2.
[15]CAPORASO J G,KUCZYNSKI J,STOMBAUGH J,et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods,2010,7(5):335-336.
[16]WEI Z G,ZHANG X D,CAO M,et al.Comparison of methods for picking the operational taxonomic units from ampliconsequences[J].Front Microbiol,2021,12(3):644012-644026.
[17]EDGAR R C, HAAS B J, CLEMENTE J C, et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics,2011,27(16):2194-2200.
[18]KÕLJALG U,NILSSON R H,ABARENKOV K,et al.Towards a unified paradigm for sequence-based identification of fungi[J].Mol Biol,2013,22(21):5271-5277.
[19]刘慧,涂璇,吕育财,等.中高温大曲在制曲过程中微生物区系演替特征及功能研究[J].食品与发酵工业,2022,48(22):180-186.
[20]XIAO C,LU Z M,ZHANG X J,et al.Bio-heat is a key environmental driver shaping the microbial community of medium-temperature Daqu[J].Appl Environ Microbiol,2017,83(23):e01550.
[21]SU C,ZHANG K Z,CAO X Z,et al.Effects of Saccharomycopsis fibuligera and Saccharomyces cerevisiae inoculation on small fermentation starters in Sichuan-style Xiaoqu liquor[J].Food Res Int,2020,137:109425.
[22]JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Technol,2017,63:18-28.
[23]ZHANG X, ZHAO J, DU X.Barcoded pyrosequencing analysis of the bacterial community of Daqu for light-flavor Chinese liquor[J].Lett Appl Microbiol,2014,58(6):549-555.
[24]LONDOÑO-HERNÁNDEZ L, RAMÍREZ-TORO C, RUIZ H A, et al.Rhizopus oryzae-Ancient microbial resource with importance in modern food industry[J].Int J Food Microbiol,2017,257(9):110-127.
[25]FAN Y,HUANG X,CHEN J,et al.Formation of a mixed-species biofilm is a survival strategy for unculturable lactic acid bacteria and Saccharomyces cerevisiae in Daqu, a Chinese traditional fermentation starter[J].Front Microbiol,2020,11(2):510900.
[26]富志磊,马景浩,周泉宇,等.模拟白酒固态发酵中异常威克汉姆酵母的提酯增香作用[J].中国食品学报,2023,23(5):175-183.
[27]FU Z L,SUN B G,LI X T,et al.Isolation and characterization of a high ethyl acetate-producing yeast from Laobaigan Daqu and its fermentation conditions for producing high-quality Baijiu[J].Biotechnol Biotechnological Equip,2018,32(5):1218-1227.