白酒中愈创木酚类化合物研究进展
唐 洁,林 斌,单义民,阮 松,江 威,李 群,杨生智,杨 强,杜佳炜,陈申习*
(劲牌有限公司 劲牌研究院 中药保健食品质量与安全湖北省重点实验室,湖北 黄石 435100)
摘 要:愈创木酚类化合物是广泛存在于我国白酒中的一类重要风味化合物,其中愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚和4-乙烯基愈创木酚具有香味阈值低、活性多样的特点,对白酒香气和品质提升具有重要贡献。该文综述了我国白酒中愈创木酚类化合物种类、功能、检测方法、生成途径及产愈创木酚类微生物研究进展,阐述了白酒中愈创木酚类化合物的健康作用及提升思路,旨在为更好的研究中国白酒中健康活性成分提供参考。
关键词:白酒;愈创木酚类化合物;检测方法;微生物;生成途径
中图分类号:TS261.1
文章编号:0254-5071(2025)01-0001-05
doi: 10.11882/j.issn.0254-5071.2025.01.001
引文格式:唐洁,林斌,单义民,等.白酒中愈创木酚类化合物研究进展[J].中国酿造,2025,44(1):1-5.
收稿日期:2024-01-26
修回日期:2024-05-21
基金项目:湖北省自然科学基金项目(2023AFD026)
作者简介:唐 洁(1987-),女,高级工程师,硕士,研究方向为酿酒微生物。
*通讯作者:陈申习(1986-),男,高级工程师,博士,研究方向为酿造微生物。
Research progress on guaiacol compounds in Baijiu
TANG Jie,LIN Bin,SHAN Yimin,RUAN Song,JIANG Wei,LI Qun,YANG Shengzhi,YANG Qiang,DU Jiawei,CHEN Shenxi*
(Hubei Provincial Key Lab for Quality and Safety of Traditional Chinese Medicine Health Food,Jing Brand Research Institute,Jing Brand Co.,Ltd.,Huangshi 435100,China)
Abstract:Guaiacol compounds are a kind of important flavor compounds widely existing in Chinese Baijiu.Among them,guaiacol,4-methylguaiacol,4-ethylguaiacol, and 4-vinylguaiacol, possessing the characteristics of low flavor threshold and diverse activities, have an important contribution to the improvement of Baijiu aroma and quality.In this paper,the research progress of the varieties,functions,detection methods,production pathways of guaiacol compounds and microorganisms producing guaiacol compounds in Chinese Baijiu was summarized, and the health functions and upgrading ideas of guaiacol compounds in Baijiu were discussed,which could provide reference for better research on the health active ingredients in Chinese Baijiu.
Key words:Baijiu;guaiacol compounds;detection method;microorganism;generation pathway
白酒是一种传统酒精饮料,从西汉开始距今已有2 000多年历史[1]。作为中国的国酒,白酒与白兰地、杜松子酒、朗姆酒、伏特加和威士忌被公认为全球著名的六大蒸馏酒。白酒通常由在固体或半固体状态下使用不同种类酒曲糖化和发酵后的谷物蒸馏而成。中国白酒独特的酿造工艺赋予其独特的香气和生物活性分子特征。目前,白酒中已检测到的化合物有2 020多种,其中有益健康化合物138种,包括酚类、有机酸、酯类、内酯、吡嗪、含硫化合物、萜烯、呋喃、醛类等挥发性化合物,以及氨基酸、多元醇、矿物质、维生素和生物活性肽等非挥发性化合物[2]。据报道,白酒中的挥发性化合物可通过改善肠道微生物群和提高功能性肠道脂肪酸浓度来预防乙醇诱导的肝损伤[3],非挥发性化合物如生物活性肽在细胞模型中显示出显著的抗氧化功能[4]。
酚类物质作为天然的抗氧化剂,广泛存在于食物和饮品中,其对白酒的色泽、味道和香气的形成起着关键作用[3]。愈创木酚类作为酚类化合物的一类,是酱香型、浓香型、清香型和芝麻香型等白酒中的呈香风味物质,由于其香味阈值低,对白酒风格形成具有重要的贡献[5]。同时,愈创木酚类化合物是天然的自由基清除剂,具有良好的活性氧消除功能,可抗氧和预防心血管等疾病的发生[6]。本文就中国白酒的微量健康成分愈创木酚类化合物的种类、功能、检测方法、生成途径及产愈创木酚类微生物研究现状进行总结分析,阐述其健康作用及提升思路,以期为科学认识中国白酒中的生物活性成分提供参考。
1 白酒中愈创木酚类化合物种类及功能
愈创木酚类化合物主要指芳环结构中同时具有酚羟基和邻甲氧基官能团结构的一类化合物,其中,愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚和4-乙烯基愈创木酚是白酒中较为常见的4种。愈创木酚类化合物作为白酒中存在的一类重要的风味化合物,各物质具有不同的风味特征,赋予了白酒烟熏、酱香、丁香和辛香味等不同风格特点。例如,愈创木酚赋予酒体水果香、焦酱香,是茅台酒有“粮香”的关键化合物[7];4-甲基愈创木酚和4-乙基愈创木酚是白酒中普遍存在的呈香、呈味物质,香味阈值分别为314.56 μg/L和617.68 μg/L,对酒体分别贡献酱油香、熏制食品香、水果香、甜香、花香以及烟熏味等[8];4-乙烯基愈创木酚香味阈值较低(209.30 μg/L),风味活性较高,在白酒中呈现出水果香、花香和甜香[9]。
此外,愈创木酚类物质还具有一定的生理活性。例如,4-甲基愈创木酚和4-乙基愈创木酚都是优良的自由基消除剂,具有较好的抗氧化、抗肿瘤和增强人体免疫力的作用[8]。张瞭飞[10]研究发现,细胞抗氧化能力随4-甲基愈创木酚的浓度升高而逐渐升高,在0~4 mmol/L的浓度范围内可以减轻人体肝细胞的氧化损伤。ZHAO D R等[11]研究发现,4-乙基愈创木酚是白酒中天然的有效抗炎成分,通过激活的B细胞核因子kappa-轻链增强子(nuclear factor kappalight-chain-enhancer of activated B cells,NF-κB)/κB抑制因子α(I kappa B alpha,IκBα)/激活蛋白-1(activator protein-1,AP-1)和核因子E2相关因子2/血红素加氧酶-1(nuclear factor erythroid-2-related actor 2/heme oxygenase 1,Nrf2/HO-1)信号通路改善脂多糖(lipopolysaccharide,LPS)诱导的人单核细胞白血病(human monocytic cell leukemia,THP-1)细胞炎症,且剂量为10 μmol/L时表现出较强的抗炎能力。愈创木酚具有镇痛、抗氧化和抗菌特性,AULESTIA V P V等[12]研究了愈创木酚/β-环糊精复合物在剂量为10 mmol/L达到对干槽症快速愈合的抗菌作用活性、细胞毒性和骨修复功效。4-乙烯基愈创木酚由于其抗癌活性和抗氧化活性,具有潜在的医药价值[9]。LUO Y等[13]研究表明,4-乙烯基愈创木酚对癌症细胞生长的抑制作用主要是通过诱导细胞凋亡介导的,并且在浓度<0.5 mmol的条件下显著地诱导细胞凋亡。
愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚和4-乙烯基愈创木酚在酱香型、浓香型、清香型、芝麻香型等白酒中均有检出,且质量浓度范围分别在23.14~1 767.11 μg/L、2.8~1 709.0 μg/L、1.3~1 167.5 μg/L和17.03~102.89 μg/L之间[7-8]。因此,研究白酒中的此4种生理活性成分对于探讨白酒健康成分具有一定指导意义。
2 白酒中愈创木酚类检测方法
愈创木酚类化合物在白酒中含量较低,一般需要先对其进行富集处理后再定量测定。目前采用的前处理方法主要有直接进样、液液萃取、液液微萃取、固相萃取、固相微萃取等,再结合气相色谱(gas chromatography,GC)、液相色谱(liquid chromatogram,LC)或者气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)技术进行检测[7]。其中,气相色谱-质谱联用技术因其样品用量少、分析速度快、分离效果好和应用范围广等优点被广泛应用于白酒微量成分分析中,更是检测微量功能成分的重要手段之一[14]。近十年以来,采用气相色谱-质谱联用技术对白酒中愈创木酚类化合物定量检测研究进展见表1。由表1可知,愈创木酚类化合物检测方法前处理大多采用萃取的方法,且不同香型白酒中不同愈创木酚类化合物含量差异较大,这可能与制备白酒的原料及工艺相关。
表1 气相色谱-质谱联用技术检测白酒中愈创木酚类化合物研究进展
Table 1 Research progress on the determination of guaiacol compounds in Baijiu by gas chromatography-mass spectrometry

前处理方法 检测分析方法 具体方法 结果气相色谱-质谱-选择离子扫描直接进样[15-16]气相色谱-质谱联用涡旋辅助液-液微萃取[8]气相色谱-质谱联用气相色谱-质谱-选择离子扫描液液萃取[14,17]气相色谱-质谱联用双水相萃取[18]气相色谱-三重四极杆串联质谱联用气相色谱-质谱-选择离子扫描液液微萃取[19-21]气相色谱-串联质谱采用直接进样结合气相色谱-质谱-离子扫描联用,样品分析时间仅需16 min。样品膜过滤后直接进样,运用GC-MS进行定量分析。采用二氯甲烷提取后配合涡旋辅助萃取,运用GC-MS进行定量分析。分别用正己烷、乙醚、乙醚-戊烷分3次萃取,运用GC-MS-选择离子监测(selected-ion monitoring,SIM)模式进行定量分析。采用二氯甲烷萃取,运用GC-MS进行定量分析。乙醇作为萃取剂,加入无机盐进行分相,通过双水相萃取,结合气相色谱-三重四极杆串联质谱法进行定量分析。用乙醚和正己烷进行萃取,运用GC-MSSIM模式进行定量分析。采用单因素法依次优化萃取溶剂、酒样酒精度等进行前处理,结合气相色谱-串联质谱进行定量分析。103种白酒中均检测到4-甲基愈创木酚和4-乙基愈创木酚,检出限分别为0.55 μg/L和0.25 μg/L;不同香型白酒中不同酚类化合物含量差异较大,浓香型和芝麻香型白酒中相对含量较高。愈创木酚和4-甲基愈创木酚在酱、清、米香型白酒中均检测到,含量分别为17.04~98.94 μg/L和19.96~258.13 μg/L,前者在酱香型白酒中含量最高,后者在清香型白酒中含量最高;4-乙基愈创木酚主要在酱、清、米、老白干、兼和凤香型白酒中检出,其在老白干香型白酒含量最高为191.76 μg/L。51种酒样中含有4-甲基愈创木酚,含量为2.8~1 709.0 μg/L;53种酒样中含有4-乙基愈创木酚,含量为1.3~1 167.5 μg/L;4-甲基愈创木酚和4-乙基愈创木酚检出限均为0.5 μg/L。芝麻香型白酒的4-甲基愈创木酚和4-乙基愈创木酚质量浓度分别为1 153.08~2 086.04 μg/L和1 202.05~1273.91 μg/L,显著高于其他香型酒样。酱香型白酒中愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚和4-乙烯基愈创木酚检出限分别为0.77 μg/L、0.63 μg/L、0.29 μg/L和1.95 μg/L,含量分别为0~116.9 μg/L、0~165.1 μg/L、0~63.4 μg/L和0~26.9 μg/L。酱香型白酒中愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚和4-乙烯基愈创木酚的质量浓度分别为0~202 μg/L、9.5~100.6 μg/L、0~74.2 μg/L和0~204.3 μg/L;一轮次基酒中的愈创木酚类物质的含量显著要高于其他轮次基酒,三轮次含量最低。12种酱香型白酒中愈创木酚、4-甲基愈创木酚和4-乙基愈创木酚质量浓度分别为0.02~0.09mg/L、0.01~0.02mg/L和0.01~0.02mg/L。酱香型白酒中愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚质量浓度最高,米香型白酒中含量最少;一轮次酱香型白酒中愈创木酚、4-甲基愈创木酚、4-乙基愈创木酚质量浓度高于其他轮次酒,而三、四轮次质量浓度则较为接近。
续表

前处理方法 检测分析方法 具体方法 结果顶空固相微萃取[22]气相色谱-质谱-选择离子扫描气相色谱-质谱联用用萃取剂进行萃取,运用GC-MS-SIM进行定量分析。高粱加水密封后进行顶空固相微萃取,萃取结束后解析附5 min后进行GC/MS定量分析。酱香型白酒中愈创木酚含量最高,浓香型白酒中4-乙基愈创木酚含量最高,清香型白酒中4-甲基愈创木酚和4-乙烯基愈创木酚含量最高。从蒸煮高粱香气成分中共鉴定出82种化学成分,相对含量较高的香气成分有12种,其中4-乙烯基愈创木酚和4-乙基愈创木酚相对含量分别为2.12%和1.31%。
3 白酒中愈创木酚类化合物的生物合成途径
据文献报道,白酒中的健康因子来源于复杂的原料体系(次要途径)、微生物自然发酵代谢体系(主要来源)和后期贮存体系(次要途径),健康因子的形成关键依赖于发酵过程中微生物的基础作用和生物调节[23]。愈创木酚类化合物作为健康因子,其在白酒中主要由微生物转化底物而来。
相对来说,研究白酒中愈创木酚生物合成途径的报道较少。据文献报道,酚类物质是由高粱、小麦、大曲等酿酒原料中的单宁、木质素、蛋白质等物质分解而来,或经发酵过程中微生物直接代谢生成,或是由酿造过程中形成的氨基酸和阿魏酸等中间产物经酵母菌或细菌代谢生成[24]。另有文献报道,白酒中的酚类化合物主要来源于真菌对木质素的降解和/或修饰,白酒的原料如高粱、稻壳和玉米富含木质素,为酚类化合物的生成提供了物质基础[11]。李青卓等[9]研究发现,在高温制曲过程中,与植物细胞壁相连接的酯键断裂从而释放阿魏酸,在微生物的作用下生成4-乙烯基愈创木酚、4-乙基愈创木酚等酚类化合物。闫如毓等[25]研究浓香型白酒发酵过程中4-甲/乙基愈创木酚的代谢规律发现,4-甲/乙基愈创木酚主要在发酵后期产生,4-乙基愈创木酚首先由发酵前期真菌和酵母转化原料中的阿魏酸生成4-乙烯基愈创木酚,随即进入发酵后期由功能细菌催化代谢4-乙烯基愈创木酚生成4-乙基愈创木酚。由此可见,愈创木酚类物质的产生离不开微生物的生物转化。
4 白酒中产愈创木酚类微生物
白酒中愈创木酚类化合物主要由酿造过程中的微生物代谢形成,目前,白酒中愈创木酚类物质含量的提升研究均是围绕优良菌株的选育及其培养条件的优化来开展,这表明了研究功能微生物对提升白酒中愈创木酚类化合物至关重要。
4.1 菌株选育
目前,针对白酒中愈创木酚类化合物含量提升的研究大多集中在高产此类物质菌株的筛选上,且筛选获得的菌株多以芽孢杆菌(Bacillus)为主。王成俊等[26]从酱香型大曲中筛选得到1株高产4-乙基愈创木酚的菌株wsp-2-2,通过形态学观察、生理生化试验和分子生物学鉴定其为蜡样芽孢杆菌(Bacillus cereus),产4-乙基愈创木酚含量达到245.3 μg/L。巩园园等[27]采用传统筛菌方法从发酵醅中筛选得到一株高产4-乙烯基愈创木酚的枯草芽孢杆菌(Bacillus subtilis),其4-乙烯基愈创木酚产量为300 μg/g。刘青阳等[28]从古井贡中高温大曲中获得的49株芽孢杆菌中筛选出一株高产愈创木酚的枯草芽孢杆菌(B.subtilis),产量达8.56 mg/L。周金虎等[29]从黄鹤楼浓香型白酒窖泥中筛选出2株高产愈创木酚类物质的功能菌株,经鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)和戴尔福特菌(Delftia sp.)X-a12,产量分别达到3.63和14.53 mg/L。王少磊等[30]从浓香型大曲中分离出1株具有较高4-乙基愈创木酚产生能力的解淀粉芽孢杆菌(B.amyloliquefaciens),产量可达32.89 μg/g。明红梅等[31]将来自传统浓香型大曲中分离筛选的地衣芽孢杆菌(Bacillus licheniformis)X19接种于小麦固体培养基上发酵9 d后,发酵产物中愈创木酚的含量达到17.1 μg/g。
除细菌外,一些真菌也可以产生愈创木酚类物质。游玲等[32]从浓香型白酒酿造车间分离得到1株毕赤酵母属(Pichia sp.)菌株Z8Y15,愈创木酚的产量达到4.83 mg/L。王柏文等[33]从白酒生产中的大曲分离得到一株高产4-乙烯基愈创木酚的菌株WL-DQ-2,经过鉴定其为异常威克汉姆酵母(Wickerhamomyces anomalus)。郑佳等[34]从多粮浓香型白酒酿造环境中分离得到一株丛梗孢属(Moniliella sp.)酵母新菌株,其可产生4-乙烯基愈创木酚等多种风味物质,具有广阔的应用前景和极大的应用价值。
4.2 培养条件优化提升产量
研究菌株产愈创木酚类化合物的培养条件有利于提升产量,以期为后续菌株应用于白酒酿造提供工艺参数。刘青阳等[28]研究发现,芽孢杆菌混合发酵提高了4-乙烯基愈创木酚的生成量,达到104.47 mg/L。周金虎等[35]采用响应面试验对产愈创木酚细菌的培养条件进行优化,结果表明,影响细菌产愈创木酚的因素主次顺序为培养温度>接种量>培养时间>水分。肖澎等[36]应用Plackett-Burman试验设计法筛选出影响枯草芽孢杆菌D-31菌体生长的主要因素是温度、可溶性淀粉及KCl的浓度,最适培养条件为可溶性淀粉27.70 g/L,KCl 6.66 g/L,酵母膏50 g/L,pH 8,接种量3%,36.9 ℃培养24 h。在此条件下,4-乙基愈创木酚产量从9.48 mg/L提高到了36.94 mg/L,转化率提高了3.9倍。
4.3 白酒中产愈创木酚类菌株应用
选育产愈创木酚类化合物菌株最终目的是应用于白酒生产,提高发酵过程或原酒中此类物质含量,从而赋予白酒健康内涵。林斌等[5]筛选获得一株高产愈创木酚类物质的枯草芽孢杆菌(B.subtilis),将其应用于清香型小曲白酒中能有效提升原酒中愈创木酚类物质含量,提升率达117%。吴秋霞等[37]采用产4-乙基愈创木酚菌株B.subtilis D-31进行强化制曲,较未强化对照曲,4-乙基愈创木酚含量提升了266.20%,同时与另一株菌共强化制曲后愈创木酚含量提升了323.79%。周金虎[38]将2株愈创木酚类物质高产菌B.amyloliquefaciens和Delftia sp.X-a12制作成麸曲应用于白酒酿造中,与传统高温大曲相比,试验组白酒中愈创木酚类物质含量比空白组提高了45%,保证了生态洞酿白酒愈创木酚类物质含量及其稳定性。管桂坤等[39]提供了一种微生物复合菌剂,将此微生物复合菌剂和大曲添加至酿酒原料中进行发酵得到酱香型白酒,其中4-甲基愈创木酚的含量高达853.1 μg/L,4-乙基愈创木酚的含量高达200.4 μg/L。刘青阳等[40]将一株高产4-乙烯基愈创木酚的芽孢杆菌菌株(Bacillus sp.)B100制备强化大曲应用于白酒生产中,相比对照不强化大曲,试验曲原酒中4-乙烯基愈创木酚含量提高了634.15%。许鹏等[41]获得一株高产愈创木酚的细菌戴尔福特菌Delftia sp.X-a12,并利用其制备成细菌麸曲和强化菌液应用于浓香型白酒生产中,结果发现,浓香型白酒中愈创木酚含量提高了173%;张文学等[42]获得一株高产愈创木酚的产氮假单胞菌(Pseudomonas azotoformans)YF-58,并将其制备成功能麸曲后应用于白酒生产中,结果发现,白酒中愈创木酚含量提高了34.10%。
5 产愈创木酚类物质微生物代谢途径研究
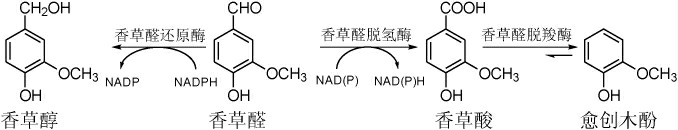
许多微生物都能以香草酸作为前体物产生愈创木酚,如诺卡氏菌属(Nocardia sp.)、西唐链霉菌(Streptomyces setonii)、巨大芽孢杆菌(Bacillus megaterium)、枯草芽孢杆菌(B.subtilis)和酸土脂环酸芽孢杆菌(Alicyclobacillus acidoterrestris)[43]。目前,果汁中酸土脂环酸芽孢杆菌(Alicyclobacillu acidoterrestris)代谢愈创木酚的生物途径已被证实,如图1所示。
由图1可知,酸土脂环酸芽孢杆菌以香草酸和香草醛为前体物代谢生成愈创木酚,具体过程为:该菌利用烟酰胺腺嘌呤二核苷磷酸(nicotinamide adenine dinucleotide phosphate,NAD(P)+)依赖的香草醛脱氢酶,先将香草醛氧化为香草酸,再利用香草酸脱羧酶发生脱羧反应产生愈创木酚,除此之外有小部分的香草醛被还原型烟酰胺腺嘌呤二核苷磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)依赖的香草醛还原酶转化为香草醇[44]。愈创木酚产生水平可能受到各种因素的影响,如培养基成分、pH、氧气浓度、培养温度和脂环芽孢杆菌本身特性,而愈创木酚的形成速率通常与脂环芽孢菌属的最佳生长条件有关[45-46]。
多种微生物被报道能将阿魏酸转化为4-乙烯基愈创木酚,如季也蒙假丝酵母(Candida guilliermondii)、汉逊德巴利酵母(Debaryomyces honsenii)、酿酒酵母(Saccharomyces cerevisiae)、黑曲霉(Aspergillus niger)DAR2、费氏乳杆菌(Lactobacillus farciminis)、土壤肠杆菌(Enterobacter soli)、西唐链霉菌(Streptomyces setonii)ATCC 39116、凝结芽孢杆菌(Bacillus coagulans)BK07等[9,47-49]。微生物利用阿魏酸生成4-乙烯基愈创木酚有7种不同代谢途径,既可以直接转化,也可以通过中间体间接生成4-乙烯基愈创木酚,同时4-乙烯基愈创木酚也可以转化为4-乙基愈创木酚、香草醛、香草酸等,而香草酸和香草醛为愈创木酚的前体物质[9]。因此,含有阿魏酸的发酵底物经过微生物的生物转化均能够产生愈创木酚类化合物。
6 总结与展望
随着“健康中国2030”规划纲要的实施,挖掘白酒中的健康功能因子、科学引导消费者健康饮酒,进而促进白酒产业高质量发展,已越来越得到国内外学者的广泛关注。随着科技的进步,白酒中愈创木酚类化合物种类、健康作用及其生成机理不断被发现和认识,这对于科学地认识中国白酒中的健康因子的种类和生物活性,促进中国白酒行业健康、可持续发展起到了重要作用。然而,不同于其他饮料酒,白酒是一个复杂的多菌种混合固态发酵体系,涉及的微生物种类多、风味成分繁杂。白酒的挥发性风味成分在整个过程中受到多种因素的相互作用,包括原料的特性和加工方式、发酵工艺参数、酒曲和发酵容器中的多种微生物相互作用以及蒸馏工艺等。虽然,目前白酒行业在产愈创木酚类菌株开展了较多研究,但白酒中此类化合物总体含量仍然偏低,且生成机理还需进一步阐明。未来如何通过生物技术筛选更高产菌株并将其融入白酒发酵工艺中,实现多菌种协同酿造,不断提升酒体中愈创木酚类化合物总体产量,还需要深入研究。
参考文献:
[1]LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[2]HONG J X,ZHAO D R,SUN B G.Research progress on the profile of trace components in Baijiu[J].Food Rev Int,2023,39(3):1666-1693.
[3]KANG Q,SUN J,WANG B W,et al.Wine,beer and Chinese Baijiu in relation to cardiovascular health:The impact of moderate drinking[J].Food Science and Human Wellness,2023,1(12):1-13.
[4]HUO J Y,LUO X L,HUANG M Q,et al.Identification and antioxidant activity of a novel peptide from Baijiu[J].Int J Peptide Res Ther,2019,(26):1199-1210.
[5]林斌,杨强,宿智新,等.产愈创木酚类功能菌筛选及其在清香型小曲白酒中的应用[J].中国酿造,2022,41(9):74-79.
[6]周金虎,管健,魏浩林,等.白酒中健康因子的研究进展[J].酿酒科技,2017(7):90-94.
[7]郑宇琴.白酒微量物质检测及其风味化学研究[D].武汉:武汉理工大学,2022.
[8]孙啸涛,王宗元,刘淼,等.涡旋辅助液液微萃取结合GC-MS法检测67种白酒中四甲基吡嗪、4-甲基愈创木酚和4-乙基愈创木酚[J].食品科学,2017,38(18):73-79.
[9]李青卓,王嘉瑞,张小龙,等.风味物质4-乙烯基愈创木酚的研究进展[J].中国酿造,2021,40(4):15-19.
[10]张瞭飞.4-甲基愈创木酚对细胞自噬活性的影响及其对小鼠酒精性肝损伤的保护作用[D].乌鲁木齐:新疆农业大学,2022.
[11]ZHAO D R,JIANG Y S,SUN J Y,et al.Amelioration of 4-methylguaiacol on LPS-induced inflammation in THP-1 cells through NF-κB/IκB α/AP-1 and Nrf2/HO-1 signaling pathway[J].J Funct Foods,2019,55:95-103.
[12]AULESTIA V P V,GONTIJO S M L,GOMES A D M,et al.Guaiacol/β-cyclodextrin for rapid healing of dry socket:antibacterial activity,cytotoxicity,and bone repair-an animal study[J].J Oral Maxil Surg,2019,23(1):53-61.
[13]LUO Y,WANG C Z,SAWADOGO R,et al.4-Vinylguaiacol,an active metabolite of ferulic acid by enteric microbiota and probiotics,possesses significant activities against drug-resistant human colorectal cancer cells[J].ACS Omega,2021,6(7):4551-4561.
[14]史改玲,郭莹,李景辉,等.LLE-GC-MS-SIM检测白酒中9种微量功能成分[J].食品科学,2021,42(20):114-119.
[15]史冬梅,王松,赵东瑞,等.GC-MS/SIM法检测103种白酒中6种酚类化合物[J].中国食品学报,2019,19(4):235-248.
[16]吴奇霄,余松柏,马龙,等.基于LC-MS和GC-MS结合多元统计的白酒酚类成分分析[J].中国酿造,2022,41(12):223-229.
[17]耿平兰,王焕琦,黄卫红,等.液液萃取-GC-MS法测定酱香型白酒中挥发性酚[J].食品科技,2023,48(5):265-271.
[18]毕荣宇,卢君,唐平,等.双水相-GC-MS/MS测定酱香型白酒酿造过程挥发性酚类物质变化规律的研究[J].酿酒科技,2023(1):137-144.
[19]陆伦维,孙优兰,王金龙,等.液液微萃取结合GC-MS-SIM法检测酱香型白酒中15种微量成分含量[J].酿酒科技,2022(12):115-120,133.
[20]孙细珍,熊亚青,唐娟,等.液液微萃取结合气相色谱-串联质谱测定饮料酒中挥发性酚类化合物[J].食品与发酵工业,2022,48(3):257-265.
[21]赵雅敏,林琳,王和玉,等.液-液微萃取结合气相色谱-质谱联用技术快速测定饮料酒中挥发性酚类化合物[J].分析科学学报,2018,34(6):789-794.
[22]岳涛,姜利,黄艳,等.SPME-GC/MS法结合保留指数分析蒸煮高粱挥发性香气成分[J].酿酒,2021,48(3):32-36.
[23]龙亚飞,唐佳代,王相勇,等.中国白酒中健康因子及其富集途径的研究进展[J].中国酿造,2022,41(2):23-28.
[24]耿平兰,黄卫红,程化鹏.白酒中酚类物质及检测方法的研究进展[J].酿酒科技,2020(8):83-88.
[25]闫如毓,郝慧宜,苗子健,等.浓香型白酒发酵过程中4-甲/乙基愈创木酚的代谢规律分析[J].食品与发酵工业,2023,49(11):41-46.
[26]王成俊,李玲珊,范梅,等.酱香型大曲中产4-乙基愈创木酚芽孢杆菌的筛选、鉴定及特性研究[J].酿酒科技,2023(4):45-52.
[27]巩园园,毛豪,晋湘宜,等.产4-乙烯基愈创木酚细菌的筛选及酚酸脱羧酶基因的克隆与表达[J].中国酿造,2021,40(7):160-164.
[28]刘青阳,黄晓宁,陆玮,等.中高温大曲中芽孢杆菌多样性及代谢特征研究[J].中国酿造,2022,41(7):26-31.
[29]周金虎,李良,方尚玲,等.窖泥中高产愈创木酚类功能菌的筛选与鉴定[J].食品与发酵工业,2019,45(3):64-70.
[30]王少磊,曹荣升,沈芳,等.浓香型大曲中4-乙基愈创木酚产生菌的筛选及其鉴定[J].酿酒科技,2018(5):48-52.
[31]明红梅,郭志,周健,等.中心组合设计优化大曲中地衣芽孢杆菌发酵产香条件[J].食品工业科技,2015,36(10):182-186.
[32]游玲,蒲岚,王涛,等.1株毕赤氏属酵母的酿造特性[J].食品与发酵工业,2012,38(2):52-56.
[33]王柏文,孙金沅,闫如毓,等.一种异常威克汉姆酵母菌及其应用:CN115322911A[P].2022-11-11.
[34]郑佳,雷学俊,张霞,等.丛梗孢属酵母新菌株及其用途:CN202011257667.1[P].2024-01-16.
[35]周金虎,叶凯,李良,等.产愈创木酚类细菌的培养条件优化[J].中国酿造,2018,37(10):101-105.
[36]肖澎,李慧,吴重德,等.4-乙基愈创木酚生产菌株D-31培养条件的优化[J].食品工业科技,2014,35(13):244-247,252.
[37]吴秋霞,黄钧,江东材,等.基于共培强化提高浓香大曲吡嗪类及4-乙基愈创木酚组分含量的研究[J].食品科技,2017,42(5):2-6.
[38]周金虎.黄鹤楼酒生态洞酿产愈创木酚类功能菌的筛选与应用[D].武汉:湖北工业大学,2019.
[39]管桂坤,吴群,刘宇,等.一种复合微生物菌剂及其在生产酱香型白酒中的应用:CN202010448141.5[P].2024-01-15.
[40]刘青阳,陆玮,张松祥,等.一种芽孢杆菌菌株及其在提高白酒酿造过程中4-乙烯基愈创木酚含量中的应用:CN202310371101[P].2024-01-16.
[41]许鹏,李良,董孝元,等.一种白酒及其制备方法和应用:CN201910064540.9[P].2022-04-19.
[42]张文学,杜亚珂,朱敏,等.一株高产愈创木酚的产氮假单胞菌YF-58及其应用:CN202310542325.1[P].2024-04-19.
[43]王琦.脂环酸芽孢杆菌生物合成愈创木酚的关键基因解析及表达研究[D].杨凌:西北农林科技大学,2023.
[44]WANG Z L,LIANG Y H, WANG Q, et al.Integrated analysis of transcriptome and proteome for exploring the mechanism of guaiacol production by Alicyclobacillus acidoterrestris[J].Food Res Int,2021,148:110621.
[45]CHANG S, PARK S H, KANG D H.Effect of extrinsic factors on the production of guaiacol by Alicyclobacillus spp.[J].J Food Protect,2015,78(4):831-835.
[46]HUX,HUANGE,BARRINGERSA,et al.Factorsaffecting Alicyclobacillus acidoterrestris growth and guaiacol production and controlling apple juice spoilage by lauric arginate and ε-polylysine[J].LWT-Food Sci Technol,2020,119:108883.
[47]XU L L,ZHANG H M,CUI Y Q,et al.Increasing the level of 4-vinylguaiacol in top-fermented wheat beer by secretory expression of ferulic acid decarboxylase from Bacillus pumilus in brewer's yeast[J].Biotechnol Lett,2020,42(12):2711-2720.
[48]SUN L H, LV S W, YU F, et al.Biosynthesis of 4-vinylguaiacol from crude feruli acid by Bacillus licheniformis DLF-17056[J].J Biotechnol,2018,281:144-149.
[49]BOUDAOUD S,AOUF C,DEVILLERS H,et al.Sourdough yeast-bacteria interactions can change ferulic acid metabolism during fermentation[J].Food Microbiol,2021,98:103790.