生物乙醇作为一种公认的清洁能源,已经用于车用燃料。第一代生物乙醇因其原料主要为玉米、小麦、木薯等粮食作物,其发展受到限制,第二代燃料生物乙醇是通过微生物将廉价的木质纤维素生物质糖发酵制取。为了获得可发酵性糖类,需要对木质纤维素进行预处理和水解[1]。酿酒酵母因其鲁棒性、较高的乙醇产率等优势,被认为是从预处理的木质纤维素中发酵生产乙醇的首选微生物。酿酒酵母对木质纤维素水解物中抑制物的耐受性是木质纤维素生物质糖能否被充分利用的关键。在预处理过程中会产生以乙酸、糠醛、5-甲基糠醛等为主的抑制酿酒酵母生长化学物质。常见的脱除抑制物的处理主要可以分为物理、化学、生物等方法。物理脱除法主要是通过真空膜蒸发[2]、膜分离[3]、吸附[4]、萃取[5]等去除水解液中对酿酒酵母生长和发酵产生抑制的物质;化学去除法主要通过添加化学物质中和或还原酸类和呋喃类物质等[6-7];生物脱除法主要是通过添加酶或添加微生物进行处理[8-13],生物脱除法虽然反应温和且发酵性糖类损失少,但成本较高且会使整个发酵周期变长。这些方法可以降低甚至去除抑制物对酿酒酵母的影响,但会提高纤维素乙醇的生产成本,而通过诱变或基因工程手段等菌株选育技术能降低获得耐受性高菌株的成本。
目前国内外学者采用紫外诱变[14-15]、化学诱变[16-17]、定向驯化诱变[18-19]和基因工程[20-23]等育种方法,得到具有一定耐抑制物特性的酵母菌株。但这些菌株对抑制物耐受性和糖醇转化率还有待进一步提高。常温常压等离子体(atmospheric room temperature plasma,ARTP)诱变育种技术是近年来应用非常广泛的育种手段,具有射流温度低(25~35 ℃)、活性粒子分布均匀、操作简便、安全性高等特点,被广泛应用于细菌[24]、酵母[25-26]、微藻[27-28]等领域。单一的ARTP方法选育菌株,工作量大,效率低下。微生物微液滴培养(microbial microdroplets culture,MMC)仪是采用微流控技术将微生物分离为单一液滴,进行适应性进化培养和高通量检测的先进筛选仪器。本研究将利用ARTP诱变技术与MMC结合,找出乙酸、糠醛、5-羟甲基糠醛所组成的适宜含量的复合抑制剂(composite inhibitors,CI)梯度进行适应性进化培养和菌株高通量筛选,并对菌株进行耐温、产乙醇能力和10 L发酵罐中发酵特性的研究,以期得到综合耐受性高的酿酒酵母(Saccharomyces cerevisiae)菌株,为该菌株中试放大和应用开发提供一定参考。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
安琪超级酿酒酵母TH-AADY、酵母浸粉(生化试剂):安琪酵母股份有限公司;蛋白胨(生化试剂):北京奥博星生物技术有限责任司;糠醛、乙酸(均为分析纯):天津科密欧化学试剂有限公司;5-羟甲基糠醛(分析纯):天津恒兴化学试剂制造有限公司;玉米浆干粉:南京全隆生物技术有限公司;磷酸二氢钾(均为分析纯):国药集团化学试剂公司;木质纤维素预处理水解液:安琪酵母股份有限公司。其他试剂均为国产分析纯。
1.1.2 培养基
酵母浸出胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:葡萄糖20 g/L,蛋白胨20 g/L,酵母浸粉10 g/L。固体培养基为液体培养基中加琼脂粉20 g/L。
酵母浸出粉胨高糖培养基:葡萄糖40 g/L,蛋白胨20 g/L,酵母浸粉10 g/L。
以上培养基灭菌条件均为121 ℃、0.1 MPa,灭菌20 min。
1.2 仪器与设备
XFLS-75MA灭菌锅:浙江新丰医疗器械有限公司;BPC-250F恒温培养箱:上海一恒科技有限公司;ZQTY-90S台式振荡培养箱:厦门亿辰科技有限公司;常温常压等离子体诱变(ARTP)仪、全自动高通量微生物微液滴培养(MMC)仪:无锡源清天木生物科技有限公司;BIOTECH-5BG-940OA自动发酵罐:上海保兴生物设备工程有限公司;UV-1100紫外分光光度计:上海美谱达仪器有限公司;GC7890手动顶空气相色谱仪:上分仪器仪表有限公司;SHP8400PMS在线质谱分析仪:上海舜宇恒平科学仪器有限公司。
1.3 方法
1.3.1 复合抑制剂的配制
为了筛选对乙酸、糠醛、5-羟甲基糠醛等抑制物有抗性的酿酒酵母,采用这三种物质不同浓度梯度进行组合实验。复合抑制剂的六个梯度组合设计见表1。筛选时直接加入不同梯度的复合抑制剂。不同含量的抑制物会对酿酒酵母的生长和代谢乙醇能力产生一定影响。其中CI1~CI5组合用于考察筛选菌株的耐受性,CI4、CI6组合用于耐抑制物的酵母高通量筛选。
表1 复合抑制剂的不同梯度组合
Table 1 Different concentration compositions of compound inhibitors g/L
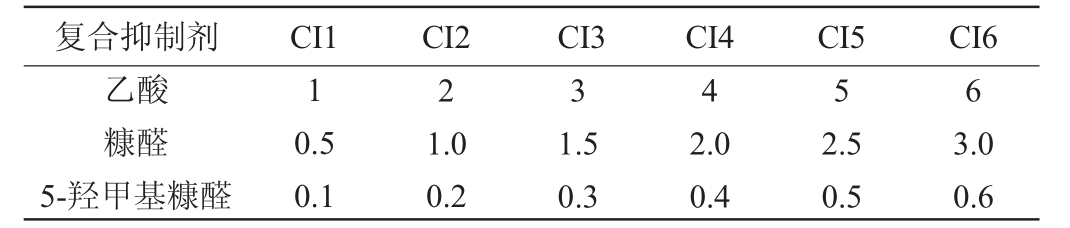
复合抑制剂 CI1 CI2 CI3 CI4 CI5 CI6乙酸糠醛5-羟甲基糠醛1 2 3 4 5 6 0.5 0.1 1.0 0.2 1.5 0.3 2.0 0.4 2.5 0.5 3.0 0.6
1.3.2 出发菌株的培养
活化:取一环-80℃保存的安琪超级酿酒酵母TH-AADY菌株划线接种至YPD固体培养基表面,28 ℃下倒置培养2~3 d。
种子培养:挑取平板上的一环菌落接种至250 mL装有100 mL YPD培养基的三角瓶中,于28 ℃、200 r/min条件下培养。
摇瓶发酵培养:将培养至对数生长中后期的种子液以10%的接种量接种至250 mL装有100 mL YPD高糖培养基的三角瓶中,于28 ℃、200 r/min条件下培养。
1.3.3 出发菌株生长曲线的测定
挑取平板上的一环菌落接种至250 mL装有100 mL YPD培养基的三角瓶中,于28 ℃、200 r/min条件下培养,每隔2 h取样测定波长600 nm处的吸光度值(OD600nm值)。以培养时间为横坐标,吸光度值为纵坐标绘制生长曲线。
1.3.4 出发菌株的ARPT诱变时间确定
用生理盐水将培养至对数期的菌液稀释至OD600 nm值为0.5的菌悬液,并加入3%的甘油漩涡振荡混匀,取10 μL混匀后的菌液均匀涂布于金属载片上,将载片置于诱变系统中,将诱变温度保持在20 ℃,选择诱变功率110 W,氦气流量10 L/min,选取不同诱变时间(0、20 s、40 s、60 s、80 s、100 s、120 s、140 s、160 s、180 s)对菌液进行处理。将金属载片置于含1 mL生理盐水的1.5 mL离心管中,漩涡振荡将处理后的菌体洗涤下来。梯度稀释后将稀释液涂布于YPD固体培养基上,30 ℃倒置培养2 d,观察菌落数并计算致死率,确定最佳诱变时间,对照组活菌数为诱变前菌悬液的数量,致死率计算公式如下:
1.3.5 复合抑制剂对出发菌株生长的影响
基于木质纤维预处理过程中,乙酸、糠醛和5-羟甲基糠醛的含量范围介于CI1~CI5之间,因此综合考察这3种物质含量范围对出发菌株生长的影响。配制不同复合抑制剂含量的YPD培养基,将培养至对数期的菌液接种至添加含有不同含量的五个梯度的复合抑制剂组合(CI1~CI5)的100 mL YPD液体培养基中,使OD600nm值为0.2。在30 ℃、200 r/min条件下培养48 h,以未接种的培养基作为对照。测定不同复合抑制剂浓度对出发菌株酿酒酵母生长的影响。
1.3.6 诱变菌株的高通量筛选
为了提高筛选效率,根据出发菌株对复合抑制物CI4的耐受性下降显著,因此选择CI4~CI6的梯度进行菌株适应性进化和高通量筛选试验。具体步骤如下:选择致死率为95%对应的诱变时间对出发菌株(W)进行处理,将处理后的菌悬液接种于100 mL YPD液体培养基中,待菌液OD600 nm值为0.1时,将菌液、含CI4的YPD培养基、CI6的YPD培养基分别接入菌液瓶、培养基瓶、高浓度化学因子瓶中,选择适应性进化,设定液滴数为50个,传代数为3,传代时间为20 h,设定复合抑制剂含量的梯度,全自动高通量微液滴培养仪自动在CI4和CI6之间进行梯度设计,对突变菌株进行高通量筛选。通过测定OD600 nm值大小,在培养结束时挑选OD600nm值高的菌株。
1.3.7 优势菌株的发酵能力测定
将筛选获得的菌体浓度较高的菌株与出发菌株分别接种至100 mL YPD液体培养基中培养至对数期,以10%接种量分别接种至含CI1的100 mL YPD培养基中,培养48 h,测定菌体浓度,挑选优势菌株。将筛选获得长势最好的菌株与出发菌株分别再接种至100 mL YPD培养基中培养至对数期,以10%接种量接种至含CI1的100 mL发酵培养基中培养48 h,进行菌株产乙醇能力的测定。
1.3.8 优势菌株的遗传稳定性考察
将优势菌株在YPD固体培养基上连续传代7次,对每一代同时在28 ℃、200 r/min条件下进行发酵培养48 h,测定乙醇产量,研究其遗传稳定性。
1.3.9 分析检测方法
菌体生长测定:用蒸馏水将菌体稀释一定倍数,测定波长600 nm条件下的吸光度值,使得数值为0.1~1.0之间;乙醇含量的测定:采用手动顶空气相色谱内标法测定[20];还原糖和葡萄糖含量的测定:参考文献[20],采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法;糖醇转化率以摩尔葡萄糖理论上转化为乙醇为基准进行计算;呼吸熵采用在线质谱分析仪测定发酵过程中尾气中二氧化碳和氧气浓度进行计算。
1.3.10 优势菌株的耐受性评价
(1)诱变菌株耐55 ℃热激能力的考察
针对纤维素糖化后的温度可达到55 ℃左右,特考察此温度下菌株的耐受性。将出发菌株与诱变菌株分别接种至YPD液体培养基中,30 ℃、200 r/min培养至对数中后期,测定OD600nm值,使用液体YPD培养基将菌液稀释至OD600 nm值为1.0,取1 mL稀释后的菌液至于1.5 mL EP管中,并于55 ℃水浴热激5 min,取热激后的菌液按照10-1、10-2、10-3、10-4梯度稀释,每个梯度取2 μL菌液整齐滴在YPD平板上,晾干后于28 ℃培养箱中倒置培养2 d后观察菌体形态。
(2)诱变菌株耐乙醇能力的考察
将出发菌株与诱变菌株分别接种至YPD液体培养基中,30 ℃、200 r/min培养至对数中后期,测定OD600nm值,使用YPD液体培养基将菌液稀释至OD600nm值为1.0,在无菌条件下加入不同量的无水乙醇使得液体培养基中乙醇体积分数分别为8%、10%、12%、14%和16%。28 ℃、200 r/min条件下培养24 h,取样测定OD600nm值判断菌株对乙醇的耐受度。
1.3.11 耐抑制物优势菌株的10 L发酵罐发酵评价
将得到的优势菌株应用于10 L发酵罐进行实验,将种子液按10%接种量使用火焰接种法接入罐中,加入木质纤维素预处理水解液,其中含有5.0 g/L乙酸、2.5 g/L糠醛和0.5 g/L 5-羟甲基糠醛,调节pH为4.5。在发酵过程中保持温度为32 ℃,每分钟通气量与罐体实际料液体积的比值为1∶1.5,搅拌转速为100 r/min,培养12 h后关闭通气,将搅拌转速调至50 r/min,每隔6 h取样测定OD600 nm值、葡萄糖含量、糖醇转化率和呼吸熵(respiratory quotient,RQ),研究其变化规律。
1.3.12 数据分析
所有实验数据采用Origin 8.0进行处理。
2 结果与分析
2.1 耐抑制物菌株的选育
2.1.1 出发菌株的生长曲线
诱变处理对处于不同生长时期的菌株的影响力不同。当酿酒酵母处于对数期时,其数量呈几何指数级增长,此时的菌株对诱变处理的敏感性最强,其基因突变率以及遗传稳定性也最高[27]。因此,一般选择对数生长期进行诱变处理,出发菌株的生长曲线见图1。由图1可知,出发菌株在0~4 h处于延滞期,此阶段菌株生长缓慢,4 h左右进入对数期,此阶段菌株快速生长传代,在12~16 h进入稳定增殖阶段。为保证菌体量和菌株活力,诱变处理应选择培养时间为12~16 h的菌液。
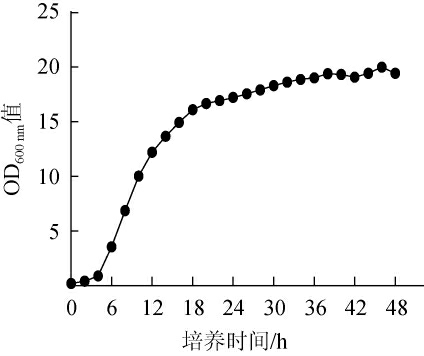
图1 出发菌株的生长曲线
Fig.1 Growth curve of the starting strain
2.1.2 最适诱变时间的确定
诱变处理不仅会造成菌株发生随机突变,而且也会带来菌株的部分死亡。研究表明,对于安琪超级酿酒酵母而言,致死率在95%左右时菌株的正突变率较高,利于筛选。出发菌株的诱变致死曲线见图2。由图2可知,出发菌株在诱变处理时间为140 s时致死率为95%左右,因此选择140 s为最佳诱变处理时间。
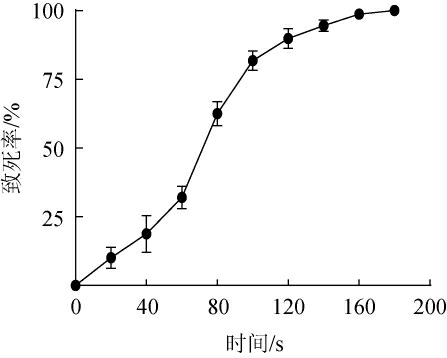
图2 出发菌株的诱变致死曲线
Fig.2 Mutagenesis lethality curve of the starting strain
2.1.3 不同浓度的复合抑制剂对出发菌株生长的影响
不同含量的复合抑制剂(CI1~CI5)对酿酒酵母的抑制效果不同,选择合适的浓度可以减轻后续筛选的工作量。不同复合抑制剂对出发菌株生长的影响见图3。由图3可知,当处理梯度为CI1~CI2时,酵母生长几乎不受影响;当处理梯度为CI4时,前12 h对酵母生长抑制效果明显,之后生长速率也比在低浓度培养时速率低。而当处理梯度为CI5时,酵母生长被完全抑制。因此CI5为复合物抑制浓度的拐点值,可以为后面适应性进化提供努力的起点。通过适应性进化,让ARTP突变后的菌株能够进一步提高其耐受性。
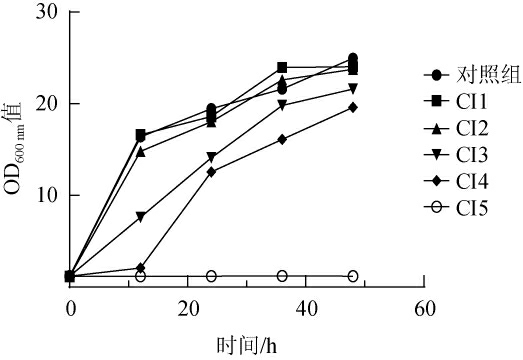
图3 不同组合复合抑制剂对出发菌株生长的影响
Fig.3 Effect of different combinations of compound inhibitors on the growth of the starting strain
2.1.4 诱变菌株的高通量筛选
采用ARTP诱变,得到菌株突变体库,分别编号为M1~8、K1~10、P1~10,然后对诱变菌株在微生物微液滴培养仪进行适应性进化和高通量筛选,在2.1.3试验结果的基础上,以CI5为复合物抑制浓度的拐点值,微生物微液滴培养仪中分设CI4~CI6的梯度,把经过ARTP的突变菌株进行一个二次压力梯度分选。以出发菌株(W)吸光度值为1.0,根据所测定不同菌株的OD600nm值折算为相对吸光度值,结果见图4。由图4可知,大多数初筛菌株相对吸光度值高于出发菌株,其中突变菌株M8的相对吸光度值最高,为出发菌株的27倍,因此选择M8作为优势菌株。
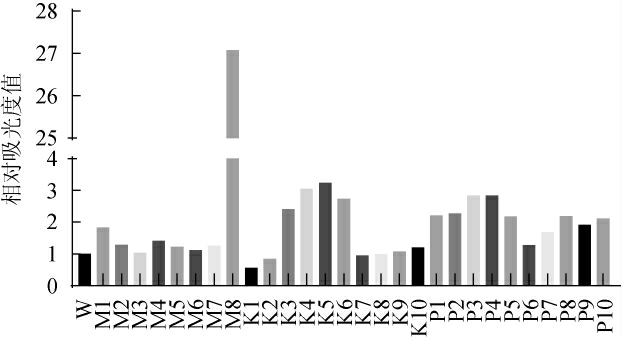
图4 不同突变株相对吸光度值测定结果
Fig.4 Results of relative absorbance values of different mutant strains
2.1.5 优势菌株发酵能力的测定结果
将获得的菌体浓度较高的菌株M8与出发菌株进行摇瓶发酵培养,利用手动顶空气相色谱检测发酵48 h时的乙醇产量,计算糖醇转化率,结果见表2。由表2可知,在复合抑制剂CI5条件存在的情况下,与出发菌株相比,糖醇转化率提高38.18%,与出发菌株在无抑制物的情况下接近。结果表明,菌株M8具有较好的抗性,能抵抗复合抑制剂的影响,并表现出安琪超级酵母发酵产乙醇的能力。
表2 优势菌株M8及出发菌株发酵能力测定结果
Table 2 Determination results of fermentation power of the dominant strain M8 and starting strain
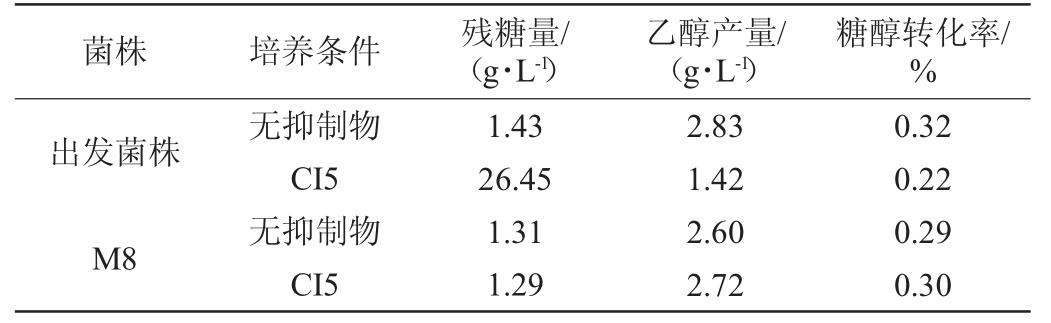
菌株 培养条件 残糖量/(g·L-1)乙醇产量/(g·L-1)糖醇转化率/%出发菌株M8无抑制物CI5无抑制物CI5 1.43 26.45 1.31 1.29 2.83 1.42 2.60 2.72 0.32 0.22 0.29 0.30
2.1.6 优势菌株的遗传稳定性
为检验该优势突变菌株M8能否保持遗传稳定性,将菌株M8连续传代7次,同时进行发酵培养,测定乙醇产量,结果见图5。由图5可知,突变菌株M8连续传代7次的乙醇产量维持在1.3 g/L左右,具有较好的遗传稳定性。
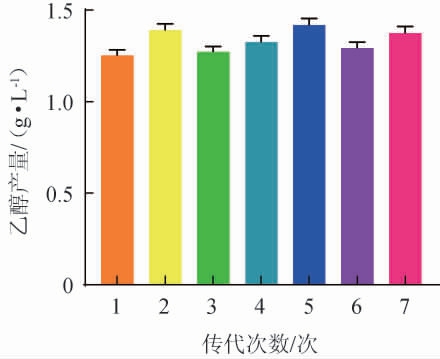
图5 诱变菌株M8的遗传稳定性
Fig.5 Genetic stability of mutant strain M8
2.2 耐抑制物优势菌株M8的温度、乙醇耐受性和发酵评价
2.2.1 耐抑制物优势菌株M8的温度及乙醇耐受效果
在实际工业发酵过程中,酿酒酵母除了需要耐受木质纤维素水解液中所含的抑制物,还需要耐受在发酵过程中可能出现的高温抑制、高产物浓度抑制。诱变菌株M8对高温及乙醇的耐受性见图6。由图6A可知,不同稀释梯度的诱变菌株M8在经过55 ℃热激5 min之后,生长形态明显好于出发菌株;在不同乙醇体积分数(8%~16%)的培养基中培养24 h后,OD600 nm值也明显高于出发菌株。综合来说,该诱变菌株M8较出发菌株对高温和乙醇的耐受性更好,能满足工业化应用需求。
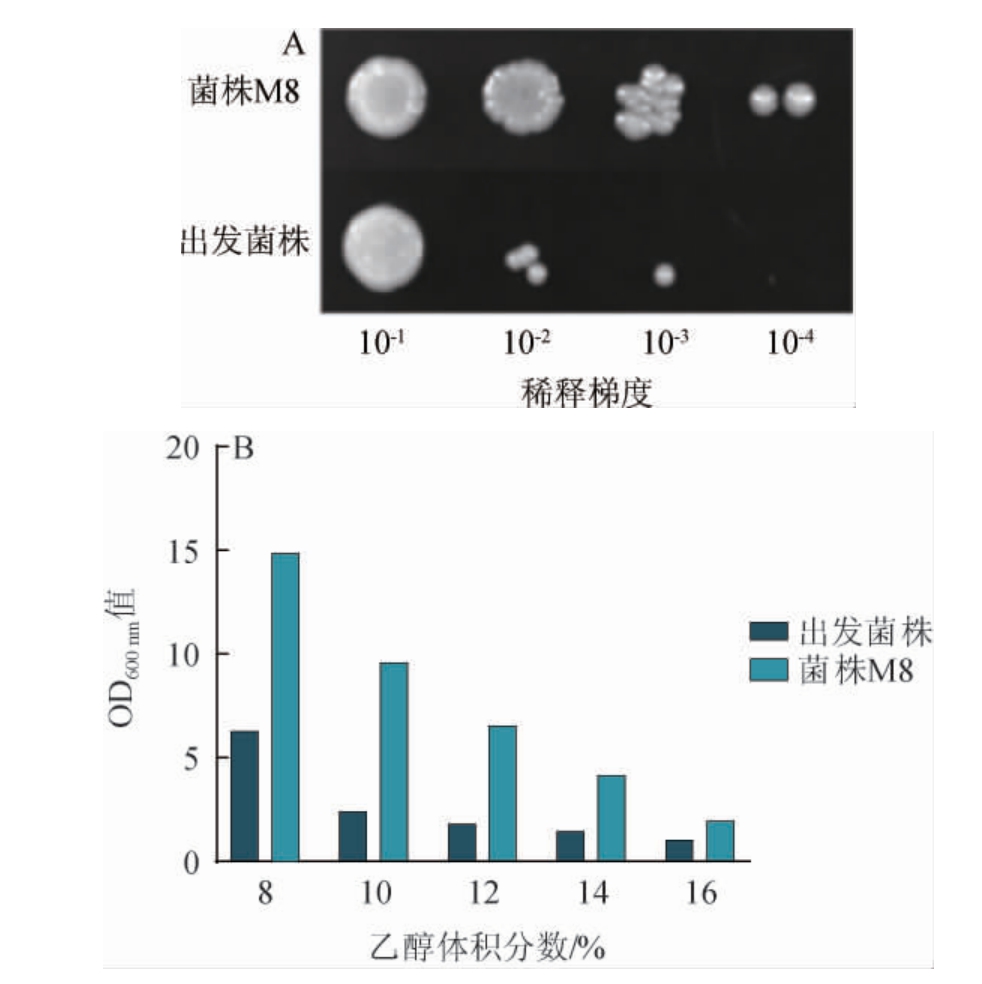
图6 诱变菌株M8与出发菌株对55 ℃热激5 min(A)及乙醇(B)的耐受性
Fig.6 Tolerance of mutant strain M8 and starting strain to 55℃heat shock for 5 min (A) and ethanol (B)
2.2.2 菌株M8的10 L发酵罐放大培养
按照1.3.10的方法在抑制物含量为CI5的条件下,对菌株M8在10 L发酵罐放大培养条件下开展试验,结果见图7。由图7可知,菌株M8在0~6 h生长缓慢,处于延滞期,此阶段葡萄糖消耗少,呼吸熵(RQ)值<1.1;6~24 h迅速增殖,处于对数生长期,伴随着菌体的快速繁殖,乙醇产量也在快速增加,符合生长偶联型产物动力学曲线特征,该阶段RQ值>1.4;24~36 h处于稳定期,此阶段RQ值不断降低,25 h左右RQ值接近1.4,是未来进行补料分批发酵的关键节点;36~48 h时由于培养基中葡萄糖浓度较低,菌体浓度稳定增长,直至葡萄糖消耗殆尽。发酵过程中最大乙醇产量为56.29 g/L,糖醇转化率为0.49 g/g,达到理论值的96.67%。表明该菌株M8具有耐受木质纤维素预处理所产生的抑制物的能力,有工业化应用前景。
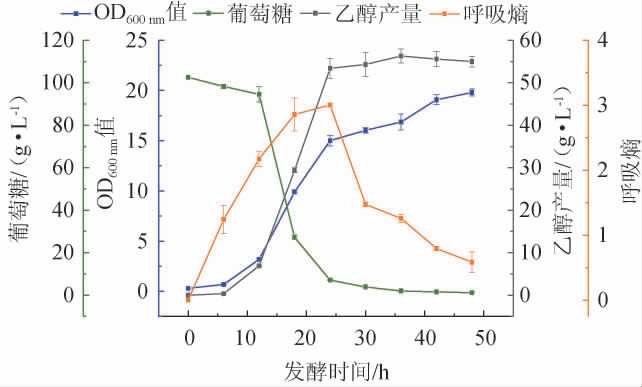
图7 菌株M8的10 L发酵罐放大培养结果
Fig.7 Results of amplification culture of strain M8 in 10 L fermenter
3 结论
该研究利用ARTP诱变与MMC相结合通过适宜复合抑制物梯度对菌株进行适应性进化和高通量筛选,获得耐抑制物强的优势酿酒酵母M8,并对优势耐抑制物菌株M8在高温、高乙醇浓度胁迫下的表现和10 L发酵特性进行了评价。诱变菌株M8具有良好的耐木质纤维素预处理所产生的抑制物能力,对于工业环境下的耐温度和耐乙醇能力表现出良好的抗性,具有工业化应用前景。本研究为该菌株在纤维素乙醇生产应用提供一定的科学依据。
[1]SERNA-LOAIZA S,DIAS M,DAZA S L,et al.Integral analysis of liquidhot-water pretreatment of wheat straw: evaluation of the production of sugars,degradation products,and lignin[J].Sustainability,2021,14(1):362.
[2]CHEN J,ZHANG Y,WANG Y,et al.Removal of inhibitors from lignocellulosic hydrolyzates by vacuum membrane distillation[J].Bioresource Technol,2013,144:680-683.
[3]GRZENIA D L, SCHELL D J, WICKRAMASINGHE S R.Membrane extraction for detoxification of biomass hydrolysates[J].Bioresource Technol,2012,111:248-254.
[4]CARTER B,GILCREASE P C,MRNKHAUS T J.Removal and recovery of furfural, 5-hydroxymethylfurfural, and acetic acid from aqueous solutions using a soluble polyelectrolyte[J].Biotechnol Bioeng,2011,108(9):2046-2052.
[5]LARSSON S, REIMANN A, NILVEBRAN N O, et al.Comparison of different methods for the detoxification of lignocellulose hydrolyzates of spruce[J].Appl Biochem Biotechnol,1999,77:91-103.
[6]HUANG C,WU H,LI R,et al.Improving lipid production from bagasse hydrolysate with Trichosporon fermentans by response surface methodology[J].New Biotechnol,2012,29(3):372-378.
[7]ALRIKSSON B,CAVKA A,JÖNSSON L J.Improving the fermentability of enzymatic hydrolysates of lignocellulose through chemical in-situ detoxification with reducing agents[J].Bioresource Technol,2011,102(2):1254-1263.
[8]HATAKKA A.Lignin-modifying enzymes from selected white-rot fungi:production and role from in lignin degradation[J].FEMS Microbiol Rev,1994,13(2-3):125-135.
[9]CAVAKA A, JONSSON L J.Detoxification of lignocellulosic hydrolysates using sodium borohydride[J].Bioresource Technol, 2013, 136:368-376.
[10]CHO D H, LEE Y J, UM Y, et al.Detoxification of model phenolic compounds in lignocellulosic hydrolysates with peroxidase for butanol production from Clostridium beijerinckii[J].Appl Microbiol Biotechn,2009,83:1035-1043.
[11]MOHAGHEGHI A,RUTH M,SCHELL D J.Conditioning hemicellulose hydrolysates for fermentation: effects of overliming pH on sugar and ethanol yields[J].Process Biochem,2006,41(8):1806-1811.
[12]MORENO A D,IBARRA D,FERNANDEZ J L,et al.Different laccase detoxification strategies for ethanol production from lignocellulosic biomass by the thermotolerant yeast Kluyveromyces marxianus CECT 10875[J].Bioresource Technol,2012,106:101-109.
[13]HUANG X, WANG Y, LIU W, et al.Biological removal of inhibitors leads to the improved lipid production in the lipid fermentation of corn stover hydrolysate by Trichosporon cutaneum[J].Bioresource Technol,2011,102(20):9705-9709.
[14]TALORIA D, SAMANTA S, DAS S, et al.Increase in bioethanol production by random UV mutagenesis of S.cerevisiae and by addition of zinc ions in the alcohol production media[J].APCBEE Procedia,2012,2:43-49.
[15]王璞,田沈,王丹,等.高耐毒性酿酒酵母的紫外诱变选育[J].可再生能源,2007,4(3):31-33,38.
[16]MOBINI D M,NAHYVI I,ZARKRESH EH,et al.Isolation of a novel mutant strain of Saccharomyces cerevisiae by an ethyl methane sulfonate-induced mutagenesis approach as a high producer of bioethanol[J].J Biosci Bioeng,2008,105(4):403-408.
[17]路亚婷.甲基磺酸乙酯(EMS)诱变定向提高酿酒酵母对糠醛耐受性的初步研究[D].成都:四川农业大学,2017.
[18]李小娟,黄瑞,张超,等.定向驯化筛选耐毒酵母[J].食品工业科技,2014,35(7):163-167.
[19]KEATING J D,PANGANIBANC H,MANSFIELD S D.Tolerance and adaptation of ethanologenic yeasts to lignocellulosic inhibitory compounds[J].Biotechnol Bioeng,2006,93(6):1196-1206.
[20]吴宇,王金华,赵筱.GLN1基因过表达对提高酿酒酵母糠醛耐受性的研究[J].生物技术通报,2020,36(8):69-78.
[21]相瑞娟.木质纤维素水解液抑制物高抗性酵母的选育[D].大连:大连理工大学,2016.
[22]CHEN Y, SHENG J, JIANG T, et al.Transcriptional profiling reveals molecular basis and novel genetic targets for improved resistance to multiple fermentation inhibitors in Saccharomyces cerevisiae[J].Biotechnol Biofuel,2016,9:1-18.
[23]LUO P,ZHANG Y,SUO Y,et al.The global regulator IrrE from Deinococcus radiodurans enhances the furfural tolerance of Saccharomyces cerevisiae[J].Biochem Eng J,2018,136:69-77.
[24]孔帅,陈敏,郑美娟,等.常温常压等离子体诱变选育高产L-异亮氨酸谷氨酸棒杆菌[J].中国酿造,2019,38(7):76-79.
[25]许鹏飞,郭金玲,吕育财,等.常压室温等离子体诱变选育高产油脂皮状丝孢酵母的研究[J].中国油脂,2019,44(3):123-127.
[26]赵静宇,陈泉,马琳琳,等.常压室温等离子体(ARTP)诱变介导的赤藓糖醇生产菌的筛选与优化[J].生物加工过程,2022,20(3):263-269.
[27]陈胜杰,高翔,袁戎宇.常温常压等离子诱变结合玉米秸秆水解液驯化酿酒酵母生产生物乙醇[J].食品与发酵工业,2020,46(4):167-171.
[28]孙哲.ARTP诱变小球藻的碳水化合物积累及生物乙醇产生特性[D].西安:西安建筑科技大学,2021.