细菌纤维素(bacterial cellulose,BC)是由微生物发酵合成的多孔性网状纳米级生物高分子聚合物。它是由β-D-吡喃型葡萄糖通过β-1,4糖苷键结合成的直链分子,因此又称为β-1,4-葡聚糖[1-2]。因其特有的高纯度、高抗拉强度、高持水性、生物降解性、生物适应性等优点[4],被广泛应用于食品[5-6]、医疗[7]、纺织、纳米生物材料[8-9]等领域。它是一种天然生物基类高分子物质,可以满足人类对于可降解和环境友好等产品要求,但同时其存在产量低、生产成本高等缺点[10-12]。目前,对于细菌纤维素制备的来源主要集中在农作物[13-14]、纺织物等领域[15],而对来源于废弃烟叶的研究相对较少,并绝大多数仅对细菌纤维素单菌发酵进行试验研究。张婷婷等[16]研究表明,烟末水浸提液可直接作为发酵原料生产细菌纤维素,无需额外添加碳源和氮源。张妍等[17]研究表明,醋酸菌与酵母菌混合发酵可提高细菌纤维素膜的产量。
本研究以废弃烟叶为来源进行产细菌纤维素菌株筛选及分离纯化,通过形态学观察、生理生化鉴定及16S rDNA序列分析对筛选得到的菌株进行鉴定。以废弃烟叶浸提液为碳源和氮源,将该筛选菌株与酿酒酵母(Saccharomyces cerevisiae)(1∶1)混合发酵,并使用单因素、Plackett-Burman和Box-Benhnken试验优化混菌发酵工艺,以期提高细菌纤维素的产量,为细菌纤维素的工业化生产提供科学基础,同时为烟草废弃物资源的开发利用提出新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
废弃烟叶:由河南农业大学许昌试验基地提供;酿酒酵母(Saccharomyces cerevisiae):河南农业大学实验室保藏菌种。
1.1.2 化学试剂
无水乙醇、葡萄糖、磷酸氢二钠、柠檬酸、氢氧化钠(均为分析纯)、琼脂粉(生化试剂):国药集团化学试剂有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天津擎科生物技术有限公司。
1.1.3 培养基[18]
斜面培养基:葡萄糖20.0 g/L,酵母粉5.0 g/L,Na2HPO4·12H2O 2.7 g/L,柠檬酸1.15 g/L,琼脂粉20.0 g/L,pH 6.0。115 ℃灭菌20 min。
富集液体培养基:葡萄糖20.0 g/L,酵母粉5.0 g/L,Na2HPO4·12H2O 2.7 g/L,柠檬酸1.15 g/L,pH 6.0。115 ℃灭菌20 min
富集固体培养基:葡萄糖20.0 g/L,酵母粉5.0 g/L,Na2HPO4·12H2O 2.7 g/L,柠檬酸1.15 g/L,碳酸钙10 g/L,琼脂粉20.0 g/L,pH 6.0。115 ℃灭菌20 min。
HS培养基:葡萄糖20.0 g/L,酵母粉5.0 g/L,蛋白胨5.0 g/L,Na2HPO4·12H2O 2.7 g/L,柠檬酸1.15 g/L,pH 6.0。115 ℃灭菌20 min
废弃烟叶浸提液培养基:烟末100 g/L,在70 ℃条件下浸提100 min后过滤,pH 5.5,120 ℃灭菌10 min。
1.2 仪器与设备
TGL-18M高速冷冻离心机:上海卢湘仪离心机仪器有限公司;UV1800PC紫外可见分光光度计:上海菁华科技仪器有限公司;G180立式自动压力蒸汽灭菌锅:致微(厦门)仪器有限公司;4-HWS-P400C恒温恒湿培养箱:合肥达斯卡特生物科技有限公司;PHS-3C精密pH酸度计:上海仪电科学仪器股份有限公司;ADV-20Q超纯水机:河南森空仪器设备有限公司;Mastercycler nexus GSX1梯度聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Eppendorf公司;DYY-6C型电泳仪:北京六一生物科技有限公司;TS-680B凝胶成像仪:培清生物科技有限公司。
1.3 方法
1.3.1 废弃烟叶中产细菌纤维素菌株的分离、纯化和筛选[19]
用电子天平称取5 g废弃烟叶,用粉碎机粉碎过60目筛,然后将粉末样品放入装有150 mL无菌水的锥形瓶中,30 ℃、160 r/min恒温摇床振荡培养8 h,将菌液按10-3、10-4、10-5梯度稀释后涂布于平板上,30 ℃培养5 d,选取菌落周围有透明圈的菌株进行划线分离纯化。
用接种环挑取分离纯化后的菌株,接入经灭菌装有12mL富集液体培养基的试管中,在30 ℃条件下静置培养7 d,接种时需充分振荡,以使菌液均匀。观察试管中是否有白色胶状菌膜产生,若有菌膜则继续转接培养,以富集优势菌株。
在无菌条件下将胶状菌膜取出置于生理盐水中浸提24 h,取浸提液经梯度稀释后平板涂布培养5 d,挑取长势优良的单菌落进一步划线分离纯化,纯化后的菌株转入斜面培养基中并置于4 ℃冰箱保藏备用。
1.3.2 细菌纤维素的制备及产量测定[20]
将产纤维素菌株分别按4%的接种量接种至装有100 mL的HS液体培养基中,28 ℃条件下静置培养9 d,获得细菌纤维素湿膜。取细菌纤维素湿膜经蒸馏水多次冲洗至菌膜表面无杂质残留,将其置于0.5%的NaOH溶液中浸泡并煮沸30 min,去除液膜中的菌体和残留培养基,再用0.5%的乙酸浸泡5~10 min以中和NaOH溶液,然后用蒸馏水多次浸泡冲洗细菌纤维素膜直至薄膜呈乳白色半透明,用滤纸吸干纤维素表面的水分后放入60~80 ℃烘箱中烘干至恒质量,称取烘干后膜的质量,细菌纤维素产量以g/L表示。
1.3.3 筛选菌株鉴定
(1)形态学观察
将该菌株接种于HS培养基上,30 ℃培养24 h,观察菌落形态,对菌落进行革兰氏染色,并在100×油镜下观察结果。
(2)生理生化试验
参考《伯杰氏细菌鉴定手册》[21]和《常见细菌系统鉴定手册》[22]关于产纤维素细菌的鉴定方法,对筛选菌株进行需氧性鉴定、过氧化氢酶接触试验、乳酸钙氧化试验、乙酸氧化试验、乙醇氧化试验、甘油生酮试验、产纤维素试验等。
(3)分子生物学鉴定
使用DNA提取试剂盒提取筛选菌种总基因组DNA,采用通用引物27F:5'-TACGGYTACCTTGTTACGACTT-3'和1492R:5'-AGAGTTTGATCMTGGCTCAG-3' PCR扩增16SrDNA序列。PCR扩增体系(25μL):模板DNA10μL,引物各5μL,Taq酶0.2μL,10×TaqBuffer缓冲液2.5μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphate,dNTPs)2 μL,双蒸水(ddH2O)8.3 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s,55 ℃复性30 s,72 ℃延伸45 s,共27个循环;72℃再延伸10min。通过1%琼脂糖凝胶电泳分析PCR产物条带是否与目的大小相符,是否单一,有无拖带。PCR扩增到目的片段的克隆即为连接有16S rDNA片段的目标克隆。培养目标克隆后送北京六合华大基因科技股份有限公司测序。PCR产物检测合格后,切割目的条带进行纯化回收,用回收后的产物进行Sanger测序。将测序结果进行序列拼接和去除多余碱基后,登录美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库进行基本局部比对搜索工具(basic localalignmentsearch tool,BLAST)同源性比对,利用软件MEGA5.0中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.4 单菌发酵与混菌发酵对细菌纤维素产量的影响
将筛选菌株和酿酒酵母各取2环,分别接入装液量为50 mL/250 mL灭菌HS液体培养基中,于30 ℃、160 r/min条件下振荡培养24 h,得到种子液[23]。并将筛选菌株种子液、筛选菌株和酿酒酵母(1∶1)混菌种子液分别按照1%接种量接种于废弃烟叶浸提液培养基中,于30 ℃下静置培养7 d,分别考察筛选菌株单菌发酵、筛选菌株和酿酒酵母混菌发酵对细菌纤维素产量的影响。
1.3.5 混菌发酵工艺优化
(1)单因素试验
以BC产量为评价指标,以废弃烟叶浸提液培养基为发酵基质,分别研究废弃烟叶浸提液添加量(5%、8%、10%、12%、15%)、初始pH值(4.5、5.0、5.5、6.0、6.5)、筛选菌株与酿酒酵母(1∶1)混菌接种量(0.1%、0.5%、1.0%、1.5%、2.0%)、发酵时间(4 d、5 d、6 d、7 d、8 d)、发酵温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)对细菌纤维素产量的影响。
(2)Plackett-Burman试验设计
在单因素试验的基础上,运用Design Expert 8.0.6软件设计12次Plackett-Burman试验,考察废弃烟叶浸提液添加量(X1)、混菌接种量(X2)、初始pH值(X3)、发酵时间(X4)、发酵温度(X5)对细菌纤维素产量(Y)的影响,每个因素设计高(1)、低(-1)2个水平,Plackett-Burman试验设计因素与水平见表1。
表1 Plackett-Burman试验设计因素与水平
Table 1 Factors and levels of Plackett-Burman experiments design
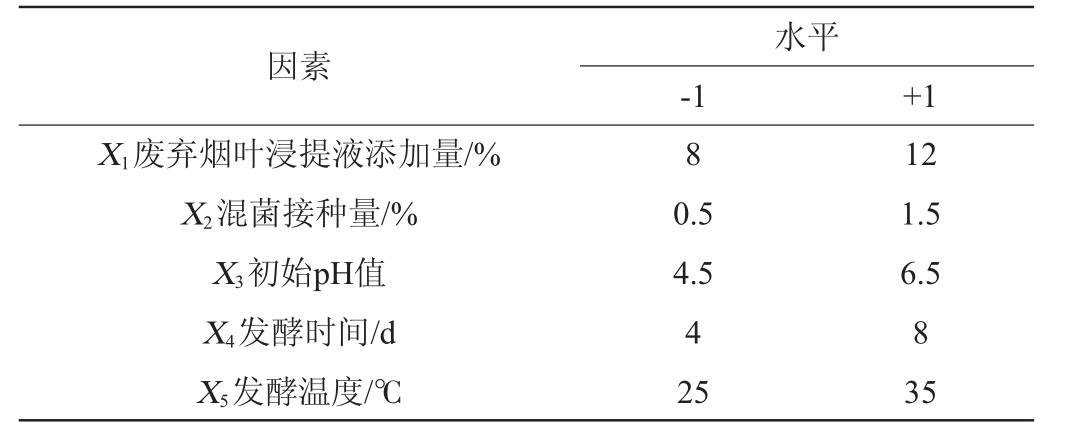
水平-1 +1因素X1废弃烟叶浸提液添加量/%X2混菌接种量/%X3初始pH值X4发酵时间/d X5发酵温度/℃8 0.5 4.5 4 25 12 1.5 6.5 8 35
(3)最陡爬坡试验
根据Plackett-Burman试验筛选结果,按照显著因素效应大小及其与响应值之间的相关系数确定各因素的步长和变化方向,从而以最快速度靠近最佳区域。根据最陡爬坡试验结果找到细菌纤维素产量最高工艺组合,确定Box-Behnken响应面试验中心点。
(4)响应面试验
以废弃烟叶浸提液添加量(X1)、混菌接种量(X2)、初始pH值(X3)3个影响因素为自变量,以细菌纤维素产量(Y)为响应值,进行3因素3水平Box-Behnken响应面试验,优化废弃烟叶混菌发酵工艺条件。Box-Behnken响应面试验因素与水平见表2。
表2 Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken experiments design
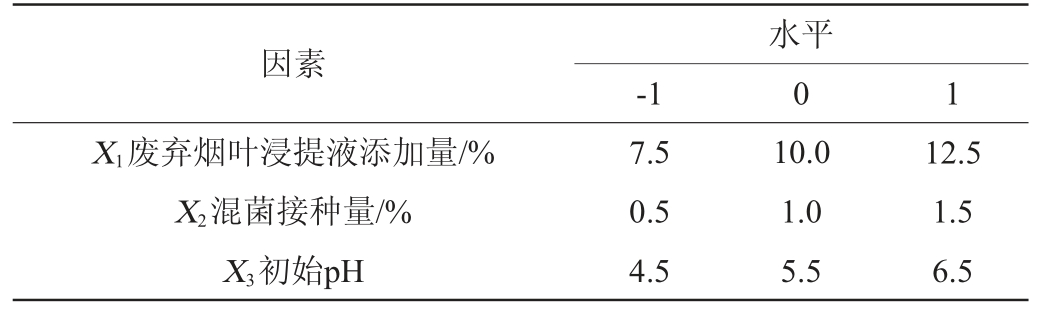
0 1因素X1废弃烟叶浸提液添加量/%X2混菌接种量/%X3初始pH 7.5 0.5 4.5水平-1 10.0 1.0 5.5 12.5 1.5 6.5
1.3.6 数据处理
使用Excel 2019、SPSS 26.0、GraphPad Prism等软件进行数据分析和绘图,采用Design Expert 8.0.6软件进行响应面试验结果分析。
2 结果与分析
2.1 产细菌纤维素菌株的筛选
按照1.3.1的方法从自然腐烂的废弃烟叶浸提液中筛选到1株产细菌纤维素的菌株,将该菌株命名为YC1。该菌株产生的纤维素薄膜可悬浮在试管表面,具有一定厚度,摇晃不会轻易散开。
2.2 菌株YC1的鉴定
2.2.1 形态学观察
菌株YC1的菌落及细胞形态观察结果见图1。由图1a可知,菌株YC1的菌落为淡黄色、光滑、中央凸起、不产色素。由图1b可知,经革兰氏染色后,菌体细胞呈红色杆状,为革兰氏阴性菌。
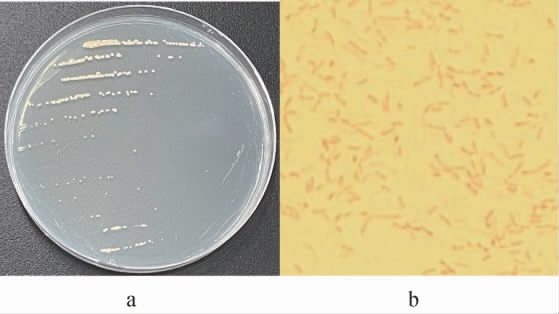
图1 菌株YC1的菌落(a)及细胞(b)形态
Fig.1 Colony (a) and cell (b) morphology of strain YC1
2.2.2 生理生化试验
菌株YC1的生理生化试验结果见表3。由表3可知,菌株YC1生长需要氧气,在接触酶试验中反应呈阳性,没有氧化乙醇和乙酸盐的能力,能氧化甘油生成生酮物质,能氧化乳酸钙生成碳酸盐,能产生纤维素。
表3 菌株YC1主要生理生化试验结果
Table 3 Results of main physiological and biochemical tests of strain YC1
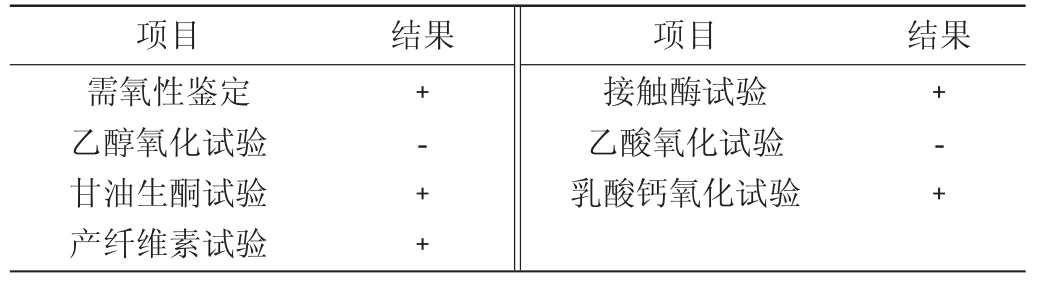
注:“+”表示结果呈阳性;“-”表示结果呈阴性。
项目 结果 项目 结果需氧性鉴定乙醇氧化试验甘油生酮试验产纤维素试验﹢-﹢﹢接触酶试验乙酸氧化试验乳酸钙氧化试验﹢-﹢
2.2.3 基于16S rDNA序列分子生物学鉴定
菌株YC1经PCR扩增,获得16SrDNA 1 412bp序列,将该序列提交至NCBI的GenBank数据库进行BLAST 16S rDNA序列同源性比较,利用软件MEGA5构建系统发育树,结果见图2。由图2可知,菌株YC1与氧化葡萄糖酸杆菌(Gluconobacter oxydans)KACC 22394亲缘关系最近,结合形态学、生理生化试验结果,鉴定菌株YC1为氧化葡萄糖酸杆菌(Gluconbacter oxydans)。

图2 基于16S rDNA基因序列菌株YC1的系统发育树
Fig.2 Phylogenetic tree of strain YC1 based on 16S rDNA gene sequence
2.3 单菌发酵与混菌发酵对细菌纤维素产量的影响
菌株YC1单菌发酵时细菌纤维素产量为1.18 g/L,菌株YC1与酿酒酵母菌以1∶1混菌发酵时细菌纤维素产量为1.86 g/L。混菌发酵时细菌纤维素的产量明显大于单菌发酵,可能是因为氧化葡萄糖酸杆菌与酵母菌之间存在共生关系,可以促进氧化葡萄糖酸杆菌生产纤维素膜;同时在发酵过程中酵母菌会产生低浓度乙醇作为第二碳源,增加了氧化葡萄糖酸杆菌产纤维素膜时所需要的营养物质,从而促进了氧化葡萄糖酸杆菌分泌更多的纤维素[23]。因此,选择氧化葡萄糖酸杆菌YC1与酿酒酵母以1∶1混菌发酵。
2.4 混菌发酵工艺优化单因素试验
废弃烟叶浸提液添加量、混菌接种量、初始pH值、发酵时间及发酵温度对细菌纤维素产量的影响结果见图3。
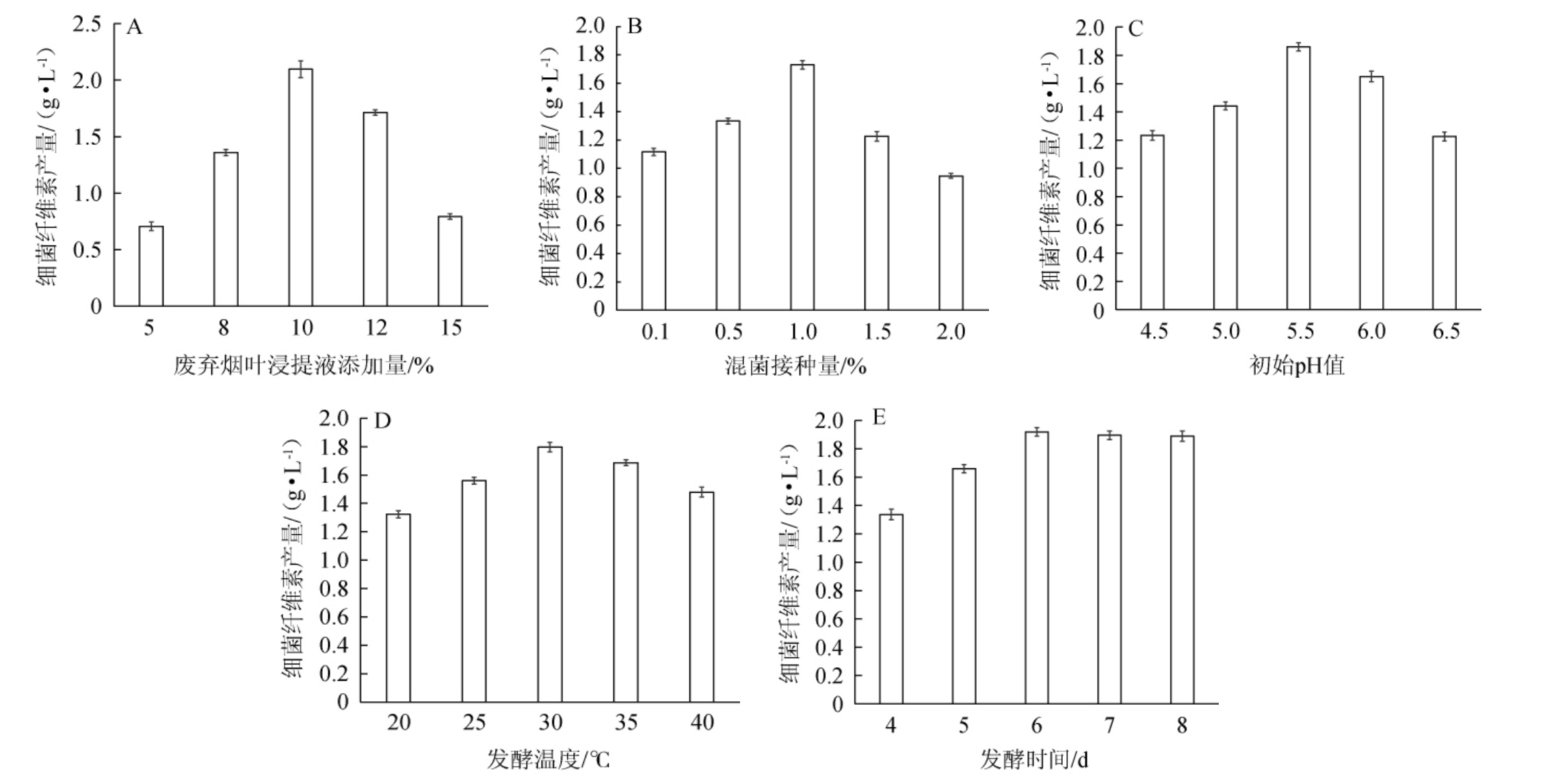
图3 废弃烟叶浸提液添加量(A)、混菌接种量(B)、初始pH值(C)、发酵温度(D)及发酵时间(E)对细菌纤维素产量的影响
Fig.3 Effects of waste tobacco leaf extract addition (A), mixed-strains inoculum (B), initial pH (C), fermentation temperature (D) and time (E) on the yield of bacterial cellulose
由图3A可知,废弃烟叶浸提液添加量在5%~10%范围内增加,细菌纤维素产量随之逐渐增加;当废弃烟叶浸提液添加量为10%时,细菌纤维素产量达到最大,为2.09 g/L;废弃烟叶浸提液添加量在10%~15%范围内,细菌纤维素产量逐渐下降。这是由于废弃烟叶浸提液中含有糖、氨基酸、无机盐等营养物质,可作为发酵底物,满足菌体生长。但同时也因含有烟碱,当添加量过大时,溶液pH过高,抑制了细菌纤维素的合成。因此,最佳废弃烟叶浸提液添加量为10%。
由图3B可知,混菌接种量在0.1%~1.0%范围内增加,细菌纤维素产量随之逐渐增加;当混菌接种量为1.0%时,细菌纤维素产量最大,为1.73 g/L;接种量在1.0%~2.0%范围内增加,细菌纤维素产量逐渐下降。这可能是因为当混菌接种量过高时,不同菌株之间可能会有竞争,导致营养物质过度消耗,从而影响菌株的生长和细菌纤维素的产量。因此,最佳混菌接种量为1.0%。
由3C可知,初始pH值在4.5~5.5范围内增加,细菌纤维素产量随之逐渐增加;初始pH值在5.5时,细菌纤维素产量最大,为1.86 g/L;初始pH值在5.5~6.5范围内增加,细菌纤维素产量逐渐下降。这可能是因为菌株的生长发育通常对特定的pH有一定的适应性,如果pH过高,会影响到营养物质的吸收和细胞内环境的稳定,从而抑制了菌株正常生长,影响细菌纤维素的合成。因此,最佳初始pH值为5.5。
由3D可知,发酵温度在20~30 ℃范围内增加,细菌纤维素产量随之逐渐增加;当发酵温度在30 ℃时,细菌纤维素产量最大,为1.8 g/L;发酵温度在30~40 ℃范围内增加,细菌纤维素产量逐渐下降。这可能是因为细菌纤维素的合成需要依赖于酶来分解蛋白质、糖类、无机盐等物质,当发酵温度过高时,会降低酶的活性,从而造成细菌纤维素产量的下降。因此,最佳发酵温度为30 ℃。
由3F可知,发酵时间在4~6 d范围内增加,细菌纤维素产量随之逐渐增加;当发酵时间在6 d时,细菌纤维素产量最大,为1.92 g/L;发酵时间在6~8 d范围内增加,细菌纤维素产量基本稳定。这可能是因为在发酵后期,碳源、氮源等营养物质被大量消耗,不足以继续提供菌株的生长需要,从而降低了细菌纤维素的合成。因此,最佳发酵时间为6 d。
2.5 混菌发酵工艺优化响应面试验
2.5.1 Plackett-Burman试验
Plackett-Burman试验设计与结果见表4,Plackett-Burman试验显著性分析结果见表5。利用Design-Expert 8.0.6软件对表4数据进行多元回归拟合,得到多元一次回归方程为:Y=2.029+0.048X1-0.118X2-0.110X3+0.006X4+0.003X5。
表4 Plackett-Burman试验设计及结果
Table 4 Design and results of Plackett-Burman experiments

编号 X1 X2 X3 X4 X5 Y 细菌纤维素产量/(g·L-1)1 2 3 4 5 6 7 8 9 1 0 1 1 1-1 1-1 1-1-1-1-1-1-1 1-1-1-1-1-1-1 1 1 1 -1-1-1-1-1-1 1-1 1-1 1 1 1 --1 1 1 -11 12 1 1 1 1 1 1 1 -1 1 1 -1 1 1 1 -1 1 1 1 1 -1-1 2.21 2.01 2.39 1.56 2.33 1.89 2.05 1.71 1.69 2.18 2.27 2.28
表5 Plackett-Burman试验结果方差分析
Table 5 Variance analysis of Plackett-Burman experiments results

注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。下同。
因素 回归系数 效应 P 值 重要性排序X1X2X3X4X5 0.048-0.118-0.110 0.006 0.003 0.46-0.12-0.22 0.024 0.051<0.000 1**0.014 0*0.000 7**0.507 2 0.188 6 1 3 2 5 4
由表5可知,该模型决定系数R2=0.975,P<0.000 1,说明模型具有极显著性。5个影响因子对细菌纤维素产量的影响顺序由大到小为:废弃烟叶浸提液添加量(X1)>初始pH值(X3)>混菌接种量(X2)>发酵温度(X5)>发酵时间(X4),其中废弃烟叶浸提液添加量(X1)、混菌接种量(X2)、初始pH值(X3)对结果影响显著(P<0.01或P<0.05)。因此,选择废弃烟叶浸提液添加量(X1)、混菌接种量(X2)、初始pH值(X3)进行下一步试验。
2.5.2 最陡爬坡试验
对废弃烟叶浸提液添加量(X1)、混菌接种量(X2)、初始pH值(X3)3个因素进行最陡爬坡试验,结果见表6。由表6可知,当废弃烟叶浸提液添加量为10%、混菌接种量为1.0%、初始pH值为5.5时,细菌纤维素产量最大(2.39 g/L)。因此将其作为中心点,进行Box-Behnken试验。
表6 最陡爬坡试验设计及结果
Table 6 Design and results of the steepest climbing tests

试验号X1废弃烟叶浸提液添加量/%X2混菌接种量/%X3初始pH值Y 细菌纤维素产量/(g·L-1)1 2 3 4 5 8 9 1 0 11 12 0.50 0.75 1.00 1.25 1.50 6.5 6.0 5.5 5.0 4.5 1.53 1.84 2.39 2.01 1.72
2.5.3 Box-Behnken试验
在Plackett-Burman试验和最陡爬坡试验基础上,以废弃烟叶浸提液添加量(X1)、混菌接种量(X2)、初始pH值(X3)为自变量,以细菌纤维素产量(Y)为响应值,进行Box-Behnken响应面试验,结果见表7,回归模型方差分析结果见表8。
表7 Box-Behnken试验设计与结果
Table 7 Design and results of Box-Behnken experiments

试验号 X1 X2 X3 Y 细菌纤维素产量/(g·L-1)1 2 3 4 5 6 7 8 9 1 0 0 0 1 -1 1 0 0 0 -0 0 1 1 0 -1 0 -1 0 -1 0 0 0 0 1 1 0 -1-1 11 12 13 14 15 16 17 1 1-1-1-1 0 0 1 0 0 0 1 0 0 0 1 0 0 1 -1 0 -1 0 1 2.72 2.72 2.18 2.01 2.11 2.06 2.74 1.90 1.80 1.98 1.89 2.13 1.96 2.72 2.07 2.73 2.21
表8 回归模型方差分析
Table 8 Variance analysis of regression model

方差来源 平方和 自由度 均方 F 值 P 值模型X1 X2 X3 X1X2 X1X3 X2X3 X12 X22 X32残差失拟项纯误差总离差1.917 0.033 0.033 0.075 0.002 0.019 0.001 0.54 0.53 0.49 0.002 0.002 0.004 1.91 9 1 1 1 1 1 1 1 1 1 7 3 4 1 6 0.21 0.033 0.033 0.075 0.002 0.019 0.001 0.54 0.53 0.49 0.0003 0.000 5 0.000 09 748.42 115.46 117.88 263.05 6.76 67.93 4.54 1 893.82 1 877.34 1 740.86<0.000 1**<0.000 1**<0.000 1**<0.000 1**0.035 4*<0.000 1**0.070 5<0.000 1**<0.000 1**<0.000 1**5.98 0.058 4
表7数据通过Design-Expert 8.0.6软件分析,得到多元二次回归方程如下:Y=-11.532+1.221X1+1.206X2+1.123X3+0.004X1X2-0.013X1X3+0.004X2X3-0.057X12-0.089X22-0.086X32。
由表8可知,回归模型具有极显著性(P<0.01),失拟项不显著(P>0.05),说明模型可行,误差较小,决定系数R2=0.999,说明模型拟合度好,能较好反映各考察因素与响应值之间的关系。由P值可知,一次项X1、X2、X3,交互项X1X3,二次项X12、X22、X32对结果影响极显著(P<0.01),交互项X1X2对结果影响显著(P<0.05),交互项X2X3对结果影响不显著(P>0.05)。由F值可知,影响细菌纤维素产量的主次顺序为初始pH值(X3)>混菌接种量(X2)>废弃烟叶浸提液添加量(X1)。
响应面及等高线可以考察各项单因素的交互作用对细菌纤维素产量的影响,响应面坡度越陡峭,等高线呈椭圆形,交互作用对结果影响越显著[24-25]。各因素间交互作用对细菌纤维素产量影响的响应曲面及等高线见图4。由图4可知,废弃烟叶浸提液添加量和混菌接种量、废弃烟叶浸提液添加量和初始pH值之间曲面陡峭,等高线呈椭圆形,交互作用显著(P<0.01或P<0.05);混菌接种量和初始pH值之间曲面较平缓,等高线呈圆形交互作用不明显。这与方差分析结果一致。

图4 各因素间交互作用对细菌纤维素产量影响的响应曲面及等高线
Fig.4 Response surface plots and contour lines of effects of interaction between various factors on the yield of bacterial cellulose
采用Design-Expert 8.0.6软件对多元二次回归方程分析得出最佳发酵工艺条件为:废弃烟叶浸提液添加量10.2%,混菌接种量1.02%,初始pH值为5.57,发酵温度30 ℃,发酵时间6 d。在此工艺条件下,细菌纤维素产量预测值为2.74 g/L。考虑实际操作可行性,将最佳发酵工艺条件修正为:废弃烟叶浸提液添加量10%,混菌接种量为1.0%,初始pH值为5.5,发酵温度30 ℃,发酵时间6 d。在该最佳条件下进行3次平行验证试验,得到细菌纤维素产量平均实际值为2.71 g/L,与预测值相差不大,比单菌发酵纤维素产量提高了1.29倍,表明该工艺可行。
3 结论
从废弃烟叶浸提液中分离筛选出一株提高细菌纤维素产量的菌株YC1,其被鉴定为氧化葡萄糖酸杆菌(Glucon bacter oxydans),利用该菌株和酿酒酵母混菌(1∶1)发酵,通过单因素、Plackett-Burman和Box-Benhnken试验确定最佳发酵工艺条件为:废弃烟叶浸提液添加量10%,菌株YC1与酿酒酵母(1∶1)混菌接种量1.0%,初始pH值5.5,发酵温度30 ℃,发酵时间6 d。在该优化条件下,细菌纤维素产量最大,为2.71 g/L,比单菌发酵提高了1.29倍。这可能是由于氧化葡萄糖酸杆菌与酵母菌之间存在共生关系,可以促进氧化葡萄糖酸杆菌生产纤维素膜,该研究为提高细菌纤维素的应用开发奠定了基础。
[1]朱晓东,杜昀怡,原续波,等.细菌纤维素的最新研究进展[J].高分子通报,2022(5):17-26.
[2]赵鑫,熊健力,任叶琳,等.细菌纤维素合成与鉴定研究综述[J].化工进展,2020,39(2):262-268.
[3]LAHIRI D, NAG M, DUTTA B, et al.Bacterial cellulose: Production,characterization and application as antimicrobial agent[J].Int J Mol Sci,2021,22(23):12984.
[4]YAMANAKA S, WATANBEE K, KITAMURA N.The structure and mechanical properties of sheets prepared from bacterial cellulose[J].J Mat Sci,1989,24(9):3141-3145.
[5]周小燕.负载茶多酚脂质体的壳聚糖/细菌纤维素缓释包装膜的构建与应用[D].无锡:江南大学,2024.
[6]KUSWANDI B, ASIH N P N, PRATOKO D K, et al.Edible pH sensor based on immobilized red cabbage anthocyanins into bacterial cellulose membrane for intelligent food packaging[J].Packag Technol Sci,2020,33(8):321-332.
[7]董宝亭.生物质多糖制备水凝胶柔性传感器及其传感性能[D].济南:齐鲁工业大学,2024.
[8]李瑞赞,马维.细菌纤维素用作伤口敷料的研究[J].辽宁丝绸,2024,52(1):39-40.
[9]杨惠仪,张栗杨,丁蒙,等.功能化细菌纤维素纳米晶复合聚氨酯医用抗菌涂层的制备及性能研究[J].纤维素科学与技术,2024,32(1):28-38.
[10]ULLAH H,SANTOS H A,KHAN T.Applications of bacterial cellulose in food,cosmetics and drug delivery[J].Cellulose,2016,23(4):2291-2314.
[11]WONG K H,LI G Q,LI K M,et al.Optimisation of Pueraria isoflavonoids by response surface methodology using ultrasonic-assisted extraction[J].Food Chem,2017,231:231-237.
[12]杨依维,刘玉飞,何敏.细菌纤维素的制备及在食品中的应用进展[J].纤维素科学与技术,2022,30(3):45-51.
[13]苏玉玉.玉米水解液发酵合成细菌纤维素[J].化学工程与装备,2022,51(2):30-31.
[14]邓健,刘四新,杨一冲,等.椰子水的发酵预处理对细菌纤维素合成促进作用研究[J].广东农业科学,2015,42(19):84-88.
[15]陈毅晖.利用废弃纺织品制备细菌纤维素[D].武汉:武汉纺织大学,2022.
[16]张婷婷,冯颖杰,杨宗灿,等.利用废烟末发酵制备细菌纤维素[J].食品与机械,2020,36(6):198-202.
[17]张妍,徐伟,傅徐阳.红茶菌产细菌纤维素菌种分离与初步鉴定[J].食品工业,2012,33(10):123-125.
[18]曹海鹏,袁帅,赵昆,等.细菌纤维素高产菌株的筛选及鉴定[J].食品科学,2010,31(5):211-214.
[19]江焕渊.细菌纤维素高产菌株筛选鉴定、细菌纤维素性能测定和共培养发酵的初步研究[D].海口:海南大学,2023.
[20]卢美欢,马英辉,王银存,等.一株细菌纤维素生产菌的分离鉴定[J].中国酿造,2013,32(7):46-49.
[21]BUCHANAN R E.伯杰氏细菌鉴定手册(第八版)[M].北京:科学出版社,1984:325-328.
[22]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:409-412.
[23]王洁琛,陈志周,王颖,等.红茶菌中醋酸菌和酵母菌的分离鉴定及其相互作用[J].中国酿造,2020,39(3):126-130.
[24]赵浩杰,王光翟,廖博文,等.响应面法优化动态发酵细菌纤维素菌株HS01培养基[J].纤维素科学与技术,2020,28(4):1-9,27.
[25]李文兵,毕江涛,惠治兵,等.一株纤维素降解菌的分离、鉴定及发酵优化[J].安徽农业大学学报,2021,48(3):458-466.