中国白酒的酿造有悠久的历史,白酒经过历史的沉淀形成了特色鲜明、风格迥异的多种香型,其中浓香型白酒具有芳香浓郁、绵柔甘洌、香味协调、入口甜、落口绵、尾净余长等特点[1],成为白酒行业的主流产品[2]。窖泥作为浓香型白酒酿造过程中微生物的载体,在风味形成过程中发挥着产酸呈味、产酯生香的重要作用。浓香型白酒的酿造讲究“千年老窖万年糟”,采用的是“续糟配料,混蒸混烧”的工艺[3],随着窖泥被持续不间断地使用,以及粮糟的持续不断向窖泥中引入营养物质,使窖泥与粮糟之间形成了“以糟养窖,以窖养糟”的关系[4]。在酿造发酵过程中有机酸、醇类、酯类等物质渗入窖泥中,使窖泥中的酿酒微生物在发酵过程中不断演化,大量具有产酒和增香功能的微生物被富集,使老窖泥在菌群组成上相对新窖泥形成了更为丰富和稳定的代谢网络[5]。窖泥中微生物的群落组成及多样性反映了窖泥的质量[6],其中包括大量的梭菌属(Clostridium)、产己酸菌属(Caproiciproducen)、乳杆菌属(Lactobacillus)、芽孢杆菌属(Bacillus)等在白酒酿造过程中发挥重要作用的功能菌群,这些功能菌群在浓香型白酒固态发酵过程中能够产生乙酸、丁酸、己酸和乳酸,为浓香型白酒中己酸乙酯、乳酸乙酯、乙酸乙酯等重要风味物质提供前体物质,对浓香型白酒风味的形成以及白酒品质有着重要的影响[1]。
浓香型白酒窖泥因其在发酵过程中长期与糟醅接触且与空气隔绝,从而营造了一个富含营养物质且厌氧的环境,为窖泥中的功能菌提供了适宜的生长环境[7]。随着高通量技术广泛应用于窖泥菌群的研究,极大地丰富了人们对窖泥微生物群落的认识,窖泥也成为了近年来酿造功能菌分离筛选的主要对象。随着培养组学的发展,近年来已有约23个窖泥来源的微生物新种被报道,GU Y等[8]从浓香型白酒窖泥中分离出的解淀粉己酸杆菌(Caproicibacterium amylolyticum)LBM1008以葡萄糖为主要碳源时能同时产生乙酸、丁酸、己酸和乳酸;WANG H等[9]从浓香型白酒中分离出的解乳酸己酸杆菌(Caproicibacterium lactatifermentans)LBM19010能够利用葡萄糖和乳酸产生丁酸和己酸;LUO Q等[10]从浓香型白酒窖泥中分离出一株能产生丁酸、戊酸乙酯、乙酸乙酯和2-戊酮等挥发性风味物质的产香梭状芽孢杆菌(Clostridium aromativorans)WLY-B-L2;YIN Q等[11]从20年窖龄的浓香型窖泥中分离出能利用葡萄糖发酵产生乙醇和丁酸的甘草梭状芽孢杆菌(Clostridium liquoris)BEY10;XU P X等[12]从浓香型窖泥中分离出一株主要产物为对甲苯酚的老窖梭状芽孢杆菌(Clostridium fermenticellae)JN500901。对这些窖泥功能菌开展相应的应用研究有助于解决窖泥老化和延缓老化,并改善窖泥的微生物群落结构,从而提升窖泥质量和产酒品质。徐占成等[13]将从窖泥中分离的一株生孢梭菌(Clostridium sporogenes)制成功能菌液对人工培养的窖泥进行强化,使窖泥老熟度标志性微生物梭菌属的相对丰度提高1.73倍,甲烷八叠球菌属的相对丰度提高2.04倍,且经过强化后的窖泥生产的酒体中己酸乙酯的含量提高60%,使人工窖泥的品质已接近5年窖龄水平。徐敬征等[14]从浓香型白酒窖泥中筛选出纯种己酸菌液、丙酸菌液、丁酸菌液与优质窖泥培菌液组合成复合功能菌液对窖泥进行养护,丰富了普通窖池的菌群,使从养护过的窖泥中获得的白酒中己酸乙酯的含量提高了70 mg/mL,对窖泥的质量和酒质的提高均有显著的效果。对窖泥微生物开展分离筛选研究对解析和应用浓香型白酒窖泥功能微生物具有重要意义。
本研究以优质窖泥为样本,采用多种培养基进行富集后对细菌进行分离筛选,并结合16S rRNA序列进行比较,通过系统发育学分析确定各细菌的分类学地位及种群关系;通过发酵试验对颤螺旋菌科(Oscillospiraceae)己酸菌的发酵产物开展初步研究,为浓香型白酒固态酿造体系提供丰富的功能微生物菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 样本
富集所用窖泥采集于四川省某浓香型白酒厂。取样时待窖池黄水抽干后,在窖底四角及中心位置挖取深度约5 cm的表层窖泥,质量约为200 g,混合均匀,立即放入无菌厌氧封口袋中,4 ℃保温箱中运回实验室待用。
1.1.2 主要试剂
葡萄糖、可溶性淀粉、无水乙酸钠、乳酸钠、丁酸钠、氯化钠、氯化铵、碳酸氢钠、九水合硫化钠、L-半胱氨酸盐酸盐、碳酸钙、磷酸二氢钾、磷酸氢二钾、氯化钙、硫酸锰(均为分析纯):成都市科隆化学品有限公司;酵母浸粉、牛肉膏、蛋白胨(均为生物试剂):北京奥博星生物技术有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
窖泥富集培养基以及菌株分离培养基主要包括:酵母浸出粉酪胨脂肪酸(yeast extract-casitone-fatty acids,YCFA)培养基[15]、乙酸盐乳酸盐(starch acetate lactate,SAL)培养基、酪胨葡萄糖培养基(casitone-glucose medium,CGM)[16]、MCI培养基[17]、CPB培养基[18]、强化梭菌培养基(reinforced clostridial medium,RCM)[19],配制均参照相应文献以及微生物实验指导书。SAL培养基:可溶性淀粉5 g,乙酸钠3 g,乳酸钠3 g,酵母粉1 g,蛋白胨1.5 g,葡萄糖0.5 g,磷酸二氢钾0.5 g,硫酸钠0.2 g,氯化钠1 g,六水氯化镁0.4 g,氯化钙0.15 g,L-半胱氨酸盐酸盐0.8 g,蒸馏水1 000 mL。所有培养基在灭菌前调pH至7.0,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
Y400双目高倍显微镜:日本尼康公司;RHT-8123全自动高压灭菌锅:成都志威仪器仪表有限公司;7890A-5975B型气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪:美国安捷伦科技有限公司;2023C型高效液相色谱(high performance liquid chromatography,HPLC)仪:日本岛津公司;WUQ-198电泳仪:北京百菁生物技术有限公司;S1000型聚合酶链式反应(polymerase chain reaction,PCR)扩增仪:成都百乐科技有限公司;SC1805凝胶成像仪:上海杉富科技仪器有限公司;CSYY-600型厌氧工作手套箱:郑州畅赛仪器科技有限公司。
1.3 方法
1.3.1 窖泥富集与微生物分离、纯化
将取回的窖泥在厌氧手套箱中混合均匀,分别取10 g接种于90 mL事先已经除氧的富集培养基(YCFA培养基、SAL培养基、CGM、MCI培养基、CPB培养基)中,使用100mL血清瓶作为培养容器,在37 ℃条件下培养15 d后,取1/10体积的富集液转移至新鲜制备的各富集培养基内连续富集。每轮富集的发酵液通过梯度稀释涂布法和四区划线法分离单菌落。挑取菌落形态存在显著性差异的单菌落在空白RCM固体培养基上划线纯化,三次纯化后对菌落形态进行拍照,同时挑取单菌落进行革兰氏染色,于油镜下观察其显微形态。将筛选所获得的菌株皆使用甘油保藏法[20]保存在-25 ℃冰箱中。
1.3.2 微生物的分子生物学鉴定
对划线纯化后的菌株进行扩培,使用改良的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)-酚氯仿碱性裂解法[21]进行脱氧核糖核酸(deoxyribonucleic acid,DNA)的提取,以提取的DNA为模板,使用细菌通用引物27f(5'-AGAGTTTGATCATGGCTCAG-3')和1492r(5'-ACGGTTACCTTGTTACGACTT-3')进行PCR扩增[22]。PCR扩增体系:脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)1 μL,终浓度为200 μmol/L;Taq DNA聚合酶1 μL,终浓度为0.1 U/μL;模板DNA 3 μL;5×Buffer(含Mg2+)10 μL;正反向引物1 μL,终浓度为1.0 nmol/L,超纯水补足至50 μL。PCR扩增条件:94 ℃预变性4 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1.5 min,进行30个循环后;72 ℃再延伸10 min。
取5 μL PCR扩增产物,使用1%的琼脂糖凝胶检测其扩增产物,将条带大小正确的PCR扩增产物送至成都擎科生物技术有限公司进行测序,将返回的序列首尾拼接后上传至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库进行同源性比对,下载相似度高的模式菌株序列,使用MEGA6.0软件中邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.3 己酸菌代谢产物的分析
将甘油保藏的己酸菌接种于RCM液体培养基中,37 ℃厌氧培养3 d作为种子液;以1%(V/V)的接种量将种子液接种于100 mL RCM液体培养基中,37 ℃培养10 d,在无菌无氧条件下取2 mL样品,13 000 r/min离心5 min,取上清液,使用0.22 μm微孔滤膜过滤;吸取1 mL过滤后的样本到进样瓶中,加入10 μL内标乙酸戊酯(21.9 mg/mL),混匀,使用GC-MS检测挥发性物质含量,使用高效液相色谱测定乳酸含量。
(1)GC-MS
气相色谱条件:DB-WAX毛细管色谱柱(60 m×250 μm×0.25 μm),进样口温度为230 ℃,氢火焰离子化检测器(flame ionization detector,FID)温度220 ℃,载气为高纯氦气(He)(纯度≥99.999 5%),载气流速30 mL/min,柱流速1 mL/min,H2流速40 mL/min,Air流速400 mL/min,尾吹流速30 mL/min,采用不分流进样方式。升温程序为初始温度35 ℃,保持5 min,以5 ℃/min升至100 ℃保持2 min,再以15 ℃/min升至230 ℃,保持5 min。
质谱条件:电子电离(electron ionization,EI)源,电子能量70 eV,采集模式为全扫描,质量范围20~550 amu,离子源温度230 ℃,四级杆温度150 ℃,接口温度230 ℃。
定性、定量:将质谱图通过与美国Agilent公司提供的美国国家标准技术研究所(national institute of standards and technology,NIST)标准谱库05a.L进行比对定性,采用内标法进行半定量。
(2)高效液相色谱
高效液相色谱条件:C18色谱柱(250 mm×4.6mm,5 μm),柱温30 ℃,流动相为2%甲醇-0.12%磷酸水溶液,流速0.8 mL/min,检测波长214 nm,进样量10 μL。
定性、定量:根据保留时间进行定性,采用外标法进行定量。
1.3.4 数据处理
采用Adobe Illustrator 2023软件对菌株菌落照片与显微形态照片进行拼接与编辑;采用MEGA6软件构建系统发育树;采用Origin 2021软件进行图形绘制;所有样品重复测定3次,结果用“平均值±标准差”表示。
2 结果与分析
2.1 微生物的分离、纯化及形态学特征
通过对窖泥富集后使用稀释平板涂布法对富集液进行涂布分离以及纯化,共分离获得63株细菌,根据形态特征,初步归为13个类群,不同类群代表性菌株的菌落与显微形态特征见图1。
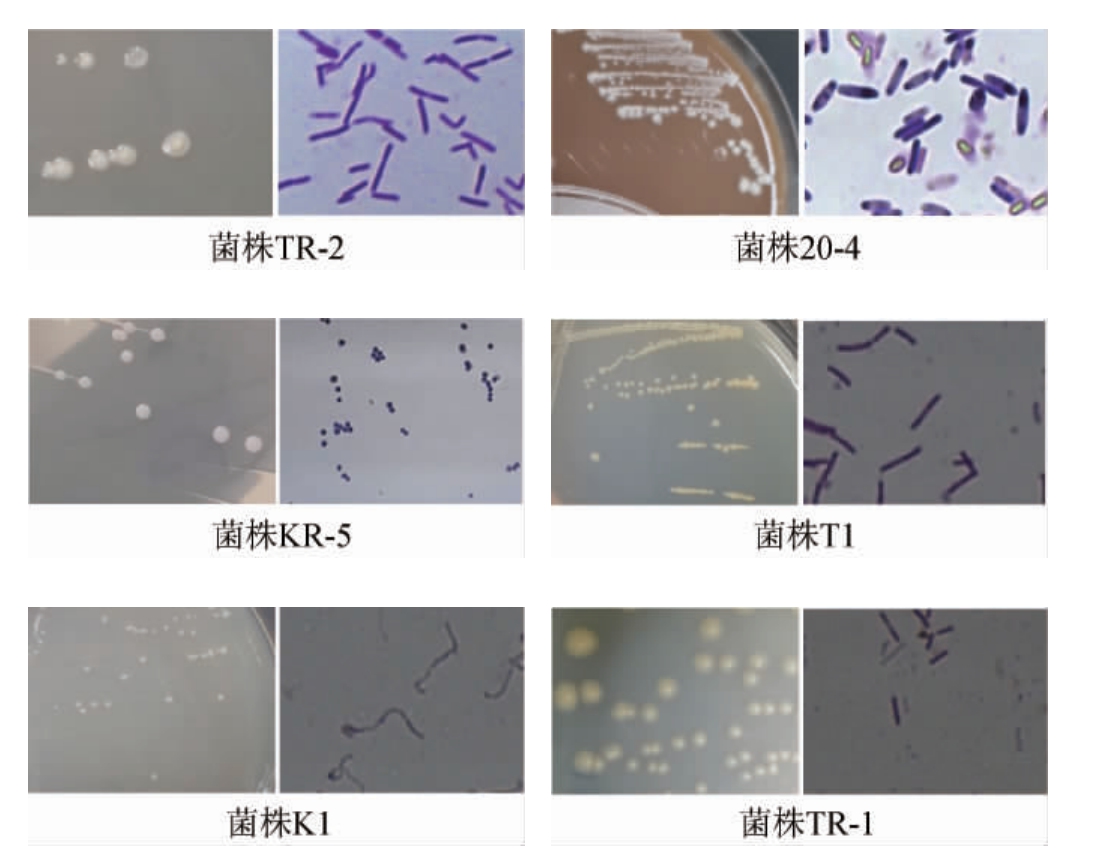
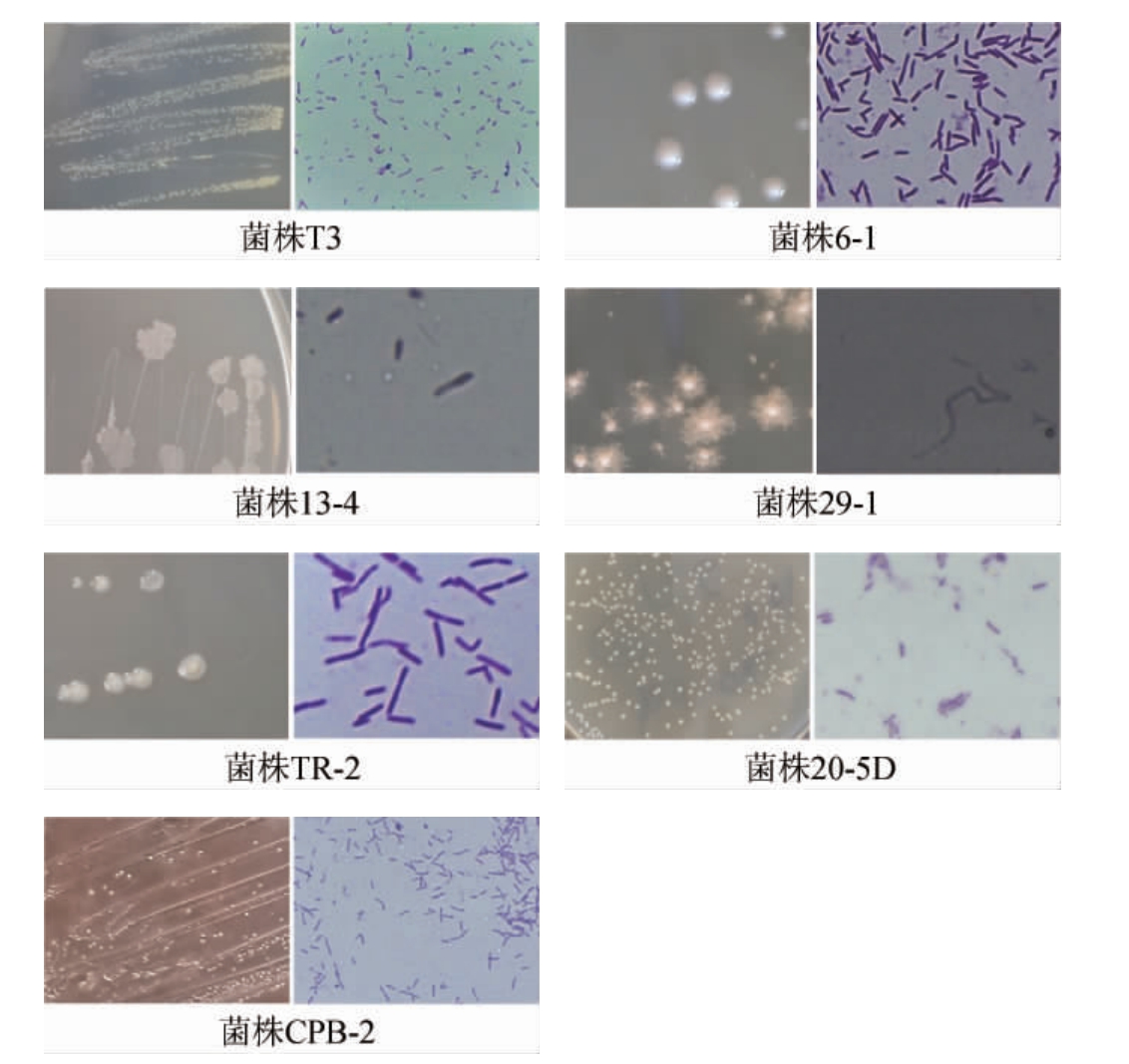
图1 代表性菌株的菌落形态与细胞形态
Fig.1 Colony and cell morphology of some representative bacteria
由图1可知,所有菌株均是革兰氏阳性菌,其中,菌株KR-5、K1、6-1、20-5D、CPB-2的菌落均呈白色不透明圆形,菌株T1、TR-1、T3的菌落均呈微黄色的不透明圆形,菌株KR-2、20-4、13-4、29-1、TR-2的菌落均呈白色不透明不规则形状;菌株KR-2、20-4、T1、TR-1、T3、6-1、13-4、TR-2、20-5D、CPB-2的细胞均呈短杆状或梭状,菌株K1、29-1的细胞均呈长丝状,菌株KR-5的细胞呈球状。
2.2 分子生物学鉴定
通过序列相似度比对发现,63株菌全部都能鉴定到属,分属于2纲3目8科15属。分属于芽孢杆菌纲和梭菌纲的菌株分别有24株和39株,将分属于梭菌纲和芽孢杆菌纲的菌株分别构建系统发育树,结果见图2。
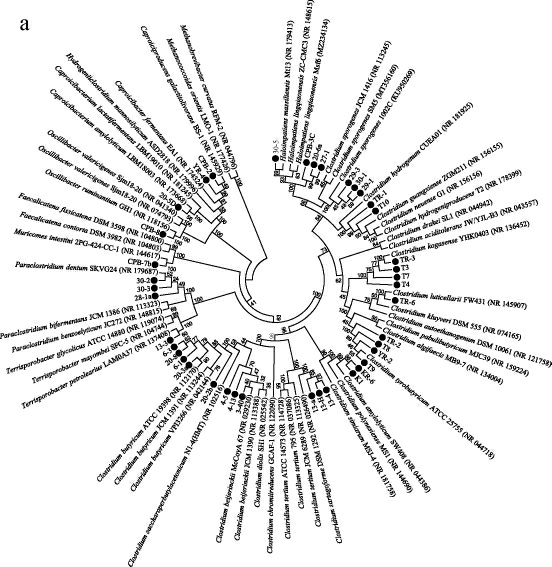
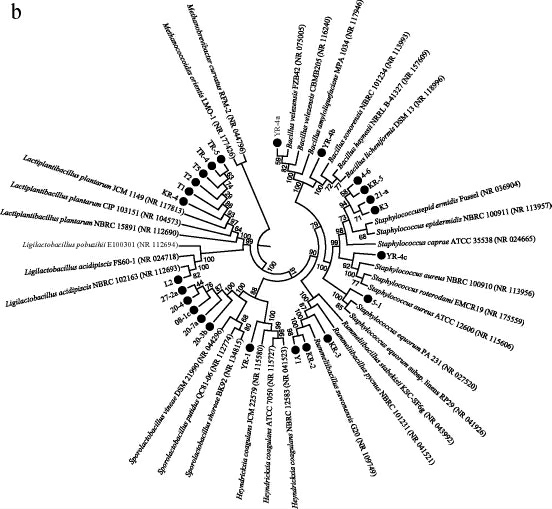
图2 基于16S rRNA基因序列梭菌纲(a)及芽孢杆菌纲(b)细菌的系统发育树
Fig.2 Phylogenetic tree of bacteria of Clostridia (a) and Bacilli (b)based on 16S rRNA gene sequences
由图2a可知,所分离的梭菌纲微生物主要分布于梭菌科(Clostridiaceae)、颤螺旋菌科(Oscillospiraceae)、毛螺菌科(Lachnospiraceae)。根据NCBI序列比对结果和系统发育树分析,确定能够鉴定到种的菌株有14株,其中,菌株30-3为Haloimpatiens massiliensis,菌株29-1、29-3和30-1为生孢梭状芽孢杆菌(Clostridium sporogenes),菌株TR-3为Clostridium kogasense,菌株T9为酪丁酸梭状芽孢杆菌(Clostridium tyrobutyricum),菌株K1和KR-6均为解淀粉梭状芽孢杆菌(Clostridium amylolyticum),菌株13-4和13-A均为煎盘梭状芽孢杆菌(Clostridium sartagoforme),菌株3-40为拜氏梭状芽孢杆菌(Clostridium beijerinckii),菌株20-3A为丁酸梭状芽孢杆菌(Clostridium butyricum),菌株13-3为石油土孢杆菌(Terrisporobacter petrolearius),菌株30-2为牙副梭状芽孢杆菌(Paraclostridium dentum)。根据序列比对结果显示,菌株TR-6与耳蜗形梭状芽孢杆菌(Clostridium luticellarii)FW431的序列相似度为96.17%,菌株CPB-2与食卫矛醇产己酸菌(Caproiciproducens galactitolivorans)BS-1的序列相似度为96.96%,通常认为16S rRNA基因序列相似度在95%~97%间为同属不同种的微生物[23],结合系统发育树分析可以推断菌株TR-6和CPB-2极有可能是梭菌属和产己酸菌属(Caproiciproducens)的新物种。菌株YR-4与食卫矛醇产己酸菌(Caproiciproducens galactitolivorans)BS-1的序列相似度为97.19%,菌株20-5D与解淀粉己酸杆菌(Caproicibacterium amylolyticum)LBM18003的序列相似度为97.7%,菌株13-H与煎盘梭状芽孢杆菌(Clostridium sartagoforme)DSM 1292的序列相似度为97.67%,以98.7%相似度作为鉴定同种的阈值[24],菌株YR-4、20-5D和13-H与近似菌株的序列相似度较低,也有可能是潜在的新物种。
由图2b可知,所分离的芽孢杆菌纲微生物主要包括芽孢乳杆菌科(Sporolactobacillaceae)、核衣细菌科(Caryo phanaceae)、芽孢杆菌科(Bacillaceae)、葡萄球菌科(Staphylococcaceae)和乳杆菌科(Lactobacillaceae),根据系统发育树分析并结合NCBI序列信息比对,能够被鉴定到种的菌株有10株,其中,菌株YR-4A为贝莱斯芽胞杆菌(Bacillus velezensis),菌株KR-2和Y1均为水原拉梅尔芽孢杆菌(Rummeliibacillus suwonensis),菌株L2为嗜酸乳酸杆菌(Ligilac tobacillus acidipiscis),菌株KR-4、T1、T2、T5、TR-4和TR-5均为植物乳杆菌(Lactiplantibacillus plantarum);以98.7%相似度作为鉴定同种的阈值,菌株20-3B、20-4、27-2A、8-1C与恶臭芽孢乳杆菌(Sporolactobacillus putidus)QC81-06的序列相似度分别为98.44%、97.14%、97.98%、97.85%,与其近似菌株的序列相似度较低,说明其中可能存在潜在新物种。
2.3 分离菌株属水平分类组成
基于属水平对分离获得的63株菌的占比信息进行统计,结果见图3。在所有分离获得的菌株中,梭菌属的数量最多,为27株,占42.86%;乳植杆菌属(Lactiplantibacillus)为6株,占9.52%;葡萄球菌属(Staphylococcus)为6株,占9.52%;芽孢乳杆菌属(Sporolactobacillus)为5株,占7.94%;Haloimpatiens、副梭菌属(Paraclostridium)和水原拉梅尔芽孢杆菌属(Rummeliibacillus)各含有3株,均分别占4.76%;产己酸菌属、芽孢杆菌属各含有2株,均分别占3.17%;己酸杆菌属(Caproicibacterium)、Muricomes、颤螺旋菌属(Oscillibacter)、土孢杆菌属(Terrisporobacter)、Heyndrickxia、联合乳杆菌属(Ligilactobacillus)各含有1株,均分别占1.59%。
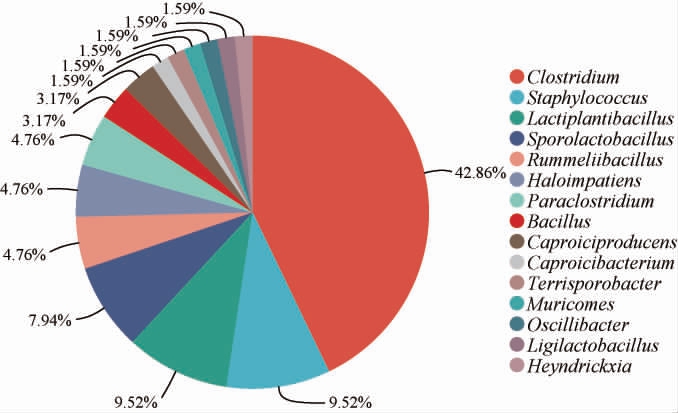
图3 基于属水平各分离菌株的占比
Fig.3 Proportion of isolated bacteria base on genus level
随着培养组学的发展,越来越多的窖泥功能微生物被分离出来,本实验从浓香型窖泥中分离得到数量较多的梭菌属微生物,这一类群都是专性厌氧的革兰氏阳性菌,是窖泥中的优势微生物,具有将大分子的淀粉、蛋白质等转化为小分子的酸类物质如乙酸、丁酸和己酸以及各种醇类物质、氢气和二氧化碳的能力[25]。SUN H等[26]对窖泥中梭菌属类群的研究表明,梭菌类群对稳定窖泥生态环境起着重要的作用,并认为梭菌属微生物是浓香型白酒风味形成和来源的重要贡献者。己酸杆菌属[8]和产己酸菌属[27]是近些年报道的能利用乙醇、半乳糖、葡萄糖等有机物生产己酸的己酸菌,这一类己酸菌可能是窖泥中产己酸的主要菌群之一。己酸菌作为窖泥关键功能菌在传统固态浓香型白酒发酵对于己酸和己酸乙酯的产量起着决定性作用,进而直接影响浓香型白酒的质量[28]。在菌株分离过程中除了能分离出大量酿酒功能微生物外,同时也有可能存在部分不利于白酒酿造的微生物,在本实验分离的菌株中包含了数株葡萄球菌属的微生物,在过往研究中该类群不被认为是窖泥功能菌,例如金黄色葡萄球菌等属种会产生许多异杂物质以及有害物质[29],在白酒发酵过程中对窖泥有害菌群进行针对性地抑制,有助于防止窖泥老化并提高白酒品质。
2.4 己酸菌代谢产物分析
由于颤螺旋菌科来源己酸菌是近年来报道的具有一定高产己酸能力的窖泥功能微生物[8-9,30-31],因此,对本次分离所得的3株颤螺旋菌科己酸菌的发酵产物进行分析,结果见表1。
表1 3株颤螺旋菌科己酸菌的发酵代谢产物分析结果
Table 1 Analysis results of metabolites of 3 caproic acid bacteria strains of Oscillospiraceae
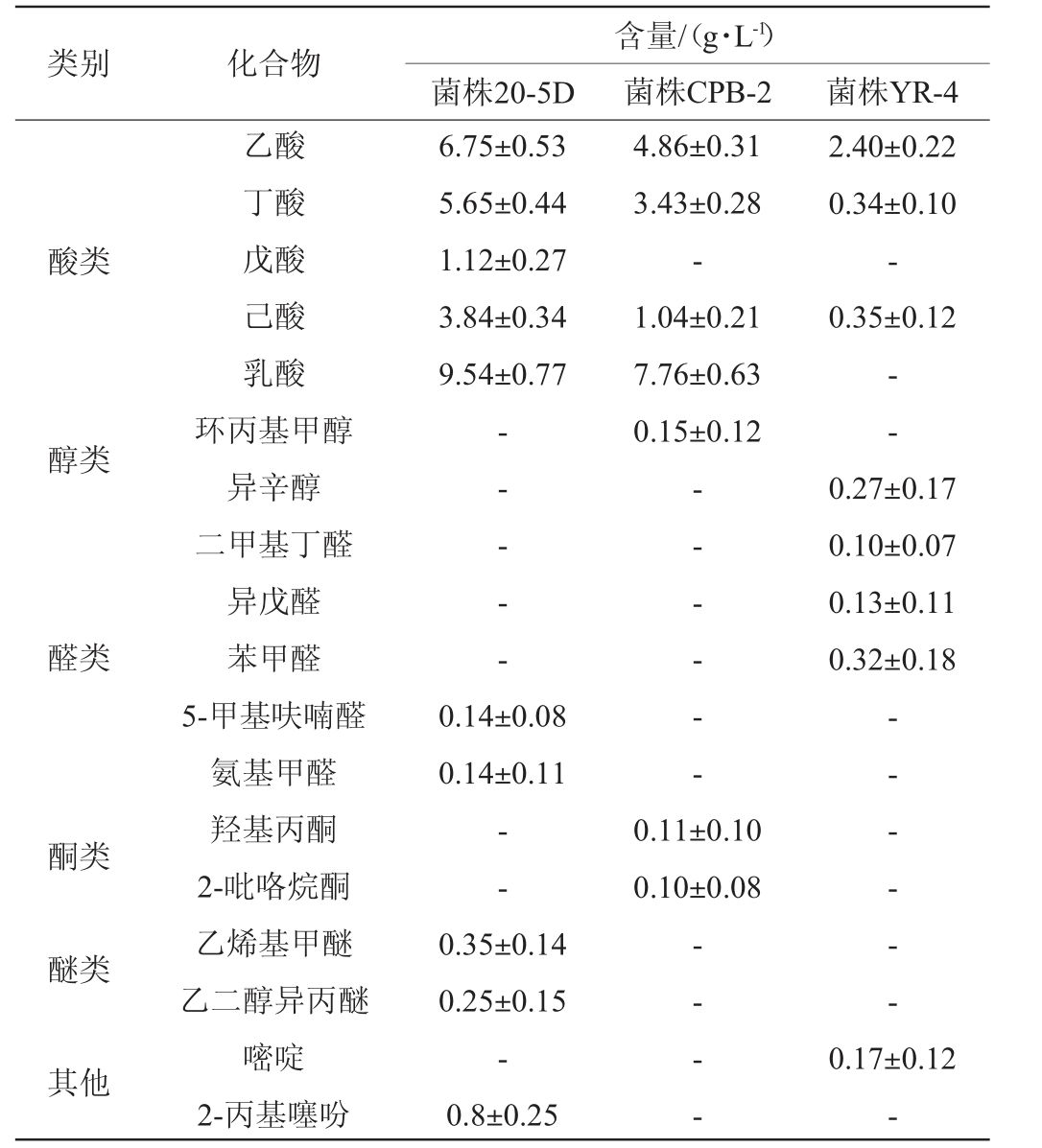
注:“-”表示未检出。
类别 化合物菌株20-5D含量/(g·L-1)菌株CPB-2 菌株YR-4酸类6.75±0.53 5.65±0.44 1.12±0.27 3.84±0.34 9.54±0.77 2.40±0.22 0.34±0.10-0.35±0.12醇类4.86±0.31 3.43±0.28-1.04±0.21 7.76±0.63 0.15±0.12--醛类-- - - -乙酸丁酸戊酸己酸乳酸环丙基甲醇异辛醇二甲基丁醛异戊醛苯甲醛5-甲基呋喃醛氨基甲醛羟基丙酮2-吡咯烷酮乙烯基甲醚乙二醇异丙醚嘧啶2-丙基噻吩0.27±0.17 0.10±0.07 0.13±0.11 0.32±0.18 0.14±0.08 0.14±0.11-- - - - -酮类--0.11±0.10 0.10±0.08醚类-- - - - -其他0.35±0.14 0.25±0.15-0.8±0.25-- - -0.17±0.12-
己酸菌是浓香型白酒酿造过程中重要的功能菌[32]。大多数己酸菌的代谢为混合酸,其产物包括乳酸、乙酸、丁酸和己酸等,它们能与乙醇发生酯化反应,生成浓香型白酒的主体风味物质,从而影响浓香型白酒的风格和质量。菌株20-5D的近似菌株Caproicibacterium amylolyticum LBM18003以葡萄糖、乙酸盐和丁酸盐为发酵底物可以产生1.6 g/L己酸、7.8 g/L乳酸以及少量乙酸和丁酸[8],菌株CPB-2和YR-4的近似菌株Caproiciproducens galactitolivorans BS-1以葡萄糖和半乳糖醇为主要发酵底物可以产生乙酸0.58 g/L、丁酸0.39 g/L和己酸0.69 g/L[27]。由表1可知,本实验所筛选获得的3株己酸菌经RCM液体培养基发酵后,菌株20-5D能产生丰富的有机酸,己酸产量能达到3.84 g/L,同时能产生5.65 g/L丁酸、1.12 g/L戊酸和9.54 g/L乳酸;菌株CPB-2能产生1.04 g/L己酸、3.43 g/L丁酸和7.76 g/L乳酸;菌株YR-4的产己酸能力相对菌株20-5D和CPB-2较弱,只能代谢产生0.34 g/L丁酸和0.35 g/L己酸。3株己酸菌在RCM液体培养基的发酵过程中除了代谢有机酸外,还代谢产生了少量其他挥发性风味物质,包括醇类、醛酮类、醚类等。其中,菌株20-5D代谢产生了0.14 g/L 5-甲基呋喃醛、0.14 g/L氨基甲醛、0.35 g/L乙烯基甲醚、0.25 g/L乙二醇异丙醚和0.8 g/L 2-丙基噻吩;菌株CPB-2代谢产生了0.15 g/L环丙基甲醇、0.11 g/L羟基丙酮、0.1 g/L 2-吡咯烷酮;菌株YR-4代谢产生了0.27 g/L异辛醇、0.10 g/L二甲基丁醛、0.13 g/L异戊醛、0.32 g/L苯甲醛、0.17 g/L嘧啶。菌株20-5D、CPB-2和YR-4与其近似菌株均表现出较强的产酸发酵能力,说明颤螺旋菌科下的己酸杆菌属和产己酸菌属微生物可能是浓香型白酒窖泥中重要的产己酸微生物类群,且在白酒发酵过程中具有重要作用。
3 结论
本研究采用多种培养基富集培养法和厌氧分离技术从浓香型白酒窖泥中共分离获得63株细菌,通过形态学观察、16S rRNA基因测序以及系统发育学分析可将全部菌株鉴定到属,分属于2纲3目8科15属,主要包括梭菌属、乳植杆菌属、葡萄球菌属、芽孢乳杆菌属、Haloimpatiens、副梭菌属、水原拉梅尔芽孢杆菌属、产己酸菌属、芽孢杆菌属、己酸杆菌属等,其中,有9株菌与近似菌的序列相似度较低(96.17~97.7%),可能为潜在的新物种。通过GC-MS及HPLC法对3株颤螺旋菌科(Oscillospiraceae)己酸菌的代谢产物进行分析发现,3株颤螺旋菌科己酸菌均能利用RCM培养基发酵产乙酸、丁酸、己酸;其中菌株20-5D(Caproicibacterium sp.)、CPB-2(Caproiciproducens sp.)和YR-4(Caproiciproducens sp.)的己酸产量分别为3.84 g/L、1.03 g/L和0.35 g/L,具有较强的产混合酸能力。本研究结果不仅能够丰富窖泥微生物菌种资源库、发现微生物新种,还能对于窖泥功能微生物生态功能研究与应用开发研究提供功能性菌种资源。
[1]孙宝国.国酒[M].北京:化学工业出版社,2019:109-110.
[2]徐发.我国白酒行业现状和发展趋势分析[D].合肥:合肥工业大学,2010.
[3]李大和,李国红.民族传统工艺白酒特点与发展的思考[J].酿酒科技,2005(9):109-113.
[4]李宾.1236揭示的浓香密码[J].中国酒,2022(6):64-67.
[5]刘念,彭奎,潘建军,等.浓香型白酒窖池价值评估体系研究(一)——窖池的价值构成及影响因素[J].食品与发酵科技,2021,57(6):1-3.
[6]张群.浓香型白酒酿造用窖泥微生物群落研究[J].食品与生物技术学报,2019,38(5):160-161.
[7]谢国排.己酸菌培养方法及其主要关联产物生成[J].酿酒科技,2011(3):63-64.
[8]GU Y,ZHU X,LIN F,et al. Caproicibacterium amylolyticum gen.nov.,sp.nov.,a novel member of the family Oscillospiraceae isolated from pit clay used for making Chinese strong aroma-type liquor[J].Int J Syst Evol Microbiol,2021,71(4):4789-4799.
[9]WANG H, GU Y, ZHAO D, et al. Caproicibacterium lactatifermentans sp.nov.,isolated from pit clay used for the production of Chinese strong aroma-type liquor[J].Int J Syst Evol Microbiol,2022,72(1):5206-5217.
[10]LUO Q,ZHENG J,ZHAO D,et al.Clostridium aromativorans sp.nov.,isolated from pit mud used for producing Wuliangye Baijiu[J].Antonie Van Leeuwenhoek,2023,116(7):739-748.
[11]YIN Q,TAO Y,ZHU X,et al.Clostridium liquoris sp.nov.,isolated from a fermentation pit used for the production of Chinese strong-flavoured liquor[J].Int J Syst Evol Microbiol,2016,66(2):749-754.
[12]XU P X, CHAI L J, QIU T, et al. Clostridium fermenticellae sp.nov.,isolated from the mud in a fermentation cellar for the production of the Chinese liquor,Baijiu[J].Int J Syst Evol Microbiol,2019,69(3):859-865.
[13]徐占成,唐清兰,徐姿静,等.剑南春天益老号窖泥特殊功能菌的选育及应用[J].酿酒科技,2019(10):94-100.
[14]徐敬征,张顺和,郝小格,等.浓香型白酒老窖中主要产香菌协同条件的优化及应用[J].酿酒,2022,49(5):59-62.
[15]DUNCAN S H,HOLD G L,HARMSEN H J M,et al.Growth requirements and fermentation products of Fusobacterium prausnitzii, and a proposal to reclassify it as Faecalibacterium prausnitzii gen.nov.,comb.nov[J].Int J Syst Evol Microbiol,2002,52(6):2141-2146.
[16]朱晓军.浓香型白酒窖泥产酸菌群培养及新型己酸合成菌的鉴定与特性分析[D].无锡:江南大学,2018.
[17]卢萌萌,任聪,聂尧,等.白酒酿造窖泥未培养微生物菌群的可培养化策略[J].食品与发酵工业,2020,46(19):9-16.
[18]ZHU X, ZHOU Y, WANG Y, et al.Production of high-concentration n-caproic acid from lactate through fermentation using a newly isolated Ruminococcaceae bacterium CPB6[J].Biotechnol Biofuels,2017(10):102-114.
[19]薛正楷,薛原.一株窖泥己酸菌株的多相鉴定及产酸研究[J].酿酒科技,2016(6):65-71.
[20]黄孟军,姜玉松,陈泉洲.微生物学实验[M].北京:冶金工业出版社,2020:53-57.
[21]YE G,WANG S,JIANG L,et al.Distribution and diversity of bacteria and archaea in marine sediments affected by gas hydrates at Mississippi Canyon in the Gulf of Mexico[J].Geomicrobiol J, 2009, 26(6): 370-381.
[22]TAO Y,LI J,RUI J,et al.Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J].Appl Environ Microbiol,2014,80(7):2254-2260.
[23]张军毅,朱冰川,徐超,等.基于分子标记的宏基因组16S rRNA基因高变区选择策略[J].应用生态学报,2015,26(11):3545-3553.
[24]STACKEBRANDT E, EBERS J.Taxonomic parameters revisited: tarnished gold standards[J].Microbiol Today,2006,8(4):6-9.
[25]DURRE P.Physiology and sporulation in Clostridium[J].Microbiol Spectr,2014,2(4):2010-2012.
[26]SUN H, CHAI L J, FANG G Y, et al.Metabolite-based mutualistic interaction between two novel clostridial species from pit mud enhances butyrate and caproate production[J].Appl Environ Microbiol, 2022,88(13):48422-48439.
[27]KIM B C,SEUNG JEON B,KIM S,et al.Caproiciproducens galactitolivorans gen.nov., sp.nov., a bacterium capable of producing caproic acid from galactitol,isolated from a wastewater treatment plant[J].Int J Syst Evol Microbiol,2015,65(12):4902-4908.
[28]吴玉轩.浓香型白酒窖泥己酸菌丰度分析与应用研究[D].济南:齐鲁工业大学,2023.
[29]徐振波,刘晓晨,李琳,等.金黄色葡萄球菌肠毒素在食源性微生物中的研究进展[J].现代食品科技,2013,29(9):2317-2324.
[30]ESQUIVEL-ELIZONDO S,BAGCI C,TEMOVSKA M,et al.The isolate Caproiciproducens sp.7D4C2 produces n-caproate at mildly acidic conditions from hexoses: Genome and rBOX comparison with related strains and chain-elongating bacteria[J].Front Microbiol, 2020(11):594524-594542.
[31]FLAIZ M,BAUR T,BRAHNER S,et al.Caproicibacter fermentans gen.nov.,sp.nov.,a new caproate-producing bacterium and emended description of the genus Caproiciproducens[J].Int J Syst Evol Microbiol,2020,70(7):4269-4279.
[32]殷想想,王欣蕊,冯文聪,等.己酸菌的筛选及其在浓香型白酒生产中应用的研究进展[J].中国酿造,2023,42(9):14-18.