“筒鲜鱼”是信阳商城的一道地方名菜,是以新鲜花鲢为原料,加入盐、花椒、辣椒面、葱丝、姜丝、高度白酒,装入竹筒或砂罐自然条件下短期腌制而成,其鱼肉鲜嫩、芳香可口、味道独特、营养丰富,因此深受广大人民群众的青睐[1]。目前由于筒鲜鱼主要是自然发酵的方式,没有标准化的生产工艺,太依赖于时令,且生产过程中对发酵有益的菌属不明等原因并无法进行大规模量化生产,因此亟需通过筛选优势发酵菌株去制备相应的发酵制剂进而使筒鲜鱼的生产工艺标准化。
由于筒鲜鱼自然发酵的生产方式,使筒鲜鱼中含有丰富的具有优良发酵性的天然微生物,如酵母菌,其在发酵过程中可以产醇、产酯等,赋予筒鲜鱼独特的醇香和酯香等香气成分[2-3],还能够延长发酵食品的保质期,在保持原有营养成分的同时,赋予发酵食品独特的营养价值。PATRIGNANI F等[4]研究发现,使用汉斯德巴氏酵母菌(Debaryomyces hansenii)和解脂耶氏酵母(Yarrowia lipolytica)共发酵香肠,并可提高其风味品质。ANDRADE M J等[5]研究发现,酵母菌产风味物质的能力较强,将混合酵母应用到肉制品的腌制中去,会产生多数风味物质,包括酯类、乙醛、次级醇等。酵母菌除了能够提供发酵制品独特的风味外,同时还有一些益生功效,比如抗氧化、抗肿瘤、降低胆固醇、提高机体的免疫力[6]等。目前国内外关于鱼肉发酵中的优势菌种仍以乳酸菌为主[7-8],而对能够使鱼肉具有独特风味的酵母菌研究不多。基于此,本研究从发酵5 d、10 d、15 d的商城筒鲜鱼中分离具有优良性能的酵母菌,考察筛选菌株的发酵性能、分解蛋白质能力及产酯能力,基于形态学观察、生理生化试验(糖发酵试验、同化试验)及26S rDNA基因序列对筛选菌株进行鉴定,并对其生长特性及最适培养条件进行分析,以期为筒鲜鱼的发酵加工工艺改良以及大规模量化生产提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
发酵5 d、10 d、15 d商城筒鲜鱼:商城市售。
1.1.2 化学试剂
磷酸二氢钾、硫酸镁、葡萄糖、氯化铵、硝酸钾、赖氨酸、氢氧化钠(均为分析纯):天津科密欧化学试剂有限公司;氯霉素标准品(997 U/mg):北京索莱宝科技有限公司;酵母菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:擎科生物科技有限公司。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)液体培养基:葡萄糖20 g/L,酵母浸粉10 g/L,蛋白胨20 g/L,蒸馏水1 000 mL,121 ℃灭菌15 min。
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:马铃薯200 g/L,蛋白胨5 g/L,琼脂20 g/L,葡萄糖20 g/L,硫酸镁1.5 g/L,磷酸二氢钾3 g/L,蒸馏水1 000 mL,121 ℃灭菌15 min。
含有氯霉素的PDA培养基:PDA培养基中加入0.1 g/L的氯霉素,121 ℃灭菌15 min。
WL鉴定培养基:上海博微生物科技有限公司。
1.2 仪器与设备
CHA-S气浴恒温振荡器、CHA-S生化培养箱:常州荣华仪器制造有限公司;MQL-621R振荡培养箱:上海旻泉仪器有限公司;LDZM-8OL-III立式高压蒸汽灭菌器:上海申安医疗器械厂;DYCP-31DN电泳仪:北京市六一仪器厂;TG16离心机:上海卢湘仪离心机仪器有限公司;EX2000生物显微镜:重庆中显光电有限公司。
1.3 方法
1.3.1 酵母菌的分离与纯化
参考田辉等[9]的方法,在无菌条件下,分别称取发酵5 d、10 d、15 d的筒鲜鱼样品25 g,加入225 g的无菌生理盐水充分混合均匀,然后依次稀释得到10-1~10-6稀释液,分别吸取100 μL上述稀释液涂布在含有氯霉素的PDA培养基上,在28 ℃下倒置培养48 h后进行形态学观察,挑取典型酵母菌形态的单菌落进行划线分离纯化,并对其进行编号。
1.3.2 酵母菌发酵性能测定
采用CO2失重法[11]测定初筛酵母菌的发酵性能。取初筛后的酵母菌液100 μL接种到YEPD液体培养基中,28 ℃静置培养48 h,随后以2%(V/V)的接种量接种于YEPD液体培养基中,28 ℃静置培养96 h,在发酵期间,每12 h称量一次发酵瓶的质量并记录,可用发酵瓶的质量损失作为菌株发酵CO2的释放量。在此基础上,以发酵瓶质量变化为纵坐标,以发酵时间为横坐标,对不同酵母菌株的发酵速率曲线进行绘制。
1.3.3 酵母菌产氨基酸态氮、产酯能力测定
参考李默等[12]的方法,将初筛的酵母菌以2%的接种量接种至YEPD液体培养基,28 ℃、160 r/min振荡培养2 d。以不接种酵母菌的培养基为空白对照。氨基酸态氮含量计算公式如下:
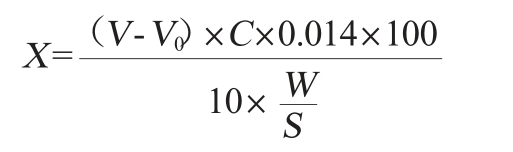
式中:X为待测液中氨基酸态氮的含量,g/100 g;V为样品消耗氢氧化钠标准溶液的体积,mL;V0为空白对照消耗氢氧化钠标准溶液的体积,mL;C为氢氧化钠溶液的浓度,mol/L;W为样品质量,g;S为样品稀释液总体积,mL;0.014为氨基酸毫克当量。
参考李欢欢等[13]的方法,将初筛的酵母菌以2%的接种量接种至YEPD液体培养基,28 ℃、160 r/min振荡培养5 d。以不接种酵母菌的培养基为空白对照。产酯量计算公式如下:
X=(25N1-N2V1)×0.088 12×2
式中:X为待测液中总酯(以乙酸乙酯计)的含量,g/100 mL;N1为氢氧化钠溶液的当量浓度,mol/L;N2为滴定消耗盐酸标准溶液的当量浓度,mol/L;V1为消耗盐酸标准溶液的体积,mL;0.088 12为乙酸乙酯毫克当量。
1.3.4 筛选菌株的鉴定
(1)形态学观察
将分离纯化后的单菌落酵母菌划线接种在PDA培养基,28 ℃培养48 h后观察其菌落形态[10],并用无菌水稀释菌悬液,通过显微镜观察其细胞形态特征。另外,取样用美蓝染液染色后在光学显微镜下观察其形态。
(2)生理生化试验
糖发酵试验:参考陶森等[14]的方法。制备同体积的YEPD液体培养基,将蔗糖、葡萄糖、麦芽糖、果糖、乳糖等按照培养液体积2%的比例加入到所用的糖发酵培养基中,再放入一根加满培养液的倒置的杜氏小管,按发酵液体积2%的接种量加入酵母菌悬浮液,28 ℃培养48~72 h,同时以不接种任何糖源作空白对照。
氮源同化实验:考查氮源包括氯化铵、L-谷氨酸钠、赖氨酸、硝酸钾。分别将各单一氮源的培养基分装,按培养液体积的2%接种量接入酵母菌悬液,放入一根加满培养液的倒置的杜氏小管,28 ℃培养72 h,观察液体试管中是否有混浊或形成环岛、杜氏小管中是否有气体产生的现象并记录,同时以不加任何氮源的培养基作空白对照。
碳源同化实验:考查碳源包括果糖、麦芽糖、乳糖、蔗糖,实验方法同氮源同化实验方法。
(3)分子生物学鉴定
根据酵母菌DNA提取试剂盒中的提取操作流程,对酵母菌的DNA进行提取,分别以NL1(5'-GCATATCAATAAGCGGAGGAAAAG-3')和NL4(5'-GGTCCGTGTTTCAAGACGG-3')为聚合酶链式反应(polymerase chain reaction,PCR)扩增引物[15],对得到的酵母菌株DNA进行扩增。PCR扩增体系(总体积50 μL):包含2.0 μL基因组DNA、25 μL 2×Taq PCR Master Mix、21 μL去离子水、正反引物各1 μL。PCR扩增程序:98 ℃预变性3 min;98 ℃变性10 s,53 ℃退火10 s,72 ℃延伸30 s,循环35次;72 ℃再延伸2 min。产物进行PCR扩增后,用1%的琼脂糖凝胶电泳对产物进行检验,并送生工生物工程(上海)股份有限公司测序。将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)对比,并借助MEGA4.0软件中的邻接法(neighbor joining,NJ)构建系统发育树,确定菌种归属。
1.3.5 筛选酵母菌的生长曲线绘制
参考姚志芳等[16]的方法稍作修改。将筛选酵母菌株以2%的接种量接种至YEPD液体培养基,28 ℃、150 r/min振荡培养60 h,培养第1天每隔2 h取样测定OD600 nm值,之后每隔6 h测定OD600 nm值。以培养时间为横坐标,以不同培养时间下所测OD600 nm值为纵坐标,绘制其生长曲线,空白对照为未接种的YEPD液体培养基。
1.3.6 筛选酵母菌的生长条件
选择生长对数期的酵母菌进行后续生长条件探究。将筛选酵母菌按2%接种量接入YEPD液体培养基中,于28 ℃静置培养12 h,酶标仪测得OD600 nm值在0.4~0.8之间,可将该OD600 nm值下的菌液视为可接种酵母菌种子液。
(1)盐浓度的影响
按2%接种量将筛选酵母菌种子液分别接种于100 mL含0、2.5%、5.0%、7.5%、10.0%NaCl的YEPD液体培养基中,28 ℃静置培养24 h后,检测各菌液的OD600 nm值,考察盐浓度对筛选菌株生长的影响。
(2)pH值的影响
按2%接种量将酵母菌种子液分别接种于100 mL pH值分别为3、4、5、6、7的YEPD液体培养基中,28 ℃静置培养24 h,检测各菌液的OD600 nm值,考察pH值对筛选菌株生长的影响。
(3)温度的影响
按2%接种量将酵母菌种子液接种于100 mL YEPD培养基,分别置于24 ℃、28 ℃、32 ℃、36 ℃、40 ℃条件下静置培养24 h,检测各菌液的OD600 nm值,考察温度对筛选菌株生长的影响。
(4)转速的影响
按2%接种量将酵母菌种子液接种于100 mL YEPD培养基28 ℃培养,分别在80 r/min、120 r/min、160 r/min、200 r/min、240 r/min的转速条件振荡培养24 h后,检测各菌液的OD600nm值,考察转速对筛选菌株生长的影响。
1.3.7 数据处理
每个试验重复3次,数据采用“平均值±标准差”表示,采用IBM SPSS Statistics 26.0软件进行数据分析处理,采用Origin 2018软件绘图。
2 结果与分析
2.1 酵母菌的分离纯化
以3种不同发酵天数的筒鲜鱼样品为原料,采用PDA培养基共分离出19株疑似酵母菌株,依次命名为A1~A4(来源于发酵5 d筒鲜鱼样品)、B5~B12(来源于发酵10 d筒鲜鱼样品)及C13~C19(来源于发酵15 d筒鲜鱼样品)。经过菌落形态观察及美兰染液染色后的显微镜形态观察,初筛7株符合酵母菌形态特征,分别为菌株A2、B5、B7、B10、C14、C16、C18。
初筛菌株A2、B5、B7、B10、C14、C16、C18的菌落及细胞形态结果见图1。由图1可知,7株初筛菌株菌落隆起、周围均较光滑,呈白色或乳白色,容易挑起,细胞形态呈现椭圆形或圆形,均符合酵母菌的形态特征[17]。
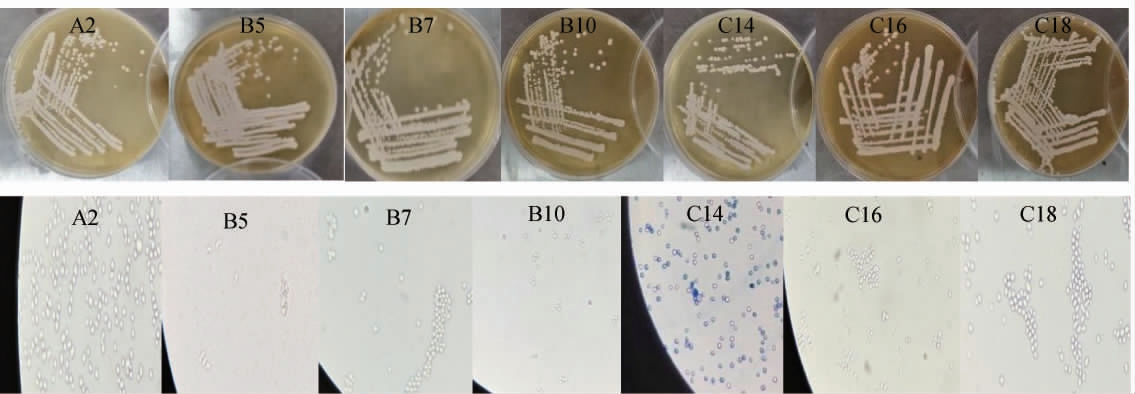
图1 初筛菌株的菌落及细胞形态
Fig.1 Colony and cell morphology of primary screening strains
2.2 优良酵母菌的筛选
2.2.1 酵母菌的发酵性能测定
采用CO2失重法对酵母菌的发酵性能进行测定,酵母菌发酵性能越强,释放CO2越多[18]。7株初筛酵母菌(A2、B5、B7、B10、C14、C16、C18)发酵96 h发酵瓶质量变化见图2。由图2可知,7株酵母菌在发酵0~36 h代谢较缓,36~72 h代谢较为活跃,CO2释放量明显增加,72~96 h代谢又趋于缓慢。其中菌株C14表现较为突出,在发酵中后期CO2释放量显著高于其他菌株(P<0.05),说明其发酵性能最优。
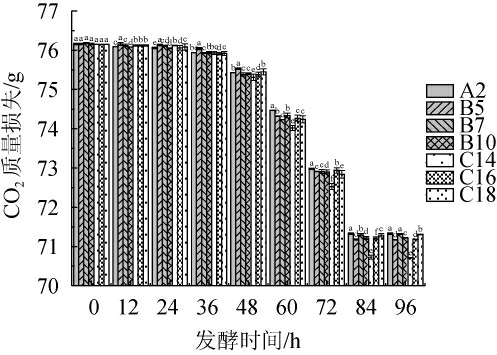
图2 7株初筛酵母菌发酵过程中CO2质量损失
Fig.2 CO2 mass loss of 7 strains of primary screening yeast during fermentation process
不同字母表示差异显著(P<0.05)。下同。
2.2.2 酵母菌产氨基酸态氮及产酯能力的测定
酵母菌在发酵的过程中可将蛋白质分解为肽和氨基酸等小分子类物质,而氨基酸在对发酵产物的风味进行改善的同时也会提高其本身的营养价值。由于酵母菌种属的不同,对蛋白中分解能力上也会存在差异,通过对发酵液中氨基酸态氮含量进行检测,便可进一步对比出不同酵母菌对蛋白质的分解能力的强弱[12]。7株酵母菌产氨基酸态氮及产酯能力测定结果见图3。
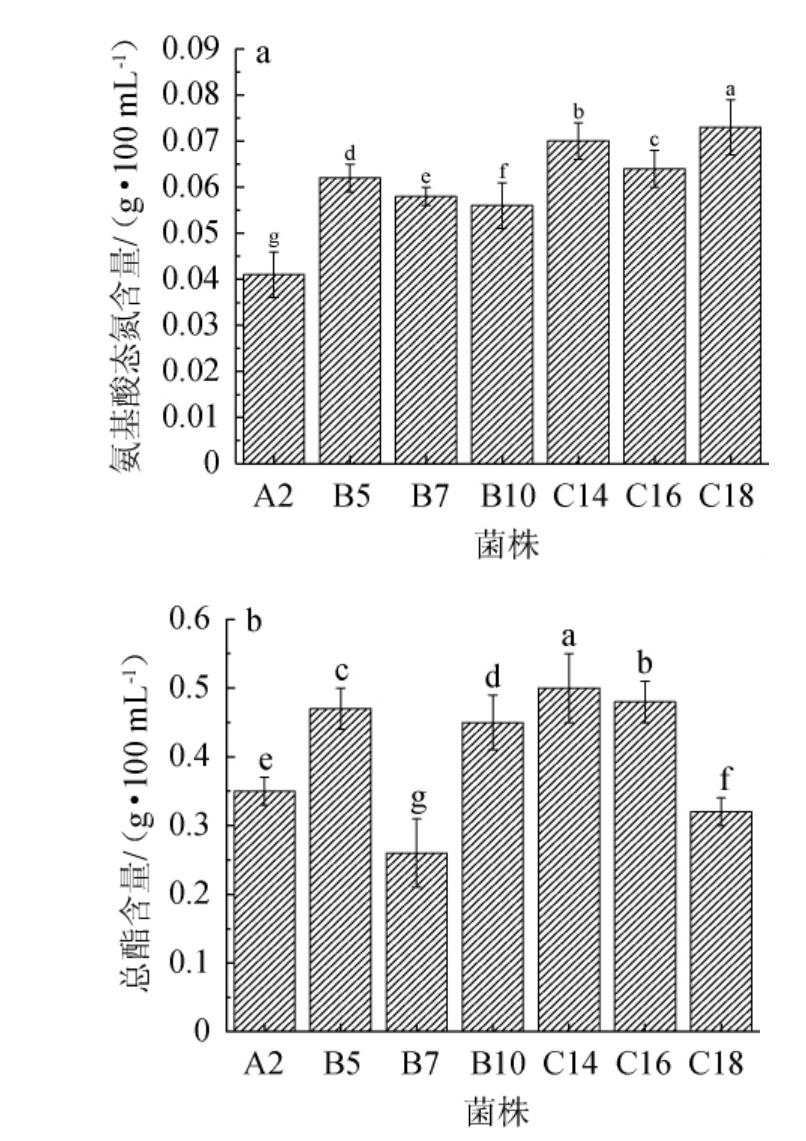
图3 7株初筛酵母菌产氨基酸态氮(a)和产酯(b)含量对比
Fig.3 Comparison of amino acid nitrogen (a) and ester (b)production of 7 strains of primary screening yeast
由图3a可知,菌株A2、B5、B7、B10、C14、C16、C18发酵液中的氨基酸态氮含量分别为0.041g/100mL、0.062g/100mL、0.058g/100mL、0.056g/100mL、0.07g/100mL、0.064g/100mL、0.073 g/100 mL,菌株C14和菌株C18中的氨基酸态氮含量明显高于其他菌株(P<0.05)。吴燕燕等[19]利用混合乳酸菌发酵鳜鱼,其氨基酸态氮含量为0.66 g/kg,稍低于本研究。由图3b可知,7株初筛菌株都具有产酯能力,但产酯能力强弱有所区别,菌株A2、B5、B7、B10、C14、C16、C18发酵液中的总酯含量分别为0.35 g/100 mL、0.47 g/100 mL、0.26 g/100 mL、0.45 g/100 mL、0.50 g/100 mL、0.48 g/100 mL、0.32 g/100 mL,菌株C14所产生的总酯含量明显高于其他菌株(P<0.05)。综上,菌株C14为优良酵母菌。
2.3 筛选酵母菌的鉴定
2.3.1 生理生化试验
利用糖发酵试验研究菌株C14对不同糖的利用能力,利用氮源、碳源同化试验研究菌株C14对不同碳源和氮源的利用能力差异从而对其进行分类[20],结果见表1。由表1可知,菌株C14可利用葡萄糖、果糖产气,不可利用蔗糖、麦芽糖、乳糖产气,可以同化氯化铵和硝酸钾,不能同化L-谷氨酸钠、赖氨酸,可稍同化果糖,不能同化蔗糖、麦芽糖、乳糖。该结果结合《酵母菌的特征与鉴定手册》[21]可初步判断菌株C14为耶氏酵母属(Yarrowia sp.)。
表1 菌株C14生理生化试验结果
Table 1 Results of physiological and biochemical test of strain C14
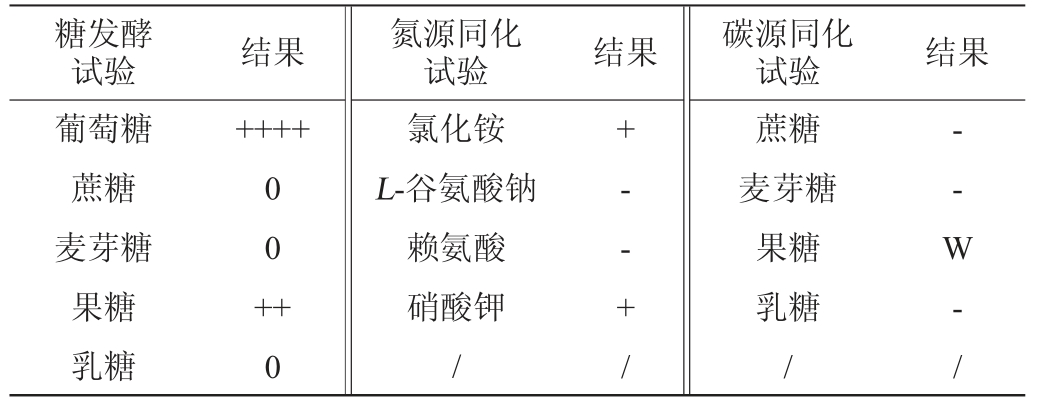
注:糖发酵试验中“++++”代表满气、“+++”代表3/4气、“++”代表1/2气、“+”代表1/4气、“0”代表不产气;氮源、碳源同化试验中“+”代表结果呈阳性、“-”代表结果呈阴性、“W”代表弱性反应。
糖发酵试验 结果 氮源同化试验 结果 碳源同化试验 结果葡萄糖蔗糖麦芽糖果糖乳糖++++0 0 ++0氯化铵L-谷氨酸钠赖氨酸硝酸钾/+- - + /蔗糖麦芽糖果糖乳糖/-- W - /
2.3.2 分子生物学鉴定
将获得的序列递交至NCBI,再通过BLAST在GenBank数据库中进行同源序列的搜索和相关的信息检索,建立菌株C14的系统发育树,结果见图4。由图4可知,菌株C14与解脂耶氏酵母(Yarrowia lipolytica)MH481651.1相似性高达100%。因此,菌株C14被鉴定为解脂耶氏酵母(Yarrowia lipolytica)。
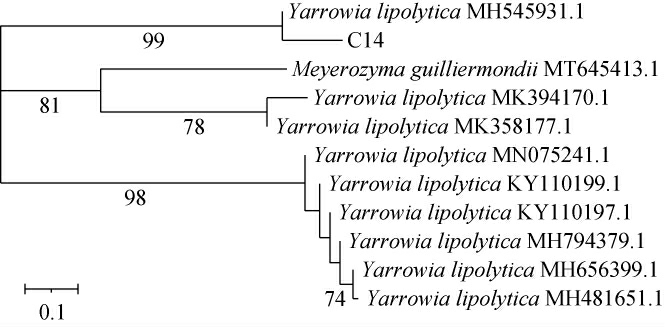
图4 基于26S rDNA基因序列菌株C14的系统发育树
Fig.4 Phylogenetic tree of strain C14 based on 26S rDNA gene sequences
2.4 解脂耶氏酵母C14生长曲线
菌株C14的生长曲线见图5。由图5可知,菌株C14在0~8 h为迟滞期,该段时间内菌株适应新的生长环境,繁殖较为迟缓,8~24 h为对数生长期,该段时间内菌株生长迅速,数量呈对数增长,在第24小时后进入稳定期,活菌数基本趋于稳定。张晓靖[22]从侗族酸鱼中筛选出2种优势酵母,其迟滞期为0~4 h,对数生长期为4~24 h,与本研究结果类似。
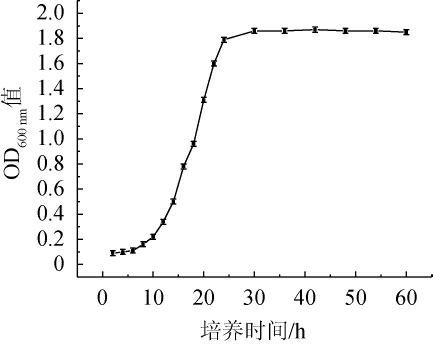
图5 菌株C14的生长曲线
Fig.5 Growth curve of strain C14
2.5 解脂耶氏酵母C14的最适培养条件
2.5.1 盐浓度对筛选酵母菌生长的影响
盐浓度对菌株C14的生长的影响见图6。由图6可知,随着NaCl浓度的升高,菌株C14的OD600 nm值呈下降趋势。当NaCl浓度为0和2.5%时,菌株C14的OD600nm值没有显著性差异(P>0.05);当NaCl浓度达到5.0%时,菌株C14的OD600 nm值显著降低(P<0.05),为1.82,而当NaCl浓度>5.0%之后,菌株C14的OD600nm值骤降,生长能力受限。有研究表明,一般腌制鱼的盐浓度添加量在6%~10%[23-24],菌株C14在低于5.0%盐浓度范围内能够正常生长发酵,因此可作为发酵鱼发酵剂使用。
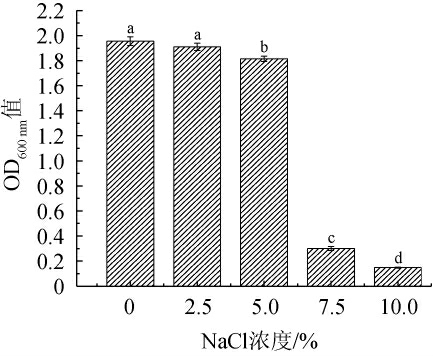
图6 盐浓度对菌株C14生长的影响
Fig.6 Effect of salt concentration on strain C14 growth
2.5.2 pH值对筛选酵母菌生长的影响
pH值变化会影响酵母菌的生长代谢,过高过低都会造成酵母菌死亡[25]。pH值对菌株C14生长的影响见图7。由图7可知,随着pH值的升高,OD600 nm值呈先上升后下降趋势。当pH值为3~5时,OD600nm值随之增加;当pH值为5时,菌株的OD600 nm值最高,为1.95;当pH值>5之后,OD600 nm值有所下降。因此,菌株C14的最适pH值为5。发酵鱼制品通常会因为乳酸菌使得整体pH值下降至5左右[26],菌株C14的最适pH值为5,很适合作为筒鲜鱼发酵剂开发使用。
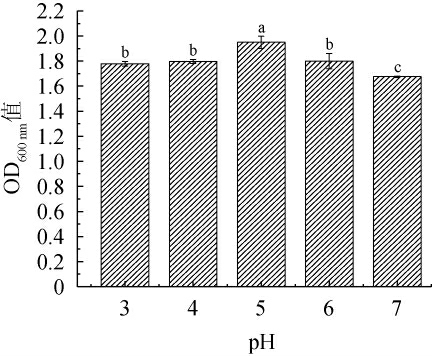
图7 pH值对菌株C14生长的影响
Fig.7 Effect of pH on strain C14 growth
2.5.3 温度对筛选酵母菌生长的影响
温度会影响酵母菌的活性及代谢,不同酵母菌对温度的耐性也不同[27]。温度对菌株C14生长的影响见图8。由图8可知,随着温度的升高,OD600nm值呈先上升后下降趋势。当温度为24~36 ℃时,OD600 nm值随之增加;当温度达到36 ℃时,菌株C14的OD600 nm值达到最高,为1.96;当温度>36 ℃之后,其OD600 nm值显著下降(P<0.05)。菌株C14在28 ℃与32 ℃的OD600 nm值差异不显著(P>0.05),在32 ℃与36 ℃的OD600 nm值差异不显著(P>0.05)。因此,菌株C14的最适生长温度在28~36 ℃之间,在此范围内酵母的长势较好。当菌株C14作为腌鱼生物发酵剂时,发酵温度应该控制在28~36 ℃范围内,该温度在一般腌鱼生产的腌制条件下可以达到或调控。
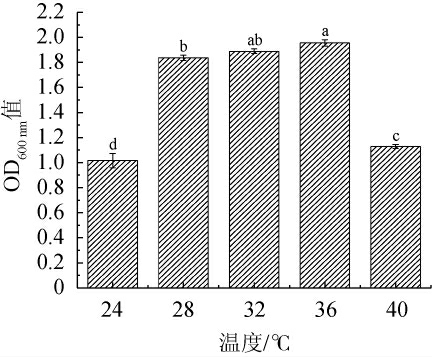
图8 温度对菌株C14生长的影响
Fig.8 Effect of temperature on strain C14 growth
2.5.4 转速对筛选酵母菌生长的影响
转速对菌株C14的生长影响见图9。由图9可知,随着转速的升高,OD600 nm值呈逐渐上升趋势。当转速达到200 r/min,其OD600 nm值为1.93,当转速达到240 r/min,其OD600 nm值为2.00,二者没有显著差异(P>0.05)。因此,菌株C14生长的最适转速为200 r/min。
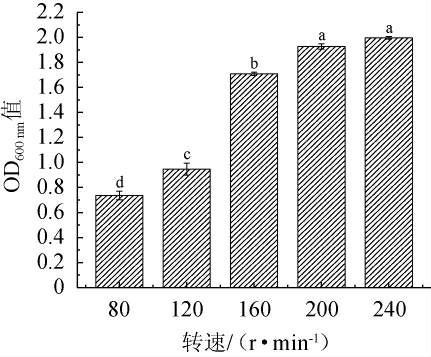
图9 转速对菌株C14生长的影响
Fig.9 Effect of rotational speed on strain C14 growth
3 结论
从发酵5 d、10 d、15 d的商城筒鲜鱼样本中共分离出19株疑似酵母菌,经过形态学观察初筛出7株酵母菌株,后经过发酵能力、分解蛋白质能力、产风味物质能力等生理生化特性试验分析,确定菌株C14具有优良的发酵特性。经形态学观察、生理生化试验及分子生物学鉴定,鉴定菌株C14为解脂耶氏酵母(Yarrowia lipolytica)。菌株C14生长特性结果显示,菌株C14在8~24 h生长活跃,其最佳培养条件为温度28~36 ℃,盐浓度<5%,pH值为5,转速200 r/min。该结果可为筒鲜鱼的生产提供了优良的酵母菌种源,对于改进筒鲜鱼生产工艺、降低能耗均有重要意义。
[1]郑雪珂,陈晖,朱静,等.商城筒鲜鱼发酵过程中微生物多样性及品质特性分析[J].食品与发酵工业,2024,50(13):91-97.
[2]柯泽华.臭鳜鱼风味物质鉴定及优选菌株对其风味的影响研究[D].邯郸:河北工程大学,2021.
[3]PETROVIC′ S,ROŽIC′ L,JOVIC′ V,et al.Optimization of a nanoparticle ball milling process parameters using the response surface method[J].Adv Powder Technol,2018,29(9):2129-2139.
[4]PATRIGNANI F,LUCCI L,VALLICELLI M,et al.Role of surface inoculated Debaryomyces hansenii and Yarrowia lipolytica strains in dried fermented sausage manufacture.Part1: Evaluation of their effects on microbial evolution,lipolytic and proteolytic patterns [J].Meat Sci, 2007,75(4):676-686.
[5]ANDRADE M J,CÓRDOBA J J,CASADO E M,et al.Effect of selected strains of Debaryomyces hansenii on the volatile compound production of dry fermented sausage"salchichon"[J].Meat Sci,2010,85(2):256-264.
[6]曾儒欣.布拉氏酵母菌联合肠内营养支持治疗对重症脑卒中患者营养状况及细胞免疫功能的影响[J].中国微生态学杂志,2015,27(7):805-808.
[7]康慎敏,徐睿,武瑞赟.乳酸菌在发酵鱼制品中的应用[J].中国水产,2021,12(7):84-87.
[8]孙慧君.锦州小菜主要理化指标及微生物多样性分析[D].沈阳:沈阳农业大学,2017.
[9]田辉,谢引荣,王琰,等.三种传统发酵食品中酵母菌的分离鉴定与特性分析[J].中国酿造,2022,41(3):87-92.
[10]杜艾明,董孝元,李俊薇,等.清香型白酒酿造体系中酵母菌的分离鉴定及生产特性分析[J].食品科技,2021,46(7):29-36.
[11]荆雄,杨辉,苏文,等.非酿酒酵母与酿酒酵母混合发酵柿子酒特性的研究[J].中国酿造,2018,37(12):52-56.
[12]李默,曹凯欣,任广钰,等.自然发酵锦州小菜中优良酵母菌的筛选及鉴定[J].中国食品学报,2021,21(4):277-285.
[13]李欢欢,曾雪莹,谢娟,等.产香酵母的筛选鉴定及产酯条件优化[J].中国酿造,2022,41(6):87-92.
[14]陶森,王雅玲,叶林,等.腌鱼中耐盐酵母菌的分离鉴定及其生理生化特性[J].食品工业科技,2019,40(2):136-141,147.
[15]BEYENE E,TEFERA A T,MULETA D,et al.Molecular identification and performance evaluation of wild yeasts from different Ethiopian fermented products[J].J Food Sci Technol,2020,57:3436-3444.
[16]姚志芳,冯宇哲,王磊,等.益生性酵母菌的筛选与鉴定[J].家畜生态学报,2021,42(5):38-44.
[17]王丹,江春阳,邓乔晟,等.地参发酵酒中专用酵母菌的筛选、鉴定及特性研究[J].食品科技,2023,48(5):18-25.
[18]刘灿珍,董书甲,姜凯凯,等.5株非酿酒酵母的耐受性及发酵特性研究[J].中国酿造,2017,36(10):42-46.
[19]吴燕燕,王悦齐,沈颖莹,等.基于混菌发酵的鳜鱼发酵工艺优化与品质分析[J].南方水产科学,2022,18(2):105-114.
[20]赵芳,李艳琴,李彬春.模拟人体胃肠道环境筛选益生乳杆菌[J].微生物学通报,2016,43(6):1396-1403.
[21]巴尼特,佩恩,亚罗,等.胡瑞卿等译.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:51.
[22]张晓靖.发酵酸鱼关键特征风味物质的确定及生香酵母对其改善作用的研究[D].无锡:江南大学,2023.
[23]陈磊,郭鹏飞,郑海波,等.发酵时间对干盐腌制臭鳜鱼品质及蛋白构象的影响[J].食品科技,2022,47(9):100-106.
[24]张鹤,吴佳佳,张记桓,等.不同腌制工艺中大黄鱼品质及微生物菌群变化[J].食品与发酵工业,2014,40(8):72-77.
[25]王辉,袁婷玉,白卫东,等.青梅自然发酵液中酵母菌的分离鉴定及特性研究[J].食品科技,2021,46(8):16-21
[26]曾雪峰.淡水鱼发酵对酸鱼品质影响的研究[D].无锡:江南大学,2013.
[27]MMORETTI V M,MADONIA G,DIAFERIA C,et al.Chemical and microbiological parameters and sensory attributes of a typical Sicilian salami ripened in different conditions[J].Meat Sci,2004,66(4):845-854.