白酒酒糟是白酒生产最主要的副产物,如果不能及时处理,会造成严重的环境污染问题[1]。白酒酒糟中的粗维素一般约占酒糟干质量的20%左右,除此之外还含有未利用的淀粉和大量粗蛋白[2-3],故对酒糟中纤维素的充分利用可以提升资源的利用效率。目前,作为饲料和肥料是白酒糟最主要的综合利用方式[4],但直接利用鲜酒糟或简单干燥处理酒糟作为饲料,不但营养无法充分利用,还会形成动物难以消化的物质进而影响动物生长[5];若未腐熟完全制备有机肥而直接使用,容易出现烧根的现象[6]。故添加纤维素酶或采用产纤维素酶菌株进行酒糟前处理能避免这些问题,使酒糟被开发利用成为富有竞争力的饲料、肥料等产品[7-8],同时采用合适的工艺方法还能在前处理时额外获得部分具有商品化潜力的酒精发酵液从而提高酒糟处理过程中的经济价值[9]。
纤维素是由β-1,4葡萄糖苷键连接而成的一种多糖[10],是自然界中分布最广、含量最多,也最清洁的可再生资源[11-12]。而纤维素酶是糖苷水解酶家族的一类多酶复合体,包括多种水解酶成员,通常划分为葡聚糖内切酶(endo-1,4-β-Dglucanase,EG)EC3.2.1.4,葡聚糖外切酶(exo-1,4-β-Dglucanase,CBH)EC3.2.1.91和β-葡萄糖苷酶(β-glycosidase,BG)EC3.2.1.21。三种酶合力水解纤维素中的β-1,4糖苷键后生成微生物可利用的葡萄糖[13-14]。自1906年来首次发现纤维素酶的作用起,科研工作者就开始各类产纤维素酶菌株的筛选[15],但是缺乏高产纤维素酶菌株依然成为了纤维素酶工业化生产和应用的最大瓶颈。
目前对产纤维素酶微生物的研究主要集中在各类霉菌,如MILLER T等[16]从树果和土壤样品中筛选获得一株阿拉巴马曲霉(Aspergillus alabamensis)菌株内切葡聚糖酶酶活达(0.46±0.02)U/mL;ARNTHONG J等[17]筛选出9株能产纤维素酶的真菌,包括土曲霉(Aspergillus terreus)、草酸青霉(Penicillium oxalicum)、蓝状菌属真菌(Talaromyces siamensis)和非洲哈茨木霉(Trichoderma afroharzianum)。虽然真菌所产酶种类较多且产量高,但是产酶生产周期较长,而细菌具有生长和产酶周期短的优点[18-19],所以筛选产纤维素酶细菌也成为也是一个研究热点。赵龙妹等[20]从玉米田土壤中筛选获得一株产纤维素酶的巨大芽孢杆菌(Bacillus megaterium),所产纤维素酶活力最高可达到0.774 U/mL。MA L L等[21]从秦岭腐木中内筛选出55株潜在的纤维素分解菌,经鉴定后发现,优势菌主要为甲基营养型芽孢杆菌(Bacillus methylotrophicus)和枯草芽孢杆菌(Bacillus subtilis)。
酵母菌具有高生产率、发酵快等优势[22]。同时,酵母菌普遍具有较高的乙醇耐受性及产率,可适用于工业生产并易于代谢工程改造,是利用纤维质原料一体化生物加工生产乙醇最具研究深度和吸引力的菌株,但是目前对于自然界中筛选产纤维素酶酵母菌的研究相对较少。罗明有等[23]从浓香型白酒醅中分离的110株酵母菌中筛选到3株能分解纤维素的酵母,其中两株为长孢洛德酵母(Lodderomyces elongisporus),一株为汉逊德巴利酵母(Debaryomyces hansenii),检测纤维素酶活性可达1.84 U/mL。张璐璐等[24]从米酒、酒糟中筛选分离得到一株产纤维素酶的酿酒酵母菌Y3,纤维素内切葡聚糖酶酶活为3.27 U/mL,纤维素外切葡聚糖酶酶活为2.22 U/mL,木聚糖酶酶活为4.21 U/mL。FU Z H等[25]从腐烂的大丽花中筛选到一株能产纤维素酶的季也蒙迈耶氏酵母(Meyerozyma guillermondii)可以用于降解椰子油饼,第5天内切葡聚糖酶酶活可达102.96 U/mL。
酱香型白酒酒醅作为一个天然的微生物资源宝库,对产纤维素酶酵母菌的挖掘却鲜有研究。本研究利用孟加拉红培养基和刚果红培养基,从酱香型白酒酒醅中筛选产纤维素酶的酵母菌,通过形态学观察、生理生化试验及分子生物学技术对该菌株进行鉴定,并考察其耐受性并优化产酶条件。旨在挖掘酱香型白酒中产纤维素酶酵母菌的资源,为酵母菌在纤维质成分的利用中提供了一种新的菌株和思路。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
酱香型白酒酒醅:贵州省仁怀市茅台镇某酒企。
1.1.2 试剂
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、葡萄糖、氯化钠、磷酸氢二钠、磷酸二氢钾、七水硫酸镁、氯化钙、硫酸铵、尿素(均为分析纯)、刚果红:国药集团化学试剂有限公司;羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)(分析纯):上海阿拉丁生化科技股份有限公司;玉米浆、豆粕、花生饼、棉籽饼、麸皮:北京鸿润宝顺科技有限公司;2×SanTaq聚合酶链式反应(polymerase chain reaction,PCR)Mix预混液、脱氧核糖核酸(deoxyribonucleic acid,DNA)分子质量Marker D、氯霉素标准品(效价997 U/mg)、酵母粉、蛋白胨、琼脂(均为生化试剂):上海生工生物工程股份有限公司。
1.1.3 培养基
刚果红培养基:硫酸铵1 g/L、氯化钠1 g/L、磷酸氢二钠1.2 g/L、磷酸二氢钾0.9 g/L、硫酸镁0.5 g/L、氯化钾0.5 g/L、酵母粉0.5 g/L、蛋白胨0.5 g/L、刚果红0.2 g/L、羧甲基纤维素钠10 g/L、琼脂20 g/L、氯霉素0.1 g/L,加入1 000 mL的去离子水,pH自然,121 ℃灭菌20 min。
孟加拉红琼脂:青岛高科技工业园海博生物技术有限公司。
YPD培养基:葡萄糖20 g/L、氯霉素0.1 g/L、蛋白胨20 g/L、酵母浸出粉10 g/L、固体培养基则需额外再添加20 g/L的琼脂粉,加入1 000 mL的去离子水,pH自然,121 ℃灭菌20 min。
产酶培养基:1 g/L酵母浸出粉、2 g/L蛋白胨、10 g/L硫酸铵、1 g/L氯化钙、0.3 g/L硫酸镁、15 g/L磷酸二氢钾、0.1 g/L氯霉素、10 g/L羧甲基纤维素钠,加入1 000 mL的去离子水,pH自然,121 ℃灭菌20 min。
1.2 仪器与设备
PHS-3E雷磁pH计、TW-12恒温水浴锅:上海仪电科学仪器股份有限公司;UVmini-1240紫外-可见分光光度计:岛津仪器(苏州)有限公司;HW3-750生化培养箱:上海森信实验仪器有限公司;ME204E电子分析天平:梅特勒-托利多仪器有限公司;TS-1102C双层恒温摇床:常州金坛良友仪器有限公司;EPOCH-SN BioTeK酶标仪:安捷伦科技(中国)有限公司;LDZX-50KBS立式压力蒸汽灭菌锅:上海申安医疗器械厂。
1.3 方法
1.3.1 高产纤维素酶菌株的筛选
取10 g新鲜的酱香型白酒酒醅放入到装有90 mL无菌生理盐水的锥形瓶中,在30 ℃摇床上振荡培养30 min左右。取100 μL的培养液和900 μL的无菌生理盐水混匀记为10-1稀释度,依次继续稀释梯度为10-2、10-3、10-4、10-5的各稀释梯度菌液,各取200 μL稀释液分别涂布到孟加拉红培养基上,每个梯度涂布3个平板作为平行对照,将已涂布好的平板放置在30 ℃的恒温培养箱中倒置培养2 d。根据形态挑选疑似酵母菌的菌落在刚果红平板上划线纯化,置于30 ℃恒温培养箱中倒置培养3 d左右。能够生长的菌株再次挑选单菌落在刚果红培养基上划线纯化,重复3次。
1.3.2 高产纤维素酶菌株的鉴定
形态学观察:将纯化好的菌株划线接种于YPD培养基上和点种接种于刚果红培养基上,30 ℃恒温培养箱培养3 d,观察菌落形态及特征,根据菌落形态及特征对所分离菌株进行初步判定。
生理生化试验:酵母菌的糖发酵、氮源同化以及碳源同化生理生化试验参考《酵母菌的特征与鉴定手册》[26]进行。
分子生物学鉴定:采用酵母基因组DNA提取试剂盒提取筛选菌株的基因DNA,以其为模版,使用酵母菌通用鉴定引物NL1:5'-GCATATCAATAAGCGGAGGAAAAG-3'和NL4:5'-GGTCCGTGTTTCAAGACGGG-3'对待测菌株的26S rDNA序列进行PCR扩增。PCR扩增体系(50 μL):25 μL 2×SanTaq PCR Mix、1 μL菌株基因组DNA、2 μL NL1和2 μL NL4、20 μL dd H2O;PCR扩增程序:94 ℃下预变性5 min,随后进入35个循环(94 ℃变性30 s、55 ℃退火30 s、72 ℃延伸1 min),最后在72 ℃再延伸10 min。将PCR扩增产物采用1%的琼脂糖凝胶电泳检验合格后,送往上海生工生物有限公司进行测序,并将得到的基因序列提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中进行基本局部比对搜索工具(Basic Local Alignment Search Tool,BLAST)比对,选取同源性较高的模式菌株的26S rDNA序列,采用MEGA 10.0软件中的邻接(neighbor joining,NJ)法构建系统发育树。
1.3.3 纤维素酶酶活的测定
采用DNS法[27]测定粗酶液的纤维素酶相关酶活力。
①在刚果红培养基中挑选单菌落接入YPD培养基中,于180 r/min、30 ℃振荡培养24 h,然后以1%的接种量接种于产酶培养基中培养5 d,每个菌株做3次重复。离心去沉淀,上清液即为粗酶液。②取1 mL不同质量浓度的葡萄糖标准溶液和2 mL pH 4.8的柠檬酸缓冲液加入到15 mL的离心管中,置于50 ℃的恒温水浴锅中反应60 min,随后立即加入3 mL DNS试剂,混匀后立即置于沸水浴5 min,冷却至室温后,使用分光光度计在波长540 nm处测定吸光度值,绘制葡萄糖标准曲线。③取1 mL粗酶液和2 mL pH4.8柠檬酸缓冲液放入15 mL离心管中,分别加入滤纸条、1%羧甲基纤维素钠溶、1%微晶纤维素溶液和1%水杨酸苷作为底物用于检测滤纸酶活、内切酶活、外切酶活和β-葡萄糖苷酶活,置于50 ℃恒温水浴锅中反应60 min,随后立即加入3 mL DNS试剂,沸水浴5 min后冷却至室温,使用分光光度计在波长540 nm处测定吸光度值,根据葡萄糖标准曲线回归方程计算还原糖含量。每个样本作3个平行重复。
纤维素酶酶活力定义:在pH4.8的条件下,1 mL粗酶液在1 min内水解底物生成1 μmol葡萄糖所需要的酶量,定义为1个酶活力单位(U/mL)。
1.3.4 高产纤维素酶菌株耐受性试验
温度耐受性:将筛选菌株接种于YPD液体培养中,分别置于30 ℃、32 ℃、34 ℃、36 ℃、38 ℃、39 ℃和40 ℃的恒温摇床中,转速180 r/min条件下培养72 h,每隔24 h利用酶标仪检测菌株OD600nm值,每组做3个平行。
乙醇耐受性:将筛选菌株接种于YPD液体培养中,添加无水乙醇使培养基乙醇体积分数为0、6%、7%、8%和9%,置于30 ℃恒温摇床中,转速180 r/min条件下培养72 h,每隔24 h利用酶标仪检测菌株OD600nm值,每组做3个平行。
pH耐受性:将培养基pH调整为2、3、4、5、6、7、8、9后过滤除菌,将筛选菌株接种于各pH的YPD液体培养中,置于30 ℃恒温摇床中,转速180 r/min条件下培养72 h,每隔24 h利用酶标仪检测菌株OD600nm值,每组做3个平行。
1.3.5 高产纤维素酶菌株产酶条件优化
初始产酶条件为使用1.1.3节产酶培养基配方,按照1%的接种量在30 ℃恒温摇床中,转速180 r/min条件下培养4 d,取粗酶液测定酶活。分别考察产碳源种类(添加量均为10 g/L麸皮、玉米芯、小麦秸秆、稻壳、甘蔗渣)、氮源种类(添加量均为10 g/L尿素、棉籽饼粉、蛋白胨、玉米浆干粉、豆粕粉、花生饼粉)、初始pH值(3、4、5、6、7、8)、接种量(3%、5%、7%、9%)和发酵温度(28 ℃、32 ℃、34 ℃)对筛选菌株产纤维素酶活力的影响。
1.3.6 数据统计分析
使用GraphPad Prism 8.0软件绘图,使用SPSS 22.0软件对数据进行统计分析。
2 结果与分析
2.1 高产纤维素酶菌株的分离与筛选
将酱香型酒醅悬液稀释后涂布于孟加拉红平板,然后挑选形态类似于酵母菌的菌株菌落到刚果红培养基划线纯化,根据能否在刚果红培养基上生长初步判断该菌株是否具有产纤维素酶的能力,挑选出在刚果红培养基上生长最快的菌株JXJP-Y19,接入产酶培养基中在30 ℃条件下培养4 d,测定4种与纤维素水解相关的酶活。结果表明,菌株JXJP-Y19产外切酶活、内切酶活和β-葡萄糖苷酶活分别为(0.700±0.035)U/mL、(0.391±0.021)U/mL和(0.482±0.019)U/mL,滤纸酶活为(0.424±0.032)U/mL,证明筛选的菌株JXJP-Y19具有产纤维素酶能力。
2.2 高产纤维素酶菌株JXJP-Y19的鉴定
2.2.1 高产纤维素酶菌株JXJP-Y19的菌落形态
如图1a所示,菌株JXJP-Y19在YPD培养基上菌落形态呈圆形,乳白色,表面扁平干燥,边缘较整齐,从菌落形态上看更类似于酵母菌而不是霉菌。如图1b所示,菌株JXJP-Y19在刚果红培养基上培养4 d后菌落形态有明显改变,菌落形态中心呈圆形,四周呈放射状,乳白色,表面干燥,中心凸起,边缘不整齐。如图1c所示,菌株JXJP-Y19的细胞形态为圆形和卵圆形,生殖方式为出芽生殖。
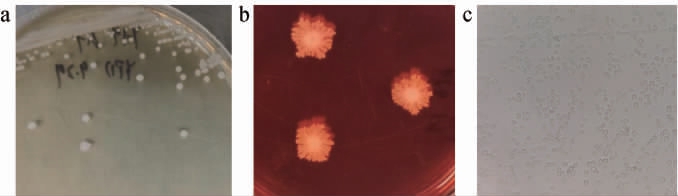
图1 JXJP-Y19菌株的菌落形态(a、b)及细胞形态(c)
Fig.1 Colony morphology (a, b) and cell morphology (c) of strain JXJP-Y19
a:YPD培养基;b:刚果红培养基;c:细胞形态。
2.2.2 生理生化试验
选取了18种不同的碳源作为培养基中唯一碳源用于检测菌株JXJP-Y19对不同碳源的同化情况,结果见表1。由表1可知,菌株JXJP-Y19可以利用D-葡萄糖、果糖、麦芽糖、D-木糖、D-甘露糖、纤维二糖、L-山梨糖、糊精、乙醇、蔗糖、甘油和棉子糖作为碳源进行生长,而不能利用乳糖、D-半乳糖、柠檬酸、淀粉、甲醇和肌醇作为碳源生长。
表1 菌株JXJP-Y19碳源同化试验结果
Table 1 Result of carbon source assimilation tests of strain JXJP-Y19
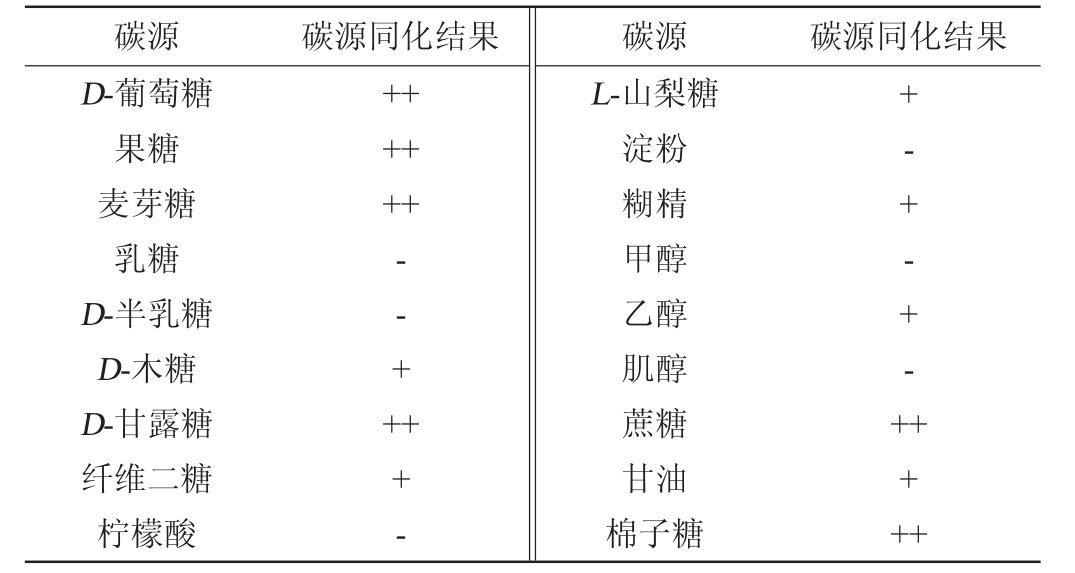
注:“++”代表结果呈强阳性;“+”代表结果呈阳性;“-”代表结果呈阴性。下同。
碳源 碳源同化结果 碳源 碳源同化结果D-葡萄糖果糖麦芽糖乳糖D-半乳糖D-木糖D-甘露糖纤维二糖柠檬酸++++++--++++-L-山梨糖淀粉糊精甲醇乙醇肌醇蔗糖甘油棉子糖+-+-+-+++++
选取了6种不同的氮源作为培养基中唯一氮源用于检测菌株JXJP-Y19对不同氮源的同化情况,结果见表2。由表2可知,菌株JXJP-Y19可以利用硫酸铵、乙胺、L-赖氨酸、肌酸作为氮源进行生长,而不能利用硝酸钾、亚硝酸钠作为唯一氮源生长。
表2 菌株JXJP-Y19氮源同化试验结果
Table 2 Result of nitrogen source assimilation tests of strain JXJP-Y19
氮源 硫酸铵 硝酸钾 乙胺 L-赖氨酸 肌酸 亚硝酸钠氮源同化结果 ++ - + + + -
选取了9种不同的菌株JXJP-Y19可利用碳源用于检测糖发酵产气和产酸的情况,结果见表3。由表3可知,菌株JXJP-Y19虽然可以同化D-葡萄糖、果糖、麦芽糖、D-木糖、纤维二糖、糊精、蔗糖、甘油和棉子糖,但是不能利用它们作为底物来发酵产气。
表3 菌株JXJP-Y19糖发酵产气、产酸能力的测定结果
Table 3 Determination result of gas and acid production capacity with sugar fermentation by strain JXJP-Y19
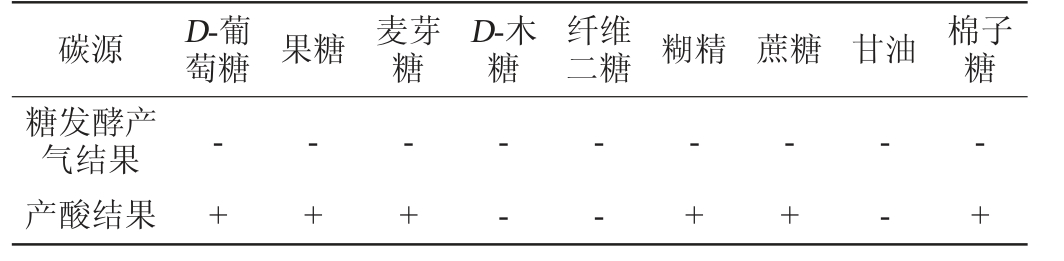
碳源 D-葡萄糖 果糖 麦芽糖D-木糖纤维二糖 糊精 蔗糖 甘油 棉子糖糖发酵产气结果产酸结果-+-+-+——-+-+---+
2.2.3 分子生物学鉴定
对分离筛选的高产纤维素酶菌株JXJP-Y19使用酵母菌鉴定通用引物NL1和NL4扩增其26S rDNA Dl/D2区域,琼脂糖凝胶电泳验证PCR扩增产物条带大小约在500~600 bp左右,扩增产物通过测序公司进行测序后在NCBI的GenBank数据库中进行BLAST比对,选取亲缘关系较近的菌株运用MEGA10.0的NJ法构建系统发育树,结果见图2。由图2可知,菌株JXJP-Y19与解脂耶氏酵母(Yarrowia lipolytica)的同源性高达99%以上。因此,菌株JXJP-Y19被鉴定为解脂耶氏酵母菌(Yarrowia lipolytica)。

图2 基于26S rDNA基因序列菌株JXJP-Y19的系统发育树
Fig.2 Phylogenetic tree of strain JXJP-Y19 based on 26S rDNA gene sequences
2.3 菌株JXJP-Y19的耐受性分析
温度对微生物的生长代谢具有非常重要的影响,一般而言,发酵温度越高,微生物的代谢活动越强,能一定程度上缩短发酵所需的时间,但同时高温也会对微生物的生长代谢产生一定的抑制。菌株JXJP-Y19的温度、乙醇及pH耐受性试验结果见图3。由图3a可知,在30~39 ℃条件下培养72 h的菌株JXJP-Y19都能够进行正常的生长代谢,但在温度30~36 ℃展现出的最大菌体生物量几乎相同,而在温度38~39 ℃随着温度升高最大菌体生物量略微降低。其中值得注意的是,从30~39 ℃温度范围内,菌株JXJP-Y19的适应期随温度的升高而逐渐延长,而当温度进一步提高到40 ℃时,菌株无法进行正常生长代谢。因此,菌株JXJP-Y19最大耐受温度为39 ℃。
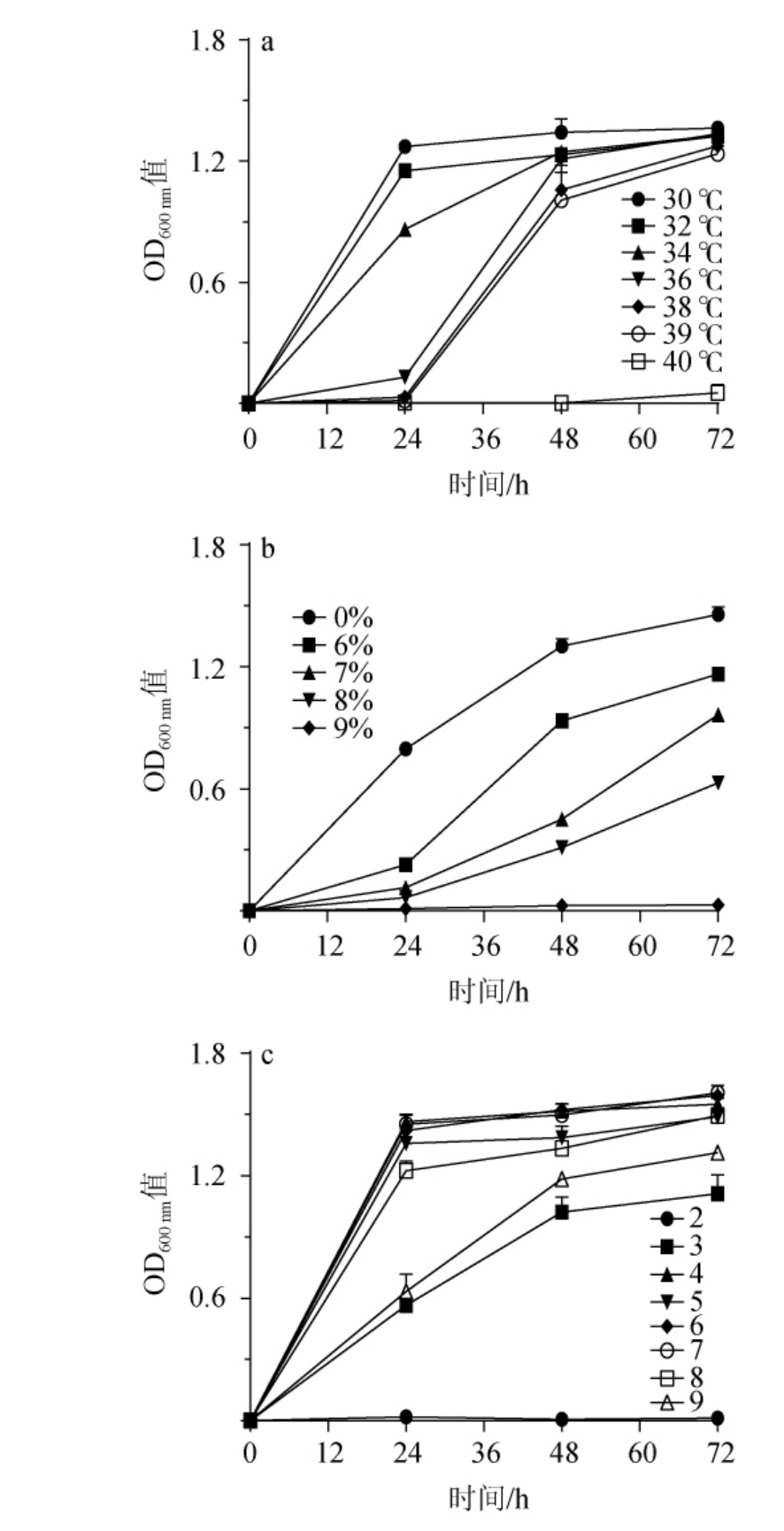
图3 菌株JXJP-Y19的耐受性试验结果
Fig.3 Results of tolerance tests of strain JXJP-Y19
a:温度;b:乙醇;c:pH。
酵母的乙醇耐受性能越好,其发酵后所得产品的酒精度就能越高,同时能适应的发酵环境就越宽泛。由图3b可知,随着培养基中加入乙醇体积分数在6%~9%范围内逐渐升高时,JXJP-Y19的生长代谢被抑制也越严重,生长速率明显变慢。相较于未添加乙醇的对照组,其适应期明显延长,且在72 h时的最大菌体生物量也随乙醇体积分数的增大而降低,而当乙醇体积分数达到9%时,完全无法生长。因此,菌株JXJP-Y19的最大乙醇耐受体积分数为8%。尽管本研究的解脂耶氏酵母JXJP-Y19经检测发现其不能利用糖类物质来发酵产乙醇,但解脂耶氏酵母可作为产香酵母与酿酒混合发酵酒类产品,或者作为底盘微生物处理含有乙醇的废弃物,而8%的乙醇耐受性能无疑为该菌株的可利用场景提供了广阔的空间。
pH能够通过影响蛋白质等大分子的电荷从而影响细胞膜的电荷水平,进而影响微生物和环境的物质交换从而影响微生物的生长,所以在过高或过低的pH条件下都会抑制酵母菌的生长或者导致酵母菌死亡。由图3c可知,菌株JXJP-Y19在pH值为4~7的范围内,都表现出良好的生长状态,其生长曲线和最大菌体浓度几乎一致,在该pH值范围内,酵母的生长不随pH值的变化而受影响,最适pH在6~7的范围内。当pH值降低至3和升高至9时,能明显看到该菌株的生长速率变慢,且72 h时的最大菌体生物量略有降低。而当pH值低至2时,菌株完全不生长。因此,菌株JXJP-Y19能耐受的最低pH为3,且最适宜在中性至微酸的环境中生长。
2.4 菌株JXJP-Y19的产酶条件优化
检测不同碳源、氮源、接种量、发酵温度、pH对菌株JXJP-Y19产纤维素酶活力的影响,结果见图4。由图4a可知,当以10 g/L羧甲基纤维素钠为碳源时,其滤纸酶活力为0.408 U/mL,而利用10 g/L麸皮、玉米芯、小麦秸秆、稻壳、甘蔗渣代替产酶培养基中的CMC-Na,其他成分和发酵条件不变的情况下,其滤纸酶活分别为0.516 U/mL、0.481 U/mL、0.371 U/mL、0.432 U/mL和0.191 U/mL。以麸皮为唯一碳源时,菌株JXJP-Y19产纤维素酶能力最强,滤纸酶活力最高,为0.516 U/mL。因此,选择麸皮作为最适碳源。
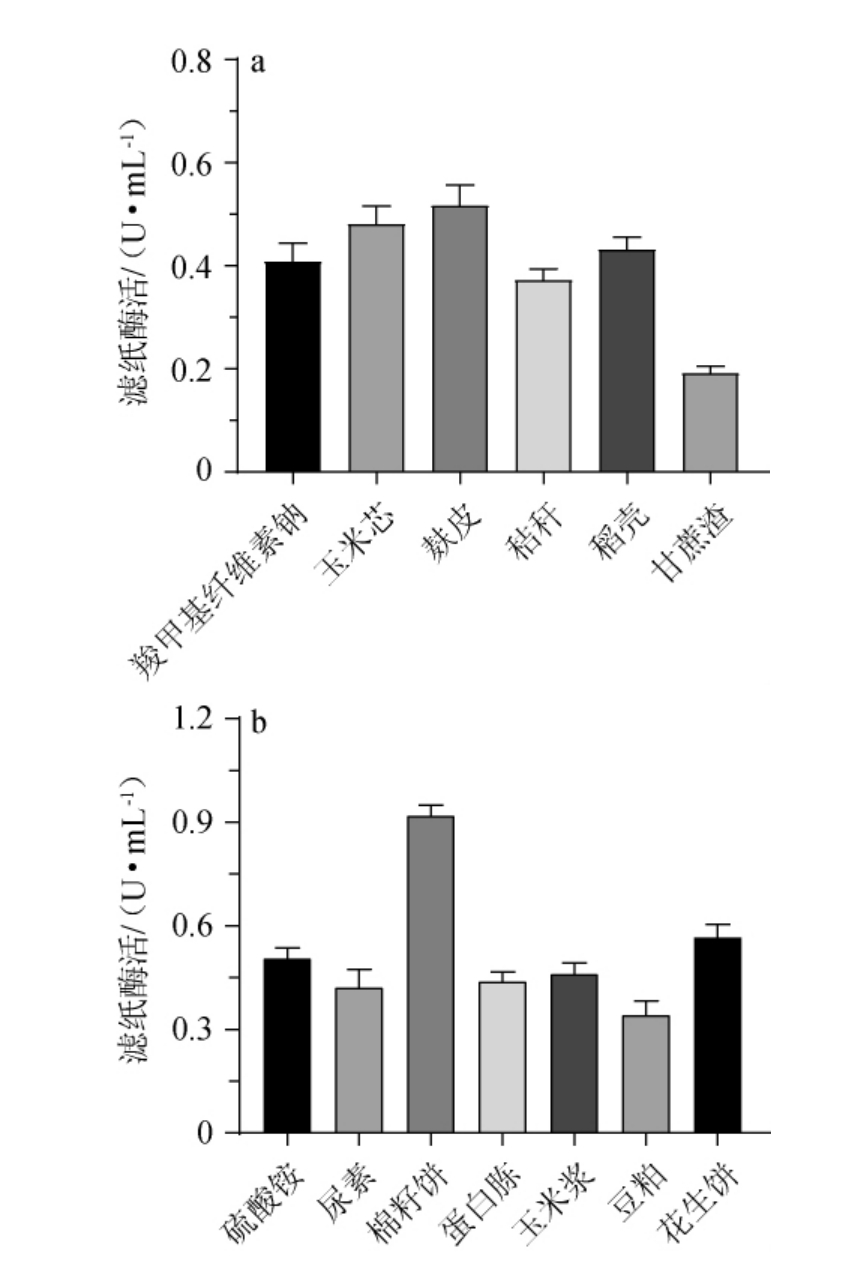
图4 菌株JXJP-Y19的产酶条件优化结果
Fig.4 Results of enzyme production conditions optimization of strain JXJP-Y19
a:碳源;b:氮源;c:接种量;d:发酵温度;e:初始pH。
由图4b可知,当以10 g/L硫酸铵为氮源时,其滤纸酶活力为0.506 U/mL,而利用10 g/L尿素、棉籽饼粉、蛋白胨、玉米浆干粉、豆粕粉、花生饼粉代替产酶培养基中的硫酸铵,其他成分和发酵条件不变的情况下,其滤纸酶活分别为0.422 U/mL、0.919 U/mL、0.439 U/mL、0.461 U/mL、0.341 U/mL和0.566 U/mL。以棉籽饼粉为唯一氮源时,菌株JXJP-Y19产纤维素酶能力最强,滤纸酶活力最高,为0.919 U/mL。因此,选择棉籽饼粉作为最适氮源。
由图4c可知,在接种量1%~9%的范围内,随接种量的增大,滤纸酶活力略微降低。因此,最适接种量为1%。由图4d可知,发酵温度在28~34 ℃,滤纸酶活力先随温度的升高而略微增加;发酵温度在30 ℃时,滤纸酶活力最大,为0.914 U/mL;随后随温度增高酶活力逐渐降低,因此,最适产酶温度为30 ℃。由图4e可知,培养基初始pH在3~8范围内,酶活力先随pH的升高而略微增加;在初始pH值为6时,滤纸酶活力最高,为0.921 U/mL;随后随pH增高酶活力又呈现略微下降的趋势。因此,最适产酶培养基pH值为6。
2.5 JXJP-Y19产酶条件优化前后酶活力变化
产酶条件优化前后检测与纤维素酶相关的四种酶活力,结果见图5。
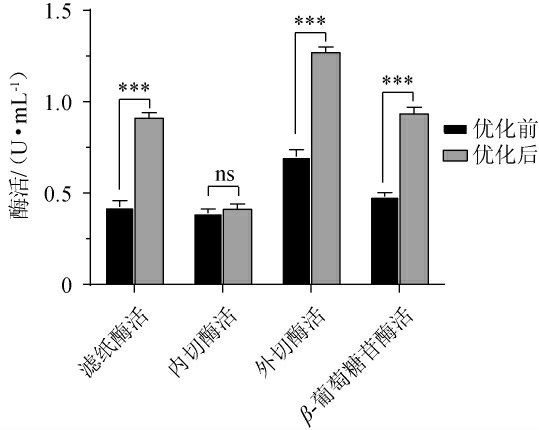
图5 菌株JXJP-Y19产酶条件优化前后纤维素酶相关酶活比较
Fig.5 Comparison of cellulase related enzyme activities of strain JXJP-Y19 before and after optimization of enzyme production conditions
“ns”表示无显著差异(P>0.05);“***”表示差异非常显著(P<0.001)。
由图5可知,优化产酶条件后菌株JXJP-Y19所产纤维素酶活力较优化前有了明显提升,菌株JXJP-Y19产滤纸酶活力、外切葡聚糖酶和β-葡萄糖苷酶酶活分别为(0.913±0.025)U/mL、(1.272±0.025)U/mL、(0.937±0.030)U/mL,分别是优化前的2.15倍、1.81倍和1.94倍(P<0.001),内切葡聚糖酶活力优化后为(0.414±0.023)U/mL,与优化前酶活(0.391±0.021)U/mL差别不大(P>0.05)。
3 讨论
纤维素的降解需要内切葡聚糖酶、外切葡聚糖酶和β-葡萄糖苷酶的协同作用才可以实现,而滤纸酶活力大小能综合体现对纤维素的水解效率。通过产酶条件优化前后的滤纸酶活力检测,发现优化后解脂耶氏酵母JXJP-Y19的产纤维素酶活力大小确实有了提升,而内切葡聚糖酶活力变化不明显,说明三种酶在纤维素的降解过程中所起的作用存在差异。在本实验条件下,外切葡聚糖酶和β-葡萄糖苷酶才是限制纤维素降解效率的关键酶,起主导作用。
依据纤维素酶的水解机制[28]:内切葡聚糖酶作用于纤维素无定型区域,随机切割产生新的还原末端,生成不同长度的寡糖;外切葡聚糖酶作用于纤维素的非还原端,生成纤维二糖及葡萄糖;β-葡萄糖苷酶,作用于游离的寡糖或纤维二糖,生成葡萄糖。推测本研究中菌株JXJP-Y19所产生的内切葡聚糖酶切割纤维素产生了大量具有还原末端的寡糖,而没有足够数量的外切葡聚糖酶来分解这些寡糖,于是外切葡聚糖酶的量成为了限制水解的关键;同时也可能是β-葡萄糖苷酶不能及时将水解出的纤维二糖分解成葡萄糖,大量累积的纤维二糖反过来抑制了其他纤维素酶的活性。王宝腾等[27]也通过对一株黄囊孔菌进行产酶条件优化得到了与本研究相似的结果。
4 结论
本研究从酱香型白酒酒醅中分离、筛选出一株能产纤维素酶的酵母菌JXJP-Y19,经形态学观察、生理生化试验和分子生物学鉴定确定其为解脂耶氏酵母菌(Yarrowia lipolytica)。菌株JXJP-Y19最大耐受温度为39 ℃,最大乙醇耐受体积分数为8%,最低耐受的pH为3,整体表现出良好的环境胁迫耐受性能。对产酶条件进行优化后,确定最适产酶条件为以碳源为麸皮、氮源为棉籽饼粉、初始pH为6,接种量为1%,温度为30 ℃。优化后菌株JXJP-Y19所产滤纸酶活力、外切葡聚糖酶和β-葡萄糖苷酶酶活分别为(0.913±0.025)U/mL、(1.272±0.025)U/mL、(0.937±0.030)U/mL,是优化前的2.15倍、1.81倍和1.94倍。本研究所筛选出的解脂耶氏酵母菌JXJP-Y19表现出良好的纤维素酶活力,完善的真菌纤维素酶体系为该菌株应用于白酒酒糟资源循环利用、纤维质原料发酵产油脂等提供了天然的优势,可作为潜在的开发菌株应用于纤维素生物降解利用。
[1]宋丽丽,闻格,霍姗浩,等.白酒酒糟中产纤维素酶细菌的分离筛选和酶学性质研究[J].食品与发酵工业,2020,46(7):43-49.
[2]李倩,裴朝曦,王之盛,等.不同类型酒糟营养成分组成差异的比较研究[J].动物营养学报,2018,30(6):2369-2376.
[3]刘志云,钟晓霞,姚焰础,等.白酒糟生物饲料及其在猪生产上的应用现状[J].动物营养学报,2020,32(1):15-20.
[4]蔡凤娇,蔡林洋,孔博,等.白酒糟的多元化利用研究进展[J].酿酒,2020,47(2):11-15.
[5]左上春,杨海泉,邹伟.白酒酒糟资源化利用研究进展[J].食品工业,2016,37(1):246-249.
[6]胡琨,秦世蓉,左勇,等.酒糟降解内切葡聚糖酶工程菌发酵条件的优化[J].食品科技,2021,46(8):7-15.
[7]王炫,汪江波,薛栋升.混菌固态发酵小曲白酒糟生产蛋白饲料的研究[J].湖北工业大学学报,2014,29(1):111-115.
[8]赵品瑶,陈巧灵,王海浪,等.白酒糟资源利用及菌种发酵研究现状[J].现代食品,2024,30(4):104-109.
[9]肖析蒙.一株纤维素降解菌的分离鉴定及其在酿酒上的应用初探[D].成都:西华大学,2020.
[10]DEMISSIE M S,LEGESSE N H,TESEMA A A.Isolation and characterization of cellulase producing bacteria from forest,cow dung,Dashen brewery and agro-industrial waste[J].PLoS One,2024,19(4):e0301607.
[11]CHOU K J,CROFT T,HEBDON S D,et al.Engineering the cellulolytic bacterium, Clostridium thermocellum, to co-utilize hemicellulose[J].Metab Eng,2024,83:193-205.
[12]FIELD J L,RICHARD T L,SMITHWICK E A H,et al.Robust paths to net greenhouse gas mitigation and negative emissions via advanced biofuels[J].Proc Natl Acad Sci USA,2020,117(36):21968-21977.
[13]张俊,许超,张宇,等.纤维素酶降解机理的研究进展[J].华南理工大学学报(自然科学版),2019,47(9):121-130.
[14]赵鑫,张红,门中华,等.纤维素酶的研究与应用进展[J].化学与生物工程,2023,40(9):1-9.
[15]胡敏.柠条表面纤维素降解菌的筛选及特性研究[D].呼和浩特:内蒙古农业大学,2023.
[16]MILLER T, WATURANGI D E, PURWADARIA T.Screening and characterization of cellulolytic molds from empty fruit bunches and soils in palm oil plantation area in Indonesia[J].BMC Res Notes,2021,14:1-6.
[17]ARNTHONG J, SIAMPHAN C, CHUASEEHARINNACHAI C, et al.Towards a miniaturized culture screening for cellulolytic fungi and their agricultural lignocellulosic degradation[J].J Microbiol Biotechnol,2020,30(11):1670-1679.
[18]ELHAMEED A E,SAYED A R M,RADWAN T E E,et al.Biochemical and molecular characterization of five Bacillus isolates displaying remarkable carboxymethyl cellulase activities[J].Curr Microbiol,2020,77(10):3076-3084.
[19]DEHGHANIKHAH F,SHAKARAMI J,ASOODEH A.Purification and biochemical characterization of alkalophilic cellulase from the symbiotic Bacillus subtilis BC1 of the Leopard Moth, Zeuzera pyrina (L.) (Lepidoptera:Cossidae)[J].Curr Microbiol,2020,77(7):1254-1261.
[20]赵龙妹,陈林,杜东晓,等.产纤维素酶细菌的筛选鉴定与特性分析[J].中国农学通报,2021,37(30):83-88.
[21]MA L L,LU Y Y,YAN H,et al.Screening of cellulolytic bacteria from rotten wood of Qinling(China) for biomass degradation and cloning of cellulases from Bacillus methylotrophicus[J].BMC Biotechnol, 2020,20:1-13.
[22]魏满红.高产蛋白酶酵母菌的筛选鉴定及其发酵豆粕和棉粕效果的研究[D].杨凌:西北农林科技大学,2022.
[23]罗明有,游玲,潘玲玲,等.一株产纤维素酶的浓香型白酒酵母产酶条件的初步研究[J].食品工业,2016,37(6):52-55.
[24]张璐璐,卫旭彪,马广,等.产纤维素酶酵母菌的筛选及鉴定[J].饲料工业,2016,37(14):49-53.
[25]FU Z H,LIU J,ZHONG L B,et al.Screening of cellulose-degrading yeast and evaluation of its potential for degradation of coconut oil cake[J].Front Microbiol,2022,13:996930.
[26]BARNET J A,PENN R W,YARROW D.酵母菌的特征与鉴定手册[M].青岛:青岛海洋大学出版社,1991:4-15.
[27]王宝腾,卓也,金锋杰,等.高效纤维素降解菌Flavodon sp.x10的酶学活性[J].菌物学报,2023,42(3):719-730.
[28]杨任飞.里氏木霉纤维素酶表达调控因子及分泌途径相关蛋白的鉴定与功能表征[D].济南:山东大学,2024.