焦磷酸酶(pyrophosphatase,PPase)是将一分子焦磷酸降解为两分子正磷酸盐离子的水解酶,而焦磷酸是脱氧核糖核酸(deoxyribonucleic acid,DNA)、核糖核酸(ribonucleic acid,RNA)、蛋白质和多糖生物合成过程中产生的副产物,因此,PPase在体内发挥着重要作用,可以水解焦磷酸生成焦磷酸盐,确保反应平衡向产物生成方向推进[1-2]。近年来,PPase在体外功能也逐渐显现,其不但应用于DNA测序、聚合酶链式反应(polymerase chain reaction,PCR)和单碱基延伸反应中,还可提高体外转录中RNA的产量[3-4]。此外,PPase还常用于量化释放焦磷酸作为副产物的反应速率,如单核苷酸多态性基因分型反应等[5]。
目前,PPase 主要来自于酿酒酵母(Saccharomyces cerevisiae)和大肠杆菌(Escherichia coli)[6-7]。酵母来源PPase在活性状态下为二聚体,单体分子质量约为32 kDa[6],姬长合等[8]利用大肠杆菌表达该PPase,酶活达到31.13 IU/mL,比酶活为99.73 IU/mg。E.coli来源PPase以六聚体形式存在,分子质量约为20 kDa[9],其每个亚基都含有一个活性位点,全酶中还含有两个镁离子[10]。但是尚未见利用E.coli同源表达该PPase的报道。
本研究将来自于E.coli的PPase基因构建到蛋白表达载体pET-28a(+)上,并在E.coli Rosetta(DE3)中进行同源过表达,进而对重组菌株的诱导表达的件(异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)浓度、诱导温度和诱导时间)进行优化;最后采用镍离子磁珠对带有组氨酸(histidine,His)标签的重组酶进行纯化,并对其酶学性质进行研究,为后续大量生成E.coli来源PPase提供技术支持。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒与引物
Escherichia coli DH5α、E.coli Rosetta(DE3)、表达质粒pET-28a(+):本实验室。本研究所用引物见表1。
表1 本研究所用引物
Table 1 Primers used in this study
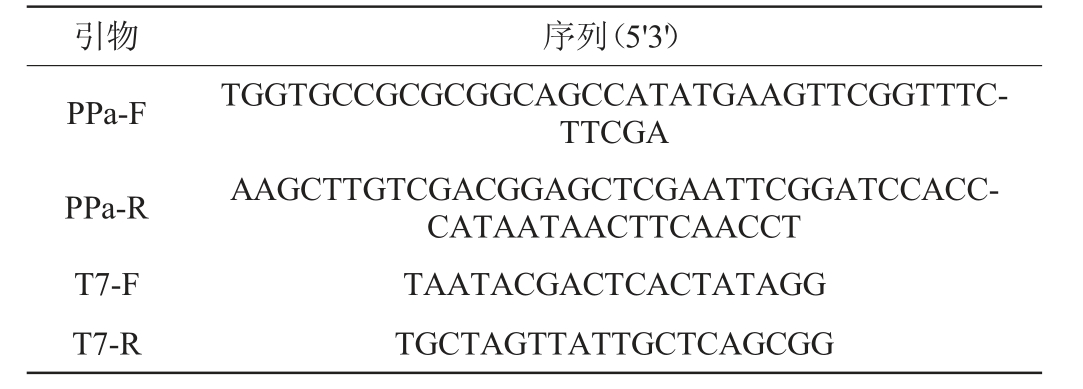
引物 序列(5'3')PPa-F PPa-R T7-F T7-R TGGTGCCGCGCGGCAGCCATATGAAGTTCGGTTTCTTCGA AAGCTTGTCGACGGAGCTCGAATTCGGATCCACCCATAATAACTTCAACCT TAATACGACTCACTATAGG TGCTAGTTATTGCTCAGCGG
1.1.2 主要试剂
Seaming Cloning K无缝克隆试剂盒、5×十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液、彩色预染蛋白Marker(10~130 kDa)、SDS-PAGE凝胶快速制备试剂盒、二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒:北京兰杰柯科技有限公司;氢氧化钠、咪唑、硫酸镁、氯化锰、氯化钙、六水氯化镁、乙酸锌、钼酸铵、抗坏血酸、琼脂粉、焦磷酸钠、磷酸氢二钠、磷酸二氢钾、酵母粉、胰蛋白胨、氯化钠、氯化钾、硫酸卡那霉素、氯霉素、IPTG(均为分析纯):生工生物工程(上海)股份有限公司;限制性内切酶NdeⅠ、XhoⅠ:日本Takara公司;BeaverBeads® IDANiekel镍离子螯合磁珠:中国Beaverbio公司;BeyoLyticTM细菌活性蛋白抽提试剂:碧云天生物技术有限公司。
1.1.3 培养基
LB培养基[11]:10 g/L NaCl,10 g/L胰蛋白胨,5 g/L酵母提取物,固体培养基额外添加20 g/L琼脂粉,121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
SPX-250-Ⅱ型生化培养箱:上海跃进医疗器械有限公司;SW-CJ-1BU洁净工作台:苏州安泰空气技术有限公司;A300基因扩增仪:杭州朗基科学仪器有限公司;ZWYR-2102C恒温培养振荡器:上海智城分析仪器制造有限公司;THZ-82数显恒温振荡器:常州天瑞仪器有限公司;希尔曼S-10生物传感器分析仪:深圳市西尔曼科技有限公司。
1.3 方法
1.3.1 表达载体构建与转化子验证
以E.coli Rosetta(DE3)基因组为模板,利用引物PPa-F/R PCR扩增目的基因片段。PCR扩增体系:PCR酶mix 22 μL,上下游引物各1 μL,模板1 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,50 ℃退火30 s,72 ℃延伸20 s,30次循环;72 ℃终延伸5 min。采用1%琼脂糖凝胶电泳鉴定并回收PCR扩增产物。通过Seaming Cloning K无缝克隆试剂盒将胶回收后的PCR扩增产物与用限制性内切酶NdeⅠ和XhoⅠ线性化后的pET-28a载体连接,热激法将连接产物转入E.coli DH5α感受态细胞,取100 μL涂布于含有50 μg/mL卡那霉素的LB培养基平板,37 ℃过夜培养。挑取单克隆培养后以T7-F/R引物进行菌液PCR验证,通过琼脂糖凝胶电泳分析扩增出的DNA条带,PCR验证正确后委托上海生工公司进行DNA测序,验证PPase基因碱基无突变后,利用热激法转化到E.coli Rosetta(DE3)进行表达。
1.3.2 重组焦磷酸酶的诱导表达及条件优化
挑取阳性转化子单克隆接种于5 mL含有50 μg/mL卡那霉素、20 μg/mL氯霉素的LB液体培养基中,37 ℃、180 r/min条件下培养12 h,然后按1%(V/V)接种量接种于装液量为50 mL/250 mL的LB液体培养基中,37 ℃、180 r/min条件下培养至OD600nm值为0.6后加入终浓度为0.2 mmol/L的IPTG,置于35 ℃、180 r/min诱导培养6 h。取菌液,8 000 r/min离心10 min后去上清,收集的菌体重悬于800 μL蛋白抽提试剂,室温裂解30 min后离心取上清,上清即为粗酶液,测定焦磷酸酶酶活。
在此基础上,依次考察诱导剂浓度(0.1 mmol/L、0.2 mmol/L、0.3 mmol/L、0.4 mmol/L、0.5 mmol/L、0.6 mmol/L、0.7 mmol/L、0.8 mmol/L、0.9和1 mmol/L)、诱导温度(15 ℃、20 ℃、25 ℃、30 ℃、35 ℃和40 ℃)和诱导时间(0、2 h、4 h、6 h、8 h、10 h、12 h、14 h、16 h、18 h、20 h、22 h和24 h)对重组焦磷酸酶酶活的影响。
1.3.3 重组焦磷酸酶的纯化
离心收集诱导表达后的重组菌,用30 mL预冷的无菌磷酸盐缓冲液(phosphate buffer saline,PBS)(pH 7.4)重悬,8 000 r/min离心10 min后弃上清,重复洗涤3次,加入30 mL PBS,涡旋振荡重悬菌体,在冰浴条件下进行超声破碎(超声时间20 min,工作3 s,停6 s),破碎,8 000 r/min离心5 min,取上清液。将上清液与镍离子螯合磁珠结合进行分离纯化:先向磁珠中加入Binding Buffer(50 mmol/L NaH2PO4、300 mmol/L NaCl、20 mmol/L咪唑,pH=7.4),悬浮磁珠,磁性分离,重复洗涤2次,将破碎所取上清加入装有磁珠的离心管,涡旋混匀仪振荡混匀15 s后,置于旋转混匀仪上,4 ℃旋转混合1 h,使蛋白与磁珠充分结合;然后用Washing Buffer(50 mmol/L NaH2PO4、300 mmol/L NaCl、50 mmol/L咪唑,pH=7.4)重悬洗涤,磁性分离弃上清,后加入Elution Buffer(50 mmol/L NaH2PO4、300 mmol/L NaCl、500 mmol/L咪唑,pH=7.4)悬浮磁珠,磁性分离,收集洗脱液。采用SDSPAGE检测并分析纯化效果,采用BCA法测定蛋白浓度[12]。
1.3.4 焦磷酸酶酶活测定
参照文献[8]测定焦磷酸酶酶活。先配制焦磷酸钠反应液:0.75mol/LTris-HCl(pH7.5),0.06mmol/LMgCl2,600mg/L Na4P2O7。将2 μL不同稀释倍数的焦磷酸酶加入600 μL焦磷酸钠反应液中,20 ℃反应10 min后,取20 μL溶液加入200 μL钼酸铵溶液(15 mmol/L钼酸铵,0.1 mol/L乙酸锌,pH 5.0)和50 μL pH 5.0的10%抗坏血酸溶液,吹打混合后于30 ℃条件下反应15 min,最后在波长750 nm处测定吸光度值。参考文献[13]以已知浓度的磷酸二氢钾溶液为标准溶液,采用上述方法得到标准曲线,将所测得样品的吸光度值带入标准曲线回归方程求得对应酶活。
焦磷酸酶单位酶活力定义:在测定条件下,每分钟分解焦磷酸产生无机正磷酸的微摩尔数为一个单位酶活力,U/mL。
1.3.5 重组焦磷酸酶酶学性质研究
温度对重组焦磷酸酶酶活及稳定性的影响:将纯化的酶液稀释适当倍数后加入pH值为7.5的焦磷酸钠反应液中,分别在不同温度(30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃和60 ℃)条件下反应,测定酶活,以最高酶活力为100%计算相对酶活,以确定最适反应温度。进一步将纯化的酶液在10~60 ℃条件下孵育30 min,然后在55 ℃条件下测定酶活,以最高酶活力为100%计算相对酶活,探究该酶的热稳定性。
pH对重组焦磷酸酶酶活及稳定性的影响:将纯化的酶液稀释适当倍数后加入不同pH值(6.5、7.0、7.5、8.0、8.5、9.0、9.5)的焦磷酸钠反应液中,在55 ℃条件下测定焦磷酸酶活,以最高酶活力为100%计算相对酶活,以确定最适反应pH。进一步将纯化的酶液在不同pH值(6.5~9.5)的缓冲液中4 ℃孵育30 min,然后在pH 9条件下测定酶活,以最高酶活力为100%计算相对酶活,探究该酶的pH稳定性。
金属离子对酶活的影响:在大多数酶催化的反应中,金属离子可以作为辅助因子参与结合底物、稳定酶分子构象、在酶促反应中传递电子等,不同的金属离子可作为激活剂或抑制剂来影响酶的活性[14-15]。因此,向焦磷酸钠反应液中分别加入终浓度为5 mmol/L的K+、Mg2+、Na+、Mn2+、Zn2+,以不加金属离子为空白对照(Control),在最适反应条件下测定焦磷酸酶的活性以确定不同的金属离子对重组PPase的影响。
半失活时间与动力学参数:将稀释适当倍数的纯化酶液在55 ℃条件下保温,分别在0、20 min、40 min、60 min、80 min、100 min和120 min后取样,在最适反应条件下测定酶活,确定酶的半失活时间。分别配制1 mmol/L、2 mmol/L、3 mmol/L、4 mmol/L、5 mmol/L、6和7 mmol/L的焦磷酸钠溶液,在最适反应条件下测定重组PPase催化不同浓度底物的速率V,以1/[S]为横坐标,1/V为纵坐标,采用双倒数法作图并计算最大反应速率(Vmax)、米氏常数(Km)和催化常数(Kcat)。
1.3.6 数据处理
所有试验重复3次,采用Origin 2018软件处理数据并进行单因素方差分析(analysis of variance,ANOVA),采用GraphPad Prism 9软件绘图。
2 结果与分析
2.1 表达载体的构建及转化子验证
利用无缝克隆技术将大肠杆菌的PPase基因与载体pET-28a连接构建焦磷酸酶表达载体pET-28a-PPa,将构建成功的表达载体转化至E.coli Rosetta(DE3),利用菌液PCR对转化子进行初步验证,并进一步对PCR扩增产物进行测序验证,结果见图1。
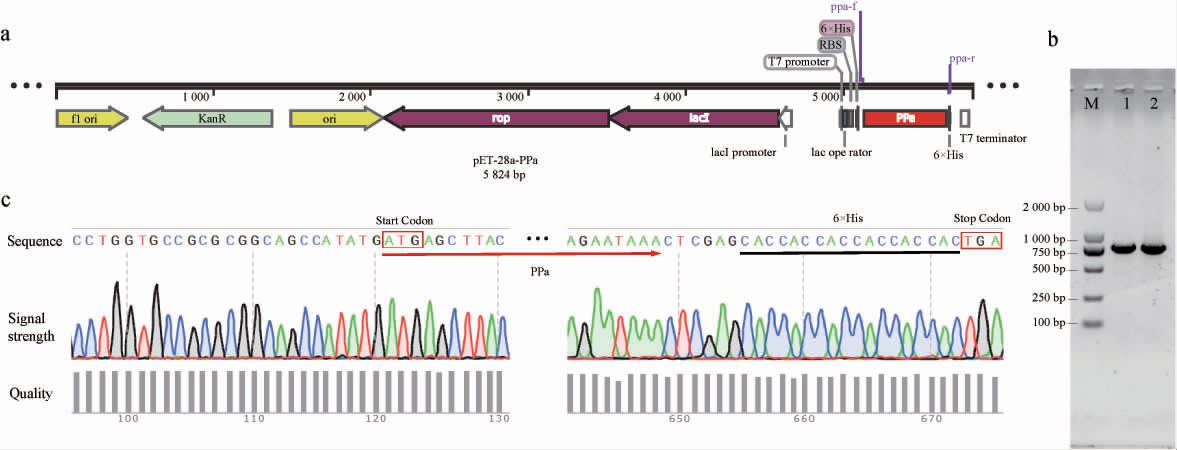
图1 pET-28a-PPa质粒示意图与转化子验证结果
Fig.1 Schematic diagram of plasmid pET-28a-PPa and verification results of transformant
a:pET-28a-PPa质粒示意图;b:琼脂糖凝胶电泳图,其中M为DL 2 000 DNA Marker,1和2均为T7-F/R为引物菌液PCR扩增产物;c:转化子使用T7-F/R为引物获得的DNA测序部分峰图。
由图1a可知,焦磷酸酶的N和C端分别存在His标签序列便于后续蛋白的分离纯化。由图1b可知,在750 bp和1 000 bp的DNA Marker之间存在条带,与预计的重组PPase基因碱基长度(774 bp)基本一致。由图1c可知,DNA序列与目的序列完全一致,无碱基突变。其中删除了基因的终止密码子,保留了载体的组氨酸标签,便于后面的蛋白纯化,最终将构建成功的阳性转化子命名为E.coli PPa。
2.2 重组焦磷酸酶诱导表达条件的优化
诱导条件直接影响蛋白表达产量[16-17],因此,对大肠杆菌诱导焦磷酸酶表达的条件进行优化可为未来大规模生产该酶提供理论依据。本研究中使用的pET-28a蛋白表达载体含有T7启动子和乳糖操纵子,需要加入IPTG才会诱导焦磷酸酶基因表达,然而普遍认为过量的IPTG会抑制细胞生长进而影响蛋白表达[18-19];同时重组菌株E.coli PPa表达重组蛋白时,过量表达的蛋白质容易发生错误折叠和堆积易在胞内形成不可溶的包涵体,导致表达出的蛋白活性降低甚至没有活性[20-21]。此外,诱导温度和诱导时间同样影响蛋白表达,诱导温度高则表达量高,容易引起包涵体的形成,而过低的诱导温度又会增加发酵过程能耗从而提高发酵成本[22]。因此,对诱导剂IPTG浓度、诱导温度以及诱导时间进行优化,以提高焦磷酸酶的表达效率和活性,结果见图2。

图2 异丙基-β-D-硫代半乳糖苷诱导重组菌株Escherichia coli PPa表达焦磷酸酶条件的优化
Fig.2 Conditions optimization for pyrophosphatase expression of recombinant strains Escherichia coli PPa induced by isopropyl-β-d-thiogalactoside
由图2a可知,随着IPTG浓度的增加,重组PPase的酶活性呈先升高后下降的趋势。当IPTG浓度为0.4 mmol/L时,重组PPase的酶活达到最高,为81.03 U/mL。由图2b可知,随着诱导温度的升高,重组PPase的酶活呈先升高后下降的趋势。当诱导温度为20 ℃时,重组PPase的酶活达到最高,为122.54 U/mL。继续提高诱导温度,酶活降低,可能是由于过高的温度使焦磷酸酶变性失活所致,此外,诱导过程中的高温也会对宿主细胞造成严重损伤[23-25]。由图2c可知,在IPTG诱导浓度为0.4 mmol/L且诱导温度为20 ℃条件下,重组菌E.coli PPase诱导生产焦磷酸酶酶活性随着诱导时间的增加呈先升高后下降的趋势,当诱导时间为8 h时,重组PPase的酶活达到最高,为129.05 U/mL;继续延长诱导时间,酶活降低,可能是由于焦磷酸酶的过表达导致包涵体的形成,先前报道大肠杆菌表达酵母来源焦磷酸酶的最适IPTG浓度为1 mmol/L[8],可能是由于本研究中焦磷酸酶的同源表达相对异源表达更加容易,且由于蛋白相对分子质量较小不易形成包涵体,因此,相对较低浓度IPTG即可达到最适诱导条件。因此,确定最佳诱导剂IPTG浓度为0.4 mmol/L,诱导温度为20 ℃,诱导时间为8 h。综上,通过对重组菌株诱导条件优化,使得焦磷酸酶粗酶液的活性提高3.15倍,为后续大量生产PPase提供了数据支持。
2.3 重组焦磷酸酶的纯化
以原始菌株E.coli Rosetta(DE3)为对照,将重组菌株E.coli PPa细胞破碎液、离心后的沉淀、上清液及纯化后的酶液进行SDS-PAGE分析,结果见图3。由图3可知,相比于对照,E.coli PPa无论是上清液还是沉淀均在25 kDa下有明显条带,与理论分子质量19.7 kDa接近,说明重组PPase被成功表达及纯化。
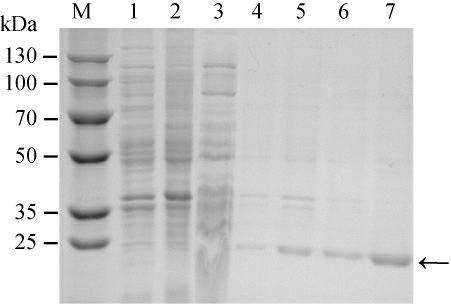
图3 重组焦磷酸酶的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分析
Fig.3 Sodium dodecyl sulfate-polyacrylamide gel electrophoresis analysis of recombinant pyrophosphatase
M为蛋白Marker,1~7分别为E.coli Rosetta(DE3)上清液、E.coli Rosetta(DE3)细胞破碎液、E.coli Rosetta(DE3)沉淀、E.coli PPa上清液、E.coli PPa沉淀、E.coli PPa细胞破碎液、纯化后的PPase。箭头所指处为纯化后的蛋白。
2.4 重组焦磷酸酶酶学性质研究
2.4.1 温度和pH对重组PPase的影响
酶作为生物催化剂,其活性受到多种因素的调节,其中pH和温度是酶促反应的主要影响因素。pH值对酶的构象和催化相关基团的解离以及底物分子的解离状态都有影响[26-27]。此外,在特定的温度范围内,酶促反应的速度随着温度的升高而加快。然而,当温度超过一定限度时,酶促反应的速度反而会随着温度的继续升高而下降。因此,研究酶的最适pH和最适温度可以帮助了解酶的工作原理和酶活限制条件,为后续对该酶的理性设计提供依据。不同温度对重组PPase活性和稳定性的影响见图4。由图4a可知,随着反应温度的升高,重组PPase的活性呈先升高后下降的趋势,当反应温度升高至55 ℃时,重组PPase活力最高,因此,确定重组PPase的最适反应温度为55 ℃。由图4b可知,随着温度的升高,重组PPase的酶活呈下降趋势,当在30 ℃孵育30 min后,相对酶活为62.23%,当孵育温度超过30 ℃之后,重组PPase的相对酶活<50%,说明重组PPase在温度10~30 ℃范围内相对稳定。
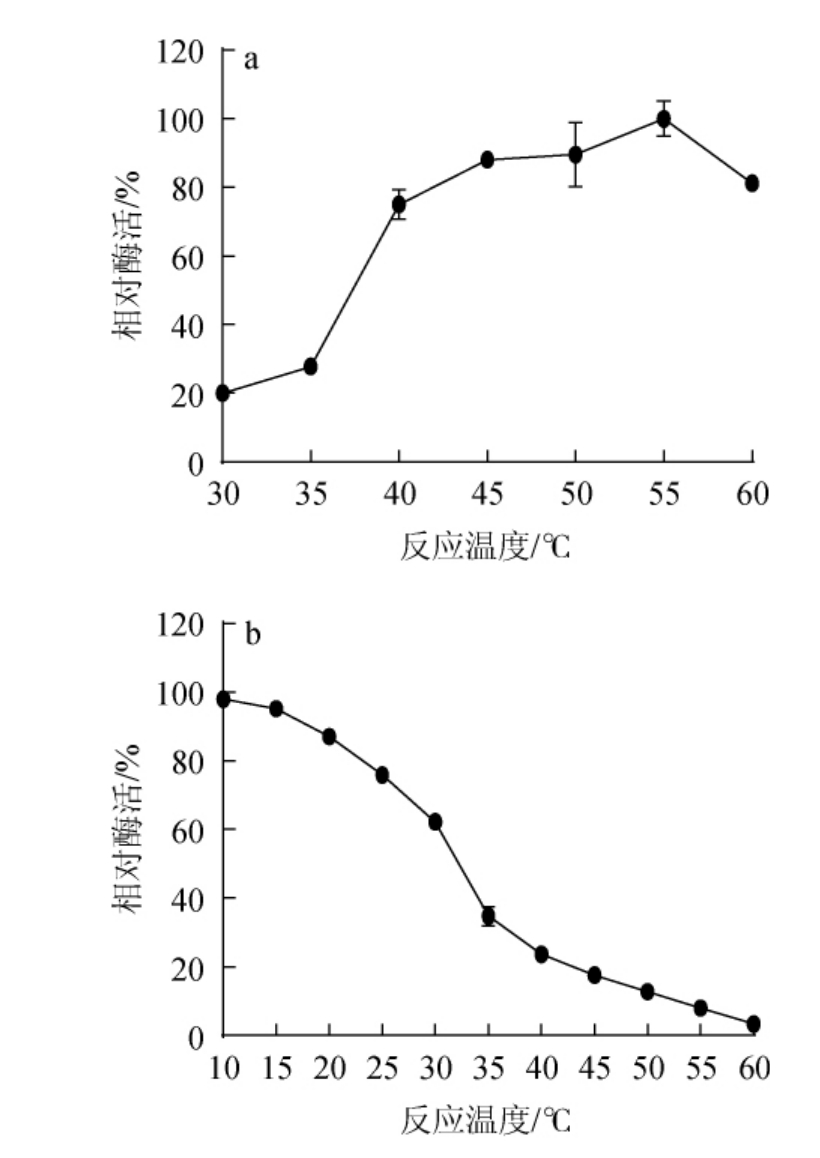
图4 不同温度对焦磷酸酶活性(a)和稳定性(b)的影响
Fig.4 Effect of different temperature on activity (a) and stability (b) of pyrophosphatase
不同pH对重组PPase活性和稳定性的影响见图5。由图5a可知,随着反应pH的升高,重组PPase的活性呈先升高后下降的趋势,当反应pH为9.0时,重组PPase活力最高,因此,确定重组PPase的最适反应pH为9.0。由图5b可知,随着pH的升高,重组PPase的酶活呈先升高后下降的趋势,当在pH 6.5和9.5条件下孵育30 min后,相对酶活均<50%,说明重组PPase在pH 7.0~9.0范围内相对稳定。
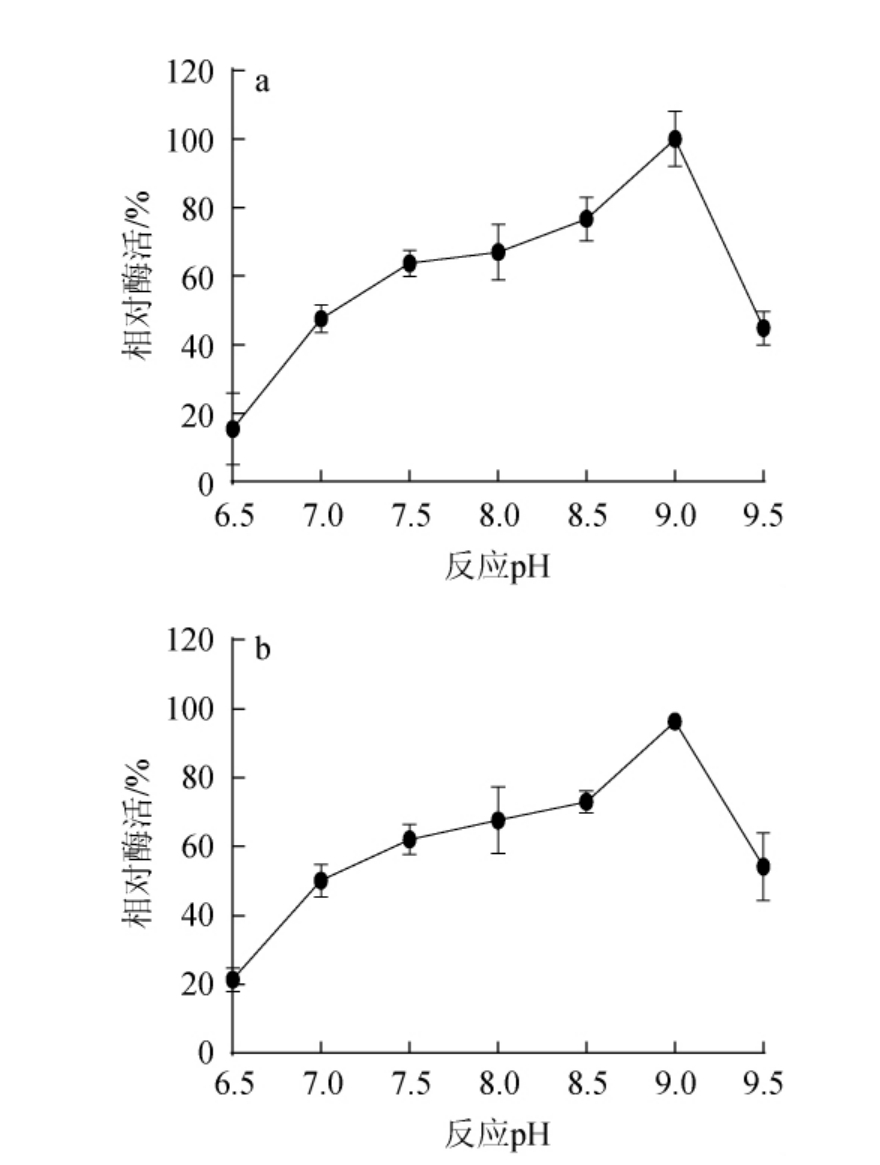
图5 不同pH对重组焦磷酸酶活性(a)和稳定性(b)的影响
Fig.5 Effect of different pH on activity (a) and stability (b) of pyrophosphatase
综上,确定重组PPase的最适反应pH和温度分别为9.0和55 ℃。已报道来源于Saccharomyces cerevisiae的PPase最适反应温度和pH分别为42 ℃和7.2[28],而常用于体外合成RNA的T7-RNA聚合酶最适反应pH为8.0[29],在该pH条件下,本研究获得的重组PPase仍具有67.01%的相对酶活,其次T7-RNA聚合酶最适反应温度为37 ℃,而耐热型T7-RNA聚合酶在52 ℃进行高效体外转录[30],以上说明重组PPase具备复配T7-RNA聚合酶的潜力,尤其是耐热型T7-RNA聚合酶。
2.4.2 金属离子对重组PPase的影响
不同金属离子(终浓度为5 mmol/L)对重组对重组PPase活性的影响见图6。由图6可知,与Control相比,K+、Na+、Mg2+均极显著提高了酶活(P<0.01),分别使酶活提高了52.92%、62.14%和49.34%,而Mn2+、Zn2+均极显著抑制了酶活(P<0.01),对该酶有强烈的抑制作用,分别使该酶活性下降了65.34%、41.72%,Ca2+对重组PPase的活性无显著性影响(P>0.05)。而据报道,Mg2+、Zn2+、Co2+、Mn2+、Ca2+二价金属离子均可以提高酵母无机焦磷酸酶催化活性[28];Ca2+、Mn2+、K+、Zn2+等金属阳离子对掘越氏火球菌(Pyrococcus horikoshii)来源的焦磷酸酶PhoPPase活性无显著性影响,但是Mg2+是PhoPPase的激活剂[31]。这说明不同来源焦磷酸酶具有差异性,且据报道Mg2+为T7-RNA聚合酶转录过程中的限制因子[32-33],而浓度大于200 mmol/L的K+、Na+可以显著抑制T7-RNA聚合酶的活性[34],因此,在体外合成RNA催化过程中应按照使用的焦磷酸酶引入Mg2+并维持相对低浓度的K+、Na+从而提高RNA合成产量。
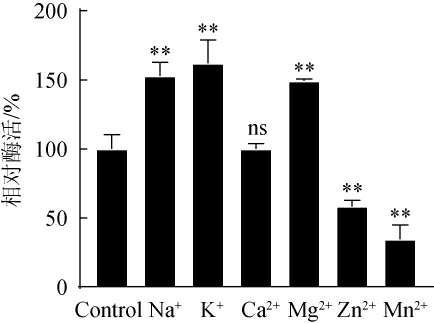
图6 金属离子对重组焦磷酸酶活的影响
Fig.6 Effects of metal ions on pyrophosphatase activities
“ns”表示与Control相比无显著差异(P>0.05);“**”表示与Control相比差异极显著(P<0.01)。
2.4.3 半失活时间与动力学参数
为探讨该重组PPase的热稳定性,将纯化酶液在最适反应温度55 ℃下孵育相应时间,通过酶活性的降低确定半失活时间,并进一步以不同浓度的焦磷酸钠溶液为底物,在最适酶反应条件下,测定PPase催化不同浓度底物的速率V,采用双倒数作图法确定酶的动力学参数,结果见图7。
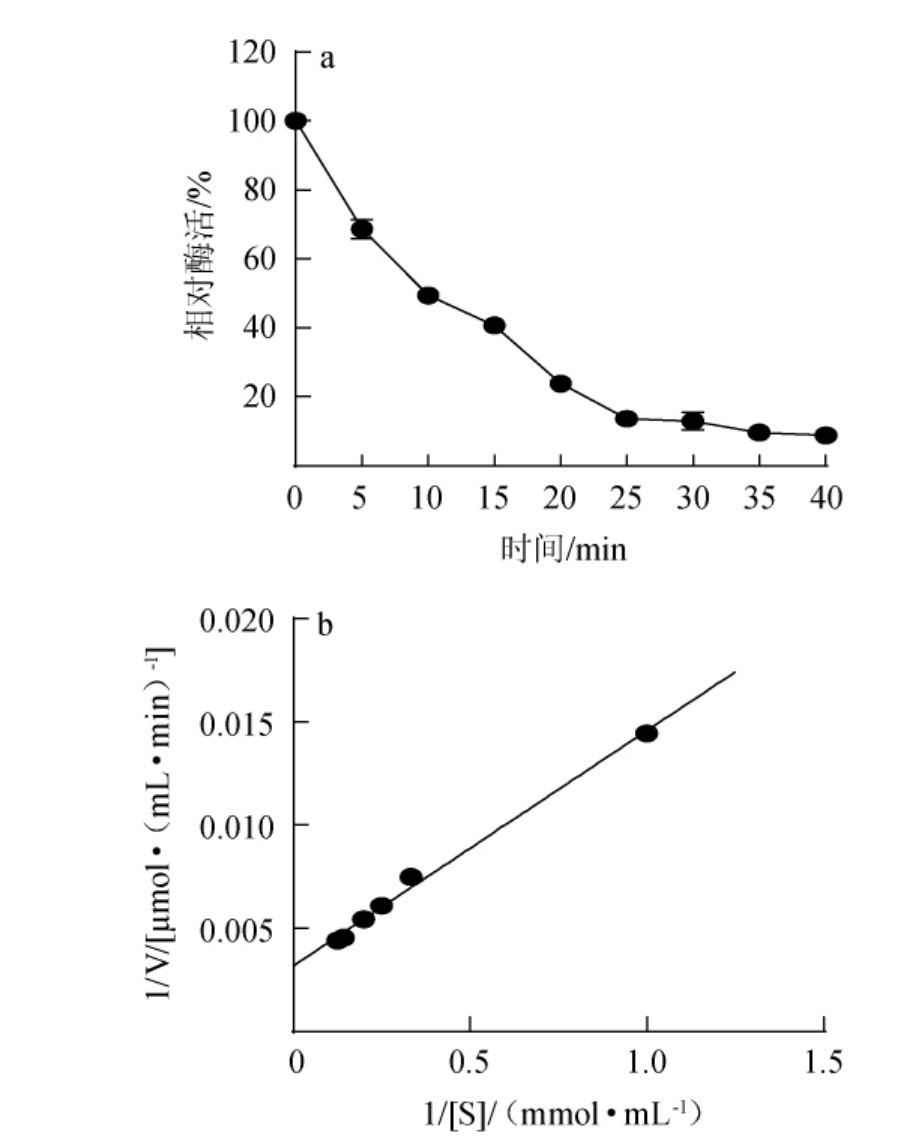
图7 重组焦磷酸酶半失活时间(a)及反应动力学(b)
Fig.7 Half-inactivation time (a) and reaction kinetics (b) of recombinant pyrophosphatase
由图7a可知,随着保温时间的延长,重组PPase的活性逐步降低,当保温时间为10 min后酶活降低50%,因此,确定其半失活时间为10 min。由图7b可知,该酶Km值为3.58 μmol/mL,Vmax值为314.66 μmol/(mL·min),且酶的转换数(催化常数)Kcat为87 300.56 S-1。其中Km值低于报道的利用大肠杆菌表达来源于超嗜热古菌Pyrococcus horikoshii的无机焦磷酸化酶(Km=14.27 μmol/mL)[30],说明其对底物具有更高的亲和力,更有利于催化。
3 结论
本研究成功在Escherichia coli Rosetta(DE3)中表达了同源PPase基因,构建了重组菌株E.coli PPa,其在诱导温度、时间和IPTG浓度分别为20 ℃、8 h和0.4 mmol/L时,重组PPase活力最高,为129.05 U/mL,是优化前的3.14倍。重组PPase的理论分子质量为19.7 kDa;最适反应温度和pH分别为55 ℃和9,在温度10~30 ℃及pH 7.0~9.0范围内稳定;金属离子K+、Mg2+和Na+可极显著性提高该酶活性(P<0.01),而Mn2+和Zn2+对该酶有极显著抑制作用(P<0.01);重组PPase的动力学参数Km值为3.58 μmol/mL、Vmax值为314.66 μmol/(mL·min),Kcat值为87 300.56 S-1,半失活时间为10 min。本研究结果为后续工业化生产PPase及对该酶的理性设计提供依据。
[1]VOROBYEVA N N,KURILOVA S A,ANASHKIN V A,et al.Inhibition of Escherichia coli inorganic pyrophosphatase by fructose-1-phosphate[J].Biochemistry,2017,82:953-956.
[2]SERRANO-BUENO G,HERNÁNDEZ A,LÓPEZ-LLUCH G,et al.Inorganic pyrophosphatase defects lead to cell cycle arrest and autophagic cell death through NAD+depletion in fermenting yeast[J].J Biol Chem,2013,288(18):13082-13092.
[3]LAPENTA F,MONTÓN SILVA A,BRANDIMARTI R,et al.Escherichia coli DnaE polymerase couples pyrophosphatase activity to DNA replication[J].Plos One,2016,11(4):e0152915.
[4]LIU X,ZHANG Y,ZHOU S R,et al.Circular RNA:An emerging frontier in RNA therapeutic targets,RNA therapeutics,and mRNA vaccines[J].J Control Release,2022,348:84-94.
[5]PU D,MAO C G, CUI L B, et al.Pyrosequencing with di-base addition for single nucleotide polymorphism genotyping[J].Anal Bioanal Chem,2016,408(12):3113-3123.
[6]TERSTEEG S, MROZOWICH T, HENRICKSON A, et al.Purification and characterization of inorganic pyrophosphatase for in vitro RNA transcription[J].Biochem Cell Biol,2022,100(5):425-436.
[7]JIN J,WU R J,ZHU J,et al.Insights into the cellular function of YhdE,a nucleotide pyrophosphatase from Escherichia coli[J].Plos One,2015,10(2):e0117823.
[8]姬长合,王靖.酿酒酵母无机焦磷酸酶基因在大肠杆菌中的表达及其意义[J].吉林大学学报(医学版),2012,38(1):70-74.
[9]VAINONEN J P,VOROBYEVA N N,RODINA E V,et al.Metal-free PPi activates hydrolysis of MgPPi by an Escherichia coli inorganic pyrophosphatase[J].Biochemistry,2005,70:69-78.
[10]SAMYGINA V R,POPOV A N,RODINA E V,et al.The structures of Escherichia coli inorganic pyrophosphatase complexed with Ca2+ or CaPPi at atomic resolution and their mechanistic implications[J].J Mol Biol,2001,314(3):633-645.
[11]胡兰兰,田亚楠,陈福生,等.重组大肠杆菌E.coli BL21/pET28a(+)-mle产苹果酸乳酸酶发酵条件的优化[J].中国酿造,2018,37(6):161-164.
[12]张璐瑶,朱伟,李瑛傑,等.消光系数法与二喹啉甲酸法测定多肽浓度精密度的比较[J].华中科技大学学报(医学版),2023,52(2):206-211.
[13]ERIKSSON J, KARAMOHAMED S, NYRÉN P.Method for real-time detection of inorganic pyrophosphatase activity[J].Anal Biochem,2001,293(1):67-70.
[14]王佰涛,刘德海,陈晓飞,等.高产β-甘露聚糖酶黑曲霉菌株的分离与鉴定[J].中国酿造,2022,41(5):101-105.
[15]权淑静,杨文玲,雷高,等.产几丁质酶高原菌的分离鉴定及酶学性质初步研究[J].中国酿造,2023,42(11):152-156.
[16]刁文涛,向凌云,宁萌,等.α-半乳糖苷酶基因在大肠杆菌中的表达及酶学性质研究[J].中国酿造,2019,38(8):60-66.
[17]苏鹏,龚国利.重组蛋白表达技术的研究进展[J].中国酿造,2016,35(10):9-12.
[18]MENZELLA H G,CECCARELLI E A,GRAMAJO H C.Novel Escherichia coli strain allows efficient recombinant protein production using lactose as inducer[J].Biotechnol Bioeng,2003,82(7):809-817.
[19]KIELKOPF C L, BAUER W, URBATSCH I L.Expression of cloned genes in E.coli using IPTG-inducible promoters[J].Cold Spring Harbor Protocols,2021,2021(2):doi: 10.1101/pdb.prot102137.
[20]赵喜红,何小维,李文美,等.大肠杆菌表达包涵体蛋白体外复性研究进展[J].食品工业科技,2010,31(6):379-383.
[21]HASHEMZADEH M S, MOHAMMADI M, GHALEH H E G, et al.Expression, solubilization, refolding and final purification of recombinant proteins as expressed in the form of"Classical Inclusion Bodies"in E.coli[J].Protein Peptide Lett,2021,28(2):122-130.
[22]DE GROOT N S,VENTURA S.Effect of temperature on protein quality in bacterial inclusion bodies[J].FEBS Lett,2006,580(27):6471-6476.
[23]AUCOIN M G,MCMURRAY-BEAULIEU V,POULIN F,et al.Identifying conditions for inducible protein production in E.coli:combining a fed-batch and multiple induction approach[J].Microb Cell Fact,2006,5:1-13.
[24]YI Y C,TAN S I,HU R E,et al.Exploring temperature-mediated plasmid replication as a reversible and switchable protein expression system in genetic Escherichia coli[J].J Taiwan Inst Chem Eng,2023,144:104751.
[25]MURATA M,FUJIMOTO H,NISHIMURA K,et al.Molecular strategy for survival at a critical high temperature in Escherichia coli[J].Plos One,2011,6(6):e20063.
[26]MAZZEI L,CIANCI M,BENINI S,et al.The impact of pH on catalytically critical protein conformational changes: the case of the urease, a nickel enzyme[J].Chem Eur J,2019,25(52):12145-12158.
[27]LOTFY S N, SAAD R, EL-MASSREY K F, et al.Effects of pH on headspace volatiles and properties of Maillard reaction products derived from enzymatically hydrolyzed quinoa protein-xylose model system[J].LWT-Food Sci Technol,2021,145:111328.
[28]HALONEN P,BAYKOV A A,GOLDMAN A,et al.Single-turnover kinetics of Saccharomyces cerevisiae inorganic pyrophosphatase[J].Biochemistry,2002,41(40):12025-12031.
[29]WU H, WEI T, YU B B, et al.A single mutation attenuates both the transcription termination and RNA-dependent RNA polymerase activity of T7 RNA polymerase[J].RNA Biol,2021,18(sup1):451-466.
[30]BOULAIN J C,DASSA J,MESTA L,et al.Mutants with higher stability and specific activity from a single thermosensitive variant of T7 RNA polymerase[J].Protein Eng Des Sel,2013,26(11):725-734.
[31]LU D M, XIE G Q, GAO R J.Cloning, purification, and characterization of inorganic pyrophosphatase from the hyperthermophilic archaea Pyrococcus horikoshii[J].Protein Expres Purif,2014,99:94-98.
[32]THOMEN P,LOPEZ P J,BOCKELMANN U,et al.T7 RNA polymerase studied by force measurements varying cofactor concentration[J].Biophys J,2008,95(5):2423-2433.
[33]WU S G.Molecular dynamics simulation study of the "stay or leave"problem for two magnesium ions in gene transcription[J].Proteins,2017,85(6):1002-1007.
[34]BORKOTOKY S,MURALI A.The highly efficient T7 RNA polymerase:A wonder macromolecule in biological realm[J].Int J Biol Macromol,2018,118:49-56.