酒曲能为白酒酿造提供丰富的功能微生物,其产生的代谢产物对白酒产量、酒体香味风格产生重要影响,是白酒酿造的原始动力[1-2]。小曲是白酒酿造常用的糖化发酵剂之一[3],常以大米、米糠或麸皮为原料,根霉或酵母菌引种制作而成[4],其发酵周期短,用量极少[5],一定程度上能够降低生产成本。目前,酒曲中微生物多样性和菌群结构的研究已大量报道[3],但关于白酒小曲微生物的研究却鲜有报道。研究解析小曲中微生物多样性及菌群结构有助于更好地解析曲药糖化发酵机理,提高酒曲质量与产量。
微生物多样性研究方法主要有依赖培养和不依赖培养法[6]。依赖传统培养的研究方法耗时耗力,效率较低,故微生物组成研究多采用现代分子生物技术,如高通量测序技术、变性梯度凝胶电泳以及单分子实时测序技术(single molecule real-time sequencing technology,SMRT)。与第一、第二代测序技术相比,单分子测序技术具有通量高、读长长、检测效率高等优点[7]。目前,已有少数研究者将该技术应用到酒曲微生物的研究中,如谢丹等[8]应用单分子测序技术解析酱香型白酒机械制曲与人工制曲发酵过程中细菌群落结构特征,结果表明,2种大曲中的优势菌门一致,优势菌属具有一定差异性。
平坝窖酒小曲以平坝大米为原料,珍珠泉为水源,再辅以多味中药材发酵制成,独特的环境以及制曲工艺造就平坝窖酒小曲独特的微生物群系[9]。本研究采用SMRT首次解析平坝窖酒小曲的微生物多样性及菌群结构,可较为全面的解析平坝小曲微生物组成,为平坝窖酒酒体质量的提升及产香来源研究奠定坚实的基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
平坝酒厂生产用小曲样品采用多点取样、整块取样的方式取自企业成曲仓,酒曲样品保持4 ℃低温环境送至实验室粉碎处理后,备用。
1.1.2 试剂
总脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:美国OMEGA公司;LSK109连接试剂盒、Ampure XP beads试剂盒、Qubit定量试剂盒:美国Pacific Biosciences公司。
1.2 仪器与设备
Oxford Nanopore PromethION测序仪:美国Nano Drop公司;Nanodrop-2000c微量紫外分光光度计:美国Thermo fisher公司;Sub-Cell电泳仪、Universial HoodⅡ凝胶成像分析系统:美国Bio-RAD公司;H2-16KR台式高速冷冻离心机:湖南可成仪器设备有限公司。
1.3 实验方法
1.3.1 小曲微生物总DNA的提取
按总DNA提取试剂盒步骤对小曲样品中所有物种的总DNA进行提取,采用琼脂糖凝胶电泳检测DNA片段大小分布,采用Nanodrop-2000c微量紫外分光光度计进行质量检验,当所提DNA的A260nm/A280nm在2.0~2.2范围内时,即认为所提DNA的质量达到测序要求。
1.3.2 测序文库构建及质量检测
样本质检合格后,利用Ampure XP beads试剂盒纯化DNA,对DNA进行损伤修复和末端修复,纯化后使用LSK109连接试剂盒中接头进行连接反应,最后用Qubit定量试剂盒精确地对建好的DNA文库进行定量检测。
1.3.3 单分子实时测序分析
文库构建完成后,开始制备上机反应体系,DNA、Squencing buffer、Load beads按照一定的比例加入Flow cell中,并将Flow cell转移到Oxford Nanopore PromethION测序仪,进行测序分析。
1.3.4 数据处理
测序完成后,测序得到的原始图像数据文件经碱基识别(Base Calling)分析转化为原始数据(raw reads),使用QIIME22019.4版本对微生物组的生物学信息进行分析。原始序列数据使用demux插件进行解码处理,然后使用DADA2插件对序列进行质量过滤、去噪、拼接和嵌合体去除。基于Silva数据库对97%相似水平的操作分类单元(operational taxonomic units,OTU)代表序列进行注释分析。采用Kraken2软件联合Bracken软件做物种注释。先利用Kraken2软件直接对获得的clean reads与marker基因集进行比对,对样品中的原核、真核微生物进行精确到种属水平的物种注释,再用Bracken软件对样本中物种实际相对丰度进行预测。基于SPSS 26.0、Origin 2021进行数据处理。
2 结果与分析
2.1 测序结果
采用SMRT共测得读长81 063 765条、读长数据量71 825 Gb,组装后得到的宏基因组数据量大小为0.785 Gb,预测到的非冗余基因数目共430 552条。scaffold N50为155 714 bp,说明获得的平坝小曲微生物物种基因组完整度较高。平坝窖酒小曲在属水平上共组装出398个微生物属,在种水平上共组装出534个物种。
2.2 平坝窖酒小曲微生物菌群α-多样性分析
平坝窖酒小曲微生物菌群的α-多样性指数见表1。由表1可知,宏基因组文库覆盖率达99.51%,说明测序结果足以反映平坝窖酒用小曲中微生物的真实情况。在97%相似度水平下,平坝窖酒小曲所有微生物测序分析共获得574个OTU。平坝窖酒小曲的Chao1指数、Shannon指数、InvSimpson指数值分别为507、4.58、6.06。陈小琴等[10]研究发现,传统小曲细菌和真菌菌群的Chao1指数值分别为401.01和140.47,Shannon指数值分别为5.86、1.24。InvSimpson指数越大代表样品多样性越高[11],贵州不同地区(威宁、黔北、兴仁)传统小曲细菌菌群的InvSimpson指数范围为2.43~4.76,真菌菌群为2.21~4.00[6]。从多样性指数数值大小上分析平坝窖酒小曲微生物多样性,可初步判断平坝窖酒小曲中的微生物菌落组成和结构较为复杂,这与平坝窖酒小曲发酵制作工艺的不同密切相关。
表1 平坝窖酒小曲微生物菌群α-多样性分析结果
Table 1 Results of α-diversity analysis of microbial community in Pingba Baijiu Xiaoqu
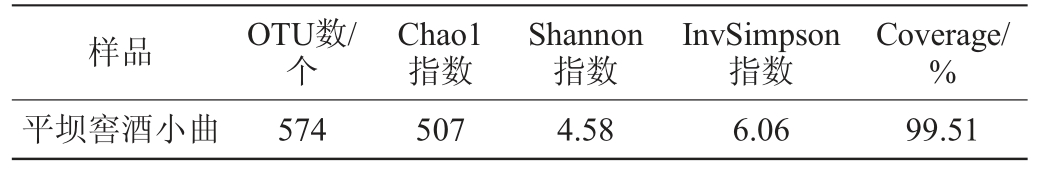
样品 OTU数/个Chao1指数Shannon指数InvSimpson指数Coverage/%平坝窖酒小曲 574 507 4.58 6.06 99.51
2.3 平坝窖酒小曲微生物菌群构成
2.3.1 微生物菌群整体构成分析
通过Kraken2和Bracken软件对小曲中微生物测序数据进行物种注释与丰度分析,结果显示,平坝窖酒小曲中微生物菌群组成呈霉菌类群(42%)占优势、细菌(33%)与酵母菌(25%)次之的特征,这与LIU Z B等[12]所报道的酒曲微生物以霉菌、细菌及酵母为主的研究结果相一致。平坝窖酒小曲中霉菌居多,有研究表明,中草药对霉菌有促进作用[13],平坝窖酒小曲制作时添加了多味中药,这可能是其霉菌为优势菌群的主要原因之一。此外,王民俊[13]研究表明,部分中药影响酵母菌的生长,这可能是平坝窖酒小曲中酵母菌数量较少的原因。平坝窖酒小曲特殊的制曲工艺形成了其独特的小曲微生物群系。在白酒酿造时,酒曲中霉菌的糖化力、液化力以及蛋白质分解能力较为突出;酵母菌以酒精发酵为主同时也可产生一些相关酶系;细菌能够为白酒提供大量的呈香呈味物质或其前体物质[14],3种酒曲微生物在白酒酿造时均发挥着重要的作用。在平坝窖酒酿造时,平坝窖酒小曲这种独特的微生物组成也将促进形成具有特色风格的平坝窖酒。
2.3.2 优势微生物构成分析
对平坝小曲中相对丰度排名前15(top15)的微生物构成进行统计分析,结果见表2。由表2可知。无论是在属水平上还是在种水平上,平坝窖酒小曲均以细菌类群为优势微生物,其次是酵母菌和霉菌。微生物整体构成结果表明,在小曲微生物中霉菌总体相对含量较高,细菌相对含量仅次于霉菌。但在相对丰度排名前15的微生物中,细菌类群处于优势地位,酵母和霉菌相对丰度相当。在发酵初期,酒曲中的酵母和霉菌会有一定程度的生长延迟期,此时细菌可为白酒发酵提供酸性的环境、同时也可产生蛋白酶、果胶酶、糖化酶和纤维素酶等酶类促进高粱及配糟中的淀粉、糖类、蛋白等物质分解进而促进各种代谢的进行,产生的风味物质利于白酒风味的形成[15]。平坝小曲优势细菌丰度较高有利于白酒发酵初期风味的形成,此外细菌形成的酸性环境可以促进原料的分解,可帮助功能酵母和功能霉菌更好的发挥其功能。总之在平坝窖酒小曲优势细菌、霉菌和酵母的协同作用下,可促进平坝窖酒特征风味的形成。
表2 平坝窖酒小曲中相对丰度排名前15的微生物构成
Table 2 Microbial composition of the top 15 in relative abundance in Pingba Baijiu Xiaoqu
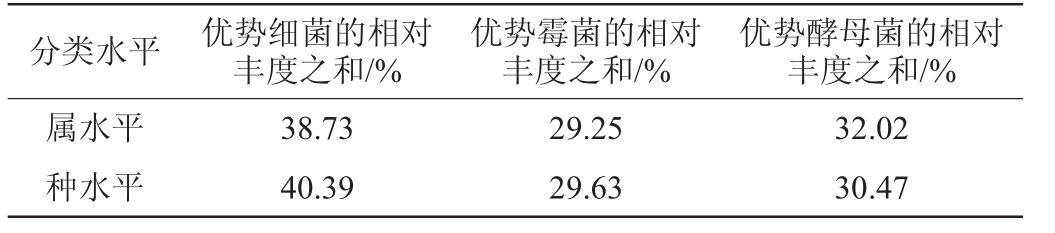
分类水平 优势细菌的相对丰度之和/%优势霉菌的相对丰度之和/%优势酵母菌的相对丰度之和/%属水平种水平38.73 40.39 29.25 29.63 32.02 30.47
2.3.3 细菌菌群结构分析
在属和种水平上对相对丰度排名前10(top10)的细菌进行分析,结果见图1。由图1可知,平坝窖酒小曲中细菌类群的分布极不均衡,其中魏斯氏菌属(Weissella sp.)的相对丰度较高,可达28.16%,是平坝窖酒小曲中最为典型的优势细菌属(相对丰度>1%),其他优势细菌属包括芽孢杆菌属(Bacillus sp.)、片球菌属(Pediococcus sp.)、肠杆菌属(Enterobacter sp.)。这与王清龙等[3]的研究结果一致,其研究结果表明,小曲优势细菌菌群特征表现为:魏斯氏菌属相对丰度高达44.86%,其他多种细菌属如芽孢杆菌属相对丰度较小。芽孢杆菌属是白酒发酵中常见的细菌,在浓香型和酱香型白酒中被认定为是优势菌属[3],其具有产酶量高、酸、热耐受性较强等特点[16]。在白酒发酵的酸性、高温环境中,芽孢杆菌分泌淀粉酶将谷物中的淀粉分解为糊精和一系列的低聚糖[16]。魏斯氏菌属是各地小曲中主要细菌类群[17],由于制曲工艺、原料、环境等均会影响酒曲微生物的菌群结构[17],所以平坝小曲中的细菌菌群结构与王清龙等[3]所报道的小曲细菌菌群结构既有同一性,也有差异性。
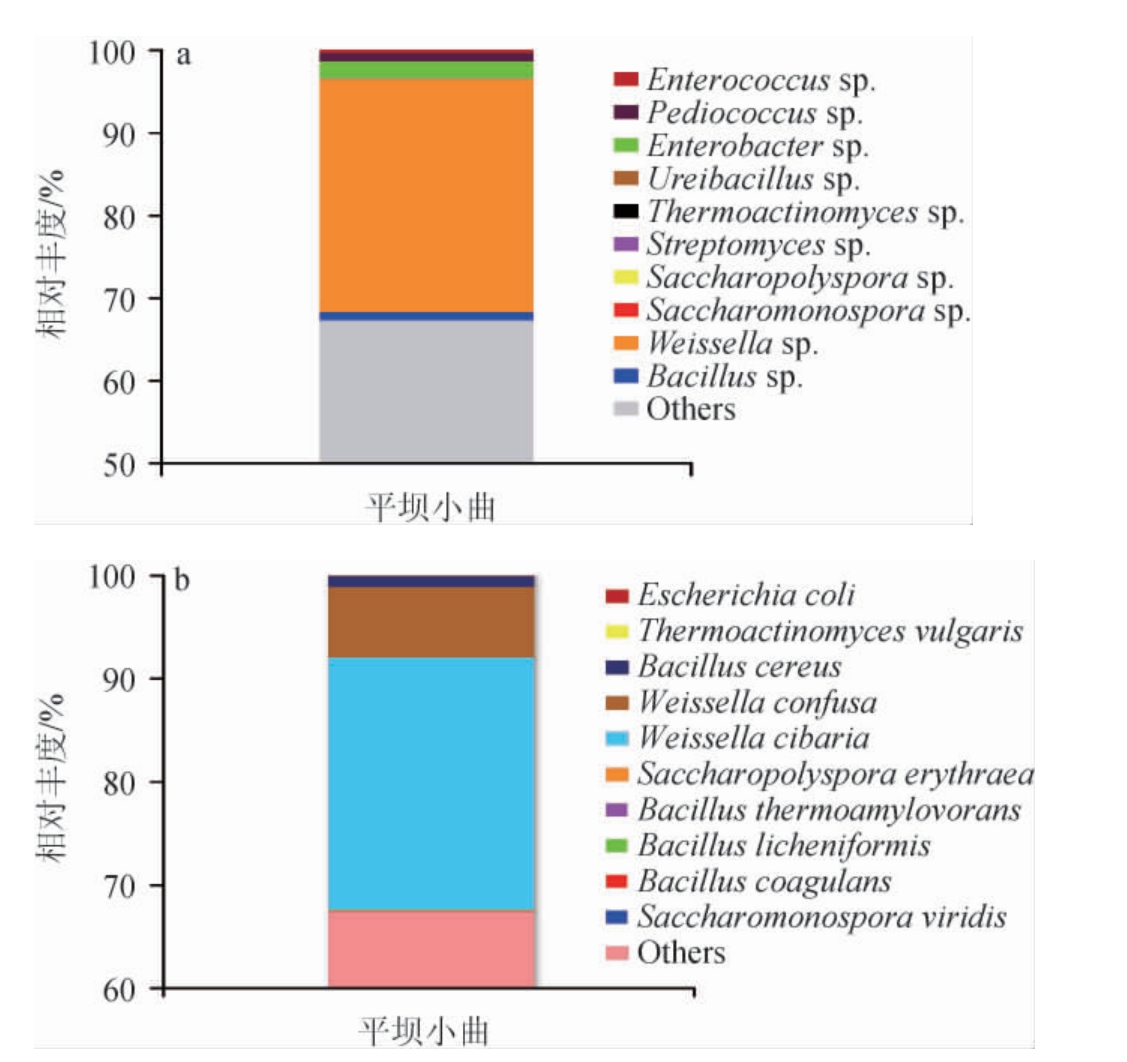
图1 基于属(a)和种(b)水平平坝窖酒小曲细菌菌群结构
Fig.1 Structure of bacterial community of Pingba Baijiu Xiaoqu based on genus (a) and species (b) level
others:相对丰度排名10之后的细菌属或种。
对平坝窖酒小曲来说,魏斯氏菌属(Weissella sp.)可以被确立为特征性绝对优势细菌属,其中食窦魏斯氏菌(Weissella cibaria)、融合魏斯氏菌(Weissella confusa)是分布最多的两个菌种,其相对丰度分别为24.46%、6.86%,是小曲中最为典型的优势细菌种。其次,蜡样芽孢杆菌(Bacillus cereus)也是平坝小曲中的优势细菌种,相对丰度为1.03%。王玉荣等[18]研究发现,小曲中食窦魏斯氏菌和融合魏斯氏菌的相对丰度分别为18.86%和16.15%,平坝窖酒小曲中食窦魏斯氏菌的相对丰度高于其所报道的小曲,而融合魏斯氏菌的相对丰度则远低于其所报道的小曲,这些差异与平坝窖酒小曲的制曲工艺、制取环境以及制曲原料都密切相关。食窦魏斯氏菌和融合魏斯氏菌均属于异型乳酸发酵优势菌,前者在产生乳酸的同时具有更加复杂的发酵特性,能发酵产生较多的风味物质[19];后者在高盐条件下可产胞外多糖、短链脂肪酸、生物胺、β-葡聚糖和乙酸等组分[20],这对于白酒风味品质的形成有积极的作用。蜡样芽孢杆菌具有产淀粉酶的能力[16],在白酒酿造过程中有助于分解原料促进白酒发酵。综上,平坝窖酒小曲中的主要优势细菌种有食窦魏斯氏菌(Weissella cibaria)、融合魏斯氏菌(Weissella confusa)、蜡样芽孢杆菌(Bacillus cereus),这些优势细菌种在平坝窖酒酿造过程中,能够促进平坝窖酒的发酵和白酒风味物质的形成。
2.3.4 霉菌菌群结构分析
在属和种水平上选择相对丰度排名前10(top10)的霉菌进行深入分析,结果见图2。由图2可知,在属水平上,平坝窖酒小曲中霉菌以根霉属(Rhizopus sp.)为绝对优势霉菌属,相对丰度最高,为27.00%,其他优势霉菌属还包括须霉属(Phycomyces sp.)、横梗霉属(Lichtheimia sp.)、曲霉属(Aspergillus sp.),这与小曲纯种微生物接种、发酵制作期短的制曲工艺密切相关[6]。Phycomyces sp.、Lichtheimia sp.、Aspergillus sp.等尽管相对丰度远远小于根霉属(Rhizopus sp.),但在白酒酿造过程中也发挥着重要重用,如曲霉属是曲药中负责降解淀粉的主要微生物[21],横梗霉属霉菌能分泌蛋白酶、淀粉酶,在白酒糖化、发酵时分解原料[22]。平坝窖酒小曲制作时加入的母曲中根霉是主要的优势霉菌之一,加上纯种接种的工艺特点,所以根霉成为成品平坝窖酒小曲的绝对优势霉菌。根霉是一种糖化力极其强的功能菌,其产生的酯化酶能将酸与乙醇缩合生成芳香酯,此外根霉还可直接产生一些复杂的代谢产物,影响白酒品质[23]。由此可以推测,平坝窖酒小曲中的根霉能为平坝窖酒的出酒率、风味形成作出重要的贡献。
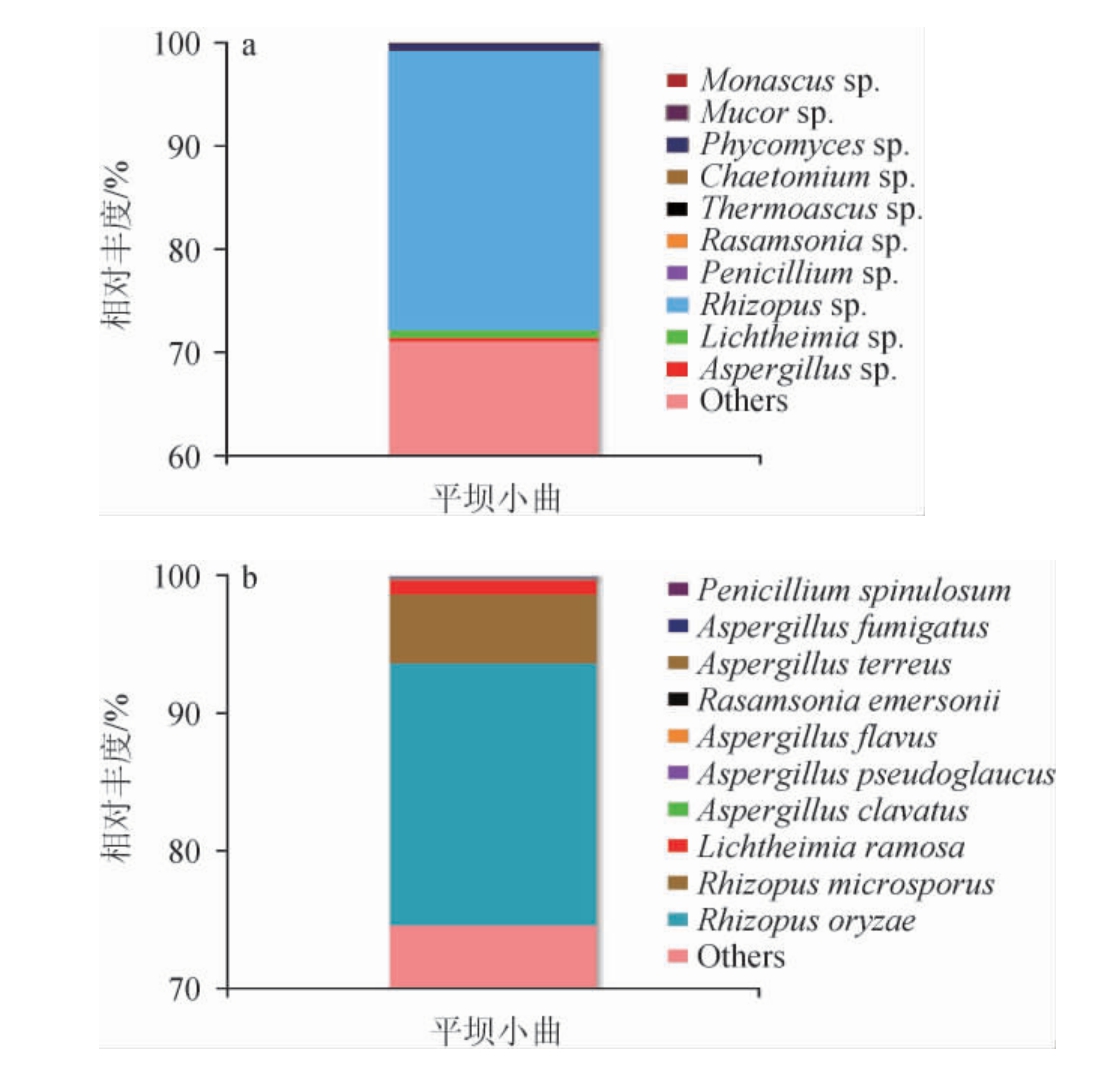
图2 基于属(a)和种(b)水平平坝窖酒小曲霉菌菌群结构
Fig.2 Structure of mold community of Pingba Baijiu Xiaoqu based on genus (a) and species (b) level
others:相对丰度排名10之后的霉菌属或种。
在种水平上,霉菌的菌群结构特征与属水平的相一致。根霉类群具有较高的相对丰度,为主要的优势霉菌属,米根霉(Rhizopus oryzae)和小孢根霉(Rhizopus microsporus)为平坝窖酒小曲中特征性优势霉菌种,相对丰度分别为19.00%、5.00%。其次,横梗霉(Lichtheimia ramosa)也是平坝窖酒小曲的优势霉菌种,相对丰度为1.01%。横梗霉能分泌酯化酶,在白酒发酵或储存期间,酯化酶能催化乙醇和己酸反应进而合成己酸乙酯[24]。小孢根霉分泌的耐酸性α-淀粉酶活性较高,在白酒发酵后期能够充分利用原料中的淀粉提高出酒率[25]。米根霉具有极强的产淀粉酶、糖化酶能力,同时具有较强的产酒能力,米根霉的这些功能特点可以促进酒质和出酒率的提升;此外,米根霉还具有较强的风味化合物生成能力,能促进酒体风味的形成[24]。如XIANG W L等[26]利用纯米根霉曲发酵生产黄酒,在黄酒中检测到丰富的游离氨基酸,不仅为酿酒微生物的生长提供氮,而且带来鲜、甜、苦、涩等多种味道;此外在纯米根霉发酵生产的黄酒中检测到丰富的酯类可以赋予黄酒果香和花香,还有醇类、醛类等风味物质。由此可推测,平坝窖酒小曲中相对丰度较高的米根霉能够促进平坝窖酒游离氨基酸和酯类、醇类、醛类等风味物质的形成,赋予平坝窖酒花果香及酒香等风味。
2.3.5 酵母菌群结构分析
王春晓等[4]综述小曲是人工接种曲母、根霉和酵母菌培养而成的微生物制剂,因此推测平坝小曲接种的曲母中酵母菌亦是主要的微生物之一。故在属和种水平上对相对丰度排名前5(top5)的酵母菌群结构进行分析,结果见图3。
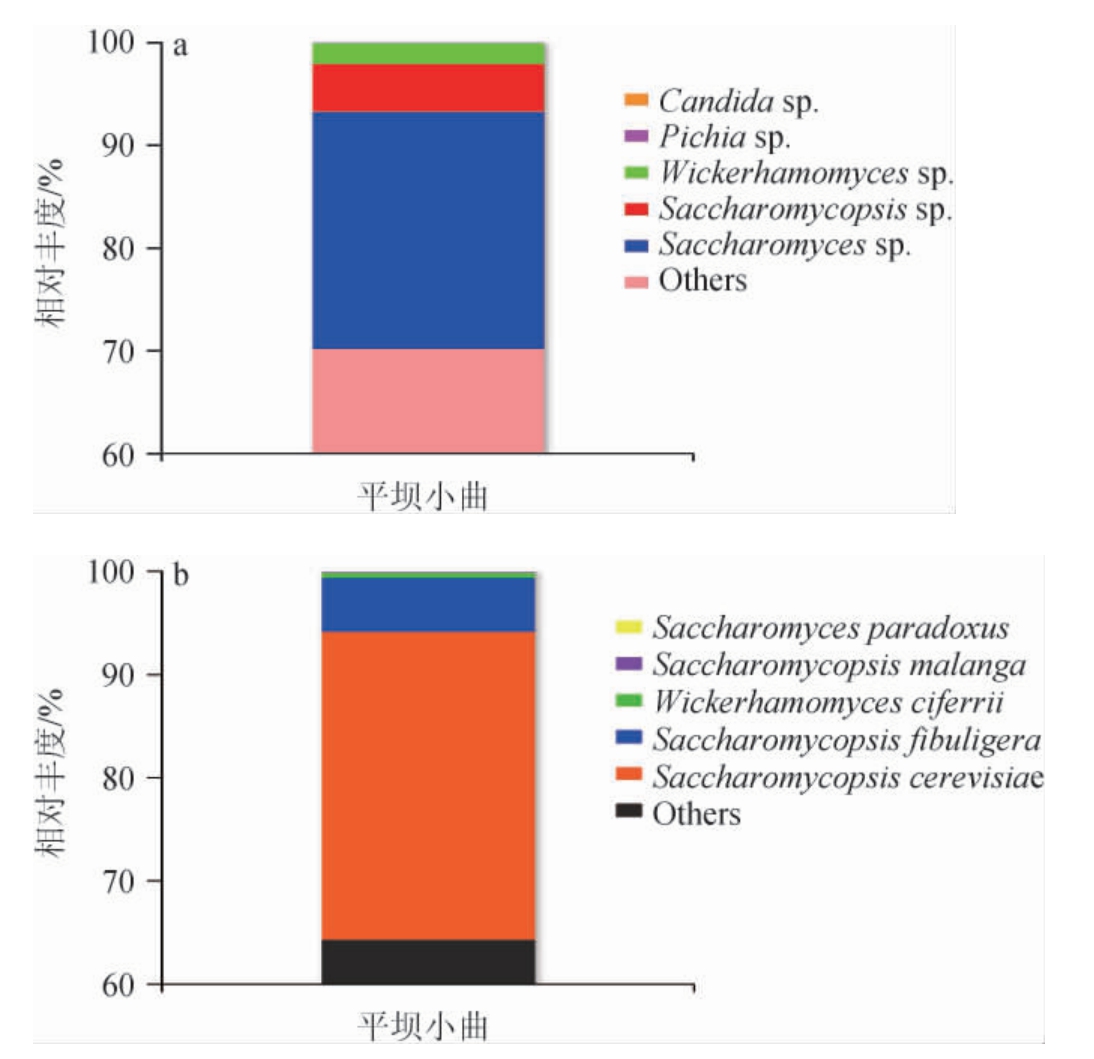
图3 基于属(a)和种(b)水平平坝窖酒小曲酵母菌菌群结构
Fig.3 Structure of yeast community of Pingba Baijiu Xiaoqu based on genus (a) and species (b) level
others:相对丰度排名5之后的酵母菌属或种。
由图3可知,在属水平上,平坝小曲中优势酵母属包括酵母属(Saccharomyces sp.)、腹膜孢酵母属(Saccharomycopsis sp.)、威克汉姆酵母属(Wickerhamomyces sp.),其相对丰度分别为23.07%、4.67%、2.05%。耿添霈等[27]从汾酒缸花中筛选出腹膜孢酵母属和威克汉姆酵母属,与清香型大曲酵母菌结构基本一致,腹膜孢酵母属和威克汉姆酵母属也是曲药中的微生物。平坝窖酒小曲微生物中不仅有小曲常见的酵母菌属,还具有腹膜孢酵母属和威克汉姆酵母属两种独特的优势酵母菌属,这种差异可能是平坝小曲的制曲工艺、原料、环境等因素造成的。
在种水平上,酿酒酵母(Saccharomyces cerevisiae)与扣囊腹膜孢酵母(Saccharomycopsis fibuligera)为平坝窖酒小曲中的特征性优势酵母菌种,相对丰度分别达到29.87%、5.14%,这与属水平上平坝小曲优势酵母的结果相对应。酿造环境中最为常见的酿酒酵母菌类群,在发酵产酒精方面具有十分突出的能力,是白酒出酒率的保证,同时还具备产生苯乙醇、乙酸乙酯等风味组分的能力[4]。郝文军等[28]的研究发现,扣囊腹膜孢酵母的代谢产物苯乙酸乙酯、乙酸苯乙酯、苯乙醛、4-乙基愈创木酚等与牛栏山二锅头白酒的重要香气成分重合。由此可推测,平坝小曲中的优势酵母扣囊腹膜孢酵母在平坝窖酒风味形成上具有一定的贡献。
3 结论
本研究采用单分子测序技术解析平坝窖酒小曲微生物组成特征。α-多样性分析结果表明,平坝窖酒小曲微生物的群落组成及结构较为复杂,平坝窖酒小曲微生物中,霉菌类群相对丰度较高,细菌类群次之,酵母菌类群相对丰度较低。在相对丰度排名前15的微生物中,平坝窖酒小曲细菌类群相对丰度最高,远高于酵母菌和霉菌。小曲中共检测到3种优势功能细菌,分别是食窦魏斯氏菌(Weissella cibaria)、融合魏斯氏菌(Weissella confusa)和蜡样芽孢杆菌(Bacillus cereus);3种优势功能霉菌,分别是米根霉(Rhizopus oryzae)、小孢根霉(Rhizopus microsporus)和横梗霉(Lichtheimia ramosa);2种优势功能酵母菌,分别为酿酒酵母(Saccharomyces cerevisiae)与扣囊腹膜酵母(Saccharomycopsis fibuligera)。白酒发酵过程中,在这些主要优势微生物及其分泌的酶类物质的作用下,原料中的淀粉、蛋白、脂肪、多糖等营养物质能够通过复杂的生理生化反应转化成酒精,同时产生有利于酒体风味形成的物质。本研究可为平坝窖酒风味形成提供一定的理论参考,而平坝窖酒风味、风格形成的机理还需进一步研究。
[1]梁敏华,赵文红,白卫东,等.白酒酒曲微生物菌群对其风味形成影响研究进展[J].中国酿造,2023,42(5):22-27.
[2]HUI W Y,HOU Q C,CAO C X,et al.Identification of microbial profile of koji using single molecule,real-time sequencing technology[J].J Food Sci,2017,82:1193-1199.
[3]王清龙,朱甜甜,刘延波,等.白酒生产不同酒曲微生物群落结构、理化指标及挥发性风味物质研究[J].中国酿造,2023,42(7):93-102.
[4]王春晓,唐佳代,吴鑫颖,等.酿酒小曲中功能微生物的研究进展[J].食品科学,2019,40(17):309-316.
[5]胡怀玲.小曲的特点以及其中主要微生物间的关系[J].酿酒,2008,25(5):52-53.
[6]唐佳代.贵州传统小曲微生物群落结构及功能酵母的筛选[D].贵阳:贵州大学,2019.
[7]刘梦,庄蕾,余忠祥,等.单分子测序技术(SMRT)在微生物研究领域中的应用[J].科技与创新,2022(14):166-170.
[8]谢丹,吴成,程平言,等.应用单分子实时测序技术解析酱香型白酒高温大曲制作过程细菌多样性[J].食品与发酵工业,2022,48(19):58-64.
[9]陈孝,温承坤,巩园园,等.酒曲的研究进展[J].中国酿造,2019,38(10):7-11.
[10]陈小琴,母应春,苏伟,等.石斛添加量对小曲微生物及风味的影响[J].中国食品学报,2022,22(12):290-302.
[11]刘建利,孙敏,曹晓虹,等.利用高通量测序技术分析民间面引子中的真菌多样性[J].食品科学,2018,39(22):186-194.
[12]LIU Z B,WANG Z Y,LV X C,et al.Comparison study of the volatile profiles and microbial communities of Wuyi Qu and Gutian Qu,two major types of traditional fermentation starters of Hong Qu glutinous rice wine[J].Food Microbiol,2018,69:105-115.
[13]王民俊.小曲米酒生产工艺(五)[J].酿酒科技,2003(5):104-106.
[14]李兵,张超,王玉霞,等.白酒大曲功能微生物与酶系研究进展[J].中国酿造,2019,38(6):7-12.
[15]肖蓓.酱香大曲中细菌类群关系研究与功能细菌筛选[D].贵阳:贵州大学,2017.
[16]李子健,黄丹,张曼,等.中高温大曲中两株耐热霉菌的分离鉴定及产酶特性比较[J].食品与发酵科技,2020,56(3):1-7.
[17]葛松涛,孙国昌,寿泉洪,等.不同工艺绍兴酒麦曲微生物菌群多样性分析[J].中国酿造,2023,42(8):140-146.
[18]王玉荣,李文鹏,蔡文超,等.基于宏基因组分箱方法揭示房县黄酒加工用小曲中微生物多样性[J].食品与发酵工业,2023,49(12):209-214.
[19]黄倩,梁安健,朱鹏程,等.魏斯氏菌胞外多糖在发酵食品中的应用进展[J].食品科学,2024,45(4):352-359.
[20]严鑫,艾连中,夏永军,等.融合魏斯氏菌安全性、益生潜力及功能特性研究进展[J].工业微生物,2022,52(6):37-48.
[21]李子健,黄丹,张曼,等.中高温大曲中两株耐热霉菌的分离鉴定及产酶特性比较[J].食品与发酵科技,2020,56(3):1-7.
[22]刘文虎,柴丽娟,张立强,等.基于宏基因组学解析不同质量等级中温大曲微生物组的异质性[J].微生物学报,2023,63(11):4383-4398.
[23]常煦,张小龙,聂文强,等.改善小曲酒出酒率和酒体品质优势根霉的筛选研究[J].酿酒科技,2021(10):120-123.
[24]钟利明,曹新志,李书源,等.横梗霉产酯化酶的纯化及酶学性质[J].现代食品科技,2021,37(6):82-88,192.
[25]莫新迎,高梅莹,韩丹,等.耐酸性α-淀粉酶产生菌筛选及培养基优化[J].中国酿造,2010,29(4):85-88.
[26]XIANG W L,XU Q,ZHANG N D, et al. Mucor indicus and Rhizopus oryzae co-culture to improve the flavor of chinese turbid rice wine[J].J Sci Food Agr,2019,99:5577-5585.
[27]耿添霈,蔚慧欣,甄攀,等.汾酒发酵室新旧土壤酵母群落结构对比研究[J].食品工程,2021(3):43-45.
[28]郝文军,刘红霞,于晓涛,等.牛栏山白酒酿造过程中扣囊复膜酵母的分离与产物分析[J].酿酒科技,2019(2):49-52.