大曲是大曲酒酿造中的糖化发酵剂,其中含有多种微生物菌系和各种酿酒酶系[1]。酱香型白酒高温大曲在制曲时需要高温培曲40 d左右,再经过长时间的曲仓贮曲,才算完成[2],此过程称为贮曲,过程中会淘汰大量生酸杂菌,从而有利于酿出高品质酒,也因此,新曲不能立即使用,酿酒时必须用陈曲[3]。当然,曲并不是越陈越好,贮曲时间过长,其中的酵母及各类酶活性也会随之降低,从而不利于发酵[3]。酱香型白酒高温大曲在不同贮曲时间的品质各不相同,理化性质是评价质量的重要维度[4]。如大曲的水分小于11%,酸度在1.5~2.0 mmol/10 g之间,糖化力在150~250 U之间被认为是优质的酱香型白酒高温大曲[5]。
近年来,对于酱香型白酒高温大曲的研究多集中在制曲过程和不同产地、不同品种成品曲中风味、微生物以及理化性质的研究。李尧等[6]研究了不同月份生产的凤香型大曲的理化指标,发现大曲水分、酸度、糖化力、液化力、发酵力受季节影响较强,淀粉与季节的相关性较小。潘天全等[7]对酵母强化大曲与普通大曲的微生物与挥发性风味特征进行了分析对比,结果表明强化大曲与普通大曲在微生物群落结构上有明显差异;强化大曲所含风味物质的种类及酯类、醛酮类等风味化合物含量高于普通大曲,使其曲香更加浓郁。对于高温大曲生产过程的研究主要集中于制曲过程理化性质变化规律和微生物演替规律方面。吴玉轩等[8]对高温大曲的各项理化生化指标变化规律及细菌(denatured gradient gel electrophoresis,DGGE)指纹图谱进行综合分析,揭示了在高温制曲及贮存进程中,各项理化生化指标的变化规律及细菌种类具有多样性及相似性;袁华伟等[9]对高温大曲制曲周期内8种主要水解酶系酶活力及其理化性质进行了测定,发现随着制曲时间的延长,高温大曲液化酶、糖化酶、纤维素酶、半纤维素酶、酸性蛋白酶、中性蛋白酶的酶活力以及发酵力、酯化力整体呈现先上升后下降再上升的趋势。对贮曲过程的研究集中于理化性质的分析,李俊丽等[10]研究发现,长时间的贮曲可以使成品曲的理化性能更趋于稳定,实现优质高产。然而,目前贮曲过程微生物的演替规律及对酱香型白酒高温大曲理化性质的影响研究还鲜有报道,有必要对其进行研究。
本研究以在不同贮曲时间的酱香型白酒高温大曲为研究对象,对其理化性质和微生物演替规律进行分析,以剖析其在贮曲过程中的品质变化。进一步采用统计学方法建立大曲理化性质与微生物之间的关联性,以研究引起酱香型白酒高温大曲品质变化的潜在微生物及其机制。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
酱香型白酒高温大曲样品(贮曲时间分别为0 d、30 d、60 d、90 d、120 d、150 d和180 d):由贵州钓鱼台国宾酒业有限公司提供。
1.1.2 试剂
氢氧化钠(分析纯):天津市大茂化学试剂厂;盐酸(色谱纯)、冰乙酸、碘化钾(均为分析纯):北京化工厂有限责任公司;无水葡萄糖、硫酸铜(均为分析纯):天津市兴复科技发展有限公司;正己酸(分析纯):上海麦克林生化科技有限公司;四水合酒石酸钾钠(分析纯):国药集团化学试剂有限公司;无水乙酸钠(分析纯):西陇科学股份有限公司;无水乙醇(分析纯):天津市致远化学试剂有限公司;可溶性淀粉:福晨(天津)化学试剂有限公司;次甲基蓝(分析纯):北京化学试剂公司。
1.2 仪器与设备
BSA224S电子分析天平:德国Sartorius公司;Gen Pure UV/UF超纯水系统:美国Thermo Fisher Scientific公司;DK-98-Ⅱ电热恒温水浴锅:天津市泰斯特仪器有限公司;LRH-250生化培养箱:上海一恒科技有限公司;PHS-3C pH计:上海仪电科学仪器股份公司;密封式粉碎机:山东千司科学仪器有限公司。
1.3 方法
1.3.1 取样方法
以不同贮曲时间的酱香型白酒高温大曲为取样对象,于贮曲0 d、30 d、60 d、90 d、120 d、150 d和180 d分别进行取样。选取曲房的五个位置,每个位置取3块曲砖,分别为上层曲砖、中层曲砖和下层曲砖,五个位置共15块曲砖,经粉碎,混匀,过筛,取500 g备用。
1.3.2 理化性质测定
酱香型白酒高温大曲的水分、酸度、淀粉含量、糖化力、液化力和发酵力依据中华人民共和国轻工行业标准QB/T 4257—2011《酿酒大曲通用分析方法》[11]进行测定。
1.3.3 基因组测序
样品前处理:取贮曲0 d、30 d、60 d、90 d、120 d、150 d和180 d的酱香型白酒高温大曲共7个样品,分别称取10 g左右样品,使用破壁粉碎机对样品进行均质化、微粒化处理。
基因组DNA的提取和PCR扩增:将样品用干冰寄送至苏州百趣生物科技有限公司,执行测序工作,采用十六烷基三乙基溴化铵(cetyltriethylammonium bromide,CTAB)与十二烷基磺酸钠(sodium dodecyl sulfonate,SDS)方法对样品的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)进行提取,之后使用琼脂糖凝胶电泳检测提取出的DNA纯度和浓度;随后取适量DNA于离心管中,并用无菌水稀释至1 ng/μL。
以稀释后的基因组DNA为模板,根据扩增区域选择使用带barcode的特异性引物、New England Biolabs公司的Phusion® High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行聚合酶链式反应(polymerase chain reaction,PCR),以确保扩增效率和准确性。对细菌16S rRNA基因的V3-V4高变区进行扩增,所使用的通用引物包括正向引物341F(5-CCTAYGGGRBGCASCAG-3)和反向物806R(5-GGACTACHVGGGTWTCTAAT-3)[12]。对真菌ITS基因的ITS1-1F进行扩增,所使用的通用引物包括正向引物ITS1-1F-F(CTTGGTCATTTAGAGGAAGTAA)和反向物ITS1-1F-R(GCTGCGTTCTTCATCGATGC)。PCR扩增体系:5×Trans Start Fast Pfu缓冲液4 μL,2.5 mmol/L脱氧核糖核苷三磷酸(deoxyribonucleoside triphosphates,d NTPs)2 μL,上游引物(5 μmol/L)0.8 μL,下游引物(5 μmol/L)0.8 μL,Trans Start Fast Pfu DNA聚合酶0.4 μL,模板DNA 10 ng,双蒸水(dd H2O)补足至20 μL。PCR扩增程序:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,细菌72 ℃延伸30 s,真菌72 ℃延伸45 s),然后72 ℃稳定延伸10 min,在4 ℃进行保存。
PCR产物用2%的琼脂糖凝胶电泳进行检测,并根据PCR产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳再次进行检测,对目的条带使用Qiagen公司提供的胶回收试剂盒进行回收。使用NEBNext® UltraTM IIDNA Library Prep Kit建库试剂盒进行文库构建,将构建好的文库进行Qubit和Q-PCR定量;待文库合格后,使用NovaSeq6000进行上机测序。
1.3.4 数据处理与分析
使用Office2016进行数据处理和分析,使用Origin 2018、office2016进行作图。对于菌落微生态的数据使用Metastats软件(http://metastats.cbcb.umd.edu/)对组间的物种丰度数据进行假设检验,筛选具有显著性差异的物种。典范对应分析(canonical correspondence analysis,CCA)与权重网络分析使用基迪奥生信云工具进行(https://www.omicshare.com/tools/)。
2 结果与分析
2.1 大曲理化性质
对酱香型白酒高温大曲理化性质变化进行分析,结果见图1。
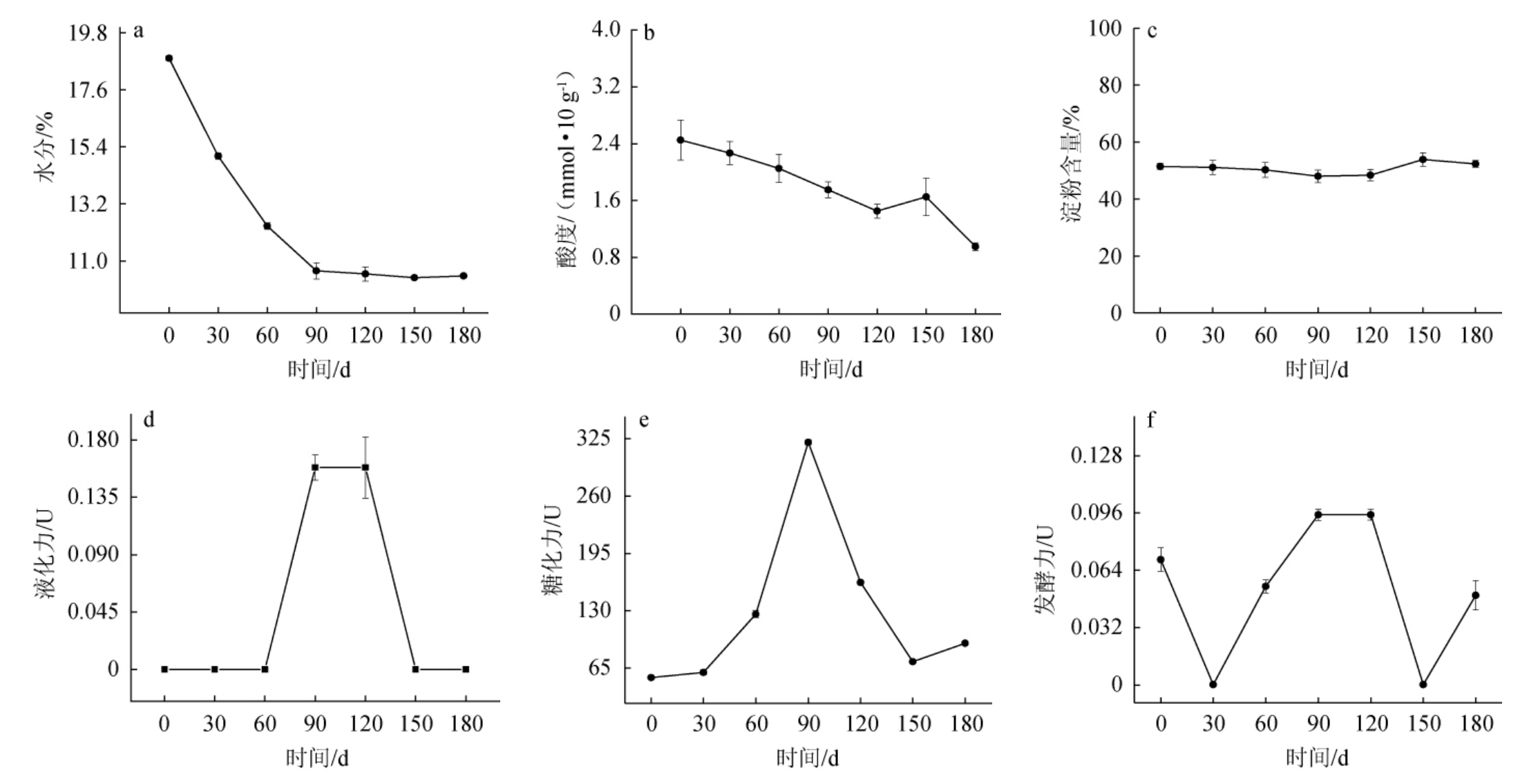
图1 酱香型白酒高温大曲贮存过程中理化性质的变化
Fig.1 Changes of physicochemical properties of high temperature Daqu in sauce-flavor Baijiu during storage process
由图1可知,不同贮曲时间酱香型白酒高温大曲的理化性质呈现不同的变化趋势。由图1a可知,水分含量呈现下降趋势,先由出仓时的18.8%逐渐下降至贮存90 d的10.6%,再保持稳定。这是由于贮曲过程中由于所处环境干燥通风,水分会逐渐下降[13],在贮曲90 d后保持稳定。由图1b可知,贮曲0~120 d时酸度呈下降的趋势,120~150 d时酸度上升,之后继续降低。原因可能与酱香型白酒高温大曲中产酸微生物的下降有关,如格氏乳球菌等[13-14],贮曲120~150 d时酸度的少量上升的原因可能与部分酵母菌裂解后呈酸性有关[15]。由图1c可知,不同贮曲时间的酱香型白酒高温大曲中淀粉含量随贮曲时间的变化不明显,保持在45%~55%之间,原因能与大曲品温高,酵母菌较少,导致缺少液化酶等水解酶系,使淀粉利用度低有关[9]。由图1d可知,除在贮曲90~120 d的液化力为0.158 5 U,其余贮曲时间未检测到液化力,对比中高温大曲与清香型大曲,酱香型白酒高温大曲贮曲过程温度较高且水分含量更低,因此液化力较低的原因可能与制曲时的高温和贮曲时的低水分有关[16]。由图1e可知,糖化力随着时间的增加先增加后降低,在贮曲0~90 d时,糖化能力逐渐增强,这与其中微生物含量、种类及活性有关[17]。由图1f可知,发酵力的变化呈现出波动变化的趋势。在贮曲30 d和150 d,未检测到发酵力,可能与其中菌群结构的演替有关,并需要对此进行深入研究。
根据优质高温大曲的理化性质范围,即大曲的水分<11%,酸度在1.5~2 mmol/10 g之间,糖化力在150~250 U之间[5],在贮曲90~150 d时,酱香型白酒高温大曲水分、酸度与糖化力均达到了优质高温大曲的指标范围。因此,贮曲90~150 d的酱香型白酒高温大曲适合使用。
2.2 大曲中微生物群落结构多样性
2.2.1 贮曲过程α-多样性分析
采用高通量测序技术对不同酱香型白酒高温大曲中的细菌、真菌进行分析。采用Chao1指数、Shannon指数、Simpson指数等对不同贮曲时间酱香型白酒高温大曲中微生物的α-多样性进行表征与分析,细菌α-多样性分析结果见表1,真菌α-多样性分析结果见表2。
表1 高温大曲贮存过程中细菌α-多样性分析
Table 1 Bacterial α-diversity analysis of high temperature Daqu during storage process
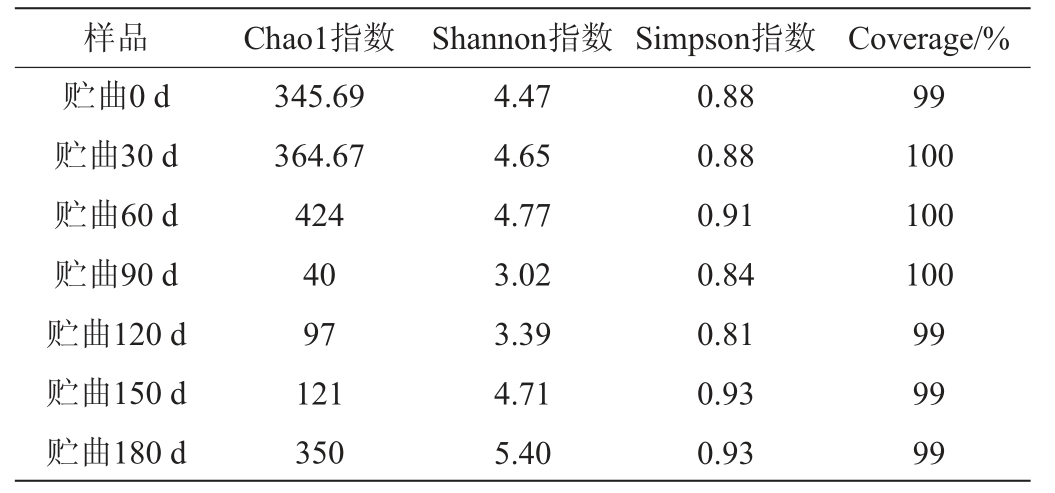
样品 Chao1指数 Shannon指数 Simpson指数 Coverage/%贮曲0 d贮曲30 d贮曲60 d贮曲90 d贮曲120 d贮曲150 d贮曲180 d 345.69 364.67 424 40 97 121 350 4.47 4.65 4.77 3.02 3.39 4.71 5.40 0.88 0.88 0.91 0.84 0.81 0.93 0.93 99 100 100 100 99 99 99
表2 高温大曲贮存过程中真菌α-多样性分析
Table 2 Fungal alpha-diversity analysis of high temperature Daqu during storage process
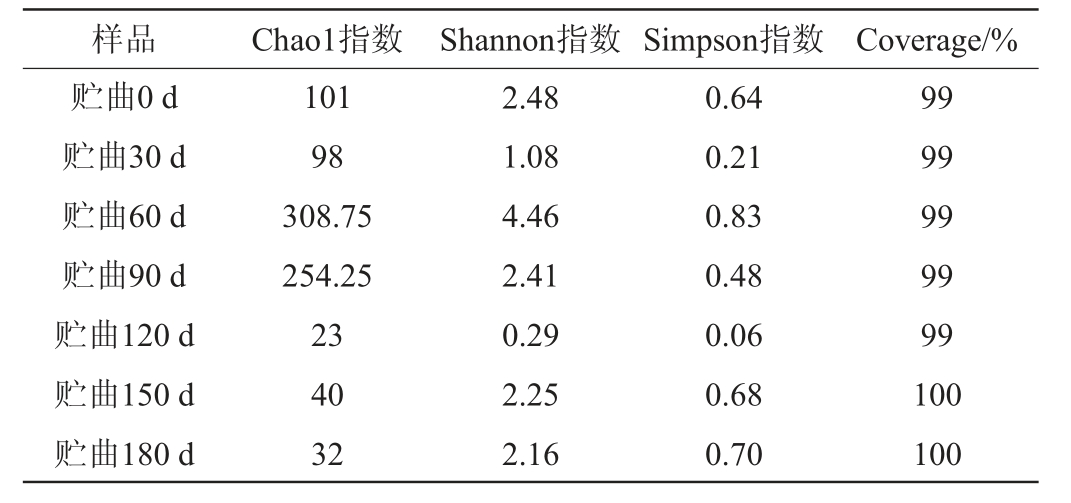
样品 Chao1指数 Shannon指数 Simpson指数 Coverage/%贮曲0 d贮曲30 d贮曲60 d贮曲90 d贮曲120 d贮曲150 d贮曲180 d 101 98 308.75 254.25 23 40 32 2.48 1.08 4.46 2.41 0.29 2.25 2.16 0.64 0.21 0.83 0.48 0.06 0.68 0.70 99 99 99 99 99 100 100
由表1可知,不同样品的细菌Coverage指数均在99%以上,测序结果能够真实地反映其中的整体细菌群落结构。随着贮曲时间延长,细菌Chao1指数呈现先降低后升高的趋势,说明细菌总数随贮曲时间的延长先减少后增多。随着贮曲时间的延长,Shannon指数呈先降低后升高的趋势,而Simpson指数先升高后降低的趋势,二者的结果均表明,不同贮曲时间的酱香型白酒高温大曲的细菌群落多样性呈现先降低后增加的趋势。Simpson指数变化程度与Shannon指数相比较为平缓,说明细菌属在不同贮曲时间的酱香型白酒高温大曲中丰富度较为接近但含量相差较大。这些趋势的原因可能为贮曲过程中酱香型白酒高温大曲中的细菌完成了富集的过程,富集的过程主要体现在不同细菌属数量的变化上。其中,根据Chao1指数可知,贮曲90~150 d的酱香型白酒高温大曲细菌总数较低,原因可能为通过贮曲过程的富集,优化了菌群结构,使其中的微生物更有利于高温大曲的发酵。
由表2可知,与细菌属不同,随着贮曲时间延长,真菌属的Chao1指数呈现先升高后降低的趋势,说明真菌总数随贮曲时间的延长先增多后减少。随着贮曲时间的延长,Shannon指数呈先降低后升高再降低的趋势,而Simpson指数的趋势与之相同,二者的结果均表明,不同贮曲时间的酱香型白酒高温大曲的真菌群落多样性呈现先降低后升高再降低的趋势。Simpson指数变化程度与Shannon指数变化趋势与程度相一致,说明真菌属在不同贮曲时间的酱香型白酒高温大曲中丰富度与数量的变化规律较为一致。其中,Chao1、Shannon与Simpson指数表明贮曲90~150 d的酱香型白酒高温大曲真菌丰富度较低,可能的原因与细菌相同。
2.2.2 微生物菌群结构分析
对不同贮曲时间的大曲优势菌属及其变化规律进行分析,结果见图2。
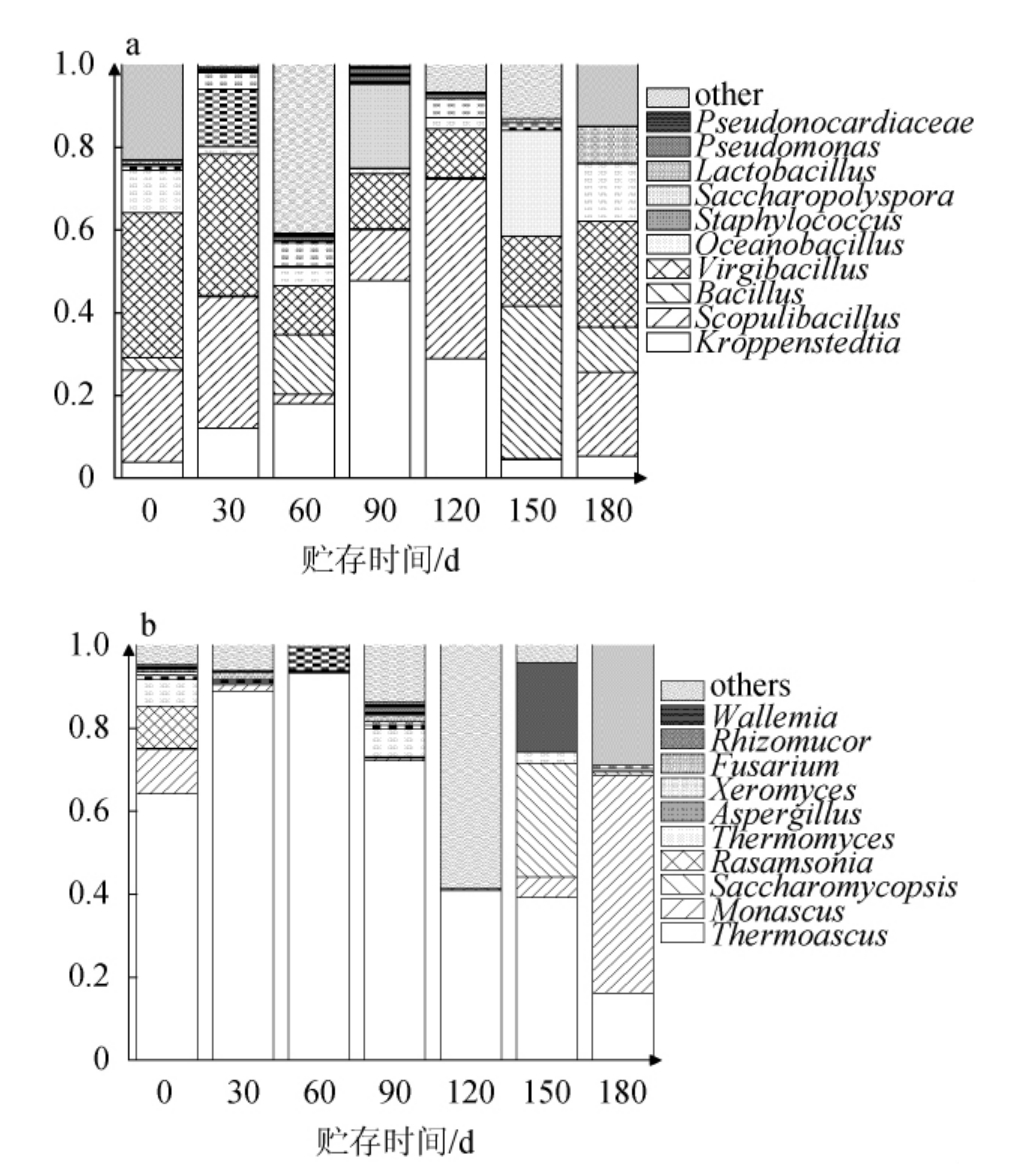
图2 酱香型白酒高温大曲贮存过程中细菌(a)和真菌(b)群落结构变化
Fig.2 Changes of bacterial (a) and fungal (b) community structure of high temperature Daqu in sauce-flavor Baijiu during storage process
由图2a可知,在细菌属水平上,泛酸枝芽孢杆菌属(Virgibacillus)与克罗彭斯特菌属(Kroppenstedtia)是其中的优势菌。泛酸枝芽孢杆菌属在整个贮曲过程中保持较高的丰度,在不同贮曲时间相对丰度均保持在10%以上,最高于贮曲0 d达到35%;但在贮曲60~150 d有较大的下降幅度,于贮曲60 d下降至11%。泛酸枝芽孢杆菌属可以分泌多种酶类,在制曲过程中有助于淀粉的转化。与之相反,克罗彭斯特菌属在贮曲30~120 d含量相对较高,贮曲90 d时可达47.81%。克罗彭斯特菌属的生化特性比较多样化,可以利用多种不同的碳源进行代谢,其含量的增加可以提高不同种类碳源的利用率。克罗彭斯特菌属细菌可以通过代谢产生酸和气体[18]。由图2b可知,嗜热子囊菌属(Thermoascus)是真菌中的优势菌属,但在贮曲60 d后的大曲中占比逐渐较少。嗜热子囊菌属可以分泌多种热稳定酶,如纤维素酶、木聚糖酶、半乳糖酶等[18]。这些酶能够在高温环境下保持较高的催化活性,为之后的高温堆积过程提供发酵动力。贮曲150 d后,优势菌属发生变化,由耐高温的嗜热子囊菌属转变为具有优良发酵性能的曲霉属(Aspergillus)、复膜孢酵母属(Saccharomycopsis)与红曲霉属(Monascus),这可能与大曲品温的下降有关。
由图2亦可知,在贮曲过程中,细菌中,克罗彭斯特菌属(Kroppenstedtia)、糖多孢菌属(Saccharopolyspora)、假诺卡氏菌属(Pseudonocardiaceae)在90 d相对丰度最大;海洋芽孢杆菌属(Oceanobacillus)、芽孢杆菌属(Bacillus)在150 d相对丰度达到最大;假单胞菌属(Pseudomonas)在60 d相对丰度最大。大曲岩石芽孢杆菌(Scopulibacillus)在150 d相对丰度最小;泛酸枝芽孢杆菌属、乳杆菌属(Lactobacillus)在60~120 d相对丰度最小。真菌中,复膜酵母菌属、曲霉属在150 d相对丰度最大;根毛霉属(Rhizomucor)、镰刀菌属(Fusarium)在60 d相对丰度最大。嗜热子囊菌属在150 d相对丰度最小;罗萨氏菌属(Rasamsonia)、红曲霉属在60~120 d相对丰度最小。担菌属(Wallemia)、耐干霉菌属(Xeromyces)、嗜热真菌属(Thermomyces)分别在0 d与90 d相对丰度最大。
贮曲90~150 d的酱香型白酒高温大曲中优势细菌属多为革兰氏阳性菌,具有高耐热性、高代谢活性以及厌氧生长特性[19-20],而像优势真菌属中的复膜酵母菌属、曲霉属、嗜热子囊菌属、红曲霉属等具有抗干旱、抗酸性环境与优良的发酵能力[21],这体现了环境对微生物的筛选作用。因此,贮曲过程中微生物菌群结构会发生改变,这可能会影响酱香型白酒高温大曲理化性质,并最终影响大曲品质。
2.3 微生物与理化性质关联性解析
采用典范对应分析(CCA)方法分析不同贮曲时间酱香型白酒高温大曲的理化性质与微生物之间的关联性,结果见图3。由图3可知,发酵力、糖化力、液化力与酸度共处于第四象限,四种理化性质在第一个变量呈负相关,第二个变量呈正相关,且酸度、液化力与糖化力夹角较小,表明三者相关性较强。同时在理化性质中,液化力、糖化力与发酵力对不同贮曲时间的酱香型白酒高温大曲的分布影响最大。贮曲90~120 d的酱香型白酒高温大曲受发酵力、液化力、糖化力与酸度的影响较大,其中贮曲120 d的酱香型白酒高温大曲的特点主要体现在其糖化力、液化力与发酵力上。发酵力、糖化力和液化力受微生物影响较大,糖化力和液化力与葡萄球菌属、镰刀菌属、克罗彭斯特菌属、节担菌属、假诺卡氏菌属、糖多孢菌属关联性较强,其中镰刀菌属和糖多孢菌属具有分解和利用复杂碳水化合物的能力,可以将淀粉、纤维素等多糖类物质分解为可利用的糖类[22]。发酵力与嗜热子囊菌属关联性较强,其对发酵力的影响可能与其产热稳定酶并将复杂有机物质转化为可发酵的糖分有关[23]。贮曲150 d的酱香型白酒高温大曲品质受理化性质影响较小,与曲霉属和复膜孢酵母属的联系较为密切。
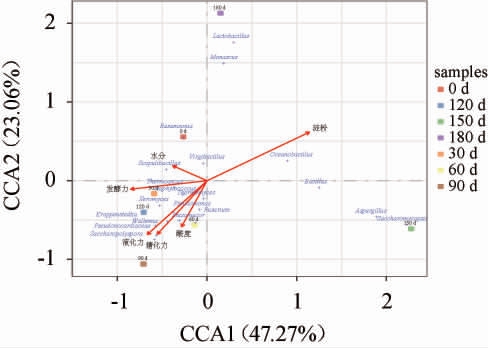
图3 酱香型白酒高温大曲贮存过程中理化性质与微生物典范对应分析
Fig.3 Canonical correspondence analysis of physicochemical properties and microorganisms of high temperature Daqu in sauce-flavor Baijiu during storage process
此外,有多种微生物对贮曲90~120 d的酱香型白酒高温大曲品质贡献具有潜力,包括嗜热子囊菌属、葡萄球菌属、嗜热真菌属、耐干霉菌属、假单胞菌属、克罗彭斯特菌属、镰刀菌属、根毛霉属、节担菌属、假诺卡氏菌属和糖多孢菌属[24-25]。
使用基迪奥生信云平台进行权重网络分析,连线粗细代表相关性强弱,结果见图4。由图4可知,与理化性质相关性较强的微生物中,泛酸枝芽孢杆菌属、罗萨氏菌属与水分相关性较强,克罗彭斯特菌属、芽孢杆菌属、海洋芽孢杆菌属、复膜酵母菌属、假诺卡氏菌属、嗜热真菌属与淀粉相关性较强,节担菌属、假诺卡氏菌属、复膜酵母菌属、克罗彭斯特菌属与糖化力相关性较强,克罗彭斯特菌属、假诺卡氏菌属与液化力相关性较强。其中,假诺卡氏菌属与淀粉、糖化力、液化力均有较强相关性,因此,假诺卡氏菌属(Pseudonocardia)可能是影响酱香型白酒高温大曲品质的关键微生物。
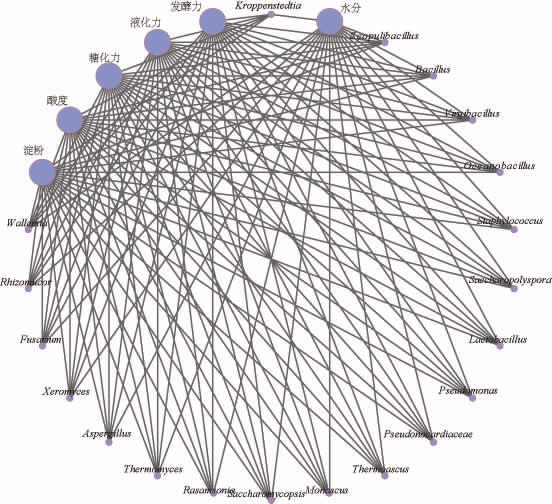
图4 酱香型白酒高温大曲理化性质与微生物权重网络分析
Fig.4 Weight network analysis of physicochemical properties and microorganisms of high temperature Daqu in sauce-flavor Baijiu
3 结论
该研究对酱香型白酒高温大曲不同贮曲时间的理化指标与微生物演替规律进行研究。理化性质分析显示,贮曲过程中淀粉保持稳定,水分、酸度呈下降趋势,液化力、糖化力和发酵力则呈先升高后降低的趋势。贮曲90~150 d的高温大曲各理化性质达到优质的指标范围,适于使用。微生物多样性及演替规律显示,细菌菌群数量呈现先降低后升高的趋势,其中泛酸枝芽孢杆菌属(Virgibacillus)与克罗彭斯特菌属(Kroppenstedtia)为优势细菌属,其在贮曲过程中的相对丰度分别呈现先降低后升高和先升高后降低的变化趋势;真菌菌群多样性呈现先降低后升高再降低的过程,其中嗜热子囊菌属为优势真菌属,相对丰度呈现先升高后降低的变化趋势。从微生物与理化性质间的典范对应分析可以看出,葡萄球菌属、镰刀菌属、克罗彭斯特菌属、节担菌属、假诺卡氏菌属、糖多孢菌属和嗜热子囊菌属可能对理化性质产生重要影响,其中假诺卡氏菌属(Pseudonocardia)可能是影响酱香型白酒高温大曲品质的关键微生物。
[1]陈珊,汤有宏,李兰.不同硬度指数小麦制曲对高温大曲质量的影响研究[J].酿酒,2023,50(4):47-49.
[2]WANG Y R,CAI W C,WANG W P,et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Sci Nutr,2021,9(2):1003-1016.
[3]张健,范奇高,陆伦维,等.浅析酱香型白酒发展现状及趋势思考[J].中国酿造,2022,41(4):234-238.
[4]郭世鑫,姚孟琦,马文瑞,等.酱香型白酒的研究现状[J].中国酿造,2021,40(11):1-6.
[5]沈毅,陈波,张亚东,等.影响高温大曲质量的关键控制点[J].酿酒科技,2019(8):17-21.
[6]李尧,闫宗科,张永利.季节变化对凤型大曲理化指标的影响[J].酿酒,2021,48(6):71-75.
[7]潘天全,关玉权,陈兴杰,等.安琪生香活性干酵母对浓香型强化大曲微生物群落结构及其挥发性风味组分的影响[J].酿酒科技,2022(11):51-60.
[8]吴玉轩,王文洁,张梦梦,等.芝麻香型高温大曲制曲过程中理化生化与细菌DGGE指纹图谱的探究[J].酿酒,2024,51(1):63-67.
[9]袁华伟,赵余,王玉婷,等.高温大曲制曲过程中水解酶系及理化性质的动态变化研究[J].酿酒,2023,50(4):31-36.
[10]李俊丽,相里加雄,王奋明,等.汾酒大曲贮曲期间理化性能的探讨[J].酿酒,2015,42(5):14-18.
[11]中华人民共和国工业和信息化部.QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国轻工业出版社,2011.
[12]WHITE J R, NAGARAJAN N, POP M.Statistical methods for detecting differentially abundant features in clinical metagenomic samples[J].PLoS Comput Biol,2009,5(4):e1000352.
[13]蒋英丽,聂宏芳,邓皖玉,等.酱香高温大曲贮存期质量变化规律的分析研究[J].酿酒科技,2022(2):61-64,68.
[14]吴正坤,缪礼鸿,张明春,等.不同贮存期高温大曲中乳酸菌的多样性及其耐受性分析[J].中国酿造,2018,37(6):61-67.
[15]刘国玉.酿酒酵母细胞静止期退出的调控机理研究[D].无锡:江南大学,2023.
[16]卢中明,张祥,叶光斌.不同生产月份中高温成品大曲理化指标、挥发性风味物质分析[J/OL].食品与发酵工业,1-10[2024-09-13].https://doi.org/10.13995/j.cnki.11-1802/ts.037741.
[17]汪彩莉,程险峰,李晓环,等.高温大曲贮存过程中部分理化指标与微生物群落演替变化规律研究[J].酿酒科技,2023(2):19-22,28.
[18]刘文虎,柴丽娟,张立强,等.基于宏基因组学解析不同质量等级中温大曲微生物组的异质性[J].微生物学报,2023,63(11):4383-4398.
[19]周泉,湛佳佳,李璧,等.一株同步糖化发酵纤维素产乙醇的尖孢镰刀菌的筛选[J].食品安全导刊,2022(35):149-154.
[20]靳汝霖.具有优良发酵特性嗜热链球菌的筛选及其发酵乳中关键性风味物质的研究[D].呼和浩特:内蒙古农业大学,2018.
[21]刘素娟.陈皮陈化过程“环境因子—真菌—药效物质基础”相关性研究[D].成都:成都中医药大学,2018.
[22]杨埔,蔚慧欣,张鑫,等.环境胁迫对清香型白酒发酵核心微生物生长的影响[J].酿酒科技,2021(12):22-26.
[23]黄静.保宁醋“中药醋曲”发酵过程中微生物菌群与理化性质动态解析[D].雅安:四川农业大学,2020.
[24]刘丹彤.基于宏基因组测序揭示山西老陈醋菌群功能[D].晋中:山西农业大学,2021.
[25]CHEN S,NIU H,WU Y,et al.Influence of lactic acid on cell cycle progressions in Lactobacillus bulgaricus during batch culture[J].Appl Biochem Biotechnol,2021,193(3):912-924.