在酱香型白酒酿造过程中,酒醅蕴含大量的发酵微生物,对白酒独特风味的产生发挥着关键性作用[1]。酱香型白酒酿造的重要功能菌主要包括芽孢杆菌(Bacillus)、乳球菌属(Lactococcus)、梭形杆菌属(Fusobacterium)、醋酸杆菌属(Acetobacter)、假丝酵母属(Candida)以及曲霉属(Aspergillus)[2],其中芽孢杆菌对酱香型白酒酿造具有重要的作用[3-4]。这类细菌中多数具有产蛋白酶、淀粉酶等活性,有利于发酵原料中蛋白质和淀粉的分解[5-8]。
酒醅中芽孢杆菌对白酒风味的影响较大[9-12],其中,蜡样芽孢杆菌(Bacillus cereus)、泛酸枝芽孢杆菌(Virgibacillus pantothenticus)、巨大芽孢杆菌(Bacillus megaterium)、枯草芽孢杆菌(Bacillus subtilis)和地衣芽孢杆菌(Bacillus licheniformis)是酱香型白酒主要的产香菌株[13]。有研究显示,源于浓酱兼香型酒醅中的枯草芽孢杆菌和地衣芽孢杆菌产碱性蛋白酶活性分别为241.69 U/mL和163.82 U/mL,均能产生典型的酱香风味[14];源于浓香型酒醅的枯草芽孢杆菌呈现出较高的产纤维素酶的能力[15];筛选自高温大曲中的产香枯草芽孢杆菌能使酱香型白酒堆积发酵酒醅中四甲基吡嗪的相对含量增加和高级醇含量降低,提高酒体感官质量[16]。目前,酒醅微生物研究主要集中在芽孢杆菌的分离、鉴定、发酵性能或者功能性芽孢杆菌的筛选[17-18],然而,芽孢杆菌的产酶特性关系到菌的发酵性能,鲜有文献报道酒醅中芽孢杆菌的产酶特性。
本研究采用平板划线法分离纯化酱香型白酒酒醅中的芽孢杆菌,通过形态学观察、生理生化实验和16S rDNA序列分析对分离菌株进行鉴定,通过平板透明圈法和分光光度计法分析分离菌株的产蛋白酶、淀粉酶和纤维素酶能力,并筛选出产酶性能优良的芽孢杆菌,以期为产酶能力强的芽孢杆菌在酿酒中应用和提升酱香型白酒品质提供参考依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
酱香型白酒酒醅样品采集自贵州省仁怀市茅台镇A酒厂(窖内上层、下层酒醅、堆积酒醅)和B酒厂(自窖内上层、中层、下层酒醅),共6个样品,每个样品被分装为每袋100 g,并置于-20 ℃冰箱中存放备用。
1.1.2 试剂
番红O、3,5-二硝基水杨酸(3,5-dinitrosalicylicacid,DNS)(均为分析纯):上海源叶生物科技有限公司;卢戈氏碘液:海博生物技术有限公司;乳糖、制霉菌素、溴化乙锭、丙烯酰胺、苯酚、Folin-酚试剂(均为分析纯):上海沃凯化学试剂有限公司;柠檬酸、尿素、四水合酒石酸钾钠、羧甲基纤维素钠(均为分析纯):美国sigma-aldrich公司;三羟甲基氨基甲烷-乙二胺四乙酸(tris-ethylene diamine tetraacetic acid,TE)缓冲液(pH=8.0):阿法埃莎(中国)化学有限公司;玉米粉、黄豆粉、麸皮:地方农贸市场。其他试剂均为国产分析纯或生化试剂。
1.1.3 培养基[19-21]
营养琼脂培养基:蛋白胨1.0%,氯化钠0.5%,牛肉浸膏0.3%,琼脂2.0%,pH 7.0~7.2。营养肉汤培养基:营养琼脂培养基中不添加琼脂。
牛肉膏蛋白胨固体培养基:牛肉膏0.3%,蛋白胨1.0%;氯化钠0.5%,琼脂2.0%,pH 7.0~7.2。牛肉膏蛋白胨液体培养基:牛肉膏蛋白胨固体培养基中不添加琼脂。
种子培养基1:葡萄糖1.0%,牛肉浸膏0.5%,蛋白胨0.5%,氯化钠1.0%,磷酸二氢钾0.2%,硫酸镁0.02%,pH 7.0~7.2。
种子培养基2:葡萄糖1.0%,蛋白胨0.5%,酵母浸膏1.0%,磷酸二氢钾0.2%,氯化钠0.5%。
种子培养基3:牛肉浸膏0.5%,蛋白胨1.0%,氯化钠0.5%,可溶性淀粉0.5%,葡萄糖0.5%,pH 7.0。
产纤维素酶鉴别培养基:羧甲基纤维素钠1.0%,酵母浸膏0.5%,蛋白胨0.5%,氯化钠1.0%,磷酸二氢钾0.15%。
产蛋白酶鉴别培养基:干酪素1.0%,蛋白胨0.5%,牛肉浸膏0.5%,葡萄糖0.5%,氯化钠0.5%,琼脂2.0%。
产淀粉酶鉴别培养基:可溶性淀粉1.0%,蛋白陈0.5%,葡萄糖0.5%,牛肉浸膏0.5%,琼脂2.0%,氯化钠0.5%。
发酵培养基1:玉米粉3.0%,麸皮3.0%,牛肉浸膏0.5%,蛋白胨0.5%,葡萄糖0.5%,氯化钠0.5%,磷酸二氢钾0.2%,硫酸镁0.02%,pH 9.5。
发酵培养基2:玉米粉2.0%,黄豆粉3.0%,蛋白胨0.5%,磷酸二氢钾0.2%,磷酸氢二钾0.2%,硫酸镁0.02%,葡萄糖0.5%,氯化钠0.5%,pH 8.0。
发酵培养基3:玉米粉3.0%,黄豆粉2.0%,硫酸镁0.02%,氯化钠0.5%,柠檬酸三钠0.2%,磷酸二氢钾0.2%,pH 7.0。
以上培养基均在121 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
TG328A型分析天平:上海菁海仪器有限公司;JY1002型电子天平:上海蒲春计量仪器有限公司;HPX-9082MBE型数显电热培养箱:上海博讯实业有限公司医疗设备厂;HW-80A漩涡混合机、XW-80A涡旋混合器:江苏海门市麒麟医用仪器厂;L5紫外可见分光光度计:上海晶科仪器有限公司;LDZX-50KBS型立式压力蒸汽灭菌锅:上海申安医疗机械厂;DHG-R40A型热风恒温鼓风干燥箱:上海实验仪器总厂;SHP-250型智能恒温培养箱:上海光都仪器设备有限公司;TS-100C恒温摇床:上海天呈实验仪器制造有限公司;Micro 17R微量高速冷冻离心机:美国Thermo Electron公司。
1.3 方法
1.3.1 酒醅中芽孢杆菌的分离与纯化
洁净环境下称取10 g酒醅溶解于90 mL无菌生理盐水,4 ℃、180 r/min振荡30 min,再转入85 ℃恒温水浴锅中恒温10 min,边加热边摇晃。按10倍系列梯度稀释至10-6,吸取10-2~10-6梯度稀释液100 μL均匀涂布于含200 mg/L制霉菌素的牛肉膏蛋白胨固体培养基,于37 ℃生化培养箱倒置培养36~48 h。挑取数量多且形态特征明显的单菌落划线于牛肉膏蛋白胨固体培养基,反复划线纯化至菌落一致。
挑取单菌落于牛肉膏蛋白胨液体培养基中,37 ℃、180 r/min条件下培养12 h,并与40%甘油等体积混合,保存于-20 ℃冰箱,备用。同时划线于牛肉膏蛋白胨固体培养基斜面,37 ℃培养24 h至长出菌落,4 ℃冰箱保藏,备用。
1.3.2 芽孢杆菌的鉴定
形态特征观察:将已纯化的菌株划线于牛肉膏蛋白胨固体培养基,37 ℃条件下培养24 h,观察并记录菌株的菌落形态。挑取菌株的菌落进行革兰氏染色,并在显微镜下观察菌株的菌体形态。
生理生化实验:按照《常见细菌系统鉴定手册》[22]和《伯杰细菌鉴定手册》(第八版)[23]对分离菌株进行生理生化测定,主要包括耐盐性实验、糖类的发酵实验、甲基红实验、V-P实验、淀粉水解实验和过氧化氢酶实验等。
分子生物学鉴定:采用十六烷基三甲基溴化铵(hexade cyltrimethyl ammonium bromide,CTAB)法提取分离菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)[24],以其为模板,采用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')PCR扩增16S rRNA基因序列。PCR扩增体系(25 μL):10×PCR Buffer 5 μL,2 mmol/L脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)mix 4 μL,45 pmol/L 27F和1492R各0.5 μL,5 U/μL Taq DNA聚合酶0.2 μL,10 ng/μL DNA 1 μL。PCR扩增条件:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火1 min,72 ℃延伸90 s,30个循环;72 ℃再延伸10 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后委托生工生物工程(上海)股份有限公司进行测序,将测序结果提交至与美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对与分析,根据序列同源性,选取模式菌株的16S rRNA基因序列,采用MEGA 7.0软件中的邻接法(neighbor-joining,NJ)构建系统发育树,确定菌株的种属关系。
1.3.3 产酶芽孢杆菌的初筛
产酶芽孢杆菌的初筛参考王振华[21]的方法。将分离纯化得到的芽抱杆菌菌株接种于营养肉汤培养基,37 ℃、180 r/min条件下培养24 h,于4 ℃、10 000 r/min离心5 min。吸取10 μL上清液于产纤维素酶鉴别培养基、产蛋白酶鉴别培养基、产淀粉酶鉴别培养基中,37 ℃条件下培养24 h。采用0.2%刚果红染色剂对产纤维素酶鉴别培养基染色0.5 h,蒸馏水洗去刚果红染色剂,用1 mol/L氯化钠溶液再次清洗,最后用5%醋酸固定颜色,在孔周围出现白色透明圈则证明此菌产纤维素酶。观察产蛋白酶鉴别培养基上有无水解圈,判断芽孢杆菌菌株是否产蛋白酶。采用革兰氏碘液对产淀粉酶鉴别培养基染色,在孔周围有透明圈产生则证明芽抱杆菌产淀粉酶。采用游标卡尺测量水解圈或透明圈的直径来判断其酶活性的高低。
1.3.4 产酶芽孢杆菌的复筛
蛋白酶活力测定:将初筛后酶活较高的芽抱杆菌接种于种子培养基2中,37 ℃条件下培养18 h,再以2%(V/V)的接种量接种到发酵培养基2中,37 ℃、180 r/min条件下培养24 h,于10 000 r/min离心10 min,取上清液为粗酶液。参考RAMADHAN A M F等[25-26]的方法测定蛋白酶活力。蛋白酶单位酶活力定义:在pH 7.0、45 ℃条件下,每分钟水解2%酪蛋白溶液产生1 μg酪氨酸的酶量为1个酶活力单位(U/mL)。
淀粉酶活力测定:将初筛后酶活较高的芽抱杆菌菌株接种到种子培养基3中,37 ℃条件下培养18 h,以3%(V/V)的接种量接种到发酵培养基3中,于37 ℃、180 r/min条件下培养24 h,于10 000 r/min离心10 min,取上清液为粗酶液。参考亓秀晔等[27-28]的方法测定淀粉酶活力。淀粉酶单位酶活力定义:在pH 6.0、55 ℃条件下单位体积的样品每30 min释放1 mg麦芽糖所需的酶量为一个单位酶活力单位(U/mL)。
纤维素酶活力测定:将初筛后酶活较高的芽孢杆菌接种到种子培养基1中,37 ℃条件下培养18 h,以2%(V/V)的接种量接种到发酵培养基1中,于37 ℃、180 r/min条件下培养24 h,于10 000 r/min离心10 min,取上清液则为粗酶液。参考ARUNA S等[29-30]的方法测定淀粉酶活力。纤维素酶单位酶活力定义:在pH 6.8、55 ℃条件下每分钟每毫升酶液产生1 μg葡萄糖为一个单位酶活力(U/mL)。
1.3.5 数据处理与统计分析
每个试验重复3次,采用WPS 2019和Origin 8.0对试验数据进行处理与分析。
2 结果与分析
2.1 酒醅中芽孢杆菌的分离及鉴定
2.1.1 菌株的分离及形态学特征
采用平板划线法从6个酒醅样品中共分离得到15株菌,编号分别为JP1、JP2、JP3、JP4、JP5、JP6、JP7、JP8、JP9、JP10、JP11、JP12、JP13、JP14和JP15,其细胞形态见图1,具体形态特征描述见表1。
表1 15株筛选菌株的菌落及细胞形态描述
Table 1 Colony and cell morphology description of 15 screened strains

菌株编号 菌落形态 细胞形态JP1 JP2 JP3 JP4 JP5 JP6白色,半透明,光滑较湿润,稍隆起,圆形,边缘整齐微黄色,不透明,粗糙无光泽度,平坦,圆形,边缘不整齐乳白色,半透明,不规则,表面较粗糙,微隆起,边缘整齐白色,扁平,表面粗糙皱褶,边缘不整齐淡黄色,无光泽度,平坦,不规则,粗糙有透明,边缘褶皱淡黄色,不规则,粗糙有透明,无光泽度,平坦,边缘褶皱革兰氏阳性菌,直杆菌,链状,具有圆端芽孢革兰氏阳性菌,较细而略长短杆菌,有芽孢革兰氏阳性菌,直杆菌,链状,具有卵圆端芽孢革兰氏阳性菌,微长杆菌,单个,较细而长,有芽孢革兰氏阳性菌,微长杆菌,单个,较细而长,孢囊稍膨大,有芽孢革兰氏阳性菌,微长杆菌,单个,较细而长,中生的椭圆状芽孢,孢囊稍膨大
续表
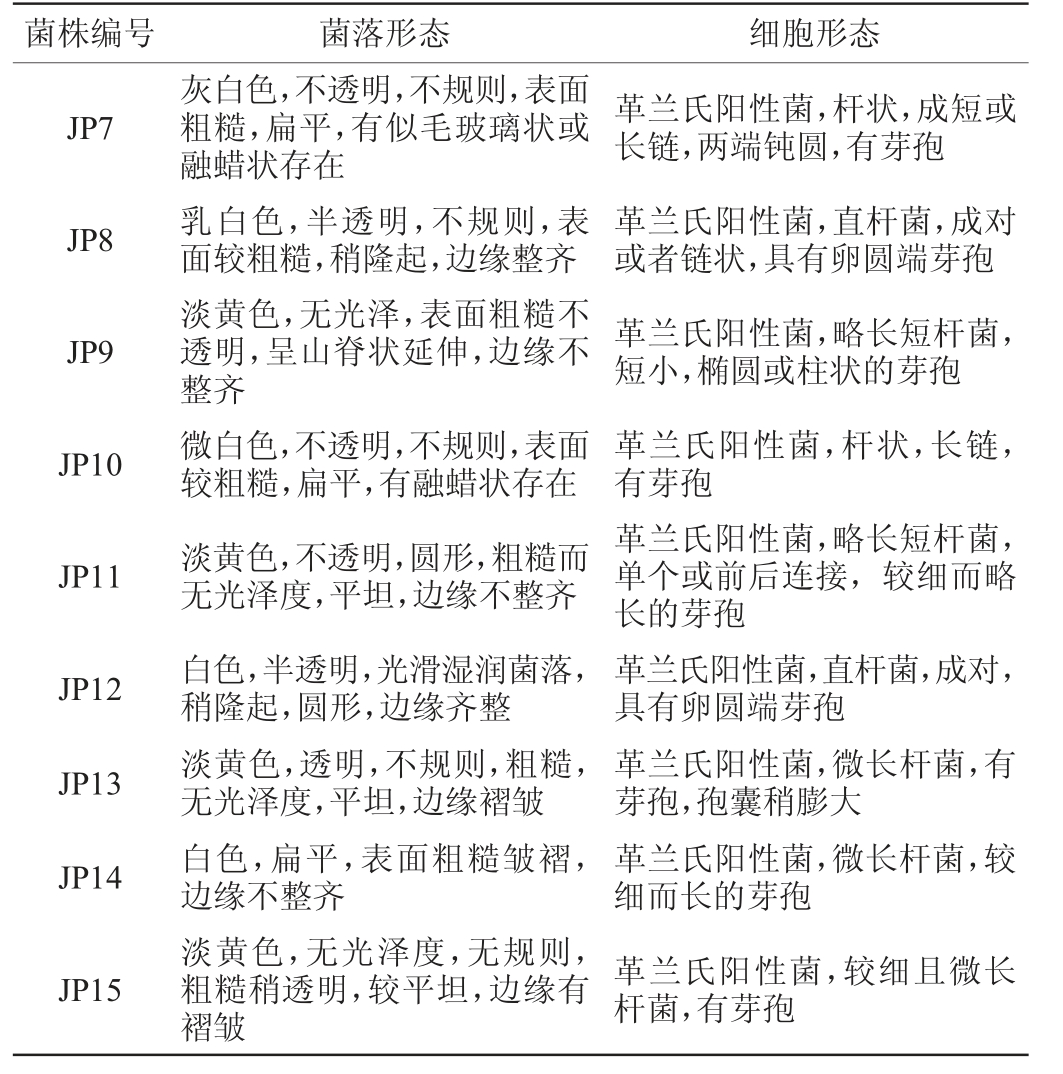
菌株编号 菌落形态 细胞形态JP7 JP8 JP9 JP10 JP11 JP12 JP13 JP14 JP15灰白色,不透明,不规则,表面粗糙,扁平,有似毛玻璃状或融蜡状存在乳白色,半透明,不规则,表面较粗糙,稍隆起,边缘整齐淡黄色,无光泽,表面粗糙不透明,呈山脊状延伸,边缘不整齐微白色,不透明,不规则,表面较粗糙,扁平,有融蜡状存在淡黄色,不透明,圆形,粗糙而无光泽度,平坦,边缘不整齐白色,半透明,光滑湿润菌落,稍隆起,圆形,边缘齐整淡黄色,透明,不规则,粗糙,无光泽度,平坦,边缘褶皱白色,扁平,表面粗糙皱褶,边缘不整齐淡黄色,无光泽度,无规则,粗糙稍透明,较平坦,边缘有褶皱革兰氏阳性菌,杆状,成短或长链,两端钝圆,有芽孢革兰氏阳性菌,直杆菌,成对或者链状,具有卵圆端芽孢革兰氏阳性菌,略长短杆菌,短小,椭圆或柱状的芽孢革兰氏阳性菌,杆状,长链,有芽孢革兰氏阳性菌,略长短杆菌,单个或前后连接,较细而略长的芽孢革兰氏阳性菌,直杆菌,成对,具有卵圆端芽孢革兰氏阳性菌,微长杆菌,有芽孢,孢囊稍膨大革兰氏阳性菌,微长杆菌,较细而长的芽孢革兰氏阳性菌,较细且微长杆菌,有芽孢
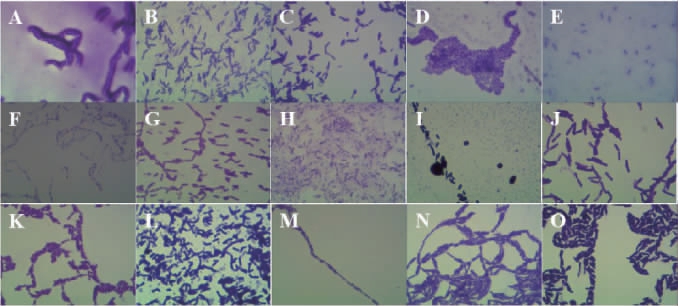
图1 15株筛选菌株的菌落和细胞形态
Fig.1 Colony and cell morphology of 15 screened strains
A~O为菌株JP1~JP15。
由图1及表1可知,15株分离菌株的菌落形态各异,菌落色泽为白色、乳白色、微白色、淡黄色或灰白色,透明、半透明或者不透明,圆形、扁平或者不规则,光滑或者粗糙,边缘整齐、不整齐或者褶皱等。经过革兰氏染色和镜检发现,菌株JP1~JP15均为革兰氏阳性菌,有芽孢,芽孢形态存在差异,细胞呈短杆或者长杆状。菌株JP4、JP5、JP6、JP13、JP14和JP15为单个存在,菌株JP11为单个或者链状存在,其余菌株均为链状分布。
2.1.2 生理生化鉴定
15株筛选菌株的生理生化实验结果见表2。由表2可知,15株分离菌株的淀粉水解、V-P、过氧化氢、乳糖发酵、芽孢、pH5.7肉汤和pH6.8肉汤实验结果均呈阳性;菌株JP1、JP3、JP8和JP12的甲基红实验及厌氧生长实验结果均呈阴性,其余菌株的甲基红实验及厌氧生长实验结果均呈阳性。15株菌株的最高生长温度介于45~55 ℃,其中菌株JP7和JP10的分解酪素实验结果呈阴性。耐盐性实验结果显示,15株菌株在氯化钠含量为5.0%的培养基中均能生长;当氯化钠含量为7.5%时,菌株JP1、JP3、JP7、JP8、JP10和JP12均不生长;当氯化钠含量≥10%时,所有菌株均不能生长,说明不同芽孢杆菌呈现不同的耐盐性能[31]。产酸实验结果显示,15株菌株的葡萄糖实验结果均呈现阳性,其中菌株JP1、JP3、JP8和JP12的阿拉伯糖实验结果呈阴性,菌株JP4、JP5、JP6、JP13、JP14和JP15的阿拉伯糖和木糖实验结果均呈阴性,菌株JP7和JP10的阿拉伯糖、木糖和甘露醇实验结果均呈阴性。根据《常见细菌系统鉴定手册》[22]和《伯杰细菌鉴定手册》(第八版)[23],6种样品中分离得到的15株菌均被初步鉴定为芽孢杆菌属(Bacillus sp.)。
表2 15株筛选菌株的生理生化实验结果
Table 2 Physiological and biochemical tests results of 15 screened strains
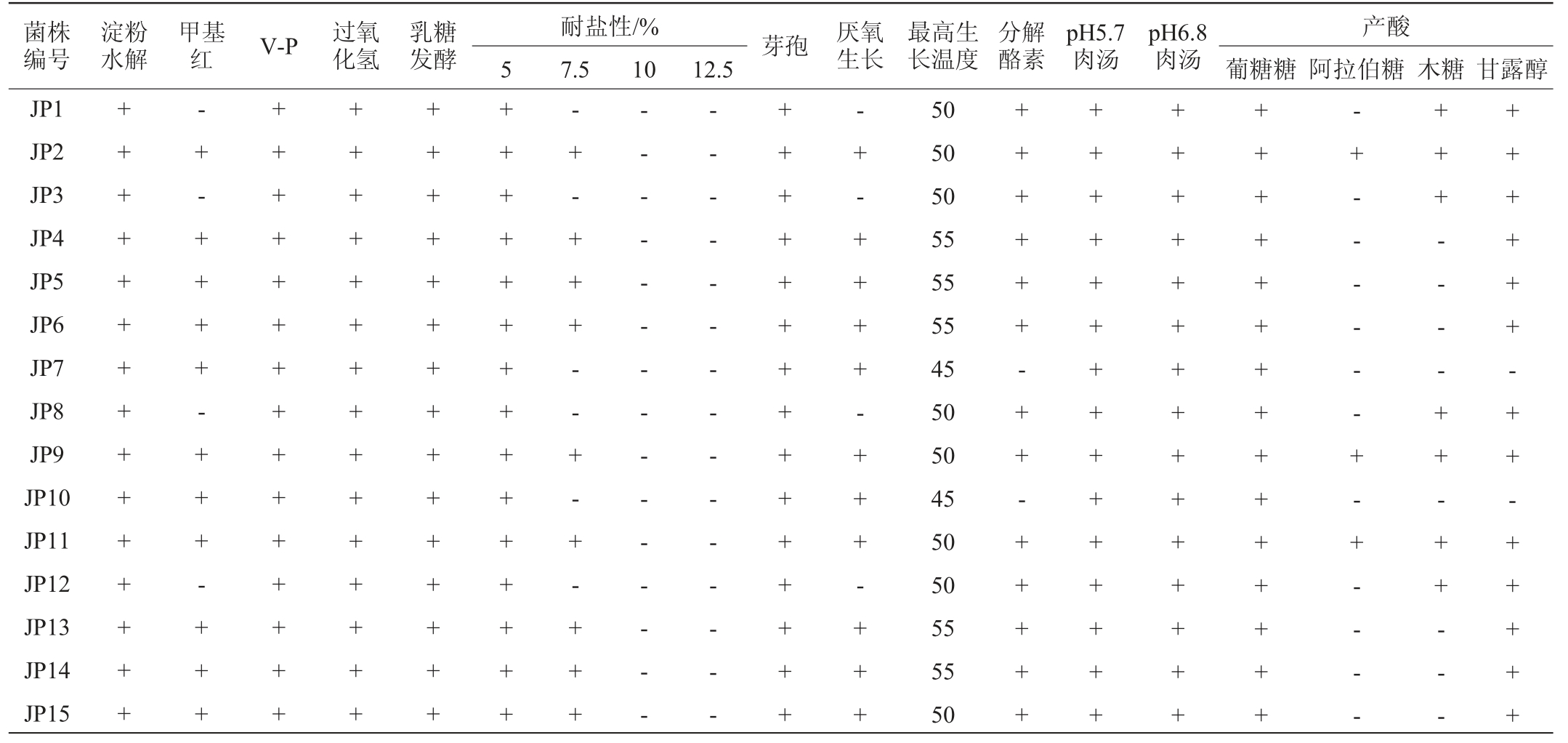
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
菌株编号淀粉水解甲基红 V-P 过氧化氢乳糖发酵 芽孢 厌氧生长耐盐性/%5 7.5 10 12.5最高生长温度分解酪素pH5.7肉汤pH6.8肉汤产酸葡糖糖 阿拉伯糖 木糖 甘露醇JP1 JP2 JP3 JP4 JP5 JP6 JP7 JP8 JP9 JP10 JP11 JP12 JP13 JP14 JP15+++++++++++++++-+ - + + + + - + + + - + + +++++++++++++++++++++++++++++++++++++++++++++++++++++++++++++-+ - + + + - - + - + - + + +-- - - - - - - - - - - - - --- - - - - - - - - - - - - -+++++++++++++++-+ - + + + + - + + + - + + +50 50 50 55 55 55 45 50 50 45 50 50 55 55 50++ + + + + - + + - + + + + ++++++++++++++++++++++++++++++++++++++++++++++-+ - - - - - - + - + - - - -++ + - - - - + + - + + - - -++++ ++ -+ +-+++ ++
2.1.3 分子生物学鉴定
基于16S rRNA基因序列构建15株筛选菌株的系统发育树,结果见图2。
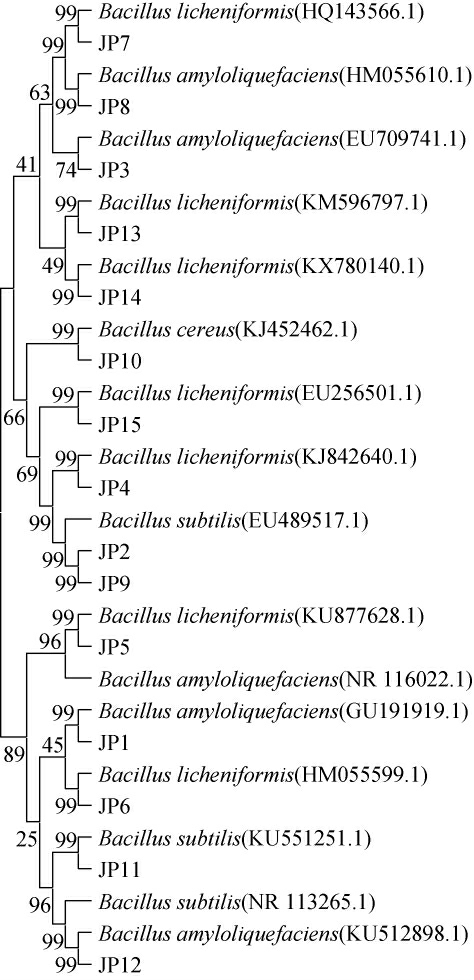
图2 基于16S rRNA基因序列15株筛选菌株的系统发育树
Fig.2 Phylogenetic tree of 15 screened strains based on 16S rRNA gene sequences
由图2可知,菌株JP1、JP3、JP8、JP12与解淀粉芽孢杆菌(Bacillus amyloliquefaciens)聚于一支,亲缘关系最近,因此鉴定这4株菌株为解淀粉芽孢杆菌;菌株JP2、JP9、JP11与枯草芽孢杆菌(Bacillus subtilis)聚于一支,亲缘关系最近,因此鉴定这3株菌株为枯草芽孢杆菌;菌株JP4、JP5、JP6、JP7、JP13、JP14、JP15与地衣芽孢杆菌(Bacillus licheniformis)聚于一支,亲缘关系最近,因此鉴定该7株菌株为地衣芽孢杆菌;菌株JP10与蜡样芽孢杆菌(Bacillus cereus)聚于一支,亲缘关系最近,因此鉴定该菌株为蜡样芽孢杆菌。综上,15株芽孢杆菌菌株被鉴定为4个种,分别为枯草芽孢杆菌、蜡样芽孢杆菌、解淀粉芽孢杆菌和地衣芽孢杆菌。有研究表明,芽孢杆菌属于酒醅堆积过程中主要的优势细菌属[32],牛栏山二锅头酒醅中芽孢杆菌主要是地衣芽孢杆菌、蜡样芽孢杆菌、短小芽孢杆菌(Bacillus pumilus)和枯草芽孢杆菌等[10]。杨玉婷等[33]研究发现,芽孢杆菌属在酒鬼酒窖池中占绝对优势。本实验室前期应用PCR-变性梯度凝胶电泳(denaturing gel gradient electrophoresis,DGGE)研究酱香型白酒酒醅微生物多样性发现,堆积酒醅和窖内酒醅中优势菌群主要以枯草芽孢杆菌和地衣芽孢杆菌为主[34],与本研究的结果相似,即枯草芽孢杆菌、蜡样芽孢杆菌、解淀粉芽孢杆菌和地衣芽孢杆菌为酱香型白酒酒醅中的优势细菌。
2.2 芽孢杆菌菌株的产酶能力分析
2.2.1 产酶能力初筛
采用平板透明圈法对15株芽孢杆菌菌株的产酶能力进行初筛,结果见图3。由图3可知,15株芽孢杆菌菌株均能产生蛋白酶;除菌株JP6、JP10和JP14外,其余菌株均能产生淀粉酶;除菌株JP15外,其余菌株均能产生纤维素酶。在产蛋白酶活性试验中,透明圈直径≥19 mm的芽孢杆菌共6株,即菌株JP2、JP4、JP7、JP9、JP11和JP15,其中,菌株JP2和JP11的透明圈直径>20 mm,菌株JP9的透明圈直径为19.93 mm。在产淀粉酶活性试验中,透明圈直径>21 mm的菌株共5株,即菌株JP2、JP3、JP5、JP9和JP11,其中,菌株JP3、JP9和JP11的透明圈直径>22 mm。在产纤维素酶活性试验中,菌株JP9和JP11的透明圈直径>27 mm,菌株JP2、JP4、JP5、JP6、JP8和JP14的透明圈直径>24 mm。综上,在15株芽孢杆菌中,菌株JP9、JP11和JP2的综合产酶能力较好,这3株菌均为枯草芽孢杆菌。
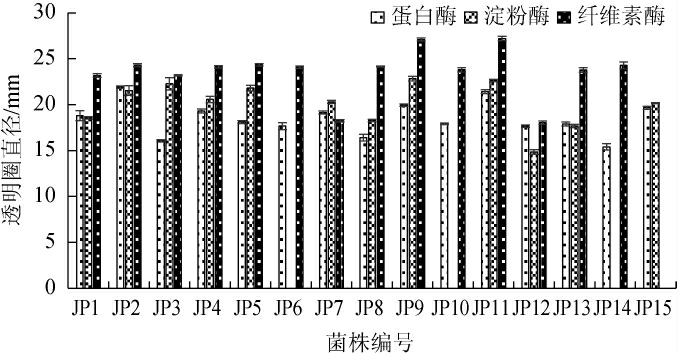
图3 15株芽孢杆菌菌株的产酶能力初筛结果
Fig.3 Preliminary screening results of enzyme-producing capacity of 15 Bacillus strains
2.2.2 产酶能力复筛
菌株JP2、JP9和JP11的产蛋白酶、淀粉酶和纤维素酶活力测定结果见图4。

图4 3株芽孢杆菌菌株的产酶能力复筛结果
Fig.4 Rescreening results of enzyme-producing capacity of 3 Bacillus strains
由图4可知,菌株JP2、JP9和JP11的产淀粉酶活性相对较低,分别为16.71 U/mL、19.88 U/mL和21.25 U/mL,而其产蛋白酶和纤维素酶活性远高于产淀粉酶活性,其中菌株JP2产蛋白酶和纤维素酶的活性分别为374.81 U/mL、198.92 U/mL,菌株JP9产蛋白酶和纤维素酶的活性分别为298.43 U/mL、309.76 U/mL,菌株JP11产蛋白酶和纤维素酶的活性分别为271.83 U/mL、387.42 U/mL。祝小等[35]采用刚果红染色法和DNS法从10株芽孢杆菌中筛选出一株纤维素酶活性达170.95 U/mL的芽孢杆菌,并通过优化使得该菌株的纤维素酶活性达358.75 U/mL,但该菌株的纤维素酶活性仍低于本研究的菌株JP11。综合蛋白酶、淀粉酶和纤维素酶活性,菌株JP11综合产酶能力最强。
3 结论
利用平板划线法从6个酱香型酒醅样品中共分离得到15株菌,编号为JP1~JP15。通过形态学观察、生理生化实验及分子生物学鉴定,最终鉴定菌株JP1、JP3、JP8、JP12为解淀粉芽孢杆菌(Bacillus amyloliquefaciens),菌株JP2、JP9、JP11为枯草芽孢杆菌(Bacillus subtilis),菌株JP4、JP5、JP6、JP7、JP13、JP14、JP15为地衣芽孢杆菌(Bacillus licheniformis),菌株JP10为蜡样芽孢杆菌(Bacillus cereus)。通过产酶能力筛选,从15株芽孢杆菌中筛选出一株综合产酶能力较高的菌株枯草芽孢杆菌JP11,其产蛋白酶、淀粉酶和纤维素酶活性分别为271.83 U、21.25 U和387.42 U。
[1]CHEN T Y,WANG H Y,SU W,et al.Analysis of the formation mechanism of volatile and non-volatile flavor substances in corn wine fermentation based on high-throughput sequencing and metabolomics[J].Food Res Int,2023,165:112350.
[2]李欣,王彦华,林静怡,等.高通量测序技术分析酱香型白酒酒醅的微生物多样性[J].福建师范大学学报:自然科学版,2017,33(1):51-59.
[3]AMIN F A Z,SABRI S,ISMAIL M,et al.Probiotic properties of Bacillus strains isolated from stingless bee (Heterotrigona itama) honey collected across Malaysia[J].Int J Env Res Pub He,2020,17(1):278.
[4]KASPAR F, NEUBAUER P, GIMPEL M.Bioactive secondary metabolites from Bacillus subtilis:A comprehensive review[J].J Nat Prod,2019,82(7):2038-2053.
[5]吴树坤,杨磊,杨玲麟,等.沉香型酒醅中产香芽孢杆菌的分离鉴定及代谢产物分析[J].中国酿造,2018,37(1):35-40.
[6]WU X,LIU J,WANG Q,et al.Research progress on the effect of Bacillus on flavor substances of Maotai flavor Baijiu[J].Food Sci Technol,2023,43:101422.
[7]WANG M Y,YANG J G,ZHAO Q S,et al.Research progress on flavor compounds and microorganisms of Maotai flavor Baijiu[J].J Food Sci,2019,84(1):6-18.
[8]罗莉,李欣,常煦,等.芽孢杆菌在中国白酒酿造中的应用机理研究进展[J].酿酒科技,2019(1):99-104.
[9]黄永光,杨国华,张肖克,等.产酱香风味芽孢杆菌类菌株发酵代谢产物及其酶分析研究[J].酿酒科技,2013(1):41-45.
[10]王月梅,赵迎路.芽孢杆菌对汾酒风味的影响[J].酿酒科技,2002(5):31-32.
[11]杨春霞,廖永红,刘峻雄,等.牛栏山二锅头酒醅中芽孢杆菌分离鉴定及发酵风味分析[J].食品工业科技,2012,33(9):69-74.
[12]张春林,杨亮,李喆,等.酱香型白酒酒醅堆积微生物多样性及其与风味物质的关系[J].食品科技,2022,47(4):111-118.
[13]钟姝霞,邓杰,汪文鹏,等.酱香型酒醅产香芽孢杆菌的分离鉴定及其代谢产物分析[J].现代食品科技,2017,33(4):89-95.
[14]王霜,缪礼鸿,张明春,等.浓酱兼香型酒醅中产酱香芽孢杆菌的筛选及发酵风味成分分析[J].中国酿造,2017,36(10):61-65.
[15]李永博,暴金磊,万敏,等.酒醅中高产纤维素酶菌株的筛选及其酶学性质[J].食品工业科技,2017,38(24):109-113.
[16]王西,沈毅,张亚东,等.产香枯草芽孢杆菌在酱香型白酒生产中的应用[J].酿酒科技,2018(7):70-75.
[17]陈蒙恩,李建民,韩素娜,等.陶融型酒醅中产香芽孢杆菌的筛选,鉴定及发酵产物分析[J].中国酿造,2020,39(9):75-79.
[18]王丽,韩建荣,赵景龙,等.汾酒曲醅中产高温蛋白酶芽孢杆菌的分离[J].中国酿造,2009,28(1):67-69.
[19]刘桂君,朱婷婷,刘红霞,等.清香大曲及酒醅中地衣芽孢杆菌的分离鉴定[J].酿酒科技,2010(1):31-35.
[20]张国庆,董晓芳,佟建明,等.一株芽孢杆菌的分离和鉴定[J].微生物学通报,2010,37(8):1159-1163.
[21]王振华.高产酶活芽孢杆菌筛选及对奶牛生产性能影响的研究[D].雅安:四川农业大学,2006.
[22]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:152-158.
[23]布坎兰,吉本斯.伯杰细菌鉴定手册(第八版)[M].北京:科学出版社,1984:63-64.
[24]AZAROUAL S E,KASMI Y,AASFAR A,et al.Investigation of bacterial diversity using 16S rRNA sequencing and prediction of its functionalities in Moroccan phosphate mine ecosystem[J].Sci Rep,2022,12(1):3741.
[25]RAMADHAN A M F,ARDYATI T,JATMIKO Y D.Halophilic bacteria producing protease from salted fish in Ponrang,Luwu regency,south Sulawesi[J].J Exp Life Sci,2023,13(1):35-42.
[26]曹慧,张腾月,赵龙妹,等.土壤中高产蛋白酶菌株产酶条件及酶学性质[J].微生物学通报,2020,47(7):2072-2081.
[27]亓秀晔,刘乃芝,郭杨丽,等.一株高产α-淀粉酶的地衣芽孢杆菌的筛选及鉴定[J].广东饲料,2021,30(3):26-28.
[28]曹丹,彭浩,兰阿峰,等.一株α-淀粉酶产生菌的分离,鉴定及产酶条件研究[J].食品研究与开发,2020,41(6):169-174.
[29]ARUNA S,GOBIKRISHNAN S.Organosolvent extraction coupled with steam explosion pretreatment of wild sugarcane and optimization of cellulase activity using response surface methodology[J].J Pure Appl Microbiol,2021,15(1):114-122.
[30]江学斌,成雪鸿,马苗鹏,等.产纤维素酶芽孢杆菌的鉴定与酶活力比较[J].广东农业科学,2022(4):116-122.
[31]徐振波,包雪蕊,姬莉莉,等.分离于酱油渣的芽孢杆菌耐盐特性研究[C].广州:第二届糖业科技与发展高峰论坛,2015.
[32]汤涵岚,秦辉,黄孟阳,等.复合香调味酒酒醅堆积过程中微生物群落演替研究[J].中国酿造,2023,42(6):43-51.
[33]杨玉婷,黎有有,吴秋蕾,等.酒鬼酒窖池酒醅芽孢杆菌的系统发育分析和胞外酶学特征[J].酿酒科技,2018(10):97-102.
[34]谭映月.应用PCR-DGGE技术对茅台酒酿造过程中细菌多样性的研究[D].贵阳:贵州大学,2013.
[35]祝小,王振华,潘康成,等.产纤维素酶芽孢杆菌筛选及发酵条件的初步研究[J].现代农业科技,2006(11):122-124.